-
2021年中国社会化石燃料的使用比重高达89%,二氧化碳(CO2)排放量高达7500万吨,随着化石燃料的大肆消耗和CO2排放量的逐年攀升,人类面临着温室效应和能源危机的双重挑战[1]. 在“碳中和”的大背景下,如何将CO2收集与资源化利用成为关键问题. 常见的CO2利用手段包括地质利用(CO2驱油提高采收率)、化工利用(以CO2为原料生产化学品或燃料)和生物利用(利用微藻类植物进行CO2生物转化)[2-3].
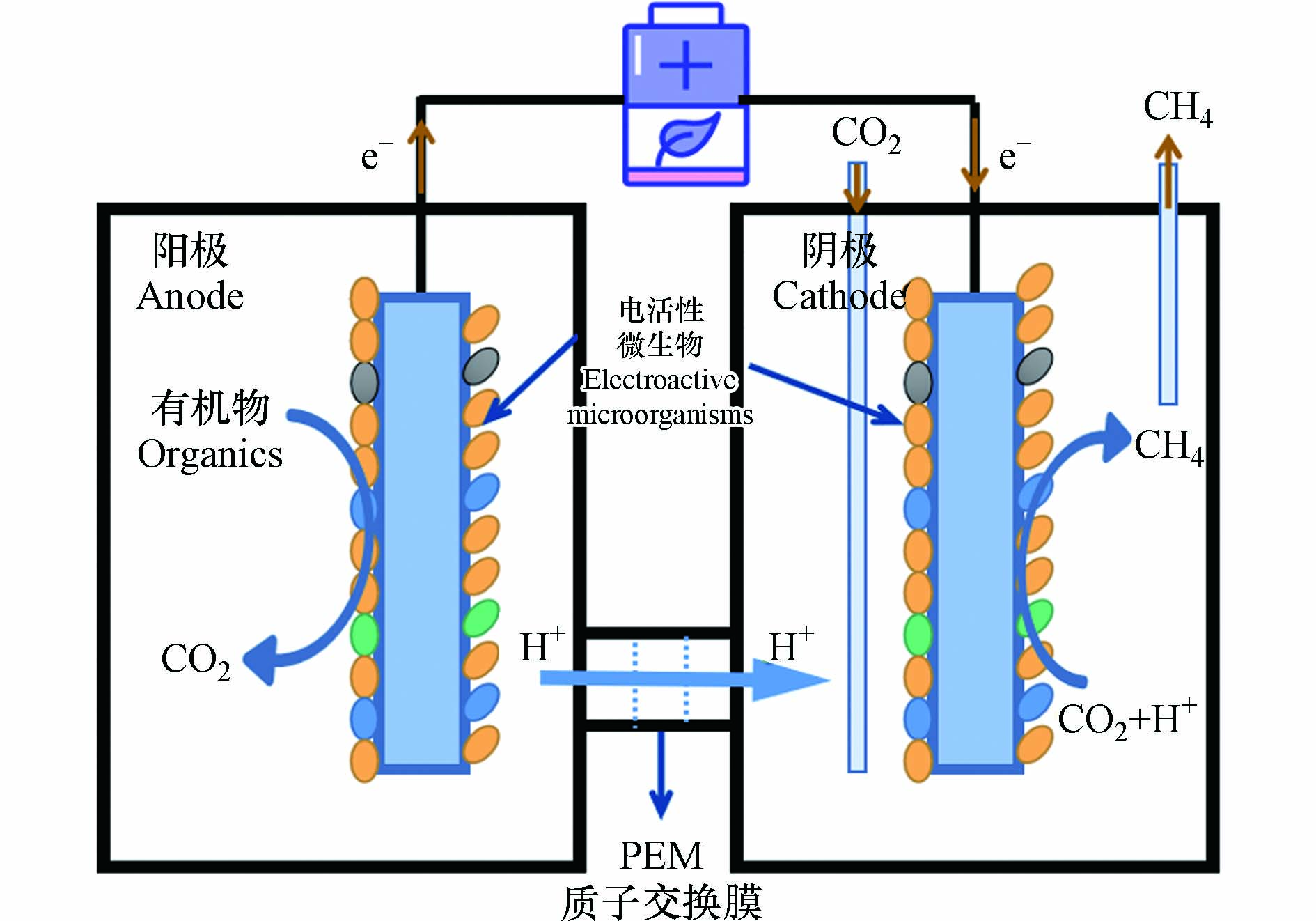
生物电化学系统(Bioelectrochemical systems,BES)是近年来发展起来的,结合了化工利用和生物利用的一项CO2资源化技术,其中微生物电解池(Microbial electrolysis cells,MEC)可有效利用CO2转化为低碳燃料[1, 3-4]. 甲烷(CH4)作为最简单的有机物且含碳量最少的烃,是当今主要的燃料和化工原料. 相较于MEC制氢气(H2)所面临的H2燃点范围宽,常温常压难储存且价格昂贵(每kg 60—70元)等挑战,利用MEC将CO2转化为低碳燃料CH4,不仅极大地降低了CO2的排放并促进碳循环,且CH4作为一种清洁的低碳燃料,价格低廉(每kg 20—30元)且便于运输,可缓解紧张的能源需求[2, 4]. 与传统的厌氧消化产甲烷相比,MEC辅助CO2电产甲烷可将有机物氧化和产甲烷过程分开进行,减少废水对产甲烷菌的冲击,提高甲烷产量[2]. 其原理如图1所示,MEC阳极通过多种氧化反应(析氧反应或有机物的氧化分解)提供质子,质子通过质子交换膜到达阴极,电活性微生物在生物阴极上完成CO2电甲烷化,HCO3-/CO2常常可以被微生物利用产生甲烷[5-6].
近年来关于MEC的研究如雨后春笋破土而出(图2),研究人员多分布在不同国家,但关于MEC的研究方向大多集中在制H2;随着“双碳”目标的提出,MEC精炼废物质能源被开发,相应的电极材料、反应器构造类型、能耗等成为了研究者们关注的问题[2, 5, 7]. 因此,本文全面回顾了MEC电极材料、电压和电产甲烷菌等对CO2电甲烷化效能的影响,并重点讨论阴极电活性功能菌和胞外电子传递机制,以期为MEC在未来应用方面的技术挑战提供理论支撑.
-
MEC辅助CO2电产甲烷的效率受到多方因素的影响,为了获得更高的甲烷产率,需性能稳定的阴极催化剂、高效传递电子的电活性微生物和合适的外加电势等.
MEC阴极作为电活性微生物电子传递的主要介质和产甲烷菌附着的主要场所,是影响MEC性能的关键因素之一,MEC阴极材料一般具有良好的导电性、无微生物毒性、高比表面积、低过电位等[2-3]. 铂(Pt)是最早被用在MEC上的电极材料,其能量效率高达75%—80%,但由于Pt开采、提取过程中负面环境影响大,故亟需开发环境友好且效率与Pt相当的电极材料,碳基材料、金属基材料和复合材料近年来渐渐崭露头角[8-9]. 图3(a)总结了近5年MEC研究者利用不同电极材料所获得的最高甲烷产率和最大电流密度[2-4, 6-21](注:产甲烷率和电流密度均做归一化处理,气体体积按照标况下进行折算). 从数据统计看,最高甲烷产生速率为复合材料>金属基材料>碳基材料. 碳布、碳纸作为MEC生物阴极的基底可达到的最高甲烷产生速率仅为35—87 mL·L−1·d−1之间,低于碳毡和碳刷,可能是由于碳布这类平面电极比表面积低、微生物难以富集在材料内部所导致的,碳毡和碳刷则具有更大的比表面积,更有利于致密电活性生物膜的形成[2, 7]. 不锈钢和过渡金属(主要是镍(Ni))作为金属基材料则具有良好的导电性,其最高甲烷产生速率可达到135—350 mL·L−1·d−1,有研究证实不锈钢可引起电解液脱氢并释放H2,进而促进氢营养型产甲烷菌通过间接电子传递的方式产生CH4[9, 21]. 此外,Ni还是产甲烷菌的关键酶(甲基辅酶M)的组成金属元素,产甲烷菌相较于其他微生物更易占据Ni电极的阴极位点,进而提高甲烷产率[15]. Pt-碳毡和Pt-钛网等是常见的贵金属修饰复合阴极,但Pt修饰的贵金属电极也极易发生析氢反应产生H2,被氢营养型产甲烷菌利用,进而通过间接电子转移的方式刺激CO2快速向CH4转化[11-12, 16]. 电流密度可以侧面反映阴极单位表面积上单位时间内通过的电量,贵金属修饰的复合电极最大电流密度可达45—60 A·m−3,说明其导电性较好[2-4, 6-21]. 纳米管和纳米粒子等纳米材料通过电沉积、空气喷涂等方法修饰在碳基或金属基材料表面制备复合阴极材料,纳米修饰的复合材料通常具有良好的催化活性和稳定性,且多孔疏松的纳米形态有利于细胞的聚集和胞外聚合物的产生,其最高甲烷产生速率高达200—350 mL·L−1·d−1,纳米修饰的复合阴极材料也是近年来MEC阴极的研究热点[10, 14, 19],如磁铁矿/沸石纳米复合材料[22]、Ni/Co-NC纳米复合材料[23]、磁性GO/Fe3O4纳米复合材料[24]等,研究表明,纳米金属复合材料作为MEC阴极更有利于电活性微生物在其上形成厚且致密的生物膜,同时促进氢营养产甲烷通过直接电子转移的方式来来增强CO2到CH4的生物电化学还原作用[22-25].
电压调控对于MEC电产甲烷也尤为重要,图3(b)总结了近几年各个学者在不同电压下利用MEC产生的最高甲烷产生速率[5, 7, 9, 25-36]. −0.6—−1.0 V vs. AgCl是常见的阴极电压,其间的最高甲烷产生速率一般在15—100 mL·L−1·d−1之间[5, 7, 9, 25-36]. 阴极电位越负甲烷产量越高,可能是因为更负的电压提高了产电菌群的活性,并增强了其内部的电子传递效率,但是最佳的甲烷产量是在−0.9—−1.0 V vs. Ag/AgCl 的平衡电位下实现的,虽然研究者常通过施加更负电位的方法以克服CO2电甲烷生成的能垒,但研究表明电压高于−1.2 V时,产甲烷菌的生物膜会遭到破坏,生长活性和代谢速率会降低,所以MEC电压保持在一个合适的范围是非常重要的[5, 9, 28, 33].
除了电极材料和阴极电压外,MEC的结构也会间接影响微生物的电子传递性能及CH4产率[2, 10]. 图3(c)总结了近些年相关文献中,单室和双室MEC的最大产甲烷速率,单室MEC的最高甲烷产生速率一般在85—200 mL·L−1·d−1之间,而双室则在45—100 mL·L−1·d−1之间[3, 4, 7-8, 11-14]. 单室MEC由于无质子膜阻隔,阴阳两极间距较双室MEC更近,故内阻更小、物质间的传质阻力更低、电流密度更高,适合进行规模化CH4生产[13-14]. 但是单室MEC由于无质子膜阻隔,阴阳电解液相互接触,极易发生副反应,所以在单室MEC中如何实现目的产物CH4的高效定向转化是研究者们应该关注的重点问题[37].
此外,MEC中最大电流密度是CO2电甲烷化过程中相对电子传递效率的重要指标,与最高产甲烷速率之间也有一定关系,电流较高意味着更快的反应动力学,更低的生物膜电阻和电荷转移电阻,同时高电流响应意味着较好的生物膜活性和较低的电位损失[14, 16-17]. 从近5年的文献中可以发现,贵金属修饰的复合材料产生的最高电流密度最大(图3(a)),达到47—59 A·m−3之间,可能是贵金属修饰的复合电极更易生物膜的快速成型,从而产生更高的电流;较高的外加电压会产生较高的电流密度,MEC在−1.2 V vs. AgCl时的最高电流密度最大(图3(b)),达到7.5—11.4 A·m−3之间,可能是较高的电压输入给予MEC更高的电流流动;单室MEC的电流密度高于双室MEC(图3(c)),可能是单室MEC内阻小、传质阻力低[13-14].
-
MEC辅助CO2电产甲烷的运行关键在于阴极腔室内的电活性功能微生物,它们承担着电子转移等重要工作,被誉为MEC的“心脏”. 电活性功能微生物可借助外源电势差突破超电势与内电阻的限制,摄取来自电极表面的电子,还原为CO2为低价态的有机物(如CH4),以及将氧化态物质还原成还原态无机物[38]. 为了提高产MEC产甲烷的性能,了解电活性功能微生物的类型、群落组成和微生物之间的相互作用也至关重要. 能够还原CO2产甲烷的微生物是一种重要的电活性功能微菌,在分类学上,属广古菌门(Euryarchaeota),其包括5个目(Methanobacteriales、Methanococcales、Methanomicrobiales 、Methanopyrales和 Methanosarcinales)、10个科(Methanobacteriaceae、Methanocaldococcaceae、Methanococcaceae、Methanocorpusculaceae、Methanomicrobiaceae、 Methanopyraceae、Methanosaetaceae 、Methanosarcinaceae、Methanospirillaceae、Methanothermaceae)及31个属,这些微生物对氧气极为敏感,因此大多是都需要在严格缺氧的环境中培养[39]. CO2电产甲烷菌常利用的底物类型为甲基类、H2和乙酸,对应的产甲烷菌分别可以被命名为甲基营养型(方程式1)、氢营养型(方程式2)和乙酸营养型(方程式3)产甲烷菌[39].
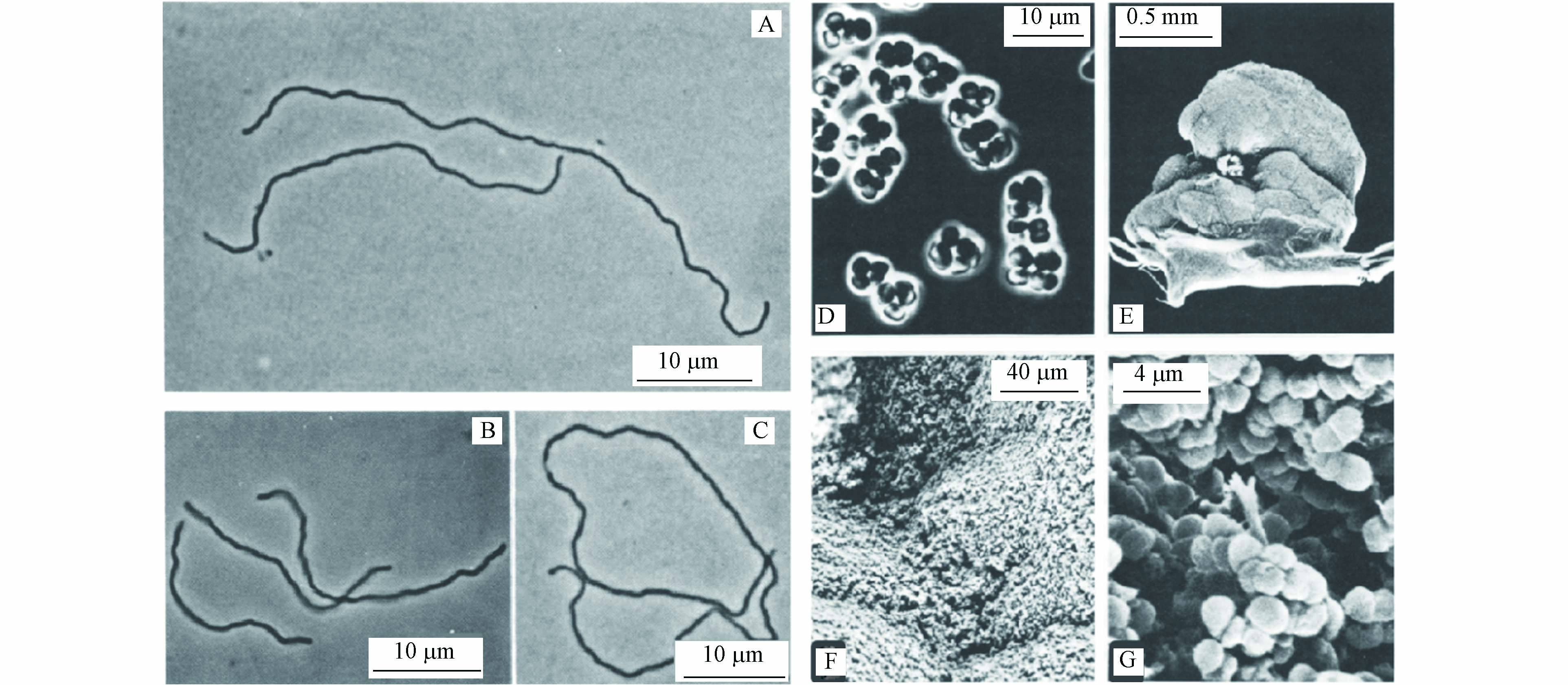
产甲烷菌的主要生理特征(碳源、温度和pH范围)总结在表1中,大多数产甲烷菌是嗜温细胞,在pH值约为7时生长最佳[40]. 形态上,典型的产甲烷菌有甲烷杆菌属(Methanobacterium)、甲烷球菌属(Methanosarcina)和甲烷丝状菌属(Methanosaeta)(图4)[40-41]. 淡水沉积物、泥炭沼泽、稻田和污水消化池等为产甲烷菌最适宜生长的环境[42].
-
MEC中电子是如何从阴极电极表面转移用于CO2还原的过程受到学界的关注,一种解释是在MEC的阴极表面产生了H2,附着在阴极的电产甲烷菌以H2/CO2为底物合成CH4,还有一种解释是电产甲烷菌可以直接从阴极表面获得电子还原CO2产生CH4 [46-47]. 培养了一段时间后的MEC的阴极将会被一层厚厚的电活性生物膜覆盖,电活性生物膜的活性外层负责转移电子产生电流,死的内层将作为导电基质发挥作用[46, 49]. 这种电活性生物膜是MEC电产甲烷中微生物和电极之间电子转移过程的重要一环,可以使得电产甲烷菌之间通过有效的细胞“交流”促进细胞间的活动与代谢,利用阴极电极表面的电子产生CH4[50].
在MEC还原CO2产甲烷的体系中,电产甲烷微生物间通过种间电子传递的合作方式对底物及阴极表面的电子进行利用,形成复杂且高度组织化的多细胞和多物种结构,达到互营共生的效果. 一些胞外活性菌会先把大分子有机物分解为小分子有机物,电产甲烷微生物通过利用小分子产生甲烷[46, 49]. 在MEC生物阴极表面,根据电子传递路径的不同可以分为直接种间电子传递(direct interspecies electron transfer,DIET)和间接种间电子传递(mediated interspecies electron transfer,MIET)两种方式[50]. 在DIET中,微生物通过细胞表面的蛋白质(如c型细胞色素)或细胞附属物(如菌毛或纳米线)与不溶性电子受体(如电极)建立直接接触,在MIET中,微生物利用可溶性氧化还原活性化合物作为电子穿梭的媒介,以介导细胞表面暴露的导电蛋白和不溶性电子受体之间的电子转移[50, 51].
H2是最早被发现的能够进行间接种间电子传递的中间载体(图5a),且MIET过程中产甲烷菌的耗H2速率与NAD+/NADH、FAD/FADH2、Fd(ox)/Fd(red)和F420/F420-H2等多种内源性氧化还原介质有关[49]. 辅酶M和辅酶B形成混合二硫化物作为整个厌氧产甲烷呼吸链的电子受体,分子氢、还原型辅酶F420和还原型铁氧还蛋白作为电子供体;A1A0-ATP催化合成的驱动力型ATP合成酶、甲基转移酶和甲酰基甲烷呋喃脱氢酶是与产甲烷过程有关的能量转导酶. 其中,甲基转移酶是一种独特的、可逆的钠离子泵,它将甲基转移与Na+跨膜转运相结合,电子受体菌则利用电子供体菌提供的H2还原辅酶(F420)和铁氧还蛋白(Fd(ox)),进而将CO2还原成甲烷[52].
除H2外,甲酸也可作为电子载体介导MIET的发生,Rotaru等[53]在Pelobacter carbinolicus和Geobacter sulfurreducens共培养体系中发现P. carbinolicus和不能利用H2但能利用甲酸的G. sulfurreducens转基因菌株共培养时很容易生长,但若以乙醇作为电子供体、富马酸盐作为电子受体时,两菌没有互营共生且生长受到抑制,证明G. sulfurreducens的甲酸脱氢酶(fdnG)基因可有效弥补氢化酶的缺失,P. carbinolicus通过H2/甲酸盐的种间转移而不是DIET与G. sulfurreducens交换电子.
除H2和甲酸外,具有氧化还原性能的电子介质,如黄素、吩嗪和醌类等,也可介导电产甲烷微生物的MIET[54](图5b). Liu等[55]构建了一个含有S. oneidensis MR-1和可产生核黄素的枯草芽孢杆菌RH33联合体,发现RH33产生的高浓度核黄素可被S. oneidensis MR-1用于提高生物电. Engel等[56]联合培养G. sulfurreducens和S. oneidensis,发现混合培养优于单独培养,可能由于S. oneidensis代谢产生的氢化酶和黄素被G. sulfurreducens用于增强直接电子转移,促进该生物体能够在阳极表面形成更厚的生物膜,同时增加电流密度. 除核黄素之外,腐殖质也具有独特的电子转移能力,能在介导微生物种间电子转移方面发挥重要作用,G. metallireducens和S. alga可利用蒽醌-2,6-二磺酸盐作为电子受体进行厌氧呼吸[57]、维持细胞生长,研究显示,低剂量的蒽醌-2-磺酸盐(50 µmol·L−1)可得到最大的甲烷产量[58].
除了间接电子传递,近年来,研究者发现电活性微生物可通过菌体DIET传递电子,实现互营共生. Summers等[59]在G. metallireducens和G. sulfurreducens的共培养体系中首次证实了DIET的存在,微生物种间DIET机制通过导电菌毛[60]、导电材料[61]与功能蛋白复合物[62]3种方式实现.
导电菌毛是一类由电活性微生物合成、具有导电性的纤维状的蛋白质细丝,通过产甲烷微生物的导电菌毛,微生物胞内代谢产生的电子可以长距离输送到胞外受体或其他产甲烷微生物,实现了微生物-胞外环境的沟通交流[60](图5c). 微生物纳米导线最初通过导电探针原子力显微镜发现,G. sulfurreducens及S. oneidensis,蛋白PilA组成的Ⅳ型菌毛能够实现快速、长距离的电子传递,将电子从细胞表面转移到 Fe (Ⅲ) 表面. 近年来的研究表明,大部分的导电菌毛的主要成分为细胞色素OmcS、PilA蛋白起到调节omcS和其他多血红素细胞色素的分泌的作用[63]. 除了OmcS,常见的功能蛋白复合物还有血红素细胞色素c(MtrC和OmcA),可转运细胞间的蛋白质,实现细胞间的交流协作[64](图5d). 当G. sulfurreducens中血红素细胞色素c基因被敲除后,菌体生长受到抑制,这表明细胞色素所组成的跨膜电子通道主导了DIET过程[62]. 敲除MtrC和OmcA后的S. oneidensis MR-1 细胞,其在电极上的覆盖量和在电极上产生的电流比未敲除基因的细胞减少80%,此外,分离并纯化两种基因后发现,两种外膜细胞色素c可以结合金属氧化物如Fe2O3,并能将电子直接转移到Fe2O3的电极表面,Xiong等[65]还利用光学波导光模型和蛋白膜伏安法测得OmcA与Fe2O3的结合力为1.2—2.6 nmol·cm−2,总之,电活性菌外膜上的MtrC和OmcA可以相互接触通过其暴露在蛋白质表面的血红素将电子直接传导给胞外电子受体[60]. Zhang等在MEC电活性系统中检测到了产甲烷菌菌毛状的纳米线的存在,并认为其有电子转移的能力.
导电材料构建的“微生物-电极”的电子传递系统也是近年来DIET的研究热点,导电材料的加入可明显提升多种厌氧系统的效率并作为导体加强产甲烷微生物种间DIET[61,66-67](图5e). Liu等[61]通过在OmcS蛋白缺失的突变种G. sulfurreducens加入纳米磁铁矿使其弥补了细胞外电子交换中菌毛相关c型细胞色素的缺乏,恢复DIET的能力. Park等[66]将颗粒活性炭加入到厌氧消化的小瓶中使得总甲烷产量比对照组升高了75%,并通过宏基因组学证明了产甲烷总量与效率的提升是颗粒活性炭的加入改变了微生物群落结构并调整了DIET的相关基因的丰度两方面同时作用的结果. 此外,无导电菌毛或导电性能较差的菌株亦可以在导电材料表面与其他微生物建立联系,从而达到互营共生,Liu等[61]研究发现,磁铁矿纳米颗粒(20—50 nm)吸附在导电菌毛上,通过作为菌毛上OmcS的替代物,增强突变种Geobacter的DIET能力. 但有学者提出磁铁矿等导电材料只接受电子,却不会将电子传递给其他微生物[67],因此研究导电材料在电子传递中的作用时,还应该综合评估对产甲烷微生物的作用.
尽管,产甲烷微生物在碳氮磷的全球循环、环境污染物的修复以及各种生物能源策略中发挥着关键作用,已经有研究将电活性功能菌的电化学行为用于提高甲烷生产,减少启动时间,并提高厌氧消化系统的稳定性[68-69]. 在混合菌种共培养体系中平衡代谢过程的潜在驱动力可能与菌种之间的种内和种间的密切交流有关,然而电活性微生物之间传递偶联尚未得到广泛探索,因此了解并识别微生物通讯通信机制对于MEC电产甲烷的应用至关重要,并为工程系统的潜在应用开辟了无数可能性. 依靠微生物的本能来增强胞外电子传递可能是增强微生物电活性的一种有前途的方法,但仍需大量研究来解开电活性生物相互“通信”的过程.
-
近年来,基于电催化耦合的技术近年来越来越多见,学者将多个处理方法有机融合到一起,达到耦合多个生化过程到一个装置、多工艺协同作用产甲烷的效果,如MEC-AD、MEC-UASB、M-MEC-AD等. 图6总结了部分典型MEC耦合其他系统产甲烷的工艺.
虽然近年来MEC相关的研究势如破竹,但MEC的大规模生应用仍面临诸多问题. 首先是成本问题,MEC的运行需要传质效率高的阴极导电材料,如活性炭颗粒(每t 2000—5000 元)、碳布(每m3 100—250 元)、生物炭(每t 1000—2000 元)、不锈钢(每m3 15—30 元)、钛网(每m3 80—120 元)、铂片(每g 300—400 元)等;虽然相较于其他材料而言,碳基材料成本较低,相关研究也比较充分,但其电催化性能不如金属电极. 金属基材料导电性能优越,但其表面光滑,不利于微生物的附着且高昂的价格也限制了其商业化的应用[4, 10, 14, 18]. 故而用复合材料修饰电极表面是近年来的研究热点,贵金属或纳米修饰的阴极材料不仅导电性好,且表面积大、易于微生物附着,但其制备过程需要用到PTFE等粘合剂,极易造成催化材料的活性位点被覆盖等问题,为此开发高性能、稳定和低成本的阴极材料以降低过电位和整体内阻并优化负载方法是未来MEC阴极材料的大势所趋[10, 14],如可以根据产甲烷菌的生理特性开发金属-纳米-碳基复合材料,并观察电活性微生物的原位长势及富集情况,改善其催化活性和电子传递方式,以提高产甲烷效果.
再者,现阶段单室MEC和双室MEC规模化放大生产中比对研究较少. 虽然单室MEC结构简单无质子膜阻隔,但阴阳电解液相互接触,极易发生副反应或短路现象,而大规模应用时副反应的发生将更加具有不可控性;双室MEC虽然有质子膜将阴阳极分离,但是极易造成阴阳两极的浓差极化,且双室MEC的阴阳两极相距较远,物质间传质阻力较大[4, 6-9, 11-15, 26-34, 37]. 故未来应通过实时监控、定点取样,推进MEC规模化生产应用的研究.
此外,生物阴极虽然结构简单,但阴极与产甲烷菌之间的电子传递和相互作用基质尚不明确,如不同导电材料的投加对于产甲烷MEC性能的影响、参与直接电子传递产甲烷代谢途径的酶除了还原酶Fdox、F420等是否还有未被发现的酶、不同种类的产甲烷菌生态位之间是否存在协同或竞争的关系、执行电子传递的主要控制基因又是什么等. 故未来应采用更加先进的技术手段(宏基因、宏蛋白和多组学生物技术等),分析MEC产甲烷阴极微生物群落结构的动态变化规律,对产甲烷菌的特性进行定向调控,优化MEC性能.
目前,MEC产甲烷的研究主要以小瓶实验为主,中试规模运行效能仍然未知. 在不少MEC耦合工艺的中试试验中,均检测到在长期运行期间由于膜污染、膜形变、废水中过量的生物质等原因,系统性能下降的情况[70-71],如Wang等[32]构建的中式规模的MEC-UASB产甲烷系统,在较低的HRT情况(HRT=2.7 h)下,VFAs积累较快,甲烷产量下降显著. 故而未来的研究中应该着重于MEC工业化长期化运行期间可能遇到的问题如膜污染、膜形变、废水中过量的生物质等问题,放大MEC反应器将是其未来研究方向的主导趋势,以推进MEC工程化应用.
-
为了实现低碳社会和可再生能源利用的目标,许多国家正进行各种技术和产业革命,发展绿色能源和低碳产业.
(1)甲烷是比较理想的清洁能源,通过微生物电解池(MEC)辅助CO2电甲烷化可以强化CO2的资源化,MEC也可以和相关技术联用,实现减碳降碳的同时对污染物进行减量化与无害化,应用前景广阔.
(2)现阶段的MEC电甲烷化依然存在长期批次试验不足、单次循环时间短、甲烷产量及纯度不高、产甲烷菌生长缓慢等问题. 故而开发连续的、系统的CO2电甲烷化反应器,优化生物阴极材料,调节微生物最适宜的环境条件迫在眉睫.
(3)未来的MEC电甲烷化研究应该将理论研究和实际应用进行更深入的结合,开发出:新型CO2电甲烷化生物反应器;克服CO2电甲烷化实验周期短、不稳定的难题;优化反应的条件(电极物理化学性质、工作温度、水力停留时间和有机负载率等);解析MEC中电活性功能微生物菌群、能量代谢理论体系及产甲烷菌的时空演替、种间信息交流方式,通过调控产甲烷菌电子传递的主控基因和胞外电子界面传导路径,提高CO2燃料化动力源的活力. 通过构建稳定、高效的CO2电甲烷化生物反应器,助力CO2减排与碳中和技术,以期为电甲烷化由基础走向工程提供新思路.
微生物电解池催化CO2电转化为甲烷:影响因素、电子传递和展望
Microbial electrolytic cell catalyzed electroconversion of CO2 to CH4:Influencing factors, electronic transmission, outlook
-
摘要: 化石燃料作为能源供应的主要来源,燃烧导致大量CO2的释放和温室效应,CO2的捕获和再利用越来越受到人们的关注. 微生物电解池(MEC)作为一种新的CO2再利用技术,可通过将电活性微生物与电化学刺激相结合,将CO2通过生物电化学作用回收为低碳燃料(如CH4),从而实现CO2固定和能量回收. 尽管近年来MEC领域有较多研究,但仍然存在许多问题阻碍了该技术的规模化和产业化. 本文梳理了CO2电化学产甲烷的工作原理、性能影响的关键因素、生物阴极电活性功能微生物及其胞外电子传递机制、电催化耦合技术的最新研究进展,提出了MEC辅助CO2电甲烷化技术的未来研究需求和挑战.
-
关键词:
- 微生物电解池(MEC) /
- CO2电甲烷化 /
- 阴极材料 /
- 电活性功能菌 /
- 胞外电子传递机制
Abstract: Fossil fuels have been the main source of energy supply, and their combustion leads to the release of a large amount of CO2 and the greenhouse effect. The capture and reuse of CO2 have attracted more and more attention. Microbial electrolysis cell (MEC), a new CO2 reuse technology, can achieve CO2 fixation by combining electroactive microorganisms with electrochemical stimulation to recycle CO2 into low-carbon fuels (such as CH4) through bioelectrochemical action and energy recovery. Although there have many researches in the field of MEC in recent years, there are still many problems which hinder the scale and industrialization of this technology. This paper compares the working principle of CO2-electrochemical methanogenesis, key factors affecting performance, bio-cathode electroactive functional microorganisms and their extracellular electron transfer mechanism, and the latest research progress of electrocatalytic coupling technology. We also presents the future research needs and challenges of MEC CO2-electrochemical methanogenesis technology. -
2021年中国社会化石燃料的使用比重高达89%,二氧化碳(CO2)排放量高达7500万吨,随着化石燃料的大肆消耗和CO2排放量的逐年攀升,人类面临着温室效应和能源危机的双重挑战[1]. 在“碳中和”的大背景下,如何将CO2收集与资源化利用成为关键问题. 常见的CO2利用手段包括地质利用(CO2驱油提高采收率)、化工利用(以CO2为原料生产化学品或燃料)和生物利用(利用微藻类植物进行CO2生物转化)[2-3].
生物电化学系统(Bioelectrochemical systems,BES)是近年来发展起来的,结合了化工利用和生物利用的一项CO2资源化技术,其中微生物电解池(Microbial electrolysis cells,MEC)可有效利用CO2转化为低碳燃料[1, 3-4]. 甲烷(CH4)作为最简单的有机物且含碳量最少的烃,是当今主要的燃料和化工原料. 相较于MEC制氢气(H2)所面临的H2燃点范围宽,常温常压难储存且价格昂贵(每kg 60—70元)等挑战,利用MEC将CO2转化为低碳燃料CH4,不仅极大地降低了CO2的排放并促进碳循环,且CH4作为一种清洁的低碳燃料,价格低廉(每kg 20—30元)且便于运输,可缓解紧张的能源需求[2, 4]. 与传统的厌氧消化产甲烷相比,MEC辅助CO2电产甲烷可将有机物氧化和产甲烷过程分开进行,减少废水对产甲烷菌的冲击,提高甲烷产量[2]. 其原理如图1所示,MEC阳极通过多种氧化反应(析氧反应或有机物的氧化分解)提供质子,质子通过质子交换膜到达阴极,电活性微生物在生物阴极上完成CO2电甲烷化,HCO3-/CO2常常可以被微生物利用产生甲烷[5-6].
近年来关于MEC的研究如雨后春笋破土而出(图2),研究人员多分布在不同国家,但关于MEC的研究方向大多集中在制H2;随着“双碳”目标的提出,MEC精炼废物质能源被开发,相应的电极材料、反应器构造类型、能耗等成为了研究者们关注的问题[2, 5, 7]. 因此,本文全面回顾了MEC电极材料、电压和电产甲烷菌等对CO2电甲烷化效能的影响,并重点讨论阴极电活性功能菌和胞外电子传递机制,以期为MEC在未来应用方面的技术挑战提供理论支撑.
1. MEC性能的影响因素 (Factors affecting the performance of MEC)
MEC辅助CO2电产甲烷的效率受到多方因素的影响,为了获得更高的甲烷产率,需性能稳定的阴极催化剂、高效传递电子的电活性微生物和合适的外加电势等.
MEC阴极作为电活性微生物电子传递的主要介质和产甲烷菌附着的主要场所,是影响MEC性能的关键因素之一,MEC阴极材料一般具有良好的导电性、无微生物毒性、高比表面积、低过电位等[2-3]. 铂(Pt)是最早被用在MEC上的电极材料,其能量效率高达75%—80%,但由于Pt开采、提取过程中负面环境影响大,故亟需开发环境友好且效率与Pt相当的电极材料,碳基材料、金属基材料和复合材料近年来渐渐崭露头角[8-9]. 图3(a)总结了近5年MEC研究者利用不同电极材料所获得的最高甲烷产率和最大电流密度[2-4, 6-21](注:产甲烷率和电流密度均做归一化处理,气体体积按照标况下进行折算). 从数据统计看,最高甲烷产生速率为复合材料>金属基材料>碳基材料. 碳布、碳纸作为MEC生物阴极的基底可达到的最高甲烷产生速率仅为35—87 mL·L−1·d−1之间,低于碳毡和碳刷,可能是由于碳布这类平面电极比表面积低、微生物难以富集在材料内部所导致的,碳毡和碳刷则具有更大的比表面积,更有利于致密电活性生物膜的形成[2, 7]. 不锈钢和过渡金属(主要是镍(Ni))作为金属基材料则具有良好的导电性,其最高甲烷产生速率可达到135—350 mL·L−1·d−1,有研究证实不锈钢可引起电解液脱氢并释放H2,进而促进氢营养型产甲烷菌通过间接电子传递的方式产生CH4[9, 21]. 此外,Ni还是产甲烷菌的关键酶(甲基辅酶M)的组成金属元素,产甲烷菌相较于其他微生物更易占据Ni电极的阴极位点,进而提高甲烷产率[15]. Pt-碳毡和Pt-钛网等是常见的贵金属修饰复合阴极,但Pt修饰的贵金属电极也极易发生析氢反应产生H2,被氢营养型产甲烷菌利用,进而通过间接电子转移的方式刺激CO2快速向CH4转化[11-12, 16]. 电流密度可以侧面反映阴极单位表面积上单位时间内通过的电量,贵金属修饰的复合电极最大电流密度可达45—60 A·m−3,说明其导电性较好[2-4, 6-21]. 纳米管和纳米粒子等纳米材料通过电沉积、空气喷涂等方法修饰在碳基或金属基材料表面制备复合阴极材料,纳米修饰的复合材料通常具有良好的催化活性和稳定性,且多孔疏松的纳米形态有利于细胞的聚集和胞外聚合物的产生,其最高甲烷产生速率高达200—350 mL·L−1·d−1,纳米修饰的复合阴极材料也是近年来MEC阴极的研究热点[10, 14, 19],如磁铁矿/沸石纳米复合材料[22]、Ni/Co-NC纳米复合材料[23]、磁性GO/Fe3O4纳米复合材料[24]等,研究表明,纳米金属复合材料作为MEC阴极更有利于电活性微生物在其上形成厚且致密的生物膜,同时促进氢营养产甲烷通过直接电子转移的方式来来增强CO2到CH4的生物电化学还原作用[22-25].
电压调控对于MEC电产甲烷也尤为重要,图3(b)总结了近几年各个学者在不同电压下利用MEC产生的最高甲烷产生速率[5, 7, 9, 25-36]. −0.6—−1.0 V vs. AgCl是常见的阴极电压,其间的最高甲烷产生速率一般在15—100 mL·L−1·d−1之间[5, 7, 9, 25-36]. 阴极电位越负甲烷产量越高,可能是因为更负的电压提高了产电菌群的活性,并增强了其内部的电子传递效率,但是最佳的甲烷产量是在−0.9—−1.0 V vs. Ag/AgCl 的平衡电位下实现的,虽然研究者常通过施加更负电位的方法以克服CO2电甲烷生成的能垒,但研究表明电压高于−1.2 V时,产甲烷菌的生物膜会遭到破坏,生长活性和代谢速率会降低,所以MEC电压保持在一个合适的范围是非常重要的[5, 9, 28, 33].
除了电极材料和阴极电压外,MEC的结构也会间接影响微生物的电子传递性能及CH4产率[2, 10]. 图3(c)总结了近些年相关文献中,单室和双室MEC的最大产甲烷速率,单室MEC的最高甲烷产生速率一般在85—200 mL·L−1·d−1之间,而双室则在45—100 mL·L−1·d−1之间[3, 4, 7-8, 11-14]. 单室MEC由于无质子膜阻隔,阴阳两极间距较双室MEC更近,故内阻更小、物质间的传质阻力更低、电流密度更高,适合进行规模化CH4生产[13-14]. 但是单室MEC由于无质子膜阻隔,阴阳电解液相互接触,极易发生副反应,所以在单室MEC中如何实现目的产物CH4的高效定向转化是研究者们应该关注的重点问题[37].
此外,MEC中最大电流密度是CO2电甲烷化过程中相对电子传递效率的重要指标,与最高产甲烷速率之间也有一定关系,电流较高意味着更快的反应动力学,更低的生物膜电阻和电荷转移电阻,同时高电流响应意味着较好的生物膜活性和较低的电位损失[14, 16-17]. 从近5年的文献中可以发现,贵金属修饰的复合材料产生的最高电流密度最大(图3(a)),达到47—59 A·m−3之间,可能是贵金属修饰的复合电极更易生物膜的快速成型,从而产生更高的电流;较高的外加电压会产生较高的电流密度,MEC在−1.2 V vs. AgCl时的最高电流密度最大(图3(b)),达到7.5—11.4 A·m−3之间,可能是较高的电压输入给予MEC更高的电流流动;单室MEC的电流密度高于双室MEC(图3(c)),可能是单室MEC内阻小、传质阻力低[13-14].
2. MEC中电活性功能菌的特点及重要作用 (Characteristics and important roles of electroactive functional bacteria in MEC)
2.1 电活性功能菌的种类与形态特征
MEC辅助CO2电产甲烷的运行关键在于阴极腔室内的电活性功能微生物,它们承担着电子转移等重要工作,被誉为MEC的“心脏”. 电活性功能微生物可借助外源电势差突破超电势与内电阻的限制,摄取来自电极表面的电子,还原为CO2为低价态的有机物(如CH4),以及将氧化态物质还原成还原态无机物[38]. 为了提高产MEC产甲烷的性能,了解电活性功能微生物的类型、群落组成和微生物之间的相互作用也至关重要. 能够还原CO2产甲烷的微生物是一种重要的电活性功能微菌,在分类学上,属广古菌门(Euryarchaeota),其包括5个目(Methanobacteriales、Methanococcales、Methanomicrobiales 、Methanopyrales和 Methanosarcinales)、10个科(Methanobacteriaceae、Methanocaldococcaceae、Methanococcaceae、Methanocorpusculaceae、Methanomicrobiaceae、 Methanopyraceae、Methanosaetaceae 、Methanosarcinaceae、Methanospirillaceae、Methanothermaceae)及31个属,这些微生物对氧气极为敏感,因此大多是都需要在严格缺氧的环境中培养[39]. CO2电产甲烷菌常利用的底物类型为甲基类、H2和乙酸,对应的产甲烷菌分别可以被命名为甲基营养型(方程式1)、氢营养型(方程式2)和乙酸营养型(方程式3)产甲烷菌[39].
4CH3OH→3CH4+CO2+2H2O (1) 4H2+CO2→CH4+2H2O (2) CH3COO−+H+→CH4+CO2 (3) 产甲烷菌的主要生理特征(碳源、温度和pH范围)总结在表1中,大多数产甲烷菌是嗜温细胞,在pH值约为7时生长最佳[40]. 形态上,典型的产甲烷菌有甲烷杆菌属(Methanobacterium)、甲烷球菌属(Methanosarcina)和甲烷丝状菌属(Methanosaeta)(图4)[40-41]. 淡水沉积物、泥炭沼泽、稻田和污水消化池等为产甲烷菌最适宜生长的环境[42].
表 1 产甲烷菌的主要生理特征Table 1. Main physiological characteristics of the methanogenic bacteria产甲烷菌Methanogenic bacteria 碳源Carbon sources 温度范围/ °C Temperature range pH 参考文献References Methanosarcinales 乙酸盐,H2 + CO2,CO, 甲醇, 甲胺,甲硫基丙酸甲酯,二甲硫 1.0—70 4.0—10.0 [43-45] Methanomicrobiales H2 + CO2,甲酸盐,乙醇,2-丙醇,2-丁醇,环戊醇 15—60 6.1—8.0 [42, 46] Methanobacteriales H2 + CO2,CO,甲酸盐,C1-甲基化合物 20—88 5.0—8.8 [44] Methanococcales H2 + CO2,甲酸盐 < 20—88 4.5—9.8 [44, 46] Methanopyrales H2 + CO2 84—110 5.5—7.0 [47-48] Methanocellales H2 + CO2,甲酸盐 25—40 6.5—7.8 [44] 2.2 电活性功能菌的胞外传递机制
MEC中电子是如何从阴极电极表面转移用于CO2还原的过程受到学界的关注,一种解释是在MEC的阴极表面产生了H2,附着在阴极的电产甲烷菌以H2/CO2为底物合成CH4,还有一种解释是电产甲烷菌可以直接从阴极表面获得电子还原CO2产生CH4 [46-47]. 培养了一段时间后的MEC的阴极将会被一层厚厚的电活性生物膜覆盖,电活性生物膜的活性外层负责转移电子产生电流,死的内层将作为导电基质发挥作用[46, 49]. 这种电活性生物膜是MEC电产甲烷中微生物和电极之间电子转移过程的重要一环,可以使得电产甲烷菌之间通过有效的细胞“交流”促进细胞间的活动与代谢,利用阴极电极表面的电子产生CH4[50].
在MEC还原CO2产甲烷的体系中,电产甲烷微生物间通过种间电子传递的合作方式对底物及阴极表面的电子进行利用,形成复杂且高度组织化的多细胞和多物种结构,达到互营共生的效果. 一些胞外活性菌会先把大分子有机物分解为小分子有机物,电产甲烷微生物通过利用小分子产生甲烷[46, 49]. 在MEC生物阴极表面,根据电子传递路径的不同可以分为直接种间电子传递(direct interspecies electron transfer,DIET)和间接种间电子传递(mediated interspecies electron transfer,MIET)两种方式[50]. 在DIET中,微生物通过细胞表面的蛋白质(如c型细胞色素)或细胞附属物(如菌毛或纳米线)与不溶性电子受体(如电极)建立直接接触,在MIET中,微生物利用可溶性氧化还原活性化合物作为电子穿梭的媒介,以介导细胞表面暴露的导电蛋白和不溶性电子受体之间的电子转移[50, 51].
H2是最早被发现的能够进行间接种间电子传递的中间载体(图5a),且MIET过程中产甲烷菌的耗H2速率与NAD+/NADH、FAD/FADH2、Fd(ox)/Fd(red)和F420/F420-H2等多种内源性氧化还原介质有关[49]. 辅酶M和辅酶B形成混合二硫化物作为整个厌氧产甲烷呼吸链的电子受体,分子氢、还原型辅酶F420和还原型铁氧还蛋白作为电子供体;A1A0-ATP催化合成的驱动力型ATP合成酶、甲基转移酶和甲酰基甲烷呋喃脱氢酶是与产甲烷过程有关的能量转导酶. 其中,甲基转移酶是一种独特的、可逆的钠离子泵,它将甲基转移与Na+跨膜转运相结合,电子受体菌则利用电子供体菌提供的H2还原辅酶(F420)和铁氧还蛋白(Fd(ox)),进而将CO2还原成甲烷[52].
 图 5 细胞间的电子传递机制(a)通过可扩散分子(如H2和甲酸盐)[53],(b)通过电子穿梭(如黄素)[54],(c)通过导电菌毛[60],(d)通过细胞间的直接接触(如外膜c型细胞色素)[64],(e)通过导电材料(如活性炭、纳米磁铁矿)[61,66-67]Figure 5. Electron transfer mechanism between cells (a) via diffusible molecules (such as H2 and formate) [53], (b) via electron shuttle (such as flavin) [54], (c) via conductive pili [60], (d) via intercellular direct contact (e.g. outer membrane c-type cytochromes) [64], (e) via conductive materials (e.g. activated carbon, nanomagnetite) [61,66-67]
图 5 细胞间的电子传递机制(a)通过可扩散分子(如H2和甲酸盐)[53],(b)通过电子穿梭(如黄素)[54],(c)通过导电菌毛[60],(d)通过细胞间的直接接触(如外膜c型细胞色素)[64],(e)通过导电材料(如活性炭、纳米磁铁矿)[61,66-67]Figure 5. Electron transfer mechanism between cells (a) via diffusible molecules (such as H2 and formate) [53], (b) via electron shuttle (such as flavin) [54], (c) via conductive pili [60], (d) via intercellular direct contact (e.g. outer membrane c-type cytochromes) [64], (e) via conductive materials (e.g. activated carbon, nanomagnetite) [61,66-67]除H2外,甲酸也可作为电子载体介导MIET的发生,Rotaru等[53]在Pelobacter carbinolicus和Geobacter sulfurreducens共培养体系中发现P. carbinolicus和不能利用H2但能利用甲酸的G. sulfurreducens转基因菌株共培养时很容易生长,但若以乙醇作为电子供体、富马酸盐作为电子受体时,两菌没有互营共生且生长受到抑制,证明G. sulfurreducens的甲酸脱氢酶(fdnG)基因可有效弥补氢化酶的缺失,P. carbinolicus通过H2/甲酸盐的种间转移而不是DIET与G. sulfurreducens交换电子.
除H2和甲酸外,具有氧化还原性能的电子介质,如黄素、吩嗪和醌类等,也可介导电产甲烷微生物的MIET[54](图5b). Liu等[55]构建了一个含有S. oneidensis MR-1和可产生核黄素的枯草芽孢杆菌RH33联合体,发现RH33产生的高浓度核黄素可被S. oneidensis MR-1用于提高生物电. Engel等[56]联合培养G. sulfurreducens和S. oneidensis,发现混合培养优于单独培养,可能由于S. oneidensis代谢产生的氢化酶和黄素被G. sulfurreducens用于增强直接电子转移,促进该生物体能够在阳极表面形成更厚的生物膜,同时增加电流密度. 除核黄素之外,腐殖质也具有独特的电子转移能力,能在介导微生物种间电子转移方面发挥重要作用,G. metallireducens和S. alga可利用蒽醌-2,6-二磺酸盐作为电子受体进行厌氧呼吸[57]、维持细胞生长,研究显示,低剂量的蒽醌-2-磺酸盐(50 µmol·L−1)可得到最大的甲烷产量[58].
除了间接电子传递,近年来,研究者发现电活性微生物可通过菌体DIET传递电子,实现互营共生. Summers等[59]在G. metallireducens和G. sulfurreducens的共培养体系中首次证实了DIET的存在,微生物种间DIET机制通过导电菌毛[60]、导电材料[61]与功能蛋白复合物[62]3种方式实现.
导电菌毛是一类由电活性微生物合成、具有导电性的纤维状的蛋白质细丝,通过产甲烷微生物的导电菌毛,微生物胞内代谢产生的电子可以长距离输送到胞外受体或其他产甲烷微生物,实现了微生物-胞外环境的沟通交流[60](图5c). 微生物纳米导线最初通过导电探针原子力显微镜发现,G. sulfurreducens及S. oneidensis,蛋白PilA组成的Ⅳ型菌毛能够实现快速、长距离的电子传递,将电子从细胞表面转移到 Fe (Ⅲ) 表面. 近年来的研究表明,大部分的导电菌毛的主要成分为细胞色素OmcS、PilA蛋白起到调节omcS和其他多血红素细胞色素的分泌的作用[63]. 除了OmcS,常见的功能蛋白复合物还有血红素细胞色素c(MtrC和OmcA),可转运细胞间的蛋白质,实现细胞间的交流协作[64](图5d). 当G. sulfurreducens中血红素细胞色素c基因被敲除后,菌体生长受到抑制,这表明细胞色素所组成的跨膜电子通道主导了DIET过程[62]. 敲除MtrC和OmcA后的S. oneidensis MR-1 细胞,其在电极上的覆盖量和在电极上产生的电流比未敲除基因的细胞减少80%,此外,分离并纯化两种基因后发现,两种外膜细胞色素c可以结合金属氧化物如Fe2O3,并能将电子直接转移到Fe2O3的电极表面,Xiong等[65]还利用光学波导光模型和蛋白膜伏安法测得OmcA与Fe2O3的结合力为1.2—2.6 nmol·cm−2,总之,电活性菌外膜上的MtrC和OmcA可以相互接触通过其暴露在蛋白质表面的血红素将电子直接传导给胞外电子受体[60]. Zhang等在MEC电活性系统中检测到了产甲烷菌菌毛状的纳米线的存在,并认为其有电子转移的能力.
导电材料构建的“微生物-电极”的电子传递系统也是近年来DIET的研究热点,导电材料的加入可明显提升多种厌氧系统的效率并作为导体加强产甲烷微生物种间DIET[61,66-67](图5e). Liu等[61]通过在OmcS蛋白缺失的突变种G. sulfurreducens加入纳米磁铁矿使其弥补了细胞外电子交换中菌毛相关c型细胞色素的缺乏,恢复DIET的能力. Park等[66]将颗粒活性炭加入到厌氧消化的小瓶中使得总甲烷产量比对照组升高了75%,并通过宏基因组学证明了产甲烷总量与效率的提升是颗粒活性炭的加入改变了微生物群落结构并调整了DIET的相关基因的丰度两方面同时作用的结果. 此外,无导电菌毛或导电性能较差的菌株亦可以在导电材料表面与其他微生物建立联系,从而达到互营共生,Liu等[61]研究发现,磁铁矿纳米颗粒(20—50 nm)吸附在导电菌毛上,通过作为菌毛上OmcS的替代物,增强突变种Geobacter的DIET能力. 但有学者提出磁铁矿等导电材料只接受电子,却不会将电子传递给其他微生物[67],因此研究导电材料在电子传递中的作用时,还应该综合评估对产甲烷微生物的作用.
尽管,产甲烷微生物在碳氮磷的全球循环、环境污染物的修复以及各种生物能源策略中发挥着关键作用,已经有研究将电活性功能菌的电化学行为用于提高甲烷生产,减少启动时间,并提高厌氧消化系统的稳定性[68-69]. 在混合菌种共培养体系中平衡代谢过程的潜在驱动力可能与菌种之间的种内和种间的密切交流有关,然而电活性微生物之间传递偶联尚未得到广泛探索,因此了解并识别微生物通讯通信机制对于MEC电产甲烷的应用至关重要,并为工程系统的潜在应用开辟了无数可能性. 依靠微生物的本能来增强胞外电子传递可能是增强微生物电活性的一种有前途的方法,但仍需大量研究来解开电活性生物相互“通信”的过程.
3. 开发实用 MEC 技术的需求和挑战 (The needs and challenges of developing practical MEC technologies)
近年来,基于电催化耦合的技术近年来越来越多见,学者将多个处理方法有机融合到一起,达到耦合多个生化过程到一个装置、多工艺协同作用产甲烷的效果,如MEC-AD、MEC-UASB、M-MEC-AD等. 图6总结了部分典型MEC耦合其他系统产甲烷的工艺.
 图 6 近五年MEC耦合其他系统产甲烷示意图Figure 6. Schematic diagram of methane production from other systems coupled with MEC in the last five years(a)AD-MEC耦合系统系统用于食品加工废水处理[70],(b)MEC-UASB耦合系统治理Fischer-Tropsch废水[32],(c)MEC-UASB耦合系统治理乙醇废水[17],(d)MEC/AnMBR反应器组合处理生活污水[71],(e)MEC-AD-耦合磁铁矿处理废弃污泥[13],(f)MFCs-MEC耦合系统去除硫化物[4],(g)MFC-MEC-ABR耦合系统处理粪便废水[72](a) AD-MEC coupled system for food processing wastewater treatment [70],(b) MEC-UASB coupled system for Fischer-Tropsch wastewater treatment [32],(c) MEC-UASB coupled system for ethanol wastewater treatment [17]; (d) MEC/AnMBR reactor combination for domestic wastewater treatment [71],(e) MEC- AD-coupled magnetite to treat waste sludge [13],(f) MFCs-MEC coupled system to remove sulfide [4], (g) MFC-MEC-ABR coupled system to treat fecal wastewater [72]
图 6 近五年MEC耦合其他系统产甲烷示意图Figure 6. Schematic diagram of methane production from other systems coupled with MEC in the last five years(a)AD-MEC耦合系统系统用于食品加工废水处理[70],(b)MEC-UASB耦合系统治理Fischer-Tropsch废水[32],(c)MEC-UASB耦合系统治理乙醇废水[17],(d)MEC/AnMBR反应器组合处理生活污水[71],(e)MEC-AD-耦合磁铁矿处理废弃污泥[13],(f)MFCs-MEC耦合系统去除硫化物[4],(g)MFC-MEC-ABR耦合系统处理粪便废水[72](a) AD-MEC coupled system for food processing wastewater treatment [70],(b) MEC-UASB coupled system for Fischer-Tropsch wastewater treatment [32],(c) MEC-UASB coupled system for ethanol wastewater treatment [17]; (d) MEC/AnMBR reactor combination for domestic wastewater treatment [71],(e) MEC- AD-coupled magnetite to treat waste sludge [13],(f) MFCs-MEC coupled system to remove sulfide [4], (g) MFC-MEC-ABR coupled system to treat fecal wastewater [72]虽然近年来MEC相关的研究势如破竹,但MEC的大规模生应用仍面临诸多问题. 首先是成本问题,MEC的运行需要传质效率高的阴极导电材料,如活性炭颗粒(每t 2000—5000 元)、碳布(每m3 100—250 元)、生物炭(每t 1000—2000 元)、不锈钢(每m3 15—30 元)、钛网(每m3 80—120 元)、铂片(每g 300—400 元)等;虽然相较于其他材料而言,碳基材料成本较低,相关研究也比较充分,但其电催化性能不如金属电极. 金属基材料导电性能优越,但其表面光滑,不利于微生物的附着且高昂的价格也限制了其商业化的应用[4, 10, 14, 18]. 故而用复合材料修饰电极表面是近年来的研究热点,贵金属或纳米修饰的阴极材料不仅导电性好,且表面积大、易于微生物附着,但其制备过程需要用到PTFE等粘合剂,极易造成催化材料的活性位点被覆盖等问题,为此开发高性能、稳定和低成本的阴极材料以降低过电位和整体内阻并优化负载方法是未来MEC阴极材料的大势所趋[10, 14],如可以根据产甲烷菌的生理特性开发金属-纳米-碳基复合材料,并观察电活性微生物的原位长势及富集情况,改善其催化活性和电子传递方式,以提高产甲烷效果.
再者,现阶段单室MEC和双室MEC规模化放大生产中比对研究较少. 虽然单室MEC结构简单无质子膜阻隔,但阴阳电解液相互接触,极易发生副反应或短路现象,而大规模应用时副反应的发生将更加具有不可控性;双室MEC虽然有质子膜将阴阳极分离,但是极易造成阴阳两极的浓差极化,且双室MEC的阴阳两极相距较远,物质间传质阻力较大[4, 6-9, 11-15, 26-34, 37]. 故未来应通过实时监控、定点取样,推进MEC规模化生产应用的研究.
此外,生物阴极虽然结构简单,但阴极与产甲烷菌之间的电子传递和相互作用基质尚不明确,如不同导电材料的投加对于产甲烷MEC性能的影响、参与直接电子传递产甲烷代谢途径的酶除了还原酶Fdox、F420等是否还有未被发现的酶、不同种类的产甲烷菌生态位之间是否存在协同或竞争的关系、执行电子传递的主要控制基因又是什么等. 故未来应采用更加先进的技术手段(宏基因、宏蛋白和多组学生物技术等),分析MEC产甲烷阴极微生物群落结构的动态变化规律,对产甲烷菌的特性进行定向调控,优化MEC性能.
目前,MEC产甲烷的研究主要以小瓶实验为主,中试规模运行效能仍然未知. 在不少MEC耦合工艺的中试试验中,均检测到在长期运行期间由于膜污染、膜形变、废水中过量的生物质等原因,系统性能下降的情况[70-71],如Wang等[32]构建的中式规模的MEC-UASB产甲烷系统,在较低的HRT情况(HRT=2.7 h)下,VFAs积累较快,甲烷产量下降显著. 故而未来的研究中应该着重于MEC工业化长期化运行期间可能遇到的问题如膜污染、膜形变、废水中过量的生物质等问题,放大MEC反应器将是其未来研究方向的主导趋势,以推进MEC工程化应用.
4. 结语 (Conclusion)
为了实现低碳社会和可再生能源利用的目标,许多国家正进行各种技术和产业革命,发展绿色能源和低碳产业.
(1)甲烷是比较理想的清洁能源,通过微生物电解池(MEC)辅助CO2电甲烷化可以强化CO2的资源化,MEC也可以和相关技术联用,实现减碳降碳的同时对污染物进行减量化与无害化,应用前景广阔.
(2)现阶段的MEC电甲烷化依然存在长期批次试验不足、单次循环时间短、甲烷产量及纯度不高、产甲烷菌生长缓慢等问题. 故而开发连续的、系统的CO2电甲烷化反应器,优化生物阴极材料,调节微生物最适宜的环境条件迫在眉睫.
(3)未来的MEC电甲烷化研究应该将理论研究和实际应用进行更深入的结合,开发出:新型CO2电甲烷化生物反应器;克服CO2电甲烷化实验周期短、不稳定的难题;优化反应的条件(电极物理化学性质、工作温度、水力停留时间和有机负载率等);解析MEC中电活性功能微生物菌群、能量代谢理论体系及产甲烷菌的时空演替、种间信息交流方式,通过调控产甲烷菌电子传递的主控基因和胞外电子界面传导路径,提高CO2燃料化动力源的活力. 通过构建稳定、高效的CO2电甲烷化生物反应器,助力CO2减排与碳中和技术,以期为电甲烷化由基础走向工程提供新思路.
-
图 3 不同电极材料[2-4, 6-21](a)、不同电压[5, 7, 9, 25-36](b)和不同反应器构型[4, 6-9, 11-15, 26-34, 37](c)下最高甲烷产生速率和MEC最大电流密度
Figure 3. Maximum methane production rate and maximum MEC current density for different electrode materials [2-4, 6-21] (a), voltages [5, 7, 9, 25-36] (b) and reactor configurations [4, 6-9, 11-15, 26-34, 37] (c)
图 4 (A—C)65—70 ℃下生长的甲烷杆菌Methanobacterium thermoautotrophicus的SEM图,10 μm[40];(D—G)甲烷球菌Methanosarcina strain 227的SEM图[41],(D)10 μm,(E)500 μm,(F)40 μm,(G)4 μm
Figure 4. (A—C) SEM images of Methanobacterium thermoautotrophicus grown at 65—70 ℃, 10 μm[40]; (D—G) SEM images of Methanosarcina strain 227 [41], (D) 10 μm , (E) 500 μm, (F) 40 μm, and (G) 4 μm
图 5 细胞间的电子传递机制(a)通过可扩散分子(如H2和甲酸盐)[53],(b)通过电子穿梭(如黄素)[54],(c)通过导电菌毛[60],(d)通过细胞间的直接接触(如外膜c型细胞色素)[64],(e)通过导电材料(如活性炭、纳米磁铁矿)[61,66-67]
Figure 5. Electron transfer mechanism between cells (a) via diffusible molecules (such as H2 and formate) [53], (b) via electron shuttle (such as flavin) [54], (c) via conductive pili [60], (d) via intercellular direct contact (e.g. outer membrane c-type cytochromes) [64], (e) via conductive materials (e.g. activated carbon, nanomagnetite) [61,66-67]
表 1 产甲烷菌的主要生理特征
Table 1. Main physiological characteristics of the methanogenic bacteria
产甲烷菌Methanogenic bacteria 碳源Carbon sources 温度范围/ °C Temperature range pH 参考文献References Methanosarcinales 乙酸盐,H2 + CO2,CO, 甲醇, 甲胺,甲硫基丙酸甲酯,二甲硫 1.0—70 4.0—10.0 [43-45] Methanomicrobiales H2 + CO2,甲酸盐,乙醇,2-丙醇,2-丁醇,环戊醇 15—60 6.1—8.0 [42, 46] Methanobacteriales H2 + CO2,CO,甲酸盐,C1-甲基化合物 20—88 5.0—8.8 [44] Methanococcales H2 + CO2,甲酸盐 < 20—88 4.5—9.8 [44, 46] Methanopyrales H2 + CO2 84—110 5.5—7.0 [47-48] Methanocellales H2 + CO2,甲酸盐 25—40 6.5—7.8 [44] -
[1] 谢典, 高亚静, 芦新波, 等. 能耗“双控”向碳排放“双控”转变的实施路径研究 [J]. 综合智慧能源, 2022, 44(7): 73-80. XIE D, GAO Y J, LU X B, et al. Research on the implementation path of the transition from dual control on energy consumption to dual control on carbon emission [J]. Integrated Intelligent Energy, 2022, 44(7): 73-80(in Chinese).
[2] 郑韶娟, 陆雪琴, 张衷译, 等. 微生物电解池: 生物电催化辅助CO2甲烷化技术 [J]. 环境化学, 2019, 38(7): 1666-1674. doi: 10.7524/j.issn.0254-6108.2018091502 ZHENG S J, LU X Q, ZHANG Z Y, et al. Microbial electrolysis cell (MEC): A new platform for CO2 bioelectromethanogenesis assisted by bioelectrocatalysis [J]. Environmental Chemistry, 2019, 38(7): 1666-1674(in Chinese). doi: 10.7524/j.issn.0254-6108.2018091502
[3] ZHEN G Y, ZHENG S J, HAN Y L, et al. Semi-continuous anolyte circulation to strengthen CO2 bioelectromethanosynthesis with complex organic matters as the e-/ H+ donor for simultaneous biowaste refinery [J]. Chemical Engineering Journal, 2022, 430: 133123. doi: 10.1016/j.cej.2021.133123 [4] JIANG Y, SU M, LI D P. Removal of sulfide and production of methane from carbon dioxide in microbial fuel cells-microbial electrolysis cell (MFCs-MEC) coupled system [J]. Applied Biochemistry and Biotechnology, 2014, 172(5): 2720-2731. doi: 10.1007/s12010-013-0718-9 [5] 邹亚娜, 臧越, 王恺元, 等. 生物电催化调控污泥-餐厨垃圾协同厌氧产酸研究 [J]. 环境化学, 2023, 42(1): 298-309. doi: 10.7524/j.issn.0254-6108.2021081202 ZOU Y N, ZANG Y, WANG K Y, et al. Regulated VFAs production from sewage sludge and food waste by insitu bioelectrocatalytic regulation [J]. Environmental Chemistry, 2023, 42(1): 298-309(in Chinese). doi: 10.7524/j.issn.0254-6108.2021081202
[6] WANG X T, ZHANG Y F, WANG B, et al. Enhancement of methane production from waste activated sludge using hybrid microbial electrolysis cells-anaerobic digestion (MEC-AD) process - A review [J]. Bioresource Technology, 2022, 346: 126641. doi: 10.1016/j.biortech.2021.126641 [7] ZHEN G Y, LU X Q, KOBAYASHI T, et al. Promoted electromethanosynthesis in a two-chamber microbial electrolysis cells (MECs) containing a hybrid biocathode covered with graphite felt (GF) [J]. Chemical Engineering Journal, 2016, 284: 1146-1155. doi: 10.1016/j.cej.2015.09.071 [8] DING A Q, YANG Y, SUN G D, et al. Impact of applied voltage on methane generation and microbial activities in an anaerobic microbial electrolysis cell (MEC) [J]. Chemical Engineering Journal, 2016, 283: 260-265. doi: 10.1016/j.cej.2015.07.054 [9] LIU D D, ZHENG T Y, BUISMAN C, et al. Heat-treated stainless steel felt as a new cathode material in a methane-producing bioelectrochemical system [J]. ACS Sustainable Chemistry & Engineering, 2017, 5(12): 11346-11353. [10] CHOI M J, YANG E, YU H W, et al. Transition metal/carbon nanoparticle composite catalysts as platinum substitutes for bioelectrochemical hydrogen production using microbial electrolysis cells [J]. International Journal of Hydrogen Energy, 2019, 44(4): 2258-2265. doi: 10.1016/j.ijhydene.2018.07.020 [11] JIN X D, ZHANG Y F, LI X H, et al. Microbial electrolytic capture, separation and regeneration of CO2 for biogas upgrading [J]. Environmental Science & Technology, 2017, 51(16): 9371-9378. [12] CAI W W, LIU W Z, ZHANG Z J, et al. mcrA sequencing reveals the role of basophilic methanogens in a cathodic methanogenic community [J]. Water Research, 2018, 136: 192-199. doi: 10.1016/j.watres.2018.02.062 [13] 程佳鑫, 李荣兴, 杨海涛, 等. 三维电催化氧化处理难生化降解有机废水研究进展 [J]. 环境化学, 2022, 41(1): 288-304. doi: 10.7524/j.issn.0254-6108.2020082804 CHENG J X, LI R X, YANG H T, et al. Review of three-dimensional electrodes for bio-refractory organic wastewater treatment [J]. Environmental Chemistry, 2022, 41(1): 288-304(in Chinese). doi: 10.7524/j.issn.0254-6108.2020082804
[14] KIM K R, KANG J, CHAE K J. Improvement in methanogenesis by incorporating transition metal nanoparticles and granular activated carbon composites in microbial electrolysis cells [J]. International Journal of Hydrogen Energy, 2017, 42(45): 27623-27629. doi: 10.1016/j.ijhydene.2017.06.142 [15] CHENG T F, LI H Y, XIA W, et al. Exploration into the nickel ‘microcosmos’ in prokaryotes [J]. Coordination Chemistry Reviews, 2016, 311: 24-37. doi: 10.1016/j.ccr.2015.12.007 [16] LI X, ZENG C P, LU Y B, et al. Development of methanogens within cathodic biofilm in the single-chamber microbial electrolysis cell [J]. Bioresource Technology, 2019, 274: 403-409. doi: 10.1016/j.biortech.2018.12.002 [17] ZHEN G Y, LU X Q, KOBAYASHI T, et al. Continuous micro-current stimulation to upgrade methanolic wastewater biodegradation and biomethane recovery in an upflow anaerobic sludge blanket (UASB) reactor [J]. Chemosphere, 2017, 180: 229-238. doi: 10.1016/j.chemosphere.2017.04.006 [18] ZHEN G Y, ZHENG S J, LU X Q, et al. A comprehensive comparison of five different carbon-based cathode materials in CO2 electromethanogenesis: Long-term performance, cell-electrode contact behaviors and extracellular electron transfer pathways [J]. Bioresource Technology, 2018, 266: 382-388. doi: 10.1016/j.biortech.2018.06.101 [19] KIM K Y, HABAS S E, SCHAIDLE J A, et al. Application of phase-pure nickel phosphide nanoparticles as cathode catalysts for hydrogen production in microbial electrolysis cells [J]. Bioresource Technology, 2019, 293: 122067. doi: 10.1016/j.biortech.2019.122067 [20] 唐韵. 阴极表面修饰和电压调控改善MEC阴极生物膜生长和产甲烷性能的研究[D]. 杭州: 浙江大学, 2017. TANG Y. The study of improving cathode biofilm growth and methane production in MEC by surface modification and voltage control[D]. Hangzhou: Zhejiang University, 2017(in Chinese).
[21] 薄涛, 翟洪艳, 季民. 不锈钢毡电极MEC甲烷原位纯化及原理 [J]. 环境科学学报, 2017, 37(11): 4057-4063. doi: 10.13671/j.hjkxxb.2017.0213 BO T, ZHAI H Y, JI M. Research on in suit methane purification in MEC with stainless steel felt as electrode and theory analysis [J]. Acta Scientiae Circumstantiae, 2017, 37(11): 4057-4063(in Chinese). doi: 10.13671/j.hjkxxb.2017.0213
[22] VU M, NOORI M, MIN B. Magnetite/zeolite nanocomposite-modified cathode for enhancing methane generation in microbial electrochemical systems [J]. Chemical Engineering Journal, 2020, 393: 124613. doi: 10.1016/j.cej.2020.124613 [23] ZHENG X M, LIN R J, XU J, et al. moEnhanced methane production by bimetallic metal-organic frameworks (MOFs) as cathode in an anaerobic digestion microbial electrolysis cell [J]. Chemical Engineering Journal, 2022, 440: 135799. doi: 10.1016/j.cej.2022.135799 [24] HE Y T, LI Q, LI J, et al. Magnetic assembling GO/Fe3O4/microbes as hybridized biofilms for enhanced methane production in microbial electrosynthesis [J]. Renewable Energy, 2022, 185: 862-870. doi: 10.1016/j.renene.2021.12.117 [25] BO T, ZHU X Y, ZHANG L X, et al. A new upgraded biogas production process: Coupling microbial electrolysis cell and anaerobic digestion in single-chamber, barrel-shape stainless steel reactor [J]. Electrochemistry Communications, 2014, 45: 67-70. doi: 10.1016/j.elecom.2014.05.026 [26] LIU W Z, CAI W W, GUO Z C, et al. Microbial electrolysis contribution to anaerobic digestion of waste activated sludge, leading to accelerated methane production [J]. Renewable Energy, 2016, 91: 334-339. doi: 10.1016/j.renene.2016.01.082 [27] WANG L, YANG C X, SANGEETHA T, et al. Methane production in a bioelectrochemistry integrated anaerobic reactor with layered nickel foam electrodes [J]. Bioresource Technology, 2020, 313: 123657. doi: 10.1016/j.biortech.2020.123657 [28] ZHANG Y, GONG L L, JIANG Q Q, et al. In-situ CO2 sequestration and nutrients removal in an anaerobic digestion-microbial electrolysis cell by silicates application: Effect of dosage and biogas circulation [J]. Chemical Engineering Journal, 2020, 399: 125680. doi: 10.1016/j.cej.2020.125680 [29] LEE M, REDDY C N, MIN B. In situ integration of microbial electrochemical systems into anaerobic digestion to improve methane fermentation at different substrate concentrations [J]. International Journal of Hydrogen Energy, 2019, 44(4): 2380-2389. doi: 10.1016/j.ijhydene.2018.08.051 [30] LIU D D, ROCA-PUIGROS M, GEPPERT F, et al. Granular carbon-based electrodes as cathodes in methane-producing bioelectrochemical systems [J]. Frontiers in Bioengineering and Biotechnology, 2018, 6: 78. doi: 10.3389/fbioe.2018.00078 [31] BRETSCHGER O, CARPENTER K, PHAN T, et al. Functional and taxonomic dynamics of an electricity-consuming methane-producing microbial community [J]. Bioresource Technology, 2015, 195: 254-264. doi: 10.1016/j.biortech.2015.06.129 [32] WANG D X, HAN Y X, HAN H J, et al. Enhanced treatment of Fischer-Tropsch wastewater using up-flow anaerobic sludge blanket system coupled with micro-electrolysis cell: A pilot scale study [J]. Bioresource Technology, 2017, 238: 333-342. doi: 10.1016/j.biortech.2017.04.056 [33] VU M T, NOORI M T, MIN B. Conductive magnetite nanoparticles trigger syntrophic methane production in single chamber microbial electrochemical systems [J]. Bioresource Technology, 2020, 296: 122265. doi: 10.1016/j.biortech.2019.122265 [34] SIEGERT M, YATES M D, CALL D F, et al. Comparison of nonprecious metal cathode materials for methane production by electromethanogenesis [J]. ACS Sustainable Chemistry & Engineering, 2014, 2(4): 910-917. [35] DOU Z O, DYKSTRA C M, PAVLOSTATHIS S G. Bioelectrochemically assisted anaerobic digestion system for biogas upgrading and enhanced methane production [J]. The Science of the Total Environment, 2018, 633: 1012-1021. doi: 10.1016/j.scitotenv.2018.03.255 [36] GOPAL J, HASAN N, MANIKANDAN M, et al. Bacterial toxicity/compatibility of platinum nanospheres, nanocuboids and nanoflowers [J]. Scientific Reports, 2013, 3: 1260. doi: 10.1038/srep01260 [37] 胡凯, 贾硕秋, 陈卫. 微生物电解池构型和电极材料研究综述 [J]. 能源环境保护, 2016, 30(5): 1-8,34. doi: 10.3969/j.issn.1006-8759.2016.05.001 HU K, JIA S Q, CHEN W. Review on configurations and electrode materials of microbial electrolysis cell [J]. Energy Environmental Protection, 2016, 30(5): 1-8,34(in Chinese). doi: 10.3969/j.issn.1006-8759.2016.05.001
[38] THRASH J C, van TRUMP J I, WEBER K A, et al. Electrochemical stimulation of microbial perchlorate reduction [J]. Environmental Science & Technology, 2007, 41(5): 1740-1746. [39] DASSARMA S, COKER J A, DASSARMA P. Archaea (overview)[M]//SCHAECHTER M. Encyclopedia of Microbiology (Third Edition). Oxford; Academic Press. 2009: 1-23. [40] ZEIKUS J G, WOLFE R S. Methanobacterium thermoautotrophicus sp. n., an anaerobic, autotrophic, extreme thermophile [J]. Journal of Bacteriology, 1972, 109(2): 707-715. doi: 10.1128/jb.109.2.707-713.1972 [41] MAH R A, SMITH M R, BARESI L. Studies on an acetate-fermenting strain of Methanosarcina [J]. Applied and Environmental Microbiology, 1978, 35(6): 1174-1184. doi: 10.1128/aem.35.6.1174-1184.1978 [42] GARCIA J-L, OLLIVIER B, WHITMAN W B. The order methanomicrobiales [J]. Prokaryotes, 2006, 3: 208-230. [43] ANGELIDAKI I, KARAKASHEV D, BATSTONE D J, et al. Chapter sixteen - Biomethanation and its potential[M]//ROSENZWEIG A C, RAGSDALE S W. Methods in Enzymology. Academic Press. 2011: 327-251. [44] LIU Y C, WHITMAN W B. Metabolic, phylogenetic, and ecological diversity of the methanogenic Archaea [J]. Annals of the New York Academy of Sciences, 2008, 1125: 171-189. doi: 10.1196/annals.1419.019 [45] DWORKIN M, FALKOW S, ROSENBERG E, et al. The Prokaryotes: Volume 3: Archaea. Bacteria: Firmicutes, Actinomycetes[M]. Springer, 2006. [46] THAUER R K, KASTER A K, SEEDORF H, et al. Methanogenic Archaea: Ecologically relevant differences in energy conservation [J]. Nature Reviews Microbiology, 2008, 6(8): 579-591. doi: 10.1038/nrmicro1931 [47] ANGELIDAKI I, KARAKASHEV D, BATSTONE D J, et al. Biomethanation and its potential [J]. Methods in Enzymology, 2011, 494: 327-351. [48] TIMMIS K N, MCGENITY T, VAN DER MEER J R, et al. Handbook of hydrocarbon and lipid microbiology[M]. Springer Berlin, 2010. [49] PAQUETE C M, ROSENBAUM M A, BAÑERAS L, et al. Let's chat: Communication between electroactive microorganisms [J]. Bioresource Technology, 2022, 347: 126705. doi: 10.1016/j.biortech.2022.126705 [50] COSTA N L, CLARKE T A, PHILIPP L A, et al. Electron transfer process in microbial electrochemical technologies: The role of cell-surface exposed conductive proteins [J]. Bioresource Technology, 2018, 255: 308-317. doi: 10.1016/j.biortech.2018.01.133 [51] BRUTINEL E D, GRALNICK J A. Shuttling happens: Soluble flavin mediators of extracellular electron transfer in Shewanella [J]. Applied Microbiology and Biotechnology, 2012, 93(1): 41-48. doi: 10.1007/s00253-011-3653-0 [52] STAMS A J M, PLUGGE C M. Electron transfer in syntrophic communities of anaerobic bacteria and Archaea [J]. Nature Reviews. Microbiology, 2009, 7(8): 568-577. doi: 10.1038/nrmicro2166 [53] ROTARU A E, SHRESTHA P M, LIU F H, et al. Inter species electron transfer via hydrogen and formate rather than direct electrical connections in cocultures of Pelobacter carbinolicus and Geobacter sulfurreducens [J]. Applied and Environmental Microbiology, 2012, 78(21): 7645-7651. doi: 10.1128/AEM.01946-12 [54] HUANG L Y, LIU X, YE Y, et al. Evidence for the coexistence of direct and riboflavin-mediated inter species electron transfer in Geobacter co-culture [J]. Environmental Microbiology, 2020, 22(1): 243-254. doi: 10.1111/1462-2920.14842 [55] LIU T, YU Y Y, CHEN T, et al. A synthetic microbial consortium of Shewanella and Bacillus for enhanced generation of bioelectricity [J]. Biotechnology and Bioengineering, 2017, 114(3): 526-532. doi: 10.1002/bit.26094 [56] ENGEL C, SCHATTENBERG F, DOHNT K, et al. Long-term behavior of defined mixed cultures of Geobacter sulfurreducens and Shewanella oneidensis in bioelectrochemical systems [J]. Frontiers in Bioengineering and Biotechnology, 2019, 7: 60. doi: 10.3389/fbioe.2019.00060 [57] 王弋博, 武春媛, 周顺桂. 腐殖质在Comamonas koreensis CY01介导的2, 4-二氯苯氧乙酸还原脱氯过程中的作用 [J]. 草业学报, 2011, 20(1): 248-252. doi: 10.11686/cyxb20110134 WANG Y B, WU C Y, ZHOU S G. Effect of humic substances on the reductive dechlorination of 2, 4-dichlorophenoxyacetic acid by Comamonas koreensis CY01 [J]. Acta Prataculturae Sinica, 2011, 20(1): 248-252(in Chinese). doi: 10.11686/cyxb20110134
[58] LOVLEY D R, FRAGA J L, COATES J D, et al. Humics as an electron donor for anaerobic respiration [J]. Environmental Microbiology, 1999, 1(1): 89-98. doi: 10.1046/j.1462-2920.1999.00009.x [59] SUMMERS Z M, FOGARTY H E, LEANG C, et al. Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria [J]. Science, 2010, 330(6009): 1413-1415. doi: 10.1126/science.1196526 [60] REGUERA G, MCCARTHY K D, MEHTA T, et al. Extracellular electron transfer via microbial nanowires [J]. Nature, 2005, 435(7045): 1098-1101. doi: 10.1038/nature03661 [61] LIU F H, ROTARU A E, SHRESTHA P M, et al. Magnetite compensates for the lack of a pilin-associated c-type cytochrome in extracellular electron exchange [J]. Environmental Microbiology, 2015, 17(3): 648-655. doi: 10.1111/1462-2920.12485 [62] HA P T, LINDEMANN S R, SHI L, et al. Syntrophic anaerobic photosynthesis via direct inter species electron transfer [J]. Nature Communications, 2017, 8: 13924. doi: 10.1038/ncomms13924 [63] 刘星, 周顺桂. 微生物纳米导线的导电机制及功能 [J]. 微生物学报, 2020, 60(9): 2039-2061. doi: 10.13343/j.cnki.wsxb.20200177 LIU X, ZHOU S G. Electrical conductivity and application of microbial nanowires [J]. Acta Microbiologica Sinica, 2020, 60(9): 2039-2061(in Chinese). doi: 10.13343/j.cnki.wsxb.20200177
[64] MCGLYNN S E, CHADWICK G L, KEMPES C P, et al. Single cell activity reveals direct electron transfer in methanotrophic consortia [J]. Nature, 2015, 526(7574): 531-535. doi: 10.1038/nature15512 [65] XIONG Y, SHI L, CHEN B, et al. High-affinity binding and direct electron transfer to solid metals by the Shewanella oneidensis MR-1 outer membrane c-type cytochrome OmcA [J]. Journal of the American Chemical Society, 2006, 128(43): 13978-13979. doi: 10.1021/ja063526d [66] PARK J H, PARK J H, JE SEONG H, et al. Metagenomic insight into methanogenic reactors promoting direct inter species electron transfer via granular activated carbon [J]. Bioresource Technology, 2018, 259: 414-422. doi: 10.1016/j.biortech.2018.03.050 [67] KATO S, HASHIMOTO K, WATANABE K. Methanogenesis facilitated by electric syntrophy via (semi)conductive iron-oxide minerals [J]. Environmental Microbiology, 2012, 14(7): 1646-1654. doi: 10.1111/j.1462-2920.2011.02611.x [68] GIANG H N, ZHANG J, ZHU Z Y, et al. Single-chamber microbial electrochemical cell for CH4 production from CO2 utilizing a microbial consortium [J]. International Journal of Energy Research, 2018, 42(3): 1308-1315. doi: 10.1002/er.3931 [69] CHOI K S, KONDAVEETI S, MIN B. Bioelectrochemical methane (CH4) production in anaerobic digestion at different supplemental voltages[J]. Bioresource Technology, 2017, 245(Pt A): 826-832. [70] PARK J, LEE B, TIAN D, et al. Bioelectrochemical enhancement of methane production from highly concentrated food waste in a combined anaerobic digester and microbial electrolysis cell [J]. Bioresource Technology, 2018, 247: 226-233. doi: 10.1016/j.biortech.2017.09.021 [71] 蔡文忠, 张希晨, 周耀辉. MEC/AnMBR反应器组合处理生活污水 [J]. 南华大学学报(自然科学版), 2017, 31(2): 107-112. CAI W Z, ZHANG X C, ZHOU Y H. Combination of MAC/MBR reactor for domestic sewage treatment [J]. Journal of University of South China (Science and Technology), 2017, 31(2): 107-112(in Chinese).
[72] LIU H B, LV Y C, XU S Y, et al. Configuration and rapid start-up of a novel combined microbial electrolytic process treating fecal sewage [J]. The Science of the Total Environment, 2020, 705: 135986. doi: 10.1016/j.scitotenv.2019.135986 期刊类型引用(0)
其他类型引用(1)
-





 下载:
下载: