-
碳酸酐酶(CA)是一种普遍存在的含锌金属酶,其主要功能是催化CO2的水合反应,反应式如下所示:CO2+H2O↔HCO3−+H+,它是目前已知的催化最快的酶之一[1]. 由于游离CA在高温、强酸或强碱溶剂和化学杂质等条件下容易失活,限制了其大规模的工业应用. 因此,采用分子修饰[2]、定向进化[3]、酶固定化[4]等策略来提高其稳定性和活性. 在上述方法中,酶固定化因其操作简单、方便的特点而被广泛应用.
通过选择良好的载体和合适的固定化方法对游离CA进行固定是降低催化剂成本、提高稳定性和可重复使用性的有效途径[5]. 基于固定化CA的生物催化剂因其低耗能和高效率被认为是转化CO2的环境友好的候选方法. 固定化CA主要通过酶促反应吸收[6],CO2矿化生成金属碳酸盐[7]和多酶级联反应[8]来进行CO2转化. 吸收是目前应用最为广泛的CO2捕集技术之一[6]. 然而,吸收溶剂具有再生所需能量高、吸收速率慢和稳定性低等缺点[9]. CA作为促进剂可以提高CO2吸收反应速率,从而降低反应器尺寸和成本. 在某些情况下,CA还用于促进酶催化的CO2转化. CA参与的多酶级联反应用于生产甲酸盐和甲醇等高价值产品[7].
无论CA是以何种方式转化CO2,CO2转化实验始终以烟气为基础,而烟气中具有高温和其他化合物(NOx和SOx等)[10]. 这些可能会影响CA的活性和稳定性,进而减缓CA转化CO2实际工业应用中的反应速率.
-
CA广泛存在于细菌、真菌和藻类等生物体内,分为不同的类别(α、β、γ、δ、ζ、η和θ)[11]. 大多数CA从牛血红细胞中提取,少数CA从羊和猪等哺乳动物的肝脏以及重组细菌中获得[12]. CA是一种以锌离子作为活性位点的金属酶,在某些情况下,也可以选择其他金属原子,如Cd2+、Co2+、Fe2+或Mn2+来代替Zn2+[13-14],催化各种水解反应,包括羧酸、卤化物、尿素和可水解底物的水合作用[15]. 虽然相同的催化反应由不同的CAs进行,但它们既没有结构相似性,也没有其他相关性[16].
-
在自然状态下,CO2的可逆水合反应十分缓慢,一级反应速率常数仅为5×10−2 s−1,反应步骤如下所示[17]:
(1)CO2水合生成H2CO3:
(2)H2CO3电离生成
HCO−3 和CO2−3 :反应式(1)是CO2水合反应的限速步骤,也是生物系统中碳矿化和碳再利用技术的切入点[18]. 随着CA的引入,Kcat值可高达1.6×106 s–1[19],说明CA可以高效催化CO2的可逆水合反应. 与此同时,CO2水合反应的机制发生改变,变为以下两个步骤[20]:
第一步是CA中与活性中心的Zn2+相连的H2O去质子化形成中间产物EZnOH−,随后CO2被EZnOH−中的OH−水合形成EZn
HCO−3 ,然后EZnHCO−3 中的HCO−3 被水置换形成EZnH2O和HCO−3 ;第二步是EZnH2O的去质子化:EZnH2O通过酶分子中的质子转运体将质子(H+)转运至溶剂中并被还原成具有催化活性的EZnOH−.
-
酶固定化的催化活性和稳定性在很大程度上取决于载体和固定化方法的选择,首先应在固定化过程中保持酶活性[21]. 近年来,各种材料已被用作固定化CA的载体,包括水凝胶[22]、壳聚糖[23]、二氧化硅[19]和金属有机框架(MOFs)[24]等. 酶可以通过多种方法固定在载体上,例如包埋、吸附、交联、共价结合、交联酶聚集体(CLEAs)[25]和纳米花型酶-无机杂化固定化酶(简称纳米花)[26]等. CA固定化方法优缺点如表1所示.
吸附是一种简单有效的固定化方法,通过氢键、疏水键、离子键和范德华力的相互作用将酶固定在载体表面. 在多数情况下,与载体的温和相互作用可确保固定后酶的微小构象变化[27],这在很大程度上取决于载体的性质. Yin等[24]结合了磁性材料易于回收和可重复使用性,以及MOF具有高孔隙率、大比表面积和良好稳定性的优点,构建了核壳磁性ZIF-8@Fe3O4复合材料. CA通过吸附固定在ZIF-8@Fe3O4上. 游离CA和CA@ZIF-8@Fe3O4分别在40 ℃的1 mol·L−1 MDEA中储存9 d,CA@ZIF-8@Fe3O4的活性随着储存时间的延长而逐渐降低,但其活性始终高于等量游离CA. 包埋是一种将酶限制在载体材料中的固定化方法,可以有效防止酶浸出和变性[6]. Hsieh等[19]将二氧化硅缩合肽(R5)与硫化氢碳酸酐酶(SazCA)融合形成R5-SazCA,再把R5-SazCA包埋到二氧化硅纳米颗粒(R5-SazCA-SP)中. 在70 ℃培养3 h后,R5-SazCA和R5-SazCA-SP的残余活性分别为49%和60%,表明CA固定化后热稳定性得到改善. 增强的热稳定性通常归因于二氧化硅交联网络施加的空间约束,这有助于维持CA的立体结构.
共价结合是一种常用的固定化方法,可以显著增强和提高酶的稳定性. 改性载体表面的胺基、羟基、羧基或环氧基等官能团和CA的氨基酸残基之间可以形成共价键,从而使得酶和载体中间具有很强的相互作用[28]. Shamna等[29]将CA通过共价结合固定在胺官能化的铝-硅氧烷气凝胶珠(BCA-Al/Si-NH2)上. BCA-Al/Si-NH2杂化珠的动力学参数与游离酶相当. 固定化CA具有热稳定性、pH稳定性和储存稳定性,这是由于酶的多点附着和酶与载体之间的相互作用导致酶刚性增加,从而减少了构象变化. Sun等[30]将CA通过戊二醛(GA)共价连接到聚偏二氟乙烯(PVDF)膜和聚乙烯膜(PE)的表面,这些膜固定化CA之前通过聚乙烯亚胺(PEI)和多巴胺(DA)的共沉淀进行了修饰. PEI/PDA-PE的活性回收率高于PEI/PDA-PVDF,因为PE具有更大的孔结构和改性后更好的亲水性,从而引起更高的酶负载量和更好的酶亲和力. 此外,固定化后,CA的储存稳定性和可重复使用性得到很大提高.
考虑到载体材料的物理和化学性质、操作条件等,通常需要多种固定化方法的协同作用从而获得高效的固定化CA[6]. Chang等[31]将CA通过吸附-交联法固定在地质聚合物微球上,与游离CA相比,固定化CA的最适pH值从7.5增加到8.0,最适温度从25 ℃增加到30 ℃. Effendi等[11]将Sulfurihydrogenibium yellowstonense CA(SyCA)共价结合在新型聚丙烯腈(PAN)和聚对苯二甲酸乙二醇酯(PET)纳米纤维上,所得复合材料通过戊二醛(GA)进一步交联. 固定化粗SyCA在60 ℃下保留了超过100%的相对残余活性,这归因于粗SyCA的胺基和纳米纤维的羟基之间的共价结合,而且固定化粗SyCA和GA之间交联也会形成共价键. 此外,测定了固定化CA对SOx和NOx的耐受性. 固定化SyCA在50 mmol·L−1 HNO3和H2SO4存在下的残余酶活性分别为57.1%和61.6%.
CLEAs是一种无需载体的新型固定化酶制备技术,该方法包括沉淀和交联两个主要步骤[26]:(1)通过沉淀剂(盐、水溶性有机溶剂或非离子聚合物)在溶液中形成酶聚集体;(2)聚集体中酶分子通过交联剂交联,使它们在去除沉淀剂后不溶. 然而,对于工业应用来说,CLEA柔软且容易断裂,为了提高CLEA的机械性能,Jun等[32]使用纳米纤维共价连接bCA,然后交联并进行沉淀,以获得bCA沉淀涂层(EPC). EPC在剧烈摇动下868 d后仍保留其活性的65.3%,EPC的高稳定性可以通过酶沉淀和交联的结合来解释,使酶分子之间通过化学键紧密的链接,从而有效防止酶变性和浸出. 纳米花型酶-无机杂化固定化酶由2012年Ge等[33]首次提出,通过将酶与硫酸铜在磷酸盐缓冲溶液中共沉淀,从而形成典型的花瓣状结构. Wen等[22]对此固定化方法进一步研究,将双金属离子(Cu2+和Zn2+)代替单个金属离子来固定CA,然后将双金属基杂化纳米花(CANF)复合材料嵌入到聚乙烯醇(PVA)/壳聚糖(CS)水凝胶膜(PVA/CS@CANF)中. 水凝胶膜在8个循环后仍保持其原始活性的75%以上,在60 ℃下仍有超过80%的相对活性. 此外,PVA/CS@CANF膜转化CO2产生的CaCO3量是游离CA的9倍.
-
二氧化碳排放是造成温室效应的主要原因. 当前,CO2捕集、利用和封存(CCUS)技术已广泛应用于减少CO2排放到大气中. CCUS技术将CO2资源化,便于运输和长期储存[29]. 基于CA的生物酶法通过捕集大气或废气中的CO2,并进一步转化为高价值的工业化学品和燃料,如金属碳酸盐、甲醇和甲酸等.
-
CA催化的CO2水合反应生成的碳酸氢盐可进一步用作碳源,用于合成无机碳酸盐和促进藻类的生长. CA将CO2矿化生成CaCO3的原理为CA首先催化CO2水合形成碳酸氢根离子(4),然后与添加的Ca2+反应生成CaCO3(5),CaCO3易于分离和储存以供进一步利用. Shamna等[29]将CA共价连接在铝-硅氧烷气凝胶珠上,并进一步检测了其将CO2转化为CaCO3的能力:1 mg游离bCA和17 μg bCA-Al/Si-NH2生成CaCO3质量为32.4 mg和12 mg. 通过XRD表明CA转化的碳酸钙的晶相为方解石,且CaCO3的晶体结构不会因添加酶而改变. Jun等[32]使用纳米纤维共价固定bCA,然后进行交联并沉淀,以获得bCA沉淀涂层(EPC). CA通过催化系统中鼓泡的CO2的可逆水合生成碳酸氢盐,为微藻提供光合作用的碳源. 添加 EPC的系统与含有25 mmol·L−1 NaHCO3和不含碳源的相比,分别使微藻生长加速了134%和231%. Xu等[34]将CA与戊二醛(GA)交联并包埋在漂浮的海藻酸钙水凝胶珠中,并将珠子保留在微藻-大气界面便于直接从空气中捕集CO2. 与(22.7±0.5) mg·L−1每天的自然生长速率相比,游离CA和CA-GA珠粒分别将微藻的生长速率提高到(37±3)mg·L−1每天和(40±1)mg·L−1每天,而且珠子容易回收和重复使用,具有广阔的工业前景.
当前通过全细胞固定化构建了用于CO2捕集的新型全细胞催化剂,避免酶泄漏和细胞裂解从而提高酶的稳定性和可重复使用性[7]. Sharma等[35]将含CA的苦参棒状杆菌菌株的细胞共价固定到戊二醛功能化的角蛋白颗粒上. 含有144 U·mg−1 CA的菌株细胞裂解物形成65.12 mg CaCO3. 进行10次CO2转化后,固定化细胞和游离细胞CaCO3的相对产量分别为53.46%和22.15%. Moon等[36]将周质水生弧菌CA(hmCA)的全细胞催化剂通过包埋固定在聚氨酯泡沫上(pCA-PUF),经9次循环使用后,pCA-PUF的高相对活性没有明显下降,并且显示出良好的可重复使用性. 使用该固定化生物催化剂将设计的填充床反应器中的CO2捕集速率提高了80%. 微生物细胞表面展示是将某一蛋白或短肽(靶蛋白)与微生物细胞的外膜蛋白(载体蛋白)以融合蛋白的形式锚定在微生物细胞表面的技术. 大肠杆菌是生产重组蛋白最常用的宿主细胞之一[37]. Zhu等[38]以大肠杆菌为宿主细胞,通过将SazCA作为靶蛋白与冰核蛋白(INPN)(载体蛋白)锚定在细胞外膜上构建表面展示菌株. 工程菌株矿化CO2产生的CaCO3质量(241 mg)明显高于胞内表达菌株(173 mg). Tan等[39]将(Mesorhizobium loti CA)MlCA克隆到3个载体中且在大肠杆菌中表达,并将离心获得的全细胞样品固定在琼脂上. 结果表明,全细胞生物催化剂具有良好的稳定性,储存40 d后相对活性保持近100%. 此外,具有固定化全细胞生物催化剂的系统可在3.5 min内有效地将CO2100%转化为CaCO3. 通过表2展示了固定化CA矿化CO2性能的比较.
-
到目前为止,已经开发了使用纯水、碳酸盐溶液(Na2CO3和K2CO3等)和醇胺溶液等吸收二氧化碳的工艺. 常用于捕集CO2的醇胺溶液主要有伯胺(一乙醇胺,MEA)、仲胺(二乙醇胺-DEA)、叔胺(N-甲基二乙醇胺-MDEA、二异丙醇胺-ADIP和三乙醇胺-TEA)和哌嗪(PZ)等[42]. MEA吸收速度快,不易挥发,但是溶剂在汽提塔中的解吸需要大量的能量,导致电费成倍增加,需要对其进行改进. 与MEA相比,K2CO3溶液具有低毒性,不易腐蚀,在高温下高效且低成本的再生等优点,而且MDEA再生能耗低、吸收CO2容量大. 但是K2CO3溶液和MDEA吸收速率较慢,添加CA可显著促进MDEA和K2CO3溶液吸收CO2[17].
当前,固定化CA已用于纯水中吸收二氧化碳研究. Chang等[31]将CA通过吸附-交联法固定在地质聚合物微球上. 采用水浴设定不同温度,pH计可监测反应溶液pH值随不同催化反应条件的变化,从而评价固定化CAs的催化性能. 当温度为30 ℃,气体流速为300 mL·min−1时,溶液的pH值明显下降. Xu等[43]将CA通过交联固定在聚多巴胺(PDA)/聚乙烯亚胺(PEI)修饰的聚偏氟乙烯(PVDF)膜上(简称CA-m-PVDF复合膜),在气液膜接触器中使用速率为0.25 m·s−1的水作为吸收剂,CA-m-PVDF复合膜具有较高的CO2通量值(2.5×10−3 mol·m−2·s−1),该CO2通量值比未添加CA时增加约160%.
MDEA吸收CO2的过程中形成不稳定的氨基甲酸盐和碳酸氢根离子,加热时释放出CO2达到解吸和再生的目的. Zhang等[44]将CA通过吸附固定到ZIF-L-1(MOFs)上,得到CA/ZIF-L-1复合材料. 由于ZIF-L-1和CA均含有Zn2+,两者之间存在协同作用,ZIF-L-1中的咪唑基团(mIm)可以作为亲核试剂参与CO2的水合生成碳酸氢盐(6),而且该反应能够促进CO2的液-固传质. 加入0.05 g·L−1 CA/ZIF-L-1后,MDEA中的CO2吸收率提高了2.5倍. Du等[45]进行了类似的研究,把CA包埋到不同粒径的ZIF-8(CA/ZIF-8)中,并将CO2吸收到MDEA中,MDEA的吸收率增加到2.4倍. Xu等[46]将CA固定在表面改性的磁性Fe3O4纳米颗粒(MNP)上,并用原位聚合合成MNP-CA纳米凝胶. 通过反应器测试了MNP-CA纳米凝胶加速MDEA水溶液中CO2吸收的有效性,MNP-CA纳米凝胶在30 ℃的CO2吸收率为不含CA时的170%. 而且MNP-CA纳米凝胶的加入使湿壁柱气相中的总传质系数(KG)在60 ℃时增加了4.61倍. 费潇瑶[47]使用共价结合法将氨基功能化介孔材料固定在CA上(CA/AFS)对用于MDEA溶液解吸CO2进行了研究,固定化CA的加入对CO2平衡解吸量基本没有影响,但CA/AFS的加入可以在未达到平衡状态之前,提高CO2的瞬时解吸量.
CO2在碳酸盐溶液中的总反应如下所示(7),CA可有效促进二氧化碳吸收到碳酸盐溶液中[9]. Fabbricino等[48]将嗜热细菌的碳酸酐酶(SspCA)作为膜锚定蛋白固定在大肠杆菌细胞的外膜(INPN-SspCA)上. 在碱性溶液(0.5 mol·L−1 Na2CO3/0.5 mol·L−1 NaHCO3)吸收CO2反应过程中,加入SspCA的膜细胞碎片用作生物催化剂,观察到压力值的迅速下降和比未添加催化剂时更高的CO2吸收率. Peirce等[49]报道了CA在高浓度碳酸盐溶液中容易失活,因此将工业级碳酸酐酶(NovoCA)固定在顺磁性Fe3O4纳米颗粒上进行改善,并分别在25 ℃和40 ℃的条件下,于0.5 mol·L−1 Na2CO3/NaHCO3缓冲液(pH=9.6)和10%wt K2CO3溶液的搅拌池反应器中进行CO2吸收测试[10]. 溶液中固定化CA的Kcat/Km均在5.52×10−1—5.52 L·mol−1·s−1之间. Qi等[50]通过湿壁柱测定表明,在20% wt K2CO3溶剂中加入2 g·L−1 CA后,CO2总传质系数(KG)提高了约5倍. 当CA浓度从零增加到2.5 g·L−1时,CO2捕集效率增加了4.6倍.
Gladi等[17]探究了在湿壁柱中对4种溶液(MEA、AMP(2-氨基-2-甲基-1-丙醇)、MDEA和K2CO3溶液)添加0.2% wt CA后吸收CO2的影响. 研究表明,添加CA显著增加了MDEA和K2CO3的液侧传质膜系数,AMP略微增加,而MEA没有变化. MDEA的反应速率随温度升高而降低,而在较低的溶剂浓度(5% wt—15 %wt)下,温度和溶剂浓度对K2CO3中反应速率的影响较小,但在20% wt时,温度升高会显着提高反应速率. 此外,混合溶剂对CO2进行吸收比单一溶剂表现出更高的吸收效率,因为它们结合了单一溶剂的优点. Sahoo等[51]将CA共价固定到异质功能化载体(HFS)和锌络合物(Zn-Im)上(CA/Zn-Im:HFS),并将CA/Zn-Im:HFS加入到混合溶剂(30% wt MEA+7.5% wt PZ+15% wt K2CO3)中加快CO2的吸收和解吸. 含有CA/Zn-Im: HFS的混合溶剂(21.65 %wt)在20 min内CO2的吸收量高于纯混合溶剂(13.75 %wt). 含有CA/Zn-Im: HFS的混合溶剂比纯混合溶剂的CO2相对解吸率高1.57倍. 通过表3展示了CA在二氧化碳吸收中的催化性能.
-
CO2加氢提供了一种碳再生方法,可以通过特定的催化剂转化为甲酸盐、甲醛和甲醇等高价值化学品和燃料. 固定化酶催化因具有反应条件温和、选择性高、可多次催化和效率高等优点,在CO2加氢中引起了广泛关注. 但是,常压下CO2的低溶解度严重限制了酶促反应的速率[53]. CA不仅能够加速CO2的水合,还用于促进酶催化的CO2转化. Wang等[54]报道随着CA的加入,甲酸脱氢酶的底物从CO2转化为更易溶解的
HCO−3 ,导致甲酸的产率提高了4.2倍. 此外,多酶级联反应在CO2的多酶转化中表现出良好的应用前景. CO2在3种不同的脱氢酶(即甲酸脱氢酶(FateDH)、甲醛脱氢酶(FaldDH)和乙醇脱氢酶(ADH))的催化下转化为甲醇. 在NADH的存在下,FateDH将CO2转化为甲酸,甲酸随后在FaldDH的催化下还原为甲醛,甲醛通过ADH进一步转化为甲醇[8].甲酸本身是一种具有商业价值的化学品,它可用作燃料电池的原料和青贮饲料防腐剂,并且二氧化碳形成甲酸所需的能量较低[55]. Zhai等[56]把CA固定在聚乙烯亚胺(PEI)和聚多巴胺(PDA)的改性的二氧化硅微球(PDA/PEI-SiO2-CA)上,并将其添加到含有NADH和FDH的反应溶液中,从而将CO2转化为甲酸盐. 通过改性在SiO2表面引入氨基,氨基与CO2反应形成氨基甲酸酯和碳酸氢盐,因此CA固定在PDA/PEI-SiO2表面上可产生协同效应. 在PDA/PEI-SiO2-CA存在下,初始反应速率是空白对照的48.6倍,甲酸盐产量也高于空白对照. Zhang等[57]通过微生物转谷氨酰胺转胺酶(MTG)充当“交联介质”将CA和FateDH交联在一起形成交联酶. 在二氧化碳转化为甲酸的实验中,交联酶的催化效率可高达游离酶的5.8倍.
固定多酶体系转化CO2生产甲酸已得到广泛研究. 然而,价格昂贵的辅因子(NADH)的再生和循环利用仍然是CO2高效转化的主要问题[58]. Ren等[53]通过将CA、FateDH、GDH(谷氨酸脱氢酶)、PEI(阳离子聚电解质)和辅因子原位包埋到ZIF-8中,构建了纳米级多酶反应器(Co-IMR). NADH通过带正电的PEI和带负电的辅因子之间的离子交换被束缚在ZIF-8中,并通过嵌入ZIF-8中的GDH再生. Co-IMR在8次重复循环使用后仍保留其初次甲酸生产率的50%,表现出良好的重复使用性. 与游离多酶系统相比,Co-IMR在8次重复循环使用后,总累积甲酸产量增加了4.6倍. Chai等[55]进行了类似研究,制备了ZIF-8/CA&FDH薄膜. ZIF-8中的咪唑基团和CA的协同作用使得CO2对甲酸的整体催化活性提高了1.6倍. Wang等[59]将CA、FateDH、GDH包埋在聚多巴胺微胶囊上. 与游离多酶相比,聚多巴胺微胶囊中固定化多酶体系催化产生的HCOOH高4.5倍以上,基于NADH的甲酸产率为342%. Li等[60]使用胺官能化MIL-101(Cr)作为核心,其具有CO2气体吸附性能,再通过包埋将CA、FateDH和GDH 3种酶固定在外层HKUST-1上. 胺官能化的MIL-101(Cr)释放的CO2底物首先进入CA并水合为碳酸氢根离子,然后
HCO−3 迁移到FateDH上转化为甲酸,而GDH用于多酶系统中NADH的连续再生. 固定化多酶系统以储存的CO2为底物催化生成的甲酸盐产量比相应的游离酶系统以鼓泡的CO2作为底物高13.1倍以上.甲醇是一种重要的化工原料及能源物质,由合成天然气制备的甲醇程序复杂,且成本较高[8]. 多酶级联催化CO2甲醇化作为一种生物催化手段近年来引起了较多关注. Wang等[61]把FateDH、FaldDH和ADH共固定在聚苯乙烯微粒上,从而将CO2转化为甲醇. 在没有添加CA的情况下,固定多酶体系11次重复循环使用后产生了48%的累计甲醇收率. 甲醇的收率较低,有待进一步改进. Ji等[62]通过将甲酸脱氢酶、甲醛脱氢酶、乙醇脱氢酶和谷氨酸脱氢酶四种酶和辅因子原位包埋在阳离子聚电解质掺杂的中空纳米纤维腔内,并通过在中空纳米纤维的外表面上组装CA加速CO2水合,进行了进一步研究. 对于涉及3种脱氢酶的CO2还原酶系统,实现了103.2%的最高甲醇收率,该反应系统10次重复循环使用后产生了940.5%的累积甲醇收率.
-
基于CA的生物催化系统可以有效地促进CO2的捕集和分离,但只有少数案例与工业过程中的实际应用密切相关. 对于工业应用,CA必须长时间在高温、高离子强度、高pH值和高剪切应力的条件下保持较高活性和稳定性. Lalande等[63]设计并安装了含有固定化CA的CO2填充柱,用于回收和循环利用来自水泥熟料生产的CO2. 固定化CA催化CO2水合形成碳酸氢根离子与添加的CaCl2反应生成的CaCO3被用作波特兰水泥厂的原料. 2015年,在加拿大魁北克省[64]进行了基于CA的CO2捕集工艺的有史以来规模最大的测试. 该测试使用了添加定向进化CA的20% wt的K2CO3/KHCO3溶液,能够在2500 h内以80%的平均捕集效率每天从燃烧天然气的锅炉的燃烧气体中捕集1×104 kg CO2. 实验过程中仅产生少量无毒碱性废水,无需特殊处理直接排入市政下水道. 此外,从汽提塔装置中排出的CO2气体的纯度约99.3%,可用于生产燃料、塑料和化学品等产品. Reardon等[65]在威尔逊维尔的国家碳捕集中心(NCCC)将CA固定在吸收柱的内表面,以20% wt K2CO3和非挥发性碱性盐溶液(AKM-24)作为吸收剂. 固定化CA使传质速率提高了6—7倍,并在40 d 3460 h内保持了超过80%的烟气中CO2的捕集效率. 为了评估CA催化的CO2加速吸收到MDEA水溶液中,在威尔逊维尔的NCCC进行中试规模的CO2捕集实验. 捕集装置在连续6 d吸收温度25—35 ℃和87 ℃解吸温度之间循环,在稳态条件下每天能够捕集多达68.1 kg的二氧化碳[3]. 总而言之,与之前的无生物催化剂过程相比,CA介导的CO2捕集过程具有显著促进作用.
-
为了改善游离CA在高温、强酸或强碱溶剂和化学杂质等条件下容易失活的特性,使用合适的载体和固定化方法对CA进行固定. CO2可通过酶促反应吸收,或通过CA一步催化或级联催化转化为无机碳酸盐、甲酸和甲醇等高价值产品. 固定化CA转化CO2的应用取得了一定的成效,但是仍存在一些技术瓶颈,可总结为以下几个方面:(1)CA价格昂贵. (2)CA对烟气中存在的高温、SOx和NOx耐受性差. (3)固定化方法尚不完善和载体的酶负载量低导致固定化CA活性低.
针对上述问题,未来的研究方向应集中于:(1)从转基因生物中提取大量CA,降低CA生产成本. (2)进一步研究CAs相关基因的生理作用和代谢途径,以提高化学和热稳定性. (3)研发先进的固定化方法和制备具有良好的机械强度、稳定性和对酶亲和力高的载体,提高固定化CA活性.
碳酸酐酶的固定化及其在二氧化碳转化中的应用
Immobilization of carbonic anhydrase and its application in carbon dioxide conversion
-
摘要: 碳酸酐酶(CA)作为生物系统中典型的含锌金属酶,可高效催化CO2的可逆水合反应. 为了提高CA在实际工业应用中的利用率,本文介绍了传统固定化方法和新型固定化方法(交联酶聚集体和纳米花),阐述了CA催化CO2的水合机理,总结了固定化CA矿化CO2生成CaCO3;CA促进单一溶剂(纯水、碳酸盐溶剂和醇胺溶剂)和混合溶剂吸收、解吸CO2;固定化多酶级联(碳酸酐酶、甲酸脱氢酶、甲醛脱氢酶、乙醇脱氢酶和谷氨酸脱氢酶)催化CO2生产甲酸和甲醇的过程,以及其实际工业应用的最新进展. 未来的研究方向应集中于从转基因生物中提取大量CA,进一步研究CAs相关基因的生理作用和代谢途径,制备高性能的载体和研发先进的固定化方法.Abstract: Carbonic anhydrase (CA), as a typical zinc-containing metalloenzyme in biological systems, which can efficiently catalyze the reversible hydration of CO2. In order to improve the utilization of CA in practical industrial applications, traditional immobilization methods and novel immobilization methods (cross-linked enzyme aggregates and nanoflowers) are introduced in this paper, and the mechanism of CA-catalyzed CO2 hydration is described. The process of immobilized CA mineralizing CO2 to generate CaCO3 is expounded. The procedure of CA to promote the absorption and desorption of CO2 in single solvent (pure water, carbonate solvent and alcohol amine solvent) and mixed solvent is summarized. The procedure of immobilized multi-enzyme cascades (carbonic anhydrase, formate dehydrogenase, formaldehyde dehydrogenase, alcohol dehydrogenase, and glutamate dehydrogenase) catalyzing CO2 to produce formic acid and methanol, and the latest progress in its practical industrial application are reviewed. Future research directions should focus on extracting large amounts of CA from transgenic organisms, further studying the physiological roles and metabolic pathways of CAs-related genes, as well as preparing high-performance carriers and developing advanced immobilization methods.
-
Key words:
- carbonic anhydrase /
- immobilization /
- carbon dioxide conversion.
-
铅锌矿在中国矿产资源体系中占据着至关重要的地位,是工业领域的“关键基石”. 我国已勘铅锌资源主要集中于7个省区,储量约占全国66%,其中就包含甘肃省[1]. 在矿业开采与工业加工进程中,废液未经妥善处理随意排放,废渣堆积成山,加上雨水冲刷,致使 Cd、Hg等有害成矿、伴矿元素不断迁移、扩散,对周边土壤造成污染. 同时,由于土壤重金属污染的累积性[2],使其在土壤中的浓度越来越高,最终对生态系统造成危害[3]. 统计数据显示,我国有超过2000万 hm2的农田土壤存在重金属污染情况,当中被工业废渣污染的农田约10万 hm2,因采矿而污染的土壤面积约20万 hm2[4]. 一旦土壤重金属富集至特定程度,便会对农作物质量产生直接影响,有研究表明,国内每年由于土壤重金属污染而导致的粮食安全损失高达1.2×108 t,直接造成的经济损失逾 200 亿元[5]. 其毒性效应可经食物链传递至人体,引发骨骼疼痛、肾脏疾病等健康问题,对人类健康构成了极大的威胁 [6].
目前国内外学者对土壤重金属源解析的方法主要包括判别污染源类别和精准解析污染源两部分[7 − 9],前者包括相关性分析法、主成分分析法和聚类分析法等,后者包括绝对因子得分-多元线性回归法和正定矩阵因子分解法(positive matrix factorization,PMF)等. PMF是对污染源进行精确分析的首选方法,该方法操作简单,可同时满足不确定性和非负性约束[10],能够自动化地处理错误和缺失数据,不需要源组分图就能得到精确、可信的结果,因此被美国环保署优先推荐使用[11]. PMF 源解析虽能识别土壤重金属污染源,但难以精准量化其生态风险和健康风险,从而无法确定首要管控要素[11]. 为此,学者们将PMF模型与生态风险、健康风险评价模型进行整合,成功提出重金属污染特定源的风险评价方法[12]. 马杰等[13]将PMF模型和健康风险模型结合,探讨了不同污染源影响下重庆市农产品主产区的土壤健康风险,确定研究区工业源和As为首要管控要素,重金属源解析成为后期尾矿库及其周围土壤修复或复垦的重要依据.
甘肃省陇南市矿产资源丰富,尾矿库数量多,以铅锌矿和金矿尾矿为主,占比分别为72.54%和15.5%[14]. 当前,铅锌尾矿库及周边农田是土壤重金属污染的重点关注区域. 本文以此为研究对象,测定其土壤重金属含量,分析其污染状况,并在源解析的基础上结合生态风险和健康风险评估模型来量化各污染源相应风险贡献率,从而确定首要控制因素. 研究结果将为尾矿库周边农田土壤污染现状的调查和评价提供科学有效的理论依据.
1. 材料与方法(Materials and methods)
1.1 研究区概况
研究区地处徽县江洛镇赵湾村,隶属于甘肃省陇南市. 县名源自城北徽山之下的徽山驿,在北纬33°32'—34°10'、东经105°34'—106°26'之间,东接两当县,南连陕西省略阳县,西接成县,北通天水市秦州区与麦积区,西北衔西和县,总面积
2699 km2. 江洛镇处于徽县北部山地向中部河谷丘陵过渡区域,地势自北向南渐次降低,地形分为东南部河谷区,西北部山区;境内最高峰海拔2002 m. 江洛镇属暖温带大陆性气候;多年来气温的平均值为11 ℃,无霜期平均每年可达180 d,降水量的平均值为700 mm,降雨每年集中在7—9月. 2022年全县耕地总面积38.98万亩. 江洛镇境内已探明地下矿藏有铅、锌、硫、铁、金、煤等矿产资源,特别是铅、锌矿储量较大[15]. 该尾矿库为山谷型,采用湿式排放方式,尾矿库现状总坝高26 m,初期坝坝高为15 m,堆积坝坝高11 m,库内堆存尾砂量约为23万m3. 该尾矿库未填埋,在工矿生产和矿渣储存过程中,土壤中的粉尘会在大气中沉积,受降雨和径流的影响,对矿区周围环境造成了严重影响,从而可能会引发一系列的生态环境安全问题.1.2 样品的采集与处理
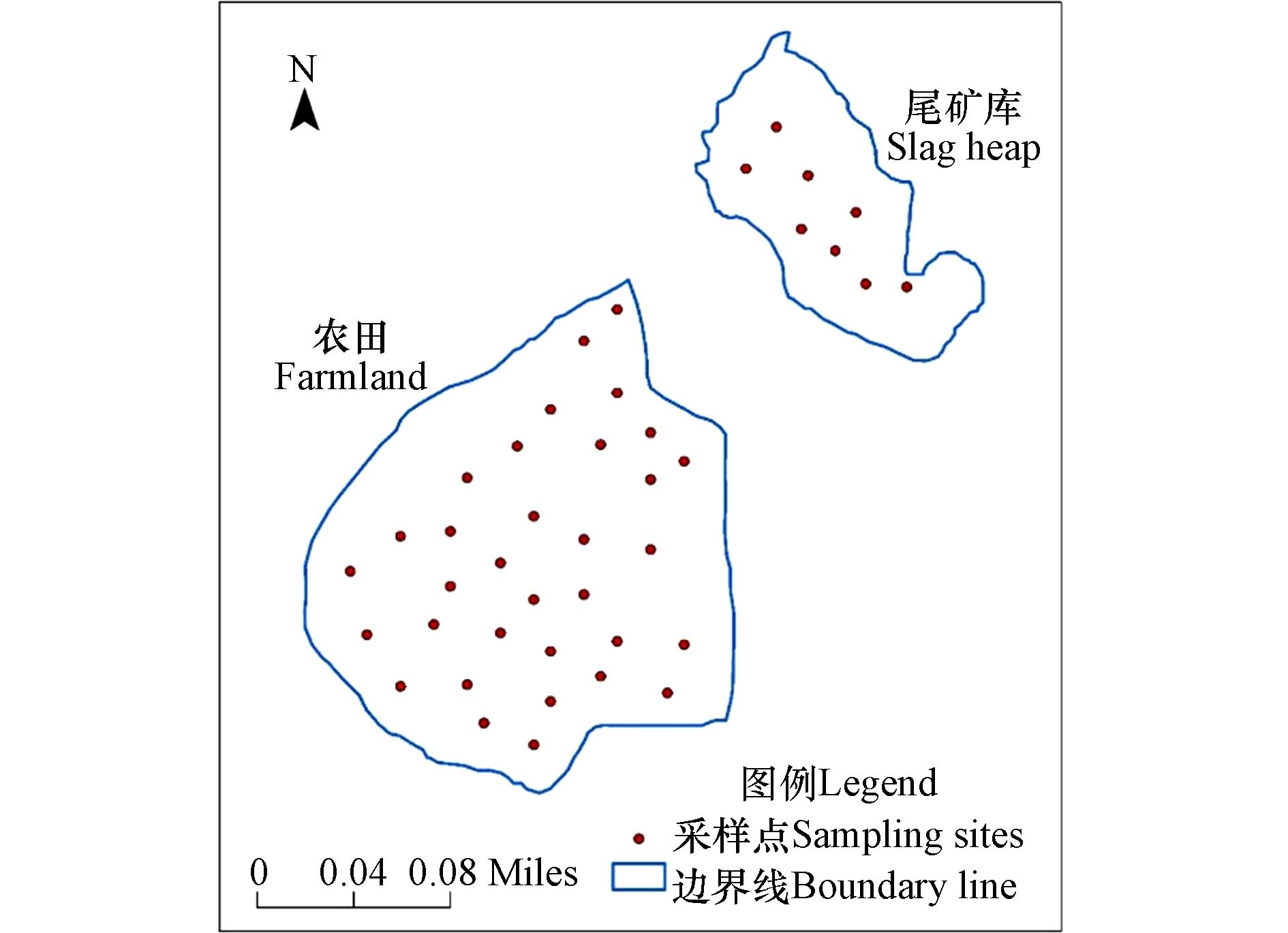
本文于2023年8月在甘肃省陇南市某铅锌尾矿库及其周边农田(北纬33°53'27''—33°53'43''、东经105°48'27''—105°48'41'')进行样品采集. 采用了简单随机布点法并结合专业判断法来布点. 为确保采样点布局的科学性与均匀性,本研究充分借助了地理信息系统的空间分析能力,结合网格化精密的划分手段,对整个研究区域进行布局(采样面积约为3.22 km2)[1]. 采样时用GPS定位采样点经纬度,并根据样点采集顺序对其编号,在现场共布置了41个采样点,其中尾矿库8个,周边农田33个,如图1所示. 在每个采样点采集表层土壤(0—20 cm),样品放在密封袋里保存. 采集的样品经自然风干、去除杂物、研磨和筛分后,一份用于测定土壤pH,一份用于测定土壤重金属含量. 采用电感耦合等离子体质谱仪(ICP-MS,NexION 2000)测定经盐酸-硝酸-氢氟酸-高氯酸微波消解(CEM MARS6)后样品中的镉(Cd)、铬(Cr)、铜(Cu)、镍(Ni)、铅(Pb) 和锌(Zn) 含量,其检出限分别为0.03、2.00、0.70、2.00、1.00 mg·kg−1和5.00 mg·kg−1;采用原子荧光光度计(AFS-930d)测定经硝酸-盐酸消解后样品中的砷(As)和汞( Hg)含量,其检出限分别为0.20 mg·kg−1和0.002 mg·kg−1. 样品测试环节均进行空白实验与平行样测定,结果精密度符合实验允许误差要求,同时用国家标准土样予以质量管控,所测元素的加标回收率为95%—106%,分析误差为±5%.
1.3 评价标准
由于农田研究区土壤pH值范围为6.00—8.18,平均值为7.85,中位数为7.75,其中pH > 7.5占比达93.94%,且变异系数小于0.1. 故选用《土壤环境质量农用地土壤污染风险管控标准》(GB15618-2018)中pH>7.5的风险筛选值(mg·kg−1)和风险管制值(mg·kg−1)分别作为农田土壤的一级和二级评价标准. 《土壤环境质量建设用地土壤污染风险管控标准》(GB36600-2018)中第二类用地的风险筛选值(mg·kg−1)和风险管制值(mg·kg−1)分别作为尾矿库土壤的一级和二级评价标准,如表1所示.
表 1 土壤环境质量评价标准Table 1. Soil environmental quality evaluation criteria指标Index 风险筛选值Risk filter value 风险管制值Risk control value 尾矿库(第二类用地) 农田(pH>7.5) 尾矿库(第二类用地) 农田(pH>7.5) Cu 18000 100 36000 − Cr − 250 − 1300 Ni 900 190 2000 − Zn − 300 − − As 60 25 140 100 Cd 65 0.60 172 4.0 Pb 800 170 2500 1000 Hg 38 3.40 82 6.0 注:“−”表示无此项,下同. Note: "−" means that there is no such item, the same below. 1.4 污染负荷指数法
污染负荷指数法在土壤重金属污染水平评估中应用广泛,既能考量单个样点污染状况,又可评定多重金属污染区域状况[16]. 污染负荷指数法的计算如下式(1–3):
stringUtils.convertMath(!{formula.content}) (1) stringUtils.convertMath(!{formula.content}) (2) stringUtils.convertMath(!{formula.content}) (3) 式中,
CFi Ci Bi PLIzone 表 2 污染负荷指数分级标准Table 2. Classification standard of the pollution load indexCF PLI 等级Level 污染程度Contamination degrees CF<1 PLI<1 0 无污染 1≤CF<3 1≤PLI<3 1 轻度污染 3≤CF<6 3≤PLI<6 2 中度污染 6≤CF 6≤PLI 3 重度污染 1.5 PMF源解析
PMF模型是将重金属含量矩阵分解为因子得分矩阵、因子载荷矩阵和残差矩阵[19]. 见式(4–7):
stringUtils.convertMath(!{formula.content}) (4) 式中,
Xij Gjk Fki Eij stringUtils.convertMath(!{formula.content}) (5) 式中,
Uij Uij stringUtils.convertMath(!{formula.content}) (6) 当土壤重金属含量高于MDL时,则由式(6)计算得出:
stringUtils.convertMath(!{formula.content}) (7) 式中,
c δ 1.6 基于源导向的土壤重金属生态风险评估
本研究将PMF模型与综合生态风险评价指数法(Nemerow integrated risk index,NIRI)有机结合,来量化各污染源对生态风险的贡献[20]. 具体计算公式如下(8–12):
stringUtils.convertMath(!{formula.content}) (8) 式中,
Ck∗ij Ci stringUtils.convertMath(!{formula.content}) (9) stringUtils.convertMath(!{formula.content}) (10) 式中,
ERkij Bi Eir Tir stringUtils.convertMath(!{formula.content}) (11) stringUtils.convertMath(!{formula.content}) (12) 式中,
EIRIkij NIRIij ERkijmax Eirmax ERkijave Eirave Eir NIRI 表 3 生态风险指数分级标准Table 3. Ecological risk index classification criteriaEir 生态风险等级Ecological risk level NIRI 生态风险等级Ecological risk level Eir 轻微 NIRI<40 轻微 40≤ Eir 中等 40≤NIRI<80 中等 80≤ Eir 强 80≤NIRI<160 强 160≤ Eir 很强 160≤NIRI<320 很强 Eir 极强 NIRI≥320 极强 1.7 基于源导向的土壤重金属健康风险评估
采用美国环保署(USEPA)推荐的健康风险评估模型,量化土壤重金属对人体健康造成的风险[23]. 土壤重金属健康风险评估模型中暴露参数和不同暴露途径的参考剂量(RfD)和致癌斜率因子(SF)值参照中国生态环境部发布的HJ 25.3-2019中的风险评估模型参数推荐值和美国环保署发布的相关参数[24 − 26]. 对于致癌风险,致癌风险值低于10−6时,表示对人体健康风险不显著,视为风险可以忽略不计;致癌风险值为10−6—10−4时,表示对人体健康有风险;致癌风险值大于10−4时,表示有显著风险,认为风险是不可接受的[27]. 基于源导向的土壤重金属风险评估是先根据PMF模型得到不同源的贡献率,并结合研究区健康风险评估结果,计算不同源对人体健康风险的贡献率[28],具体计算公式如下(13–16):
stringUtils.convertMath(!{formula.content}) (13) stringUtils.convertMath(!{formula.content}) (14) stringUtils.convertMath(!{formula.content}) (15) stringUtils.convertMath(!{formula.content}) (16) 式中,
HQj Fij HQi Dj,HQ CRj CRi Dj,CR 1.8 数据处理与分析
研究数据处理采用SPSS 27和EXCEL,进行描述性统计分析,利用EPA PMF 5.0软件进行溯源解析,使用Origin 2024和ArcGIS软件处理数据并绘制图形.
2. 结果与讨论(Results and discussion)
2.1 土壤重金属污染评价
土壤中As、Cd、Cr、Cu、Ni、Pb、Zn和Hg元素含量描述性统计结果如表4所示,研究区尾矿库土壤中As、Cd、Cr、Cu、Ni、Pb、Zn和Hg含量范围分别为21.64—43.69、0.25—1.04、11.23—16.95、26.07—51.85、7.13—14.61、653.99—925.67、412.96—603.57 mg·kg−1和7.65—9.45 mg·kg−1,其中只有Pb有50.00%的样点超出一级标准. 研究区农田土壤中As、Cd、Cr、Cu、Ni、Pb、Zn和Hg的含量范围分别为10.20—26.85、1.35—3.30、68.76—134.98、12.64—23.60、11.44—29.20、39.12—92.61、66.65—139.35 mg·kg−1和2.48—4.33 mg·kg−1. 根据评价标准(表1),农田土壤中Cd所有样点的含量均超过一级标准,As有3.03%的样点超过了一级标准,Hg有39.39%的样点超过了一级标准,Cr、Cu、Ni、Pb和Zn含量均未超过一级标准. 尾矿库和农田土壤中所有重金属含量均未超过二级标准. 污染负荷指数法结果(图2)表明,农田土壤中8种重金属的
CFi PLI — CFi PLI 1000 万亩[29],农业活动频繁,结合PMF的结果,说明这2种重金属污染与农业活动和成土母质有关. 这与李多杰等[30]对内蒙古兴安盟某铅锌矿的研究结果相似,矿区周围的土壤受到明显的Zn和Pb污染,而铅锌矿周边土壤中的Cd和Cr污染归因于成土母岩风化和人为活动的共同作用.表 4 土壤重金属含量描述性统计分析Table 4. Descriptive statistical analysis of soil heavy metal content项目Item 采样地Sampling site 最小值/( mg·kg−1)Minimum 最大值/( mg·kg−1)Maximum 平均值/( mg·kg−1)Average value 标准差Standard deviation 变异系数Standard deviation 超标率Excess ratio 以一级标准为评价标准 以二级标准为评价标准 As 尾矿库 21.64 43.69 32.04 7.26 22.66% 0% 0% 农田 10.20 26.85 16.04 2.86 17.83% 3.03% 0% Cd 尾矿库 0.25 1.04 0.67 0.25 37.31% 0% 0% 农田 1.35 3.30 2.25 0.41 18.22% 100% 0% Cr 尾矿库 11.23 16.95 14.57 2.38 16.33% − − 农田 68.76 134.98 98.66 18.37 18.62% 0% 0% Cu 尾矿库 26.07 51.85 43.70 10.23 23.41% 0% 0% 农田 12.64 23.60 18.17 1.98 10.89% 0% − Ni 尾矿库 7.13 14.61 10.19 2.48 24.34% 0% 0% 农田 11.44 29.20 20.04 4.61 23.01% 0% − Pb 尾矿库 653.99 925.67 795.70 101.05 12.70% 50% 0% 农田 39.12 92.61 56.68 12.93 22.81% 0% 0% Zn 尾矿库 412.96 603.57 508.20 60.45 11.89% − − 农田 66.65 139.35 90.25 17.36 19.23% 0% − Hg 尾矿库 7.65 9.45 8.28 0.60 7.24% 0% 0% 农田 2.48 4.33 3.37 0.50 14.84% 39.39% 0% pH 尾矿库 8.26 8.58 8.42 0.16 1.90% − − 农田 6.00 8.18 7.85 0.75 9.59% − − 变异系数(coefficient of variance,CV)是一种反映重金属元素含量空间分布离散程度的指标[31],根据CV值的大小,可分为低度变异(CV<0.1)、中度变异(0.1≤CV<0.36)、高度变异(0.36≤CV<1)和极度变异(CV>1)[32]. 由表4可知,尾矿库研究区域土壤中Cd属于高度变异;As、Cu、Ni、Cr、Pb和Zn属于中度变异;Hg属于低度变异. 农田研究区域表层土壤中重金属的变异系数均在0.1—0.36之间,均属于中度变异. 因此,研究区域土壤中重金属含量的空间分布差异显著,地理环境和人类活动对其影响较大.
2.2 农田土壤重金属污染源解析
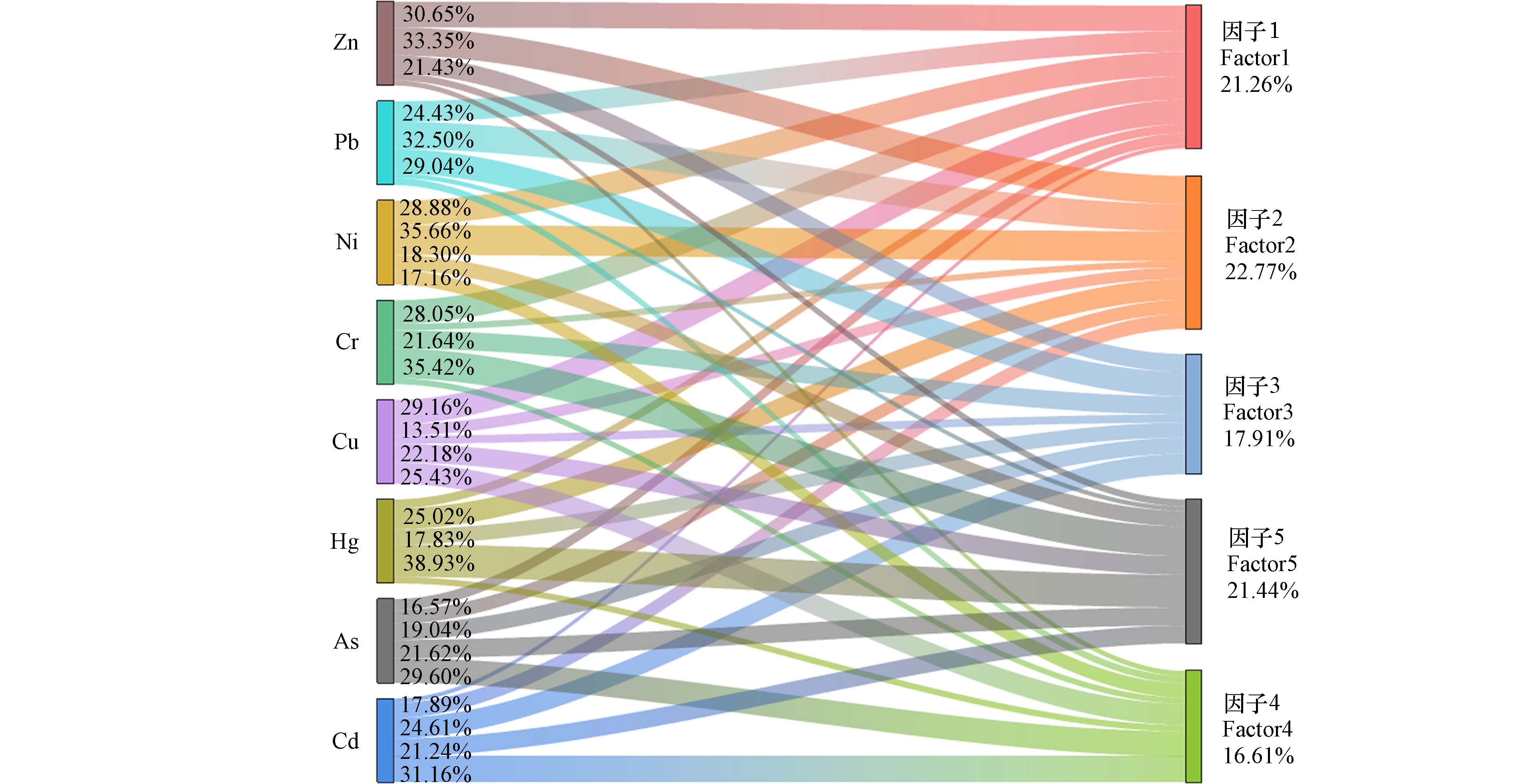
本研究设定4至7个因子数量,经多番运行调试,最终选定5个因子,获取了较低的Q值 42.43,此时实测值与预测值拟合效果最好,且多数残差处于−3—3区间. 8 种元素的R2系数为0.545—0.951,表明PMF的整体拟合效果较好,能够很好地满足研究需求,并解释了原始数据中包含的信息. PMF模型的解析结果如图3所示,5个污染源的占比分别为 21.26%、22.77%、17.91%、16.61%和 21.44%.
由图3可知,因子1主要载荷元素包括Cr、Cu、Ni、Pb和Zn,其贡献率分别为28.05%、29.16%、28.88%、24.43%和30.65%. 据报道,Ni和Cr含量的变化与成土母质、成土过程和地质活动密切相关[33]. 农田土壤中Cr、Cu和Ni均未超过一级评价标准,且含量较低,这表明Cr、Cu和Ni主要是受成土母质的影响,属于自然源. 而农田土壤中Pb和Zn的含量较高,且有研究表明铅锌矿影响区土壤中Pb、 Zn和Cu主要来自于矿山开采活动[34],故污染主要来源于周边的铅锌尾矿库. 故因子1是由自然源和尾矿库源的混合源.
因子2主要载荷元素包括Ni、Pb、Zn和Hg,其贡献率分别为35.66%、32.50%、33.35%和25.02%,变异系数分别为0.23、0.23、0.19和0.15,均属于中度变异,受人类活动影响较大. 有研究表明,铅锌矿区在开采和冶炼活动中所产生的三废中含有大量的Zn、Pb、Cd、As和Hg等元素[7],排放后通过大气降尘进入周围土壤,导致土壤污染. 经调查,农田研究区右侧是废弃工厂,工矿活动及矿渣堆存期间的扬尘会通过大气沉降在土壤中积累,受降雨等影响导致Ni、Pb、Zn和Hg的二次富集. 故因子2是工业降尘源.
因子3 主要载荷元素包括Pb、Cd、Zn和Cr,其贡献率分别为29.04%、24.61%、21.43%和21.64%. 汽车发动机、镀锌构件及轮胎等因机械摩擦、化学侵蚀引发的磨损与腐蚀,以及燃油燃烧或泄露和尾气排放等交通活动,都会将Cd、Pb和Zn元素释放到周边环境中[35,36]. 由因子1可知,Cr含量变化与成土过程显著相关,但研究区Cr的超标率96.97%,表明受到了人类活动的影响. 研究发现Cr还与金属零件和镀铬配件磨损有关[37]. 考虑研究区农田周围有交通运输道路及汽修厂,故因子3是交通源.
因子4主要载荷元素包括As、Cd 和Cu,其贡献率分别为29.60%、31.16%和25.43%,变异系数分别0.18、0.18和0.11,属于中度变异,受人类活动影响较大. 除草剂和杀虫剂的大量使用会造成As的大量积累,磷肥中含有的微量As也是土壤As的重要来源之一[38]. 农家肥中含有较多的Cu、Cd元素,农药、化肥长期投入到农用地中会导致重金属Cu、Cd元素的大量积累[39]. 故因子4是农业源.
因子5主要载荷元素包括As、Cd、Cr、Cu、Ni和Hg,其贡献率分别为21.62%、21.24%、35.42%、22.18%、18.30%和38.93%. Cd污染的主要来源包括汽油燃烧、农药和化肥、垃圾堆积、铅锌矿开采和冶炼等[40]. Cr、Cu、Ni主要受成土母质的影响,同时也有研究表明,农业投入品 (化肥、农药、有机肥等)中含有的Hg、As、Cu、Zn、Cd、Cr等元素易残留在土壤中,如磷肥中Cr含量在几十到几百mg·kg−1[8],As含量在20到50 mg·kg−1,施用不合理时,土壤中Cr、As这类元素含量会升高[39, 41]. 长期的尾矿库堆存、物料转运及加工等人为活动也会向周围环境释放Cd、Hg、As等元素[42],故因子5是由多种类型的活动组成的综合源.
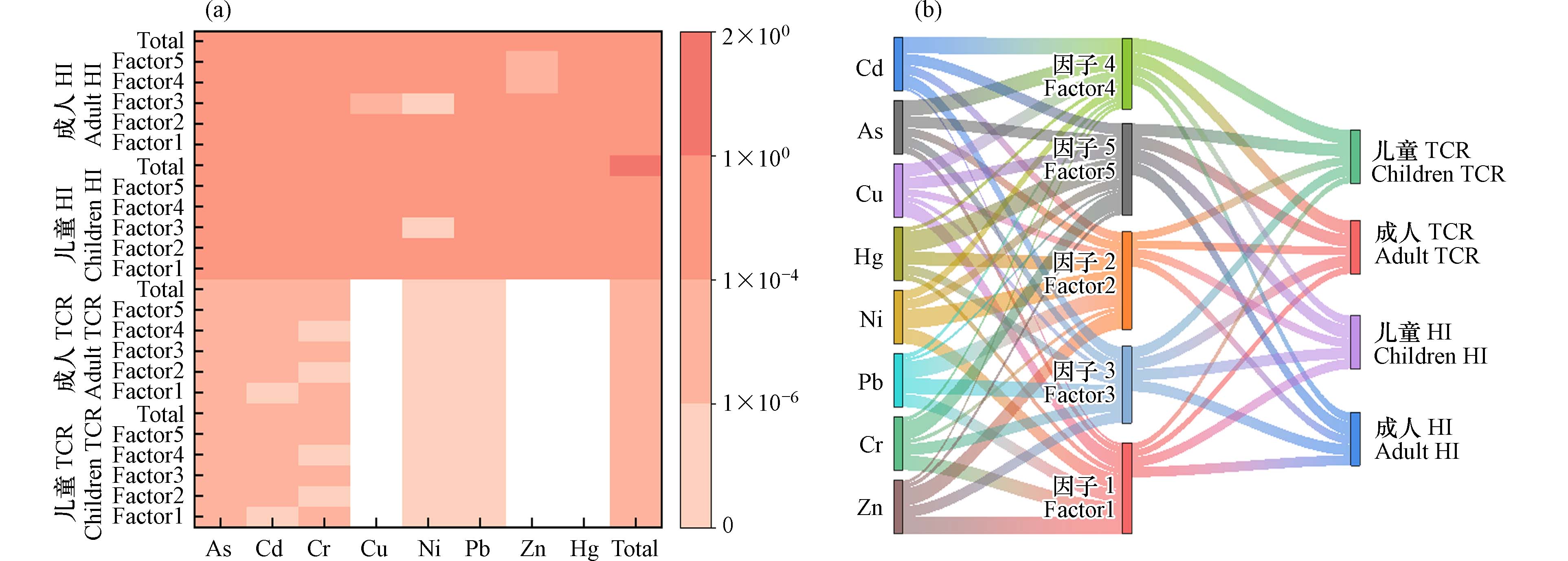
2.3 农田土壤重金属特定源-综合生态风险评估
研究区农田土壤中重金属的
Eir NIRI Eir 2243.04 )>Cd(582.06)>Pb(15.08)>As(12.73)>Cu(3.77)>Ni(2.85)>Cr(2.82)>Zn(1.30). 除了属于极强生态风险的Hg和Cd元素之外,其余元素均属于轻微生态风险,说明造成研究区生态风险的首要污染元素为Hg和Cd. 这与陈希瑶等[43]人研究中国土壤重金属的生态风险结果一致,对土壤造成生态风险的主要元素是Hg和Cd. 此外,研究区农田土壤重金属的综合生态风险指数(NIRI 1673.76 —2921.86 ,平均值为2271.48 ,属于极强生态风险.表 5 农田土壤重金属潜在生态危害系数(Eir Table 5. Evaluation results of potential ecological hazard coefficients (Eir As Cd Cr Cu Ni Pb Zn Hg Eir 8.10 348.44 1.96 2.62 1.62 10.40 0.96 1651.74 Eir 21.31 853.45 3.86 4.90 4.15 24.63 2.01 2883.33 Eir 12.73 582.06 2.82 3.77 2.85 15.08 1.30 2243.04 NIRI 1673.76 — 2921.86 研究区特定源-综合生态风险的评价结果如图4所示,按其贡献率的高低对5 种污染源进行排序:因子5(综合源)(38.37%)> 因子2(工业降尘源)(24.67%)> 因子3(交通源)(17.62%)> 因子1(自然源和尾矿库源的混合源)(10.47%)> 因子4(农业源)(8.86%),表明综合源对农田研究区影响的贡献率最大. 由于Hg元素自身毒性很高,且在研究区土壤中,Hg为首要的生态危害元素,在因子5中贡献率达到了38.93%,导致因子5是对综合生态风险贡献最高的污染源. 本研究中对综合生态风险贡献最高的污染源与以工业降尘源为主要污染源的PMF源解析结果不一致. 这与李军等[21]对敦煌市主城区的土壤重金属的研究结果一致,Hg元素负荷高的工业降尘源虽然不是重金属的最高贡献源,但却是综合生态风险的最高贡献源. 这表明重金属贡献率高的污染源并不一定具有高生态风险.
2.4 农田土壤重金属特定源-人体健康风险评估
图5a 显示了针对特定来源的人体健康风险评估模型的结果. 对于非致癌风险,不同污染源对儿童总
HI HI HI HI HI TCR TCR 对于研究区农田土壤重金属、污染源与健康风险关系如图5b所示,就致癌风险而言,因子4(农业源)是导致成人和儿童致癌风险的首要污染源,贡献率分别为25.87%和26.92%. 其次是因子5(综合源),对成人的贡献率是23.77%,对儿童的贡献率是23.12%,污染因子以As为主,对成人的贡献率是51.79%,对儿童的贡献率是54.70%;对于非致癌风险而言,污染源贡献率的排列顺序:因子5(综合源)> 因子3(交通源)> 因子1(自然源和尾矿库源的混合源)> 因子4(农业源)> 因子2(工业降尘源). 因子5(综合源)是导致儿童非致癌风险的首要污染源,贡献率为25.17%,最主要的污染因子也是As元素,贡献率为43.57%. 这可能与As元素本身毒性有关,其有较低的RfD和较高的SF [46]. 这一结果不仅与杨杰等[47]研究鄂西某铜铅锌尾矿库周边农田土壤重金属风险评估的结果一致,还与张丽瑞等[48]研究甘肃省农田土壤潜在有毒元素污染的典型区域白阴市东大沟的健康风险评价结果一致,As元素是造成当地人群致癌风险影响的主要因子. 考虑到农业源和多种类型活动共同作用的综合源是造成研究区人体健康风险的主要因子,因而工业和农业等人类活动排放的重金属对人体存在健康风险,未来可通过提升工业废物排放标准,建立合适的管控机制以及减少农药和化肥用量等途径减少污染物进入环境的量,从而减少重金属对人体的危害 [45].
3. 结论(Conclusion)
1)研究区尾矿库和农田土壤中重金属含量均低于国家风险管制值,但尾矿库土壤中Pb有50.00%的样点超出国家风险筛选值,农田土壤中Cd、As和Hg分别有100%、3.03%和39.39%的样点超出国家风险筛选值. 总体而言,尾矿库土壤中重金属的污染程度较农田土壤明显偏高,其中尾矿库土壤以Hg、Pb、Zn和Cd污染为主,整体上属于中度污染水平,占比为100%;农田土壤以Hg和Cd污染为主,整体上属于轻度污染水平,占比为93.94%.
2)研究区农田土壤重金属分别受自然源及尾矿库源的混合源(贡献率为21.26%)、工业降尘源(贡献率为22.77%)、交通源(贡献率为17.91%)、农业源(贡献率为16.61%)和由多种类型活动组成的综合源(贡献率为 21.44%)的共同影响.
3)综合源对研究区生态风险贡献率为38.37%,为优先控制污染源,Hg为生态风险优先控制污染元素;农田重金属对成人不构成非致癌健康风险,但综合源是引起当地儿童非致癌风险的优先控制污染源,贡献率为25.17%,农业源是引起当地成人和儿童致癌风险的优先控制污染源,贡献率分别为25.87%和26.92%,健康风险的优先控制污染元素均为As.
-
表 1 CA固定化方法优缺点
Table 1. Advantages and disadvantages of CA immobilization methods
表 2 CA在二氧化碳捕集中的矿化性能
Table 2. Mineralization performance of CA in carbon dioxide capture
碳酸酐酶种类Types of carbonic anhydrase 矿化特性Mineralization properties CaCO3晶相CaCO3 crystal phase 参考文献Reference 牛CA(bCA) 固定化细胞比游离细胞的CaCO3产量增加了1.35倍;固定化细胞和游离细胞的CaCO3 相对产量在10个循环后分别为53.46%和22.15% 球霰石和方解石 [35] bCA 17 μg固定化CA产生12 mg CaCO3 方解石 [29] CA CA@ZIF-8获得的CaCO3的产量是游离 CA的22倍 球霰石 [40] 硫化氢碳酸酐酶(SazCA) 固定化CA转化CO2形成碳酸钙的时间比游离CA缩短了33% 球霰石和方解石 [19] SazCA 工程菌株矿化CO2产生的CaCO3质量(241 mg)高于细胞内表达菌株(173 mg) — [38] 周质水生弧菌CA(hmCA) 固定化CA将填充床反应器中的CO2捕集速率提高了80% — [36] CA PVA/CS@CANF膜转化CO2产生的CaCO3 量是游离CA的9倍 — [22] bCA 添加EPC的系统与含有25 mmol·L−1 NaHCO3和不含碳源的对照相比,分别使微藻生长加速了134%和231% — [32] bCA 与(22.7±0.5)mg·L−1·d−1的自然生长速率相比,游离CA和CA-GA珠粒分别将微球藻的生长速率提高到(37±3)mg·L−1·d−1和(40±1)mg·L−1·d−1 — [34] Sulfurihydrogenibium yellowstonense CA(SyCA) 固定化粗CA的CaCO3总产量是游离CA的5.8倍 — [11] CA 固定化CA产生的CaCO3质量是空白实验的5倍 — [31] bCA CA@ZIF-8和PVA/CS/CA@ZIF-8水凝胶膜获得的CaCO3产量分别为游离CA的20倍和32.6倍. 球霰石和方解石 [41] Mesorhizobium loti CA(MICA) 具有固定化全细胞生物催化剂的系统可在3.5 min内有效地将CO2100%转化为CaCO3 — [39] 表 3 CA在二氧化碳吸收中的催化性能
Table 3. Catalytic performance of CA in carbon dioxide absorption
吸收剂成分Absorbent ingredients 温度Temperature 催化特性Catalytic properties 参考文献References 100 mg的固定化CA(固载量为2 mg·g−1)+H2O 30 ℃ 反应进行30 min,CO2吸收量Gv=1.858×10−4 L [31] CA-m-PVDF复合膜+0.25 m·s−1 H2O 25 ℃ CA-m-PVDF复合膜CO2通量值为2.5×10−3 mol·m−2·s−1 [43] 0.05 g·L−1 CA/ZIF-L-1+20 mL 1 mol·L−1 MDEA 40 ℃ MDEA中的CO2吸收率提高了2.5倍 [44] CA/ZIF-8+MDEA 40 ℃ CO2吸收到含有不同粒径的ZIF-8的MDEA溶液中,MDEA溶液的吸收率增加到2.4倍 [45] 10 mg MNP-CA纳米凝胶+100 mL 1 mol·L−1 MDEA 30 ℃ 反应3 h后,MNP-CA纳米凝胶的CO2吸收率为不含CA时的170% [46] 0.3 kg m−3工业级碳酸酐酶(NovoCA)+2—3 mol·L−1 K2CO3(碳酸盐转化度0—40%) 25 ℃和40 ℃ 当加入的酶浓度低于0.018 kg·m−3时,Kcat/Km值介于0.50×102 L·mol−1·s−1和0.39×103 L·mol−1·s−1之间 [49] 0.2×10−2—1.5×10−2 kg NovoCA·m−3 Fe3O4纳米颗粒固定化CA+0.5 mol·L−1 Na2CO3/NaHCO3缓冲液(pH=9.6) 25 ℃和40 ℃ 固定化CA的Kcat/Km值介于4.87—8.06 L·mol−1·s−1之间 [10] 0.2×10−2—1.5×10−2 kg NovoCA·m−3 Fe3O4纳米颗粒固定化CA+10%wt K2CO3溶液(碳酸盐转化度0—40%) 25 ℃ 固定化CA的Kcat/Km值介于3.24—6.73 L·mol−1·s−1之间 [10] 嗜热细菌的全细胞固定(INPN-SspCA)+0.5 mol·L−1 Na2CO3/NaHCO3 25 ℃ INPN-SspCA的Kcat/Km值介于9.94×10−1—3.09 L·mol−1·s−1之间 [48] 2 g·L−1 CA+20% wt K2CO3 40 ℃ 与未添加CA相比,CO2总传质系数(KG)提高了约5倍 [50] 0.22 g·L−1 CA+30% wt K2CO3(pH~11—12) 50 ℃ CA的Kcat/Km值为5.3×108 L·mol−1·s−1 [52] 0.2% wt CA+30% MDEA/15% K2CO3 17—50 ℃ 添加CA显著增加了MDEA和K2CO3的液侧传质膜系数 [17] 0.2% wt CA+30% wt MEA + 7.5% wt PZ+15% wt K2CO3 30 ℃ 含有CA/Zn-Im: HFS的混合溶剂(21.65% wt)在20 min内CO2的吸收量高于纯混合溶剂(13.75% wt) [51] 0.2% wt CA+30% wt MEA +7.5% wt PZ+15% wt K2CO3 90 ℃ 含有CA/Zn-Im: HFS的混合溶剂比纯混合溶剂的CO2相对解吸率高1.57倍. [51] -
[1] SUPURAN C T. Structure and function of carbonic anhydrases [J]. The Biochemical Journal, 2016, 473(14): 2023-2032. doi: 10.1042/BCJ20160115 [2] WEST D. Structural modification of human Carbonic anhydrase II (HCAII) and its impact on catalysis[D]. University of Florida, 2012 [3] ALVIZO O, NGUYEN L J, SAVILE C K, et al. Directed evolution of an ultrastable carbonic anhydrase for highly efficient carbon capture from flue gas [J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(46): 16436-16441. doi: 10.1073/pnas.1411461111 [4] LEE C H, JANG E K, YEON Y J, et al. Stabilization of Bovine carbonic anhydrase II through rational site-specific immobilization [J]. Biochemical Engineering Journal, 2018, 138: 29-36. doi: 10.1016/j.bej.2018.06.019 [5] CUI J D, JIA S R. Optimization protocols and improved strategies of cross-linked enzyme aggregates technology: Current development and future challenges [J]. Critical Reviews in Biotechnology, 2015, 35(1): 15-28. doi: 10.3109/07388551.2013.795516 [6] MOLINA-FERNÁNDEZ C, LUIS P. Immobilization of carbonic anhydrase for CO2 capture and its industrial implementation: A review [J]. Journal of CO2 Utilization, 2021, 47: 101475. doi: 10.1016/j.jcou.2021.101475 [7] REN S Z, CHEN R X, WU Z F, et al. Enzymatic characteristics of immobilized carbonic anhydrase and its applications in CO2 conversion [J]. Colloids and Surfaces B:Biointerfaces, 2021, 204: 111779. doi: 10.1016/j.colsurfb.2021.111779 [8] 梁珊, 宗敏华, 娄文勇. 酶法催化二氧化碳制备高附加值化学品研究进展 [J]. 化学学报, 2019, 77(11): 1099-1114. doi: 10.6023/A19060240 LIANG S, ZONG M H, LOU W Y. Recent advances in enzymatic catalysis for preparation of high value-added chemicals from carbon dioxide [J]. Acta Chimica Sinica, 2019, 77(11): 1099-1114(in Chinese). doi: 10.6023/A19060240
[9] OCHEDI F O, YU J L, YU H, et al. Carbon dioxide capture using liquid absorption methods: A review [J]. Environmental Chemistry Letters, 2021, 19(1): 77-109. doi: 10.1007/s10311-020-01093-8 [10] PEIRCE S, RUSSO M E, PERFETTO R, et al. Kinetic characterization of carbonic anhydrase immobilized on magnetic nanoparticles as biocatalyst for CO2 capture [J]. Biochemical Engineering Journal, 2018, 138: 1-11. doi: 10.1016/j.bej.2018.06.017 [11] EFFENDI S S W, CHIU C Y, CHANG Y K, et al. Crosslinked on novel nanofibers with thermophilic carbonic anhydrase for carbon dioxide sequestration [J]. International Journal of Biological Macromolecules, 2020, 152: 930-938. doi: 10.1016/j.ijbiomac.2019.11.234 [12] CHAFIK A, EL HASSANI K, ESSAMADI A, et al. Efficient sequestration of carbon dioxide into calcium carbonate using a novel carbonic anhydrase purified from liver of camel (Camelus dromedarius) [J]. Journal of CO2 Utilization, 2020, 42: 101310. doi: 10.1016/j.jcou.2020.101310 [13] MOREL F M M, LAM P J, SAITO M A. Trace metal substitution in marine phytoplankton [J]. Annual Review of Earth and Planetary Sciences, 2020, 48: 491-517. doi: 10.1146/annurev-earth-053018-060108 [14] JENSEN E L, MABERLY S C, GONTERO B. Insights on the functions and ecophysiological relevance of the diverse carbonic anhydrases in microalgae [J]. International Journal of Molecular Sciences, 2020, 21(8): 2922. doi: 10.3390/ijms21082922 [15] BOSE H, SATYANARAYANA T. Utility of thermo-alkali-stable γ-CA from polyextremophilic bacterium Aeribacillus pallidus TSHB1 in biomimetic sequestration of CO2 and as a virtual peroxidase [J]. Environmental Science and Pollution Research International, 2017, 24(11): 10869-10884. doi: 10.1007/s11356-017-8739-5 [16] GÜZEL-AKDEMIR Ö, CARRADORI S, GRANDE R, et al. Development of thiazolidinones as fungal carbonic anhydrase inhibitors [J]. International Journal of Molecular Sciences, 2020, 21(8): 2960. doi: 10.3390/ijms21082960 [17] GLADIS A, GUNDERSEN M T, FOSBØL P L, et al. Influence of temperature and solvent concentration on the kinetics of the enzyme carbonic anhydrase in carbon capture technology [J]. Chemical Engineering Journal, 2017, 309: 772-786. doi: 10.1016/j.cej.2016.10.056 [18] HOU J, LI X K, KACZMAREK M B, et al. Accelerated CO2 hydration with thermostable Sulfurihydrogenibium azorense carbonic anhydrase-chitin binding domain fusion protein immobilised on chitin support [J]. International Journal of Molecular Sciences, 2019, 20(6): 1494. doi: 10.3390/ijms20061494 [19] HSIEH C J, CHENG J C, HU C J, et al. Entrapment of the fastest known carbonic anhydrase with biomimetic silica and its application for CO2 sequestration [J]. Polymers, 2021, 13(15): 2452. doi: 10.3390/polym13152452 [20] 温欢. 碳酸酐酶杂化纳米花及其PVA/CS凝胶酶膜在CO2转化中应用的基础研究[D]. 天津: 天津科技大学, 2020. WEN H. Basic research on the application of carbonic anhydrase hybrid nanoflower and its PVA/CS hydrogels enzyme membrane in CO2 conversion[D]. Tianjin: Tianjin University of Science & Technology, 2020(in Chinese).
[21] WU Z H, NAN Y, ZHAO Y, et al. Immobilization of carbonic anhydrase for facilitated CO2 capture and separation [J]. Chinese Journal of Chemical Engineering, 2020, 28(11): 2817-2831. doi: 10.1016/j.cjche.2020.06.002 [22] WEN H, ZHANG L, DU Y J, et al. Bimetal based inorganic-carbonic anhydrase hybrid hydrogel membrane for CO2 capture [J]. Journal of CO2 Utilization, 2020, 39: 101171. doi: 10.1016/j.jcou.2020.101171 [23] REN S Z, JIANG S H, YAN X Y, et al. Challenges and opportunities: Porous supports in carbonic anhydrase immobilization [J]. Journal of CO2 Utilization, 2020, 42: 101305. doi: 10.1016/j.jcou.2020.101305 [24] YING Q, CHEN H, SHAO P J, et al. Core-shell magnetic ZIF-8@Fe3O4-carbonic anhydrase biocatalyst for promoting CO2 absorption into MDEA solution [J]. Journal of CO2 Utilization, 2021, 49: 101565. doi: 10.1016/j.jcou.2021.101565 [25] PEIRCE S, RUSSO M E, ISTICATO R, et al. Structure and activity of magnetic cross-linked enzyme aggregates of bovine carbonic anhydrase as promoters of enzymatic CO2 capture [J]. Biochemical Engineering Journal, 2017, 127: 188-195. doi: 10.1016/j.bej.2017.08.014 [26] 冯慧, 韩娟, 黄文睿, 等. 纳米花型酶-无机杂化固定化酶研究进展 [J]. 化学通报, 2021, 84(12): 1263-1273. doi: 10.14159/j.cnki.0441-3776.2021.12.004 FENG H, HAN J, HUANG W R, et al. Research progress in nanoflower enzyme-inorganic hybrid immobilized enzyme [J]. Chemistry, 2021, 84(12): 1263-1273(in Chinese). doi: 10.14159/j.cnki.0441-3776.2021.12.004
[27] SHAO P J, CHEN H, YING Q, et al. Structure-activity relationship of carbonic anhydrase enzyme immobilized on various silica-based mesoporous molecular sieves for CO2 absorption into a potassium carbonate solution [J]. Energy & Fuels, 2020, 34(2): 2089-2096. [28] ZHANG S H, LU Y Q, YE X H. Catalytic behavior of carbonic anhydrase enzyme immobilized onto nonporous silica nanoparticles for enhancing CO2 absorption into a carbonate solution [J]. International Journal of Greenhouse Gas Control, 2013, 13: 17-25. doi: 10.1016/j.ijggc.2012.12.010 [29] SHAMNA I, KWAN JEONG S, MARGANDAN B. Covalent immobilization of carbonic anhydrase on amine functionalized alumino-siloxane aerogel beads for biomimetic sequestration of CO2 [J]. Journal of Industrial and Engineering Chemistry, 2021, 100: 288-295. doi: 10.1016/j.jiec.2021.05.010 [30] SUN J, WANG C H, WANG Y Z, et al. Immobilization of carbonic anhydrase on polyethylenimine/dopamine codeposited membranes [J]. Journal of Applied Polymer Science, 2019, 136(29): 47784. doi: 10.1002/app.47784 [31] CHANG S, HE Y, LI Y X, et al. Study on the immobilization of carbonic anhydrases on geopolymer microspheres for CO2 capture [J]. Journal of Cleaner Production, 2021, 316: 128163. doi: 10.1016/j.jclepro.2021.128163 [32] JUN S H, YANG J S, JEON H, et al. Stabilized and immobilized carbonic anhydrase on electrospun nanofibers for enzymatic CO2 conversion and utilization in expedited microalgal growth [J]. Environmental Science & Technology, 2020, 54(2): 1223-1231. [33] GE J, LEI J D, ZARE R N. Protein–inorganic hybrid nanoflowers [J]. Nature Nanotechnology, 2012, 7(7): 428-432. doi: 10.1038/nnano.2012.80 [34] XU X Y, KENTISH S E, MARTIN G J O. Direct air capture of CO2 by microalgae with buoyant beads encapsulating carbonic anhydrase [J]. ACS Sustainable Chemistry & Engineering, 2021, 9(29): 9698-9706. [35] SHARMA T, KUMAR A. Bioprocess development for efficient conversion of CO2 into calcium carbonate using keratin microparticles immobilized Corynebacterium flavescens [J]. Process Biochemistry, 2021, 100: 171-177. doi: 10.1016/j.procbio.2020.10.009 [36] MOON H, KIM S, JO B H, et al. Immobilization of genetically engineered whole-cell biocatalysts with periplasmic carbonic anhydrase in polyurethane foam for enzymatic CO2 capture and utilization [J]. Journal of CO2 Utilization, 2020, 39: 101172. doi: 10.1016/j.jcou.2020.101172 [37] 刘亚茹. 细胞表面展示碳酸酐酶及其酶学性质研究[D]. 天津: 天津大学, 2020. LIU Y R. Cell surface display of carbonic anhydrase and its enzymology properties[D]. Tianjin: Tianjin University, 2020(in Chinese).
[38] ZHU Y Z, LIU Y R, AI M M, et al. Surface display of carbonic anhydrase on Escherichia coli for CO2 capture and mineralization [J]. Synthetic and Systems Biotechnology, 2021, 7(1): 460-473. [39] TAN S I, HAN Y L, YU Y J, et al. Efficient carbon dioxide sequestration by using recombinant carbonic anhydrase [J]. Process Biochemistry, 2018, 73: 38-46. doi: 10.1016/j.procbio.2018.08.017 [40] REN S Z, FENG Y X, WEN H, et al. Immobilized carbonic anhydrase on mesoporous cruciate flower-like metal organic framework for promoting CO2 sequestration [J]. International Journal of Biological Macromolecules, 2018, 117: 189-198. doi: 10.1016/j.ijbiomac.2018.05.173 [41] REN S Z, LI C H, TAN Z L, et al. Carbonic Anhydrase@ZIF-8 hydrogel composite membrane with improved recycling and stability for efficient CO2 capture [J]. Journal of Agricultural and Food Chemistry, 2019, 67(12): 3372-3379. doi: 10.1021/acs.jafc.8b06182 [42] 于洋, 刘琦, 吕静, 等. 碳酸酐酶固定及在二氧化碳捕集应用研究进展 [J]. 洁净煤技术, 2021, 27(2): 69-78. doi: 10.13226/j.issn.1006-6772.CCUS20100903 YU Y, LIU Q, LYU J, et al. Research progress on the immobilization of carbonic anhydrase and its application in carbon dioxide capture [J]. Clean Coal Technology, 2021, 27(2): 69-78(in Chinese). doi: 10.13226/j.issn.1006-6772.CCUS20100903
[43] XU Y L, LIN Y Q, CHEW N G P, et al. Biocatalytic PVDF composite hollow fiber membranes for CO2 removal in gas-liquid membrane contactor [J]. Journal of Membrane Science, 2019, 572: 532-544. doi: 10.1016/j.memsci.2018.11.043 [44] ZHANG S H, DU M E, SHAO P J, et al. Carbonic anhydrase enzyme-MOFs composite with a superior catalytic performance to promote CO2 absorption into tertiary amine solution [J]. Environmental Science & Technology, 2018, 52(21): 12708-12716. [45] DU M E, CHEN H, YE J X, et al. One-pot synthesis of efficient carbonic anhydrase-zeolitic imidazolate framework-8 composite for enhancing CO2 absorption [J]. Journal of CO2 Utilization, 2020, 40: 101211. doi: 10.1016/j.jcou.2020.101211 [46] XU W N, WANG Z Y, CHEN G, et al. Accelerating CO2 absorption in aqueous amine solutions at high temperature with carbonic anhydrase in magnetic nanogels [J]. Catalysis Letters, 2018, 148(7): 1827-1833. doi: 10.1007/s10562-018-2401-9 [47] 费潇瑶. 碳酸酐酶的固定化及其CO2的捕集性能[D]. 大连: 大连理工大学, 2018. FEI X Y. Immobilization of carbonic anhydrase and the performance in CO2 capture[D]. Dalian: Dalian University of Technology, 2018(in Chinese).
[48] FABBRICINO S, PRETE S D, RUSSO M E, et al. In vivo immobilized carbonic anhydrase and its effect on the enhancement of CO2 absorption rate [J]. Journal of Biotechnology, 2021, 336: 41-49. doi: 10.1016/j.jbiotec.2021.06.016 [49] PEIRCE S, PERFETTO R, RUSSO M E, et al. Characterization of technical grade carbonic anhydrase as biocatalyst for CO2 capture in potassium carbonate solutions [J]. Greenhouse Gases:Science and Technology, 2018, 8(2): 279-291. doi: 10.1002/ghg.1738 [50] QI G J, LIU K, HOUSE A L, et al. Laboratory to bench-scale evaluation of an integrated CO2 capture system using a thermostable carbonic anhydrase promoted K2CO3 solvent with low temperature vacuum stripping [J]. Applied Energy, 2018, 209: 180-189. doi: 10.1016/j.apenergy.2017.10.083 [51] SAHOO P C, KUMAR M, SINGH A, et al. Accelerated CO2 capture in hybrid solvent using co-immobilized enzyme/complex on a hetero-functionalized support [J]. Journal of CO2 Utilization, 2017, 21: 77-81. doi: 10.1016/j.jcou.2017.06.019 [52] HU G P, SMITH K H, NICHOLAS N J, et al. Enzymatic carbon dioxide capture using a thermally stable carbonic anhydrase as a promoter in potassium carbonate solvents [J]. Chemical Engineering Journal, 2017, 307: 49-55. doi: 10.1016/j.cej.2016.08.064 [53] REN S Z, WANG Z Y, BILAL M, et al. Co-immobilization multienzyme nanoreactor with co-factor regeneration for conversion of CO2 [J]. International Journal of Biological Macromolecules, 2020, 155: 110-118. doi: 10.1016/j.ijbiomac.2020.03.177 [54] WANG Y Z, LI M F, ZHAO Z P, et al. Effect of carbonic anhydrase on enzymatic conversion of CO2 to formic acid and optimization of reaction conditions [J]. Journal of Molecular Catalysis B:Enzymatic, 2015, 116: 89-94. doi: 10.1016/j.molcatb.2015.03.014 [55] CHAI M, RAZAVI BAZAZ S, DAIYAN R, et al. Biocatalytic micromixer coated with enzyme-MOF thin film for CO2 conversion to formic acid [J]. Chemical Engineering Journal, 2021, 426: 130856. doi: 10.1016/j.cej.2021.130856 [56] ZHAI T T, WANG C H, GU F J, et al. Dopamine/polyethylenimine-modified silica for enzyme immobilization and strengthening of enzymatic CO2 conversion [J]. ACS Sustainable Chemistry & Engineering, 2020, 8(40): 15250-15257. [57] ZHANG X N, SHAO W X, CHEN B Q, et al. Cross-linking of carbonic anhydrase and formate dehydrogenase based on amino acid specific recognition: Conversion of carbon dioxide to formic acid [J]. Enzyme and Microbial Technology, 2021, 146: 109763. doi: 10.1016/j.enzmictec.2021.109763 [58] BENÍTEZ-MATEOS A I, SAN SEBASTIAN E, RÍOS-LOMBARDÍA N, et al. Asymmetric reduction of prochiral ketones by using self-sufficient heterogeneous biocatalysts based on NADPH-dependent ketoreductases [J]. Chemistry - A European Journal, 2017, 23(66): 16843-16852. doi: 10.1002/chem.201703475 [59] WANG J, LV Y Q. An enzyme-loaded reactor using metal-organic framework-templated polydopamine microcapsule [J]. Chinese Journal of Chemical Engineering, 2021, 29: 317-325. doi: 10.1016/j.cjche.2020.07.042 [60] LI Y, WEN L Y, TAN T W, et al. Sequential co-immobilization of enzymes in metal-organic frameworks for efficient biocatalytic conversion of adsorbed CO2 to formate [J]. Frontiers in Bioengineering and Biotechnology, 2019, 7: 394. doi: 10.3389/fbioe.2019.00394 [61] EL-ZAHAB B, DONNELLY D, WANG P. Particle-tethered NADH for production of methanol from CO2 catalyzed by coimmobilized enzymes [J]. Biotechnology and Bioengineering, 2008, 99(3): 508-514. doi: 10.1002/bit.21584 [62] JI X Y, SU Z G, WANG P, et al. Tethering of nicotinamide adenine dinucleotide inside hollow nanofibers for high-yield synthesis of methanol from carbon dioxide catalyzed by coencapsulated multienzymes [J]. ACS Nano, 2015, 9(4): 4600-4610. doi: 10.1021/acsnano.5b01278 [63] LALANDE J M, TREMBLAY A. Process and a plant for the production of Portland cement clinker. U. S. Patent 6, 908, 507[P]. 2005. [64] FRADETTE L, LEFEBVRE S, CARLEY J. Demonstration results of enzyme-accelerated CO2 capture [J]. Energy Procedia, 2017, 114: 1100-1109. doi: 10.1016/j.egypro.2017.03.1263 [65] LEIMBRINK M, LIMBERG T, KUNZE A K, et al. Different strategies for accelerated CO2 absorption in packed columns by application of the biocatalyst carbonic anhydrase [J]. Energy Procedia, 2017, 114: 781-794. doi: 10.1016/j.egypro.2017.03.1221 期刊类型引用(5)
1. 邓威,翟健梁,赖淏,陆福洋,宗有杰,熊锐,关博文,常明丰. 微生物-碳化改性钢渣及其对水泥水化特性影响研究进展. 复合材料学报. 2025(01): 119-132 .  百度学术
百度学术
2. 王鹏伟,樊恒辉,任冠洲,谢非含,张星宇,霍江茹. 碳酸酐酶对仿岩溶碳酸氢钙生成速率的影响及其作用机理. 水利与建筑工程学报. 2025(01): 118-124+199 .  百度学术
百度学术
3. 王玉杰,张艳梅,栾金义,赵之平. 酶催化固碳过程及其强化技术研究进展. 化工进展. 2024(01): 232-245 .  百度学术
百度学术
4. 谢昕,王春辉,于荣珍,徐恒,周昊,孙志明,王建兵. CO_2干式生物甲烷化试验研究. 能源环境保护. 2024(03): 109-116 .  百度学术
百度学术
5. 刘鹏,曹源兴,程钰,白云波. 碳酸酐酶增强微生物矿化固土效果的试验研究. 岩土力学. 2024(09): 2554-2564 .  百度学术
百度学术
其他类型引用(0)
-






 下载:
下载: