-
全氟化合物(PFCs)是一类人工合成的烷烃类有机化合物,其烷烃链上的氢原子全部被氟原子取代,并在烷烃链的末端带有亲水性官能团. 因此它们既具有疏水性,又具有疏油性,呈现出良好的表面活性[1]. 在生产生活的多个领域中获得了广泛应用,如食品包装袋、不粘锅厨具、洗涤剂、防油处理剂、电镀添加剂和泡沫灭火剂等[2]. PFCs的种类多达上千种,全氟辛烷羧酸(PFOA)和全氟辛烷磺酸(PFOS)是产量最大、应用最广泛、最具有代表性的PFCs,也是多种PFCs在环境中的最终转化产物[3-4]. 通过对PFCs的环境行为研究发现,它们具有环境持久性、难降解性、远距离迁移性和生物蓄积性[5-6]. 并且由于PFCs的极性和水溶性较好,其在水环境中的污染较为严重,污染分布范围非常广泛,在多种环境水体以及自来水、饮用水中均有检出,对水生态环境和人体健康造成了巨大威胁[7-8]. 由于PFOA和PFOS的广泛检出和潜在风险,2009年美国环境保护署(EPA)颁布了饮用水中PFOS和PFOA的短期健康建议值分别为200 ng·L−1和400 ng·L−1,2016年EPA将该值均修改为70 ng·L−1[9]. 2022年我国最新发布的《生活饮用水卫生标准》(GB5749-2022)中增加了对PFOA和PFOS的标准限值分别为80 ng·L−1和40 ng·L−1. 因此及时开展水环境中PFCs的污染检测非常必要,可以为环境污染预警和治理修复提供重要的技术支持.
目前,对于PFCs检测的方法主要是采用基于色谱-质谱联用的传统分析方法,包括气相色谱-质谱联用(GC-MS)[10]、液相色谱-质谱联用(LC-MS)[11]和液相色谱-串联质谱(LC-MS/MS)[12-13]方法,Trojanowicz等[14]对这些方法的研究进展已经进行了综述报道. 美国EPA颁布了3种标准分析方法用于PFCs检测,包括方法533、537和537.1[15-17]. 在这些方法中,首先采用固相萃取技术对样品进行富集浓缩,然后使用LC-MS/MS方法进行检测,检测限可以达到ng·L−1. 虽然色谱-质谱联用技术已经实现了高灵敏检测,但是需要将采集的样品运送至实验室进行多步预处理,检测周期较长,所用的仪器精密昂贵,需要专业的技术人员进行维护使用,检测成本较高,不具有现场检测的应用能力. 因此,为了提高检测效率,降低检测成本,实现批量样品的快速筛查,建立更简便、快速、经济有效的方法对PFCs进行检测是非常必要的.
近年来,电化学传感和光学传感研究获得了快速发展,通过建立电信号或光信号的变化与待测目标物浓度之间的相关性,可以实现对目标物的定性或定量检测. 与色谱-质谱方法相比,传感技术具有简便、快速、仪器成本低、易操作的优点,一些研究者致力于将其用于PFCs检测. 在电化学传感中,主要是通过对电极表面进行修饰改性,使PFCs吸附到界面处时,可以导致电位、电流、电阻等多种电信号发生改变,实现对PFCs的定量分析. 采用不同的电极材料或修饰方法,可以对电化学传感的灵敏度和稳定性产生较大影响. 在光学传感中,采用多种功能化的光学材料作为信号探针,与PFCs发生相互作用后,可以导致吸收、散射、荧光等多种光信号发生改变,实现对PFCs的识别检测. 不同的光学材料与PFCs的作用方式不同,是影响方法灵敏度和选择性的重要因素. 近年来,通过改变电极或光学探针,建立了多种电化学和光学传感方法用于对水环境中PFCs的检测研究,并取得了显著的效果. 而目前对PFCs的传感检测方法研究进展报道较少,因此本论文通过对电化学和光学传感方法的检测原理和研究进展进行综述讨论,并对PFCs的传感检测方法研究趋势和应用前景进行展望,以期望能够为PFCs的快速检测技术研究提供重要的参考.
-
电化学传感是根据目标物存在下引起的电化学信号的变化,实现对目标物的快速检测. 传统的电化学传感方法需要依赖目标物本身的氧化还原反应性质来产生可检测的电信号[18]. 而PFCs是一类电化学惰性物质,不能直接检测,因此一些研究者将分子印迹技术和电化学传感结合,建立了可对PFOS或PFOA进行选择性检测的多种电化学传感方法[19-23]. 分子印迹技术是通过模拟酶-底物或抗原-抗体之间的相互作用,使制备的分子印迹聚合物(MIP)可以对印迹分子(即模板分子)产生专一性识别,提高检测的选择性[24]. 目前,建立的电化学传感方法主要包括伏安、电位、阻抗、光电化学和电化学发光传感.
-
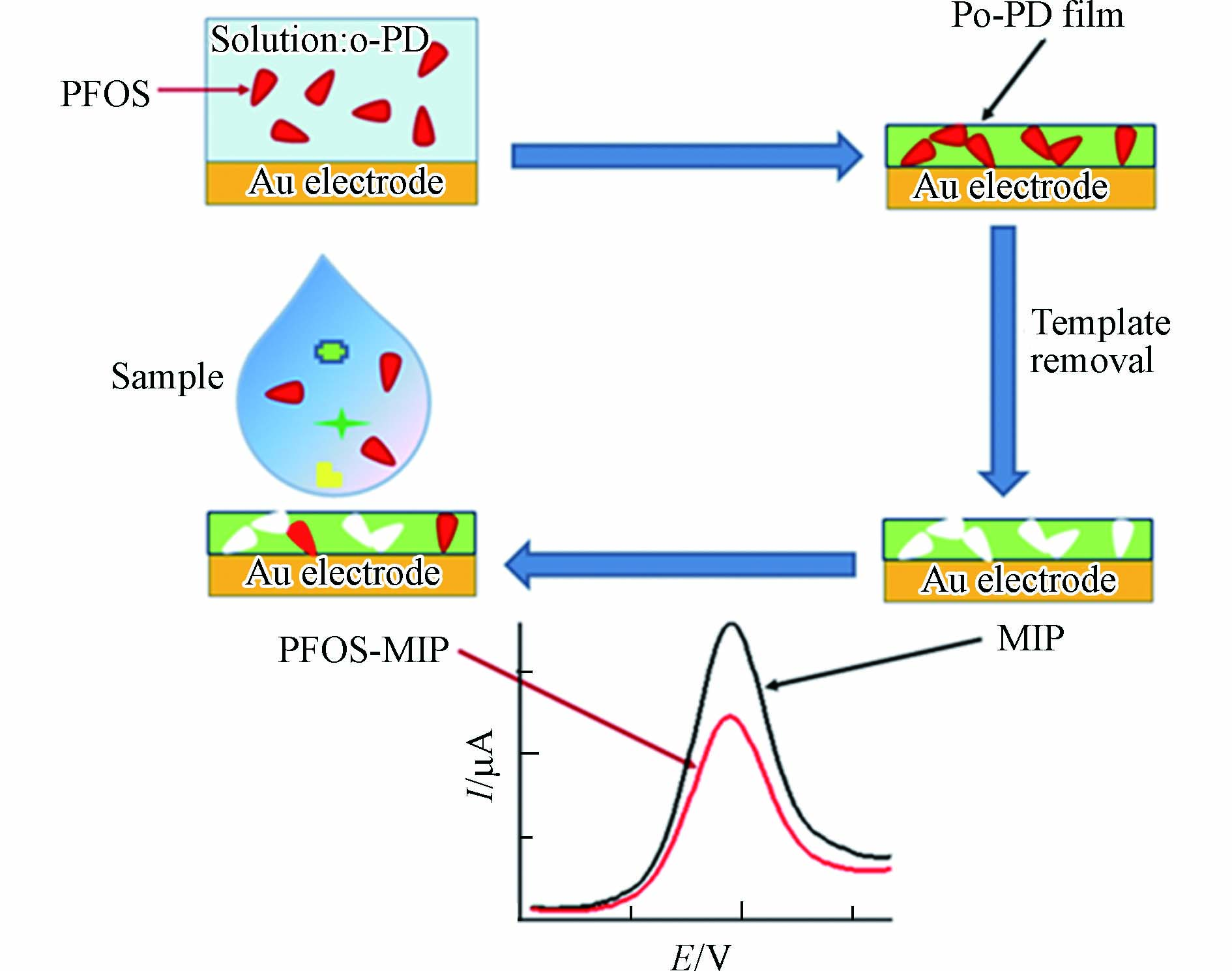
伏安传感是在一定电极电位下测定电流的变化,根据电极电位与电流之间的关系,获得伏安信号. Karimian等[19]通过在金电极上修饰MIP,建立了一种电化学伏安传感方法用于对PFOS的选择性检测(图1). 当PFOS结合到印迹识别位点时,二茂铁羧酸(FcCOOH)的伏安信号会下降,基于该信号的变化实现对PFOS的灵敏检测,检测限为0.04 nmol·L−1(即0.02 μg·L−1). 由于在电极表面沉积纳米材料可以提高电化学传感的灵敏度,Lu等[25]首先在电极上修饰金纳米星材料,然后将MIP电聚合到金纳米星表面,建立了一种高灵敏的差分脉冲伏安法检测自来水的PFOS,检测限可低至0.015 nmol·L−1(即7.5×10−3 μg·L−1).
-
电位传感是在没有电流的情况下测量电化学电池中两个电极的电位差. 在该方法中常用的是离子选择性电极,通过测量离子选择性膜电位的变化实现对目标物的定性和定量分析. Fang等[20]采用铅笔芯作为电极材料,将聚吡咯和模板分子(氟表面活性剂)掺杂后电聚合到电极表面形成分子印迹膜. 当将修饰的铅笔芯电极浸没到PFOA、PFOS或1H,1H,2H,2H-全氟辛烷磺酸(6:2FTS)溶液中时,电极电位发生改变,通过测量电极电位的变化量实现对目标物的检测,该方法对PFOA的检测限为100 nmol·L−1(即41 μg·L−1).
-
电化学阻抗谱(EIS)是测量电化学系统中的阻抗随正弦波频率的变化,当检测目标物与电极表面发生作用时,可以导致EIS发生改变,通过测量阻抗的变化量,实现对目标物的灵敏检测. Cheng等[21]采用多孔的金属有机骨架(MOF)材料Cr-MIL-101作为识别探针,将其嵌入到微流体通道内,形成微流控平台(图2). 当在通道内注入含有PFOS的溶液时,探针与PFOS发生相互作用可以产生电化学响应,导致电荷转移电阻增大,根据电荷转移电阻与PFOS浓度之间的相关性,实现对PFOS的定量检测,方法的检测限为5×10−4 μg·L−1.
-
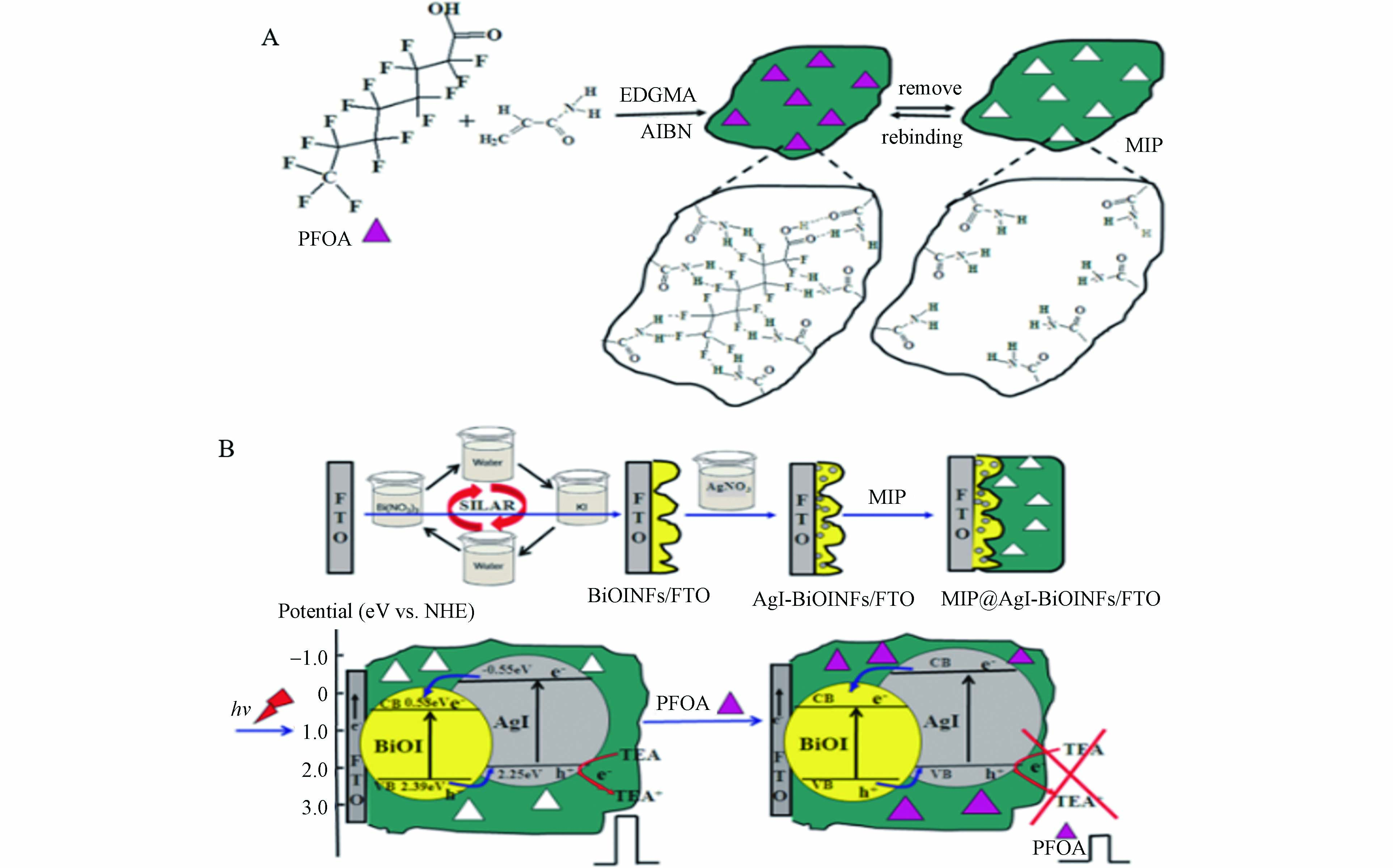
光电化学(PEC)传感是利用光活性材料受到光激发后,电荷载流子流向电极产生光电流,光电流量与目标物相关,根据光电流的变化,实现对目标物的检测. Tran等[22]将MIP修饰到TiO2纳米管阵列上组装得到一种光电化学传感器,在PFOS存在下,可以导致体系的光电流增强,实现对PFOS的快速检测,方法的线性范围为0.5—10 μmol·L−1,检测限为0.17 μmol·L−1(即86 μg·L−1). 除了采用传统的电极材料外,将一些新型纳米材料用于电化学传感器的构建可以进一步提高检测的灵敏度,Gong等[26]制备了一种光活性材料碘化银(AgI)纳米颗粒-碘化铋(BiOI)纳米薄片异质结,将其沉积到电极上与MIP组装得到光活性电极MIP@AgI-BiOINFs(图3),当加入PFOA后,电极表面的MIP对PFOA产生特异性识别,导致电子供体的扩散受到空间阻碍,产生的光电流信号下降,方法的线性范围为0.02—1000 μg·L−1,检测限为0.01 μg·L−1. 通过对河流水样进行富集预处理后,该方法可以用于对水样中PFOA的检测. 基于相似的原理,Li等[27]通过在丝网印刷电极表面原位电聚合BiOI纳米阵列并涂渍MIP后,制备了一种一次性光电化学传感条. 当加入全氟辛基磺酰氟(PFOSF)后,可以导致传感条中的光电流信号下降,方法的线性范围为0.05—500 μg·L−1,检测限为0.01 μg·L−1. 通过对河流水样进行加标检测,得到的加标回收率为92.5%—100.5%,并且该一次性光电化学传感条简便易携带,具有实现快速原位检测的应用潜力.
-
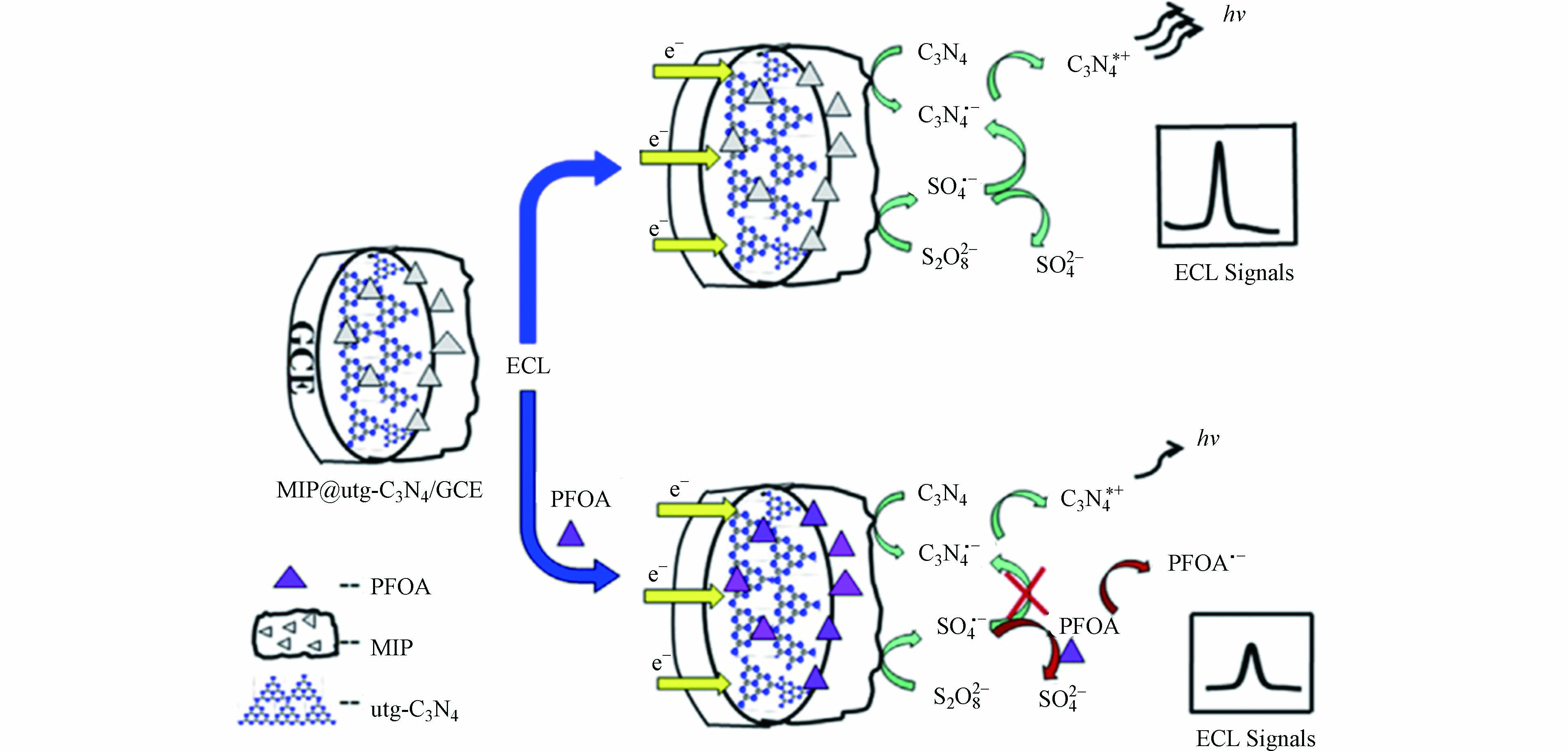
电化学发光(ECL)传感是一种将电化学和光结合的技术,利用ECL活性物质在电极处的氧化或还原反应产生自由基离子,当自由基离子从激发态回到基态时产生发射光. 产生的光强度与目标物相关,根据光强度的变化实现对目标物的定量检测. Chen等[23]将分子印迹聚吡咯修饰的二维超薄氮化碳(utg-C3N4)纳米片作为阴极ECL发射器,同时将S2O82- 作为共反应物和光化学氧化剂掺杂到电极中,建立了一种对PFOA检测的ECL传感方法(图4). 加入PFOA后,部分中间体强氧化剂SO4·- 被消耗用于氧化PFOA,导致体系的ECL信号下降,实现对PFOA的选择性检测,方法的检测限为0.01 μg·L−1.
采用上述的电化学传感方法对多种环境水样进行加标检测,获得了较高的加标回收率,表明这些方法对水环境中PFCs的检测呈现出良好的应用潜力. 表1对上述电化学传感方法的分析物、检测限、实际样品和回收率等进行了总结. 通过将分子印迹技术和电化学结合建立的电化学传感方法可以提高对PFCs检测的选择性,但是电极的制备过程较为繁琐,还需要进一步改善优化.
-
光学传感作为一种简便、快速的传感方法,获得了广泛的应用. 在光学传感中,采用光学材料作为信号探针,当其与待测目标物发生特异性相互作用后,可以导致探针的光学信号发生改变,通过测量光学信号的变化量,可以实现对目标物的识别检测. 目前在PFCs检测中,常用的光学传感方法包括比色、共振光散射和荧光传感.
-
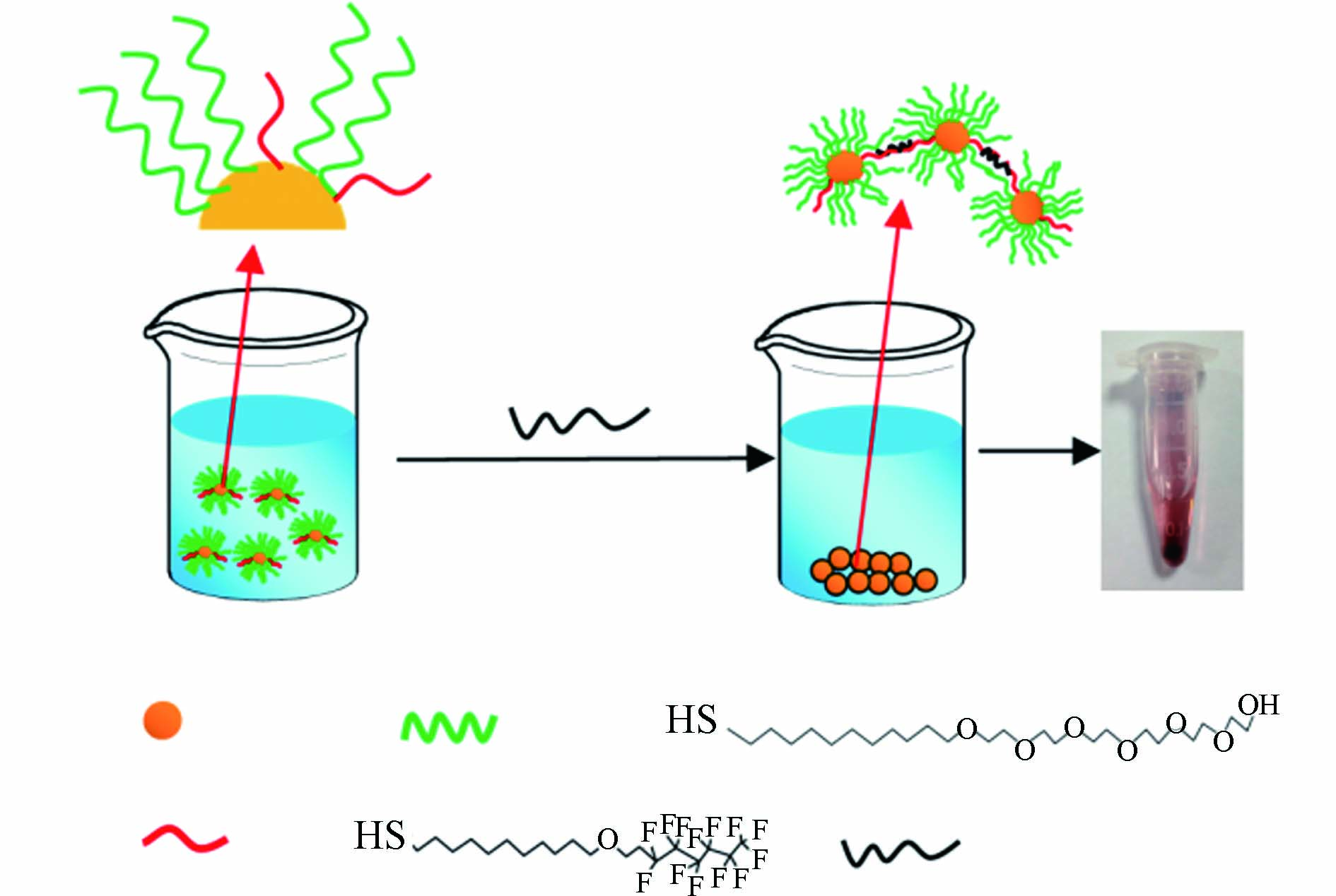
比色传感是通过裸眼观察化学反应产生的溶液颜色特征变化或采用分光光度计检测反应溶液的吸光度变化,实现对待测目标物定性和定量分析的一种光学传感方法,已经获得了广泛应用[28]. Takayose等[29]采用聚苯乙烯修饰的金纳米颗粒作为探针,在PFOA存在下,可以造成聚苯乙烯层从金颗粒表面分离,导致金颗粒发生聚集,溶液颜色由红色变为蓝-紫色. 通过观察颜色变化对PFOA检测的最低浓度为250 μmol·L−1(即1.04×105 μg·L−1),该方法的灵敏度较低. Niu等[30]将含有巯基末端的聚乙二醇和全氟烷烃同时修饰到金颗粒表面,得到Au@PEG-F纳米颗粒探针(图5). PFCs可以通过氟-氟相互作用吸附到颗粒表面,导致颗粒的疏水性增加,并从溶液中沉淀出来,使上层溶液的紫外吸光度下降,通过测定紫外吸光度与PFCs浓度之间的相关性,可以实现对多种PFCs的识别检测,方法的检测限为10 μg·L−1.
除了采用金颗粒作为直接的比色传感探针外,基于3,3,5,5-四甲基联苯胺(TMB)氧化的显色反应也是一种常用的比色传感方法. Liu等[31]采用水热法制备了磁性的MoS2/Fe3O4纳米复合材料,该材料可以催化H2O2氧化TMB成蓝色的TMB氧化物. 但是在PFOS存在下,PFOS可以通过静电作用优先吸附到材料表面,导致材料的活性位点被覆盖,从而不能产生蓝色的TMB氧化物. 基于PFOS浓度依赖的颜色变化,实现对PFOS的比色传感检测,方法的线性范围为0.1—12.5 μmol·L−1,检测限为8.6 nmol·L−1(即4.3 μg·L−1).
-
共振光散射(RLS)传感是通过测定样品在聚集和解离状态时的光散射信号,揭示探针与目标分子之间的相互作用,实现对目标分子的快速检测. 近年来,谭克俊课题组分别以健那绿B(JGB)、结晶紫(CV)和维多利亚蓝B(VBB)作为探针,建立了多种RLS传感方法用于检测水环境中的PFOS或PFOA[32-34],这些探针都是带正电荷的阳离子染料,可以与带负电荷的PFOS或PFOA发生静电作用和疏水作用导致RLS信号增强,方法的检测限分别为5.6 nmol·L−1(即2.8 μg·L−1),11 nmol·L−1(即4.55 μg·L−1)和5 nmol·L−1(即2.5 μg·L−1). 通过在自来水和河流水样中进行加标检测,获得的回收率均在90%以上,表明这些方法具有良好的应用潜力. 因此基于类似的原理,可以采用其他的阳离子染料作为探针构建多种RLS传感方法用于对PFOA或PFOS的快速检测.
-
荧光传感是利用荧光材料与目标分析物发生特异性相互作用后,导致荧光强度发生改变,实现对目标分析物的灵敏检测. 近年来,荧光传感获得了快速发展,通过采用不同的荧光材料作为信号探针构建了多种荧光传感方法,实现了对不同目标物的检测[35-36]. PFCs本身不具有荧光发射性质,当荧光探针与PFCs发生相互作用后,可以导致探针荧光强度发生改变,实现对PFCs的荧光传感检测. 目前,已经报道了采用不同的荧光材料作为探针,建立了多种对PFOS和PFOA检测的荧光传感方法.
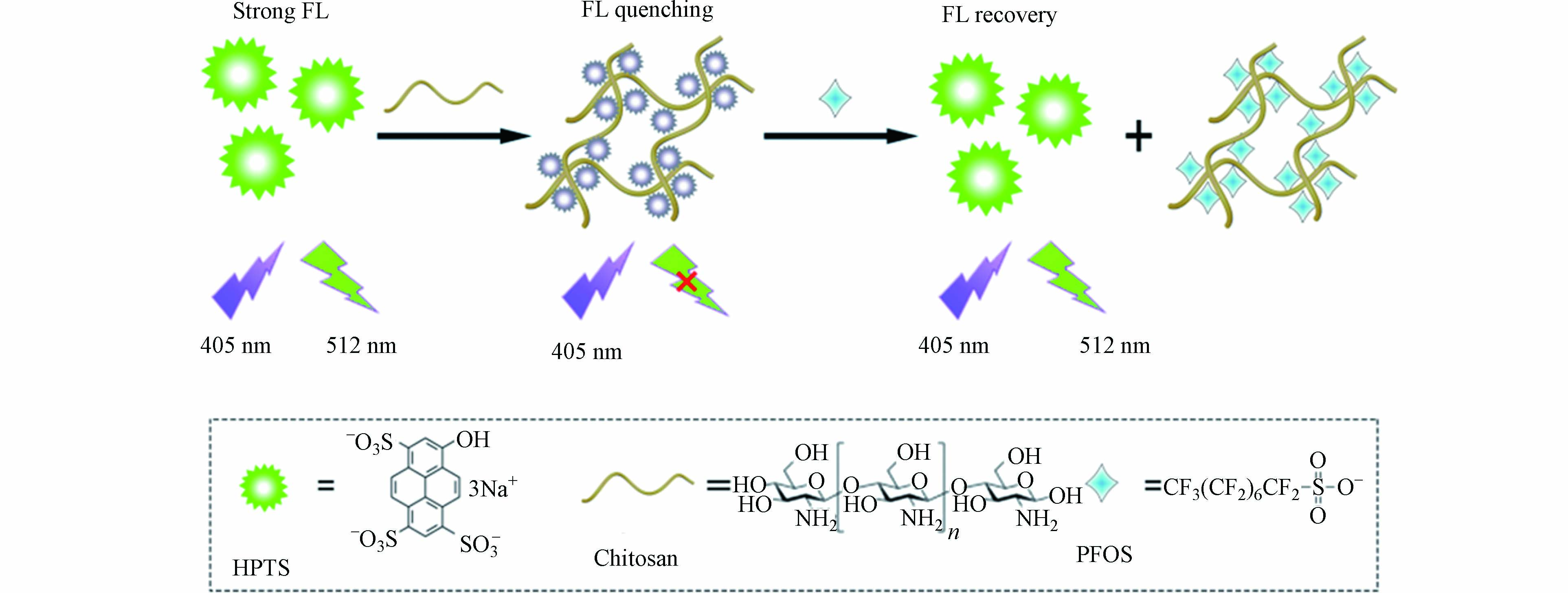
荧光染料大多是含有苯环或杂环并带有共轭双键的化合物,既有天然染料也有合成染料,作为荧光标记物在生物成像和荧光传感方面都获得了广泛应用[37-38]. Cheng等[39]采用染料赤藓红B(EB)作为探针,十六烷基三甲基溴化铵(CTAB)可以使EB的荧光发生淬灭,当加入PFOS和PFOA后,体系的荧光又逐渐增强,建立了荧光增强型的传感方法,对PFOS和PFOA的检测限分别为12.8 nmol·L−1(即6.4 μg·L−1)和11.8 nmol·L−1(即4.9 μg·L−1). He等[40]以绿色荧光染料8-羟基芘-1,3,6-三磺酸三钠(HPTS)作为探针,壳聚糖可以使其荧光发生淬灭,当加入PFOS时,壳聚糖优先与PFOS结合,从而使HPTS的荧光发生恢复,对PFOS的检测限为1.0 nmol·L−1(即0.5 μg·L−1)(图6). 基于相似的原理,Liang等[41]采用伊红Y作为探针,聚乙烯亚胺(PEI)作为淬灭剂,对PFOS的检测限为15 nmol·L−1(即7.5 μg·L−1). 除了使染料探针的荧光增强外,PFOS或PFOA也可以使探针的荧光发生淬灭,Zhang等[42]制备了一种水溶性的阳离子苝二酰亚胺衍生物(PDI-Pyr)荧光探针,PFOS可以使其荧光显著淬灭,建立了一种荧光淬灭型传感方法,对PFOS检测的线性范围为0.1—1.5 μmol·L−1,检测限为28 nmol·L−1(即14 μg·L−1). 通过将分子印迹技术与荧光传感结合,建立的分子印迹荧光传感方法可以提高对PFCs检测的选择性,Feng等[43]将荧光染料异硫氰酸荧光素(FITC)、有机胺和MIP固载到SiO2颗粒表面,制备得到分子印迹荧光探针,可以对PFOS产生特异性识别,导致荧光发生淬灭,实现对水样中PFOS的选择性检测,线性范围为5.57—48.54 μg·L−1,检测限为5.57 μg·L−1.
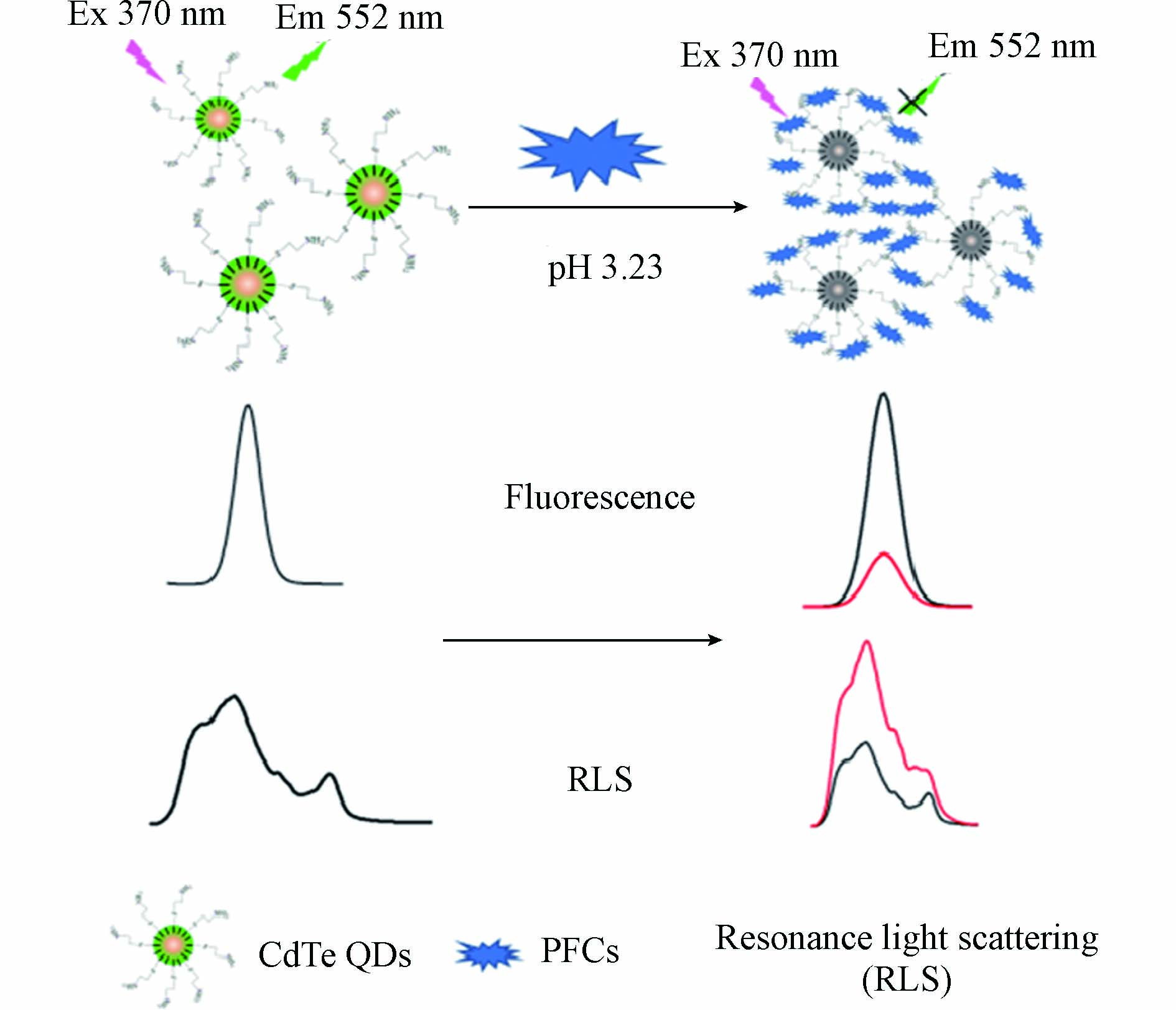
虽然采用荧光染料探针已经实现了对PFOS或PFOA的检测,但是大多数染料的荧光不够稳定,易发生漂白或淬灭,因此近年来荧光纳米材料引起了研究者的广泛关注. 半导体量子点简称为量子点,是纳米尺度原子和分子的集合体,一般粒径范围在2—20 nm. Ⅱ-Ⅵ族和Ⅲ-Ⅴ族半导体都是常见的荧光量子点,可以产生强荧光发射[44-45]. Liu等[46]采用巯基丙酸修饰的CdS半导体量子点作为荧光探针,在PFOA存在下,探针的荧光发生淬灭,方法的线性范围为0.5—40 μmol·L−1,检测限为0.3 μmol·L−1(即124.22 μg·L−1). Zhang等[47]采用水溶性半胱胺修饰的CdTe量子点作为荧光探针,建立了一种荧光和共振光散射双信号输出的传感方法(图7). 在PFOA或PFOS存在下,探针的荧光强度下降,共振光散射强度增加. 在荧光检测模式下的灵敏度是更高的,对PFOA和PFOS的检测限分别为32.02 pmol·L−1(即0.013 μg·L−1)和43.96 pmol·L−1(即0.022 μg·L−1). 为了实现对PFOA的特异性检测,Zheng等[48]制备了一种MIP修饰的CdTe@CdS量子点探针,PFOA可以与探针表面的印迹孔穴产生特异性结合,导致探针的荧光强度下降,方法的线性范围为0.25—15 μmol·L−1,检测限为25 nmol·L−1(即10.4 μg·L−1). 虽然采用这些传统的半导体量子点可以实现对PFOA和PFOS的灵敏检测,但是在这些材料中含有重金属元素Cd,具有一定的环境毒性,不具有良好的生物相容性.
而碳量子点作为一种无毒的、环境友好的荧光纳米材料,获得了研究者更大的青睐. 碳量子点即碳点,是一种碳基零维材料,由分散的类球状碳颗粒组成,尺寸极小(在10 nm以下),具有良好的水溶性和优异的荧光性能,在荧光传感领域展现出良好的应用前景[49-50]. Cheng等[51]制备了一种蓝色荧光碳点作为传感探针,氯化小檗碱水合物(BH)可以使碳点的荧光发生淬灭,当加入PFOS后,带正电荷的BH可以与带负电荷的PFOS发生静电作用,从而使碳点的荧光恢复. 该方法对PFOS检测的线性范围为0.22—50.0 μmol·L−1,检测限为21.7 nmol·L−1(即10.85 μg·L−1). Chen等[52]采用一种红光发射的碳点作为探针,与PFOS反应形成基态复合物,导致碳点的荧光和紫外-可见吸收信号下降,RLS信号增强,以荧光信号响应进行定量分析时方法的灵敏度是最高的,检测限为18.27 nmol·L−1(即9.14 μg·L−1). 同时,他们将荧光染料溴化乙锭(EB)作为参比信号,N掺杂的碳点(N-CDs)作为响应信号,设计了一种比率荧光传感方法(图8)[53],在PFOS存在下,N-CDs可以与带负电荷的PFOS发生静电作用和氢键作用,引起N-CDs聚集,导致荧光淬灭和二级光散射增加. 根据两种信号的比率变化,实现对PFOS的定量检测,方法的检测限为27.8 nmol·L−1(即13.9 μg·L−1). 与单一荧光检测相比,比率型荧光传感方法通过以两个或多个响应信号的比值进行定量分析可以进一步减少环境以及探针浓度等因素的影响,提高检测的准确性.
除了荧光量子点之外,具有高孔隙率的发光金属有机框架(LMOFs)材料也引起了研究者的广泛关注. LMOFs是一种新型的有机无机杂化材料,具有良好的结构可调性,较大的比表面积和多样的荧光发射性质,逐渐被应用到荧光传感领域[54-55]. Chen等[56]制备了3种水相稳定的锆卟啉LMOFs探针(PCN-222,PCN-223,PCN-224),建立了一种新型的荧光传感阵列方法检测水溶液中的PFCs(图9). 这3种探针均可以发射稳定的红色荧光,PFCs可以与探针发生吸附作用,导致探针的荧光强度下降. 由于3种探针的拓扑结构不同,可以对多种PFCs产生不同的吸附亲和力,呈现出多种荧光淬灭响应模式. 通过线性判别分析(LDA)和层次聚类分析(HCA)对传感阵列的信号进行处理,可以区分检测水中6种不同的PFCs. 通过在地表水和地下水中加入PFCs标准溶液进行加标回收检测,验证了该传感阵列对实际水样检测的应用潜力.
传统的荧光材料是采用高能量的紫外或可见光激发,产生低能量的荧光发射,即发射波长大于激发波长. 而上转换纳米颗粒(UCNPs)是一种由镧系元素掺杂的反-斯托克斯发光材料,即采用长波长的近红外光激发,产生短波长的紫外-可见光发射[57-58]. 这类材料具有更低的自动荧光背景信号和更高的光化学稳定性. Li等[59]将UCNPs和共价有机骨架材料(COFs)结合,制备了一种COFs功能化的UCNPs荧光探针(UCNPs@COFs). PFOS可以与探针表面的COFs层发生作用,使探针的荧光发生淬灭,方法的检测限为0.15 pmol·L−1(即7.5×10−5 μg·L−1). 通过掺杂不同的镧系元素,Yin等[60]制备了3种不同发光颜色的UCNPs,将全氟辛基三乙氧基硅烷修饰到UCNPs表面后,制得的荧光探针分别可以与PFCs发生氟-氟相互作用和氢键作用,导致探针的荧光发生淬灭. 通过LDA和HCA分析可以鉴定7种不同的PFCs,为复杂样品中PFCs的精准分析提供了良好的应用前景. 此外,也有报道将UCNPs和分子印迹技术结合,来提高探针的选择性,Tian等[61]将发射绿色和蓝色荧光的UCNPs分别作为响应信号和参比信号,制备了一种近红外激发的表面印迹比率型荧光探针. 在PFOS存在下,蓝色荧光的参比信号没有发生改变,而绿色荧光的强度下降,基于两种信号的比率分析实现对PFOS的选择性、灵敏性检测,检测限为1 pmol·L−1(即5×10−4 μg·L−1).
采用不同的光学材料作为信号探针对PFCs进行识别检测,建立了多种光学传感方法,并通过对探针进行调节优化,逐渐提高了方法的灵敏度和选择性,在加标样品检测中呈现了良好的应用潜力. 表2对上述光学传感方法的分析物、检测限、实际样品和回收率等进行了总结.
-
在PFCs的检测方法研究中,传感检测技术受到了越来越多的关注,本文对电化学传感和光学传感在PFCs检测中的研究进展进行了综述讨论. 与色谱-质谱联用技术相比,传感检测具有更简便、快速、易操作、成本低的优点,建立传感检测方法并不是要取代传统的仪器分析方法,而是弥补它们的缺陷,为PFCs的现场检测提供技术支持. 对于PFCs的理想检测过程是先采用传感方法进行快速筛查,初步得到样品中PFCs的浓度范围后,再根据需求采用色谱-质谱联用技术进行精密检测. 通过将电化学传感和光学传感进行比较分析,可以得出电化学传感的优势是灵敏度较高,缺点是电极的制备过程较为繁琐,方法的重现性容易受到影响. 而光学传感的优势是更简便,并且可以进行可视化检测,缺点是灵敏度较低,光学探针材料的稳定性有待提高. 因此这两种方法各有优缺点,需要根据具体需求进行选择. 此外,它们也存在相同的不足点:(1)目前建立的传感方法主要用于对PFOS或PFOA的检测,而对其他种类PFCs的传感检测研究较少. (2)在目前已经报道的传感方法中,大多数都是以自来水、河流或湖泊水作为实际水样进行检测,但是一般情况下,这些水样中PFCs的浓度较低而无法检测到,只能通过在样品中进行加标回收实验来验证传感方法对实际水样检测的应用潜力. 但是多种生活废水、工业污水等实际环境水样的基质是更复杂的,干扰物质也较多,传感方法的应用能力还有待深入考察.
为了实现电化学传感和光学传感技术在PFCs检测中的应用,需要进一步改善传感方法的灵敏度、选择性以及抗干扰能力. 可以考虑从以下方面进行优化:(1)随着纳米材料领域的快速发展,可以将多种纳米材料与电化学、光学传感结合,制备筛选更优异的信号探针. (2)通过将传统的传感技术与数字化、信息化等智能检测技术结合,进一步提高数据采集的精密度和准确度. (3)通过开发新型的快速预处理方法对水样进行有效富集后,再采用传感方法进行检测,以弥补传感方法灵敏度较低的缺陷,提高方法的实际应用能力. 虽然目前对PFCs的传感检测方法研究面临重大的挑战,但是随着PFCs的污染问题受到越来越多的关注,为了实现样本的现场大规模筛查,降低检测成本,深入开展PFCs的快速传感检测技术研究将是重要的发展趋势.
水环境中全氟化合物的传感检测方法研究进展
Research progress on sensing methods for the detection of perfluorinated compounds in water environment
-
摘要: 全氟化合物(PFCs)作为一类新型的持久性有机污染物,可以对环境和人体健康造成巨大的危害效应. 尤其在水环境中PFCs污染较为严重,污染分布范围广泛,使饮用水安全存在较大风险. 建立有效的分析方法对水环境中的PFCs污染水平进行及时检测是非常必要的. 虽然采用色谱-质谱联用技术已经实现了对PFCs的高灵敏检测,但是检测周期较长,检测成本较高. 为了解决该问题,近年来,电化学和光学传感方法逐渐被研究用于水环境中PFCs的检测. 传感方法可以提高对PFCs检测的便捷性,降低检测成本,并具有现场检测的应用潜力. 本文主要对电化学和光学传感方法在PFCs检测中的研究进展进行了综述,并对未来的研究趋势进行了预测和展望,希望可为水环境中PFCs的快速检测技术研究提供参考.Abstract: As a new type of persistent organic pollutants, perfluorinated compounds (PFCs) can cause great harm to the environment and human health. Especially, the pollution of PFCs is more serious in water environment, which is widely distributed and makes a great risk to the safety of drinking water. It is very necessary to establish the effective analytical methods to detect the pollution level of PFCs in water environment in time. Although the highly sensitive detection of PFCs has been realized by chromatography-mass spectrometry, it takes a long time and high cost. To solve this problem, electrochemical and optical sensing methods have been gradually investigated for the detection of PFCs in water environment in recent years. Sensing methods can improve the convenience of detection of PFCs, reduce the detection cost, and have the application potential of on-site detection. In this review, we mainly summarize the research progress of electrochemical and optical sensing methods in the detection of PFCs, and forecast and prospect the future research trends, which can provide a reference for the rapid detection technology research of PFCs in water environment.
-
湖滨湿地作为水陆交界地带,是各种微生物生存和繁衍的重要场所[1-2]。近年来,砷污染给我国地表水环境安全带来严重威胁[3-4],湖泊、河流、水库等已受到不同程度的砷污染,高原湖滨湿地因其脆弱的生态环境,面临着更高的砷污染风险[5]。微生物是湿地生态系统的重要分解者,对湿地生态系统中的能量流动及物质循环具有关键作用[6],微环境的变化对其影响显著,同时,微生物群落结构和多样性也会随着环境的变化而改变,可有效指示湿地生态环境的变化[7-9]。目前,湿地微生物群落的研究开始受到广泛关注,国内外大量学者已经证实,微生物能够通过同化和异化等作用改变环境条件,进而影响矿质元素的生物地球化学循环(如C、N、P等)、能量流动以及污染物的形态和降解(如重金属、有机污染物等),对湿地生态系统的稳定产生显著影响[10-12]。
我国学者对湿地微生物群落结构及多样性的研究主要集中在鄱阳湖、太湖、巢湖等富营养化湖泊[13-15],对三峡库区消落带的微生物群落结构及多样性也有一定研究[16],于小彦等通过室内模拟实验发现水分条件是左右生物碳添加对湿地微生物群落影响的重要因子[15],钢迪嘎等以密云水库消落带为研究对象,发现水位变化能够显著影响消落带土壤中氨氧化细菌和古菌的多样性、丰度[17]。然而,在研究高原湖滨湿地底泥中微生物群落结构及多样性上,多关注重金属污染及外界干扰方式对底泥中微生物群落结构的影响[18],水位条件的变化对富砷湖滨湿地底泥中细菌群落结构及多样性的影响尚不明确。
本文探究了不同水位条件下富砷湖滨湿地底泥中微生物群落结构及多样性特征,以期明晰微生物群落结构及多样性对于水位变化的响应关系,这有助于分析湿地底泥微生物与湿地环境变化之间的关系,进一步探明湿地生态系统中各元素的迁移与转化,为湿地生态环境保护与合理治污提供理论指导。
1. 材料与方法(Materials and methods)
1.1 试验材料与设计
本试验采取室内模拟湿地的方式,设置3种水位条件:a. 高水位(淹水15 cm),b. 中水位(淹水7 cm),c. 无水位(保持湿润即可),每种水位条件设置9组平行,共27个处理。试验在西南林业大学农村污水处理研究所温室进行,以黑色聚乙烯桶(高32 cm,内口径44 cm,底径32 cm)内栽植湿地植物的方式人工模拟湿地,底泥取自云南省昆明市盘龙区金汁河底泥(0—20 cm),挺水植物选择常见的湿地植物狭叶香蒲,购自云南省昆明市泛亚苗圃基地,使用Na2HAsO4·7H2O(分析纯)模拟富砷环境,砷的底泥含量为300 mg·kg−1[19]。
具体操作如下:将沟渠底泥剔除石块及植物根茎等杂物之后,混合均匀,通过外源添加Na2HAsO4·7H2O(以As计)的方式设置富砷底质,将富砷底泥加至黑色聚乙烯实验桶12 cm处,放置平衡后栽种狭叶香蒲幼苗。水位通过每周定量加水保持在设定高度,待香蒲稳定2个月后,进行实验样品采集。
1.2 样品采集及预处理
本试验分别于湖滨湿地典型挺水植物香蒲的生长期、繁盛期、枯落期对底泥进行破坏性采样。对香蒲叶、茎进行收割后,桶中淹水采用虹吸式排水方式抽出,底泥样品采自植物根系区,每种水位条件均随机采集3个平行作为重复,剔除植物根系之后混合均匀,将混匀后的底泥样品分为两部分:①用于Illumina PE250高通量测序,样品以干冰低温保存送往上海凌恩生物科技有限公司进行微生物测序工作;②用于污染指标测定,将样品装入自封袋带回实验室,放置阴凉处自然风干后研磨,过160目孔筛,实验待用。
1.3 样品指标测定
本实验研究测定的指标包括:总氮(TN)、总磷(TP)、土壤有机碳(SOC)、总砷(TAs),测定方法如表1所示。
表 1 实验样品指标测定方法Table 1. Determination methods of experimental sample indexes指标Index 测定方法Determination method 仪器名称Instrument name 型号Model 公司Company TN 凯氏定氮法(LY/T 1228—1999) 全自动凯氏定氮仪 KDN-1000 上海昕瑞仪器有限公司 TAs (3∶1)王水消解提取法(NY/T 1121.11-2006) 原子荧光光度计 PF3 北京普析通用仪器有限公司 TP 钼锑抗分光光度法(LY/T 1228—1999) 紫外可见光光度计 T6新世纪 北京普析通用仪器有限公司 SOC 重铬酸钾氧化—外加热法(LY/T 1237—1999) 电热恒温油浴锅 HWS-26 上海一恒科技仪器有限公司 1.4 样品Illumina PE250测序
本模拟实验中所有样品的Illumina PE250测序工作由上海凌恩生物科技有限公司完成,利用1%琼脂糖凝胶电泳抽取基因组DNA,每个样本3个平行,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris_HCl洗脱;2%琼脂糖电泳检测。将PCR产物用QuantiFluorTM -ST蓝色荧光定量系统(Promega公司)进行检测定量,按照每个样本的测序量要求,进行相应比例的混合,随后进行文库构建,检验合格之后使用Illumina PE250进行上机测序。
1.5 实验数据分析及处理
采用Excel 2016 对原始数据进行基础性处理;利用SPSS 26对数据进行显著性分析。利用单因素方差分析检验不同水位条件下富砷湖滨湿地底泥中环境条件及污染特征的差异性(One-way-ANOVA, P < 0.05),平均数之间的多重比较采用LSD检验。文中所有堆积柱状图均由Origin 2018绘制完成,用以表示不同分类水平下细菌群落的组成情况;使用LEFSe识别不同水位条件下富砷湖滨湿地底泥中的关键差异微生物,利用Canoco 5进行冗余分析(RDA),比较底泥污染指标和细菌群落之间的相关性。
2. 结果与讨论(Results and discussion)
2.1 富砷湖滨湿地底泥的污染特征
由表2可知,水位条件的变化是影响湿地生态系统的主要因子,不同水位条件下富砷湖滨湿地底泥中TN、TP、TAs和SOC具有显著差异(P<0.05),其中,TN含量在不同水位条件下的变化总体表现为:无水位<中水位<高水位,
NH+4 NO−3 表 2 不同水位条件下富砷湖滨湿地底泥的污染特征Table 2. Pollution characteristics of sediment in arsenic-rich lakeside wetland under different water levels不同水位条件Different water levels TN/(mg·kg−1) NO−3 NH+4 TP/(mg·kg−1) TAs/(mg·kg−1) SOC/(g·kg−1) 生长期 无水位 1006.13±7.64i 383.23±0.57f 683.61±4.68d 1738.73±9.44a 222.80±9bcd 15.75±0.13c 中水位 1262.80±5.60f 379.70±0.74g 756.94±21.77c 1475.74±9.63c 239.63±9.47abc 20.50±0.27a 高水位 1219.87±16.19f 379.11±0.45g 776.56±14.47c 1629.18±6.73b 200.45±4.32de 16.24±0.03b 繁盛期 无水位 1538.13±10.78d 515.09±0.57d 841.84±28.76b 1642.01±7.38b 271.50±1.58a 14.13±0.06d 中水位 1167.60±30.8g 514.75±0.92d 903.71±14.02b 1130.51±19.86f 249.69±0.41ab 6.93±0.12h 高水位 1067.73±15.70h 510.93±0.17e 908.42±14.48b 1244.07±3.86e 208.22±16.28cde 7.13±0.12h 枯落期 无水位 2375.33±19.42a 586.67±0.11a 873.72±14.95b 1117.87±21.36f 190.63±9.27de 8.28±0.13f 中水位 1957.20±10.10b 583.23±0.58b 976.56±14.17a 1109.37±9.38f 145.33±13.24f 7.60±0.07g 高水位 1896.53±12.13c 579.58±0.49c 992.87±13.33a 1367.42±11.78d 183.56±2.35e 8.48±007f 注:表中数据为平均值±标准差,同一列不同字母表示显著性差异(P<0.05). Note: The data in the table is the average ± standard deviation, and different letters in the same column indicate significant differences (P<0.05). 2.2 富砷湖滨湿地底泥中细菌群落丰度及多样性指数差异分析
运用Chaol指数(Chaol index)、Shannon指数(Shannon index)和Simpson指数(Simpson index)对不同水位条件下富砷湖滨湿地底泥中细菌丰度及多样性进行分析。由表3可知,各样品文库的覆盖率(Coverage)范围为97.97%—98.93%,表明本次测序结果能够有效反应湿地底泥中细菌群落的基本情况。Chao1 指数反应的细菌群落丰度变化规律一致,均为:无水位<中水位<高水位,即在实验范围内,淹水程度越大,其菌群丰度越高,这表明水位变化对底泥细菌丰度的影响显著。Shannon指数与Simpson指数通常用于表示α多样性指数,Shannon指数值越大,湿地底泥中细菌群落多样性就越高,Simpson指数则与之相反。Shannon指数和Simpson指数反应的细菌多样性表现为,细菌多样性程度较高的状态以高水位条件居多,例如,Shannon指数均为在生长期和枯落期的高水位条件下最大,Simpson指数则与之相反,这一结果表明,与无水位条件下的细菌多样性相比,水位条件对底泥细菌多样性有显著影响。
表 3 不同水位条件下富砷湖滨湿地底泥中细菌丰度及多样性指数Table 3. Bacterial abundance and diversity index in sediment of arsenic-rich lakeside wetland under different water levels不同水位条件Different water levels 97% 相似水平Similarity 序列Reads OUT数OTUs 覆盖率Coverage Chaol指数Chaol index 香农指数Shannon index 辛普森指数Simpson index 生长期 无水位 30740 2380 0.9797 2911 6.5032 0.0044 中水位 37621 2390 0.9830 2952 6.3112 0.0049 高水位 54831 2949 0.9893 3325 6.5211 0.0041 繁盛期 无水位 50472 2377 0.9878 2878 5.9651 0.0078 中水位 39474 2702 0.9840 3316 6.5134 0.0048 高水位 33345 2699 0.9872 3518 6.4510 0.0060 枯落期 无水位 28172 1844 0.9835 2247 6.1622 0.0062 中水位 37289 2345 0.9889 2638 6.1574 0.0067 高水位 39289 2443 0.9855 2841 6.5083 0.0039 湿地底泥是各种微生物参与、物质发生频繁交换、具有高度生活活性的特殊生物环境[20],而微生物种类多、分布广、代谢强、繁殖快,被认为是土壤生态系统中最活跃的部分,对外界环境干扰的响应十分敏感。水位条件是影响湿地生态过程的关键因素[21],很多研究表明,淹水程度的变化对土壤微生物群落有重要影响[22-23]。王鹏等通过对鄱阳湖不同水位植被带的土壤细菌群落特征进行研究,发现中等水位梯度下的土壤具有更高的菌群丰度和多样性[8];张洪霞等通过对不同淹水条件下滨海芦苇湿地土壤微生物的研究,发现淹水条件下土壤古菌和细菌多样性较高[24];张琼琼等研究不同水位深度的植物根系区细菌多样性发现,植物根系区细菌多样性随水位加深而减少[25];刘亚军在其研究中表明细菌群落受淹水深度的影响不大[26]。本试验结果与顾诗云、张洪霞、郭太忠等的研究结果相似[24, 27-28],在本研究中3种不同水位条件下,香蒲不同生长期湿地底泥中的细菌丰度表现具有一致性:无水位<中水位<高水位。就细菌群落多样性而言,高水位条件下细菌多样性程度较高。造成该结果的原因有两点,一方面,水位条件的变化可直接改变底泥细菌群落的生存环境,水位条件的变化引起的底泥中其他环境因子的变化会导致氧化还原条件发生改变[29-30],在水位条件较高时,植物根系区底泥中处于微还原状态,部分砷酸盐(H3AsO4)转化为亚砷酸盐(H3AsO3),对底泥及植物危害相对较小,使得一部分砷敏感细菌得以存活,从而影响到底泥中细菌群落丰度和多样性的变化。另一方面,水位条件通过改变植物的生长环境间接影响底泥细菌群落,本研究中的试供植物为典型挺水植物香蒲,它具有根系生物量大及通气组织发达等特点,增加植物根在饱和机制中的输氧能力,促使植物根际形成好氧微生物的微氧环境[31-32],因而底泥细菌丰度及多样性在高水位条件下并未降低;另外,较高的水位条件能使得底泥微生物对基质的利用能力增加,植物的生长亦会向底泥中输入大量微生物可利用的碳源,充足的水分条件更利于微生物的生长[33]。本研究结果显示了微生物群落丰度与多样性对不同水位条件的响应关系基本一致,水位越高,其细菌群落丰度和多样性指数越大,这可以用于指示富砷湖滨湿地在不同水位条件及不同淹没期的生态环境变化,为湖滨湿地做出更好的环境响应提供依据。
2.3 富砷湖滨湿地底泥中细菌组成特征
在不同水位条件下,门水平分类的优势细菌群落相对丰度具有一定的变化趋势。由图1可知,在本次模拟实验中,富砷湖滨湿地底泥中的五种优势群落分别为Proteobacteria(变形菌门)、Firmicutes(厚壁菌门)、Chloroflexi(绿弯菌门)、Bacteroidetes(拟杆菌门)和Acidobacteria(酸杆菌门),这五类细菌约占总测序序列的68.70%—86.06%。其中,变形菌门为细菌群落门水平分类中的绝对优势菌门,生长期、枯落期变形菌门的相对丰度随淹水高度加大总体上呈现减少的趋势,繁盛期则表现为水位越高,相对丰度越小。很多研究表明,变形菌门在湖泊沉积物中具有较高比例[53],在砷污染土壤中也具有较强的耐受性,因而在砷污染底泥中依然是优势细菌群落,然而在变形菌门中存在大量好氧或兼性细菌,湖泊底泥长期处于高水位淹水状态,变形菌门的相对幅度在高水位条件下较小[34-35];绿弯菌门、厚壁菌门、酸杆菌门和拟杆菌门是门水平分类上除变形菌门在之外的优势菌群,这四大菌群对不同水位条件的响应呈现出多样性的特征。绿弯菌门相对丰度的最大值均出现中水位条件,这是由于绿弯菌门是兼性厌氧菌,依靠光能进行光合作用,同时在无氧条件下也能进行无氧呼吸[36],中水位梯度下的环境更加适合绿弯菌门的生长;除繁盛期外,厚壁菌的门相对丰度在无水位条件均显著低于高水位,分析原因,或是因为这一微生物群落为无毒的单细胞生物,生活在水中或水分充足、养分少的环境中[37],然而生长旺盛期,由于长期处于中、高水位的淹水状态下,植物分泌物数量增加,促使根系区底泥营养物质增多[38-39],不利于厚壁菌门的繁殖;在生长期和枯落期,酸杆菌门相对丰度最大值均出现在无水位条件,通常,在淹水状态下,特别是随水位的增加,氧气进入土壤的能力下降,不利于好氧微生物的生存和它们的代谢[40],而酸杆菌门属于好氧菌,因而在无水位条件下具有较高的相对丰度,这与Zeglin等的研究结果相似[41];拟杆菌门相对丰度在生长期不同水位条件下并无显著变化,但在其繁盛期和衰落期则表现为无水位条件下相对丰度减少,中水位条件下相对丰度增加,这可能是因为拟杆菌门为厌氧菌,更倾向于生活在水位较高的状态[42]。其他相对丰度较低的细菌群落在不同水位条件下的变化不大。
另外,在变形菌门的纲水平下,包含了Gammaproteobacteria(γ-变形菌纲)、Deltaproteobacteria(δ-变形菌纲)和Alphaproteobacteria(α-变形菌纲)3个亚类,具有丰富的代谢多样性,对于C、N、P等营养元素的循环以及其他污染物的降解具有重要作用[43]。其中, Gammaproteobacteria(γ-变形菌纲)为优势菌纲,相对丰度最高,γ-变形菌纲以硫酸盐为电子受体降解有机物,具有耐砷性[44, 5],其在不同水位条件下的变化趋势同变形菌门完全一致,这是因为同种门属的菌群特性具有相似性,但在属水平上细菌群落的结构及多样性仍需更进一步探究。不同水位条件下富砷湖滨湿地底泥细菌群落结构存在显著差异,这说明底泥细菌具有通过调整自身群落结构以适应环境条件变化的生存机制。
图2为不同水位条件下富砷湖滨湿地底泥中属分类水平上的细菌群落组成,将细菌群落中平均丰度低于2%的部分合并在图中显示(≤2%);属水平分类中属于分类学数据库分类学谱系的中间等级,没有科学名称,以norank作为标记;uncultured表示属水平分类中未分离培养的细菌群落;unclassified属水平分类中在置信度阈值下,与数据库比对不上的细菌群落。
在不同水位条件下,富砷湖滨湿地底泥中的细菌群落在属水平上完整且相对丰度较高的两个菌群分别是:Steroidobacteraceae_uncultured(固醇杆菌科下的一个未培养属)和Bacteroidetes vadinHA17_norank。Steroidobacteraceae_uncultured总体上无显著差异,但其在枯落期变化相对显著,随水位降低呈现减小趋势,且相对丰度最小值(3.08%)出现在高水位条件下;Bacteroidetes vadinHA17_norank总体上呈现随淹水高度的加大而显著增加的趋势,总体变化趋势一致,其相对丰度最大值出现在高水位条件,这表明水位条件对属水平上细菌优势群落具有一定的影响。
2.4 富砷湖滨湿地底泥中细菌群落与底泥污染指标的相关性分析
图3为不同水位条件下微生物群落在不同分类水平下的LEFSe分值柱状图,仅得分大于2.0的物种被展示。结果表明,微生物群落在不同分类水平上共有21个物种表现出了显著性的组间差异,无水位条件富集到的具有显著影响效应的目水平物种为Thalassobaculales,中水位条件富集到的具有显著影响效应的目水平物种为Flavobacteriales,科水平物种为Flavobacteriaceae,高水位条件富集到的具有显著影响效应的属水平物种为Clostridium_sensu_stricto_13和Sporacetigenium,这表明微生物群落组成在不同分类水平上对水位变化具有不同的响应特征,也说明了不同水位条件下微生物群落组成的显著变化与特定物种的消长具有明显的相关性[45]。就门水平而言,以上21个物种分别隶属于Proteobacteria、Bacteroidetes、Firmicutes、Actinobacteria、Cyanobacteria、Cyanobacteria等。
图4为不同水位条件下富砷湖滨湿地底泥细菌门水平分类上群落结构与污染指标的冗余分析(RDA)结果排序图。根据RDA结果排序图中物种箭头和环境箭头之间的夹角判定相关性,呈钝角,为负相关,呈锐角,则为正相关,根据物种到环境因子的垂直距离越小,相关性越强。由图4可知,不同水位条件下,富砷湖滨湿地底泥污染指标与细菌群落之间的相关性存在差异性,底泥污染指标对细菌群落结构的影响程度不同。在无水位条件下(轴1和轴2共解释了68.4%的变量),TN和
NO−3 NO−3 NH+4 NH+4 NO−3 在高水位条件下(轴1和轴2共解释了77.2%的变量),TP、TAs、SOC、
NO−3 NH+4 NO−3 NH+4 NO−3 NH+4 本模拟实验的研究结果中,富砷湿地底泥在门水平分类上的5种优势细菌群落分别是Proteobacteria(变形菌门)、Firmicutes(厚壁菌门)、Chloroflexi(绿弯菌门)、Bacteroidetes(拟杆菌门)和Acidobacteria(酸杆菌门),这些优势菌门中包含了变形菌门、厚壁菌门、拟杆菌门等关键差异微生物,LDA分析结果显示关键差异微生物在不同水位条件下具有差异性。其中,变形菌门、厚壁菌门包含了大多数好氧反硝化菌,适宜在水位较低的底泥环境中生存[46, 28, 30],所以这些菌群在无水位条件和中水位条件下的相对丰度较高,绿弯菌门的相对丰度在中水位条件下最高,可见,淹水程度的变化能够显著影响湿地底泥中优势菌群的结构分布。RDA分析也显示变形菌门与底泥SOC、
NO−3 NH+4 NO−3 NO−3 3. 结论(Conclusion)
本论文研究了不同水位条件下富砷湖滨湿地底泥中细菌群落结构及多样性的变化特征,得出了以下结论:
(1)富砷湖滨湿地底泥中的细菌群落丰度变化具有一致性:无水位<中水位<高水位。就细菌群落多样性而言,高水位条件下细菌多样性程度较高。
(2)在细菌群落结构中,门水平分类上的5种优势菌门为变形菌门、厚壁菌门、绿弯菌门、拟杆菌门和酸杆菌门,各优势菌门对不同水位条件的响应表现出多样性的特征。变形菌门纲水平分类上的优势细菌为γ-变形菌纲、δ-变形菌纲和α-变形菌纲3个亚类,γ-变形菌纲相对丰度最高,其在不同水位条件下的变化趋势与变形菌门一致。属水平分类上,相对丰度占比最大的为固醇杆菌科的部分属水平未培养细菌,隶属于变形菌门,且与变形菌门在不同水位条件下的变化特征一致。
(3)TN、TP、SOC以及
NO−3 NH+4 NO−3 NH+4 本文通过模拟实验研究,明晰了不同水位条件对于富砷湖滨湿地底泥中微生物群落结构及多样性具有显著影响,这可以用于指示砷污染湖滨湿地在不同水位条件下的生态环境变化,从而为湿地环境的改善和治理提供科学依据。但是对于水位引起的富砷湖滨湿地底泥中砷形态转化及其与微生物的作用关系并未进行探讨,需进一步详细研究。
-
表 1 用于PFCs检测的电化学传感方法
Table 1. Electrochemical sensing methods for the detection of PFCs
电化学传感Electrochemical sensing 分析物Analyte 检测限/(μg·L−1)Limit of detection 样品Sample 加标回收率/%Spike recovery 参考文献References 伏安法Voltammetry PFOS 0.02 蒸馏水、自来水、矿泉水 82—110 [19] PFOS 7.5×10−3 去离子水、自来水 85.5—93.0 [25] 电位法Potentiometry PFOAPFOS6:2FTS 41 — — [20] 阻抗法Impedimetric PFOS 5×10−4 — — [21] 光电化学法Photoelectrochemistry PFOS 86 自来水、湘江河流水、岳麓山水 95.81—117.83 [22] PFOA 0.01 自来水、长江水 98.2—102.4 [26] PFOSF 0.01 自来水、长江水、东湖水 92.5—100.5 [27] 电化学发光法Electrochemiluminescence PFOA 0.01 自来水、长江水、东湖水 96.9—103.8 [23] 表 2 用于PFCs检测的光学传感方法
Table 2. Optical sensing methods for the detection of PFCs
光学传感Optical sensing 探针Probe 分析物Analyte 检测限/(μg·L−1)Limit of detection 样品Sample 加标回收率/%Spike recovery 参考文献References 比色法Colorimetric 金颗粒 PFOA 1.04×105 — — [29] 金颗粒 PFBSPFHxSPFHpAPFCs(F7-F17) 10 自来水河流水 PFOS:115±1285±10 [30] TMB PFOS 4.3 — — [31] 共振光散射法Resonant light scattering 健那绿B PFOS 2.8 自来水嘉陵江水 91—104 [32] 结晶紫 PFOA 4.55 自来水嘉陵江水 91.36—104.80 [33] 维多利亚蓝B PFOS 2.5 自来水嘉陵江水 91.8—106.3 [34] 荧光法Fluorescence 赤藓红B PFOSPFOA PFOS: 6.4PFOA: 4.9 自来水嘉陵江水 PFOS:93.5—106.5PFOA:91.5—107.0 [39] 8-羟基芘-1,3,6-三磺酸三钠(HPTS) PFOS 0.5 珠江河水海珠湖水 90.8—102 [40] 伊红Y PFOS 7.5 自来水嘉陵江水 97.4—105.1 [41] 阳离子苝二酰亚胺衍生物(PDI-Pyr) PFOS 14 自来水土壤提取物 — [42] 异硫氰酸荧光素掺杂的印迹探针 PFOS 5.57 自来水湘江水 95.7—101 [43] CdS量子点 PFOA 124.22 纺织品悬浮液 95—113 [46] CdTe量子点 PFOAPFOS PFOA: 0.013PFOS: 0.022 自来水嘉陵江水 PFOA:99—106.3PFOS:98.3—107.3 [47] CdTe@CdS量子点 PFOA 10.4 自来水嘉陵江水 91—107 [48] 蓝色荧光碳点 PFOS 10.85 自来水嘉陵江水 91.6—99.6 [51] 红色荧光碳点 PFOS 9.14 自来水嘉陵江水 97.9—104.8 [52] 氮掺杂的碳点 PFOS 13.9 自来水嘉陵江水 90.15—101.44 [53] 锆卟啉LMOFs PFOSPFDAPFNAPFOAPFHpAPFHxA PFOS: 36PFDA: 45PFNA: 47PFOA: 46PFHpA: 44 太湖水地下水 — [56] UCNPs@COFs PFOS 7.5×10−5 自来水塑料瓶 106—108103—104 [59] UCNPs@SiO2-F PFDAPFNAPFOAPFHpA PFHxAPFOSPFHxS PFOS: 2.15 自来水地表海水河流水塑料瓶 — [60] UCNPs-SiO2@MIP PFOS 5×10−4 鄱阳湖水人血清鸡蛋 70.6—106 [61] -
[1] LINDSTROM A B, STRYNAR M J, LIBELO E L. Polyfluorinated compounds: past, present, and future [J]. Environmental Science & Technology, 2011, 45(19): 7954-7961. [2] PREVEDOUROS K, COUSINS I T, BUCK R C, et al. Sources, fate and transport of perfluorocarboxylates [J]. Environmental Science & Technology, 2006, 40(1): 32-44. [3] GIESY J P, KANNAN K. Global distribution of perfluorooctane sulfonate in wildlife [J]. Environmental Science & Technology, 2001, 35(7): 1339-1342. [4] ARMITAGE J, COUSINS I T, BUCK R C, et al. Modeling global-scale fate and transport of perfluorooctanoate emitted from direct sources [J]. Environmental Science & Technology, 2006, 40(22): 6969-6975. [5] 杨琳, 李敬光. 全氟化合物前体物质生物转化与毒性研究进展 [J]. 环境化学, 2015, 34(4): 649-655. doi: 10.7524/j.issn.0254-6108.2015.04.2014091803 YANG L, LI J G. Perfluorinated compound precursors: Biotransformation and toxicity [J]. Environmental Chemistry, 2015, 34(4): 649-655(in Chinese). doi: 10.7524/j.issn.0254-6108.2015.04.2014091803
[6] ZENG H C, ZHANG L, LI Y Y, et al. Inflammation-like glial response in rat brain induced by prenatal PFOS exposure [J]. NeuroToxicology, 2011, 32(1): 130-139. doi: 10.1016/j.neuro.2010.10.001 [7] 杨兰琴, 冯雷雨, 陈银广. 中国水环境中全氟化合物的污染水平及控制策略 [J]. 化工进展, 2012, 31(10): 2304-2312. doi: 10.16085/j.issn.1000-6613.2012.10.037 YANG L Q, FENG L Y, CHEN Y G. Pollution status and control strategies of perfluorinated compounds in water environments over China: A review [J]. Chemical Industry and Engineering Progress, 2012, 31(10): 2304-2312(in Chinese). doi: 10.16085/j.issn.1000-6613.2012.10.037
[8] ZHANG L, LIU J G, HU J X, et al. The inventory of sources, environmental releases and risk assessment for perfluorooctane sulfonate in China [J]. Environmental Pollution, 2012, 165: 193-198. doi: 10.1016/j.envpol.2011.09.001 [9] BAI X L, SON Y. Perfluoroalkyl substances (PFAS) in surface water and sediments from two urban watersheds in Nevada, USA [J]. Science of the Total Environment, 2021, 751: 141622. doi: 10.1016/j.scitotenv.2020.141622 [10] STRÓŻYŃSKA M, SCHUHEN K. Dispersive solid-phase extraction followed by triethylsilyl derivatization and gas chromatography mass spectrometry for perfluorocarboxylic acids determination in water samples [J]. Journal of Chromatography A, 2019, 1597: 1-8. doi: 10.1016/j.chroma.2019.03.008 [11] SHI Y L, PAN Y Y, LIANG L N, et al. An on-line solid phase extraction-liquid chromatography tandem mass spectrometry method for the determination of perfluoroalkyl substances in the Antarctic ice core samples [J]. Chinese Chemical Letters, 2015, 26(9): 1073-1078. doi: 10.1016/j.cclet.2015.05.038 [12] 李鑫, 陈军辉, 程红艳, 等. 近岸海水中全氟化合物的液相色谱-离子阱质谱法测定 [J]. 环境化学, 2012, 31(6): 896-901. LI X, CHEN J H, CHENG H Y, et al. Simultaneous determination of common perfluorinated compounds in coastal seawater by liquid chromatography-ion trap mass spectrometry [J]. Environmental Chemistry, 2012, 31(6): 896-901(in Chinese).
[13] HUANG Y F, ZHANG W H, BAI M D, et al. One-pot fabrication of magnetic fluorinated carbon nanotubes adsorbent for efficient extraction of perfluoroalkyl carboxylic acids and perfluoroalkyl sulfonic acids in environmental water samples [J]. Chemical Engineering Journal, 2020, 380: 122392. doi: 10.1016/j.cej.2019.122392 [14] TROJANOWICZ M, KOC M. Recent developments in methods for analysis of perfluorinated persistent pollutants [J]. Microchim Acta, 2013, 180(11): 957-971. [15] ROSENBLUM L, WENDELKEN S C. Method 533: Determination of per-and polyfluoroalkyl substances in drinking water by isotope dilution anion exchange solid phase extraction and liquid chromatography/tandem mass spectrometry[S]. U. S. Environmental Protection Agency, Office of Ground Water and Drinking Water, Cincinnati, OH, 2019. [16] SHOEMAKER J A, GRIMMETT P E, BOUTIN B K. Method 537: Determination of selected per-and polyfluorinated alkyl substances in drinking water by solid phase extraction and liquid chromatography/tandem mass spectrometry (LC/MS/MS)[S]. U. S. Environmental Protection Agency, Office of Research and Development, National Exposure Research Laboratory, Washington, D. C. , 2009. [17] SHOEMAKER J A, TETTENHORST D R. Method 537.1: Determination of selected per-and polyfluorinated alkyl substances in drinking water by solid phase extraction and liquid chromatography/tandem mass spectrometry (LC/MS/MS)[S]. U. S. Environmental Protection Agency, Office of Research and Development, National Center for Environmental Assessment, Washington, D. C. , 2020. [18] HERNÁNDEZ-RODRÍGUEZ J F, ROJAS D, ESCARPA A. Electrochemical sensing directions for next-generation healthcare: trends, challenges, and frontiers [J]. Analytical Chemistry, 2021, 93(1): 167-183. doi: 10.1021/acs.analchem.0c04378 [19] KARIMIAN N, STORTINI A M, MORETTO L M, et al. Electrochemosensor for trace analysis of perfluorooctanesulfonate in water based on a molecularly imprinted poly(o-phenylenediamine) polymer [J]. ACS Sensors, 2018, 3(7): 1291-1298. doi: 10.1021/acssensors.8b00154 [20] FANG C, CHEN Z L, MEGHARAJ M, et al. Potentiometric detection of AFFFs based on MIP [J]. Environmental Technology & Innovation, 2016, 5: 52-59. [21] CHENG Y H, BARPAGA D, SOLTIS J A, et al. Metal-organic framework-based microfluidic impedance sensor platform for ultrasensitive detection of perfluorooctanesulfonate [J]. ACS Applied Materials & Interfaces, 2020, 12(9): 10503-10514. [22] TRAN T T, LI J Z, FENG H, et al. Molecularly imprinted polymer modified TiO2 nanotube arrays for photoelectrochemical determination of perfluorooctane sulfonate (PFOS) [J]. Sensors and Actuators B:Chemical, 2014, 190: 745-751. doi: 10.1016/j.snb.2013.09.048 [23] CHEN S H, LI A M, ZHANG L Z, et al. Molecularly imprinted ultrathin graphitic carbon nitride nanosheets-based electrochemiluminescence sensing probe for sensitive detection of perfluorooctanoic acid [J]. Analytica Chimica Acta, 2015, 896: 68-77. doi: 10.1016/j.aca.2015.09.022 [24] CHEN L X, XU S F, LI J H. Recent advances in molecular imprinting technology: current status, challenges and highlighted applications [J]. Chemical Society Reviews, 2011, 40(5): 2922-2942. doi: 10.1039/c0cs00084a [25] LU D N, ZHU D Z, GAN H H, et al. An ultra-sensitive molecularly imprinted polymer (MIP) and gold nanostars (AuNS) modified voltammetric sensor for facile detection of perfluorooctance sulfonate (PFOS) in drinking water [J]. Sensors and Actuators B:Chemical, 2022, 352: 131055. doi: 10.1016/j.snb.2021.131055 [26] GONG J M, FANG T, PENG D H, et al. A highly sensitive photoelectrochemical detection of perfluorooctanic acid with molecularly imprined polymer-functionalized nanoarchitectured hybrid of AgI-BiOI composite [J]. Biosensors and Bioelectronics, 2015, 73: 256-263. doi: 10.1016/j.bios.2015.06.008 [27] LI X, WANG X L, FANG T, et al. Disposable photoelectrochemical sensing strip for highly sensitive determination of perfluorooctane sulfonyl fluoride on functionalized screen-printed carbon electrode [J]. Talanta, 2018, 181: 147-153. doi: 10.1016/j.talanta.2018.01.005 [28] LIU B, ZHUANG J Y, WEI G. Recent advances in the design of colorimetric sensors for environmental monitoring [J]. Environmental Science:Nano, 2020, 7(8): 2195-2213. doi: 10.1039/D0EN00449A [29] TAKAYOSE M, AKAMATSU K, NAWAFUNE H, et al. Colorimetric detection of perfluorooctanoic acid (PFOA) utilizing polystyrene-modified gold nanoparticles [J]. Analytical Letters, 2012, 45(18): 2856-2864. doi: 10.1080/00032719.2012.696225 [30] NIU H Y, WANG S H, ZHOU Z, et al. Sensitive colorimetric visualization of perfluorinated compounds using poly(ethylene glycol) and perfluorinated thiols modified gold nanoparticles [J]. Analytical Chemistry, 2014, 86(9): 4170-4177. doi: 10.1021/ac403406d [31] LIU J, DU J Y, SU Y, et al. A facile solvothermal synthesis of 3D magnetic MoS2/Fe3O4 nanocomposites with enhanced peroxidase-mimicking activity and colorimetric detection of perfluorooctane sulfonate [J]. Microchemical Journal, 2019, 149: 104019. doi: 10.1016/j.microc.2019.104019 [32] CHENG Z, ZHANG F, CHEN X P, et al. Highly sensitive and selective detection of perfluorooctane sulfonate based on the Janus Green B resonance light scattering method [J]. Analytical Methods, 2016, 8(45): 8042-8048. doi: 10.1039/C6AY02739C [33] ZHANG F, ZHENG Y H, LIANG J M, et al. A simple and highly sensitive assay of perfluorooctanoic acid based on resonance light scattering technique [J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2016, 159: 7-12. doi: 10.1016/j.saa.2016.01.010 [34] 陈现平, 陶艺, 吴飞, 等. 维多利亚蓝B共振光散射法高灵敏选择性检测全氟辛烷磺酸 [J]. 光谱学与光谱分析, 2017, 37(3): 811-815. CHEN X P, TAO Y, WU F, et al. High sensitive and selective detection of PFOS with resonance light scattering technology based on interaction with Volatile Blue B [J]. Spectroscopy and Spectral Analysis, 2017, 37(3): 811-815(in Chinese).
[35] GAO M, TANG B Z. Fluorescent sensors based on aggregation-induced emission: recent advances and perspectives [J]. ACS Sensors, 2017, 2(10): 1382-1399. doi: 10.1021/acssensors.7b00551 [36] GUO Z, CHEN G Q, ZENG G M, et al. Fluorescence chemosensors for hydrogen sulfide detection in biological systems [J]. Analyst, 2015, 140(6): 1772-1786. doi: 10.1039/C4AN01909A [37] LIU J, SUN Y Q, ZHANG H X, et al. Sulfone-rhodamines: a new class of near-infrared fluorescent dyes for bioimaging [J]. ACS Applied Materials & Interfaces, 2016, 8(35): 22953-22962. [38] HE L W, LIN W Y, XU Q Y, et al. A unique type of pyrrole-based cyanine fluorophores with turn-on and ratiometric fluorescence signals at different pH regions for sensing pH in enzymes and living cells [J]. ACS Applied Materials & Interfaces, 2014, 6(24): 22326-22333. [39] CHENG Z, DU L L, ZHU P P, et al. An erythrosin B-based “turn on” fluorescent sensor for detecting perfluorooctane sulfonate and perfluorooctanoic acid in environmental water samples [J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2018, 201: 281-287. doi: 10.1016/j.saa.2018.05.013 [40] HE J C, SU Y Y, SUN Z J, et al. A chitosan-mediated “turn-on” strategy for rapid fluorometric detection of perfluorooctane sulfonate [J]. Microchemical Journal, 2020, 157: 105030. doi: 10.1016/j.microc.2020.105030 [41] LIANG J M, DENG X Y, TAN K J. An eosin Y-based “turn-on” fluorescent sensor for detection of perfluorooctane sulfonate [J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2015, 150: 772-777. doi: 10.1016/j.saa.2015.05.069 [42] ZHANG Q J, LIAO M Y, XIAO K R, et al. A water-soluble fluorescence probe based on perylene diimide for rapid and selective detection of perfluorooctane sulfonate in 100% aqueous media [J]. Sensors and Actuators B:Chemical, 2022, 350: 130851. doi: 10.1016/j.snb.2021.130851 [43] FENG H, WANG N Y, TRAN T T, et al. Surface molecular imprinting on dye-(NH2)-SiO2 NPs for specific recognition and direct fluorescent quantification of perfluorooctane sulfonate [J]. Sensors and Actuators B:Chemical, 2014, 195: 266-273. doi: 10.1016/j.snb.2014.01.036 [44] BAILEY R E, NIE S M. Alloyed semiconductor quantum dots: tuning the optical properties without changing the particle size [J]. Journal of the American Chemical Society, 2003, 125(23): 7100-7106. doi: 10.1021/ja035000o [45] FARIAS P M A, SANTOS B S, THOMAZ A A, et al. Fluorescent II-VI semiconductor quantum dots in living cells: nonlinear microspectroscopy in an optical tweezers system [J]. The Journal of Physical Chemistry B, 2008, 112(9): 2734-2737. doi: 10.1021/jp0758465 [46] LIU Q, HUANG A Z, WANG N, et al. Rapid fluorometric determination of perfluorooctanoic acid by its quenching effect on the fluorescence of quantum dots [J]. Journal of Luminescence, 2015, 161: 374-381. doi: 10.1016/j.jlumin.2015.01.045 [47] ZHANG F, LIANG J M, LIU Y, et al. A highly sensitive dual-readout assay for perfluorinated compounds based CdTe quantum dots [J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2022, 269: 120753. doi: 10.1016/j.saa.2021.120753 [48] ZHENG L, ZHENG Y H, LIU Y, et al. Core-shell quantum dots coated with molecularly imprinted polymer for selective photoluminescence sensing of perfluorooctanoic acid [J]. Talanta, 2019, 194: 1-6. doi: 10.1016/j.talanta.2018.09.106 [49] DEVI P, THAKUR A, CHOPRA S, et al. Ultrasensitive and selective sensing of selenium using nitrogen-rich ligand interfaced carbon quantum dots [J]. ACS Applied Materials & Interfaces, 2017, 9(15): 13448-13456. [50] PANDA S, JADAV A, PANDA N, et al. A novel carbon quantum dot-based fluorescent nanosensor for selective detection of flumioxazin in real samples [J]. New Journal of Chemistry, 2018, 42(3): 2074-2080. doi: 10.1039/C7NJ04358A [51] CHENG Z, DONG H C, LIANG J M, et al. Highly selective fluorescent visual detection of perfluorooctane sulfonate via blue fluorescent carbon dots and berberine chloride hydrate [J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2019, 207: 262-269. doi: 10.1016/j.saa.2018.09.028 [52] CHEN Q, ZHU P P, XIONG J, et al. A sensitive and selective triple-channel optical assay based on red-emissive carbon dots for the determination of PFOS [J]. Microchemical Journal, 2019, 145: 388-396. doi: 10.1016/j.microc.2018.11.003 [53] CHEN Q, ZHU P P, XIONG J, et al. A new dual-recognition strategy for hybrid ratiometric and ratiometric sensing perfluorooctane sulfonic acid based on high fluorescent carbon dots with ethidium bromide [J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2020, 224: 117362. doi: 10.1016/j.saa.2019.117362 [54] ZHANG L L, KANG Z X, XIN X L, et al. Metal-organic frameworks based luminescent materials for nitroaromatics sensing [J]. CrystEngComm, 2016, 18(2): 193-206. doi: 10.1039/C5CE01917F [55] TIAN D, LIU X J, FENG R, et al. Microporous luminescent metal-organic framework for a sensitive and selective fluorescence sensing of toxic mycotoxin in moldy sugarcane [J]. ACS Applied Materials & Interfaces, 2018, 10(6): 5618-5625. [56] CHEN B N, YANG Z S, QU X L, et al. Screening and discrimination of perfluoroalkyl substances in aqueous solution using a luminescent metal-organic framework sensor array [J]. ACS Applied Materials & Interfaces, 2021, 13(40): 47706-47716. [57] WILHELM S. Perspectives for upconverting nanoparticles [J]. ACS Nano, 2017, 11(11): 10644-10653. doi: 10.1021/acsnano.7b07120 [58] CHENG T, MARIN R, SKRIPKA A, et al. Small and bright lithium-based upconverting nanoparticles [J]. Journal of the American Chemical Society, 2018, 140(40): 12890-12899. doi: 10.1021/jacs.8b07086 [59] LI J, ZHANG C Y, YIN M Y, et al. Surfactant-sensitized covalent organic frameworks-functionalized lanthanide-doped nanocrystals: an ultrasensitive sensing platform for perfluorooctane sulfonate [J]. ACS Omega, 2019, 4(14): 15947-15955. doi: 10.1021/acsomega.9b01996 [60] YIN M Y, CHE L H, JIANG S Z, et al. Sensing of perfluorinated compounds using a functionalized tricolor upconversion nanoparticle based fluorescence sensor array [J]. Environmental Science:Nano, 2020, 7(10): 3036-3046. doi: 10.1039/D0EN00554A [61] TIAN L X, GUO H Q, LI J, et al. Fabrication of a near-infrared excitation surface molecular imprinting ratiometric fluorescent probe for sensitive and rapid detecting perfluorooctane sulfonate in complex matrix [J]. Journal of Hazardous Materials, 2021, 413: 125353. doi: 10.1016/j.jhazmat.2021.125353 期刊类型引用(5)
1. 李亦奇,郭洋,张露菁,彭少杰. 2021—2023年上海市市售豇豆中倍硫磷的膳食暴露风险评估. 食品安全质量检测学报. 2025(02): 296-301 .  百度学术
百度学术
2. 孙齐娟,王建. 农产品中有机磷农药残留的检测及其降解技术研究——气相色谱仪与液质联用技术的应用. 中外食品工业. 2024(07): 56-58 .  百度学术
百度学术
3. 魏智化,张睿婷,赵秦,魏军彦. 生物荧光酶抑制法快速定性检测粮食中有机磷类和氨基甲酸酯类农药残留的方法学验证. 粮油仓储科技通讯. 2024(06): 41-44 .  百度学术
百度学术
4. 杜文瑜,马迪,李备,尹青春,曹宁,谭梦男,宋烨,郑晓冬,赵恒. 表面增强拉曼光谱快速检测香蕉中的苯醚甲环唑和毒死蜱残留. 食品安全质量检测学报. 2023(08): 238-244 .  百度学术
百度学术
5. 陈锐,瞿佳,孙晓宇,门欣,邓媛,赵玲侠. 菌剂PA9降解农田土壤残留氧化乐果研究. 广东农业科学. 2023(06): 73-82 .  百度学术
百度学术
其他类型引用(8)
-






 DownLoad:
DownLoad: