-
邻苯二甲酸酯(phthalate esters,PAEs)作为增塑剂,被大量添加在塑料、涂料、化肥和化妆品等商品中. 根据信息处理服务公司(Information handling services,IHS)的一份报告,2014年全球生产和消费的增塑剂为840万吨,其中PAEs类占了70%[1]. 预计2017—2022年全球对PAEs的需求将以年均1.3%的速度增长[2]. 目前,PAEs在中国每年的生产量和消费量大约为130万吨,占全球总量的20%[3]. 鉴于PAEs不是通过稳定的化学键与产品结合,此类化合物很容易通过多种方式释放到环境中,例如工业和市政废水排放、固体废物处置和浸出、产品使用过程中的迁移和挥发[4-6]. 研究表明全球大多数人群均已暴露于PAEs中,并且已在人体血清和脂肪中发现PAEs的存在[7]. 人体暴露于PAEs的主要途径为食物和饮用水的摄入[8-9],其中饮用水作为每日必须摄入的介质,其中含有的PAEs对人体的影响近年来受到了广泛关注[5,10-11].
邻苯二甲酸二甲酯(dinethyl phthalate,DMP)、邻苯二甲酸二乙酯(diethyl phthalate,DEP)、邻苯二甲酸二丁酯(di-n-phthalate,DBP)、邻苯二甲酸丁苄酯(butylbenzyl phthalate,BBP)、邻苯二甲酸二(2-乙基己基)酯(di(2-ethylhexyl)phthalate,DEHP)和邻苯二甲酸二辛酯(di-n-octyl phthalate,DNOP)已被联合国列入优先管控污染物[12],DMP、DBP和DEHP也已被列入我国水环境优先控制污染物黑名单,但均未列入我国2017年和2020年出台的两批《优先控制化学品名录》中. 我国《地表水环境质量标准》(GB3838-2002)、《生活饮用水卫生标准》(GB 5749-2006)、《城市供水水质标准》(CJ/T206-2005)中也规定了部分PAEs的限值. DEHP由于存在最多的健康和环境问题,已被归类为国际癌症研究机构(IARC)确定的可能对人类致癌的物质[13]. 尽管近几年来,PAEs在各类饮用水环境中的检出引起了人们的重视,研究范围涉及水源水、自来水和瓶装水等样品,但针对江苏省沿江城市居民住宅自来水的研究几近空白.
本研究选取江苏省不同区域居民自来水中的PAEs作为研究对象,分析PAEs的污染特征,检验加热煮沸过程对自来水中的PAEs是否具有去除效果,评估经口摄入的人体健康风险,以期为全省饮用水健康安全管控提供科学支撑.
-
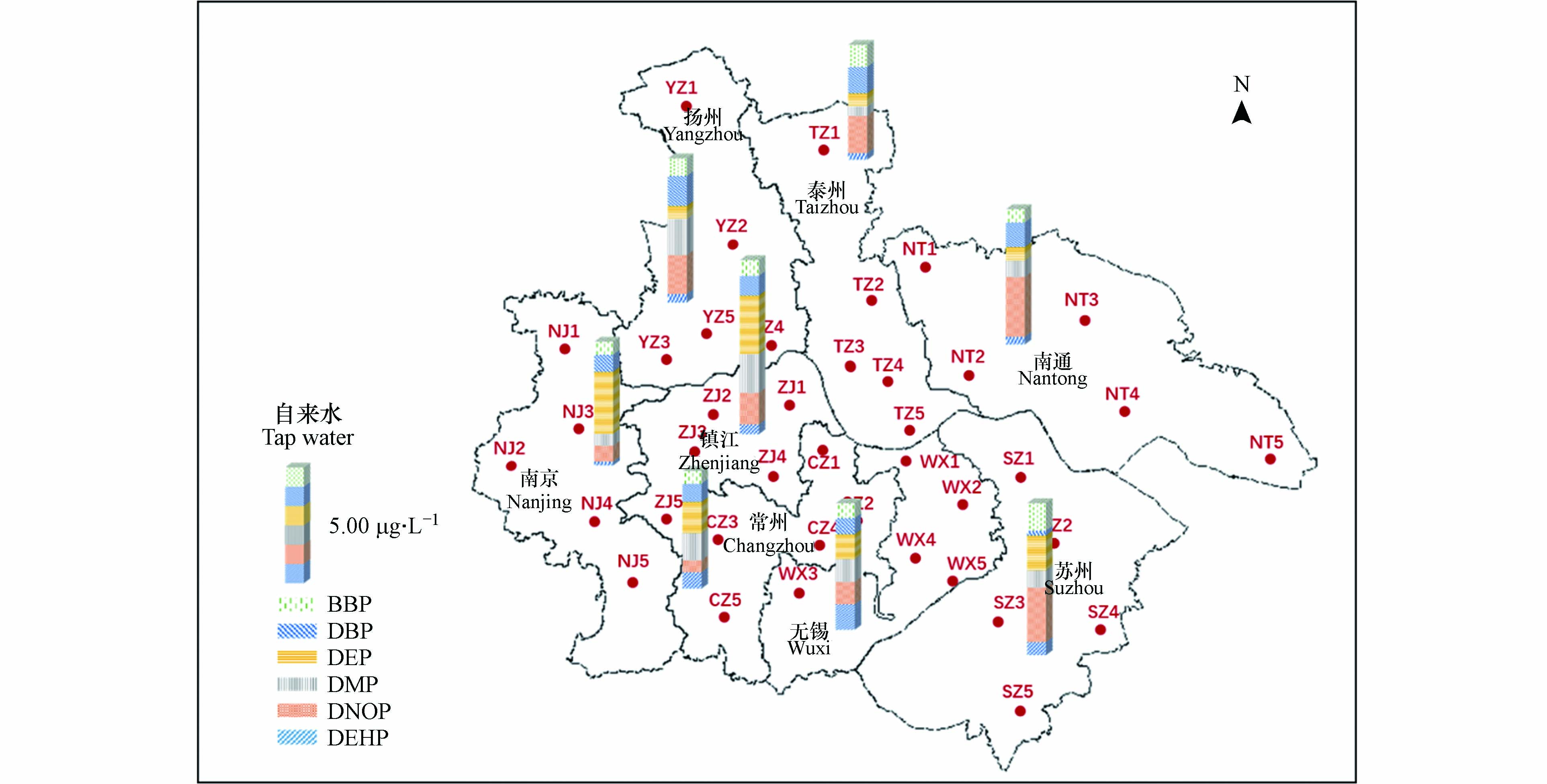
于2017年3月至4月,分别采集江苏省沿江8市(南京、无锡、常州、苏州、南通、扬州、镇江、泰州)居民住宅自来水,采样点位如图1所示. 每个城市选取5户居民进行取样(n=40),采样体积为2 L,所有水样均置于棕色玻璃瓶中,4 ℃避光保存,并于24 h内运回实验室分析. 为了研究加热煮沸过程对水中PAEs的去除效果,从每个城市选取两份水样在实验室煮沸,冷却至室温后保存待测(n=16).
-
超高效液相色谱/串联质谱(Waters Acquity/TQD),Masslynx工作站,ODS液相色谱柱(waters, BEH C18, 50 mm×2.1 mm, 1.7 μm);Milli-Q超纯水器(美国Millipore公司);HLB玻璃材质固相萃取柱(200mg/5cc,Waters,美国).
6种PAEs(DMP、DEP、DBP、BBP、DEHP和DNOP)混合标准品储备液,质量浓度为100 μg·mL−1(德国Dr. Ehrenstorfer公司),纯度在98.5%—99.5%之间;替代标准物氘代邻苯二甲酸二正丁酯(d4-DBP)和内标物氘代邻苯二甲酸二乙酯(d4-DEP),质量浓度均为100 μg·mL−1(美国Accustandard公司),实验用甲醇、正己烷、乙腈、丙酮等试剂均为农药级或LC-MS级.
-
取1L水样,加入回收率指示物(d4-DBP),以10 mL·min -1的流速通过HLB固相萃取柱. 上样前依次用10 mL乙醚、5 mL乙腈和5 mL超纯水活化萃取柱. 水样过柱后,用高纯氮气吹干HLB小柱,再用体积95:5的乙醚-乙腈溶液进行洗脱,收集洗脱液,氮吹浓缩至近干,用乙腈定容至1 mL,加入内标化合物(d4-DEP)后置于进样瓶中,等待进样.
-
本研究采用超高效液相色谱/串联质谱仪(Waters Acquity/TQD)、BEH C18色谱柱(50 mm×2.1 mm,1.7 μm)对目标化合物进行定性和定量分析. 进样量为10 μL,流动相为水(A相,含0.2%甲酸)和甲醇(B相),流速为0.4 mL·min−1,色谱柱温度为40 ℃,流动相梯度设置如下: 0 min,A相比例为90%,保持2 min; 2—12 min,A相比例由90%降为0%,保持4 min; 16—18 min,A相比例恢复至60%. 质谱采用电喷雾离子源(ESI),正离子扫描方式,多离子反应监测(MRM)模式,监测条件见表1. 离子源温度120 ℃,毛细管电压4.0 kV,去溶剂温度400 ℃.
-
实验过程中发现采用液质联用分析PAEs时,存在较大的系统空白干扰,为解决该问题,参考已有研究方法并进行优化完善[14]:在液相输液泵和进样阀之间加入一根吸附分配柱,通过六通阀切换,流动相经过该分配柱后,进入定量环,将定量环中样品带入色谱柱进行分离分析; 由于色谱系统产生的干扰经过吸附分配柱后可以进行短暂的吸附保留,再进入色谱柱,而定量环中的样品则直接经过色谱柱被吸附保留. 因此,系统产生的干扰和目标化合物可以产生出峰时间差,从而减少误差干扰.
实验过程中避免使用塑料和橡胶器皿,所使用的玻璃容器均在马弗炉中400 ℃高温烘烤4 h后经正己烷、丙酮和乙腈清洗. 所有水样均添加回收率标样,每5份样品添加1个程序空白. 自来水中6种PAEs的加标回收率范围为86.5%—109%. 以3倍空白水样加标样测定结果的标准偏差计算各种物质的方法检出限(detection limit,DL),6种PAEs化合物的DL范围为0.1—0.5 μg·L−1.
-
本研究采用美国环保署(USEPA)推荐的水环境健康风险评价模型,分别评估了通过饮用水途径暴露的DEHP致癌风险和∑PAEs非致癌风险. 通过饮用水摄入的日均PAEs剂量(CDI)可以通过公式(1)计算:
式中, CDI为每天通过饮水摄入的PAEs平均剂量(mg·kg−1·d−1); C为饮用水中PAEs的含量(mg·L−1); IR为每日饮用水的摄入量(取2 L·d−1); BW为人均体重(取60 kg).
通过饮用水途径暴露的DEHP致癌风险(RDEHP)通过公式(2)计算:
式中,SF为经口摄入致癌斜率因子,DEHP的SF值为0.014 kg·d·mg−1.
PAEs非致癌风险采用危险指数(HI)进行评估,通过公式(3)计算:
式中,RfD为法规或指南中给出的PAEs非致癌危害的参考剂量(mg·kg−1·d−1),DEP、BBP、DBP、DNOP和DEHP的RfD分别为0.8、0.2、0.1、0.01、0.02 mg·kg−1·d−1,DMP缺少RfD参考剂量数据,HI小于1表示处于安全范围.
-
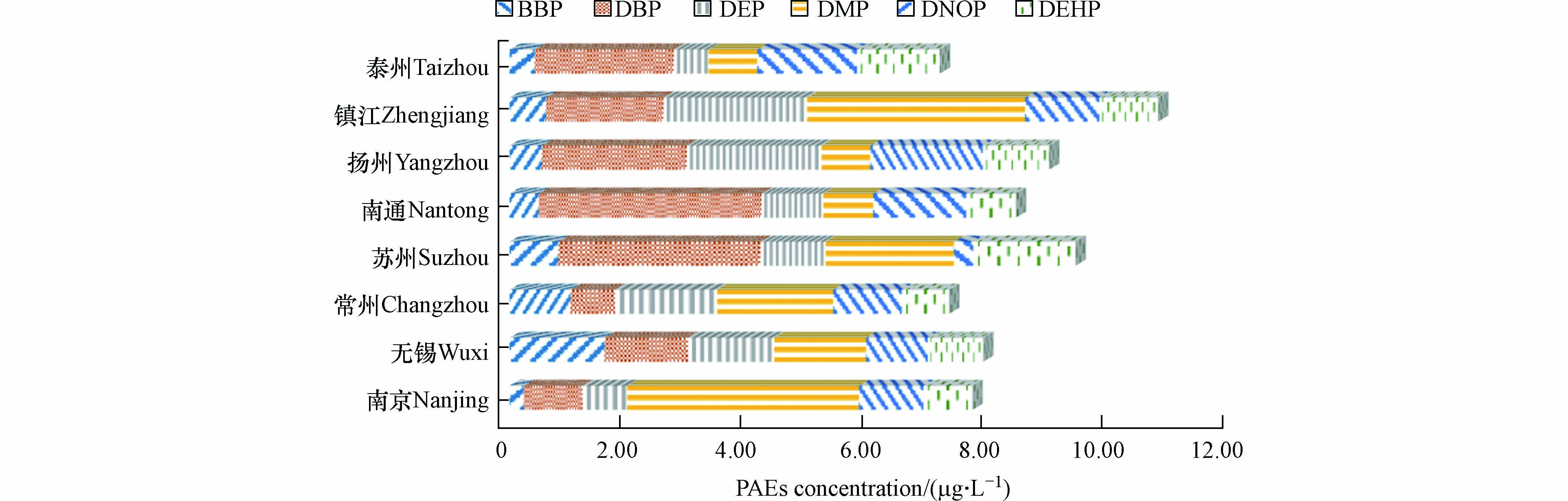
江苏省8个城市居民自来水水样中PAEs检出率为100%,PAEs含量如图2所示,∑PAEs检出范围为4.10—14.23 μg·L−1,平均值为(8.43±2.76)μg·L−1,其中镇江市自来水中∑PAEs含量最高,达到(10.76±2.10)μg·L−1,苏州市其次((9.39±2.08)μg·L−1),泰州市最低((7.14±3.39)μg·L−1).
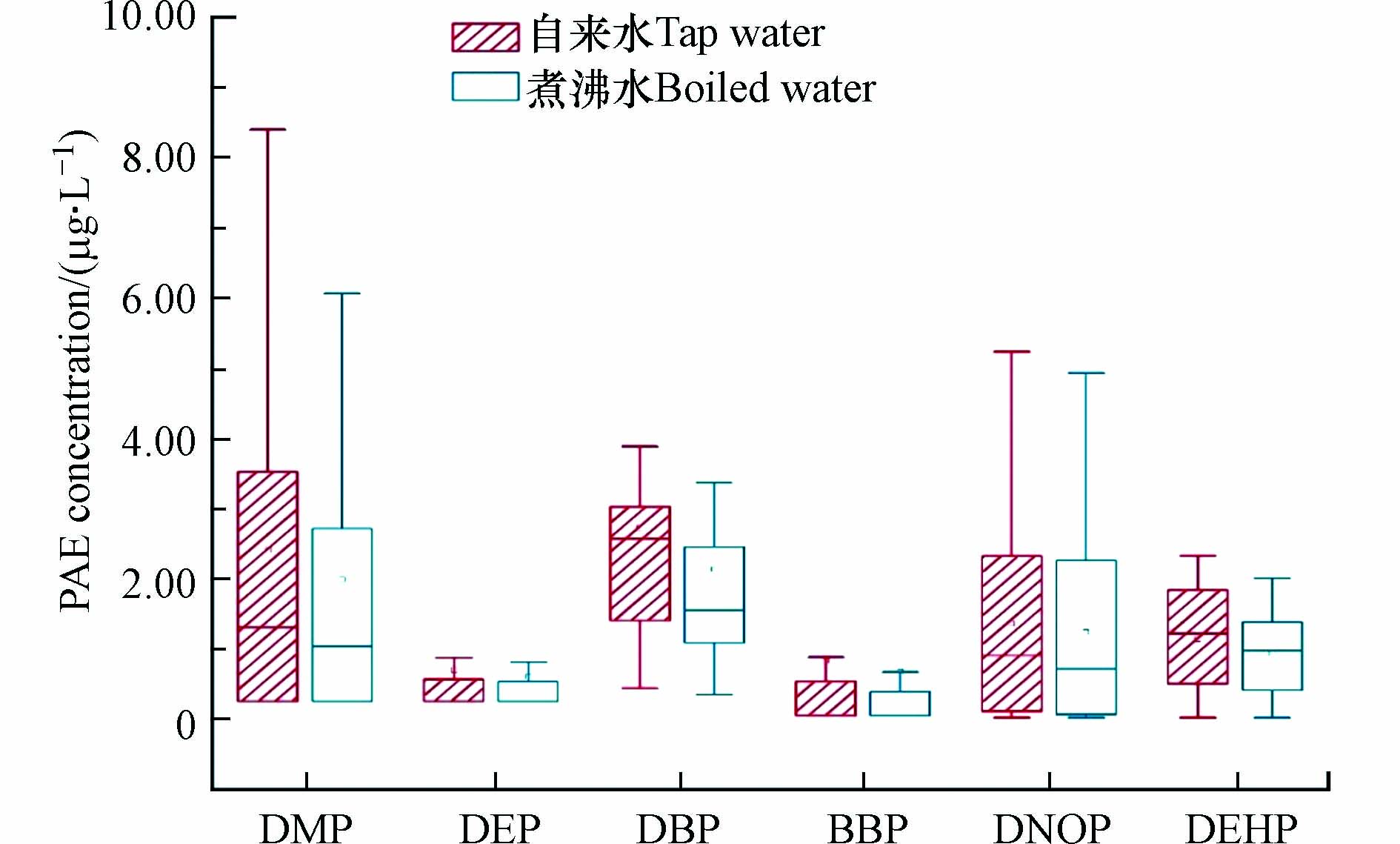
DBP在所有水样中均有检出,且平均含量最高((2.10±1.65)μg·L−1),17.5%的自来水样品中DBP浓度超过《生活饮用水规范》(GB5749-2006)限值(3 μg·L−1). 所有自来水样品中DEHP浓度均未超过《生活饮用水规范》(GB5749-2006)与世界卫生组织(WHO)《饮用水水质准则》限值(8 μg·L−1)或美国瓶装水中的标准限值(6 μg·L−1)[15],说明江苏省部分城市居民自来水已受到PAEs污染,存在一定的潜在健康风险,该结论与我国其他已有研究结果相似[16-17]. 然而,根据美国环保署1997年出台的饮用水法规和健康建议,由于DEHP致癌性,美国对DEHP的最终管理目标是零暴露风险[18]. 同时有研究表明,长期饮用含有微量PAEs的水,即使其含量满足饮用水标准,也可能对人体健康造成危害[19-20]. 从组成成分来看,DBP和DMP是造成自来水中PAEs含量差异的最主要因素.
表2列出了全球其他国家和地区饮用水中PAEs的污染情况,本研究结果与沙特阿拉伯(0.2—30.8 μg·L−1)和墨西哥(0.6—45.1 μg·L−1)等国家瓶装水中PAEs的含量相近[5],比葡萄牙(0.02—0.35 μg·L−1)、法国(0.03—0.35 μg·L−1)和伊朗(0.07—0.52 μg·L−1)等西方国家自来水中浓度高近两个数量级[11,21-22],比我国天津市居民饮用水((2.41±0.39)μg·L−1)高一个数量级[23],但低于河南省的研究结果(0.24—82.2 μg·L−1)[24],这与河南饮用水取样点位受到污染河流水平扩散、垂直渗透和雨水溶解有关. 已有研究表明江苏居民自来水中PAEs来源广泛,包括水源水赋存、生产过程带入和塑料管道析出等[25].
图3比较了自来水与煮沸后冷却至室温的水样中PAEs的浓度,结果与其他研究类似[32],加热或煮沸后的自来水中,PAEs含量有所下降,但下降程度有限,其中DBP平均降低程度最高(21.6%),其次是BBP(18.6%),DNOP最低(9.1%). 值得注意的是,有研究报道,若将开水立刻倒入塑料杯,高温会加速塑料中PAEs的析出,导致饮用水中PAEs含量显著升高[23].
-
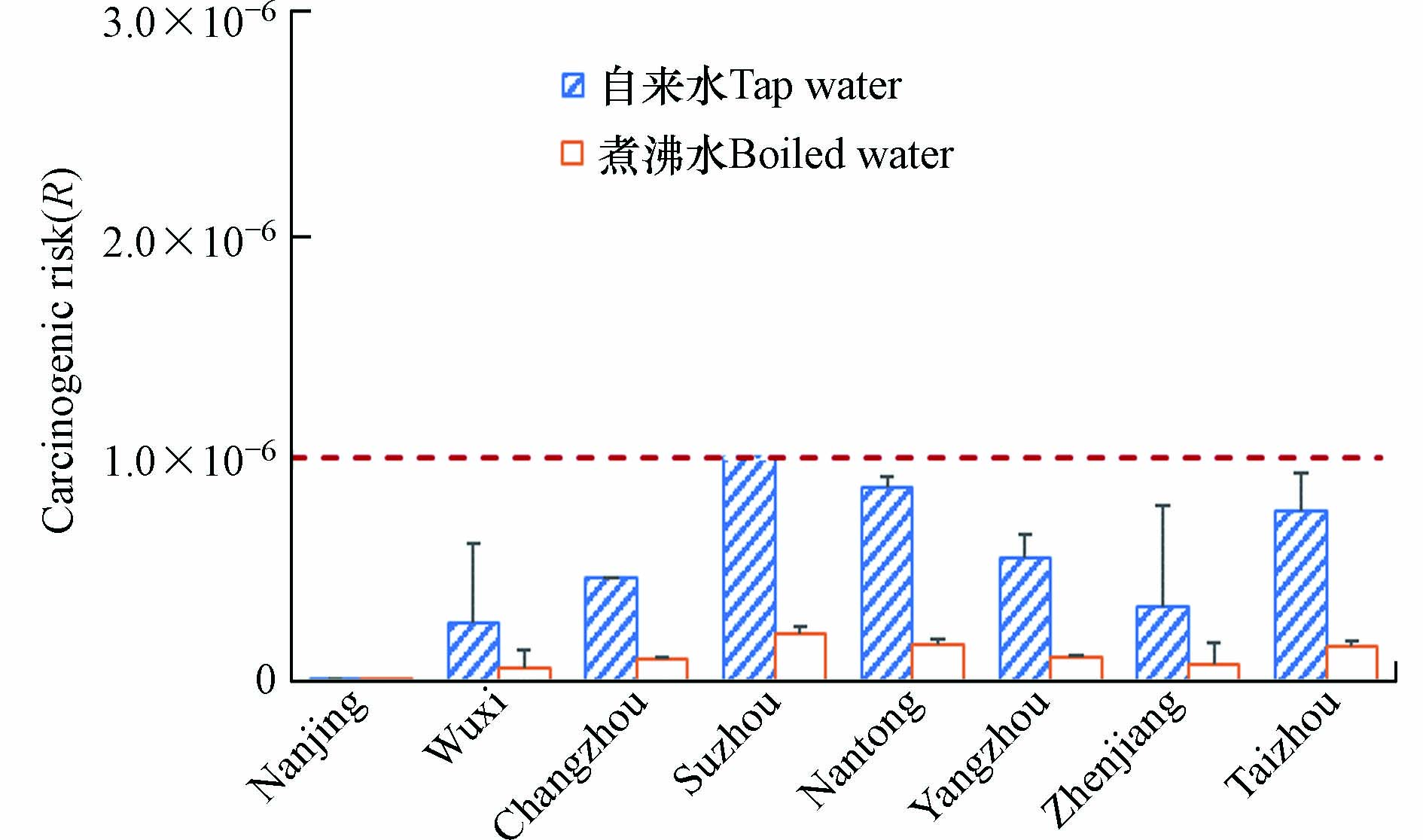
江苏省不同地区通过饮用水摄入导致的DEHP致癌风险如图4所示,所有自来水和煮沸冷却水中DEHP的致癌风险均低于USEPA推荐的健康风险可接受最大水平(1×10−6),其中苏州、南通和泰州水样中DEHP致癌风险较高. 煮沸后的自来水在一定程度上降低了DEHP的致癌风险,降幅达到78%. 但在高温情况下DEHP会从塑料包装中迁移至水体,导致DEHP的致癌风险有超过1×10−6的可能[23,33],另外随着储存时间的增加,水中DEHP的含量也会随之上升[22]. 因此,长期饮用存放在高温环境中的瓶装水,例如高温天气车内长时间放置的瓶装水,对人体健康危害极大,应引起高度重视.
-
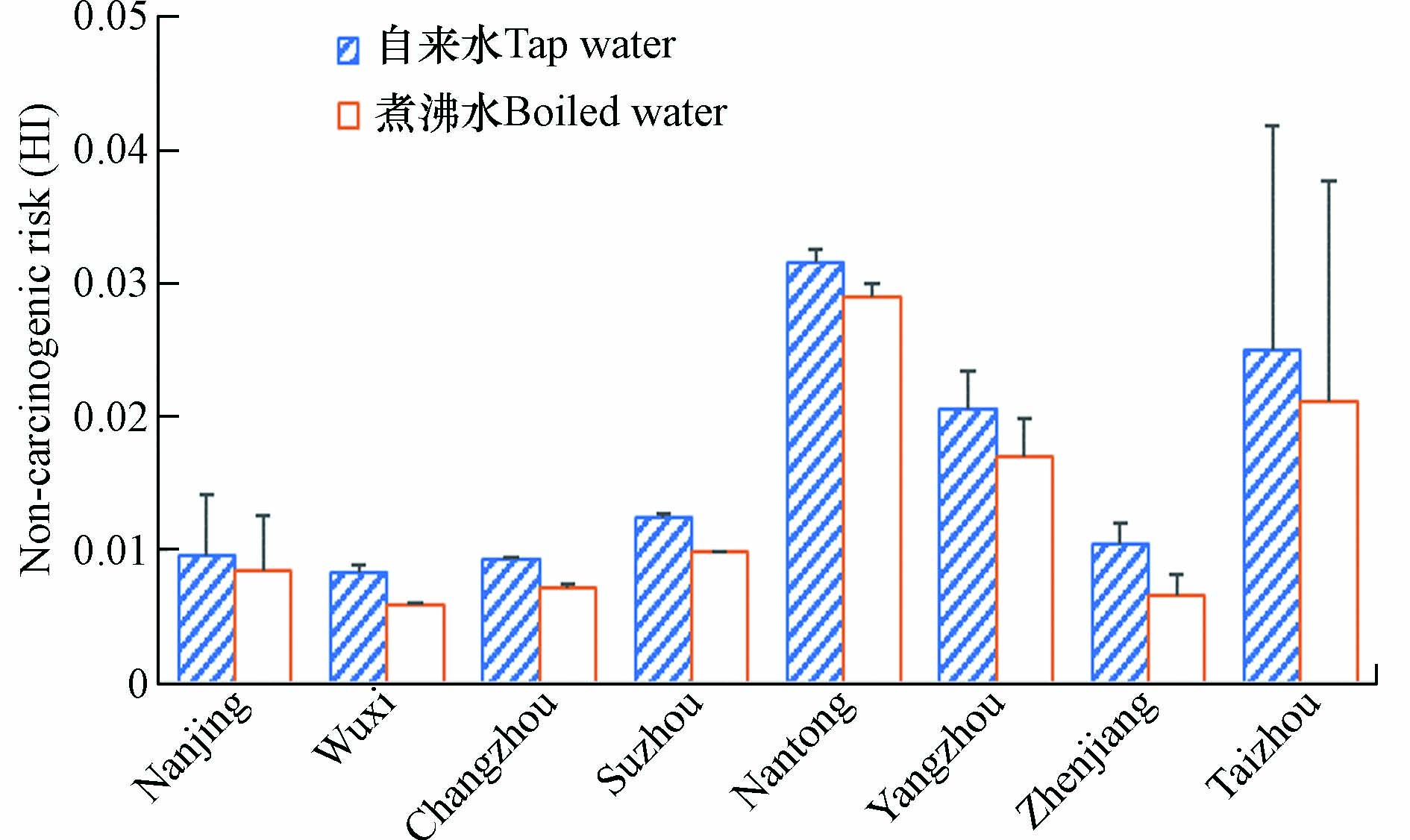
5种PAEs(DEP、BBP、DBP、DNOP和DEHP)的非致癌风险采用危险指数如图5和表3所示. 结果显示,江苏省8个城市自来水中∑PAEs的HI范围在8.26×10−3(无锡市)—3.25×10−2(南通市),均远小于1,表明江苏省不同地区自来水中PAEs摄入对人体造成的非致癌健康风险可忽略不计. 煮沸后的自来水PAEs非致癌风险与致癌风险变化情况类似,均有不同程度的降低,该结果与Wang[23]和Li[20]在天津市和黄海沿海城市的研究结果一致. DBP在自来水中占总非致癌风险的47.3%,而BBP和DEHP仅占1.60%和1.58%,该结果与天津市自来水中PAEs的非致癌风险占比(DEHP占比最大)有较大差别[23],主要原因是尽管DEHP毒性最大,但在江苏省8个城市自来水样中DEHP的含量相对较低,因此对∑PAEs非致癌风险贡献较小.
除了通过饮用水的暴露方式,PAEs还可以通过食物摄入和皮肤接触等途径对人体健康造成负面影响. 此外,自来水中可能存重金属、农药、消毒副产物和个人护理产品等多种污染物,它们之间的协同效应可能会对人体健康产生多重负面影响. 因此,建议进一步研究并持续监测这些化学物质在不同条件下的自来水和瓶装水中的赋存特征,以期更好地管控生态环境健康风险.
-
(1)江苏省8个城市40份居民自来水中均检出了PAEs,检出范围为4.10—14.23 μg·L−1,其中镇江市自来水中PAEs的含量最高. 与其他国家和地区相比,本研究区域自来水中PAEs含量处于中等偏上水平,其污染来源有待进一步明确.
(2)与自来水相比,煮沸后冷却至室温的水样在一定程度上降低了PAEs浓度和此类化合物的致癌风险与非致癌风险.
(3)研究区域内DEHP致癌风险指数小于最大可接受风险水平(1×10−6),∑PAEs的非致癌风险指数远小于1,但部分水样中DBP含量超过《生活饮用水规范》(GB5749-2006)限值,存在潜在的生态环境健康风险.
江苏省自来水中邻苯二甲酸酯的污染特征及风险评估
Pollution characteristics and health risk assessment of phthalate esters in tap water from Jiangsu Province
-
摘要: 为了解江苏省不同地区自来水中邻苯二甲酸酯(phthalate esters,PAEs)污染特征与风险水平,采用固相萃取-超高效液相色谱-三重四极杆质谱联用(SPE-UPLC-MS/MS)定性定量分析法,对江苏省沿江8市40户居民自来水中6种优控PAEs进行检测,分析了PAEs的污染水平,并开展人体健康风险评估. 结果表明,PAEs在40份水样中均有检出,∑PAEs检出范围为4.10—14.23 μg·L−1,平均值为(8.43±2.76)μg·L−1. DBP和DMP是自来水中PAEs的主要组成成分,约占∑PAEs总浓度的50%,其中DBP检出率为100%. 与全球其他国家和地区相比,江苏省居民自来水中PAEs浓度处于中等偏上水平. 加热煮沸过程可以降低自来水中PAEs浓度,但程度有限. 健康风险评估结果显示,研究区域内DEHP的致癌风险指数均小于最大可接受风险水平(1×10−6),∑PAEs的非致癌风险指数处于8.18×10−3—1.92×10−2,远小于1. 江苏省沿江8市居民自来水已受到不同程度的PAEs污染,且有部分点位DBP浓度超过《生活饮用水规范》(GB5749-2006)限值(3 μg·L−1),存在潜在的健康风险.Abstract: Jiangsu were overall high compared with other countries and regions around the world. Heating and boiling process could reduce the PAEs content in tap water, but to a limited extent. The results of the health risk assessment showed that the carcinogenic risk indexes of DEHP in this study area were overall below the maximum acceptable risk level of 1×10−6. The non-carcinogenic risk indexes of ∑PAEs were in the range of 8.18×10−3—1.92×10−2, much lower than 1. To conclude, tap water from 8 cities along the Yangtze River in Jiangsu Province has been polluted by PAEs by varying degrees. In addition, the concentration of DBP at some points has exceeded the limit (3 μg·L−1) of ‘Standard for Drinking Water Quality’(GB5749-2006), which has posed a potential health risk to human beings.
-
Key words:
- phthalate esters /
- tap water /
- health risk assessment /
- Jiangsu Province.
-
抗生素的大量使用使得其会通过直接或间接途径进入水体引起污染. 四环素(TC)是水体检出浓度和检出频率最高的抗生素之一[1]. 水体中的四环素会诱导微生物逐渐产生抵抗力,造成抗药性菌群和抗性基因的产生[2]. 常规生物法、生物电化学法、高级氧化法、膜分离法、吸附法、微生物降解等是水体中四环素去除的主要方法[3-6] . 其中,高级氧化法(AOPs)已经被证明能有效的去除水中的四环素,因为具有高度活性的自由基的存在,包括硫酸根自由基(
SO−4⋅ 基于
SO−4⋅ SO−4⋅ SO−4⋅ 研究显示,生物炭有作为高级氧化反应催化剂的潜力[12]. 但是原状生物炭的催化能力有限,需要对原状生物炭进行改性以进一步提升其对污染物的降解效果[13]. 其中,生物炭负载铁作为催化剂的研究报道最多,因为纳米铁氧化物能有效的启动催化降解反应[14]. 过渡金属活化PMS可以在常温常压下进行,且反应迅速、操作简便,被认为是活化效果最好的一种活化方式. 但同时在反应过程中也存在着过渡金属易团聚、重复利用性差和金属离子流失等问题[15]. 因此,如何改性提升生物炭的催化降解能力亟需进一步研究. 与此同时,氮改性生物炭也引起了更多关注,因为引入了含氮官能团和可以改变生物炭的结构[16]. 氮修饰生物炭更多的应用于生物炭的催化降解领域[17],因为氮具有局部未成对电子:(1) 改善周围碳原子的电子密度;(2)提高共轭增强sp2碳中π电子流;(3)进入更多的官能团和缺陷;(4)增加碳材料的表面亲水性能有效的结合极性吸附质. 因此,可以考虑铁氮共改性以提升生物炭的降解性能.
近年来,铁氮共改性生物炭在高级氧化领域的应用也逐渐引起了研究,作为催化剂被用于降解废水中有机污染物,包括酸性橙7 [18]、异丙甲草胺[19]、罗丹明B [20]、双酚A [21-22]、双酚F [23]和磺胺噻唑 [24]. 仅有Yu等[25]研究了铁氮改性生物炭活化过硫酸盐(PS)降解四环素的效果及机理. 上述研究均显示铁氮共改性碳材料可以有效的降解废水中的有机污染物. 然而,铁氮共改性生物炭活化PMS降解TC的研究报道还较少,降解的机理也尚不清楚.
因此,本研究以典型的农林废弃物—水稻秸秆为对象,选择氯化铁、尿素为改性剂,通过热解制备出铁氮改性生物炭,同时制备原状生物炭作为对照,对生物炭进行SEM、TEM、BET、EA、XPS、FTIR、Raman和VSM进行全面的表征,考察铁氮改性对生物炭理化性质的影响,探究对水体中四环素的降解行为及机理,以期为秸秆的资源化的利用及水体中四环素的去除提供理论依据和技术参考.
1. 材料与方法 (Materials and methods)
1.1 实验材料
水稻秸秆来自安徽合肥郊区农田,将秸秆水洗去除灰尘,放入烘箱80℃烘干,之后用破碎机破碎后过40目筛,保存备用.
四环素(tetracycline,TC,购于上海源叶生物有限公司)、FeCl3·6H2O、尿素、甲醇、叔丁醇、糠醇、对苯醌、碘化钾、NaOH 、HCl均为分析纯,购于国药集团化学试剂有限公司.
1.2 改性生物炭的制备
将5 g水稻秸秆与0.1 mol·L−1 (FeCl3·6H2O)、0.1 mol·L−1尿素在100 mL水溶液中混合,放在磁力搅拌器上搅拌24 h后放入烘箱80 ℃烘干. 将烘干的混合固体盛于石英舟中,放置于管式马弗炉中(OTF-1200X-S,合肥科晶材料技术有限公司),700 ℃下热解(全程氮气保护),升温速率为5 ℃·min−1,保温2 h,待温度降至室温时,取出生物炭,对生物炭进行水洗,至洗脱接近中性后在烘箱中烘干. 最后进行球磨1 min后制得铁氮改性水稻秸秆生物炭(Fe-N-RSBC). 同时,制备原状水稻秸秆生物炭作为对照(RSBC).
1.3 生物炭对四环素的降解试验
(1)吸附体系:将100 mL含TC (浓度为50 mg∙L−1)的溶液置于锥形瓶中,然后加入0.02 g生物炭,将锥形瓶置于在摇床上,摇床转速为150 r·min−1. 分别在 0、5、10、20、30、40、50、60、90 min取样测定,并通过0.45 μm的膜过滤. 用紫外分光光度计(UV-5100B, 上海元析仪器有限公司)测量上清液的吸光度,波长设定为358 nm. TC浓度选择50 mg·L−1的原因是:有的药厂或畜禽养殖废水抗生素的浓度确实很高;凸显铁氮生物炭的吸附降解效果;便于仪器测定.
(2)PMS降解体系(没有添加生物炭):将100 mL含TC (浓度为50 mg·L−1)的溶液置于锥形瓶中,将锥形瓶置于在摇床上,摇床转速为150 r·min−1. 添加0.2 mL PMS (浓度为1 mmol·L−1),0、5、10、20、30、40、50、60、90 min取样测定 (预先加入1mL硫代硫酸钠作为淬灭剂),并通过0.45 μm的膜过滤. 用紫外分光光度计(UV-5100B, 上海元素仪器有限公司) 测量上清液的吸光度,波长设定为358 nm.
(3)生物炭催化降解体系(添加生物炭):将100 mL含TC (浓度为50 mg∙L−1)的溶液置于锥形瓶中,添加0.02 g生物炭,将锥形瓶置于在摇床上,摇床转速为150 r·min−1. 之后再添加0.2 mL PMS启动反应,在0、5、10、20、30、40、50、60、90 min取样测定(预先加入1mL硫代硫酸钠作为淬灭剂),并通过0.45 μm的膜过滤后测定.
(4)不同影响因素
溶液初始pH值:将100 mL含TC (浓度为50 mg∙L−1)的溶液置于锥形瓶中. 使用0.1 mol·L−1 NaOH或0.1 mol·L−1 HCl调整溶液的pH为3.0、5.0、7.0、9.0和11.0. 随后,0.02 g Fe-N-RSBC加入到溶液中,进行振荡,进行60 min预吸附后,随后加入0.2 mL PMS,启动降解实验,其它条件同上.
生物炭量:将100 mL含TC (TC浓度为50 mg∙L−1)的溶液置于锥形瓶中. 分别加入0.005、0.01、0.02、0.025 g Fe-N-RSBC加入到瓶中进行振荡,60 min预吸附之后,再加入0.2 mL PMS,启动降解实验,其它条件同上.
PMS量:将100 mL含TC(浓度为50 mg∙L−1)的溶液置于锥形瓶中. 随后,0.02 g Fe-N-RSBC加入到瓶中的溶液中,将锥形瓶置于150 r·min−1的摇床上,进行60 min预吸附,之后分别加入0.1、0.2、0.25、0.3 mL PMS,启动降解实验,其它条件同上.
TC初始浓度:将不同浓度的含TC(浓度为30、50 、75、100 mg∙L−1)溶液置于锥形瓶中. 随后,向锥形瓶的溶液中加入0.02 g Fe-N-RSBC,进行振荡,进行60 min预吸附之后,再加入0.2 mL PMS,进行降解实验,其它条件同上.
阴离子类型:将100 mL含阴离子的TC(浓度为50 mg∙L−1)的溶液置于锥形瓶中, 阴离子类型为Cl−、
H2PO−4 NO−3 CO2−3 1.4 生物炭表征
采样扫描电镜(SEM,SU8010, Hitachi, Japan)和透射电镜(TEM, TecnaiG2F20S-TWIN, 200KV)对生物炭的表面形貌和结构进行观察. 生物炭的晶体结构采用X射线衍射(XRD, Bruker D8 Advance, Germany)测定. 生物炭的比表面积、孔体积和孔尺寸采用比表面积和孔径分析仪(Micromeritics, Tristar II 3020, USA)测定. 采用元素分析仪( Elementar Vario EL cube,Germany) 测定秸秆生物炭中C、N、H和的含量. 灰分测定: 称取一定量的生物炭置于箱式马弗炉中700 ℃燃烧2 h,冷却至室温后称量,根据质量差计算灰分含量. 采用傅里叶变换红外光谱(FTIR,Nicolette is50,Thermo Fourier, USA )分析表征生物炭的官能团类型. 利用X光电子能谱分析表征(XPS, Thermo-VGScientific, ESCALAB250, USA)生物炭的表面元素及化学形态. 采用Zeta电位仪(DelsaMax PRO, Beckman Coulter, USA )测定生物炭的zeta电位. 采用Raman光谱进行表征(DXR Raman microscope; Thermo Fisher Scientific, Madison, WI, USA)生物炭的碳缺陷结构.
1.5 机理实验
(1)活性氧化剂抑制实验
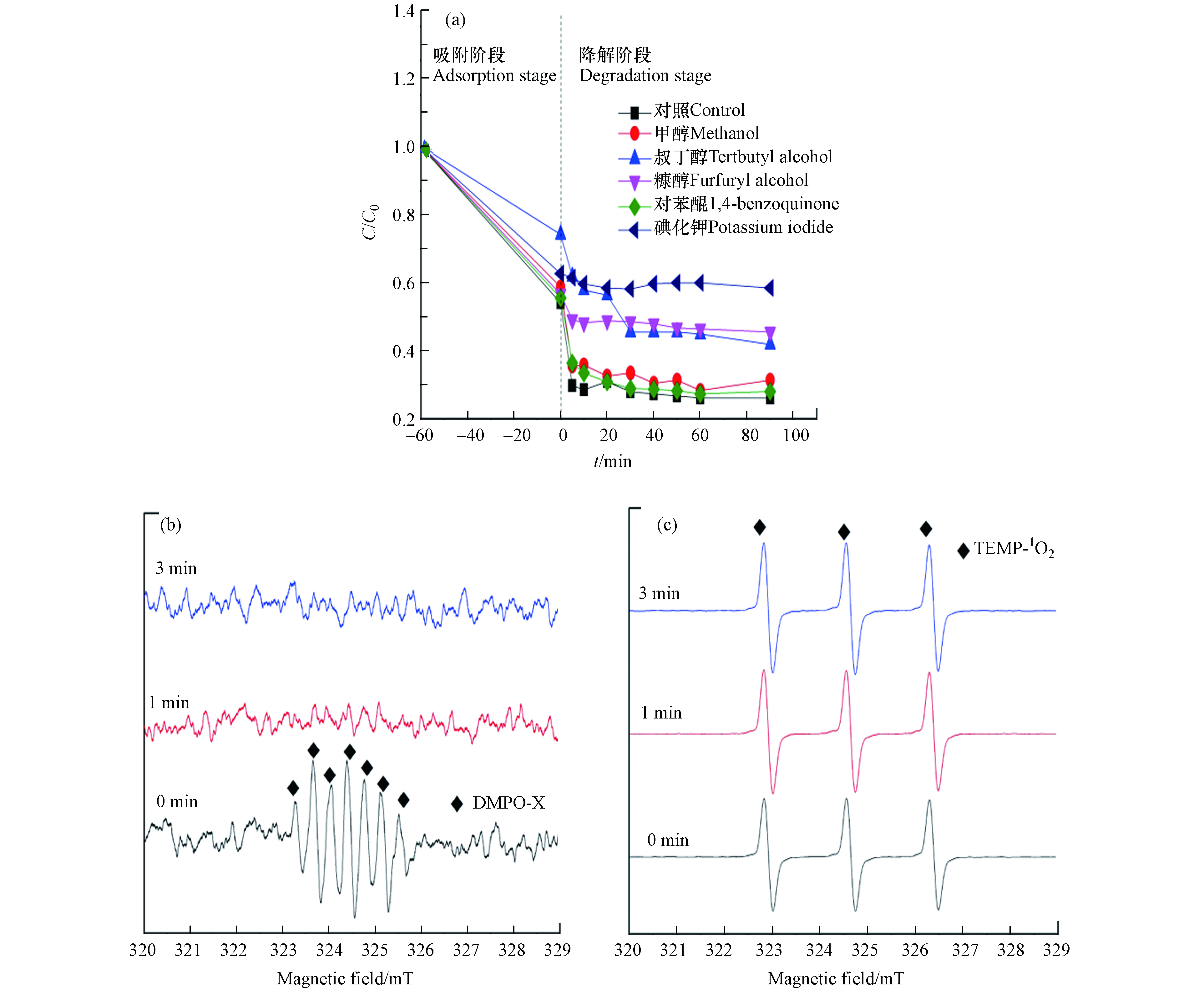
将100 mL含TC (50 mg·L−1)的溶液置于一系列锥形瓶中,之后分别加入0.02 g Fe-N-RSBC,添加甲醇(1 mol·L−1)、糠醇(20 mmol·L−1)、对苯醌(20 mmol·L−1)、叔丁醇(1 mol·L−1)、碘化钾(20 mmol·L−1)作为活性氧物种抑制剂. 将锥形瓶置于的摇床上振荡,进行60 min预吸附实验, 之后加入0.2 mL PMS启动降解实验,分别在0、5、10、20、30、40、50、60、90 min时取样(取样瓶中预先加入1 mL淬灭剂). 并通过0.45 μm的膜过滤后测定.
(2)EPR测定实验
在10 mL溶液中提前加入TEMP和DMPO,分别0.002 g Fe-N-RSBC,之后加入0.2 mL的PMS启动反应,振荡反应时间3 min,采用电子顺磁共振波谱仪(EPR)测定活性氧物种类型(JEOL JES-FA200,Tokyo, Japan).
1.6 生物炭的再生利用和适用性实验
将降解反应完成后的Fe-N-RSBC通过磁分离之后,水洗并烘干,开展再生利用实验,共进行3次. 再生利用降解的实验条件是:将100 mL含TC (浓度为50 mg∙L−1)的溶液置于锥形瓶中,添加0.02 g生物炭,进行振荡,之后再添加0.2 mL PMS,0、5、10、20、30、40、50、60、90 min取样测定 (预先加入1 mL硫代硫酸钠淬灭剂),并通过0.45 μm的膜过滤后测定.
为验证材料的适用性,选择代表性的阳离子染料亚甲基蓝和阴离子染料橙黄Ⅱ,探究Fe-N-RSBC催化PMS降解染料的效果,降解实验条件: 将100 mL含染料废水 (浓度为50 mg∙L−1)的溶液置于锥形瓶中,添加0.02 g Fe-N-RSBC,进行振荡预吸附60 min, 之后再添加0.2 mL PMS,0、5、10、20、30、40、50、60、90 min取样测定 (预先加入1 mL硫代硫酸钠淬灭剂),通过0.45μm的膜过滤后用分光光度计测定,亚甲基蓝的测定波长为665 nm,橙黄Ⅱ的测定波长为484 nm.
2. 结果与讨论 (Results and discussion)
2.1 生物炭的表征
RSBC和Fe-N-RSBC的SEM、TEM和EDS mapping见图1.
由图1可见,原状秸秆生物炭中的存在无规则的杆状或梗状形态,但是也有一定的破碎,因为热解温度为700℃,秸秆中的大部分有机物都会热分解. Fe-N-RSBC中存在球状颗粒,但是可以看出明显孔隙结构更加发达,说明Fe、N能与秸秆组分之间反应从而促进秸秆热分解的更加彻底,使得生物炭更加碎片化. RSBC和Fe-N-RSBC的TEM见图1(c, d).
由TEM可见,RSBC性状不规则,呈现无定形形态,生物炭的碳层比较厚,有着明显的堆积. 黑色颗粒可能是生物炭中的矿物质组分. Fe-N-RSBC的碳层也比较薄,黑色颗粒为铁氧化物,铁氧化物分布在炭结构中,也有铁分布在炭的外围. HR-TEM可以看出存在微孔结构. 铁氮改性导致炭基质更加规则平整规则,降低了碳结构的堆积和褶皱的性状. 从 Fe-N-RSBC 的 EDS mapping 图可见,Fe 和 N 较为均匀的分布在生物炭的表面.
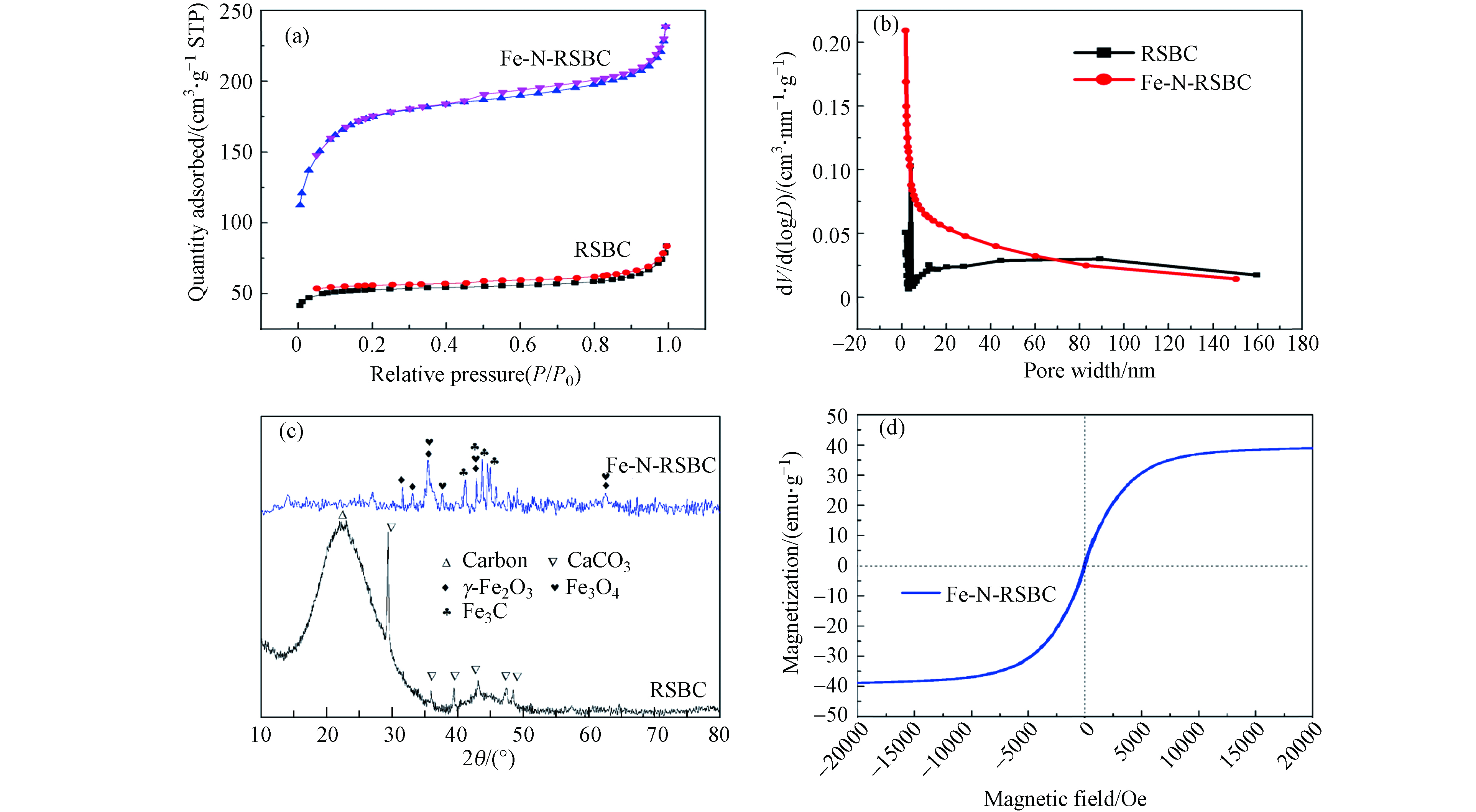
RSBC和Fe-N-RSBC的N2吸附-解吸曲线及孔径分布图见图2(a). RSBC及Fe-N-RSBC的N2吸附-解吸曲线都是典型的IV类型曲线,即高压处存在明显的滞后回线,说明都存在典型的介孔特性. 从孔径分布曲线(图2(b))可以看出,RSBC和Fe-N-RSBC的主要孔径分布在2—4 nm,也证实了RSBC和Fe-N-RSBC的介孔分布特性. 可以看出,Fe-N-RSBC的孔体积也大于RSBC.
RSBC和Fe-N-RSBC的XRD见图2(c). 如图2所示,RSBC在22°和44°附近分别是无定形碳和石墨碳结构[26]. 此外,RSBC中还含有CaCO3, 说明水稻秸秆中含有碱性元素. 铁氮改性之后生物炭中出现了γ-Fe2O3和Fe3O4,这也是导致铁改性生物炭具有磁性的原因. 铁氮改性之后出现还出现了Fe3C,说明氮的存在促进了铁的还原. 铁氮改性导致了铁进入了碳基质中形成Fe3C. 热解过程中铁的形态变化是:Fe3+→ Fe2O3→Fe3O4→Fe3C [27-28]. 可见,铁与氮的共改性会明显改性生物炭中碳的形态.
Fe-N-RSBC的磁滞曲线见图2(d),剩磁及矫顽力接近于零,判断Fe-N-RSBC为超顺磁性材料 [29]. Fe-N-RSBC的饱和磁化值38.99 emu·g−1,说明在外加磁场作用后,Fe-N-RSBC有良好的固液分离效果.
RSBC和Fe-N-RSBC的N2吸附-解吸曲线得到的比表面积和孔径参数见表1. 由表1可知,Fe-N-RSBC的比表面积达到606.62 m2·g−1, 微孔面积为341.29 m2·g−1 ,总孔体积为0.33 cm3·g−1,微孔体积为0.15 cm3·g−1,分别是原状生物炭的3.41倍、2.41倍、3.00倍和2.27倍. 铁氮改性之后平均孔径尺寸从2.48 nm降低2.21 nm. 从Vmicro/Vtotal比值可知,RSBC中以微孔和介孔为主,Fe-N-RSBC改性之后微孔所占比例降低到45.93%,介孔占据优势. 这与图2(b)一致. 生物炭比表面积和孔径参数与SEM和TEM的结果一致. 铁氮改性使得生物炭存在更多的介孔结构.
表 1 生物炭的比表面积及孔隙参数Table 1. Surface area and pore parameters of biochars生物炭 Biochar BET /( m2·g−1 ) Smicro /( m2·g−1 ) Vtotal /( cm3·g−1) Vmicro /( cm3·g−1) Vmicro/Vtotal/% 孔径/nmPore size RSBC 177.71 141.62 0.11 0.066 59.60 2.48 Fe-N-RSBC 606.62 341.29 0.33 0.15 45.93 2.21 热解过程中,Fe、N能与生物炭中的碳组分发生热化学反应,促进了生物炭的中纤维素、半纤维素和木质素的分解. 铁氮改性增加生物炭比表面积的原因是 [30]:氮原子能掺杂到碳原子的网格之中,同时铁降低了碳基质在炭化过程中的伸缩;尿素的热分解能产生气体,这些气体会破坏碳结构从而制造更多的孔隙;氮的存在能促进铁与基质碳之间的反应从而形成更多的微孔. 同时,铁改性提高生物炭的比表面积和孔体积因为铁进入了介孔炭之中,从而降低了炭化过程中基质炭的伸缩;热解过程中铁的催化作用,能促进孔隙结构形成,特别是介孔结构;铁催化能将相邻的碳材料气化成低分子气体,如CH4和CO等;铁氧化物覆盖生物炭上也能创造更多的孔隙结构 [31-34].
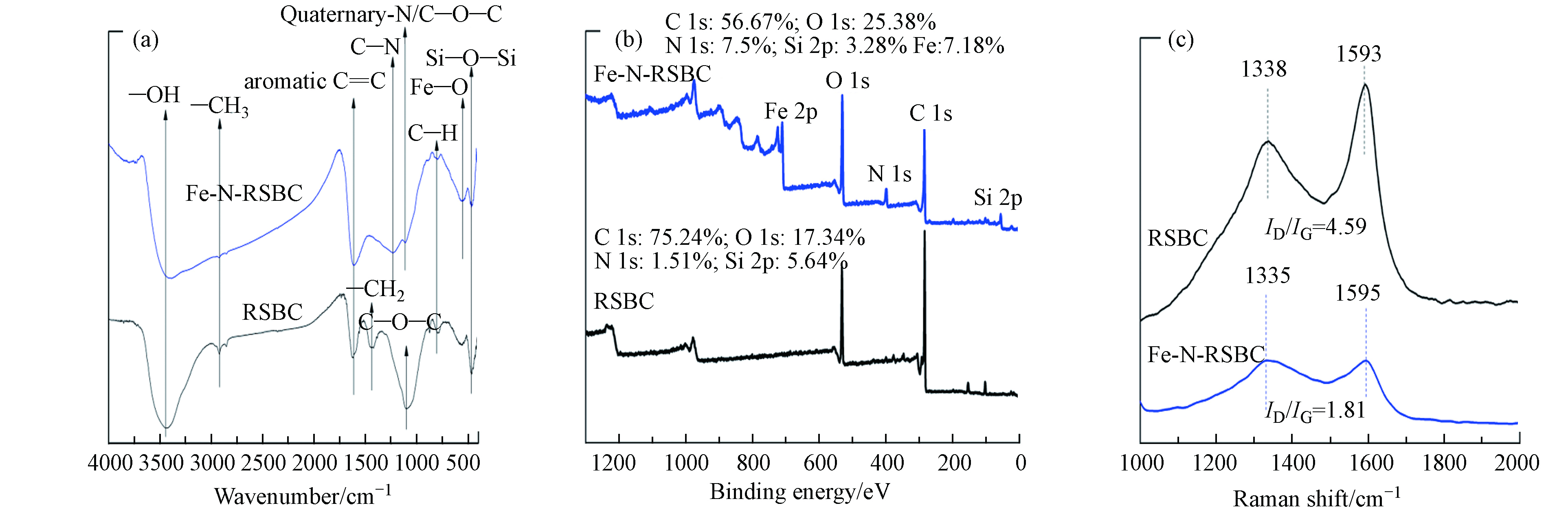
RSBC和Fe-N-RSBC的元素含量、原子比、灰分含量及zeta电位见表2. 与RSBC相比,Fe-N-RSBC中的C含量显著降低,而N含量明显上升,H和O含量略微增加,灰分含量也显著增加,灰分增加主要是因为铁氧化物的存在. 此外,铁氮改性还导致了zeta电位的明显变化,从-43.89 mV变为-29.45 mV. 生物炭的原子比H/C、O/C和(N + O) / C分别指示生物炭的芳香性、亲水性和极性大小. H/C比值越小则芳香性越高,O/C和(O+N)/C比值越大,则亲水性和极性越大. 由表2可知, 铁氮改性之后生物炭的亲水性和极性均增加了,有利于与水体中极性污染物的结合.
表 2 元素组成、灰分含量及表面电荷Table 2. Element, ash content and zeta potential生物炭Biochar 元素/%Element H/C O/C (N + O) / C 灰分/%Ash Zeta 电位/mVZeta potential C N H O RSBC 56.97 0.71 1.63 6.70 0.03 0.12 0.13 33.99 -43.89 Fe-N-RSBC 23.74 4.35 1.68 7.07 0.07 0.30 0.48 63.16 -29.45 O%=100%-C-N-H-ash RSBC和Fe-N-RSBC的FTIR见图3(a). 由图3可知,原状生物炭中含有的官能团包括—OH、—CH3、芳香C=C环拉伸、—CH2、C—O—C、C—H和Si—O—Si等官能团 [35]. 铁氮改性之后生物炭的官能团包括—OH(3385 cm−1)、芳香C=C环拉伸(1610 cm−1)、C—N 拉伸(1230 cm−1)、Quaternary−N/C—O—C (1113 cm−1)、Fe—O (551 cm−1)、Si—O—Si (468 cm−1). 铁氮改性部分保留了生物炭的芳香结构(1617 cm−1),但是生物炭的芳香结构弱化了因为Fe和N已经嵌入到了生物炭的碳结构中,这与TEM、XRD、元素分析比H/C的结果是吻合的. 可见,改性导致铁氮已经嵌入到碳基质中,并改变了生物炭的含碳和含氧官能团.
RSBC和Fe-N-RSBC的XPS图谱见图3(b). RSBC的表面能检测到 C 1s、O 1s、N 1s和Si 2p的存在. Fe-N-RSBC中还能明显检测到Fe 2p的存在. 与RSBC相比,Fe和N改性之后导致了生物炭表面元素相对含量发生明显变化. Fe-N改性生物炭表面氮和氮的相对质量分数分别为6.13%和4.33%. Fe改性后碳含量的降低, 说明改性导致铁氮负载到生物炭上,同时铁和氮已经成功嵌入到碳骨架.
拉曼光谱可用于分析生物炭的碳结构缺陷. RSBC和Fe-N-RSBC的拉曼光谱见图3(c). 如图所示,生物炭的Raman光谱有两个明显的特征峰. D峰(1350 cm−1附近)是由碳层结构中的缺陷导致的,代表了碳材料中乱层结构以及不小于6 个环的多环芳烃,在1575 cm−1 附近出现的峰称为G 峰,代表稠芳环结构以及类石墨微晶的sp2杂化振动 [36]. ID/IG(面积之比)可以用来表示碳结构的石墨化程度,比值越大表明碳结构缺陷越大. 如图3(c)所示,RSBC的ID/IG值为4.59, 且存在明显的D和G峰. 铁氮改性之后ID/IG值变成1.81,因为铁氮改性会明显影响G峰,铁和氮会嵌入到石墨碳结构,从而破坏石墨碳结构,与TEM、BET和XRD的结果是一致的. 研究发现铁氮改性会破坏材料的碳格网络,产生更多的缺陷 [37]. 也有研究发现氮改性导致了石墨碳结构的破坏,因为氮原子嵌入到碳网格中,导致碳结构的缺陷 [38]. 此外,Raman分析还发现铁氮改性导致了D峰和G峰位置的偏移. 可见,铁氮改性会影响无定形的碳结构和石墨碳结构,特别是石墨碳结构.
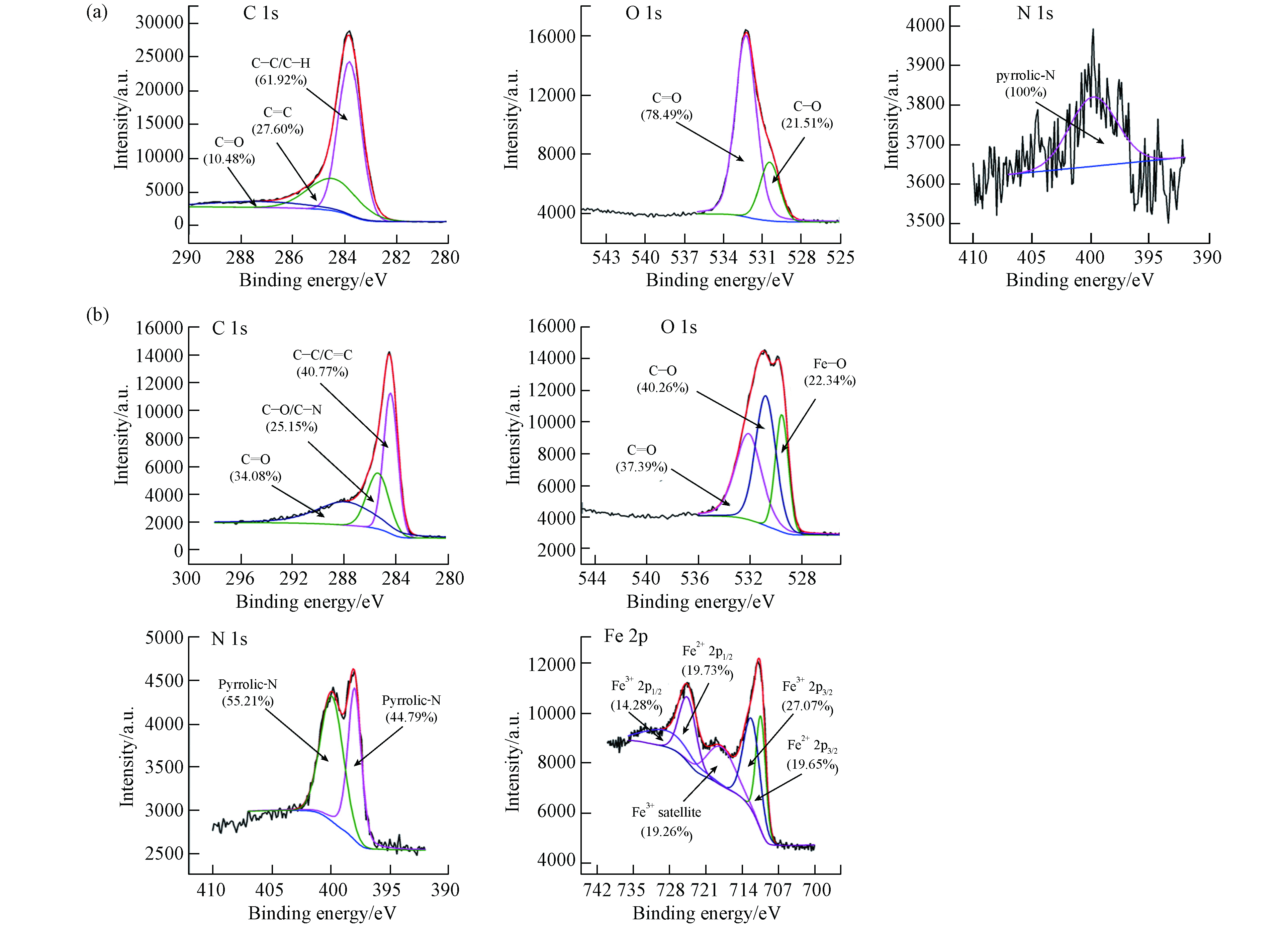
RSBC和Fe-N-RSBC的XPS分峰拟合见图4. RSBC的C分峰为283.8、284.5、287.3 eV, 分别对应C—C/C—H, C=C, C=O [39]. Fe-N-RSBC的C分峰为284.4 、285.37 、287.9 eV,分别对应C—C/C=C, C—O/C—N和C=O. RSBC中O以C—O和C=O形态存在. Fe-N-RSBC中O 分峰为C—O、C=O和Fe-O [40]. RSBC中N主要以pyrrolic-N形态存在. Fe-N-RSBC中N分峰为 pyrrolic-N和pyridinic-N. Pyridinic-N是形成是因为N取代了在石墨平面的C6环末端的C [41]. 可见,N掺杂到了碳结构中,这与XRD, Raman的结果相符合. Fe-N-RSBC中Fe 2p XPS分峰对应的是710.4、712.1、718、724.5、728.6 eV. Fe3+卫星峰的出现证实有Fe3+化合物的存在 [42],结合XRD结果,Fe2+和Fe3+的铁化合物为γ-Fe2O3、Fe3O4和Fe3C. 可见,铁氮改性导致了含碳、含氧、含氮和含铁官能团类型和所占比例的变化.
FeCl3改性生物炭的反应机理如下 [33]:
200—330 °C:
FeCl3+2H2O→FeOCl∙H2O+2HCl (g) (1) FeOCl∙H2O+2HCl(g)→FeOOH+3HCl(g) (2) 330—700 °C:
2FeOOH→Fe2O3+H2O (3) 6Fe2O3+C→4Fe3O4+CO2 (4) 尿素热分解的组分可进一步与碳的官能团反应,从而取代碳层表面的羰基和羟基,形成含氮官能团,具体的反应如下 [43- 44]:
CO(NH2)2→NH3*/NH2*/NH*+HCNO (5) NH3/NH2*/NH*+(―C=O) →―CO-NH2 (6) NH3/NH2*/NH*+(―C-OH) →―(C-NH2)+H2O (7) 综上可见,铁氮改性会明显改变生物炭的理化性质,使得生物炭具有更大的比表面积和孔体积、更多的微孔体积,赋予更丰富的官能团,并引入了磁性组分,但是破坏了部分石墨碳结构.
2.2 铁氮生物炭催化PMS对四环素的降解
不同体系下生物炭及PMS对四环素的去除见图5. 在90 min内,RSBC和Fe-N-RSBC对四环素的去除率为16%和50%(吸附过程),而PMS对四环素的去除率13%. 当PMS添加到RSBC,Fe-N-RSBC和四环素体系中,对四环素的去除率为59%和87%,其中前5 min的去除率分别为18%和80%. 可见Fe-N-RSBC催化PMS降解TC主要发生在初期阶段,因为存在大量的反应位点和活性氧化剂. 在吸附/降解体系中,150 min之内Fe-NRSBC/PMS对四环素的去除率可达87%.
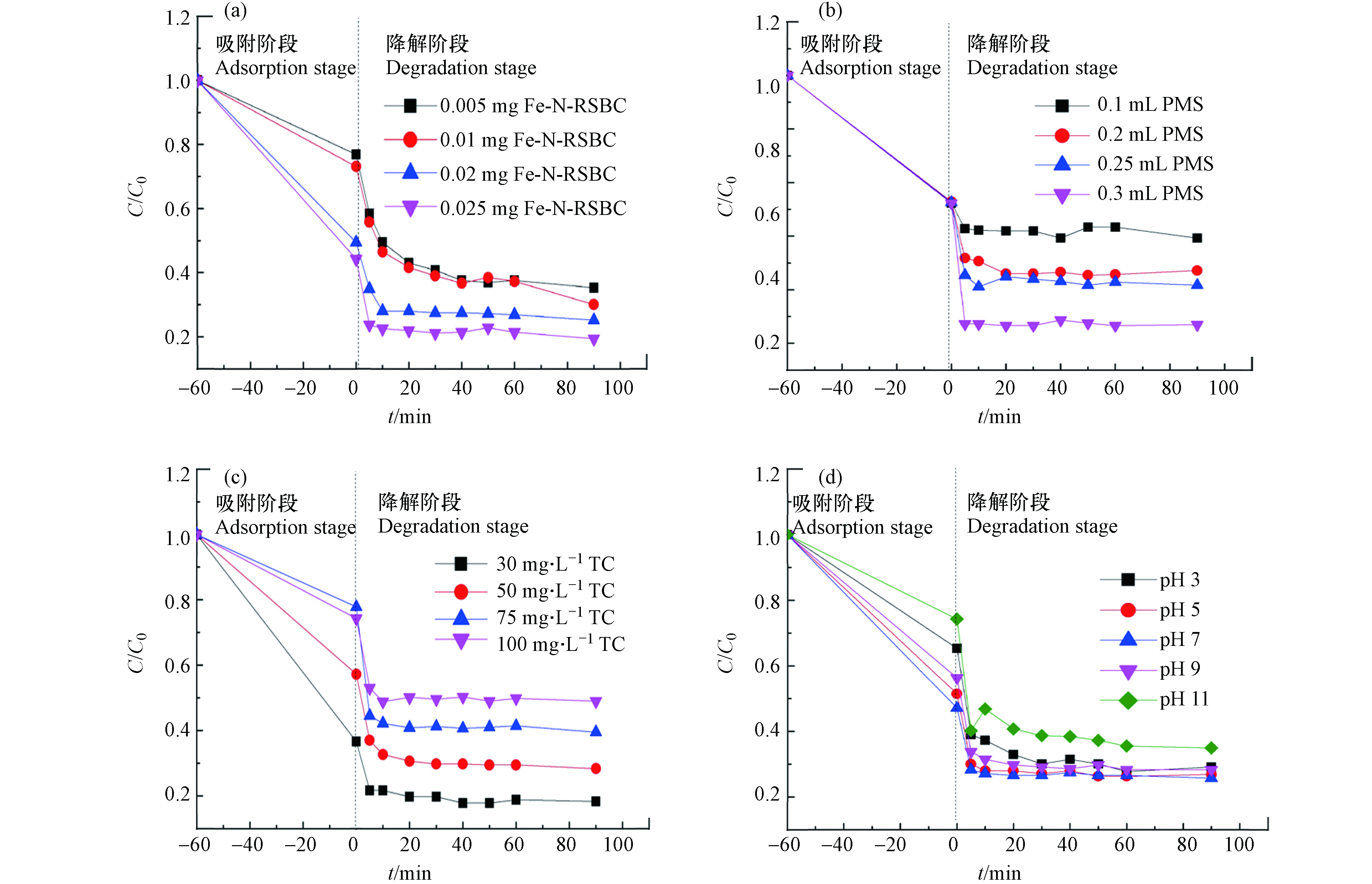
Fe-N-RSBC催化剂用量对四环素降解的影响见图6(a). 当加入PMS启动降解时,Fe-N-RSBC对TC的降解率为23%—43%. 添加量越大,对TC的去除率越高,当Fe-N-RSBC添加量为0.025 mg时,对TC的去除率可达80%以上. 显然, 催化剂用量提高可以提供更多的表面积和活性位点为TC的吸附和PMS活化;更高效的吸附可能导致降解加快;吸附的四环素迅速分解提供了更多的吸附位点激活PMS,从而促进TC的去除.
PMS用量对四环素降解的影响见图6(b). Fe-N-RSBC对TC在前60分钟的吸附率在50%. 当加入PMS启动降解时,Fe-N-RSBC对TC的降解率为13%—46%. PMS添加量越大,对TC的降解率越高,当PMS添加量为0.3 mL时,对TC的去除率可达95%以上. 因为,随着PMS浓度的增加,生物炭的表面会形成亚稳态PMS来降解污染物,或产生更多的活性氧物种(reactive oxidative species)来降解污染物.
四环素初始浓度对降解的影响见图6(c). 当加入PMS启动降解时,Fe-N-RSBC对TC的降解率为18%—37%. 初始浓度越低,对TC的去除率越高. 当TC浓度为30 mg∙L−1时,对TC的去除率可达80%以上. TC浓度越低,生物炭有更多的吸附位点来吸附四环素,加入PMS之后,也很快的能完成降解反应. TC浓度越高需要更多的活性氧物种来进行降解.
溶液初始pH对四环素降解的影响见图6(d). pH会影响Fe-N-RSBC对TC在前60分钟的吸附效果,pH为7时,吸附效果最好. 当加入PMS启动降解时,Fe-N-RSBC对TC的降解率为20%—40%,pH在3—9内下TC降解效果均较好. 碱性环境下降解效果略微下降的原因是:碱性条件下PMS降解效率降低可能是由于PMS在碱性条件下分解为
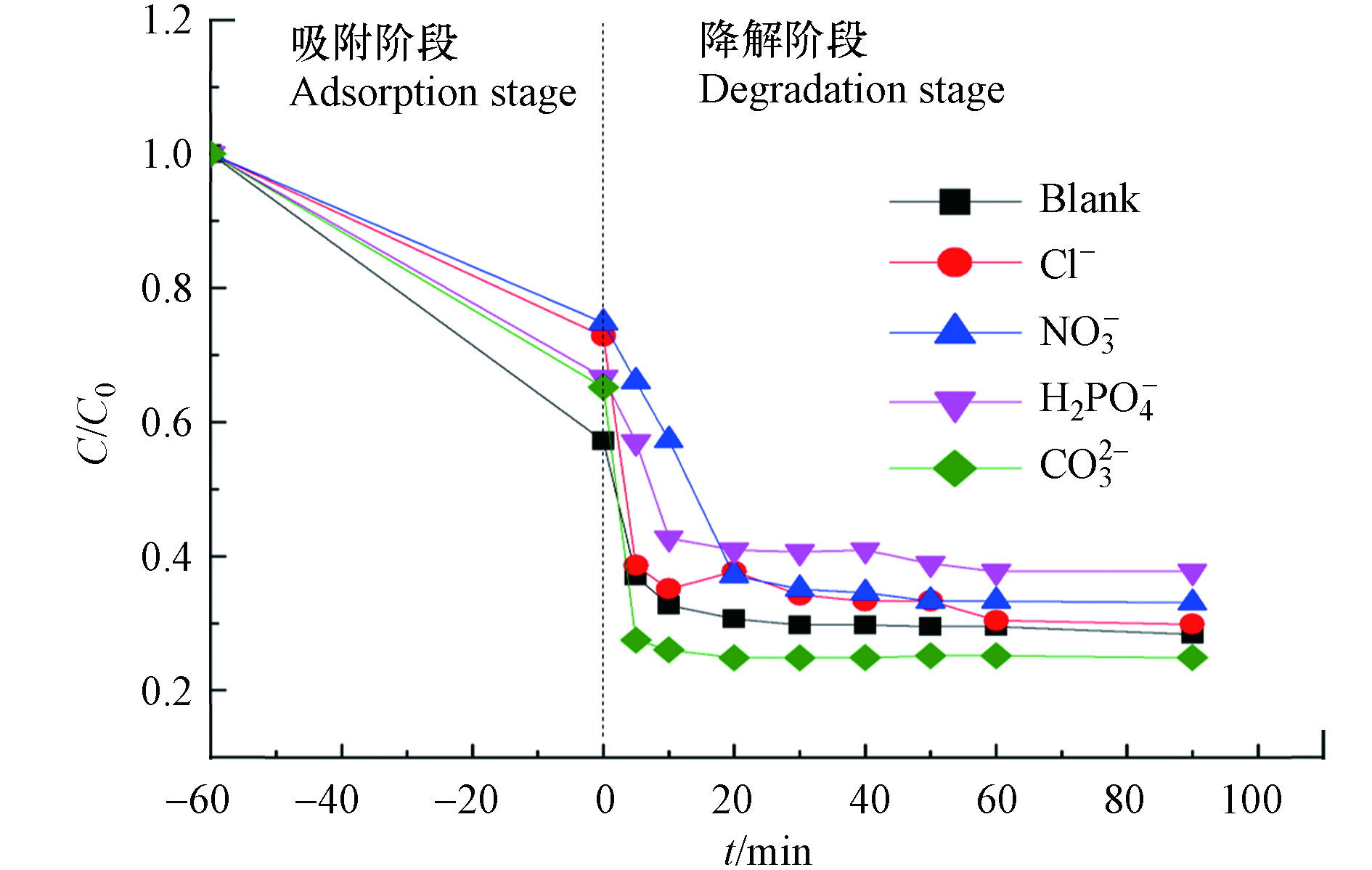
SO2−4 2HSO−5+2OH−→2SO2−4+O2+2H2O (8) 阴离子类型对Fe-N-RSBC催化PMS降解TC的影响见图7. 由图7可知,Cl−、
H2PO−4 NO−3 CO2−3 2.3 Fe-N-RSBC对四环素降解机理的探究
不同类型淬灭剂对Fe-N-RSBC催化PMS降解四环素的影响见图8(a). 甲醇可以淬灭∙OH和
SO−4⋅ O⋅−2 SO−4⋅ 为进一步证实催化降解机理,采用EPR对催化降解过程中的自由基进行检测. 如图所示,EPR能检测到DMPO-X[图8(b))]和1O2[图8(c))]存在. DMPO-X的产生原因 [47-49]:由于DMPO的氧化出现了带有七元体的强峰DMPOX,这间接说明了在Fe-N-RSBC/PMS体系中产生的强氧化物种,如∙OH和
SO−4⋅ 1O2的来源可能是PMS的自降解、Fe-N-RSBC中铁的催化、Fe-N-RSBC中的官能团(如C=O,C=N,芳香基团和Fe-N-RSBC中的结构缺陷,具体反应公式所示 [8, 21, 24, 50]:
Fe0+2HSO−5→Fe2++ 2SO·−4+2OH− (9) Fe2++HSO−5→Fe3++ SO·−4+ OH− (10) Fe3++HSO−5→Fe2++SO·−5+ H+ (11) HSO−5+e−→⋅OH+SO2−4 (12) HSO−5+e−→SO·−4+ OH− (13) Fe3++ e−→Fe2+ (14) O2+e−→O−·2 (15) 2O·−2+H+→1O2+H2O2 (16) SO·−4+OH−→⋅OH+SO2−4 (17) 2SO·−5→2SO·−4+O2 (18) ·OH+ O·−2→1O2+ OH− (19) HSO−5+SO2−5→SO2−4+HSO−4+1O2 (20) HSO−5→SO·−5+H++e− (21) 2SO·−5+H2O→1.51O2+ 2HSO−4 (22) SO·−5+ SO·−5→1O2+2SO−4 (23) 综上可见,Fe-N-RSBC降解TC的机理是包括自由基路径和非自由基路径,自由基途径涉及表面结合的自由基等,但是1O2非自由基作用占主要地位. 与其它材料相比[18-25],本研究制备的Fe-N-RSBC催化PMS降解TC的优势在:去除效果较好;受到干扰少;Fe和N能发挥协同作用.
2.4 Fe-N-RSBC再生利用和适用性实验
图9(a)显示的是Fe-N-RSBC的再生利用结果. Fe-N-RSBC第1次、第2次和第3次对四环素的去除率分别为70%、53%和52%,去除效果降低可能与铁离子的流失、生物炭理化性质改变等有关. 为验证材料的适用性,选择代表性的阳离子染料亚甲基蓝和阴离子染料橙黄Ⅱ,探究Fe-N-RSBC催化PMS降解染料的效果,结果见图9(b). 可见,Fe-N-RSBC催化PMS对染料有着较好的效果,150 min内,对亚甲基蓝和橙黄Ⅱ的去除效果可达73%和95%,说明Fe-N-RSBC具有较好的适用性.
3. 结论(Conclusion)
(1) 铁氮共改性可以明显改变生物炭的理化性质,使得生物炭的比表面积从177.7 m2·g−1增加到606.6 m2·g−1,孔体积从0.11 cm3·g−1增加到0.33 cm3·g−1,微孔体积从0.066 cm3·g−1增加到0.154 cm3·g−1,改性赋予更丰富的官能团,并引入磁性组分,Fe-N-RSBC的饱和磁化值在38.99 emu·g−1,但破坏了部分石墨碳结构.
(2) 铁氮改性生物炭可以有效催化PMS降解四环素,在预吸附60 min降解90 min体系中,Fe-N-RSBC催化PMS对TC的去除率可达87%(四环素浓度为50 mg·L−1, 固液比0.2 g·L−1, PMS浓度为1 mmol·L−1 , PMS添加量0.2 mL, 溶液pH=7).
(3) Fe-N-RSBC催化PMS降解TC的机理是包括自由基路径和非自由基路径,其中非自由基途径以1O2为主要活性氧物种.
-
表 1 目标化合物的多反应监测条件
Table 1. MRM parameters for target compounds
化合物Compounds 母离子Precursor ions(m/z) 子离子Product ions (m/z) 解簇电压/VDeclustering potential 碰撞能量/VCollision energy DMP 195.3 163.0* 40 12 195.3 77.1 40 46 DEP 223.1 177.4* 50 25 223.1 149.3 50 12 BBP 313.3 91.3* 68 27 313.3 205.2 68 12 DBP 279.1 149.3* 72 20 279.1 205.2 72 12 DEHP 391.1 167.0* 84 18 391.1 149.0 84 32 DNOP 391.3 261.1* 60 10 391.3 149.0 60 20 表 2 世界其他国家和地区自来水中PAEs含量
Table 2. Concentrations of PAEs in other countries and regions around the world
国家和地区Country and region BBP/(μg·L−1) DBP/(μg·L−1) DEP/(μg·L−1) DMP/(μg·L−1) DNOP/(μg·L−1) DEHP/(μg·L−1) ∑PAEs/(μg·L−1) 参考文献Reference 江苏省Jiangsu nd—7.39(0.71) 0.34—7.40(2.01) nd—6.41(1.40) nd—8.40(1.93) nd—5.23(1.23) nd—6.87(1.93) 4.10—14.23(8.43) 本研究 天津市Tianjin 0.44—0.71 0.38—0.68 — — — 1.10—1.78 1.92—2.78(2.41) [23] 河南省Henan nd 0.93 44.04 38.19 — 12.49 — [24] 武汉市Wuhan — 0.60 0.90 nd — — — [26] 葡萄牙Portugal 0.03 0.52 0.19 0.04 — 0.06 0.02—0.35 [21] 德国Germany 0.05 0.64 0.16 — — 0.06 0.02—0.60 [27] 西班牙Span nd nd—0.91 nd—0.38 nd—0.03 — nd 0.38—0.73 [10] 西班牙Span nd nd 0.19 nd — nd nd—0.19 [28] 法国France nd 0.04 0.03 nd — 0.35 — [22] 希腊Greece — 1.04 0.30 — — 0.93 0.30—1.04 [29] 捷克Czech 0.002 0.05 0.07 0.08 nd 0.66 — [30] 越南Vietnam 0.20—4.21 0.01—2.56 nd—2.57 nd—0.54 nd—1.93 1.01—14.50 2.10—18.00(11.2) [31] 伊朗Iran 0.05—0.15(0.10) nd—0.14(0.09) nd—0.09(0.05) 0.08—0.67(0.37) nd—0.11(0.01) nd—0.38(0.15) 0.07—0.52 [11] 注:nd,未检出,not detected;—,未参与检测,not included;( ),平均值,mean level 表 3 江苏省不同城市居民自来水中PAEs非致癌风险
Table 3. Non-carcinogenic risks of PAEs in residential tap water from different cities in Jiangsu Province
城市 City HIBBP HIDBP HIDEP HIDMP HIDNOP HIDEHP ∑HI 南京Nanjing 1.67×10−5 4.67×10−3 9.36×10−5 na 4.77×10−3 4.17×10−5 9.59×10−3 无锡Wuxi 1.27×10−3 4.72×10−3 2.66×10−4 na 1.07×10−3 9.36×10−4 8.26×10−3 常州Changzhou 1.67×10−5 2.48×10−3 1.23×10−4 na 5.02×10−3 1.64×10−3 9.28×10−3 苏州Suzhou 1.67×10−5 8.69×10−3 4.17×10−5 na 8.33×10−5 3.60×10−3 1.24×10−2 南通Nantong 1.67×10−5 1.58×10−2 4.17×10−5 na 1.26×10−2 3.09×10−3 3.15×10−2 扬州Yangzhou 3.97×10−4 1.15×10−2 4.17×10−5 na 6.66×10−3 1.97×10−3 2.06×10−2 镇江Zhenjiang 1.55×10−4 8.65×10−3 2.86×10−4 na 8.33×10−5 1.18×10−3 1.04×10−2 泰州Taizhou 3.24×10−4 1.60×10−2 4.17×10−5 na 5.91×10−3 2.73×10−3 2.50×10−2 注:na,无参考数据,no reference data -
[1] ZHANG Z M, ZHANG H H, ZHANG J, et al. Occurrence, distribution, and ecological risks of phthalate esters in the seawater and sediment of Changjiang River Estuary and its adjacent area [J]. The Science of the Total Environment, 2018, 619/620: 93-102. doi: 10.1016/j.scitotenv.2017.11.070 [2] HIS Markit, Plasticizers-Chemical Economics Handbook (CEH). [EB/OL]. [2022-3-4]. https://www.spglobal.com/commodityinsights/en/ci/products/plasticizers-chemical-economics-handbook.html [3] HASSANZADEH N, ESMAILI SARI A, KHODABANDEH S, et al. Occurrence and distribution of two phthalate esters in the sediments of the Anzali wetlands on the coast of the Caspian Sea (Iran) [J]. Marine Pollution Bulletin, 2014, 89(1/2): 128-135. [4] LÜ H, MO C H, ZHAO H M, et al. Soil contamination and sources of phthalates and its health risk in China: A review [J]. Environmental Research, 2018, 164: 417-429. doi: 10.1016/j.envres.2018.03.013 [5] LUO Q, LIU Z H, YIN H, et al. Migration and potential risk of trace phthalates in bottled water: A global situation [J]. Water Research, 2018, 147: 362-372. doi: 10.1016/j.watres.2018.10.002 [6] YANG X, CHEN D W, LV B, et al. Dietary exposure of the Chinese population to phthalate esters by a total diet study [J]. Food Control, 2018, 89: 314-321. doi: 10.1016/j.foodcont.2017.11.019 [7] LIOU S H, YANG G C C, WANG C L, et al. Monitoring of PAEMs and beta-agonists in urine for a small group of experimental subjects and PAEs and beta-agonists in drinking water consumed by the same subjects [J]. Journal of Hazardous Materials, 2014, 277: 169-179. doi: 10.1016/j.jhazmat.2014.02.024 [8] HEINEMEYER G, SOMMERFELD C, SPRINGER A, et al. Estimation of dietary intake of bis(2-ethylhexyl)phthalate (DEHP) by consumption of food in the German population [J]. International Journal of Hygiene and Environmental Health, 2013, 216(4): 472-480. doi: 10.1016/j.ijheh.2013.01.001 [9] 韩文辉, 赵颖, 党晋华, 等. 汾河流域邻苯二甲酸酯的分布特征及生态风险评价 [J]. 环境化学, 2017, 36(6): 1377-1387. doi: 10.7524/j.issn.0254-6108.2017.06.2016092204 HAN W H, ZHAO Y, DANG J H, et al. Distribution and ecological risk evaluation of phthalate esters in Fenhe River Basin [J]. Environmental Chemistry, 2017, 36(6): 1377-1387(in Chinese). doi: 10.7524/j.issn.0254-6108.2017.06.2016092204
[10] DOMÍNGUEZ-MORUECO N, GONZÁLEZ-ALONSO S, VALCÁRCEL Y. Phthalate occurrence in rivers and tap water from central Spain [J]. The Science of the Total Environment, 2014, 500/501: 139-146. doi: 10.1016/j.scitotenv.2014.08.098 [11] ABTAHI M, DOBARADARAN S, TORABBEIGI M, et al. Health risk of phthalates in water environment: Occurrence in water resources, bottled water, and tap water, and burden of disease from exposure through drinking water in Tehran, Iran [J]. Environmental Research, 2019, 173: 469-479. doi: 10.1016/j.envres.2019.03.071 [12] DEBLONDE T, COSSU-LEGUILLE C, HARTEMANN P. Emerging pollutants in wastewater: A review of the literature [J]. International Journal of Hygiene and Environmental Health, 2011, 214(6): 442-448. doi: 10.1016/j.ijheh.2011.08.002 [13] CHEN X P, XU S S, TAN T F, et al. Toxicity and estrogenic endocrine disrupting activity of phthalates and their mixtures [J]. International Journal of Environmental Research and Public Health, 2014, 11(3): 3156-3168. doi: 10.3390/ijerph110303156 [14] 章勇, 张蓓蓓, 赵永刚, 等. 液相色谱/串联质谱法测定水中邻苯二甲酸酯类化合物 [J]. 分析试验室, 2014, 33(3): 303-307. doi: 10.13595/j.cnki.issn1000-0720.2014.0068 ZHANG Y, ZHANG B B, ZHAO Y G, et al. Determination of six phthalate acid ester residues in water by ultra performance liquid chromatographytandem mass spectrometry [J]. Chinese Journal of Analysis Laboratory, 2014, 33(3): 303-307(in Chinese). doi: 10.13595/j.cnki.issn1000-0720.2014.0068
[15] U. S. , Food and Drug Administration, Guidance for Industry: bottled water quality standard; establishing an allowable level for di(2-ethylhexyl) phthalate. 21CFR165.110(b). [EB/OL]. [2022-3-16]. https://www.fda.gov/media/84475/download [16] 丁梦雨, 康启越, 张释义, 等. 全国23个城市水源水中邻苯二甲酸酯代谢物浓度调查 [J]. 中国环境科学, 2019, 39(10): 4205-4211. doi: 10.3969/j.issn.1000-6923.2019.10.021 DING M Y, KANG Q Y, ZHANG S Y, et al. National survey of phthalate metabolites in drinking source water of 23 cities in China [J]. China Environmental Science, 2019, 39(10): 4205-4211(in Chinese). doi: 10.3969/j.issn.1000-6923.2019.10.021
[17] 贺涛, 白小舰, 陈隽, 等. 饮用水源地塑化剂类污染物环境健康风险评估[J]. 中国环境科学, 2013, 33(S1): 26-31. HE T, BAI X J, CHEN J, et al. Environmental health risk assessment of plasticizer contaminants in drinking water source[J]. China Environmental Science, 2013, 33(Sup 1): 26-31(in Chinese).
[18] ZHANG F H, ZHANG M, ZHU Y, et al. Investigation on the pollution status of phthalates in drinking water and source water of Hefei city [J]. Environment Monitoring and Assessment, 2008, 20(2): 22-24. [19] 于云江, 叶昊, 杨彦, 等. 太湖流域(苏南地区)经口介质中邻苯二甲酸酯的生物有效性及人体暴露评估 [J]. 环境化学, 2014, 33(2): 194-205. doi: 10.7524/j.issn.0254-6108.2014.02.007 YU Y J, YE H, YANG Y, et al. The bioaccessibility and exposure assessment of PAEs via oral media in Taihu Lake Basin of south Jiangsu Province [J]. Environmental Chemistry, 2014, 33(2): 194-205(in Chinese). doi: 10.7524/j.issn.0254-6108.2014.02.007
[20] LI Z K, CHANG F Y, SHI P, et al. Occurrence and potential human health risks of semi-volatile organic compounds in drinking water from cities along the Chinese coastland of the Yellow Sea [J]. Chemosphere, 2018, 206: 655-662. doi: 10.1016/j.chemosphere.2018.05.064 [21] SERÔDIO P, NOGUEIRA J M F. Considerations on ultra-trace analysis of phthalates in drinking water [J]. Water Research, 2006, 40(13): 2572-2582. doi: 10.1016/j.watres.2006.05.002 [22] MARTINE B, MARIE-JEANNE T, CENDRINE D, et al. Assessment of adult human exposure to phthalate esters in the urban centre of Paris (France) [J]. Bulletin of Environmental Contamination and Toxicology, 2013, 90(1): 91-96. doi: 10.1007/s00128-012-0859-5 [23] WANG C C, HUANG P P, QIU C S, et al. Occurrence, migration and health risk of phthalates in tap water, barreled water and bottled water in Tianjin, China [J]. Journal of Hazardous Materials, 2021, 408: 124891. doi: 10.1016/j.jhazmat.2020.124891 [24] TANG C Y, LI A Q, GUAN Y B, et al. Influence of polluted SY river on child grows and sex hormones [J]. Biomedical and Environmental Sciences, 2012, 25(3): 291-296. [25] YU H, HU J Y, JIN X H, et al. , Monitoring of phthalates in raw water and treatment process of a water plant in north China [J]. Water Supply Drain, 2005, 31(06): 20-23. [26] XU J, LIANG P, ZHANG T Z. Dynamic liquid-phase microextraction of three phthalate esters from water samples and determination by gas chromatography [J]. Analytica Chimica Acta, 2007, 597(1): 1-5. doi: 10.1016/j.aca.2007.06.047 [27] LUKS-BETLEJ K, POPP P, JANOSZKA B, et al. Solid-phase microextraction of phthalates from water [J]. Journal of Chromatography. A, 2001, 938(1/2): 93-101. [28] REGUEIRO J, LLOMPART M, GARCIA-JARES C, et al. Ultrasound-assisted emulsification-microextraction of emergent contaminants and pesticides in environmental waters [J]. Journal of Chromatography. A, 2008, 1190(1/2): 27-38. [29] PSILLAKIS E, KALOGERAKIS N. Hollow-fibre liquid-phase microextraction of phthalate esters from water [J]. Journal of Chromatography. A, 2003, 999(1/2): 145-153. [30] PROKŮPKOVÁ G, HOLADOVÁ K, POUSTKA J, et al. Development of a solid-phase microextraction method for the determination of phthalic acid esters in water [J]. Analytica Chimica Acta, 2002, 457(2): 211-223. doi: 10.1016/S0003-2670(02)00020-X [31] LE T M, NGUYEN H, NGUYEN V K, et al. Profiles of phthalic acid esters (PAEs) in bottled water, tap water, lake water, and wastewater samples collected from Hanoi, Vietnam [J]. The Science of the Total Environment, 2021, 788: 147831. doi: 10.1016/j.scitotenv.2021.147831 [32] SHI W, HU X X, ZHANG F X, et al. Occurrence of thyroid hormone activities in drinking water from Eastern China: Contributions of phthalate esters [J]. Environmental Science & Technology, 2012, 46(3): 1811-1818. [33] SALAZAR-BELTRÁN D, HINOJOSA-REYES L, RUIZ-RUIZ E, et al. Determination of phthalates in bottled water by automated on-line solid phase extraction coupled to liquid chromatography with UV detection [J]. Talanta, 2017, 168: 291-297. doi: 10.1016/j.talanta.2017.03.060 期刊类型引用(2)
1. 周忠城,孙春暖,何子阳,宋小宇,吕强汝,赵健,邹海明. 2种磁性藻渣碳基功能材料的制备及其对养殖废水中抗生素去除效果. 安徽科技学院学报. 2025(02): 35-41 .  百度学术
百度学术
2. 贾华,牛建瑞,高玮,芮遨宇,余铭浩,陈梦,郭延凯. 电子转移主导的载钴生物炭活化PMS降解四环素. 环境科学学报. 2024(03): 51-60 .  百度学术
百度学术
其他类型引用(9)
-














 下载:
下载: