-
多氯联苯(PCBs)、有机氯农药(OCPs)、氯苯类(CBs)、多环芳烃(PAHs)和邻苯二甲酸酯(PAEs)是典型的持久性有机污染物(POPs),广泛存在于环境中。土壤中的POPs可以通过挥发、扩散等方式在大气、地表水和地下水中相互迁移转换,并会通过生物积累最终会进入食物链,对生态环境和人类健康造成威胁[1-2]。因此,土壤中持久性有机污染物的研究历来是国内外关注的焦点。测定土壤中的POPs主要包括提取、浓缩、净化以及仪器测定等步骤,分析周期长,试剂和耗材消耗大,劳动投入强。国内外针对单一类有机污染物的检测方法比较成熟,近年来研究学者倾向多组分化合物的同步分析趋势 [3-7],但目前针对土壤中多种持久性有机污染物同时预处理和仪器测定的高通量分析方法报道尚少。国内现有的标准分析方法大都是针对某类化合物的分析[8-11],且土壤样品采集后一般要求6—10 d完成萃取,时效性要求高。随着国家对土壤环境管控越来越严,对土壤监测要求日渐增大,迫切需要开发土壤中多种POPs同时测定的高通量分析方法。
传统的提取方式存在试剂用量大、萃取时间长、萃取提取效率低以及稳定性差等缺点,目前研究学者更倾向于使用快速、高效的方法萃取土壤中的有机污染物,微波辅助萃取技术试剂消耗低,仪器管道少,实验操作简单,并可同时处理多个样品,具批量处理优势,常用于土壤中的POPs的提取[12-17]。测定有机污染物常用的净化方式有酸洗、复合硅胶层析柱、凝胶渗透色谱、固相萃取等,酸洗或酸性硅胶净化效果好,但OCPs、PAHs和PAEs等化合物会被浓硫酸氧化,而凝胶渗透色谱仪设备投入高,且仪器管道较多,容易引入PAEs的污染;硅酸镁小柱具有普适性强、操作简便的优点,但是具有柱容量小的缺点[18-20]。低温分配技术(low-temperature partition extraction,LTPE)近年来被证明是性能优越的前处理手段[21],并在多种环境样品有机污染物的前处理中得到应用 [17,22-24]。
本文建立的微波辅助萃取-低温分配净化-气相色谱-质谱法,同时实验处理和检测土壤中的18种多氯联苯、23种有机氯农药(包括五氯苯和六氯苯)、16种多环芳烃和6种邻苯二甲酸酯。实验结果表明,该方法回收率高、平行性好,能满足土壤中63种POPs的检测分析要求,在分析大批量样品时,具批处理优势,显著提高工作效率。
-
气相色谱-质谱联用仪(Thermo,TSQ 8000 EVO)、气相色谱-质谱联用仪(Waters,Micromass Quattro)微波萃取仪(Milestone,ETHOS UP 44位)、旋转蒸发仪(BUCHI,V-100)、氮吹仪(EYELA,MG-2200)、低温冰箱(海尔,DW-40W380)。正己烷、二氯甲烷、丙酮(Honeywell,农残级),硅酸镁固相萃取小柱(CNW,1 g,玻璃材质),微孔滤膜(安谱,0.22 μm),无水硫酸钠(广州牌化学试剂,分析纯),石英砂(广州牌化学试剂,分析纯)。
16种多环芳烃混合标准品,23种OCPs混合标准品,18种PCBs混合标准品,6种邻苯二甲酸酯混合标准品,均购自Accustandard。提取内标:5种氘代多环芳烃混合标准品(包括D8-萘、D10-苊、D10-菲、D12-䓛、D12-苝),购自Accustandard;5种13C标记有机氯农药(包括13C-α-六六六、13C-γ-氯丹、13C-o,p'-DDE,13C-p,p'-DDD,13C-p,p'-DDT),购自CIL;5种13C标记多氯联苯(包括13C-PCB28、13C-PCB52、13C-PCB 101、13C-PCB153、13C-PCB180),购自CIL。进样内标:D10-芘,购自Accustandard ;13C-p,p'-DDE和13C-PCB138,购自CIL。
土壤中18种PCBs有证标准物质(Sigma-Aldrich,CRM962),土壤中23种OCPs有证标准物质(ERA,093),土壤中16种PAHs有证标准物质(ERA,722),土壤中6种PAEs有证标准物质(东莞龙昌智能技术研究院,RUM001)。
-
配制63种POPs6个浓度系列的标准曲线,PCBs浓度范围为0.005、0.01、0.05、0.1、0.2、0.5 μg·mL−1,提取内标和进样内标浓度均为0.1 μg·mL−1;OCPs浓度范围为0.02、0.05、0.1、0.5、1.0、5.0 μg·mL−1,提取内标和进样内标浓度均为0.5 μg·mL−1;PAHs和PAEs浓度范围为0.1、0.25、0.5、1.0、5.0、10.0 μg·mL−1,提取内标和进样内标浓度均为1.0 μg·mL−1。
-
土壤样品采集完毕在4 ℃以下、避光保存运输回实验室,去除石子、叶片等异物,混匀样品,称取10.0 g样品加入适量无水硫酸钠研磨至流沙状。将制备好的样品装入特氟龙材质的微波罐内,加入同位素提取内标,加入30 mL正己烷+丙酮(1+1)混合试剂,在115 ℃条件下微波萃取15 min。提取液旋转蒸发浓缩后,用正己烷转溶并继续旋蒸浓缩至1 mL左右,然后氮吹至0.5 mL左右,于-20 ℃冰箱静置4 h,取上清液或使用微孔滤膜过滤后,转移到进样瓶内,加入进样内标,待测。
-
气相色谱条件:色谱柱为 Rxi-XLB(30 m×0.25 mm×0.25 μm,RESTEK);进样口温度为280 ℃;载气为高纯氦气(99.999%);柱流速为1.0 mL·min−1;进样量1 μL,不分流进样;升温程序为70 ℃(保持2 min),以25 ℃·min−1升温至140 ℃,再以10 ℃·min−1升温至240 ℃,5 ℃·min−1升温至280 ℃(保持4 min),最后10 ℃·min−1升温至320 ℃(保持5 min)。
质谱条件:离子源为EI源;电子能量70 eV;离子源温度300 ℃,传输线温度300 ℃,选择离子扫描模式,同位素内标法定量。表1列出了18种PCBs、23种OCPs、16种PAHs和6种PAEs及内标物的保留时间、定量离子、定性离子和定量关系。
-
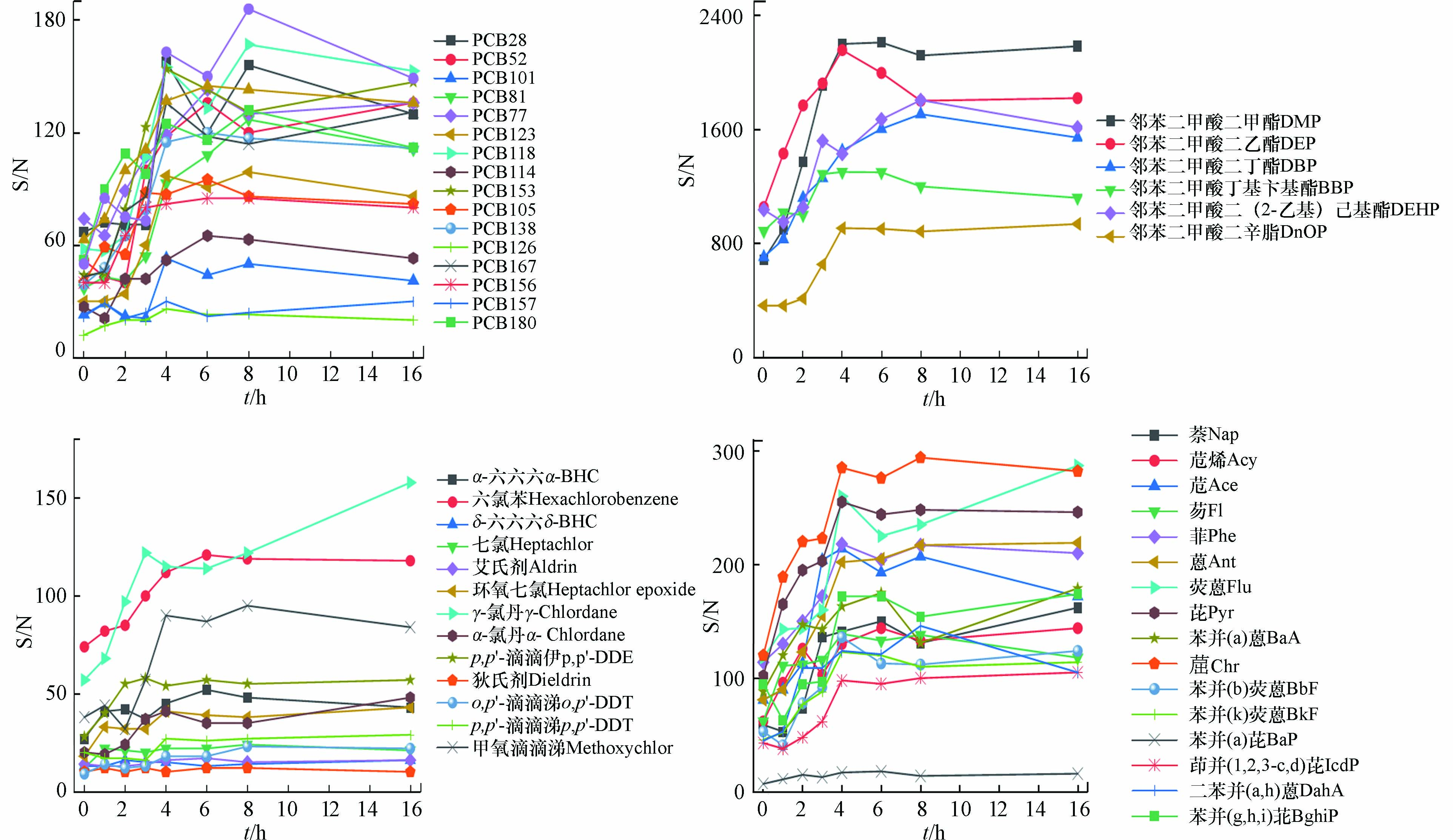
本研究所采用的低温分配技术是依据相似相溶的原理,在低温条件下,极性较强的杂质在弱极性的有机溶剂(正己烷)中溶解度迅速降低而解析出来,再借助微孔滤膜过滤,达到去除杂质的目的;冷冻时间和萃取剂对化合物的溶解性是影响低温分配的重要因素[20,25],选择正己烷为低温分配实验时的有机溶剂,在-20 ℃条件下设计0、1、2、3、4、6、8、16 h时间梯度,全扫描模式测定化合物色谱峰信噪比的变化。如图1所示,随着保存时间的延长,绝大部分化合物色谱峰的信噪比在4 h左右能提高1.5—3倍,4 h后延长时间信噪比呈略有波动状态但无显著差异,推测是4 h后低温分配达到了相态平衡,这与文献中-20 ℃保持3 h为最佳萃取条件的结论相近[26]。因此,本研究在低温分配净化时,用于冷冻样品的时间为4 h。
-
测定6个不同浓度水平的POPs混合标准曲线,化合物的相对响应因子(relative response factor,RRF)的相对标准偏差结果(表2)均小于20%,具有良好的线性关系。对PCBs含量为1 μg·kg −1,OCPs含量为5 μg·kg−1,PAHs和PAEs含量为10 μg·kg−1的石英砂空白加标进行8次平行分析,计算测定结果的2.998倍标准偏差作为方法检出限,以4倍方法检出限作为测定下限。对两个浓度水平的土壤基质加标样品分别平行分析6次,计算样品的精密度和准确度。
测定结果(表2)显示,当取样量为10.0 g,最后定容在0.5 mL时,PCBs的方法检出限在0.1—0.2 μg·kg−1之间,测定下限在0.4—0.8 μg·kg−1之间,含量为2.0 μg·kg−1和5.0 μg·kg−1的土壤基质加标回收率范围为96%—114%,相对标准偏差(relative standard deviation,RSD)为0.9%—4.1%。OCPs的方法检出限在0.3—1.5 μg·kg−1之间,测定下限在1.2—6.0 μg·kg−1之间,含量为10.0 μg·kg−1和50.0 μg·kg−1的土壤基质加标回收率范围为78%—119%,RSD为1.0%—10.6%。PAHs的方法检出限在0.4—1.9 μg·kg−1之间,测定下限分别在1.6—7.6 μg·kg−1之间,含量为20.0 μg·kg−1和200 μg·kg−1的土壤基质加标回收率范围为76%—111%,RSD为0.4%—3.8%。PAEs的方法检出限在1.0—2.2 μg·kg -1之间,测定下限在4.0—8.8 μg·kg -1之间,含量为20.0 μg·kg−1和200 μg·kg−1的土壤基质加标回收率范围为91%—116%,RSD为1.7%—4.8%。该方法的校准曲线、方法检出限、精密度和准确度均满足土壤中相关化合物测定的检测要求[8-11]。
-
实际土壤样品平行分析3次,测试结果,同位素标记的提取内标回收率范围为79%—119%。18种PCBs均未检出,大部分OCPs未检出,只有δ-六六六、p,p'-DDE、p,p'-DDD、p,p'-DDT检出,浓度范围为0.5—14.5 μg·kg−1(RSD:1.9%—7.0%),16种PAHs检出率100%,浓度范围为28.0—400 μg·kg−1(RSD:0.2%—11.1%),PAEs检出指标有邻苯二甲酸二丁酯、邻苯二甲酸丁基卞基酯和邻苯二甲酸二(2-乙基)己酯,浓度范围为1.5—10.5 μg·kg−1(RSD:0.7%—1.5%)。用本方法对PCBs、OCPs、PAHs和PAEs的土壤标准物质进行分析(n=3),PCBs、OCPs和PAHs测定结果均在合格区间内(表3),土壤中的PAEs有证标准物质只给出扩展不确定度,未给出合格区间,测定结果(表4)目标物回收率在50%—89%之间,RSD在1.5%—2.8%之间。
-
选择相关环境检测标准推荐的硅酸镁小柱固相萃取净化与本实验方法进行净化效果比较,并使用土壤有证参考物质0.5 mL的萃取浓缩液,作为不净化对照样,固相萃取净化方法参考HJ835选择玻璃材质的硅酸镁小柱(1 g),低温分配净化试验按照前述步骤,每种净化方法分别进行3次平行分析。
土壤有证参考物质测定结果显示(表5),目标物的回收率在49%—119%之间,同一化合物的不同处理方式其回收率无显著差异,并且PCBs、OCPs和PAHs均在合格区间内,PAEs的有证标准物质未给出合格区间,回收率在50%—90%;回收率结果基本呈现不净化对照(54%—119%)>低温分配净化(50%—114%)>硅酸镁固相萃取净化(49%—112%)的趋势。表明,实验流程变长,操作变多,目标物的损失会增加。测定结果相对标准偏差显示,不净化对照(1.1%—13.0%)与低温分配净化(0.1%—10.6%)的RSD普遍较小,硅酸镁固相萃取净化(0.3%—13.2%)的RSD结果普遍较大。推测是可能是因为实验步骤的延长,导致目标物测试的平行性变差所致。
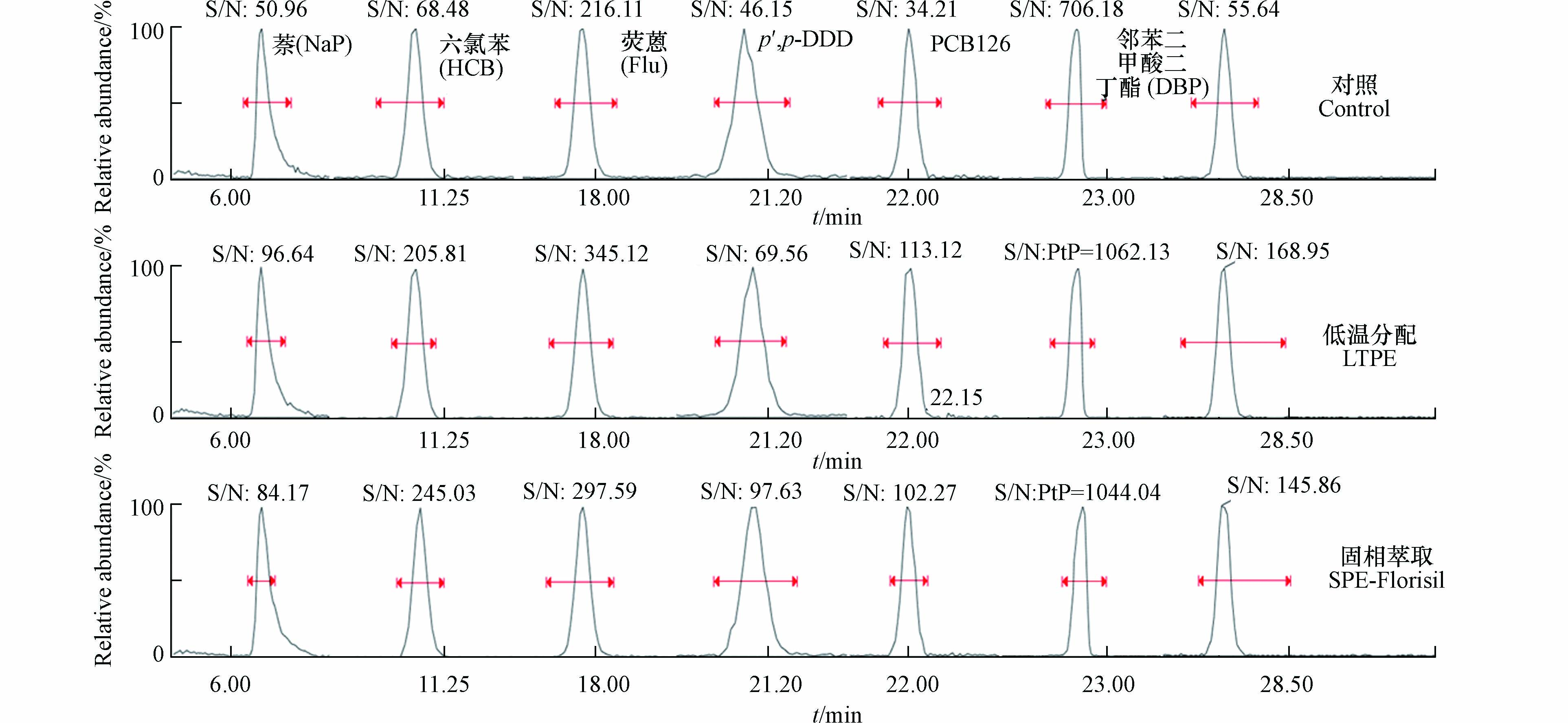
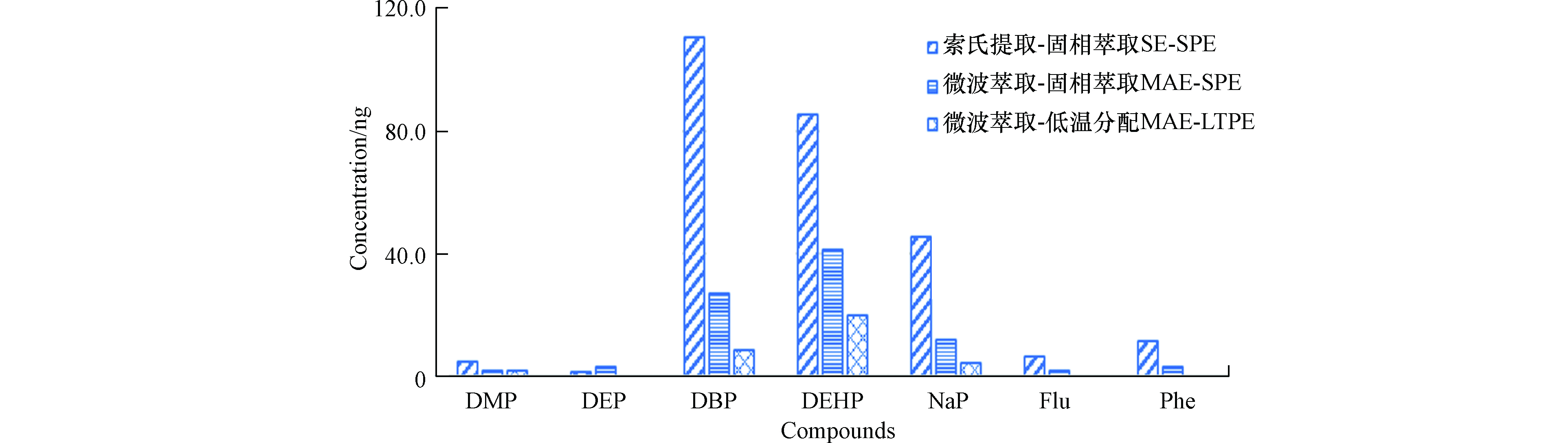
从化合物色谱峰的信噪比分析,与不净化对照相比,低温分配净化和固相萃取净化可提高1.5—3倍的信噪比,结果见图2。说明,萃取液经过低温分配后,能降低干扰,提高色谱峰的信噪比,且与硅酸镁固相萃取净化效果相当。样品前处理过程存在试剂使用量大、处理周期长、会引入PAHs和PAEs干扰等问题,本研究比较了索氏提取-固相萃取净化、微波萃取-固相萃取净化和微波萃取-低温分配净化的空白结果(图3),对于空白测试检出率较高的化合物尤其是萘、邻苯二甲酸二丁酯和邻苯二甲酸二(2-乙基)己酯等,微波萃取-低温分配净化方法可明显降低空白干扰。
综上所述,低温分配净化方法处理方式简单,同时减少试剂与耗材的投入,简化实验流程,且部分方法有效性结果更有优势,比如平行样品重复性、实验空白均优于硅酸镁固相萃取法。同传统的净化方法相比,该方法尤其适合大批量样品(比如样品数量在100个以上)的快速净化。
-
本研究采用微波辅助提取-低温分配净化气相色谱-质谱法同时测定土壤中的63种持久性有机污染物(18种多氯联苯、23种有机氯农药、16种多环芳烃和6种邻苯二甲酸酯),方法有效性结果满足相关环境标准方法的检测要求,同时提高了样品分析测试的效率,降低监测成本,尤其适合大批量样品的快速分析,是一种值得推广的分析方法。
微波辅助萃取-低温分配净化-气相色谱/质谱法同时检测土壤中63种持久性有机污染物
Simultaneous determination of 63 persistent organic pollutants in soil by GC/MS with microwave-assisted extraction and low-temperature partition extraction purification
-
摘要: 建立了土壤中18种多氯联苯、23种有机氯农药、16种多环芳烃和6种邻苯二甲酸酯同时实验处理和仪器测定的分析方法。10.0 g土壤样品经30 mL正己烷+丙酮(1+1)试剂于110 ℃微波萃取15 min,萃取液氮吹浓缩到0.5 mL后于−20 ℃保持4 h进行低温分配净化,使用气相色谱-质谱法进行测定。结果显示,63种化合物的方法检出限在0.1—2.2 μg·kg−1之间,测定下限在0.4—8.8 μg·kg−1之间;对两个浓度水平的土壤基质加标样品分别进行6次平行分析,测定结果的回收率在76%—119%之间,相对标准偏差在0.4%—10.6%之间。对相关土壤标准物质进行分析,测定结果均在化合物质控范围内。研究表明本方法快速简便,回收率高,重现性好,能满足土壤中63种POPs的检测要求。与常规的前处理净化相比,该方法操作简单,具备批处理优势,在分析大批量样品时,可提高工作效率,节省监测成本。Abstract: A method for simultaneous determination of 18 PCBs, 23 OCPs, 16 PAHs and 6 PAEs in soils by gas chromatography-mass spectrometry (GC-MS), with microwave extraction and low-temperature partition extraction purification was developed. Microwave-assisted extraction conditions involved the use of 30 mL n-hexane+acetone(1+1)at 115 ℃ for 5 min, the collected extraction liquid was concentrated to 0.5 mL by nitrogen, and subsequently in a freezer at −20 ℃ for 4 h. After the water phase was iced, the upper organic phase was taken out and analyzed by GC-MS. The result shows that, detection limits of this method were 0.1—2.2 μg·kg−1, quantitative lower limits were 0.4—8.8 μg·kg−1, and average recoveries of spiked samples ranged from 76% to 119% with relative standard deviations between 0.4% and 10.6%. The determination results of soils standard reference materials were all in the acceptance limits. The method shows high accuracy and precision, fast simple operation, high throughput and suitable for the simultaneous determination of 63 persistent organic pollutants (POPs) in the soil.
-
地表径流有组织下渗不仅是恢复开发前水文特征的重要手段,也是控制地表径流污染的有效途径。与其他污染物不同,地表径流重金属具有毒性大、易富集、不可降解等特点,可通过吸附、沉淀、络合等方式固定在下渗设施土壤中[1-2]。当环境因子发生变化时,长期积蓄在土壤中的重金属可发生再释放、再迁移,对土壤、地下水等环境造成难以控制的危害。因此,控制下渗设施中土壤已积蓄重金属的再释放迁移对保护人类健康、维护生态系统安全具有重要意义。
受水动力和化学条件影响,径流下渗过程中土壤会释放大量可移动胶体(1 nm—10 µm)[3-4],这些胶体可以通过离子交换吸附或络合-螯合等形式与重金属结合,成为土壤已积蓄重金属再迁移的载体。张维等[5]研究发现,降雨可引起紫色土坡耕地裂隙潜流中胶体颗粒浓度升高至7倍;Luo等[6]研究表明,虽然土壤胶体对钒(Ⅴ)的吸附量可达238.1 mg·g−1,但在强酸、强碱和高离子强度条件时吸附量会显著降低。Yin等[7]发现,在土壤中80%以上的Pb离子以胶体(0.45—8 μm)-Pb复合形式在土壤中向下迁移。因此,研究降雨入渗对下渗设施中土壤胶体-重金属的共释放迁移影响,对有效控制下渗设施中土壤已积蓄重金属的再释放迁移具有重要意义。
笔者课题组已对运行多年的下渗设施进行了系列研究,发现下渗介质中Cu2+、Pb2+和Cd2+累积量最多[8]。在前期研究的基础上,本文考察降雨入渗对下渗设施土壤胶体-重金属共释放迁移的影响,并探讨其响应因素,以期为下渗设施中土壤重金属在地下环境中的迁移风险评估提供支撑。
1. 材料与方法(Materials and methods)
1.1 土壤胶体提取及表征
1.1.1 供试土壤采集及土壤胶体提取
采集某运行多年下渗设施0—20 cm表层土壤及周边背景土壤,自然通风晾干后过2 mm筛备用。将背景土壤与去离子水以质量比1:30 配制悬浊液,并放于超声波清洗器(AS-B,北京恒奥德,中国)中超声30 min,使土壤胶体充分分散在悬浊液中。将土壤悬浊液置于离心机(LXJ-IIb型,上海安亭,中国)中以750 r·min−1和4500 r·min−1连续离心4 min和30 min[9],得到0.2—10 µm土壤胶体储备悬浊液。另取超声后的土壤悬浊液逐步以750 r·min−1离心4 min、2000 r·min−1离心10 min、4500 r·min−1 离心30 min分别得到0.45—10 µm和0.2—0.45 µm的土壤胶体悬浊液[9]。
1.1.2 土壤胶体Zeta电位测定
将1.1.1节提取的0.2—10 µm土壤胶体悬浊液分别与10 mL浓度为10 mg·L−1的硝酸铅(Pb(NO3)2)、硝酸铜(Cu(NO3)2)和硝酸镉(Cd(NO3)2)溶液均匀混合1 h,得到土壤胶体-重金属悬浊液备用。将土壤胶体悬浊液、土壤胶体-重金属悬浊液置于超声波清洗器中超声分散20 min,并使用HCl(0.01 mol·L−1)和NaOH(0.01 mol·L−1)精确调节pH值为4.0、5.0、6.0、7.0、8.0后,采用激光粒度Zeta电位分析仪(Zetasizer Nano ZS90,Malvern Panalytical,英国)测定不同pH值条件下土壤胶体悬浊液、土壤胶体-重金属悬浊液的Zeta电位值。
1.1.3 土壤胶体可移动性(relative movement value,RMV)测定
在通风橱中将20 mg亚甲基蓝溶解在1 L甲醇溶液中制备亚甲基蓝溶液,裁剪多个滤纸条(4 cm×40 cm),重复使用亚甲基蓝溶液对其进行染色并晾干。将染色后的滤纸条竖直悬挂在土壤胶体悬浊液、土壤胶体-重金属悬浊液上方,滤纸条下端与烧杯内悬浊液水平面接触,4 h后用尺子分别测量胶体(h)和水(H)在纸条上的移动高度,通过公式RMV=h/H计算相对移动值[10]得到胶体可移动性。
1.1.4 土壤重金属含量测定
取0.5 g采集风干后的背景土壤与下渗设施土壤,分别置于25 mL聚四氟乙烯坩埚中,依次加入5 mL硝酸(HNO3)、5 mL氢氟酸(HF)和3 mL 高氯酸(HClO4),置于电热板上进行消解,直至坩埚内没有明显颗粒物后使用5%的HNO3定容于25 mL容量瓶中,采用电感耦合等离子体质谱仪(ICP-MS)(NexION 300,PerkinElmer,德国)测定重金属Pb、Cu和Cd含量[11]。经测定扣除背景值后,下渗设施土壤中重金属Pb、Cu和Cd含量分别为118、95、46 μg·g−1。
1.1.5 土壤可蚀性(K值)测定
使用粒度分布仪(Mastersizer 3000,Malvern Panalytical,美国)测定土壤颗粒物粒径分布,利用重铬酸钾氧化-分光光度法测定土壤有机碳含量[12];根据测得的土壤粒度分布、有机碳含量等,使用Williams和Arnold[13]提出的EPIC模型估算土壤可蚀性K值,公式如下:
stringUtils.convertMath(!{formula.content}) (1) 式中,
SN=1−Sd100 1.2 模拟下渗柱
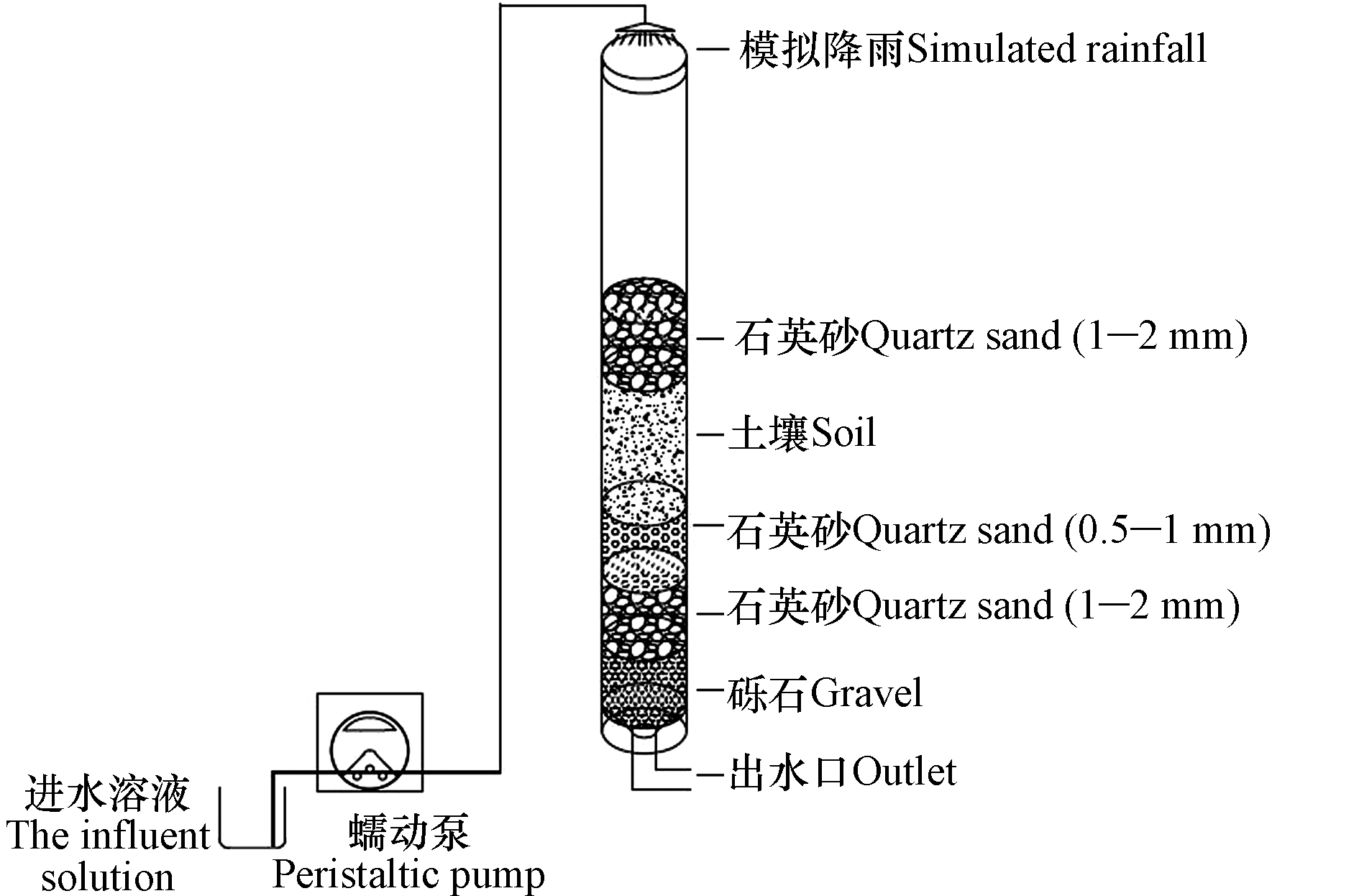
模拟下渗柱采用内径25 mm、高200 mm的内壁磨砂有机玻璃制成。下渗柱内部由下至上依次装填20 mm砾石(粒径为4—6 mm)、20 mm粗石英砂(粒径为1—2 mm)、20 mm细石英砂(粒径为0.5—1 mm)、40 mm受试土壤(下渗设施内采集土壤)和20 mm粗石英砂(粒径为1—2 mm)。装置结构及填料填充方式如图1所示。
1.3 降雨入渗对土壤下渗柱内土壤胶体-重金属共释放迁移的影响
调节降雨强度(i=2、3、4 mm·min−1)、降雨溶液化学条件(使用氯化钠调节降雨溶液Na+浓度为0.002、0.02、0.2 mol·L−1或使用的HCl(0.01 mol·L−1)和NaOH(0.01 mol·L−1)溶液调节降雨溶液的pH值为4.0、6.0、7.0和8.0),从模拟下渗装置顶部进行模拟降雨,连续收集下渗柱底部出流液。将不同时间收集的出流液采用离心分离法提取0.2—10 µm土壤胶体悬浊液,并采用紫外分光光度计(752型,上海舜宇恒平,中国)在600 nm处测定其胶体浓度[14]。将提取的悬浊液消解后采用ICP-MS(NexION 300,PerkinElmer,德国)测定其中重金属Pb、Cu和Cd的浓度。
1.4 土壤胶体粒径对下渗柱内重金属释放迁移的影响
采用纯水对下渗柱以3 mm·min−1的降雨强度进行模拟降雨,连续定时收集底部出流液;并将出流液样品置于离心机中逐步以750 r·min−1离心4 min、2000 r·min−1离心10 min、4500 r·min−1离心30 min分别得到0.45—10 µm和0.2—0.45 µm的土壤胶体悬浊液[9]。按1.3节的方法分别测定0.45—10 µm和0.2—0.45 µm粒径范围悬浊液的胶体和重金属浓度。
2. 结果与讨论 (Results and discussion)
2.1 土壤胶体表征
2.1.1 Zeta 电位
胶体悬浊液是一个高度分散的多相体系,可以利用Zeta 电位表征胶体悬浊液的稳定性。一般而言,Zeta电位的绝对值越低,土壤胶体表面的净负电荷总量越小,土壤胶体越不稳定[15-16]。测定不同pH条件时土壤胶体及土壤胶体-重金属悬浊液Zeta电位值,结果如图2所示。
由图2可以看出,土壤胶体及土壤胶体-重金属悬浊液Zeta电位值均为负值,两者Zeta电位绝对值均随pH值升高而逐渐增加,说明其稳定性均随悬浊液的pH升高而增强;且同一pH值下,土壤胶体Zeta电位绝对值均高于其与重金属结合悬浊液,说明与重金属结合后土壤胶体稳定性及可移动性减弱。一般而言,pH较低时土壤胶体表面的负电荷与悬浊液中大量的H+发生电中和反应,所以土壤胶体表面的净负电荷总量减少,Zeta 电位绝对值较低;反之,当pH值较高时,土壤胶体表面的净负电荷总量较多,所以其Zeta电位绝对值较高。同理,当土壤胶体与重金属结合后,胶体表面负电荷被重金属阳离子中和,胶体表面净负电荷降低,致使其Zeta电位绝对值降低。与土壤胶体-Cu和土壤胶体-Cd悬浊液对比,土壤胶体-Pb悬浊液的Zeta电位绝对值较高,说明该类型土壤胶体对Pb的携带能力较强,更容易发生携带迁移现象。
2.1.2 可移动性RMV值
0.45—10 μm与0.2—0.45 μm粒径范围土壤胶体及其重金属(Pb、Cu和Cd)复合胶体悬浊液的可移动性RMV值如表1所示。一般而言,可移动性RMV值越高,胶体越稳定,越容易迁移。
表 1 土壤胶体和土壤胶体-重金属悬浊液RMV值Table 1. RMV values of soil colloids and soil colloids-heavy metals悬浊液种类Type of suspension RMV值RMV value 悬浊液种类Type of suspension RMV值RMV value 0.45—10 μm土壤胶体 0.359 0.2—0.45 μm土壤胶体 0.710 0.45—10 µm土壤胶体-Pb 0.326 0.2—0.45 μm土壤胶体-Pb 0.606 0.45—10 µm土壤胶体-Cu 0.282 0.2—0.45 μm土壤胶体-Cu 0.564 0.45—10 µm土壤胶体-Cd 0.303 0.2—0.45 μm土壤胶体-Cd 0.588 由表1可见,在同一粒径范围内,土壤胶体-重金属悬浊液的RMV值均小于土壤胶体的RMV值;说明与重金属结合后,土壤胶体的可移动性减弱,迁移能力降低;这与Zeta电位结果一致。0.45—10 μm土壤胶体及其与重金属结合悬浊液的RMV值均小于相应的0.2—0.45 μm土壤胶体及其与重金属结合悬浊液的RMV值;说明胶体粒径越小,可移动性越强,更容易携带重金属迁移。
2.2 降雨强度对下渗柱土壤胶体-重金属共释放迁移的影响
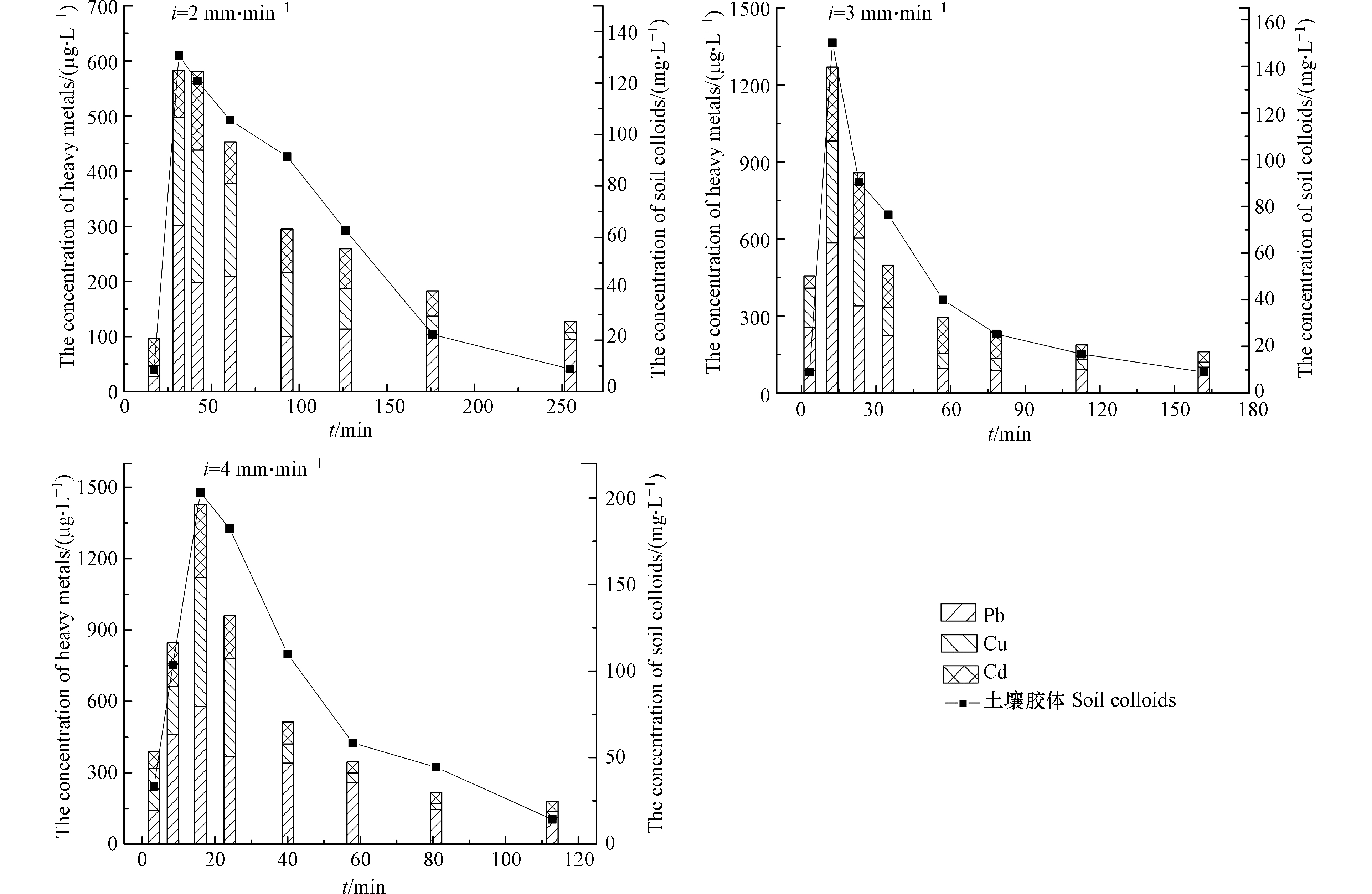
以降雨强度i 为2、3、4 mm·min−1时分别对下渗柱进行人工模拟降雨,测定不同时间出水中土壤胶体浓度及其携带的重金属浓度,结果如图3所示。
由图3可见,下渗柱出流液中土壤胶体及其携带重金属出流峰值浓度随降雨强度的增强而增高,即降雨强度越大,两者的出流峰值浓度越高。当降雨强度从2 mm·min−1增加到3 mm·min−1时,土壤胶体峰值释放量增长15%,与胶体结合迁移出的Pb、Cu和Cd峰值浓度分别提高93.3%、103.7%、234.9%;而当降雨强度从3 mm·min−1增加到4 mm·min−1时,胶体的出流峰值浓度增长35%,与胶体结合迁移出的Pb、Cu和Cd峰值浓度分别提高−1.1%、36.5%、7.0%。说明降雨强度增加可以促进土壤胶体及重金属的共释放量,但超过一定降雨强度后与土壤胶体共释放迁移的重金属量增幅降低。这可能是由于降雨强度较大时,水力冲刷作用增强,土壤胶体释放量增大;同时土壤胶体迁移速度加快使其与重金属的结合时间缩短,使得共释放迁移的重金属量增幅降低。
由图3还可以看出,随降雨历时增加,土壤胶体及与其结合的重金属出流浓度呈现先快速增加至峰值再减小的趋势;峰值出现时间随降雨强度增加而提前。这是因为降雨初期对土壤表面的侵蚀作用比持续降雨的作用更明显,由入渗引起的水动力条件改变使土壤中易扩散移动胶体携带重金属快速释放,且降雨强度越大,水流速度越高,土壤胶体及重金属的出流峰值越靠前;之后土壤胶体释放迁移致下渗柱内较大孔隙被堵塞,降雨后期只有少量的土壤胶体-重金属释出迁移。
通常,土壤可蚀性(K)可反映土壤对外部侵蚀力的敏感性,其值可衡量土壤可蚀能力强弱;K值越大,土壤越易被侵蚀,释放的可移动胶体量越多,从而携带迁移的重金属量可能越高。经测定,下渗柱土壤K值为(0.0473±0.0026) t·h·MJ−1·mm−1,属于高可蚀性;说明该类型土壤较易被降雨冲蚀,并携带重金属迁移。在同一降雨强度下,土壤胶体对3种重金属携带迁移能力顺序依次为:Pb>Cu>Cd;结果与Zeta电位及可移动性RMV值结果一致,说明该类型土壤对Pb的携带迁移能力最强。由于Pb是地表径流中主要的重金属风险污染物[17-18],因此使用该类型土壤的下渗设施应采取换填土壤等措施以减少土壤胶体对Pb的向下携带迁移。
2.3 入渗径流化学条件对下渗柱土壤胶体-重金属共释放迁移的影响
2.3.1 入渗径流离子强度对下渗柱土壤胶体-重金属共释放迁移的影响
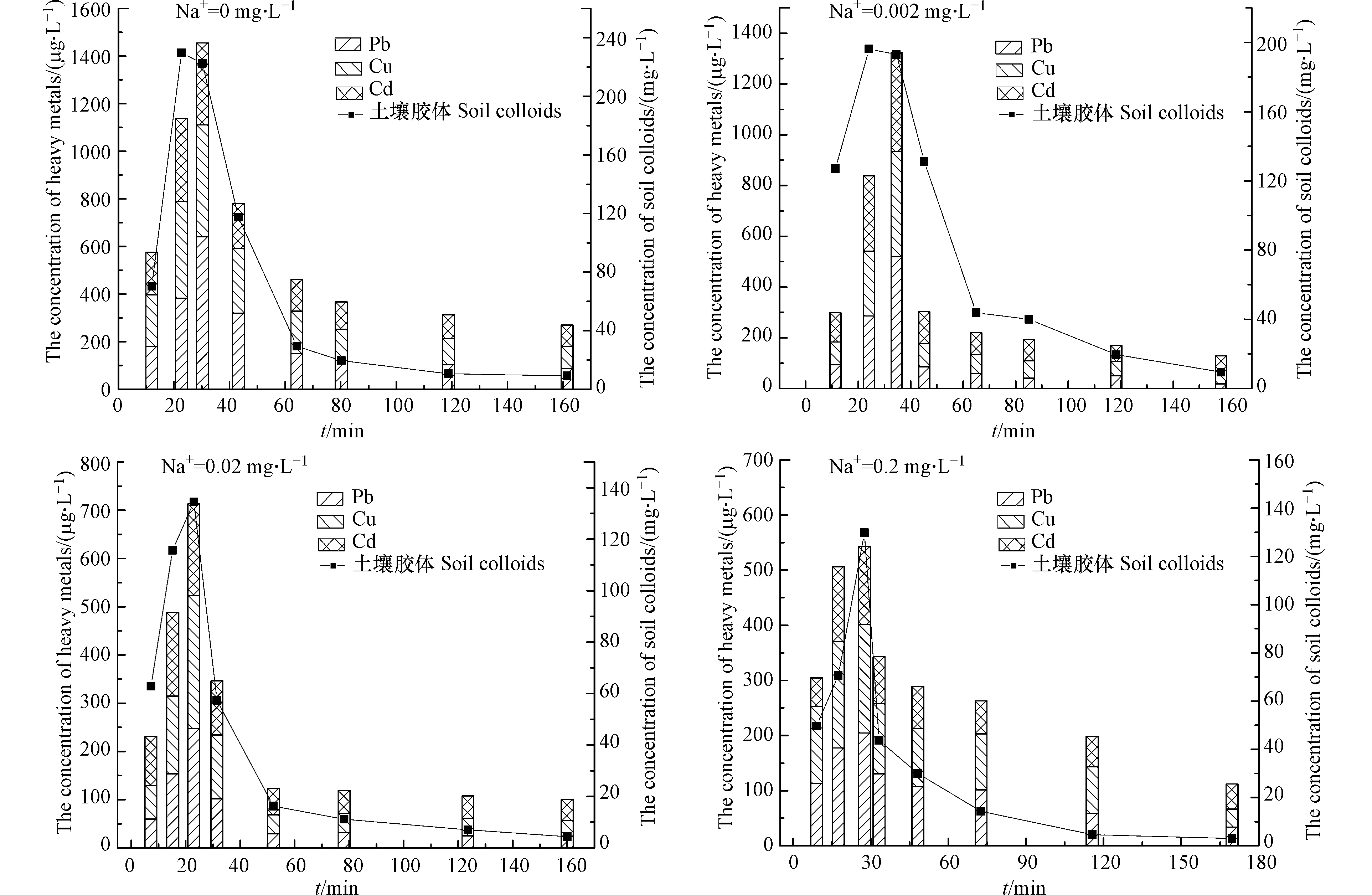
调节模拟降雨溶液Na+浓度分别为0、0.002、0.02、0.2 mol·L−1,以3 mm·min−1降雨强度对下渗柱进行人工模拟降雨,测定不同时间下出流液中土壤胶体及其携带的重金属浓度,结果如图4所示。
由图4可见,进水溶液Na+为0 mol·L−1时,土壤胶体的峰值释放量为229.67 mg·L−1,Pb、Cu和Cd峰值释放量分别高达640.48、470.05、344.66 μg·L−1,明显高于Na+为0.002、0.02、0.2 mol·L−1时土壤胶体及重金属的峰值释放量,故进水Na+存在能够抑制土壤胶体对重金属的携带迁移能力;且随进水Na+离子强度增加,土壤胶体释放量逐渐降低,其对Pb、Cu和Cd的携带迁移能力也逐渐降低;即进水Na+存在能够抑制土壤胶体对重金属的携带迁移能力,进水Na+浓度越高,下渗柱同一出流时刻土壤胶体浓度越低、携带重金属的量也越少。这是因为进水Na+离子强度越高,土壤胶体表面呈负电的压缩双电层越容易被破坏,造成土壤胶体与土壤颗粒之间的静电斥力减弱,致使土壤胶体通过桥接、表面沉积等作用团聚于土壤颗粒表面不易被释放[19]。因此,进水Na+强度越高,下渗柱淋出液中胶体释放浓度降低。此外,进水Na+加入使土壤胶体表面部分可吸附位点被抢占[20],导致其对重金属的携带迁移量减少,使更多的重金属被滞留与下渗柱土壤中。因此,降雨入渗携带的Na+能抑制土壤胶体释放,降低土壤胶体-重金属的共迁移量。
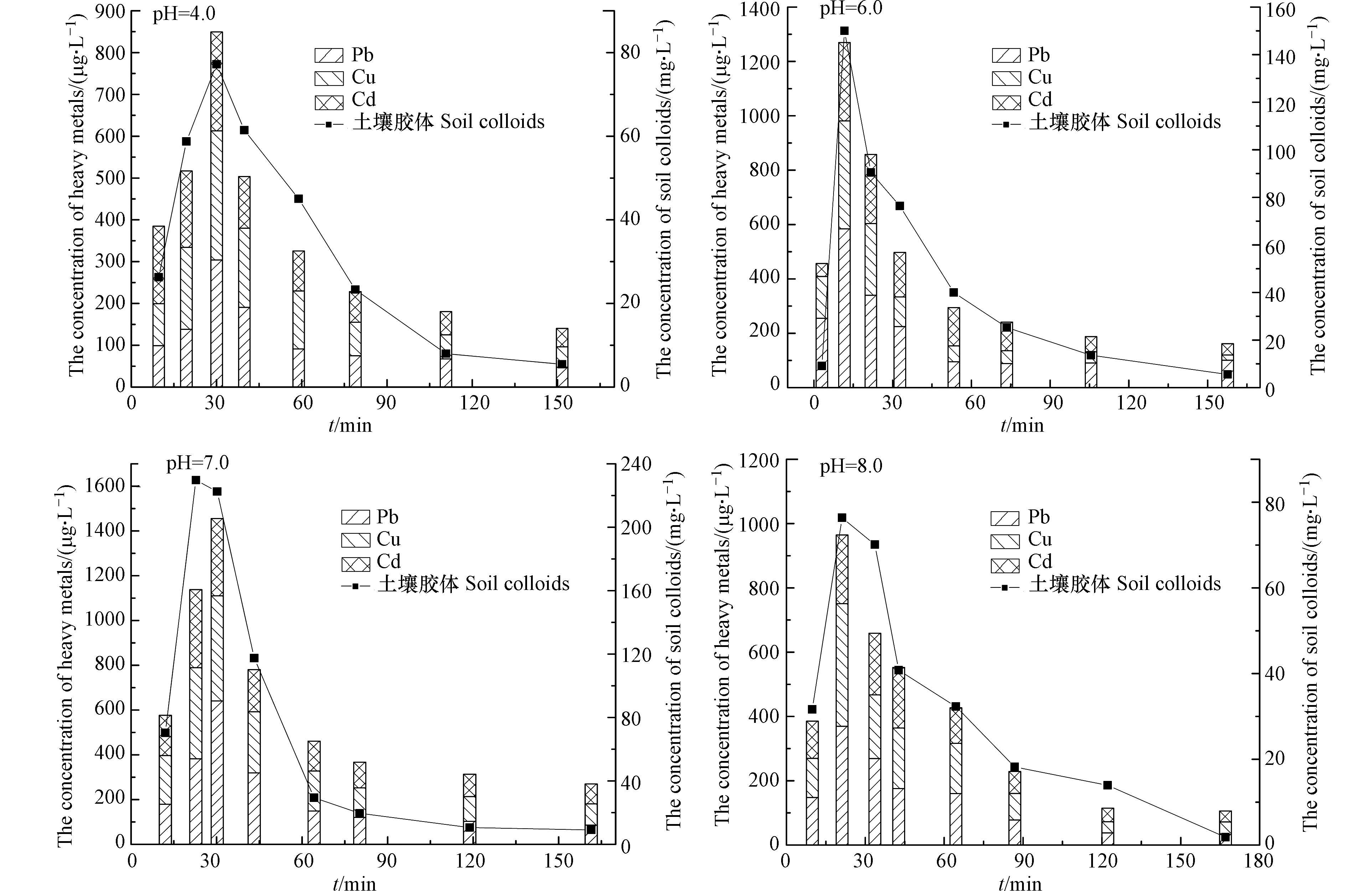
2.3.2 入渗径流pH值对下渗柱土壤胶体-重金属共释放迁移的影响
调节模拟降雨溶液pH分别为4.0、6.0、7.0和8.0,以3 mm·min−1降雨强度对下渗柱进行人工模拟降雨,测定不同时间下淋出液中土壤胶体及其携带的重金属浓度,结果如图5所示。由图5可知,土壤胶体及其携带重金属的输出浓度均随进水pH升高呈先增强后逐渐降低的趋势,在中性条件时土壤胶体及其携带的重金属出流峰值浓度达到最高。进水pH值较低时,土壤胶体表面的负电荷与降雨入渗引入的大量H+发生电中和反应,使得土壤胶体和土壤颗粒之间的静电斥力降低,土壤胶体更易团聚或沉淀在土壤颗粒表面而不被释放,由此其携带迁移的重金属量也降低;随进水pH值升高至7.0,因H+减少致使土壤胶体和土壤颗粒之间静电斥力变大,土壤胶体易于携带重金属释放迁移,使淋出液中土壤胶体和重金属浓度均增加;当进水pH继续升高至8.0时,虽然溶液中大量OH−会使得土壤胶体与土壤颗粒间的静电斥力进一步增大从而增加土壤胶体释放量,但因调节pH时使用了NaOH溶液引入了Na+,Na+破坏了土壤胶体颗粒扩散双电子层中的静电平衡,两者共同作用最终导致土壤颗粒和土壤胶体的静电斥力降低,淋出液中土壤胶体浓度减少,其携带迁移的重金属量也减少。
2.4 土壤胶体粒径对下渗柱重金属释放迁移的影响
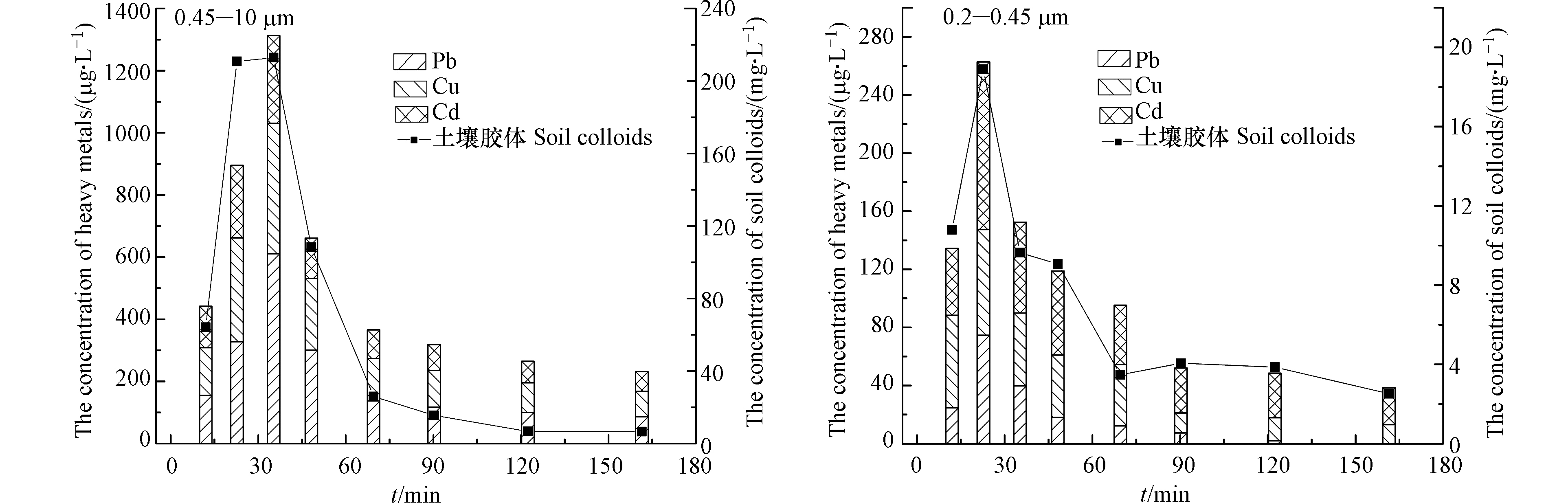
采用纯水对下渗柱以3 mm·min−1的降雨强度进行模拟降雨,出流液中0.45—10 µm和0.2—0.45 µm两种粒径土壤胶体及其携带的重金属浓度如图6所示。
由图6可见,在同一出流时刻,下渗柱释放的0.2—0.45 µm土壤胶体浓度明显低于0.45—10 µm的土壤胶体;且与粒径为0.45—10 μm的土壤胶体相比,0.2—0.45 μm胶体峰值出流时间明显提前,这是由于小粒径胶体更容易穿透土壤空隙释出造成的。虽然下渗柱中0.45—10 μm胶体携带出流的重金属浓度明显高于0.2—0.45 µm土壤胶体,但0.2—0.45 μm胶体对Pb、Cu和Cd的携带能力(0.029、0.050、0.066 mg·mg−1)却高于0.45—10 μm胶体(0.028、0.024、0.017 mg·mg−1)。这是因为土壤胶体粒径越小,土壤胶体比表面积越大且布朗运动越明显[21],对重金属离子的吸附携带能力越强;结合2.2.2节不同粒径土壤胶体可移动性RMV值可见,0.2—0.45 μm土壤胶体可移动性较强,其携带重金属在下渗柱中的迁移速度较快。因此,在下渗设施中应着重关注小粒径土壤胶体携带重金属的向下迁移行为。
3. 结论(Conclusion)
(1)降雨入渗会引起下渗设施中土壤胶体与重金属Pb、Cu和Cd同步释放迁移,Zeta电位和RMV值结果表明与重金属结合后土壤胶体可移动性减弱,迁移能力降低。在降雨初期土壤胶体与重金属的共释放迁移作用较明显,随降雨历时增加两者的释放量均逐渐降低至稳定。
(2)土壤胶体-重金属共释放迁移量随降雨强度增强而增高,但超过一定降雨强度后与土壤胶体共释放迁移的重金属量增幅降低。在同一降雨强度下,土壤胶体对3种重金属迁移携带能力顺序依次为:Pb>Cu>Cd。
(3)降雨入渗引起的土壤溶液化学条件变化对土壤胶体-重金属共释放迁移量影响较大,土壤胶体-Pb、Cu和Cd的共迁移量随入渗溶液Na+浓度的减小而增加,随入渗水pH的升高呈先增多后降低的趋势,且土壤胶体粒径越小其携带重金属离子迁移的能力越强。
-
表 1 化合物的保留时间、定量离子、定性离子和定量内标
Table 1. Retention time, quantitative ions, qualitative ions and quantitative internal standard of compounds
序号Number 化合物名称Compound 保留时间/min RT 定量离子Quantitative ion 定性离子Qualitative ion 定量内标Quantitative internal standard 序号Number 化合物名称Compound 保留时间/min RT 定量离子Quantitative ion 定性离子Qualitative ion 定量内标Quantitative internal standard 1 萘 6.98 128 127 D8-萘 42 PCB123 25.86 325.8 255.9 13C-PCB101 2 D8-萘 7.02 136 108 D10-芘 43 o,p'-DDT 26.00 236.8 235 13C-p,p'-DDD 3 邻苯二甲酸二甲酯 9.42 163 77 D10-苊 44 PCB118 26.09 325.8 255.9 13C-PCB101 4 苊烯 9.72 152 151 D10-苊 45 PCB114 26.52 325.8 255.9 13C-PCB101 5 D10-苊 10.05 164 163 D10-芘 46 13C-p,p'-DDD 26.61 247.1 177.2 13C-p,p'-DDE 6 苊 10.14 154 153 D10-苊 47 p,p'-DDD 26.62 236.8 235 13C-p,p'-DDD 7 邻苯二甲酸二乙酯 11.19 177 149 D10-苊 48 硫丹2 26.72 241 195 13C-p,p'-DDT 8 芴 11.77 166. 165 D10-苊 49 13C-PCB153 26.74 371.9 301.9 13C-PCB138 9 13C-α-六六六 14.08 225 189 13C-p,p'-DDE 50 PCB153 26.75 359.8 289.8 13C-PCB153 10 α-六六六 14.11 218.8 182.8 13C-α-六六六 51 PCB105 27.19 325.8 255.9 13C-PCB101 11 六氯苯 14.42 283.8 248.8 13C-α-六六六 52 异狄氏剂醛 27.20 345 279 13C-p,p'-DDT 12 γ-六六六 15.50 218.7 180.9 13C-α-六六六 53 邻苯二甲酸丁基卞基酯 27.32 206 149 D12-䓛 13 D10-菲 15.92 188 184 D10-芘 54 13C-p,p'-DDT 27.88 247.1 177.2 13C-p,p'-DDE 14 菲 16.04 178. 176 D10-菲 55 p,p'-DDT 27.89 236.8 235 13C-p,p'-DDT 15 蒽 16.31 178 176 D10-菲 56 13C-PCB138 27.90 371.9 301.9 13C-PCB138 16 β-六六六 16.77 218.7 180.9 13C-α-六六六 57 PCB138 27.92 359.8 289.8 13C-PCB153 17 13C-PCB28 17.55 270 198 13C-PCB138 58 PCB126 28.83 325.8 255.9 13C-PCB101 18 PCB28 17.57 257.8 186.1 13C-PCB28 59 PCB167 29.37 359.8 289.8 13C-PCB153 19 δ-六六六 17.65 218.8 182.8 13C-α-六六六 60 甲氧滴滴涕 29.97 227.1 212 13C-p,p'-DDT 20 七氯 17.73 271.8 100 13C-α-六六六 61 异狄氏剂酮 30.01 316.9 281 13C-p,p'-DDT 21 邻苯二甲酸二丁酯 18.42 205 149 D10-菲 62 PCB156 30.27 359.8 289.8 13C-PCB153 22 13C-PCB52 18.71 304 232.1 13C-PCB138 63 邻苯二甲酸二(2-乙基)己酯 30.30 167 149 D12-䓛 23 PCB52 18.72 291.8 221.9 13C-PCB52 64 PCB157 30.42 359.8 289.8 13C-PCB153 24 艾氏剂 19.07 293 262.7 13C-α-六六六 65 苯并(a)蒽 30.48 228 226 D12-䓛 25 环氧七氯 21.35 352.8 262.9 13C-γ-氯丹 66 D12-苝 30.54 240 236 D10-芘 26 荧蒽 22.40 202 101 D10-菲 67 硫丹硫酸酯 30.55 271.7 238.7 13C-p,p'-DDT 27 13C-o,p'-DDE 22.48 330 258.1 13C-p,p'-DDE 68 13C-PCB180 30.59 405.9 335.9 13C-PCB138 28 13C-PCB101 22.93 337.9 267.9 13C-PCB138 69 PCB180 30.60 393.8 323.8 13C-PCB180 29 PCB101 22.94 325.8 255.9 13C-PCB101 70 䓛 30.70 228 226 D12-䓛 30 13C-γ-氯丹 22.96 382.9 276.9 13C-p,p'-DDE 71 灭蚁灵 31.87 272 236.8 13C-p,p'-DDT 31 γ-氯丹 22.98 374.7 271.7 13C-γ-氯丹 72 PCB169 32.01 359.8 289.8 13C-PCB153 32 α-氯丹 23.18 374.7 372.8 13C-γ-氯丹 73 PCB189 33.01 393.8 323.8 13C-PCB180 33 硫丹1 23.24 240.9 195 13C-o,p'-DDE 74 邻苯二甲酸二辛酯 33.33 279 149 D12-䓛 34 D12-䓛 23.54 212 106 D10-芘 75 苯并(b)荧蒽 34.88 252 126 D12-䓛 35 芘 23.67 202 101 D10-菲 76 苯并(k)荧蒽 34.94 252 126 D12-䓛 36 13C-p,p'-DDE 24.28 330 258.1 13C-p,p'-DDE 77 苯并(a)芘 35.72 252 126 D12-䓛 37 p,p'-DDE 24.29 317.8 246 13C-o,p'-DDE 78 D10-芘 35.84 264 260 D10-芘 38 狄氏剂 24.45 276.9 262.9 13C-p,p'-DDD 79 茚并(1,2,3-cd)芘 38.87 276 138 D12-苝 39 PCB81 24.73 291.8 221.9 13C-PCB52 80 二苯并(a,h)蒽 38.90 278 139 D12-苝 40 PCB77 25.22 291.8 221.9 13C-PCB52 81 苯并(g,h,i)苝 39.79 276 138 D12-苝 41 异狄氏剂 25.41 281 262.9 13C-p,p'-DDD 表 2 63 POPs的方法性能参数
Table 2. Method performance parameters of 63 POPs
化合物Compound 标准曲线相对相应因子的相对标准偏差/% RSD of RRF 方法检出限/(μg·kg−1)Detection limit 测定下限/(μg·kg−1)Quantitative lower limit 低浓度Low concentration(n=6) 高浓度High concentration(n=6) 加标量/(μg·kg−1)Adding standard value 回收率/% Recovery RSD/% 加标量/(μg·kg−1)Adding standard value 回收率/% Recovery RSD/% PCB28 7.0 0.1 0.4 2.0 100—107 2.4 5.0 102—106 1.0 PCB52 6.3 0.1 0.4 2.0 103— 106 1.4 5.0 102—107 2.0 PCB101 6.9 0.1 0.4 2.0 102— 109 2.6 5.0 100—102 0.9 PCB81 6.0 0.1 0.4 2.0 102— 109 3.2 5.0 104—113 3.1 PCB77 7.3 0.2 0.8 2.0 98— 106 3.1 5.0 100—109 3.2 PCB123 4.4 0.1 0.4 2.0 96— 107 4.1 5.0 98—105 2.5 PCB118 5.6 0.1 0.4 2.0 102— 105 1.2 5.0 99—104 2.2 PCB114 6.4 0.1 0.4 2.0 100— 106 2.6 5.0 100—106 2.2 PCB153 7.0 0.1 0.4 2.0 104— 113 3.4 5.0 101—108 2.3 PCB105 10.9 0.1 0.4 2.0 100— 105 1.9 5.0 100—104 1.7 PCB138 7.0 0.1 0.4 2.0 101— 110 3.2 5.0 105—109 1.2 PCB126 7.1 0.1 0.4 2.0 98— 106 2.9 5.0 108—112 1.6 PCB167 7.8 0.1 0.4 2.0 104— 113 3.4 5.0 103—112 2.8 PCB156 6.0 0.1 0.4 2.0 105— 113 2.5 5.0 107—113 2.0 PCB157 6.0 0.1 0.4 2.0 98— 104 2.5 5.0 101—109 2.8 PCB180 6.8 0.2 0.8 2.0 101— 108 2.8 5.0 110—113 0.9 PCB169 5.9 0.2 0.8 2.0 97— 106 3.5 5.0 104—114 3.1 PCB189 7.3 0.2 0.8 2.0 97— 102 1.8 5.0 101—105 1.4 α−六六六 3.8 0.4 1.6 10.0 84— 91 3.3 50.0 91—104 5.0 六氯苯 3.5 0.6 2.4 10.0 89— 92 1.2 50.0 94—101 2.7 γ−六六六 2.3 0.4 1.6 10.0 89— 96 2.7 50.0 98—103 1.8 β−六六六 2.7 0.4 1.6 10.0 95— 98 1.3 50.0 99—102 1.0 δ−六六六 2.5 0.5 2.0 10.0 94— 98 1.6 50.0 99—102 1.3 七氯 3.0 0.6 2.4 10.0 93— 106 4.5 50.0 98—104 2.4 艾氏剂 16.7 0.5 2.0 10.0 105— 115 3.1 50.0 96—117 7.7 环氧七氯 2.1 0.3 1.2 10.0 84— 98 5.4 50.0 98—101 1.2 γ−氯丹 3.4 0.3 1.2 10.0 98— 100 1.0 50.0 96—103 2.7 α−氯丹 3.1 0.3 1.2 10.0 92— 95 1.3 50.0 94—102 3.4 硫丹1 3.7 0.4 1.6 10.0 95— 100 1.8 50.0 98—102 1.6 p,p'−DDE 2.9 0.3 1.2 10.0 87— 91 1.8 50.0 88—102 6.0 狄氏剂 4.5 0.5 2.0 10.0 80—85 2.3 50.0 93—102 3.6 异狄氏剂 1.4 0.7 2.8 10.0 87—92 2.0 50.0 97—103 2.1 o,p'−DDT 15.7 1.5 6.0 10.0 112—119 2.3 50.0 94—101 2.9 p,p'−DDD 8.1 0.6 2.4 10.0 94—114 7.9 50.0 89—101 5.0 硫丹2 5.7 0.4 1.6 10.0 87—94 2.9 50.0 81—105 9.3 异狄氏剂醛 1.8 1.2 4.8 10.0 89—94 1.9 50.0 81—101 8.5 p,p'−DDT 8.0 1.0 4.0 10.0 89—98 4.5 50.0 94—123 10.2 硫丹硫酸酯 14.7 0.4 1.6 10.0 85—100 5.4 50.0 94—116 10.0 甲氧滴滴涕 6.5 0.6 2.4 10.0 92—97 2.0 50.0 91—103 4.4 异狄氏剂酮 16.3 0.4 1.6 10.0 101—110 3.3 50.0 78—104 10.6 灭蚁灵 8.9 0.3 1.2 10.0 81—84 1.6 50.0 87—102 6.0 萘 8.3 1.5 6.0 20.0 95—102 2.9 200 105—111 2.0 苊烯 5.9 0.9 3.6 20.0 88—95 2.6 200 98—99 0.4 苊 7.1 0.4 1.6 20.0 90—93 1.3 200 97—99 0.8 芴 7.2 0.7 2.8 20.0 89—94 2.4 200 101—103 1.0 菲 7.2 1.0 4.0 20.0 92—100 3.3 200 97—102 2.0 蒽 7.8 0.9 3.6 20.0 88—94 2.8 200 108—110 0.6 荧蒽 7.6 0.8 3.2 20.0 101—108 2.7 200 101—108 2.3 芘 6.9 0.7 2.8 20.0 103—108 2.0 200 106—109 0.9 苯并(a)蒽 7.2 1.6 6.4 20.0 100—107 2.7 200 100—103 1.0 䓛 7.6 1.3 5.2 20.0 81—89 3.7 200 96—101 1.7 苯并(b)荧蒽 7.1 1.9 7.6 20.0 98—107 3.8 200 92—97 1.8 苯并(k)荧蒽 6.2 0.7 2.8 20.0 76—80 2.0 200 95—100 1.6 苯并(a)芘 5.3 1.0 4.0 20.0 99—106 2.4 200 96—100 1.5 茚并(1,2,3-c,d)芘 6.4 0.8 3.2 20.0 92—99 3.0 200 100—104 1.6 二苯并(a,h)蒽 5.3 0.8 3.2 20.0 93—99 2.7 200 100—107 2.3 苯并(g,h,i)苝 8.3 1.1 4.4 20.0 94—101 2.7 200 100—103 1.1 邻苯二甲酸二甲酯 11.6 1.4 5.6 20.0 92—104 4.3 200 94—103 3.0 邻苯二甲酸二乙酯 6 2.2 8.8 20.0 99—106 2.3 200 102—108 2.0 邻苯二甲酸二丁酯 13.2 1.2 4.8 20.0 107—116 3.6 200 98—106 2.6 邻苯二甲酸丁基卞基酯 8.1 1 4.0 20.0 97—108 4.8 200 91—96 1.7 邻苯二甲酸二(2-乙基)己酯 6.6 1.2 4.8 20.0 101—107 2.5 200 106—113 2.2 邻苯二甲酸二辛酯 7.5 1.5 6.0 20.0 99—110 3.8 200 99—107 3.4 表 3 土壤中PCBs、OCPs和PAHs标准物质测定结果(μg·kg-1)
Table 3. Determination results of Certified reference materials(PCBs, OCPs and PAHs)
化合物 Compound 标准值 Certified value 测定值Determined value 合格区间Prediction interval 化合物 Compound 标准值Certified value 测定值Determined value 合格区间 Prediction interval PCB28 178 172 101—255 p,p'-DDE 238 224 117—273 PCB52 186 207 97.4—274 狄氏剂 478 382 231—527 PCB101 42.2 42 24.5—60 异狄氏剂 230 178 106—283 PCB81 194 206 140—248 o,p'-DDT 199 118 89.2—232 PCB77 214 241 146—283 p,p'-DDD 324 248 145—379 PCB123 141 136 96.7—186 硫丹2 60.5 59 15.4—54.0 PCB118 219 201 156—281 异狄氏剂醛 481 312 126—468 PCB114 145 132 107—183 p,p'-DDT 78.6 72 32.1—92.9 PCB153 87 99 63—111 硫丹硫酸酯 275 247 112—319 PCB105 246 232 174—319 甲氧滴滴涕 392 358 148—511 PCB138 92.1 104 63.4—121 异狄氏剂酮 370 291 153—414 PCB126 76.2 83 54.7—98 灭蚁灵 127 70 51.2—140 PCB167 277 279 204—351 萘 400 387 40.0—461 PCB156 145 156 112—177 苊烯 391 265 39.1—501 PCB157 85.8 60 66.5—105 苊 269 261 50.9—309 PCB180 232 232 176—288 芴 166 179 33.6—197 PCB169 289 328 208—369 菲 217 232 64.8—244 PCB189 305 347 242—368 蒽 302 233 73.8—332 α-六六六 319 312 120—346 荧蒽 263 292 99.9—313 六氯苯 407 306 193—448 芘 327 360 103—376 γ-六六六 234 228 89—256 苯并(a)蒽 306 247 108—337 β-六六六 265 223 104—291 䓛 455 449 142—513 δ-六六六 365 323 145—412 苯并(b)荧蒽 245 263 95.8—270 七氯 472 333 204—535 苯并(k)荧蒽 222 249 84.4—246 艾氏剂 277 236 123—301 苯并(a)芘 54.2 52 6.78—70.5 环氧七氯 299 298 139—326 并(1,2,3-c,d)芘 106 102 31.8—136 γ-氯丹 194 159 93—213 147 146 47.0—163 α-氯丹 90.7 82 42—100 苯并(g,h,i)苝 401 313 115—441 硫丹1 339 242 75—275 表 4 土壤中PAEs标准物质测定结果
Table 4. Determination results of standard samples(PAEs)
化合物 Compound 标准值/ (mg·kg-1)Certified value 测定值/ (mg·kg-1)Determined value 回收率 /%Recovery RSD% 邻苯二甲酸二甲酯 71.5 39.8 56 2.6 邻苯二甲酸二乙酯 90.7 63.2 70 1.9 邻苯二甲酸二丁酯 166 97.6 59 1.6 邻苯二甲酸丁基苄酯 146 73.7 50 1.5 邻苯二甲酸二(2-乙基)己酯 157 110 70 2.0 邻苯二甲酸二正辛酯 134 119 89 2.8 表 5 三种净化方式化合物的回收率和相对标准偏差结果
Table 5. Recovery and RSD of compounds with different methods
化合物 Compound 回收率(RSD)/% Recovery 化合物 Compound 回收率 (RSD)/% Recovery 对照样Control 低温分配净化LTPE 固相萃取净化SPE -Florisil 对照样Control 低温分配净化LTPE 固相萃取净化SPE -Florisil PCB28 98(8.3) 96(6.4) 97(6.7) o,p'-DDT 62(11.7) 59(3.1) 49(9.0) PCB52 109(8.7) 111(6.6) 110(7.9) p,p'-DDD 76(6.2) 77(5.4) 70(7.8) PCB101 102(5.3) 99(3.6) 98(4.9) 硫丹2 86(12.7) 98(10.6) 81(14.2) PCB81 110(7.8) 106(2) 105(4.5) 异狄氏剂醛 64(7.1) 65(5.7) 62(13.2) PCB77 114(8.5) 113(3.1) 109(7.1) p,p'-DDT 97(12.6) 92(4.3) 85(3.7) PCB123 98(5.7) 96(4.8) 98(8.2) 硫丹硫酸酯 87(8.7) 90(8.7) 81(9.9) PCB118 91(6.1) 92(5.6) 93(7.6) 甲氧滴滴涕 93(5.9) 91(4.6) 72(2.5) PCB114 90(7.0) 91(4.7) 89(5.5) 异狄氏剂酮 80(4.9) 79(3.8) 78(4.3) PCB153 114(7.9) 114(4.4) 111(7.6) 灭蚁灵 56(9.9) 55(10.2) 52(2.1) PCB105 93(7.8) 94(5.1) 94(5.4) 萘 96(7.2) 97(3.6) 100(9.1) PCB138 113(7.8) 113(5.4) 112(8.9) 苊烯 65(8) 68(6.6) 65(7.8) PCB126 111(8.7) 108(5.8) 108(8.6) 苊 94(6.3) 97(2.3) 96(3.7) PCB167 103(6.8) 101(4.7) 99(6.5) 芴 108(4.9) 108(3.3) 104(4.8) PCB156 108(7.8) 108(5.3) 106(7.4) 菲 115(6.5) 107(1.8) 95(3.7) PCB157 74(7.6) 70(3.8) 70(7.2) 蒽 78(6) 77(3.3) 77(6.5) PCB180 105(6.0) 100(4.5) 101(6.9) 荧蒽 110(1.1) 111(0.8) 110(0.2) PCB169 119(4.1) 114(3.7) 110(7.1) 芘 109(4.3) 110(3.6) 109(4.2) PCB189 119(7.3) 110(1.9) 112(5.7) 苯并(a)蒽 84(9.4) 81(6.1) 80(7.5) α-六六六 94(5.4) 98(3.3) 91(8.6) 䓛 100(3.8) 99(2.6) 97(2.5) 六氯苯 74(5.6) 75(2.5) 69(7.8) 苯并(b)荧蒽 107(1.7) 107(1.2) 103(2.4) γ-六六六 91(5.2) 97(2.8) 90(8.7) 苯并(k)荧蒽 114(4.7) 112(3.3) 106(3.7) β-六六六 81(6.9) 84(2.4) 79(10.2) 苯并(a)芘 94(2.2) 96(1.1) 93(2.3) δ-六六六 88(5.2) 89(3.9) 88(10.0) 茚并(1,2,3-cd)芘 95(4.3) 96(1.5) 91(5.7) 七氯 73(9.5) 71(3.6) 66(10.4) 二苯并(a,h)蒽 91(4.7) 100(1.8) 80(6.9) 艾氏剂 90(6.8) 85(3.5) 81(7.9) 苯并(g,h,i)苝 76(6.4) 78(5.5) 68(9.1) 环氧七氯 100(13) 100(8.8) 84(9.3) 邻苯二甲酸二甲酯 56(3.8) 56(1.7) 56(2.6) γ-氯丹 85(10.8) 82(5.5) 75(7.4) 邻苯二甲酸二乙酯 71(5.2) 70(0.1) 72(1.9) α-氯丹 96(9.2) 90(6.2) 89(9.6) 邻苯二甲酸二丁酯 65(5.5) 59(0.9) 64(0.3) 硫丹1 72(3.1) 71(1.7) 68(7.0) 邻苯二甲酸丁基苄酯 54(4.9) 50(3.2) 51(1.5) p,p'-DDE 90(8.8) 94(2.9) 83(6.6) 邻苯二甲酸二(2-乙基)己酯 77(2.8) 70(2.8) 52(0.9) 狄氏剂 79(8.3) 80(2.5) 70(0.4) 邻苯二甲酸二正辛酯 90(6.1) 89(1.9) 63(1.1) 异狄氏剂 78(7.3) 78(5.8) 66(11.9) -
[1] 于艳新, 李奇, 王慧, 等. 食物中典型持久性有机污染物(POPs)的生物可给性研究综述 [J]. 生态环境学报, 2015, 24(8): 1406-1414. doi: 10.16258/j.cnki.1674-5906.2015.08.023 YU Y X, LI Q, WANG H, et al. The bioaccessibility of typical persistent organic pollutants(POPs) in food matrix: A review [J]. Ecology and Environmental Sciences, 2015, 24(8): 1406-1414(in Chinese). doi: 10.16258/j.cnki.1674-5906.2015.08.023
[2] LÜ H, MO C H, ZHAO H M, et al. Soil contamination and sources of phthalates and its health risk in China: A review [J]. Environmental Research, 2018, 164: 417-429. doi: 10.1016/j.envres.2018.03.013 [3] 吴亮, 岳中慧, 张皓, 等. ASE-GC-MS法同时测定农用地土壤中的多环芳烃、多氯联苯和有机氯农药 [J]. 化学分析计量, 2019, 28(4): 7-12, 17. doi: 10.3969/j.issn.1008-6145.2019.04.002 WU L, YUE Z H, ZHANG H, et al. Simultaneous determination of polycyclic aromatic hydrocarbons, polychlorinated biphenyls and organochlorine pesticides in soil by GC-MS coupled with accelerated solvent extraction [J]. Chemical Analysis and Meterage, 2019, 28(4): 7-12, 17(in Chinese). doi: 10.3969/j.issn.1008-6145.2019.04.002
[4] 张延平, 陈振超, 孙晓薇, 等. 固相萃取/气相色谱-串联质谱法测定竹笋产地土壤中42种持久性有机污染物 [J]. 分析测试学报, 2018, 37(12): 1431-1438. doi: 10.3969/j.issn.1004-4957.2018.12.005 ZHANG Y P, CHEN Z C, SUN X W, et al. Determination of 42 persistent organic pollutants in geographical original soil of bamboo shoot by gas chromatography-tandem mass spectrometry with solid phase extraction [J]. Journal of Instrumental Analysis, 2018, 37(12): 1431-1438(in Chinese). doi: 10.3969/j.issn.1004-4957.2018.12.005
[5] 张丽萍, 项亚男, 王宗义, 等. 冷冻辅助相分离-气相色谱-串联质谱法检测设施蔬菜与土壤中的邻苯二甲酸酯 [J]. 食品安全质量检测学报, 2020, 11(3): 847-853. ZHANG L P, XIANG Y N, WANG Z Y, et al. Detection of phthalates in vegetables and soil in facilities by freezing-assisted phase separation-gas chromatography-tandem mass spectrometry [J]. Journal of Food Safety & Quality, 2020, 11(3): 847-853(in Chinese).
[6] FANG J, WANG K X. Multiresidual analysis of organochlorine pesticides, polychlorinated biphenyls and polycyclic aromatic hydrocarbons in marine shellfishes by gas chromatography-ion trap mass spectrometry [J]. Chinese Journal of Analytical Chemistry, 2007, 35(11): 1607-1613. doi: 10.1016/S1872-2040(07)60095-4 [7] LEE J, LEE S Y, PARK K W, et al. Simultaneous determination of PCBs, OCPs and PAHs in mussel by ultrasound-assisted cloudy extraction and gas chromatography-tandem mass spectrometry [J]. Food Additives & Contaminants:Part A, 2020, 37(10): 1730-1743. [8] 中华人民共和国环境保护部. 中华人民共和国环保行业标准: 土壤和沉积物 多氯联苯的测定 气相色谱-质谱法 HJ 743-2015[S]. 北京: 中国环境科学出版社, 2015. Ministry of Environmental Protection of the People's Republic of China. Environmental Protection Standard of the People's Republic of China: Soil and sediment-Determination of polychlorinated biphenyls(PCBs)-Gas chromatography mass spectrometry. HJ 743-2015[S]. Beijing: China Environment Science Press, 2015(in Chinese). chromatography mass spectrometry[S]. Beijing: China Environmental Science Press, 2015(in Chinese).
[9] 中华人民共和国环境保护部. 中华人民共和国环保行业标准: 土壤和沉积物 有机氯农药的测定 气相色谱-质谱法 HJ 835-2017[S]. 北京: 中国环境出版社, 2017. Ministry of Environmental Protection of the People's Republic of China. Environmental Protection Standard of the People's Republic of China: Soil and sediment-Determination of organochlorine pesticides-Gas chromatography/Mass spectrometry. HJ 835-2017[S]. Beijing: China Environmental Science Press, 2017(in Chinese).
[10] 中华人民共和国环境保护部. 中华人民共和国环保行业标准: 土壤和沉积物 多环芳烃的测定 气相色谱-质谱法 HJ 805—2016[S]. 北京: 中国环境科学出版社, 2016. Ministry of Environmental Protection of the People's Republic of China. Environmental Protection Standard of the People's Republic of China: Soil and Sediment–Determination of polycyclic aromatic hydrocarbon by Gas chromatography-Mass Spectrometry Method. HJ 805—2016[S]. Beijing: China Environment Science Press, 2016(in Chinese). chromatography/Mass spectrometry Method[S]. Beijing: China Environmental Science Press, 2016(in Chinese).
[11] 中华人民共和国生态环境部. 中华人民共和国环保行业标准: 土壤和沉积物 6种邻苯二甲酸酯类化合物的测定 气相色谱-质谱法 HJ 1184-2021[S]. 北京: 中国环境科学出版社, 2021. Environmental Protection Standard of the People's Republic of China. Soil and sediment-Determination of 6 Phthalate Esters(PAEs)-Gas Chromatography/Mass spectrometry HJ 1184-2021[S]. Beijing: China Environment Science Press, 2021 (in Chinese).
[12] LLOMPART M, CELEIRO M, DAGNAC T. Microwave-assisted extraction of pharmaceuticals, personal care products and industrial contaminants in the environment [J]. TrAC Trends in Analytical Chemistry, 2019, 116: 136-150. doi: 10.1016/j.trac.2019.04.029 [13] 罗治定, 万秋月, 王芸, 等. 微波萃取-气相色谱质谱法测定土壤中的多环芳烃 [J]. 天津理工大学学报, 2019, 35(4): 53-57. doi: 10.3969/j.issn.1673-095X.2019.04.012 LUO Z D, WAN Q Y, WANG Y, et al. PAHs in soil extracted by microwave extraction and analyzed by gas chromatography-mass spectrometry [J]. Journal of Tianjin University of Technology, 2019, 35(4): 53-57(in Chinese). doi: 10.3969/j.issn.1673-095X.2019.04.012
[14] LIAO C, YANG P, XIE Z W, et al. Application of GC-triple quadrupole MS in the quantitative confirmation of polycyclic aromatic hydrocarbons and phthalic acid esters in soil [J]. Journal of Chromatographic Science, 2010, 48(3): 161-166. doi: 10.1093/chromsci/48.3.161 [15] HALFADJI A, TOUABET A, PORTET-KOLTALO F, et al. Concentrations and source identification of polycyclic aromatic hydrocarbons (PAHs) and polychlorinated biphenyls (PCBs) in agricultural, urban/residential, and industrial soils, east of Oran (northwest Algeria) [J]. Polycyclic Aromatic Compounds, 2019, 39(4): 299-310. doi: 10.1080/10406638.2017.1326947 [16] CARRO N, GARCÍA I, IGNACIO M, et al. Microwave-assisted solvent extraction and gas chromatography ion trap mass spectrometry procedure for the determination of persistent organochlorine pesticides (POPs) in marine sediment [J]. Analytical and Bioanalytical Chemistry, 2006, 385(5): 901-909. doi: 10.1007/s00216-006-0485-3 [17] RAMÍREZ A, TEIXEIRA M, NEVES A, et al. Development and validation of a solid-liquid extraction with low temperature partitioning (SLE/LTP) method for determination of the herbicide indaziflam in Brazilian soils by high performance liquid chromatography (HPLC-UV/vis) [J]. Journal of Experimental Agriculture International, 2018, 21(3): 1-8. [18] 朱芸, 李世刚, 周圆, 等. 加速溶剂萃取-气相色谱质谱法同时测定土壤及沉积物中34种有机氯农药及18种多氯联苯类化合物 [J]. 环境监控与预警, 2019, 11(3): 30-35. ZHU Y, LI S G, ZHOU Y, et al. Simultaneous determination of 34 organochlorine pesticides and 18 polychlorinated biphenyls in soil and sediment by accelerated solvent extraction-gas chromatography-mass spectrometry [J]. Environmental Monitoring and Forewarning, 2019, 11(3): 30-35(in Chinese).
[19] 廖健, 邓超, 陈怡, 等. 西湖景区土壤中邻苯二甲酸酯污染水平、来源分析和空间分布特征 [J]. 环境科学, 2019, 40(7): 3378-3387. doi: 10.13227/j.hjkx.201812207 LIAO J, DENG C, CHEN Y, et al. Pollution levels, sources, and spatial distribution of phthalate esters in soils of the west lake scenic area [J]. Environmental Science, 2019, 40(7): 3378-3387(in Chinese). doi: 10.13227/j.hjkx.201812207
[20] 刘彬, 闫强, 郭丽, 等. 加压流体萃取-硅酸镁柱净化-气相色谱质谱法同时测定土壤中有机氯农药和多环芳烃 [J]. 环境化学, 2019, 38(10): 2212-2221. doi: 10.7524/j.issn.0254-6108.2018112605 LIU B, YAN Q, GUO L, et al. Simultaneous determination of OCPs and PAHs in soil by GC-MSD with ASE and florisil SPE purification [J]. Environmental Chemistry, 2019, 38(10): 2212-2221(in Chinese). doi: 10.7524/j.issn.0254-6108.2018112605
[21] MAGALHÃES E J, NASCENTES C C, AUGUSTI R, et al. Fast determination of benzodiazepines in human urine via liquid-liquid extraction with low temperature partitioning and LC-HRMS [J]. American Journal of Analytical Chemistry, 2012, 3(2): 118-124. doi: 10.4236/ajac.2012.32017 [22] 金梦, 李彦希, 黎玉清, 等. 多环芳烃污染与儿童内暴露负荷的关系 [J]. 环境科学与技术, 2020, 43(1): 212-216. doi: 10.19672/j.cnki.1003-6504.2020.01.031 JIN M, LI Y X, LI Y Q, et al. Relationship between PAHs pollution and exposure levels in children [J]. Environmental Science & Technology, 2020, 43(1): 212-216(in Chinese). doi: 10.19672/j.cnki.1003-6504.2020.01.031
[23] SOUSA D A, GONÇALVES R M, HELENO F F, et al. Chemometric optimization of solid-liquid extraction with low-temperature partition (SLE-LTP) for determination of persistent organic pollutants in Caiman yacare eggs [J]. Microchemical Journal, 2014, 114: 266-272. doi: 10.1016/j.microc.2014.01.012 [24] 刘笑笑, 张菁菁, 李晨曦, 等. 低温微萃取-GCMS/MS联用技术检测食用油中20种持久性污染物 [J]. 食品与发酵工业, 2020, 46(5): 292-298. doi: 10.13995/j.cnki.11-1802/ts.021039 LIU X X, ZHANG J J, LI C X, et al. Determination of 20 persistent pollutants in edible oil by freeze-degreasing-GCMS/MS [J]. Food and Fermentation Industries, 2020, 46(5): 292-298(in Chinese). doi: 10.13995/j.cnki.11-1802/ts.021039
[25] GOULART S M, de QUEIROZ M E L R, NEVES A A, et al. Low-temperature clean-up method for the determination of pyrethroids in milk using gas chromatography with electron capture detection [J]. Talanta, 2008, 75(5): 1320-1323. doi: 10.1016/j.talanta.2008.01.058 [26] GOULART S M, ALVES R D, NEVES A A, et al. Optimization and validation of liquid-liquid extraction with low temperature partitioning for determination of carbamates in water [J]. Analytica Chimica Acta, 2010, 671(1/2): 41-47. -






 下载:
下载: