-
多氯联苯(PCBs)、有机氯农药(OCPs)、氯苯类(CBs)、多环芳烃(PAHs)和邻苯二甲酸酯(PAEs)是典型的持久性有机污染物(POPs),广泛存在于环境中。土壤中的POPs可以通过挥发、扩散等方式在大气、地表水和地下水中相互迁移转换,并会通过生物积累最终会进入食物链,对生态环境和人类健康造成威胁[1-2]。因此,土壤中持久性有机污染物的研究历来是国内外关注的焦点。测定土壤中的POPs主要包括提取、浓缩、净化以及仪器测定等步骤,分析周期长,试剂和耗材消耗大,劳动投入强。国内外针对单一类有机污染物的检测方法比较成熟,近年来研究学者倾向多组分化合物的同步分析趋势 [3-7],但目前针对土壤中多种持久性有机污染物同时预处理和仪器测定的高通量分析方法报道尚少。国内现有的标准分析方法大都是针对某类化合物的分析[8-11],且土壤样品采集后一般要求6—10 d完成萃取,时效性要求高。随着国家对土壤环境管控越来越严,对土壤监测要求日渐增大,迫切需要开发土壤中多种POPs同时测定的高通量分析方法。
传统的提取方式存在试剂用量大、萃取时间长、萃取提取效率低以及稳定性差等缺点,目前研究学者更倾向于使用快速、高效的方法萃取土壤中的有机污染物,微波辅助萃取技术试剂消耗低,仪器管道少,实验操作简单,并可同时处理多个样品,具批量处理优势,常用于土壤中的POPs的提取[12-17]。测定有机污染物常用的净化方式有酸洗、复合硅胶层析柱、凝胶渗透色谱、固相萃取等,酸洗或酸性硅胶净化效果好,但OCPs、PAHs和PAEs等化合物会被浓硫酸氧化,而凝胶渗透色谱仪设备投入高,且仪器管道较多,容易引入PAEs的污染;硅酸镁小柱具有普适性强、操作简便的优点,但是具有柱容量小的缺点[18-20]。低温分配技术(low-temperature partition extraction,LTPE)近年来被证明是性能优越的前处理手段[21],并在多种环境样品有机污染物的前处理中得到应用 [17,22-24]。
本文建立的微波辅助萃取-低温分配净化-气相色谱-质谱法,同时实验处理和检测土壤中的18种多氯联苯、23种有机氯农药(包括五氯苯和六氯苯)、16种多环芳烃和6种邻苯二甲酸酯。实验结果表明,该方法回收率高、平行性好,能满足土壤中63种POPs的检测分析要求,在分析大批量样品时,具批处理优势,显著提高工作效率。
-
气相色谱-质谱联用仪(Thermo,TSQ 8000 EVO)、气相色谱-质谱联用仪(Waters,Micromass Quattro)微波萃取仪(Milestone,ETHOS UP 44位)、旋转蒸发仪(BUCHI,V-100)、氮吹仪(EYELA,MG-2200)、低温冰箱(海尔,DW-40W380)。正己烷、二氯甲烷、丙酮(Honeywell,农残级),硅酸镁固相萃取小柱(CNW,1 g,玻璃材质),微孔滤膜(安谱,0.22 μm),无水硫酸钠(广州牌化学试剂,分析纯),石英砂(广州牌化学试剂,分析纯)。
16种多环芳烃混合标准品,23种OCPs混合标准品,18种PCBs混合标准品,6种邻苯二甲酸酯混合标准品,均购自Accustandard。提取内标:5种氘代多环芳烃混合标准品(包括D8-萘、D10-苊、D10-菲、D12-䓛、D12-苝),购自Accustandard;5种13C标记有机氯农药(包括13C-α-六六六、13C-γ-氯丹、13C-o,p'-DDE,13C-p,p'-DDD,13C-p,p'-DDT),购自CIL;5种13C标记多氯联苯(包括13C-PCB28、13C-PCB52、13C-PCB 101、13C-PCB153、13C-PCB180),购自CIL。进样内标:D10-芘,购自Accustandard ;13C-p,p'-DDE和13C-PCB138,购自CIL。
土壤中18种PCBs有证标准物质(Sigma-Aldrich,CRM962),土壤中23种OCPs有证标准物质(ERA,093),土壤中16种PAHs有证标准物质(ERA,722),土壤中6种PAEs有证标准物质(东莞龙昌智能技术研究院,RUM001)。
-
配制63种POPs6个浓度系列的标准曲线,PCBs浓度范围为0.005、0.01、0.05、0.1、0.2、0.5 μg·mL−1,提取内标和进样内标浓度均为0.1 μg·mL−1;OCPs浓度范围为0.02、0.05、0.1、0.5、1.0、5.0 μg·mL−1,提取内标和进样内标浓度均为0.5 μg·mL−1;PAHs和PAEs浓度范围为0.1、0.25、0.5、1.0、5.0、10.0 μg·mL−1,提取内标和进样内标浓度均为1.0 μg·mL−1。
-
土壤样品采集完毕在4 ℃以下、避光保存运输回实验室,去除石子、叶片等异物,混匀样品,称取10.0 g样品加入适量无水硫酸钠研磨至流沙状。将制备好的样品装入特氟龙材质的微波罐内,加入同位素提取内标,加入30 mL正己烷+丙酮(1+1)混合试剂,在115 ℃条件下微波萃取15 min。提取液旋转蒸发浓缩后,用正己烷转溶并继续旋蒸浓缩至1 mL左右,然后氮吹至0.5 mL左右,于-20 ℃冰箱静置4 h,取上清液或使用微孔滤膜过滤后,转移到进样瓶内,加入进样内标,待测。
-
气相色谱条件:色谱柱为 Rxi-XLB(30 m×0.25 mm×0.25 μm,RESTEK);进样口温度为280 ℃;载气为高纯氦气(99.999%);柱流速为1.0 mL·min−1;进样量1 μL,不分流进样;升温程序为70 ℃(保持2 min),以25 ℃·min−1升温至140 ℃,再以10 ℃·min−1升温至240 ℃,5 ℃·min−1升温至280 ℃(保持4 min),最后10 ℃·min−1升温至320 ℃(保持5 min)。
质谱条件:离子源为EI源;电子能量70 eV;离子源温度300 ℃,传输线温度300 ℃,选择离子扫描模式,同位素内标法定量。表1列出了18种PCBs、23种OCPs、16种PAHs和6种PAEs及内标物的保留时间、定量离子、定性离子和定量关系。
-
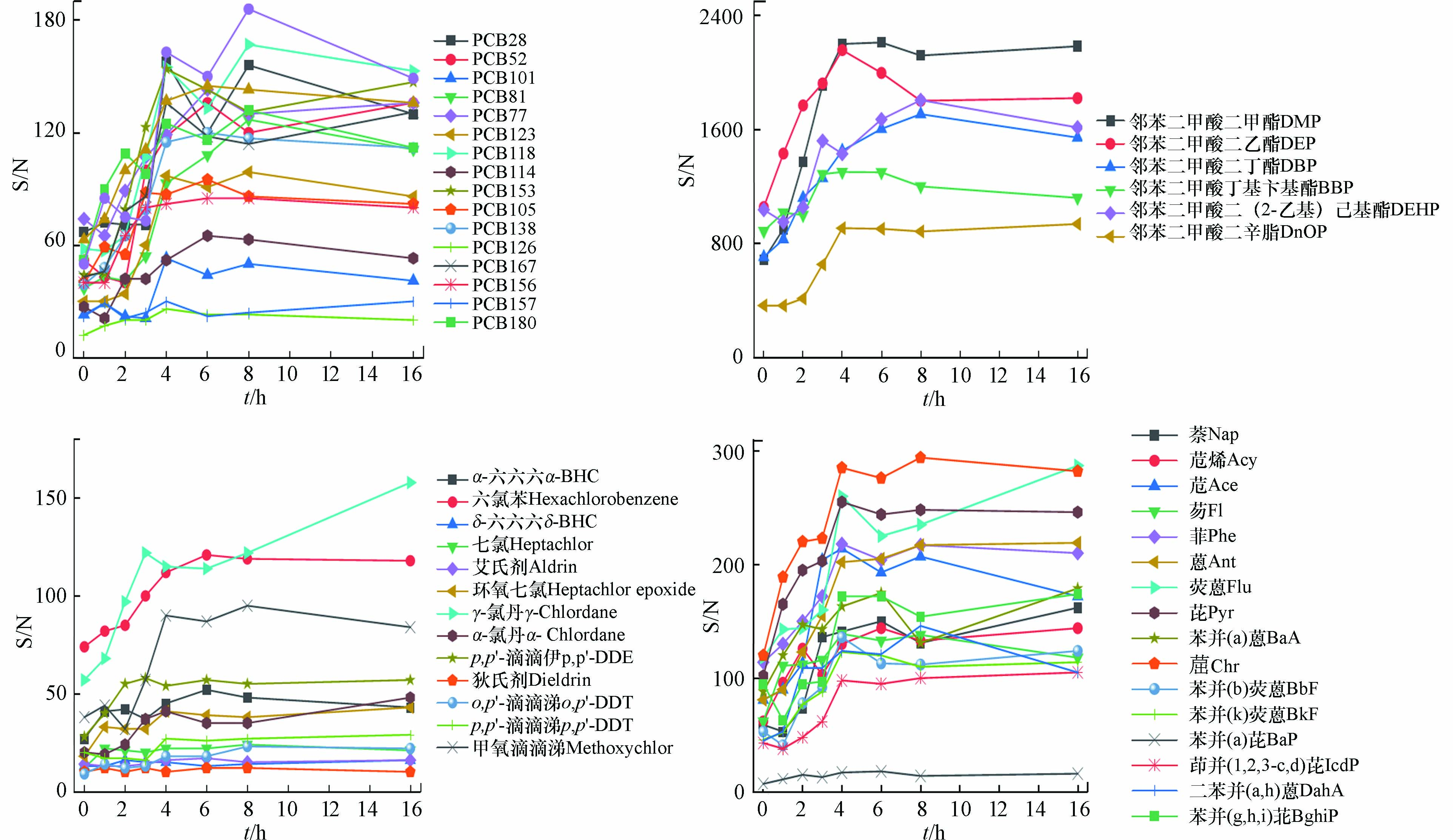
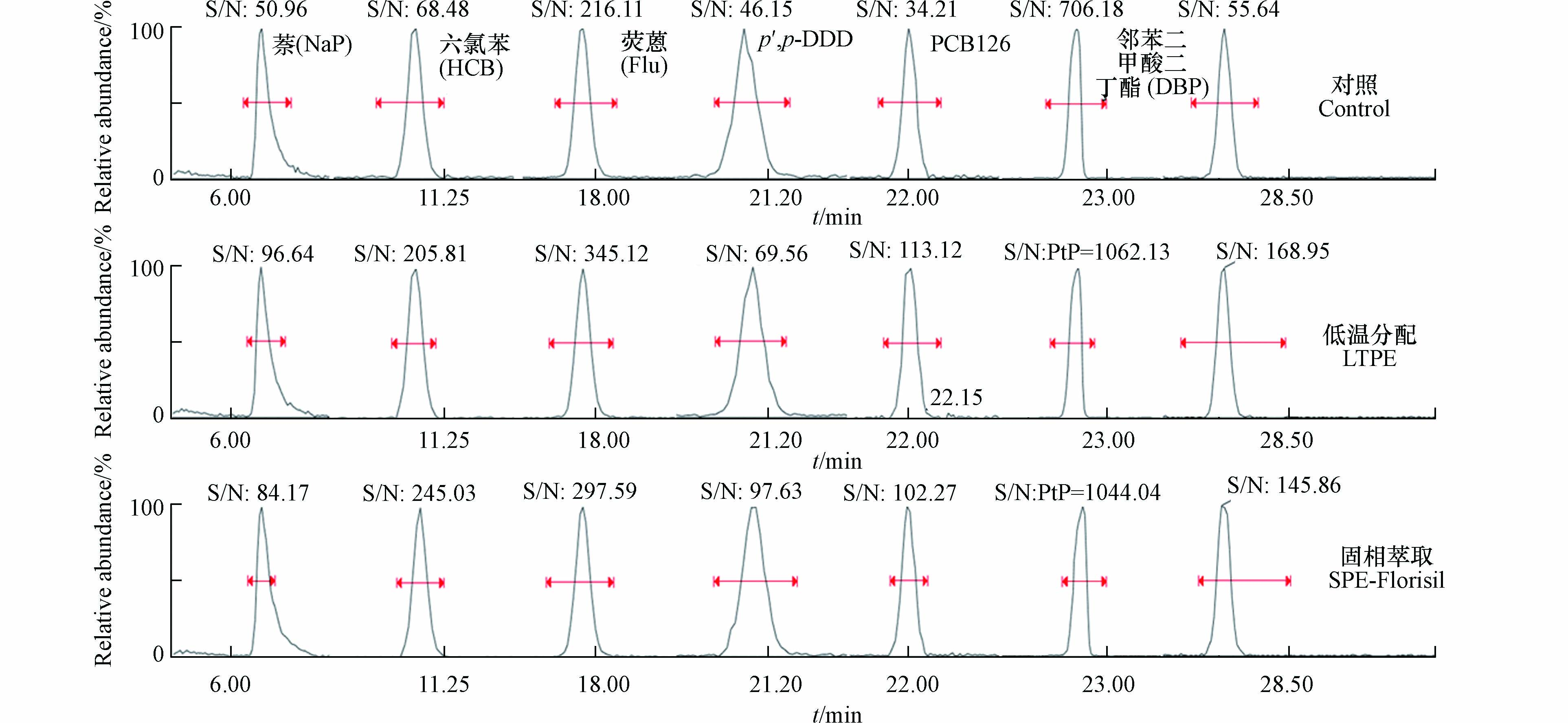
本研究所采用的低温分配技术是依据相似相溶的原理,在低温条件下,极性较强的杂质在弱极性的有机溶剂(正己烷)中溶解度迅速降低而解析出来,再借助微孔滤膜过滤,达到去除杂质的目的;冷冻时间和萃取剂对化合物的溶解性是影响低温分配的重要因素[20,25],选择正己烷为低温分配实验时的有机溶剂,在-20 ℃条件下设计0、1、2、3、4、6、8、16 h时间梯度,全扫描模式测定化合物色谱峰信噪比的变化。如图1所示,随着保存时间的延长,绝大部分化合物色谱峰的信噪比在4 h左右能提高1.5—3倍,4 h后延长时间信噪比呈略有波动状态但无显著差异,推测是4 h后低温分配达到了相态平衡,这与文献中-20 ℃保持3 h为最佳萃取条件的结论相近[26]。因此,本研究在低温分配净化时,用于冷冻样品的时间为4 h。
-
测定6个不同浓度水平的POPs混合标准曲线,化合物的相对响应因子(relative response factor,RRF)的相对标准偏差结果(表2)均小于20%,具有良好的线性关系。对PCBs含量为1 μg·kg −1,OCPs含量为5 μg·kg−1,PAHs和PAEs含量为10 μg·kg−1的石英砂空白加标进行8次平行分析,计算测定结果的2.998倍标准偏差作为方法检出限,以4倍方法检出限作为测定下限。对两个浓度水平的土壤基质加标样品分别平行分析6次,计算样品的精密度和准确度。
测定结果(表2)显示,当取样量为10.0 g,最后定容在0.5 mL时,PCBs的方法检出限在0.1—0.2 μg·kg−1之间,测定下限在0.4—0.8 μg·kg−1之间,含量为2.0 μg·kg−1和5.0 μg·kg−1的土壤基质加标回收率范围为96%—114%,相对标准偏差(relative standard deviation,RSD)为0.9%—4.1%。OCPs的方法检出限在0.3—1.5 μg·kg−1之间,测定下限在1.2—6.0 μg·kg−1之间,含量为10.0 μg·kg−1和50.0 μg·kg−1的土壤基质加标回收率范围为78%—119%,RSD为1.0%—10.6%。PAHs的方法检出限在0.4—1.9 μg·kg−1之间,测定下限分别在1.6—7.6 μg·kg−1之间,含量为20.0 μg·kg−1和200 μg·kg−1的土壤基质加标回收率范围为76%—111%,RSD为0.4%—3.8%。PAEs的方法检出限在1.0—2.2 μg·kg -1之间,测定下限在4.0—8.8 μg·kg -1之间,含量为20.0 μg·kg−1和200 μg·kg−1的土壤基质加标回收率范围为91%—116%,RSD为1.7%—4.8%。该方法的校准曲线、方法检出限、精密度和准确度均满足土壤中相关化合物测定的检测要求[8-11]。
-
实际土壤样品平行分析3次,测试结果,同位素标记的提取内标回收率范围为79%—119%。18种PCBs均未检出,大部分OCPs未检出,只有δ-六六六、p,p'-DDE、p,p'-DDD、p,p'-DDT检出,浓度范围为0.5—14.5 μg·kg−1(RSD:1.9%—7.0%),16种PAHs检出率100%,浓度范围为28.0—400 μg·kg−1(RSD:0.2%—11.1%),PAEs检出指标有邻苯二甲酸二丁酯、邻苯二甲酸丁基卞基酯和邻苯二甲酸二(2-乙基)己酯,浓度范围为1.5—10.5 μg·kg−1(RSD:0.7%—1.5%)。用本方法对PCBs、OCPs、PAHs和PAEs的土壤标准物质进行分析(n=3),PCBs、OCPs和PAHs测定结果均在合格区间内(表3),土壤中的PAEs有证标准物质只给出扩展不确定度,未给出合格区间,测定结果(表4)目标物回收率在50%—89%之间,RSD在1.5%—2.8%之间。
-
选择相关环境检测标准推荐的硅酸镁小柱固相萃取净化与本实验方法进行净化效果比较,并使用土壤有证参考物质0.5 mL的萃取浓缩液,作为不净化对照样,固相萃取净化方法参考HJ835选择玻璃材质的硅酸镁小柱(1 g),低温分配净化试验按照前述步骤,每种净化方法分别进行3次平行分析。
土壤有证参考物质测定结果显示(表5),目标物的回收率在49%—119%之间,同一化合物的不同处理方式其回收率无显著差异,并且PCBs、OCPs和PAHs均在合格区间内,PAEs的有证标准物质未给出合格区间,回收率在50%—90%;回收率结果基本呈现不净化对照(54%—119%)>低温分配净化(50%—114%)>硅酸镁固相萃取净化(49%—112%)的趋势。表明,实验流程变长,操作变多,目标物的损失会增加。测定结果相对标准偏差显示,不净化对照(1.1%—13.0%)与低温分配净化(0.1%—10.6%)的RSD普遍较小,硅酸镁固相萃取净化(0.3%—13.2%)的RSD结果普遍较大。推测是可能是因为实验步骤的延长,导致目标物测试的平行性变差所致。
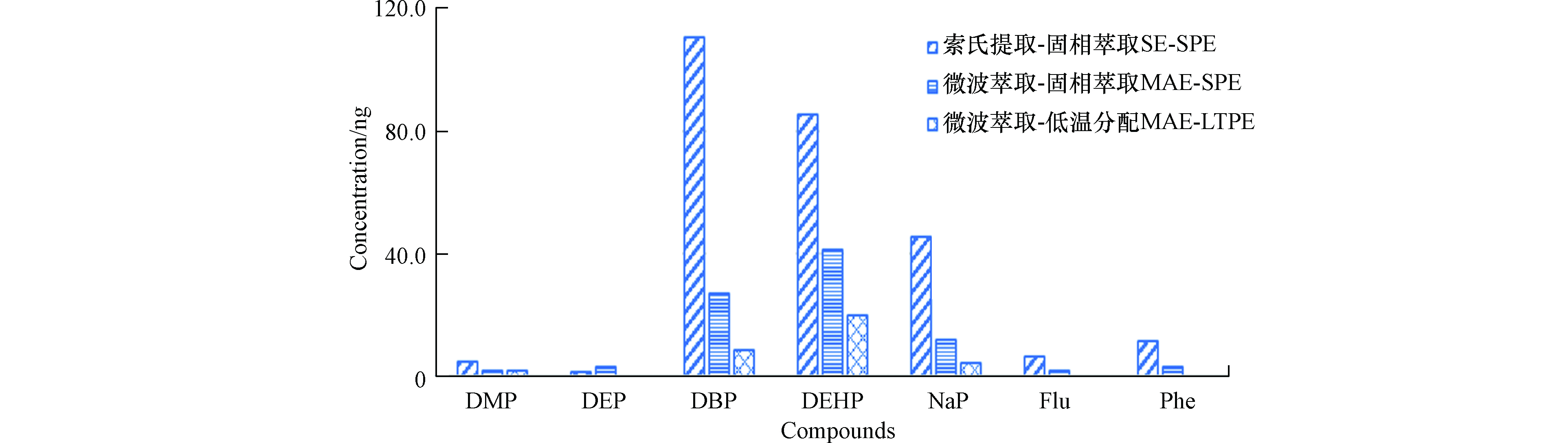
从化合物色谱峰的信噪比分析,与不净化对照相比,低温分配净化和固相萃取净化可提高1.5—3倍的信噪比,结果见图2。说明,萃取液经过低温分配后,能降低干扰,提高色谱峰的信噪比,且与硅酸镁固相萃取净化效果相当。样品前处理过程存在试剂使用量大、处理周期长、会引入PAHs和PAEs干扰等问题,本研究比较了索氏提取-固相萃取净化、微波萃取-固相萃取净化和微波萃取-低温分配净化的空白结果(图3),对于空白测试检出率较高的化合物尤其是萘、邻苯二甲酸二丁酯和邻苯二甲酸二(2-乙基)己酯等,微波萃取-低温分配净化方法可明显降低空白干扰。
综上所述,低温分配净化方法处理方式简单,同时减少试剂与耗材的投入,简化实验流程,且部分方法有效性结果更有优势,比如平行样品重复性、实验空白均优于硅酸镁固相萃取法。同传统的净化方法相比,该方法尤其适合大批量样品(比如样品数量在100个以上)的快速净化。
-
本研究采用微波辅助提取-低温分配净化气相色谱-质谱法同时测定土壤中的63种持久性有机污染物(18种多氯联苯、23种有机氯农药、16种多环芳烃和6种邻苯二甲酸酯),方法有效性结果满足相关环境标准方法的检测要求,同时提高了样品分析测试的效率,降低监测成本,尤其适合大批量样品的快速分析,是一种值得推广的分析方法。
微波辅助萃取-低温分配净化-气相色谱/质谱法同时检测土壤中63种持久性有机污染物
Simultaneous determination of 63 persistent organic pollutants in soil by GC/MS with microwave-assisted extraction and low-temperature partition extraction purification
-
摘要: 建立了土壤中18种多氯联苯、23种有机氯农药、16种多环芳烃和6种邻苯二甲酸酯同时实验处理和仪器测定的分析方法。10.0 g土壤样品经30 mL正己烷+丙酮(1+1)试剂于110 ℃微波萃取15 min,萃取液氮吹浓缩到0.5 mL后于−20 ℃保持4 h进行低温分配净化,使用气相色谱-质谱法进行测定。结果显示,63种化合物的方法检出限在0.1—2.2 μg·kg−1之间,测定下限在0.4—8.8 μg·kg−1之间;对两个浓度水平的土壤基质加标样品分别进行6次平行分析,测定结果的回收率在76%—119%之间,相对标准偏差在0.4%—10.6%之间。对相关土壤标准物质进行分析,测定结果均在化合物质控范围内。研究表明本方法快速简便,回收率高,重现性好,能满足土壤中63种POPs的检测要求。与常规的前处理净化相比,该方法操作简单,具备批处理优势,在分析大批量样品时,可提高工作效率,节省监测成本。Abstract: A method for simultaneous determination of 18 PCBs, 23 OCPs, 16 PAHs and 6 PAEs in soils by gas chromatography-mass spectrometry (GC-MS), with microwave extraction and low-temperature partition extraction purification was developed. Microwave-assisted extraction conditions involved the use of 30 mL n-hexane+acetone(1+1)at 115 ℃ for 5 min, the collected extraction liquid was concentrated to 0.5 mL by nitrogen, and subsequently in a freezer at −20 ℃ for 4 h. After the water phase was iced, the upper organic phase was taken out and analyzed by GC-MS. The result shows that, detection limits of this method were 0.1—2.2 μg·kg−1, quantitative lower limits were 0.4—8.8 μg·kg−1, and average recoveries of spiked samples ranged from 76% to 119% with relative standard deviations between 0.4% and 10.6%. The determination results of soils standard reference materials were all in the acceptance limits. The method shows high accuracy and precision, fast simple operation, high throughput and suitable for the simultaneous determination of 63 persistent organic pollutants (POPs) in the soil.
-
草甘膦是一种非选择性的广谱除草剂,因其具有与土壤快速结合、不挥发、不易光解等特性[1],在全世界范围内被广泛应用。有研究[2-3]表明:每生产1 t草甘膦原药,要至少排放4倍的高浓度废水,其中的草甘膦含量约为0.9%,该废水可生化性差、治理难度大。当农田施加草甘膦以后,其通过介质迁移而进入到水体中。张石云等[4]在哈尼梯田采集水源水库及梯田汇水处水样,草甘膦检出率为100%;王静等[5]和陈界江等[6]分别在浙江省饮用水源、太湖及阳澄湖水源地水样中检测到少量草甘膦。MESNAGE等[7]的研究表明,即使浓度低于监管限值,商业制剂中的草甘膦也会对肝肾有致癌、致畸和致瘤作用。鉴于草甘膦在饮用水源地的高检出和潜在毒理效应,《生活饮用水卫生标准》(GB 5749-2006)中规定草甘膦浓度限值为0.7 mg L−1。因此,草甘膦的去除也成为近年的水处理领域的热点问题[1, 8]。
在草甘膦的去除技术中,吸附法[9-10]被证明是一种高效廉价的技术。草甘膦作为阴离子型有机磷化合物,带有正电荷的吸附材料可以通过静电吸附作用实现对其的高效吸附。2016年以来,DONG等[11]制备了以季铵基团(-N+(CH3)3)为核心的高正电荷水凝胶吸附剂:MGO-CH[12]、MCH-La[13]和载有La3+(ion)/La(OH)3-W/La(OH)3-EW的MCH,其与AR88、F−和
PO3−4 之间存在显著的静电吸附作用,但目前尚未使用此类水凝胶吸附剂对草甘膦进行吸附研究。近年来,环糊精作为聚合物的单体而受到关注[14-17],环糊精具有疏水性内腔和亲水性外表面的特定截锥形结构,可用于与各种具有适当大小和极性的分子相互作用形成可逆的主-客体包含物[15]。同时,环糊精内部和外部的高密度羟基可以通过各种官能团进行修饰,使环糊精具有额外的特殊性能[18]。以β-环糊精为单体制备的新型环糊精基聚合物(EA-CDP)[16]和两亲性高交联多孔环糊精聚合物(PBCD-B-D)[17]在有机污染物的吸附中发挥了环糊精包合作用及疏水性和氢键等其他作用,取得了良好的吸附效果,然而其对草甘膦的吸附性能尚需验证。
基于上述研究,本研究以阳离子化的β-环糊精为单体,通过自由基接枝共聚,制备了环氧丙基三甲基氯化铵-β-环糊精复合水凝胶(MGTA-CDCH),耦合季胺基团的正电荷特征与β-环糊精的氢键专属吸附作用,进行了草甘膦的吸附研究;通过静态吸附实验,评价了MGTA-CDCH对草甘膦的吸附效果、探讨其吸附特征,并分析相应的吸附机制,为草甘膦的高效去除提供技术支撑。
1. 材料与方法
1.1 试剂
β-环糊精、2,3-环氧丙基三甲基氯化铵(GTA)、氢氧化钠、过硫酸钾、磷酸二氢钾、氯化钠、无水乙醇、腐殖酸和纳米Fe3O4均为分析纯,购于国药基团化学试剂有限公司;另外,N,N'-亚甲基双丙烯酰胺(MBA)、N,N,N',N'-四甲基乙二胺(TEMED)及草甘膦试剂均购于上海麦克林生化科技有限公司,且均为分析纯试剂。甲醇为色谱纯,购于上海阿拉丁生化科技股份有限公司。高效液相色谱测试实验用水为超纯水。相关试剂的主要结构参数见表1。
表 1 相关试剂的主要参数Table 1. Main structural parameters for the reagents试剂名称 分子式 结构式 分子质量 草甘膦 C3H8NO5P 
169 β-环糊精 C42H70O35 
1 134 2,3-环氧丙基三甲基氯化铵 C6H14ClNO 
151.6 纳米Fe3O4 Fe3O4 231.5 草甘膦废水的配置。称取0.2 g草甘膦试剂置于烧杯中加入去离子水溶解后,将其定容到1 L容量瓶中,制备成浓度为200 mg·L−1的草甘膦标准溶液。在后续吸附实验中,从标准液中移取相应体积的溶液稀释至定容刻度,即可得到相应浓度的草甘膦溶液。
1.2 实验方法
磁性阳离子环糊精基复合水凝胶(MGTA-CDCH)的制备。称取2.5 g的β-环糊精于质量分数为40%的NaOH溶液中,再加入3.5 g GTA、2 mL无水乙醇和5 mL去离子水,在70 ℃下反应4 h,将pH调至7后,真空干燥24 h至恒重,获得阳离子化环糊精(GTA-CD)。准确称取5 g GTA-CD,向其中加入0.05 g交联剂MBA。待交联剂MBA全部溶解后(搅拌均匀后),加入加速剂0.02 mL TEMED和0.2 g纳米Fe3O4。当以上物质混合均匀后,加0.6 mL饱和过硫酸钾(KPS)溶液作为引发剂。在60 ℃水浴中搅拌反应15 min。将生成的MGTA-CDCH转移到玻璃瓶中,浸没在纯水里,每8 h换一次水,然后将磁性水凝胶冷冻干燥,磨成颗粒备用。
在进行吸附动力学实验时,取1 000 mL浓度为20 mg·L−1的草甘膦水样,采用0.1 mol·L−1的HCl或NaOH溶液调节水样pH后,按投加量加入0.2 g·L−1的MGTA-CDCH。在恒温((25±1) ℃)振荡箱中,在pH=7.0±0.2和转速为150 r·min−1的条件下振荡。在不同反应时间点取样,经0.45 μm膜过滤,所得样品存放于(4±0.5) ℃冰箱内备用。此外,所使用的进行动力学模拟的模型方程[12]如式(1)~式(3)所示。准一级动力学模型见式(1),准二级动力学模型见式(2),Weber–Morris方程见式(3)。
qt=qe(1−e−k1t) (1) qt=q2ek2t1+qek2t (2) qt=kpt0.5 (3) 式中:qe和qt分别为草甘膦的平衡吸附量和t时刻的吸附量,mg·g−1;k1为准一级动力学模型的平衡常数,h−1;k2为准二级动力学模型的平衡常数,g∙(mg·h)−1;kp为Weber-Morris方程的平衡常数,h−1。
在进行吸附等温线实验时,取一系列不同浓度的草甘膦水样,向其中分别加入0.2 g·L−1 MGTA-CDCH,其余测定条件同上。此外,进行等温线拟合的模型方程[12]如式(4)~式(6)所示。Langmuir方程见式(4),Freundlich方程见式(5),Sips方程见式(6)。
qe=kLqmc1+kLc (4) qe=kFC1/n (5) qe=ksCβse1+αsCβse (6) 式中:qe和qm分别为吸附平衡时草甘膦的吸附量和最大吸附量,mg·g−1;kL、kF和ks分别为Langmuir、Freundlich和Sips模型常数;Ce为平衡浓度,mg·L−1;RL为Langmuir模型中无量纲的分离系数;n为Freundlich吸附指数;αs为平衡常数;βs为吸附平衡分解常数。
pH、共存有机物对吸附量的影响实验。取一系列20 mg·L−1的草甘膦水样加入0.2 g·L−1 MGTA-CDCH,使用0.1 mol·L−1的HCl或NaOH溶液调节初始pH,共存有机物浓度为0~200 mg·L−1,待吸附平衡后,取样测定不同条件下草甘膦的吸附量。
在进行吸附再生实验时,吸附实验方法同上,在吸附结束后,在磁场下进行固液分离,直接在固体样品中加入配制好的脱附液进行脱附,在一定时间后,同样固液分离并进行下一次的吸附实验,一共重复5次。脱附率按脱附量与吸附量的比值进行计算。
1.3 分析测试方法
为表征样品表面形貌,采用蔡司Merlin扫描电子显微镜(SEM)对样品进行观察分析。为了解样品的相关物理化学性质如荷电特性、比表面积和孔径分布、磁强度特征等性质,其中,Zeta电位测试测定使用Zetasizer Nano Z分析仪(英国马尔文)测量吸附剂的表面电荷;BET比表面积使用美国麦克公司ASAP-2460全自动比表面积与孔隙度仪分析测定。
草甘膦浓度的测定使用高效液相色谱法测定(GB/T 20684-2017),以pH=1.9的磷酸二氢钾水溶液和甲醇为流动相,使用色谱柱Agilent ZORBAX Eclipse Plus C18(150 mm × 2.1 mm,2.6 μm),紫外检测器波长195 nm,对样品中草甘膦进行高效液相色谱的分离与测定。流速0.8 mL·min−1,柱温为室温,进样体积20 μL。
2. 结果与讨论
2.1 材料的制备与表征
图1为MGTA-CDCH的SEM图。由图1可知,在MGTA-CDCH表面有明显的褶皱和不同的球状聚集体,球形直径分布在10~50 nm。
图2为MGTA-CDCH的N2吸附-脱附等温线、孔径分布及其在不同pH条件下Zeta电位的变化情况。如图2(a)所示,MGTA-CDCH的吸附等温线为Ⅰ型[19],这说明材料中存在大量微孔,这类等温线在接近饱和蒸汽压时,由于微粒之间存在缝隙,会发生类似于大孔的吸附,等温线会迅速上升。MGTA-CDCH的比表面积和平均孔径(图2(b))分别为0.67 m2·g−1和0.52 nm。传统水凝胶常具有较小(0.47~4.46 m2·g−1)的比表面积[11, 20],结合扫描电镜图与BET所得参数可知,MGTA-CHCH脱水所得的颗粒间发生团聚,粒径较大,比表面积和孔体积相对较小。此外,MGTA-CDCH的平均孔径(0.52 nm)小于β-环糊精的空腔尺寸(0.65 nm),有研究[21]表明,β-环糊精在强碱条件下易形成6号位羟基取代物,此时仅有2、3号位羟基可形成分子内氢键,这可能导致β-环糊精本身的空腔结构缩小,同时,在凝胶的合成过程中,可能在环糊精空腔内部发生了聚合而导致孔径降低。
Zeta电位是影响吸附剂与吸附质之间静电作用的关键影响因素。实验测定了pH为3~10.5下MGTA-CDCH的Zeta电位,结果如图2(c)所示。MGTA-CDCH的Zeta电位在整个测试区间内均保持在27 mV以上,其主要原因是,MGTA-CDCH表面的季胺基团使吸附剂具有较高的表面正电荷[11]。当pH为3.0~4.0时,MGTA-CDCH的Zeta电位从38.1 mV降低至30.3 mV;当pH为4.0~7.0时,MGTA-CDCH的Zeta电位基本稳定在30.3 mV左右;当pH在7.0~8.3时,MGTA-CDCH的Zeta电位缓慢下降至28.0 mV左右,并在此后随pH的升高,Zeta电位保持稳定。MGTA-CDCH中的环糊精中含有羟基基团,在强酸性条件下其会发生质子化,从而增强MGTA-CDCH的正电性;随着pH的升高,在弱酸和中性条件下羟基质子化程度有所减弱、在碱性条件下发生氢离子离解,产生氧负离子,从而在一定程度上降低了MGTA-CDCH的正电性。在碱性条件下,OH−对MGTA-CDCH表面正电荷的屏蔽作用似乎并不明显。
2.2 吸附等温线
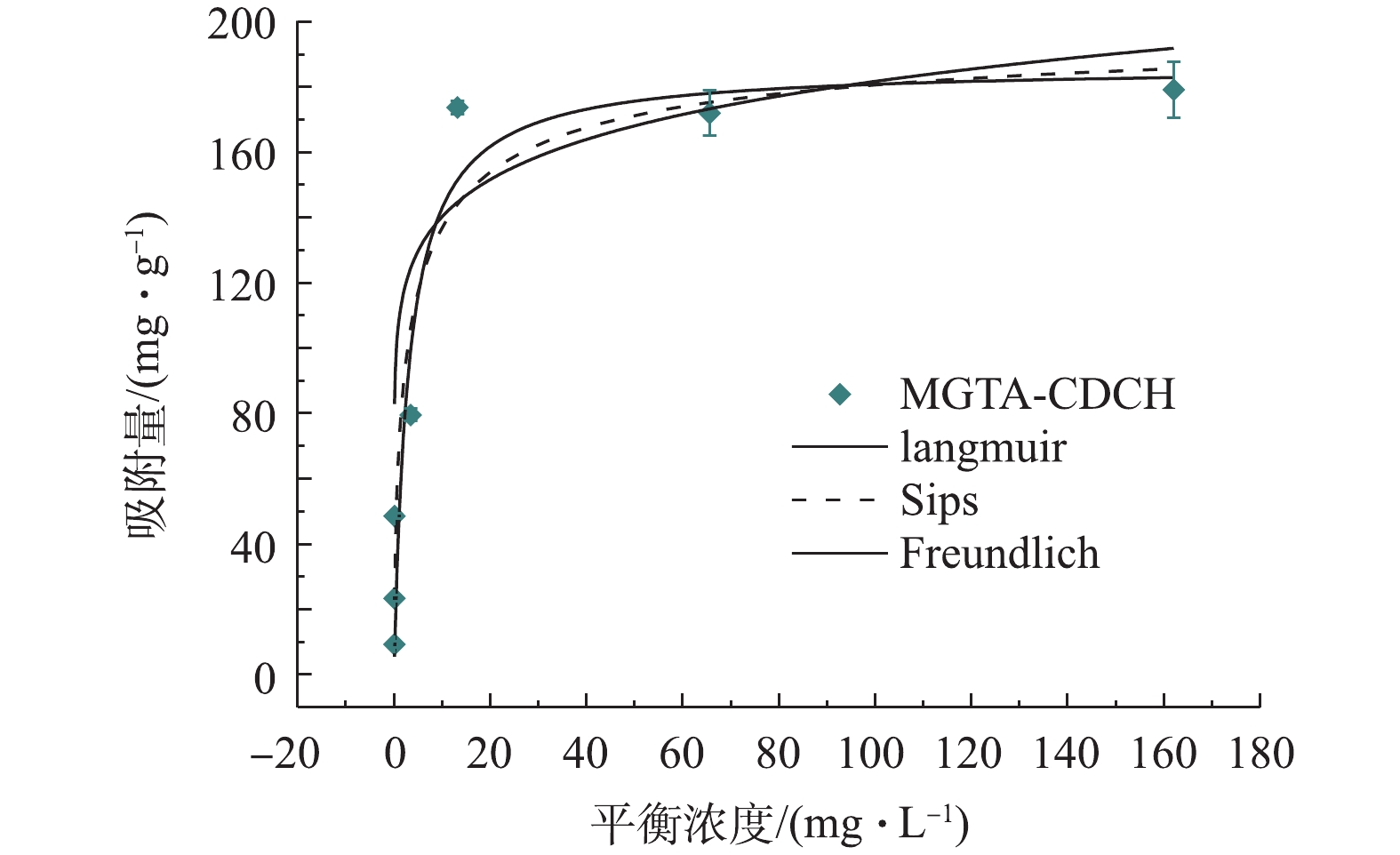
图3显示了草甘膦的初始浓度为0~200 mg·L−1时,MGTA-CDCH对草甘膦的吸附等温线。由图3可知,吸附量随草甘膦平衡浓度从0~15 mg·L−1的增加而急剧增加。在草甘膦平衡浓度为13.1 mg·L−1时,MGTA-CDCH的吸附容量接近179.2 mg·g−1的稳定值,如表2所示,与相关研究[8-9, 22, 27]报道的吸附剂相比,MGTA-CDCH对草甘膦的吸附能力最高。MGTA-CDCH对草甘膦废水的吸附等温线由Langmuir、Freundlich和Sips模型拟合,相应的拟合结果见表3。Sips模型具有最高的拟合系数(R2=0.927),拟合效果最好。这些结果证明,草甘膦在MGTA-CDCH上的吸附可以同时用单层和多层协同吸附模型来描述[28]。
表 2 MGTA-CDCH与其他相关吸附剂对草甘膦吸附量的对比Table 2. Comparison of the adsorption capacities of different adsorbents toward glyphosate表 3 MGTA-CDCH对草甘膦的Langmuir、Freundlich和Sips等温线拟合数据Table 3. Langmuir, Freundlich and Sips adsorption isotherm parameters for glyphosate adsorption onto MGTA-CDCHLangmuir Freundlich Sips qe kL 
kF 1/n 
kS βS αS 
186.3 0.33 0.908 108.29 0.11 0.768 201.9 0.61 0.52 0.927 2.3 吸附动力学
图4为初始浓度为20 mg·L−1草甘膦在MGTA-CDCH上的吸附动力学拟合结果。如图4(a)所示,吸附容量在1 h内迅速增加,达到最大吸附容量的96.6%。拟一级动力学模型(R2=0.970)和拟二级动力学模型(R2=0.973)均能描述草甘膦在MGTA-CDCH上的吸附过程,且计算得到的平衡吸附量(93.53 mg·g−1和93.65 mg·g−1)与实验测得的平衡吸附量(94.10 mg·g−1)接近,这表明MGTA-CDCH吸附草甘膦吸附过程主要以物理吸附作用和化合键力的化学吸附作用为主导[12, 29]。Weber-Morris吸附动力学模型的拟合结果如图4(b)所示,存在3个线性区域,斜率分别为211.39、3.93和0.17,这意味着在上述吸附过程中发生了3个连续的传质速率控制步骤:液膜或外部扩散、颗粒内或内部扩散,以及进入内表面活性中心的过程[27]。由图4(b)可知,第1个线性部分具有最陡的斜率,对应于初始快速动力学特征。在这个扩散阶段,草甘膦从溶液迁移到MGTA-CDCH粒子周围的边界层,或穿过边界层迁移到MGTA-CDCH的外表面与其外表面结合。第2直线段坡度较低,草甘膦连续从外表面迁移到内表面[28, 30],由于MGTA-CDCH的孔容孔径较小,导致颗粒内或内部扩散受到限制。第3个线性部分是最后阶段,草甘膦进入MGTA-CDCH内表面的活性位点,完成吸附。在这一阶段,缓慢的吸附动力学是由速率限制的扩散传质引起的。如图4(b)所示,该曲线未穿过原点,这意味着边界层扩散和粒子内扩散对速率控制均有贡献[29]。
2.4 pH对草甘膦吸附的影响
MGTA-CDCH对草甘膦的吸附量随pH的变化情况如图5所示。当pH为3.0~5.0时,MGTA-CDCH对草甘膦的吸附量保持在85.1 mg·g−1;当pH为5.0~7.0时,草甘膦的吸附量略有增加,达到最大值(92.3 mg·g−1);当pH≥8时,吸附量逐渐下降到61.1 mg·g−1;当pH≥10时,吸附量急剧下降。
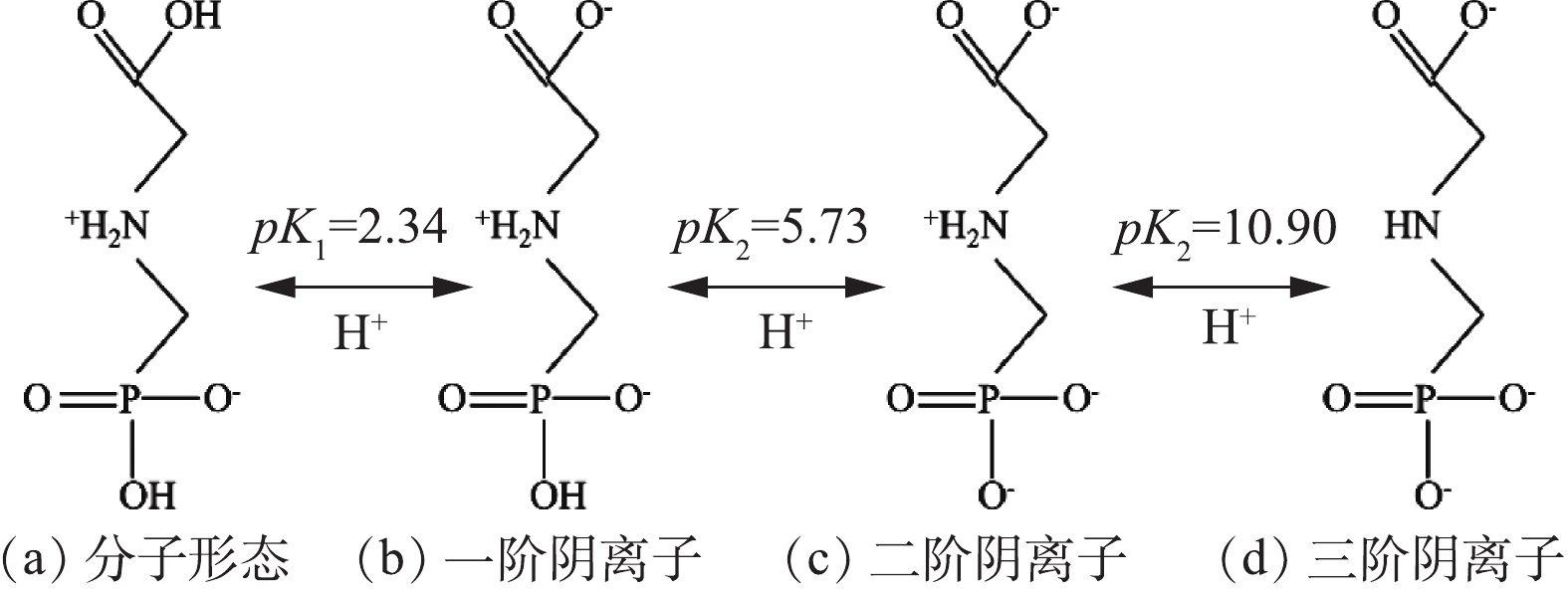
图6为草甘膦的酸解离方程式[31],有3个氢离子在不同pH下可以发生相应的离解;因此,溶液pH的变化会对MGTA-CDCH表面电荷(图2(b))和草甘膦解离形态造成影响,从而导致MGTA-CDCH对草甘膦吸附性能的差异。当pH<pK1=2.20时,草甘膦以分子形态所示,磷酸根上羟基氢离子的离解而带上了1个负电荷,
NH+2 基团带有1个正电荷,分子形态中净的电荷为零;当pH为3.0~4.1时,草甘膦以一阶阴离子为主,而且其比例越来越多,该形态为草甘膦分子上的羧酸基团上羟基氢离子的离解而带上了1个净的负电荷,但此时MGTA-CDCH表面正电荷的下降程度相对较大,导致其与草甘膦一阶阴离子之间的静电吸引力下降,从而降低了吸附量;当pH=4.1~7.0时,MGTA-CDCH表面正电荷基本保持稳定,草甘膦分子形态(b)由100%的比例(pH=(pK1+ pK2)/2=4.03)开始逐渐降低,而其二阶阴离子的比例逐渐升高,其中二阶阴离子为一阶阴离子进一步发生磷酸根上羟基氢离子的离解而带上了2个净的负电荷,因此,MGTA-CDCH与草甘膦之间的静电作用逐渐增强;此外,随着pH向中性变化,MGTA-CDCH与草甘膦之间的氢键数量会增加;这些均导致草甘膦在MGTA-CDCH上的吸附量在该pH范围内逐渐上升。当pH继续上升至碱性条件时,草甘膦二阶阴离子的比例上升至100%(pH=(pK2+ pK3)/2=8.31)后再下降,草甘膦分子形态(d)的比例逐渐上升,其中三阶阴离子为二阶阴离子进一步发生NH+2 基团上氢离子的离解而带上了3个净的负电荷;MGTA-CDCH的正电荷在该范围内发生了一定程度的降低;因此,MGTA-CDCH与草甘膦二阶阴离子之间的静电吸引力下降;随着pH向碱性变化,MGTA-CDCH与草甘膦二阶阴离子和三阶阴离子之间的氢键数量也减少了;这些变化均导致草甘膦在MGTA-CDCH上的吸附量大幅度下降[15, 32]。2.5 共存有机物对草甘膦吸附的影响
HA实验浓度为0~200 mg·L−1,实验结果如图7所示。HA对草甘膦的吸附存在负面影响,但随着HA浓度的升高,吸附量逐渐回升,MGTA-CDCH对草甘膦的吸附量仍然能保持在118 mg·g−1以上。HA相比于草甘膦具有更多的苯基和含氧基团,并且其尺寸较大,因此在低浓度的情况下,HA的部分结构能够被环糊精的疏水空腔包络[29]。此时腐殖酸分子为长链结构,优先接触MGTA-CDCH的活性位点,草甘膦和HA发生竞争吸附,导致吸附量的下降。随着HA浓度的逐渐升高,HA分子链呈团缩状,使分子链中的羧基等官能团被屏蔽而导致反应活性降低,削减其在MGTA-CDCH上的吸附作用[33]。同时,溶液中HA的剩余浓度增加,HA含有的羟基、羧基及疏水官能团会与草甘膦通过氢键、范德华力相互作用[34]。因此,草甘膦与HA单独形成新的复合物导致草甘膦剩余浓度下降,表现为吸附量回升。
2.6 吸附再生实验
本研究采用0.5 mol·L−1 NaCl、1 mol·L−1 NaOH和无水乙醇混合溶液作为脱附剂,并对MGTA-CDCH进行5次吸脱附再生回用实验,结果如图8所示。在20 mg·L−1草甘膦初始浓度下,经过5个吸附-解吸循环后,再生后保持新鲜MGTA-CDCH的85.8%吸附能力。在前2次循环中,被吸附的草甘膦仅占据表面活性吸附位点,该位点很容易被NaCl-NaOH-乙醇解吸;随着循环使用次数增加,部分草甘膦以静电吸引和氢键的双重作用而与固体表面紧密结合,同时内部扩散阻力也可以抑制NaCl-NaOH-乙醇的解吸作用,导致吸附量下降,但吸附量的损失率不到初始饱和吸附量的15%。
2.7 MGTA-CDCH在实际废水中的应用
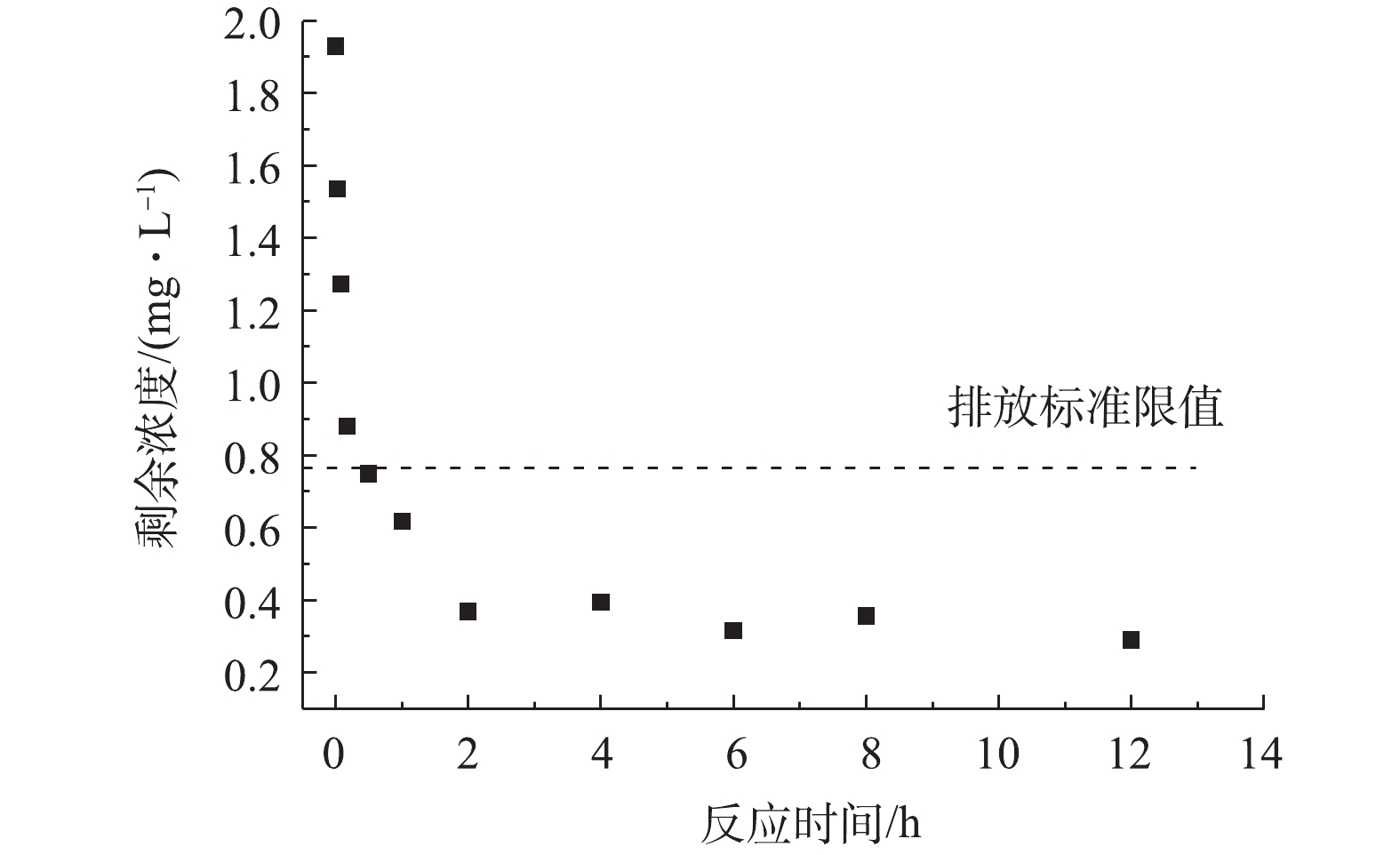
本研究中所用实际水样取自北京市地表水,水样经0.45 μm滤膜过滤后进行测定,相应的草甘膦浓度由后续实验室添加获得,具体的水质参数为1.93 mg·L−1草甘膦、pH=7.12、9.03 mg·L−1 COD、
PO3−4 -P <0.051 mg·L−1、10.08 mg·L−1NO−3 、86 mg·L−1 Cl−、57.4 mg·L−1SO2−4 。可见该废水中的草甘膦浓度大约为2 mg·L−1,并且存在着数倍于草甘膦浓度的各种共存离子和一定有机物,水质参数较模拟水样更为复杂。MGTA-CDCH对实际污染水体的草甘膦吸附能力如图9所示,在投加量为0.2 g·L−1时,2 h内剩余草甘膦浓度远低于《生活饮用水卫生标准》(GB 5749-2006)中规定草甘膦浓度限值(0.7 mg·L−1)。此时,MGTA-CDCH对草甘膦的吸附量为8.30 mg·g−1,仍能保持草甘膦模拟水样吸附量的89.7%。结果表明,在复杂的实际污染水体中,MGTA-CDCH仍能保持对草甘膦的吸附能力。
3. 结论
1)利用阳离子化和自由基聚合法成功合成了一种可再生且易于磁分离的复合水凝胶MGTA-CDCH,表征结果表明,该材料中存在大量微孔结构,且Zeta电位在整个测试区间(pH=3~10.5)均保持在27 mV以上,这说明该材料具有永久正电荷。
2) MGTA-CDCH对草甘膦吸附过程符合Sips等温线模型,饱和吸附量为186.3 mg·g−1。吸附动力学拟合结果表明,吸附量在1 h内迅速增加,可达饱和吸附量的96.6%。pH=3~7为该吸附过程的适用范围,在腐殖酸存在下,MGTA-CDCH同样具有较好的草甘膦吸附性能。吸附后经NaOH-NaCl-乙醇脱附液处理后的MGTA-CDCH脱附率可达90%以上,在5次循环后仍保持86%的吸附容量,这说明该材料具有可重复使用性。
3)针对阴离子有机物草甘膦,MGTA-CDCH中起主要活性作用为阳离子基团–[N+(CH3)3]和环糊精主体结构,该吸附过程依赖于静电吸引和氢键的双重作用。
-
表 1 化合物的保留时间、定量离子、定性离子和定量内标
Table 1. Retention time, quantitative ions, qualitative ions and quantitative internal standard of compounds
序号Number 化合物名称Compound 保留时间/min RT 定量离子Quantitative ion 定性离子Qualitative ion 定量内标Quantitative internal standard 序号Number 化合物名称Compound 保留时间/min RT 定量离子Quantitative ion 定性离子Qualitative ion 定量内标Quantitative internal standard 1 萘 6.98 128 127 D8-萘 42 PCB123 25.86 325.8 255.9 13C-PCB101 2 D8-萘 7.02 136 108 D10-芘 43 o,p'-DDT 26.00 236.8 235 13C-p,p'-DDD 3 邻苯二甲酸二甲酯 9.42 163 77 D10-苊 44 PCB118 26.09 325.8 255.9 13C-PCB101 4 苊烯 9.72 152 151 D10-苊 45 PCB114 26.52 325.8 255.9 13C-PCB101 5 D10-苊 10.05 164 163 D10-芘 46 13C-p,p'-DDD 26.61 247.1 177.2 13C-p,p'-DDE 6 苊 10.14 154 153 D10-苊 47 p,p'-DDD 26.62 236.8 235 13C-p,p'-DDD 7 邻苯二甲酸二乙酯 11.19 177 149 D10-苊 48 硫丹2 26.72 241 195 13C-p,p'-DDT 8 芴 11.77 166. 165 D10-苊 49 13C-PCB153 26.74 371.9 301.9 13C-PCB138 9 13C-α-六六六 14.08 225 189 13C-p,p'-DDE 50 PCB153 26.75 359.8 289.8 13C-PCB153 10 α-六六六 14.11 218.8 182.8 13C-α-六六六 51 PCB105 27.19 325.8 255.9 13C-PCB101 11 六氯苯 14.42 283.8 248.8 13C-α-六六六 52 异狄氏剂醛 27.20 345 279 13C-p,p'-DDT 12 γ-六六六 15.50 218.7 180.9 13C-α-六六六 53 邻苯二甲酸丁基卞基酯 27.32 206 149 D12-䓛 13 D10-菲 15.92 188 184 D10-芘 54 13C-p,p'-DDT 27.88 247.1 177.2 13C-p,p'-DDE 14 菲 16.04 178. 176 D10-菲 55 p,p'-DDT 27.89 236.8 235 13C-p,p'-DDT 15 蒽 16.31 178 176 D10-菲 56 13C-PCB138 27.90 371.9 301.9 13C-PCB138 16 β-六六六 16.77 218.7 180.9 13C-α-六六六 57 PCB138 27.92 359.8 289.8 13C-PCB153 17 13C-PCB28 17.55 270 198 13C-PCB138 58 PCB126 28.83 325.8 255.9 13C-PCB101 18 PCB28 17.57 257.8 186.1 13C-PCB28 59 PCB167 29.37 359.8 289.8 13C-PCB153 19 δ-六六六 17.65 218.8 182.8 13C-α-六六六 60 甲氧滴滴涕 29.97 227.1 212 13C-p,p'-DDT 20 七氯 17.73 271.8 100 13C-α-六六六 61 异狄氏剂酮 30.01 316.9 281 13C-p,p'-DDT 21 邻苯二甲酸二丁酯 18.42 205 149 D10-菲 62 PCB156 30.27 359.8 289.8 13C-PCB153 22 13C-PCB52 18.71 304 232.1 13C-PCB138 63 邻苯二甲酸二(2-乙基)己酯 30.30 167 149 D12-䓛 23 PCB52 18.72 291.8 221.9 13C-PCB52 64 PCB157 30.42 359.8 289.8 13C-PCB153 24 艾氏剂 19.07 293 262.7 13C-α-六六六 65 苯并(a)蒽 30.48 228 226 D12-䓛 25 环氧七氯 21.35 352.8 262.9 13C-γ-氯丹 66 D12-苝 30.54 240 236 D10-芘 26 荧蒽 22.40 202 101 D10-菲 67 硫丹硫酸酯 30.55 271.7 238.7 13C-p,p'-DDT 27 13C-o,p'-DDE 22.48 330 258.1 13C-p,p'-DDE 68 13C-PCB180 30.59 405.9 335.9 13C-PCB138 28 13C-PCB101 22.93 337.9 267.9 13C-PCB138 69 PCB180 30.60 393.8 323.8 13C-PCB180 29 PCB101 22.94 325.8 255.9 13C-PCB101 70 䓛 30.70 228 226 D12-䓛 30 13C-γ-氯丹 22.96 382.9 276.9 13C-p,p'-DDE 71 灭蚁灵 31.87 272 236.8 13C-p,p'-DDT 31 γ-氯丹 22.98 374.7 271.7 13C-γ-氯丹 72 PCB169 32.01 359.8 289.8 13C-PCB153 32 α-氯丹 23.18 374.7 372.8 13C-γ-氯丹 73 PCB189 33.01 393.8 323.8 13C-PCB180 33 硫丹1 23.24 240.9 195 13C-o,p'-DDE 74 邻苯二甲酸二辛酯 33.33 279 149 D12-䓛 34 D12-䓛 23.54 212 106 D10-芘 75 苯并(b)荧蒽 34.88 252 126 D12-䓛 35 芘 23.67 202 101 D10-菲 76 苯并(k)荧蒽 34.94 252 126 D12-䓛 36 13C-p,p'-DDE 24.28 330 258.1 13C-p,p'-DDE 77 苯并(a)芘 35.72 252 126 D12-䓛 37 p,p'-DDE 24.29 317.8 246 13C-o,p'-DDE 78 D10-芘 35.84 264 260 D10-芘 38 狄氏剂 24.45 276.9 262.9 13C-p,p'-DDD 79 茚并(1,2,3-cd)芘 38.87 276 138 D12-苝 39 PCB81 24.73 291.8 221.9 13C-PCB52 80 二苯并(a,h)蒽 38.90 278 139 D12-苝 40 PCB77 25.22 291.8 221.9 13C-PCB52 81 苯并(g,h,i)苝 39.79 276 138 D12-苝 41 异狄氏剂 25.41 281 262.9 13C-p,p'-DDD 表 2 63 POPs的方法性能参数
Table 2. Method performance parameters of 63 POPs
化合物Compound 标准曲线相对相应因子的相对标准偏差/% RSD of RRF 方法检出限/(μg·kg−1)Detection limit 测定下限/(μg·kg−1)Quantitative lower limit 低浓度Low concentration(n=6) 高浓度High concentration(n=6) 加标量/(μg·kg−1)Adding standard value 回收率/% Recovery RSD/% 加标量/(μg·kg−1)Adding standard value 回收率/% Recovery RSD/% PCB28 7.0 0.1 0.4 2.0 100—107 2.4 5.0 102—106 1.0 PCB52 6.3 0.1 0.4 2.0 103— 106 1.4 5.0 102—107 2.0 PCB101 6.9 0.1 0.4 2.0 102— 109 2.6 5.0 100—102 0.9 PCB81 6.0 0.1 0.4 2.0 102— 109 3.2 5.0 104—113 3.1 PCB77 7.3 0.2 0.8 2.0 98— 106 3.1 5.0 100—109 3.2 PCB123 4.4 0.1 0.4 2.0 96— 107 4.1 5.0 98—105 2.5 PCB118 5.6 0.1 0.4 2.0 102— 105 1.2 5.0 99—104 2.2 PCB114 6.4 0.1 0.4 2.0 100— 106 2.6 5.0 100—106 2.2 PCB153 7.0 0.1 0.4 2.0 104— 113 3.4 5.0 101—108 2.3 PCB105 10.9 0.1 0.4 2.0 100— 105 1.9 5.0 100—104 1.7 PCB138 7.0 0.1 0.4 2.0 101— 110 3.2 5.0 105—109 1.2 PCB126 7.1 0.1 0.4 2.0 98— 106 2.9 5.0 108—112 1.6 PCB167 7.8 0.1 0.4 2.0 104— 113 3.4 5.0 103—112 2.8 PCB156 6.0 0.1 0.4 2.0 105— 113 2.5 5.0 107—113 2.0 PCB157 6.0 0.1 0.4 2.0 98— 104 2.5 5.0 101—109 2.8 PCB180 6.8 0.2 0.8 2.0 101— 108 2.8 5.0 110—113 0.9 PCB169 5.9 0.2 0.8 2.0 97— 106 3.5 5.0 104—114 3.1 PCB189 7.3 0.2 0.8 2.0 97— 102 1.8 5.0 101—105 1.4 α−六六六 3.8 0.4 1.6 10.0 84— 91 3.3 50.0 91—104 5.0 六氯苯 3.5 0.6 2.4 10.0 89— 92 1.2 50.0 94—101 2.7 γ−六六六 2.3 0.4 1.6 10.0 89— 96 2.7 50.0 98—103 1.8 β−六六六 2.7 0.4 1.6 10.0 95— 98 1.3 50.0 99—102 1.0 δ−六六六 2.5 0.5 2.0 10.0 94— 98 1.6 50.0 99—102 1.3 七氯 3.0 0.6 2.4 10.0 93— 106 4.5 50.0 98—104 2.4 艾氏剂 16.7 0.5 2.0 10.0 105— 115 3.1 50.0 96—117 7.7 环氧七氯 2.1 0.3 1.2 10.0 84— 98 5.4 50.0 98—101 1.2 γ−氯丹 3.4 0.3 1.2 10.0 98— 100 1.0 50.0 96—103 2.7 α−氯丹 3.1 0.3 1.2 10.0 92— 95 1.3 50.0 94—102 3.4 硫丹1 3.7 0.4 1.6 10.0 95— 100 1.8 50.0 98—102 1.6 p,p'−DDE 2.9 0.3 1.2 10.0 87— 91 1.8 50.0 88—102 6.0 狄氏剂 4.5 0.5 2.0 10.0 80—85 2.3 50.0 93—102 3.6 异狄氏剂 1.4 0.7 2.8 10.0 87—92 2.0 50.0 97—103 2.1 o,p'−DDT 15.7 1.5 6.0 10.0 112—119 2.3 50.0 94—101 2.9 p,p'−DDD 8.1 0.6 2.4 10.0 94—114 7.9 50.0 89—101 5.0 硫丹2 5.7 0.4 1.6 10.0 87—94 2.9 50.0 81—105 9.3 异狄氏剂醛 1.8 1.2 4.8 10.0 89—94 1.9 50.0 81—101 8.5 p,p'−DDT 8.0 1.0 4.0 10.0 89—98 4.5 50.0 94—123 10.2 硫丹硫酸酯 14.7 0.4 1.6 10.0 85—100 5.4 50.0 94—116 10.0 甲氧滴滴涕 6.5 0.6 2.4 10.0 92—97 2.0 50.0 91—103 4.4 异狄氏剂酮 16.3 0.4 1.6 10.0 101—110 3.3 50.0 78—104 10.6 灭蚁灵 8.9 0.3 1.2 10.0 81—84 1.6 50.0 87—102 6.0 萘 8.3 1.5 6.0 20.0 95—102 2.9 200 105—111 2.0 苊烯 5.9 0.9 3.6 20.0 88—95 2.6 200 98—99 0.4 苊 7.1 0.4 1.6 20.0 90—93 1.3 200 97—99 0.8 芴 7.2 0.7 2.8 20.0 89—94 2.4 200 101—103 1.0 菲 7.2 1.0 4.0 20.0 92—100 3.3 200 97—102 2.0 蒽 7.8 0.9 3.6 20.0 88—94 2.8 200 108—110 0.6 荧蒽 7.6 0.8 3.2 20.0 101—108 2.7 200 101—108 2.3 芘 6.9 0.7 2.8 20.0 103—108 2.0 200 106—109 0.9 苯并(a)蒽 7.2 1.6 6.4 20.0 100—107 2.7 200 100—103 1.0 䓛 7.6 1.3 5.2 20.0 81—89 3.7 200 96—101 1.7 苯并(b)荧蒽 7.1 1.9 7.6 20.0 98—107 3.8 200 92—97 1.8 苯并(k)荧蒽 6.2 0.7 2.8 20.0 76—80 2.0 200 95—100 1.6 苯并(a)芘 5.3 1.0 4.0 20.0 99—106 2.4 200 96—100 1.5 茚并(1,2,3-c,d)芘 6.4 0.8 3.2 20.0 92—99 3.0 200 100—104 1.6 二苯并(a,h)蒽 5.3 0.8 3.2 20.0 93—99 2.7 200 100—107 2.3 苯并(g,h,i)苝 8.3 1.1 4.4 20.0 94—101 2.7 200 100—103 1.1 邻苯二甲酸二甲酯 11.6 1.4 5.6 20.0 92—104 4.3 200 94—103 3.0 邻苯二甲酸二乙酯 6 2.2 8.8 20.0 99—106 2.3 200 102—108 2.0 邻苯二甲酸二丁酯 13.2 1.2 4.8 20.0 107—116 3.6 200 98—106 2.6 邻苯二甲酸丁基卞基酯 8.1 1 4.0 20.0 97—108 4.8 200 91—96 1.7 邻苯二甲酸二(2-乙基)己酯 6.6 1.2 4.8 20.0 101—107 2.5 200 106—113 2.2 邻苯二甲酸二辛酯 7.5 1.5 6.0 20.0 99—110 3.8 200 99—107 3.4 表 3 土壤中PCBs、OCPs和PAHs标准物质测定结果(μg·kg-1)
Table 3. Determination results of Certified reference materials(PCBs, OCPs and PAHs)
化合物 Compound 标准值 Certified value 测定值Determined value 合格区间Prediction interval 化合物 Compound 标准值Certified value 测定值Determined value 合格区间 Prediction interval PCB28 178 172 101—255 p,p'-DDE 238 224 117—273 PCB52 186 207 97.4—274 狄氏剂 478 382 231—527 PCB101 42.2 42 24.5—60 异狄氏剂 230 178 106—283 PCB81 194 206 140—248 o,p'-DDT 199 118 89.2—232 PCB77 214 241 146—283 p,p'-DDD 324 248 145—379 PCB123 141 136 96.7—186 硫丹2 60.5 59 15.4—54.0 PCB118 219 201 156—281 异狄氏剂醛 481 312 126—468 PCB114 145 132 107—183 p,p'-DDT 78.6 72 32.1—92.9 PCB153 87 99 63—111 硫丹硫酸酯 275 247 112—319 PCB105 246 232 174—319 甲氧滴滴涕 392 358 148—511 PCB138 92.1 104 63.4—121 异狄氏剂酮 370 291 153—414 PCB126 76.2 83 54.7—98 灭蚁灵 127 70 51.2—140 PCB167 277 279 204—351 萘 400 387 40.0—461 PCB156 145 156 112—177 苊烯 391 265 39.1—501 PCB157 85.8 60 66.5—105 苊 269 261 50.9—309 PCB180 232 232 176—288 芴 166 179 33.6—197 PCB169 289 328 208—369 菲 217 232 64.8—244 PCB189 305 347 242—368 蒽 302 233 73.8—332 α-六六六 319 312 120—346 荧蒽 263 292 99.9—313 六氯苯 407 306 193—448 芘 327 360 103—376 γ-六六六 234 228 89—256 苯并(a)蒽 306 247 108—337 β-六六六 265 223 104—291 䓛 455 449 142—513 δ-六六六 365 323 145—412 苯并(b)荧蒽 245 263 95.8—270 七氯 472 333 204—535 苯并(k)荧蒽 222 249 84.4—246 艾氏剂 277 236 123—301 苯并(a)芘 54.2 52 6.78—70.5 环氧七氯 299 298 139—326 并(1,2,3-c,d)芘 106 102 31.8—136 γ-氯丹 194 159 93—213 147 146 47.0—163 α-氯丹 90.7 82 42—100 苯并(g,h,i)苝 401 313 115—441 硫丹1 339 242 75—275 表 4 土壤中PAEs标准物质测定结果
Table 4. Determination results of standard samples(PAEs)
化合物 Compound 标准值/ (mg·kg-1)Certified value 测定值/ (mg·kg-1)Determined value 回收率 /%Recovery RSD% 邻苯二甲酸二甲酯 71.5 39.8 56 2.6 邻苯二甲酸二乙酯 90.7 63.2 70 1.9 邻苯二甲酸二丁酯 166 97.6 59 1.6 邻苯二甲酸丁基苄酯 146 73.7 50 1.5 邻苯二甲酸二(2-乙基)己酯 157 110 70 2.0 邻苯二甲酸二正辛酯 134 119 89 2.8 表 5 三种净化方式化合物的回收率和相对标准偏差结果
Table 5. Recovery and RSD of compounds with different methods
化合物 Compound 回收率(RSD)/% Recovery 化合物 Compound 回收率 (RSD)/% Recovery 对照样Control 低温分配净化LTPE 固相萃取净化SPE -Florisil 对照样Control 低温分配净化LTPE 固相萃取净化SPE -Florisil PCB28 98(8.3) 96(6.4) 97(6.7) o,p'-DDT 62(11.7) 59(3.1) 49(9.0) PCB52 109(8.7) 111(6.6) 110(7.9) p,p'-DDD 76(6.2) 77(5.4) 70(7.8) PCB101 102(5.3) 99(3.6) 98(4.9) 硫丹2 86(12.7) 98(10.6) 81(14.2) PCB81 110(7.8) 106(2) 105(4.5) 异狄氏剂醛 64(7.1) 65(5.7) 62(13.2) PCB77 114(8.5) 113(3.1) 109(7.1) p,p'-DDT 97(12.6) 92(4.3) 85(3.7) PCB123 98(5.7) 96(4.8) 98(8.2) 硫丹硫酸酯 87(8.7) 90(8.7) 81(9.9) PCB118 91(6.1) 92(5.6) 93(7.6) 甲氧滴滴涕 93(5.9) 91(4.6) 72(2.5) PCB114 90(7.0) 91(4.7) 89(5.5) 异狄氏剂酮 80(4.9) 79(3.8) 78(4.3) PCB153 114(7.9) 114(4.4) 111(7.6) 灭蚁灵 56(9.9) 55(10.2) 52(2.1) PCB105 93(7.8) 94(5.1) 94(5.4) 萘 96(7.2) 97(3.6) 100(9.1) PCB138 113(7.8) 113(5.4) 112(8.9) 苊烯 65(8) 68(6.6) 65(7.8) PCB126 111(8.7) 108(5.8) 108(8.6) 苊 94(6.3) 97(2.3) 96(3.7) PCB167 103(6.8) 101(4.7) 99(6.5) 芴 108(4.9) 108(3.3) 104(4.8) PCB156 108(7.8) 108(5.3) 106(7.4) 菲 115(6.5) 107(1.8) 95(3.7) PCB157 74(7.6) 70(3.8) 70(7.2) 蒽 78(6) 77(3.3) 77(6.5) PCB180 105(6.0) 100(4.5) 101(6.9) 荧蒽 110(1.1) 111(0.8) 110(0.2) PCB169 119(4.1) 114(3.7) 110(7.1) 芘 109(4.3) 110(3.6) 109(4.2) PCB189 119(7.3) 110(1.9) 112(5.7) 苯并(a)蒽 84(9.4) 81(6.1) 80(7.5) α-六六六 94(5.4) 98(3.3) 91(8.6) 䓛 100(3.8) 99(2.6) 97(2.5) 六氯苯 74(5.6) 75(2.5) 69(7.8) 苯并(b)荧蒽 107(1.7) 107(1.2) 103(2.4) γ-六六六 91(5.2) 97(2.8) 90(8.7) 苯并(k)荧蒽 114(4.7) 112(3.3) 106(3.7) β-六六六 81(6.9) 84(2.4) 79(10.2) 苯并(a)芘 94(2.2) 96(1.1) 93(2.3) δ-六六六 88(5.2) 89(3.9) 88(10.0) 茚并(1,2,3-cd)芘 95(4.3) 96(1.5) 91(5.7) 七氯 73(9.5) 71(3.6) 66(10.4) 二苯并(a,h)蒽 91(4.7) 100(1.8) 80(6.9) 艾氏剂 90(6.8) 85(3.5) 81(7.9) 苯并(g,h,i)苝 76(6.4) 78(5.5) 68(9.1) 环氧七氯 100(13) 100(8.8) 84(9.3) 邻苯二甲酸二甲酯 56(3.8) 56(1.7) 56(2.6) γ-氯丹 85(10.8) 82(5.5) 75(7.4) 邻苯二甲酸二乙酯 71(5.2) 70(0.1) 72(1.9) α-氯丹 96(9.2) 90(6.2) 89(9.6) 邻苯二甲酸二丁酯 65(5.5) 59(0.9) 64(0.3) 硫丹1 72(3.1) 71(1.7) 68(7.0) 邻苯二甲酸丁基苄酯 54(4.9) 50(3.2) 51(1.5) p,p'-DDE 90(8.8) 94(2.9) 83(6.6) 邻苯二甲酸二(2-乙基)己酯 77(2.8) 70(2.8) 52(0.9) 狄氏剂 79(8.3) 80(2.5) 70(0.4) 邻苯二甲酸二正辛酯 90(6.1) 89(1.9) 63(1.1) 异狄氏剂 78(7.3) 78(5.8) 66(11.9) -
[1] 于艳新, 李奇, 王慧, 等. 食物中典型持久性有机污染物(POPs)的生物可给性研究综述 [J]. 生态环境学报, 2015, 24(8): 1406-1414. doi: 10.16258/j.cnki.1674-5906.2015.08.023 YU Y X, LI Q, WANG H, et al. The bioaccessibility of typical persistent organic pollutants(POPs) in food matrix: A review [J]. Ecology and Environmental Sciences, 2015, 24(8): 1406-1414(in Chinese). doi: 10.16258/j.cnki.1674-5906.2015.08.023
[2] LÜ H, MO C H, ZHAO H M, et al. Soil contamination and sources of phthalates and its health risk in China: A review [J]. Environmental Research, 2018, 164: 417-429. doi: 10.1016/j.envres.2018.03.013 [3] 吴亮, 岳中慧, 张皓, 等. ASE-GC-MS法同时测定农用地土壤中的多环芳烃、多氯联苯和有机氯农药 [J]. 化学分析计量, 2019, 28(4): 7-12, 17. doi: 10.3969/j.issn.1008-6145.2019.04.002 WU L, YUE Z H, ZHANG H, et al. Simultaneous determination of polycyclic aromatic hydrocarbons, polychlorinated biphenyls and organochlorine pesticides in soil by GC-MS coupled with accelerated solvent extraction [J]. Chemical Analysis and Meterage, 2019, 28(4): 7-12, 17(in Chinese). doi: 10.3969/j.issn.1008-6145.2019.04.002
[4] 张延平, 陈振超, 孙晓薇, 等. 固相萃取/气相色谱-串联质谱法测定竹笋产地土壤中42种持久性有机污染物 [J]. 分析测试学报, 2018, 37(12): 1431-1438. doi: 10.3969/j.issn.1004-4957.2018.12.005 ZHANG Y P, CHEN Z C, SUN X W, et al. Determination of 42 persistent organic pollutants in geographical original soil of bamboo shoot by gas chromatography-tandem mass spectrometry with solid phase extraction [J]. Journal of Instrumental Analysis, 2018, 37(12): 1431-1438(in Chinese). doi: 10.3969/j.issn.1004-4957.2018.12.005
[5] 张丽萍, 项亚男, 王宗义, 等. 冷冻辅助相分离-气相色谱-串联质谱法检测设施蔬菜与土壤中的邻苯二甲酸酯 [J]. 食品安全质量检测学报, 2020, 11(3): 847-853. ZHANG L P, XIANG Y N, WANG Z Y, et al. Detection of phthalates in vegetables and soil in facilities by freezing-assisted phase separation-gas chromatography-tandem mass spectrometry [J]. Journal of Food Safety & Quality, 2020, 11(3): 847-853(in Chinese).
[6] FANG J, WANG K X. Multiresidual analysis of organochlorine pesticides, polychlorinated biphenyls and polycyclic aromatic hydrocarbons in marine shellfishes by gas chromatography-ion trap mass spectrometry [J]. Chinese Journal of Analytical Chemistry, 2007, 35(11): 1607-1613. doi: 10.1016/S1872-2040(07)60095-4 [7] LEE J, LEE S Y, PARK K W, et al. Simultaneous determination of PCBs, OCPs and PAHs in mussel by ultrasound-assisted cloudy extraction and gas chromatography-tandem mass spectrometry [J]. Food Additives & Contaminants:Part A, 2020, 37(10): 1730-1743. [8] 中华人民共和国环境保护部. 中华人民共和国环保行业标准: 土壤和沉积物 多氯联苯的测定 气相色谱-质谱法 HJ 743-2015[S]. 北京: 中国环境科学出版社, 2015. Ministry of Environmental Protection of the People's Republic of China. Environmental Protection Standard of the People's Republic of China: Soil and sediment-Determination of polychlorinated biphenyls(PCBs)-Gas chromatography mass spectrometry. HJ 743-2015[S]. Beijing: China Environment Science Press, 2015(in Chinese). chromatography mass spectrometry[S]. Beijing: China Environmental Science Press, 2015(in Chinese).
[9] 中华人民共和国环境保护部. 中华人民共和国环保行业标准: 土壤和沉积物 有机氯农药的测定 气相色谱-质谱法 HJ 835-2017[S]. 北京: 中国环境出版社, 2017. Ministry of Environmental Protection of the People's Republic of China. Environmental Protection Standard of the People's Republic of China: Soil and sediment-Determination of organochlorine pesticides-Gas chromatography/Mass spectrometry. HJ 835-2017[S]. Beijing: China Environmental Science Press, 2017(in Chinese).
[10] 中华人民共和国环境保护部. 中华人民共和国环保行业标准: 土壤和沉积物 多环芳烃的测定 气相色谱-质谱法 HJ 805—2016[S]. 北京: 中国环境科学出版社, 2016. Ministry of Environmental Protection of the People's Republic of China. Environmental Protection Standard of the People's Republic of China: Soil and Sediment–Determination of polycyclic aromatic hydrocarbon by Gas chromatography-Mass Spectrometry Method. HJ 805—2016[S]. Beijing: China Environment Science Press, 2016(in Chinese). chromatography/Mass spectrometry Method[S]. Beijing: China Environmental Science Press, 2016(in Chinese).
[11] 中华人民共和国生态环境部. 中华人民共和国环保行业标准: 土壤和沉积物 6种邻苯二甲酸酯类化合物的测定 气相色谱-质谱法 HJ 1184-2021[S]. 北京: 中国环境科学出版社, 2021. Environmental Protection Standard of the People's Republic of China. Soil and sediment-Determination of 6 Phthalate Esters(PAEs)-Gas Chromatography/Mass spectrometry HJ 1184-2021[S]. Beijing: China Environment Science Press, 2021 (in Chinese).
[12] LLOMPART M, CELEIRO M, DAGNAC T. Microwave-assisted extraction of pharmaceuticals, personal care products and industrial contaminants in the environment [J]. TrAC Trends in Analytical Chemistry, 2019, 116: 136-150. doi: 10.1016/j.trac.2019.04.029 [13] 罗治定, 万秋月, 王芸, 等. 微波萃取-气相色谱质谱法测定土壤中的多环芳烃 [J]. 天津理工大学学报, 2019, 35(4): 53-57. doi: 10.3969/j.issn.1673-095X.2019.04.012 LUO Z D, WAN Q Y, WANG Y, et al. PAHs in soil extracted by microwave extraction and analyzed by gas chromatography-mass spectrometry [J]. Journal of Tianjin University of Technology, 2019, 35(4): 53-57(in Chinese). doi: 10.3969/j.issn.1673-095X.2019.04.012
[14] LIAO C, YANG P, XIE Z W, et al. Application of GC-triple quadrupole MS in the quantitative confirmation of polycyclic aromatic hydrocarbons and phthalic acid esters in soil [J]. Journal of Chromatographic Science, 2010, 48(3): 161-166. doi: 10.1093/chromsci/48.3.161 [15] HALFADJI A, TOUABET A, PORTET-KOLTALO F, et al. Concentrations and source identification of polycyclic aromatic hydrocarbons (PAHs) and polychlorinated biphenyls (PCBs) in agricultural, urban/residential, and industrial soils, east of Oran (northwest Algeria) [J]. Polycyclic Aromatic Compounds, 2019, 39(4): 299-310. doi: 10.1080/10406638.2017.1326947 [16] CARRO N, GARCÍA I, IGNACIO M, et al. Microwave-assisted solvent extraction and gas chromatography ion trap mass spectrometry procedure for the determination of persistent organochlorine pesticides (POPs) in marine sediment [J]. Analytical and Bioanalytical Chemistry, 2006, 385(5): 901-909. doi: 10.1007/s00216-006-0485-3 [17] RAMÍREZ A, TEIXEIRA M, NEVES A, et al. Development and validation of a solid-liquid extraction with low temperature partitioning (SLE/LTP) method for determination of the herbicide indaziflam in Brazilian soils by high performance liquid chromatography (HPLC-UV/vis) [J]. Journal of Experimental Agriculture International, 2018, 21(3): 1-8. [18] 朱芸, 李世刚, 周圆, 等. 加速溶剂萃取-气相色谱质谱法同时测定土壤及沉积物中34种有机氯农药及18种多氯联苯类化合物 [J]. 环境监控与预警, 2019, 11(3): 30-35. ZHU Y, LI S G, ZHOU Y, et al. Simultaneous determination of 34 organochlorine pesticides and 18 polychlorinated biphenyls in soil and sediment by accelerated solvent extraction-gas chromatography-mass spectrometry [J]. Environmental Monitoring and Forewarning, 2019, 11(3): 30-35(in Chinese).
[19] 廖健, 邓超, 陈怡, 等. 西湖景区土壤中邻苯二甲酸酯污染水平、来源分析和空间分布特征 [J]. 环境科学, 2019, 40(7): 3378-3387. doi: 10.13227/j.hjkx.201812207 LIAO J, DENG C, CHEN Y, et al. Pollution levels, sources, and spatial distribution of phthalate esters in soils of the west lake scenic area [J]. Environmental Science, 2019, 40(7): 3378-3387(in Chinese). doi: 10.13227/j.hjkx.201812207
[20] 刘彬, 闫强, 郭丽, 等. 加压流体萃取-硅酸镁柱净化-气相色谱质谱法同时测定土壤中有机氯农药和多环芳烃 [J]. 环境化学, 2019, 38(10): 2212-2221. doi: 10.7524/j.issn.0254-6108.2018112605 LIU B, YAN Q, GUO L, et al. Simultaneous determination of OCPs and PAHs in soil by GC-MSD with ASE and florisil SPE purification [J]. Environmental Chemistry, 2019, 38(10): 2212-2221(in Chinese). doi: 10.7524/j.issn.0254-6108.2018112605
[21] MAGALHÃES E J, NASCENTES C C, AUGUSTI R, et al. Fast determination of benzodiazepines in human urine via liquid-liquid extraction with low temperature partitioning and LC-HRMS [J]. American Journal of Analytical Chemistry, 2012, 3(2): 118-124. doi: 10.4236/ajac.2012.32017 [22] 金梦, 李彦希, 黎玉清, 等. 多环芳烃污染与儿童内暴露负荷的关系 [J]. 环境科学与技术, 2020, 43(1): 212-216. doi: 10.19672/j.cnki.1003-6504.2020.01.031 JIN M, LI Y X, LI Y Q, et al. Relationship between PAHs pollution and exposure levels in children [J]. Environmental Science & Technology, 2020, 43(1): 212-216(in Chinese). doi: 10.19672/j.cnki.1003-6504.2020.01.031
[23] SOUSA D A, GONÇALVES R M, HELENO F F, et al. Chemometric optimization of solid-liquid extraction with low-temperature partition (SLE-LTP) for determination of persistent organic pollutants in Caiman yacare eggs [J]. Microchemical Journal, 2014, 114: 266-272. doi: 10.1016/j.microc.2014.01.012 [24] 刘笑笑, 张菁菁, 李晨曦, 等. 低温微萃取-GCMS/MS联用技术检测食用油中20种持久性污染物 [J]. 食品与发酵工业, 2020, 46(5): 292-298. doi: 10.13995/j.cnki.11-1802/ts.021039 LIU X X, ZHANG J J, LI C X, et al. Determination of 20 persistent pollutants in edible oil by freeze-degreasing-GCMS/MS [J]. Food and Fermentation Industries, 2020, 46(5): 292-298(in Chinese). doi: 10.13995/j.cnki.11-1802/ts.021039
[25] GOULART S M, de QUEIROZ M E L R, NEVES A A, et al. Low-temperature clean-up method for the determination of pyrethroids in milk using gas chromatography with electron capture detection [J]. Talanta, 2008, 75(5): 1320-1323. doi: 10.1016/j.talanta.2008.01.058 [26] GOULART S M, ALVES R D, NEVES A A, et al. Optimization and validation of liquid-liquid extraction with low temperature partitioning for determination of carbamates in water [J]. Analytica Chimica Acta, 2010, 671(1/2): 41-47. -






 DownLoad:
DownLoad: