-
多环芳烃(polycyclic aromatic hydrocarbons,以下简称PAHs)对人体具有强烈的致癌、致畸、致突变效应,且在环境中广泛存在 [1-3]。燃煤电厂是环境中大气污染物的重要来源[4-5]。我国燃煤电厂广泛配备的脱硝、除尘和脱硫设施虽然可以高效去除NOx、SO2、粉尘等常规大气污染物,却难以去除更容易进入人体肺部的可过滤细颗粒物、可凝结颗粒物和气态PAHs[6-8]。
近年来,燃煤电厂大气污染物的排放因子和排放清单成为大气污染防治领域的研究热点,并且在识别燃煤电厂大气污染物排放特征、时空分布、以及区域环境效应等方面取得重要进展[9-13]。燃煤电厂排放PAHs的研究主要关注燃煤产物中PAHs的含量、分布和赋存状态的分析,以及燃煤锅炉烟气排放过程PAHs的赋存规律及影响因素等方面[13-19],而关于燃煤电厂PAHs的排放因子和清单的研究较少,尤其缺乏不同燃煤锅炉大气PAHs的精细化排放因子以及其历史排放通量的基础数据。基于此,本研究以安徽省为例,结合资料收集、实地调研和现场实测数据,“自下而上”构建了安徽燃煤电厂大气PAHs的历史排放清单,以查明锅炉、机组、大气污染控制设施以及超低排放改造对安徽燃煤电厂PAHs历史排放量的贡献值。
-
实地调研了安徽省86家燃煤电厂的锅炉机组、大气污染控制设施、燃煤量、产灰量等详细信息,并结合安徽省环保局内部资料,构建了安徽省燃煤电厂基本信息数据库。该数据囊括2010—2017年安徽省173台在役燃煤机组和21台退役机组。基本信息包括位置、机组容量、锅炉类型、燃料类型(煤、煤矸石、煤泥)、煤炭年消费量、大气污染控制设施(脱硝、脱硫、除尘)和机组年龄。截至2017年底,安徽在役燃煤电厂的锅炉机组年龄跨度为0—32年,平均年龄为11年。这些电厂分布在除黄山以外的15个城市。其中煤粉炉95台,流化床炉75台,链条炉3台。煤粉炉装机容量为43.9 GW,占总装机容量的92.4%。流化床炉装机容量为3.4 GW,占总装机容量的7.6%。
选择性催化还原脱硝(SCR)和非选择性催化还原脱硝(SNCR)是安徽燃煤电厂的主要脱硝技术。煤粉炉均装配了SCR和湿式脱硫设备(WFGDs,石灰石-石膏湿法、氨法、电石渣湿法脱硫)。流化床炉装配SCR占其装机容量的75%,其余均装配了SNCR。炉内喷钙是流化床炉的主要脱硫方式,占其装机容量的86%。其余流化床炉装配了WFGDs(占装机容量的7.8%)和半干法脱硫(占装机容量的6.3%)。此外,所有煤粉炉和流化床炉均装配了除尘装置。
-
2010年至2017年间,安徽燃煤电厂发电量从142.0 TWh增至231.1 TWh[20]。与此同时,煤炭消费量从61.8 Mt增至87.4 Mt,远小于发电量的增长速率,说明燃煤电厂锅炉机组发电效率的显著提升。在此期间,安徽共新建了48台燃煤锅炉,装机容量共计21.5 GW,占2017年安徽燃煤电厂总装机容量的45%。此外,截止2017年底,装机容量≥300 MW的大锅炉占全省总装机容量的93.7%,而装机容量≤30 MW的小锅炉占全省总装机容量的1.7%。由于“上大压小”政策的实施,安徽燃煤电厂平均能耗从2010年的322 gce·kWh−1降至2017年的301 gce·kWh−1[20]。
-
基于不同的锅炉类型和大气污染控制设施,将安徽省173台发电燃煤锅炉分为6类:煤粉炉1(600 MW≤机组容量≤1000 MW),煤粉炉2(300 MW≤机组容量<600 MW),煤粉炉3(6 MW≤机组容量≤210 MW),流化床炉1(6 MW≤机组容量≤210 MW),流化床炉2(3 MW≤机组容量≤60 MW),流化床炉3(3 MW≤机组容量≤15 MW)。
排放因子(EFPAH)基于实测计算得出:EFPAH = V×CPAH/Ccoal,其中V是烟气流速(m3·h−1),CPAH是烟气中PAHs的浓度(µg·m−1),Ccoal是锅炉每小时煤炭消费量(tons·h−1)。计算得出6种燃煤锅炉PAHs的排放因子(表1)。PAHs排放清单基于每一台锅炉的排放因子和煤炭消耗量计算得出:
其中,E是燃煤锅炉年排放量(kg·a−1),M是每一台燃煤锅炉的耗煤量(tons),EF是每一种锅炉类型的PAHs的排放因子,i、k、m分别是锅炉类型、机组容量和大气污染控制设施类型。锅炉煤炭消耗量数据来自安徽省环保局。
-
PAHs使用内标法定量, 以9个不同浓度梯度的PAHs标准溶液(10、20、50、100、200、500、1000、2000、5000 ng·mL−1)绘制标准曲线。所有化合物的标准曲线的回归系数R2均大于0.99。样品中回收率指示物萘-d10、菲-d10、芘-d12、苊-d10和䓛-d12的回收效率分别为56%±12%、73%±13%、69%±10%、84%±11%和71%±14%,方法检测限为0.009—0.017 ng·g−1,在可接受的范围以内。
-
为了定量结果的不确定性,以及各因子对预测结果的影响,应用蒙特卡罗模型模拟2010年至2017年安徽燃煤电厂PAHs的年排放量,所有参数均假设为对数正态分布。蒙特卡罗模拟在Crystal Ball 7.2中运行10000次。
-
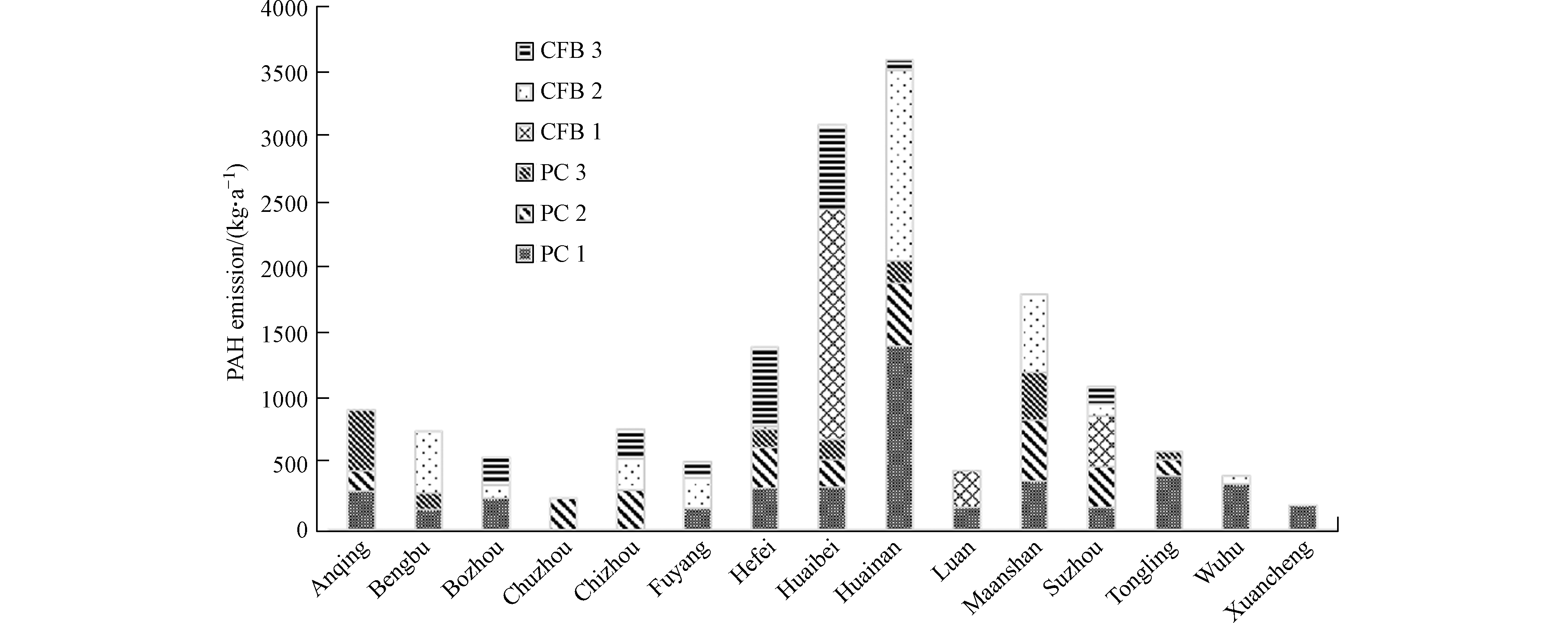
2017年,安徽燃煤电厂PAHs的大气排放量为16400 kg,煤粉炉为8600 kg,流化床炉为7800 kg。其中煤粉炉1、煤粉炉2、煤粉炉3、流化床炉1、流化床炉2、流化床炉3的PAHs排放量分别占比27.9%、15.8%、8.9%、14.9%、20.2%、12.3%(图1)。这6种锅炉的燃煤量占比分别为69.6%、13.8%、4.0%、7.0%、2.8%和2.2%。这表明装机容量更大的锅炉由于燃烧效率更高,且大气污染控制设施条件更先进,从而污染物排放的相对量更小。细分至不同城市级别,淮南(3600 kg)、淮北(3100 kg)和马鞍山(1800 kg)的排放量最大。这主要因为3座城市电厂燃煤量相对较大。此外,安徽南部城市(铜陵、芜湖和宣城)由于燃煤电厂主要为大锅炉(煤粉炉1),导致PAHs相对排放量远小于北部城市(淮北、亳州)和中部城市(合肥)。
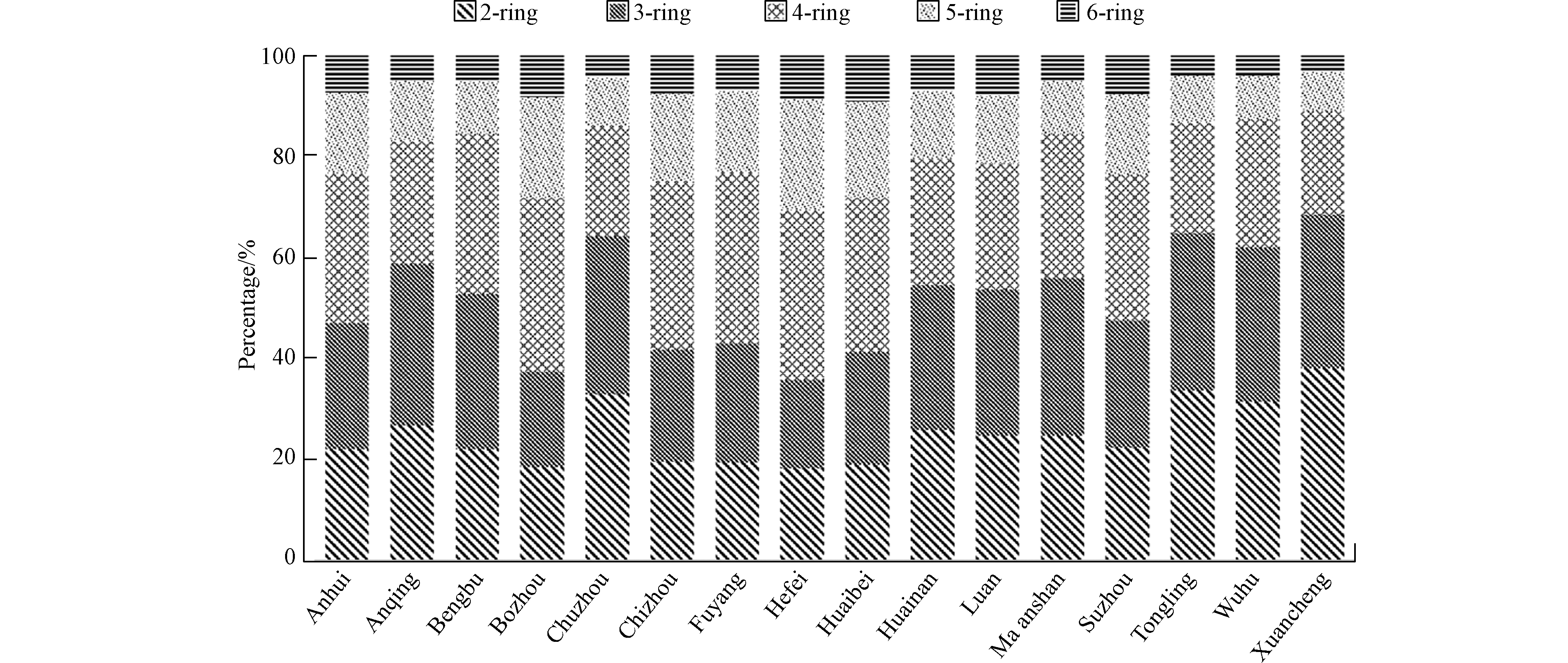
燃煤电厂排放的PAHs以4环PAHs为主,贡献值为28.0%,其次为3环PAHs(占比26.8%)和2环PAHs(占比25.0%)(图2)。中部和北部城市燃煤电厂排放PAHs中的高分子量PAHs(5环和6环PAHs)比南部城市的相对贡献率更高。主要原因是:1)小锅炉(煤粉炉3和流化床炉3)主要分布在中部和北部城市,而它们排放高分子量PAHs的量更大;2)南部城市燃煤电厂的流化床炉装配WFGD的比例更高,而WFGD对于高分子量PAHs的脱除效率更高[6]。
PAHs的排放率(kg·t−1)和排放强度(kg·MW−1),分别定义为PAHs排放量与煤炭消费量,以及PAHs排放量与机组装机容量的比值,表现为煤粉炉 (分别为1.1 kg·t−1和0.19 kg·MW−1)显著大于流化床炉 (7.2 kg·t−1和2.1 kg·MW−1)。这主要是由于流化床炉燃烧温度相对更低(800—1000 ℃),因此比煤粉炉排放PAHs的相对量更大[6]。机组容量相对较大的煤粉炉1、煤粉炉2和流化床炉1比其它锅炉的排放率和排放强度更小(表2),原因是它们具有更高的燃烧温度和锅炉压力。此外,流化床炉3的PAHs排放率和排放强度更高(表2)。
-
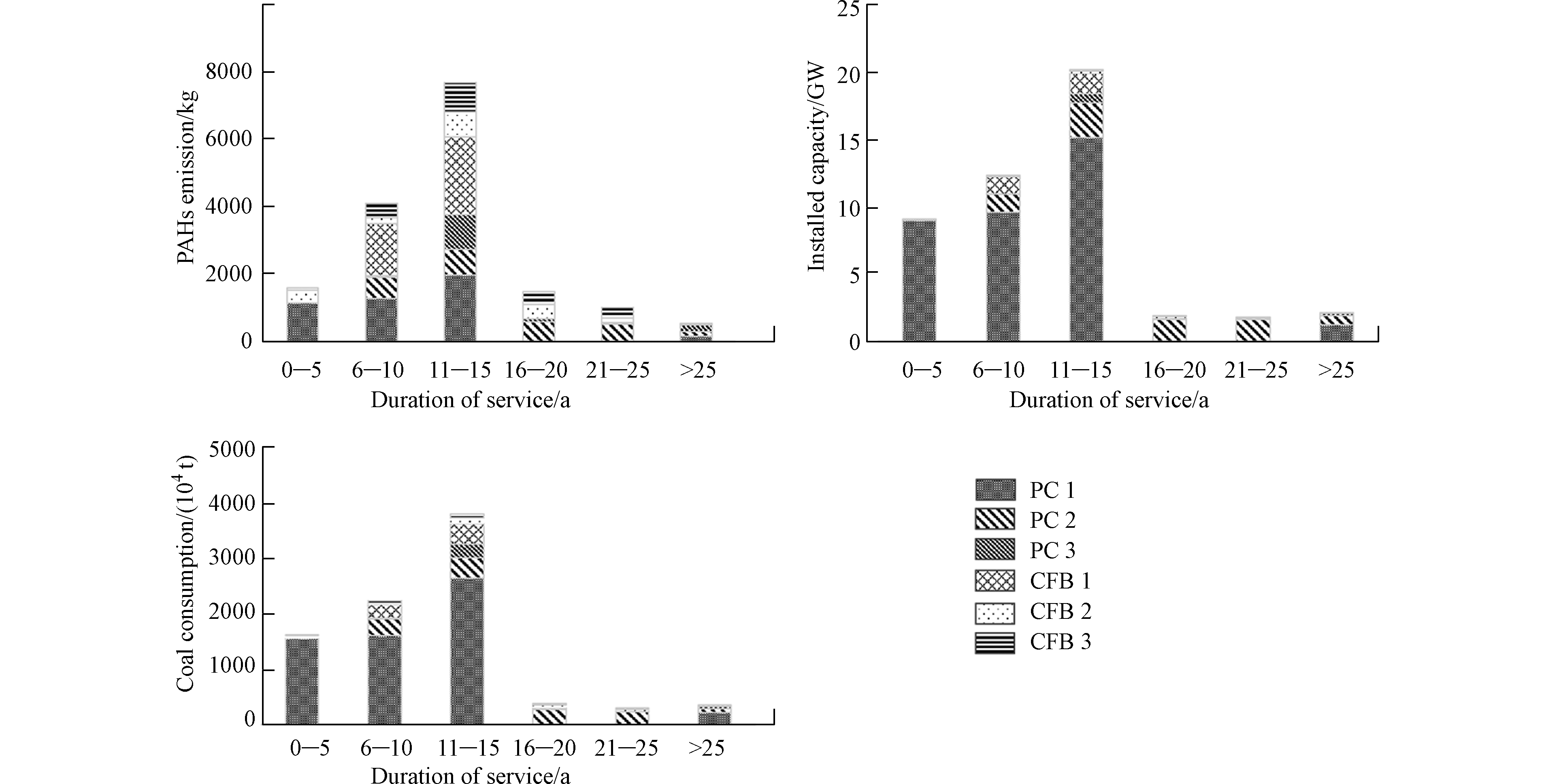
将燃煤锅炉按年龄分为6类:0—5年(2015—2017),6—10年(2010–2014),11—15年(2005—2009),16—20年(2000—2004),21—25年(1995—1999)和> 25年(1986—1994)。从图3可知,11—15年的燃煤锅炉对PAHs排放总量的贡献最大,占46.6%,其次为6—10年和0—5年的锅炉,分别占比25.0%和9.8%(图3)。从不同年龄锅炉的PAHs排放量主要受装机容量和燃煤量的影响:大机组锅炉(煤粉炉1、煤粉炉2和流化床炉1)是较新锅炉(0—5、6—10、11—15年)PAHs排放量的主要贡献者;小机组锅炉(煤粉炉3,流化床炉2和流化床炉3)则是较老锅炉(年龄段为16—20、21—25、>25年)PAHs排放量的主要贡献者(图3)。
-
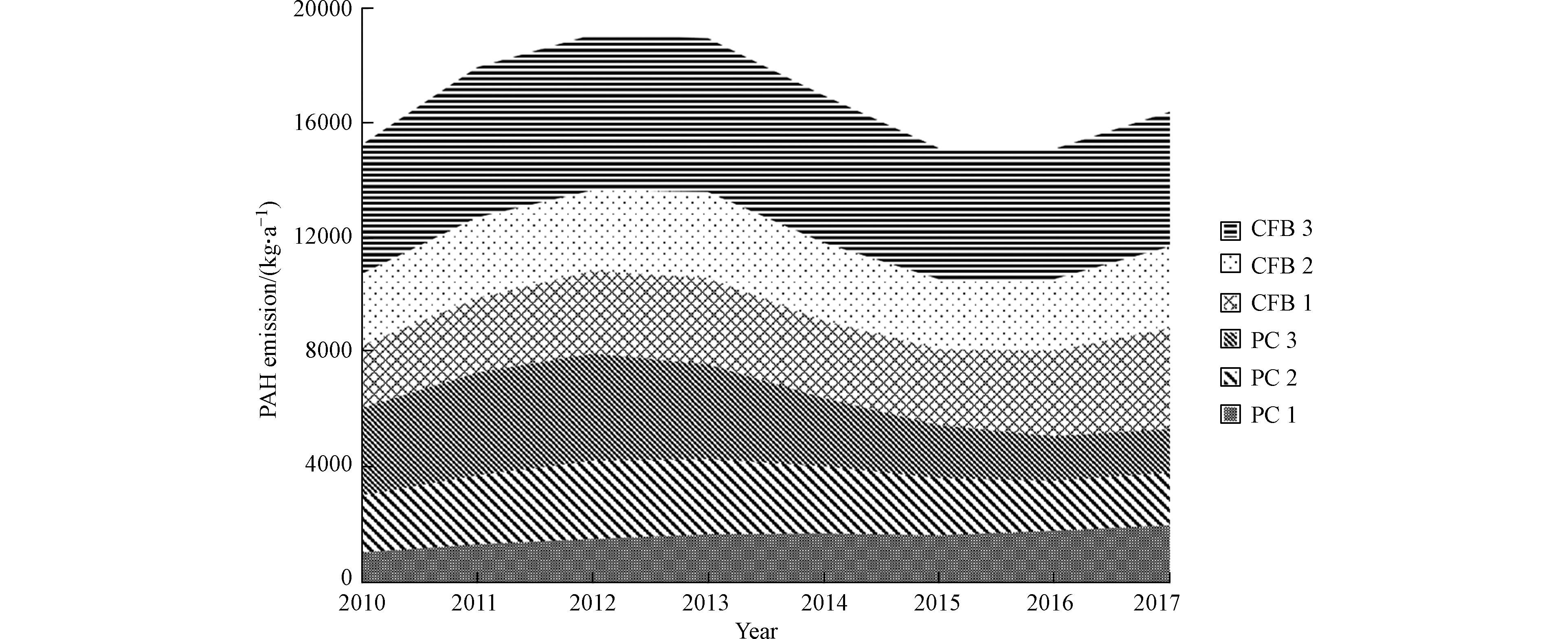
从2010年至2017年,安徽省燃煤电厂大气PAHs的排放量从15200 kg增加至16400 kg,年均增长1.1%。该增长率低于煤炭消费量增长率(5.9%)和发电量的增长率(9.0%)。在6种不同类型的锅炉中,流化床炉3和煤粉炉3的贡献量最大,约分别占总排放量的28.2%—30.2%和14.0%—19.9%。然而,煤粉炉3的贡献量自2013年呈现明显的下降趋势(如图4),这主要是因为安徽省在2013至2017的5年时间里,共取缔了17家小型燃煤电厂,其中取缔的PC3机组占煤粉炉3总机组容量的89.2%—92.7%,导致煤粉炉3锅炉排放PAHs逐年减少。
通过计算得出,自2013年以来,由于关停小电厂导致多环芳烃排放减少的总量为1880 kg。此外,中国于2014年颁布了《全面实施燃煤电厂超低排放和节能改造工作方案》,对燃煤电厂进行全面改造。截止2017年底,安徽省共对67台锅炉机组进行超低排放改造,计算得出截止2017年,经过超低排放改造,安徽省燃煤电厂减少PAHs排放量为760 kg。
-
安徽省燃煤电厂的发电量、煤炭消费量和PAHs的排放量之间具有十分密切的联系(图5)。
通过研究发现,2010年至2017年,安徽燃煤电厂PAHs排放量的年度变化与安徽省夏季和冬季平均气温有非常有趣的相关性,例如:2011年安徽省经历了一个“冷冬”(1997年以来最低),即冬季的平均气温比往年低约1 ℃,而该年PAHs的排放量呈现一个明显的峰值;2013年安徽省经历了一个“热夏”,即夏季的平均气温比往年高约0.7 ℃,而该年PAHs的排放量也呈现一个明显的峰值。因此,气温的升高或降低会导致居民用电量的变化(如极冷或极热气候下,空调使用量会显著增加),从而可能导致煤炭消费量的增加和随之带来的PAHs排放量的增加。
-
燃煤电厂PAHs排放清单估算过程中,锅炉类型、机组容量、年龄、年燃煤量来自安徽省环保局。PAHs的排放因子基于前期机理研究获得[6,16-18,21-22]。燃煤电厂大气大气污染控制设施和条件来源于安徽省环保局和实地调研,均可降低结果的不确定性。但2010—2016年间新建和退役锅炉的年燃煤量基于外推法估算得出。因此,蒙特卡洛计算得到2017年PAHs排放量的不确定度为-25%—26%,而2010—2016年PAHs历史排放量的不确定度为-39%—40%。“关闭小锅炉”导致PAHs减少的排放量的不确定度为-58%—59%。
-
(1)安徽省燃煤电厂PAHs的排放量从2010年的15200 kg增加至2017年的16400 kg。8年间累计排放量为126000 kg。
(2)从锅炉年龄来看,这些大机组锅炉和小机组锅炉分别是0—15年和>16年的锅炉的主要贡献者。大锅炉PAHs的排放率和排放强度比其它锅炉要低,主要是其更好的燃烧条件和WFGDs装配率。
(3)与超低排放改造带来的PAHs减排量相比,淘汰小锅炉带来的PAHs减排量更大。
(4)从燃煤电厂PAHs的历史排放量变化来看,区域气温变化(更热的夏天和更冷的冬天)导致了空调用电量的增加和随着而来PAHs排放量的增加。
安徽燃煤电厂多环芳烃的历史排放量及影响因素分析
The historical emissions of polycyclic aromatic hydrocarbons (PAHs) from coal-fired power plants in Anhui and influencing factors
-
摘要: 自2010年,中国燃煤电厂大范围普及的大气污染物净化设备极大地改变了多环芳烃(PAHs)的排放格局。本研究以中国煤炭重要产地安徽为例,建立自下而上的PAHs历史排放清单,分析2010年到2017年间PAHs的排放规模、强度和特征的变化。2017年煤粉炉和循环流化床锅炉的PAHs排放总量近似,分别为8600 kg和7800 kg。细分至不同城市,PAHs排放量最大的城市分别为淮南(3600 kg),淮北(3100 kg),马鞍山(1800 kg)。不同锅炉类型的年均排放速率和排放强度产生极大的差异,循环流化床炉的年均排放速率和排放强度(7.2 kg·t−1和2.1 kg·MW-1)分别是煤粉炉(1.1 kg·t-1和0.19 kg·MW−1)的7倍和11倍。这主要是由于循环流化床的较低燃烧温度和不完全的燃烧条件所导致。PAHs排放量的时间尺度变化也较为显著,在2012年至2017年间,随着燃煤电厂对小锅炉的关闭和大气污染净化设备的革新升级,单位锅炉的PAHs排放强度不断降低。此外,PAHs的排放格局还受到气温变化的影响,在相对较热的夏季和较冷的冬季,过度使用空调也会造成电力的额外消耗,增加区域PAHs的排放强度。Abstract: The polycyclic aromatic hydrocarbon (PAH) emissions have changed dramatically since the great change of infrastructures of Chinese coal-fired power plants (CFPPs) after 2010. The current study aims to construct a unit-based PAH emission inventory for CFPPs in Anhui province, which is one of the most important coal habitat in China, to characterize the PAH emissions from CFPPs between 2010 to 2017. The total atmospheric PAH emissions from pulverized coal (PC) and circulating fluidized bed (CFB) in 2017 were 8600 kg and 7800 kg, respectively. At civic level, Huainan, Huaibei, and Ma’Anshan ranked the top three cities in 2017, with total PAH emissions at 3650 kg, 3100 kg, and 1800 kg, respectively. The emission rates and intensities for CFB units (7.2 kg·t−1 and 2.1 kg·MW−1) were ca. 7 and 11 times higher than those for PC units (1.1 kg·t−1 and 0.19 kg·MW−1). The decreased PAH emissions from CFPPs between 2012 and 2017 was attributed to the accomplishment of ultralow emission technologies and phase-out of outdated coal-fired units. The increased PAH emissions in 2013 and 2017, when there were a warmer summer and colder winter, respectively, compared to other years, may resulted from increased coal consumption of the CFPPs accompanied by the electricity consumption for cooling or heating.
-
多环芳烃(polycyclic aromatic hydrocarbons,以下简称PAHs)对人体具有强烈的致癌、致畸、致突变效应,且在环境中广泛存在 [1-3]。燃煤电厂是环境中大气污染物的重要来源[4-5]。我国燃煤电厂广泛配备的脱硝、除尘和脱硫设施虽然可以高效去除NOx、SO2、粉尘等常规大气污染物,却难以去除更容易进入人体肺部的可过滤细颗粒物、可凝结颗粒物和气态PAHs[6-8]。
近年来,燃煤电厂大气污染物的排放因子和排放清单成为大气污染防治领域的研究热点,并且在识别燃煤电厂大气污染物排放特征、时空分布、以及区域环境效应等方面取得重要进展[9-13]。燃煤电厂排放PAHs的研究主要关注燃煤产物中PAHs的含量、分布和赋存状态的分析,以及燃煤锅炉烟气排放过程PAHs的赋存规律及影响因素等方面[13-19],而关于燃煤电厂PAHs的排放因子和清单的研究较少,尤其缺乏不同燃煤锅炉大气PAHs的精细化排放因子以及其历史排放通量的基础数据。基于此,本研究以安徽省为例,结合资料收集、实地调研和现场实测数据,“自下而上”构建了安徽燃煤电厂大气PAHs的历史排放清单,以查明锅炉、机组、大气污染控制设施以及超低排放改造对安徽燃煤电厂PAHs历史排放量的贡献值。
1. 材料与方法(Materials and methods)
1.1 锅炉机组和大气污染控制设施地理分布
实地调研了安徽省86家燃煤电厂的锅炉机组、大气污染控制设施、燃煤量、产灰量等详细信息,并结合安徽省环保局内部资料,构建了安徽省燃煤电厂基本信息数据库。该数据囊括2010—2017年安徽省173台在役燃煤机组和21台退役机组。基本信息包括位置、机组容量、锅炉类型、燃料类型(煤、煤矸石、煤泥)、煤炭年消费量、大气污染控制设施(脱硝、脱硫、除尘)和机组年龄。截至2017年底,安徽在役燃煤电厂的锅炉机组年龄跨度为0—32年,平均年龄为11年。这些电厂分布在除黄山以外的15个城市。其中煤粉炉95台,流化床炉75台,链条炉3台。煤粉炉装机容量为43.9 GW,占总装机容量的92.4%。流化床炉装机容量为3.4 GW,占总装机容量的7.6%。
选择性催化还原脱硝(SCR)和非选择性催化还原脱硝(SNCR)是安徽燃煤电厂的主要脱硝技术。煤粉炉均装配了SCR和湿式脱硫设备(WFGDs,石灰石-石膏湿法、氨法、电石渣湿法脱硫)。流化床炉装配SCR占其装机容量的75%,其余均装配了SNCR。炉内喷钙是流化床炉的主要脱硫方式,占其装机容量的86%。其余流化床炉装配了WFGDs(占装机容量的7.8%)和半干法脱硫(占装机容量的6.3%)。此外,所有煤粉炉和流化床炉均装配了除尘装置。
1.2 燃煤电厂关闭和更新锅炉情况
2010年至2017年间,安徽燃煤电厂发电量从142.0 TWh增至231.1 TWh[20]。与此同时,煤炭消费量从61.8 Mt增至87.4 Mt,远小于发电量的增长速率,说明燃煤电厂锅炉机组发电效率的显著提升。在此期间,安徽共新建了48台燃煤锅炉,装机容量共计21.5 GW,占2017年安徽燃煤电厂总装机容量的45%。此外,截止2017年底,装机容量≥300 MW的大锅炉占全省总装机容量的93.7%,而装机容量≤30 MW的小锅炉占全省总装机容量的1.7%。由于“上大压小”政策的实施,安徽燃煤电厂平均能耗从2010年的322 gce·kWh−1降至2017年的301 gce·kWh−1[20]。
1.3 排放清单构建
基于不同的锅炉类型和大气污染控制设施,将安徽省173台发电燃煤锅炉分为6类:煤粉炉1(600 MW≤机组容量≤1000 MW),煤粉炉2(300 MW≤机组容量<600 MW),煤粉炉3(6 MW≤机组容量≤210 MW),流化床炉1(6 MW≤机组容量≤210 MW),流化床炉2(3 MW≤机组容量≤60 MW),流化床炉3(3 MW≤机组容量≤15 MW)。
排放因子(EFPAH)基于实测计算得出:EFPAH = V×CPAH/Ccoal,其中V是烟气流速(m3·h−1),CPAH是烟气中PAHs的浓度(µg·m−1),Ccoal是锅炉每小时煤炭消费量(tons·h−1)。计算得出6种燃煤锅炉PAHs的排放因子(表1)。PAHs排放清单基于每一台锅炉的排放因子和煤炭消耗量计算得出:
表 1 典型燃煤锅炉现场试验的基本信息Table 1. Basic information of the six coal-fired units in field tests锅炉Boiler 城市City 机组容量/MWCapacity 燃煤类型Coal typea APCDb 燃煤效率/(t·h−1)Combustion efficiency 烟气流速/(m·s−1)Velocity of flue gas 样本Samplesc PAHs数量Number of PAHs 煤粉炉1 淮南 600 BC SCR+WFGD+ESP 95.8 9.3 P+G 16 煤粉炉2 淮南 300 BC SCR+WFGD+ESP 37.8 10.4 P+G 16 煤粉炉3 淮南 60 BC SCR+WFGD+ESP 18.7 8.7 P+G 16 流化床炉1 淮南 300 BC, CG或IC SNCR+IFSC+FF 53.6 9.8 P+G 16 流化床炉2 淮北 15 BC, CG或IC SNCR+WFGD+FF 25.2 8.3 P+G 16 流化床炉3 淮北 15 BC, CG或IC SNCR+ISFC+FF 9.1 9.7 P+G 16 注:a, BC:烟煤,CG:煤矸石,IC:低质煤;b, SCR:选择性催化还原脱硝,SNCR:非选择性催化还原脱硝,WFGD:湿式脱硫,IFSC:炉内喷钙脱硫,ESP:静电除尘,FF:袋式除尘;c, P:颗粒相,G:气相. Note: a, BC: bituminous coal, CG: coal gangue, IC: inferior coal; b, SCR: selective catalytic reduction, SNCR: selective non-catalytic reduction, WFGD: wet flue gas desulfurization, IFSC: in-furnace spraying calcium, ESP: electrostatic precipitator, FF: fabric filter; P: particulate, G: gaseous. E = ∑i∑k∑m Mi × EFi,k,m (1) 其中,E是燃煤锅炉年排放量(kg·a−1),M是每一台燃煤锅炉的耗煤量(tons),EF是每一种锅炉类型的PAHs的排放因子,i、k、m分别是锅炉类型、机组容量和大气污染控制设施类型。锅炉煤炭消耗量数据来自安徽省环保局。
1.4 质量控制与保证
PAHs使用内标法定量, 以9个不同浓度梯度的PAHs标准溶液(10、20、50、100、200、500、1000、2000、5000 ng·mL−1)绘制标准曲线。所有化合物的标准曲线的回归系数R2均大于0.99。样品中回收率指示物萘-d10、菲-d10、芘-d12、苊-d10和䓛-d12的回收效率分别为56%±12%、73%±13%、69%±10%、84%±11%和71%±14%,方法检测限为0.009—0.017 ng·g−1,在可接受的范围以内。
1.5 不确定性分析
为了定量结果的不确定性,以及各因子对预测结果的影响,应用蒙特卡罗模型模拟2010年至2017年安徽燃煤电厂PAHs的年排放量,所有参数均假设为对数正态分布。蒙特卡罗模拟在Crystal Ball 7.2中运行10000次。
2. 结果与讨论 (Results and discussion)
2.1 不同类型燃煤锅炉PAHs的排放因子和通量
2017年,安徽燃煤电厂PAHs的大气排放量为16400 kg,煤粉炉为8600 kg,流化床炉为7800 kg。其中煤粉炉1、煤粉炉2、煤粉炉3、流化床炉1、流化床炉2、流化床炉3的PAHs排放量分别占比27.9%、15.8%、8.9%、14.9%、20.2%、12.3%(图1)。这6种锅炉的燃煤量占比分别为69.6%、13.8%、4.0%、7.0%、2.8%和2.2%。这表明装机容量更大的锅炉由于燃烧效率更高,且大气污染控制设施条件更先进,从而污染物排放的相对量更小。细分至不同城市级别,淮南(3600 kg)、淮北(3100 kg)和马鞍山(1800 kg)的排放量最大。这主要因为3座城市电厂燃煤量相对较大。此外,安徽南部城市(铜陵、芜湖和宣城)由于燃煤电厂主要为大锅炉(煤粉炉1),导致PAHs相对排放量远小于北部城市(淮北、亳州)和中部城市(合肥)。
燃煤电厂排放的PAHs以4环PAHs为主,贡献值为28.0%,其次为3环PAHs(占比26.8%)和2环PAHs(占比25.0%)(图2)。中部和北部城市燃煤电厂排放PAHs中的高分子量PAHs(5环和6环PAHs)比南部城市的相对贡献率更高。主要原因是:1)小锅炉(煤粉炉3和流化床炉3)主要分布在中部和北部城市,而它们排放高分子量PAHs的量更大;2)南部城市燃煤电厂的流化床炉装配WFGD的比例更高,而WFGD对于高分子量PAHs的脱除效率更高[6]。
PAHs的排放率(kg·t−1)和排放强度(kg·MW−1),分别定义为PAHs排放量与煤炭消费量,以及PAHs排放量与机组装机容量的比值,表现为煤粉炉 (分别为1.1 kg·t−1和0.19 kg·MW−1)显著大于流化床炉 (7.2 kg·t−1和2.1 kg·MW−1)。这主要是由于流化床炉燃烧温度相对更低(800—1000 ℃),因此比煤粉炉排放PAHs的相对量更大[6]。机组容量相对较大的煤粉炉1、煤粉炉2和流化床炉1比其它锅炉的排放率和排放强度更小(表2),原因是它们具有更高的燃烧温度和锅炉压力。此外,流化床炉3的PAHs排放率和排放强度更高(表2)。
表 2 锅炉机组基本信息和PAHs排放量、排放率、排放强度Table 2. Basic information and PAH emissions, emission rates, and emission intensities from different coal-fired units锅炉Boiler 煤炭消耗量(×104) /t Coal consumptions 总装机容量/MWTotalcapacities 脱氮装置Denitrification device 脱硫装置Desulphurization device 除尘装置De-dust device PAHs排放因子/(μg·kg−1) PAHemission factors PAHs排放量/kgPAH emission amount PAHs排放率/(kg·t−1)PAH emission rates PAHs排放强度/(kg·MW−1)PAH emission intensities 煤粉炉1 6120 35,340 SCR WFGD ESPs 75 4600 0.75 0.13 煤粉炉2 1220 7780 SCR WFGD ESPs 210 2550 2.1 0.32 煤粉炉3 350 1064 SCR WFGD ESPs或FFs 420 1450 4.1 1.4 流化床炉1 620 2808 SCR或SNCR IFSC ESPs或FFs 620 3800 6.1 1.4 流化床炉2 250 487 SCR或SNCR WFGD ESPs或FFs 740 1850 7.4 3.8 流化床炉3 190 300 SCR或SNCR IFSC ESPs或FFs 1150 2150 11.3 7.2 2.2 不同年龄和机组容量PAHs排放通量对比
将燃煤锅炉按年龄分为6类:0—5年(2015—2017),6—10年(2010–2014),11—15年(2005—2009),16—20年(2000—2004),21—25年(1995—1999)和> 25年(1986—1994)。从图3可知,11—15年的燃煤锅炉对PAHs排放总量的贡献最大,占46.6%,其次为6—10年和0—5年的锅炉,分别占比25.0%和9.8%(图3)。从不同年龄锅炉的PAHs排放量主要受装机容量和燃煤量的影响:大机组锅炉(煤粉炉1、煤粉炉2和流化床炉1)是较新锅炉(0—5、6—10、11—15年)PAHs排放量的主要贡献者;小机组锅炉(煤粉炉3,流化床炉2和流化床炉3)则是较老锅炉(年龄段为16—20、21—25、>25年)PAHs排放量的主要贡献者(图3)。
2.3 安徽燃煤电厂PAHs的历史排放通量
从2010年至2017年,安徽省燃煤电厂大气PAHs的排放量从15200 kg增加至16400 kg,年均增长1.1%。该增长率低于煤炭消费量增长率(5.9%)和发电量的增长率(9.0%)。在6种不同类型的锅炉中,流化床炉3和煤粉炉3的贡献量最大,约分别占总排放量的28.2%—30.2%和14.0%—19.9%。然而,煤粉炉3的贡献量自2013年呈现明显的下降趋势(如图4),这主要是因为安徽省在2013至2017的5年时间里,共取缔了17家小型燃煤电厂,其中取缔的PC3机组占煤粉炉3总机组容量的89.2%—92.7%,导致煤粉炉3锅炉排放PAHs逐年减少。
通过计算得出,自2013年以来,由于关停小电厂导致多环芳烃排放减少的总量为1880 kg。此外,中国于2014年颁布了《全面实施燃煤电厂超低排放和节能改造工作方案》,对燃煤电厂进行全面改造。截止2017年底,安徽省共对67台锅炉机组进行超低排放改造,计算得出截止2017年,经过超低排放改造,安徽省燃煤电厂减少PAHs排放量为760 kg。
2.4 PAHs历史排放量与气温和用电量之间的耦合关系探讨
安徽省燃煤电厂的发电量、煤炭消费量和PAHs的排放量之间具有十分密切的联系(图5)。
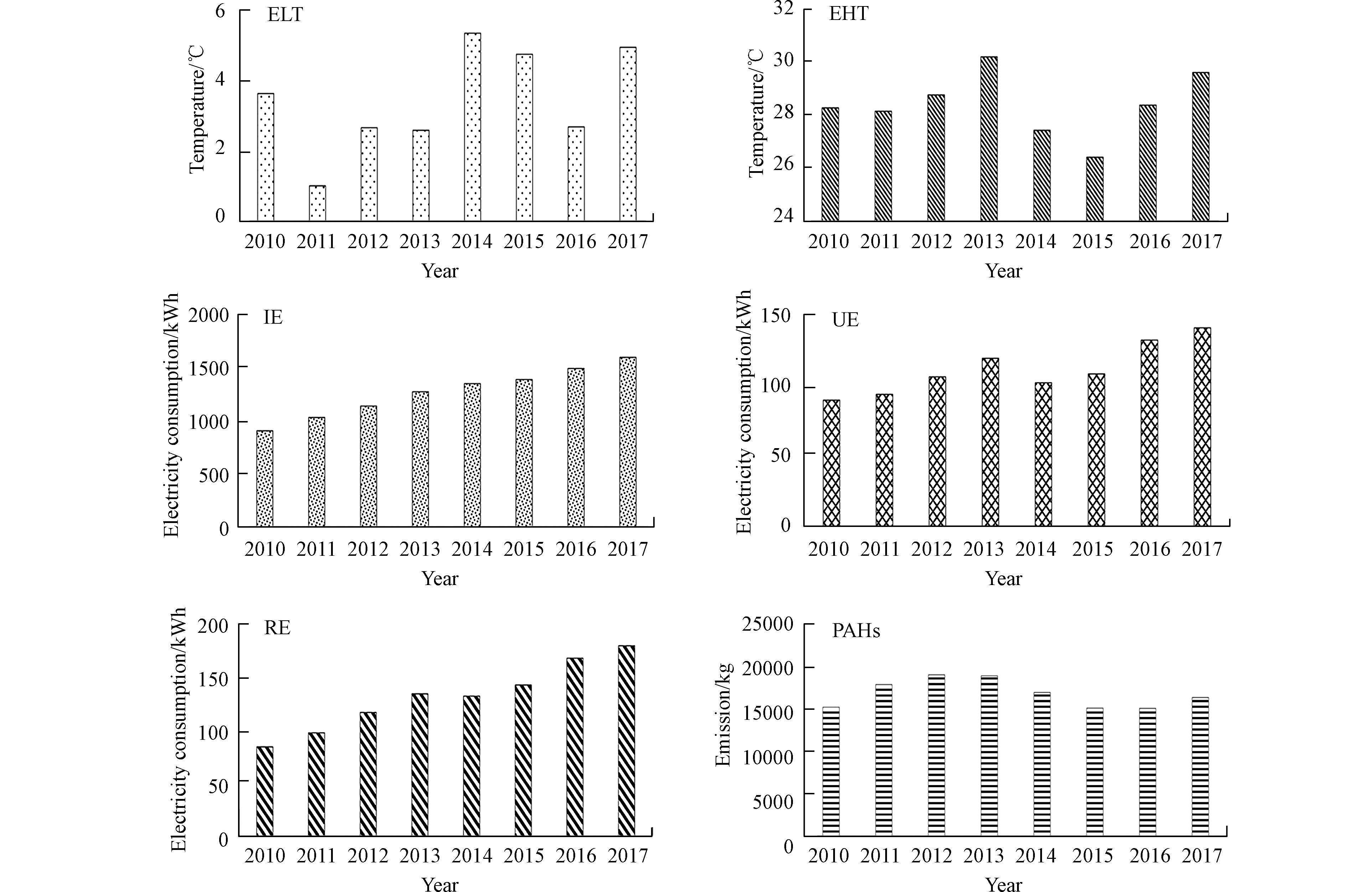 图 5 2010—2017年PAHs年排放量(PAHs)、居民用电量(RE)、城市用电量(UE)、工业用电量(IE)、高温值(EHT)、低温值(ELT)的lg值变化Figure 5. The logarithmic values of PAH emissions (PAHs), resident electricity consumption (RE), urban electricity consumption (UE), industry-wide electricity consumption (IE), extreme high temperature (EHT), and extreme low temperature (ELT) from 2010 to 2017 in Anhui
图 5 2010—2017年PAHs年排放量(PAHs)、居民用电量(RE)、城市用电量(UE)、工业用电量(IE)、高温值(EHT)、低温值(ELT)的lg值变化Figure 5. The logarithmic values of PAH emissions (PAHs), resident electricity consumption (RE), urban electricity consumption (UE), industry-wide electricity consumption (IE), extreme high temperature (EHT), and extreme low temperature (ELT) from 2010 to 2017 in Anhui通过研究发现,2010年至2017年,安徽燃煤电厂PAHs排放量的年度变化与安徽省夏季和冬季平均气温有非常有趣的相关性,例如:2011年安徽省经历了一个“冷冬”(1997年以来最低),即冬季的平均气温比往年低约1 ℃,而该年PAHs的排放量呈现一个明显的峰值;2013年安徽省经历了一个“热夏”,即夏季的平均气温比往年高约0.7 ℃,而该年PAHs的排放量也呈现一个明显的峰值。因此,气温的升高或降低会导致居民用电量的变化(如极冷或极热气候下,空调使用量会显著增加),从而可能导致煤炭消费量的增加和随之带来的PAHs排放量的增加。
2.5 不确定性讨论
燃煤电厂PAHs排放清单估算过程中,锅炉类型、机组容量、年龄、年燃煤量来自安徽省环保局。PAHs的排放因子基于前期机理研究获得[6,16-18,21-22]。燃煤电厂大气大气污染控制设施和条件来源于安徽省环保局和实地调研,均可降低结果的不确定性。但2010—2016年间新建和退役锅炉的年燃煤量基于外推法估算得出。因此,蒙特卡洛计算得到2017年PAHs排放量的不确定度为-25%—26%,而2010—2016年PAHs历史排放量的不确定度为-39%—40%。“关闭小锅炉”导致PAHs减少的排放量的不确定度为-58%—59%。
3. 结论(Conclusion)
(1)安徽省燃煤电厂PAHs的排放量从2010年的15200 kg增加至2017年的16400 kg。8年间累计排放量为126000 kg。
(2)从锅炉年龄来看,这些大机组锅炉和小机组锅炉分别是0—15年和>16年的锅炉的主要贡献者。大锅炉PAHs的排放率和排放强度比其它锅炉要低,主要是其更好的燃烧条件和WFGDs装配率。
(3)与超低排放改造带来的PAHs减排量相比,淘汰小锅炉带来的PAHs减排量更大。
(4)从燃煤电厂PAHs的历史排放量变化来看,区域气温变化(更热的夏天和更冷的冬天)导致了空调用电量的增加和随着而来PAHs排放量的增加。
-
图 5 2010—2017年PAHs年排放量(PAHs)、居民用电量(RE)、城市用电量(UE)、工业用电量(IE)、高温值(EHT)、低温值(ELT)的lg值变化
Figure 5. The logarithmic values of PAH emissions (PAHs), resident electricity consumption (RE), urban electricity consumption (UE), industry-wide electricity consumption (IE), extreme high temperature (EHT), and extreme low temperature (ELT) from 2010 to 2017 in Anhui
表 1 典型燃煤锅炉现场试验的基本信息
Table 1. Basic information of the six coal-fired units in field tests
锅炉Boiler 城市City 机组容量/MWCapacity 燃煤类型Coal typea APCDb 燃煤效率/(t·h−1)Combustion efficiency 烟气流速/(m·s−1)Velocity of flue gas 样本Samplesc PAHs数量Number of PAHs 煤粉炉1 淮南 600 BC SCR+WFGD+ESP 95.8 9.3 P+G 16 煤粉炉2 淮南 300 BC SCR+WFGD+ESP 37.8 10.4 P+G 16 煤粉炉3 淮南 60 BC SCR+WFGD+ESP 18.7 8.7 P+G 16 流化床炉1 淮南 300 BC, CG或IC SNCR+IFSC+FF 53.6 9.8 P+G 16 流化床炉2 淮北 15 BC, CG或IC SNCR+WFGD+FF 25.2 8.3 P+G 16 流化床炉3 淮北 15 BC, CG或IC SNCR+ISFC+FF 9.1 9.7 P+G 16 注:a, BC:烟煤,CG:煤矸石,IC:低质煤;b, SCR:选择性催化还原脱硝,SNCR:非选择性催化还原脱硝,WFGD:湿式脱硫,IFSC:炉内喷钙脱硫,ESP:静电除尘,FF:袋式除尘;c, P:颗粒相,G:气相. Note: a, BC: bituminous coal, CG: coal gangue, IC: inferior coal; b, SCR: selective catalytic reduction, SNCR: selective non-catalytic reduction, WFGD: wet flue gas desulfurization, IFSC: in-furnace spraying calcium, ESP: electrostatic precipitator, FF: fabric filter; P: particulate, G: gaseous. 表 2 锅炉机组基本信息和PAHs排放量、排放率、排放强度
Table 2. Basic information and PAH emissions, emission rates, and emission intensities from different coal-fired units
锅炉Boiler 煤炭消耗量(×104) /t Coal consumptions 总装机容量/MWTotalcapacities 脱氮装置Denitrification device 脱硫装置Desulphurization device 除尘装置De-dust device PAHs排放因子/(μg·kg−1) PAHemission factors PAHs排放量/kgPAH emission amount PAHs排放率/(kg·t−1)PAH emission rates PAHs排放强度/(kg·MW−1)PAH emission intensities 煤粉炉1 6120 35,340 SCR WFGD ESPs 75 4600 0.75 0.13 煤粉炉2 1220 7780 SCR WFGD ESPs 210 2550 2.1 0.32 煤粉炉3 350 1064 SCR WFGD ESPs或FFs 420 1450 4.1 1.4 流化床炉1 620 2808 SCR或SNCR IFSC ESPs或FFs 620 3800 6.1 1.4 流化床炉2 250 487 SCR或SNCR WFGD ESPs或FFs 740 1850 7.4 3.8 流化床炉3 190 300 SCR或SNCR IFSC ESPs或FFs 1150 2150 11.3 7.2 -
[1] 张玉洁, 云洋. 环境中的氧化多环芳烃综述 [J]. 环境化学, 2021, 40(1): 150-163. doi: 10.7524/j.issn.0254-6108.2020022802 ZHANG Y J, YUN Y. Oxygenated polycyclic aromatic hydrocarbons in the environment: A review [J]. Environmental Chemistry, 2021, 40(1): 150-163(in Chinese). doi: 10.7524/j.issn.0254-6108.2020022802
[2] 马涛, 孔继婕, 韩孟书, 等. 环境中硝基多环芳烃的污染现状及其毒性效应研究进展 [J]. 环境化学, 2020, 39(9): 2430-2440. doi: 10.7524/j.issn.0254-6108.2019062907 MA T, KONG J J, HAN M S, et al. Review on the pollution status and toxicity effects of nitrated polycyclic aromatic hydrocarbons in the environment [J]. Environmental Chemistry, 2020, 39(9): 2430-2440(in Chinese). doi: 10.7524/j.issn.0254-6108.2019062907
[3] 李杏茹, 白羽, 陈曦, 等. 北京冬季重污染过程大气细颗粒物化学组成特征及来源分析 [J]. 环境化学, 2018, 37(11): 2397-2409. doi: 10.7524/j.issn.0254-6108.2018011401 LI X R, BAI Y, CHEN X, et al. Chemical composition and source apportionment of PM2.5 during winter in Beijing [J]. Environmental Chemistry, 2018, 37(11): 2397-2409(in Chinese). doi: 10.7524/j.issn.0254-6108.2018011401
[4] 张晗, 刘凯, 邹天森, 等. 某地区两个燃煤电厂周边农田土壤中多环芳烃污染特征及生态安全评价 [J]. 环境化学, 2019, 38(8): 1832-1841. doi: 10.7524/j.issn.0254-6108.2018090401 ZHANG H, LIU K, ZOU T S, et al. Pollution characteristics and evaluation ecological safety of the polycyclic aromatic hydrocarbons(PAHs) pollution in surface soil of farmland around two coal-fired power plants [J]. Environmental Chemistry, 2019, 38(8): 1832-1841(in Chinese). doi: 10.7524/j.issn.0254-6108.2018090401
[5] LIU W, WU B B, BAI X X, et al. Migration and emission characteristics of ammonia/ammonium through flue gas cleaning devices in coal-fired power plants of China [J]. Environmental Science & Technology, 2020, 54(1): 390-399. [6] WANG R W, LIU G J, ZHANG J M. Variations of emission characterization of PAHs emitted from different utility boilers of coal-fired power plants and risk assessment related to atmospheric PAHs [J]. Science of the Total Environment, 2015, 538: 180-190. doi: 10.1016/j.scitotenv.2015.08.043 [7] WU B B, TIAN H Z, HAO Y, et al. Effects of wet flue gas desulfurization and wet electrostatic precipitators on emission characteristics of particulate matter and its ionic compositions from four 300 MW level ultralow coal-fired power plants [J]. Environmental Science & Technology, 2018, 52(23): 14015-14026. [8] LIU J, WANG T, CHENG J, et al. Distribution of organic compounds in coal-fired power plant emissions [J]. Energy & Fuels, 2019, 33(6): 5430-5437. [9] TONG D, ZHANG Q, LIU F, et al. Current emissions and future mitigation pathways of coal-fired power plants in China from 2010 to 2030 [J]. Environmental Science & Technology, 2018, 52(21): 12905-12914. [10] TONG D, ZHANG Q, DAVIS S J, et al. Targeted emission reductions from global super-polluting power plant units [J]. Nature Sustainability, 2018, 1(1): 59-68. doi: 10.1038/s41893-017-0003-y [11] ZHOU S L, WEI W D, CHEN L, et al. Impact of a coal-fired power plant shutdown campaign on heavy metal emissions in China [J]. Environmental Science & Technology, 2019, 53(23): 14063-14069. [12] WANG G, DENG J G, ZHANG Y, et al. Air pollutant emissions from coal-fired power plants in China over the past two decades [J]. Science of the Total Environment, 2020, 741: 140326. doi: 10.1016/j.scitotenv.2020.140326 [13] WANG R W, ZHANG J M, LIU J J, et al. Levels and patterns of polycyclic aromatic hydrocarbons in coal-fired power plant bottom ash and fly ash from Huainan, China [J]. Archives of Environmental Contamination and Toxicology, 2013, 65(2): 193-202. doi: 10.1007/s00244-013-9902-8 [14] 杨艳蓉, 周雪明, 秦娟娟, 等. 燃煤锅炉颗粒物化学组成排放特征 [J]. 环境科学, 2019, 40(9): 3908-3915. YANG Y R, ZHOU X M, QIN J J, et al. Emission characteristics of chemical composition of particulate matter from coal-fired boilers [J]. Environmental Science, 2019, 40(9): 3908-3915(in Chinese).
[15] 陈自祥, 王儒威, 孙若愚, 等. 淮南燃煤电厂汞分配、富集与释放通量 [J]. 环境化学, 2018, 37(2): 193-199. CHEN Z X, WANG R W, SUN R Y, et al. Distribution and enrichment of mercury in utility boiler of Huainan coal-fired power plant [J]. Environmental Chemistry, 2018, 37(2): 193-199(in Chinese).
[16] 倪秀峰, 王儒威, 蔡飞旋, 等. 燃煤电厂和垃圾焚烧电厂燃烧产物中卤代多环芳烃的赋存特征和毒性风险 [J]. 环境科学, 2021, 42(4): 1660-1667. NI X F, WANG R W, CAI F X, et al. Emission characteristics and toxicity effects of halogenated polycyclic aromatic hydrocarbons from coal-fired and waste incineration power plants [J]. Environmental Science, 2021, 42(4): 1660-1667(in Chinese).
[17] 袁晶晶, 笪春年, 王儒威, 等. 淮南燃煤电厂烟气中颗粒相和气相中多环芳烃的赋存特征 [J]. 环境化学, 2018, 37(6): 1382-1390. doi: 10.7524/j.issn.0254-6108.2017090201 YUAN J J, DA C N, WANG R W, et al. Occurence of polycyclic aromatic hydrocarbons in PM10-and gaseous phases of flue gases emitted from Huainan coal-fired power plant [J]. Environmental Chemistry, 2018, 37(6): 1382-1390(in Chinese). doi: 10.7524/j.issn.0254-6108.2017090201
[18] 倪秀峰, 王儒威, 王继忠, 等. 燃煤电厂排放PAHs的气粒分配机制和排放通量 [J]. 中国环境科学, 2021, 41(1): 49-55. doi: 10.3969/j.issn.1000-6923.2021.01.006 NI X F, WANG R W, WANG J Z, et al. Studies on the gas-particle partitioning mechanism of polycyclic aromatic hydrocarbons(PAHs) and emission amount from coal-fired power plants [J]. China Environmental Science, 2021, 41(1): 49-55(in Chinese). doi: 10.3969/j.issn.1000-6923.2021.01.006
[19] 荆丹华, 牟玲, 王洁, 等. 机械炼焦过程生成飞灰中含碳组分分布特征 [J]. 中国环境科学, 2017, 37(11): 4097-4102. doi: 10.3969/j.issn.1000-6923.2017.11.011 JING D H, MU L, WANG J, et al. Characterization of carbon contents in fly ash from coking processes [J]. China Environmental Science, 2017, 37(11): 4097-4102(in Chinese). doi: 10.3969/j.issn.1000-6923.2017.11.011
[20] ANHUI STATISTICAL YEARBOOK. Natural resources and environmental protection [M]. China Statistics Press: Beijing, China, 2011-2018. [21] WANG R W, YOUSAF B, SUN R Y, et al. Emission characterization and δ13C values of parent PAHs and nitro-PAHs in size-segregated particulate matters from coal-fired power plants [J]. Journal of Hazardous Materials, 2016, 318: 487-496. doi: 10.1016/j.jhazmat.2016.07.030 [22] WANG R W, LIU G J, SUN R Y, et al. Emission characteristics for gaseous- and size-segregated particulate PAHs in coal combustion flue gas from circulating fluidized bed (CFB) boiler [J]. Environmental Pollution, 2018, 238: 581-589. doi: 10.1016/j.envpol.2018.03.051 -





 DownLoad:
DownLoad: