-
樟子松(Pinus sylvestris var. mongolica)是我国“三北”地区营建防护林的优良树种,具有适应性强、耐寒耐旱、根系发达等特性。因其可以将土壤中的水分紧紧留住,固定沙丘的流动从而起到防风固沙作用,在辽西北章古台地区有着大面积的栽植。近年来,学者们分别从土壤水分[1]、土壤养分[2]、土壤物理性质[3-4]、土壤酶活性[5-6]等方面对樟子松人工林的合理经营进行了研究。
土壤微生物作为土壤有机及无机复合体的组成部分,在森林生态系统的物质循环和能量流动中具有明显促进作用[7]。土壤微生物易受到环境条件的影响而发生变化,能产生快速灵敏的响应[8-10],其中土壤微生物量通常可以反映土壤肥力状况。土壤微生物量主要包括土壤微生物量碳、氮、磷、硫,与土壤有机质、全氮等养分指标存在相关性[11]。土壤微生物量碳(MBC)能够体现土壤中有机碳的活性,周转周期较短,可以较为敏捷地指示土壤环境的细微变化,可用于预测土壤有机质早期变化[12]。而土壤微生物量氮(MBN)作为土壤氮素的贮藏库,具有较强的活跃性,能够参与土壤氮素循环转化[13]。土壤呼吸强度可以反映土壤微生物的活性,土壤呼吸作用影响大气碳循环,在土壤碳源输送中扮演着重要角色[14]。通过土壤呼吸所释放的CO2既可以作为土壤植物和动物的活性指标,还可以检测土壤肥力和土壤透气性[15]。因而土壤微生物可以作为评估土壤质量及肥力变化最为敏感同时也最具潜力的指标[16-17]。
目前,国内外关于森林生态系统对土壤微生物的影响多集中于土地利用类型[18]、森林类型[19-20]和林木根系[21]方面。对于樟子松人工林,李陆平等[22]研究了幼林龄到中龄林下土壤微生物类群(细菌、真菌、放线菌)数量变化特征。林雅超等[23]研究了中龄林和成熟林下樟子松土壤微生物量动态变化规律。然而对樟子松人工林全生育周期(幼龄林到过熟林)下土壤微生物特性尚未系统开展。本文对不同林龄樟子松人工林土壤微生物量碳、氮、土壤呼吸变化规律进行研究,可为人工林经营管理提供科学基础。
-
研究区位于科尔沁沙地东南缘的辽宁省阜蒙县彰武台镇樟子松试验示范林(42°43′—42°51′N,121°53′—122°22′E)。属典型的温带半干旱半湿润气候区的季风大陆性气候,年均气温为7.9 ℃,最高温度38.3 ℃,最低温度-34.4 ℃,昼夜温差大,全年四季变化明显,且雨热同期。平均风速3.8 m·s−1,最大风速30 m·s−1,年均降水量497 mm,年均蒸发量1450 mm,蒸发量大于降水量,平均无霜期156 d。该地土壤类型为风沙土,抗风、抗旱的沙生植物为优势种。
-
在樟子松人工林勘查的基础上,选取地形、气候、水文、土壤质地等立地条件相对均一地段,分别选取林龄为10 a、20 a、30 a、40 a、50 a和60 a的樟子松人工林(表1)。根据国家林业行业标准中主要树种龄级与龄组划分(LY/T 2908—2017)[24]及樟子松人工林生长特性,本研究中将其龄期划分为幼龄林(10 a、20 a)、中龄林(30 a)、近熟林(40 a)、成熟林(50 a)和过熟林(60 a)。选择荒草沙地作为对照(CK),各林龄分别设置4块20 m×20 m的标准地。2018年8月,采用S形取样法,每个标准地中布设10个取样点,用土钻分别取0—20 cm、20—40 cm、40—60 cm、60—80 cm和80—100 cm 的5个深度的土样。将同一土层样品混合均匀后过0.25 mm筛,剔除杂质装入塑封袋放入冰箱待测。
-
土壤微生物量碳氮采用氯仿熏蒸浸提法测定,对土壤分别进行熏蒸处理和未熏蒸处理,利用0.5 mol·L−1 K2SO4溶液进行浸提[25]。土壤微生物量碳(MBC)和土壤微生物量氮(MBN)分别用下式计算[26]:
式中,EC、EN分别为熏蒸和未熏蒸土样之差;KEC、KEN分别为氯仿熏蒸杀死的微生物体中碳、氮被浸提出来的比例,KEC一般取0.38,KEN一般取0.45[26-27]。
土壤微生物碳、氮熵计算公式如下:
土壤养分指标按照鲍士旦编著的《土壤农化分析》[28]进行测定。其中,土壤有机碳采用重铬酸钾-稀释热法,土壤全氮采用凯式定氮法,土壤碱解氮采用碱解扩散法,土壤全磷采用浓H2SO4消煮-钼锑抗比色法,土壤有效磷采用碳酸氢钠浸提-钼锑抗比色法。土壤呼吸强度采用室内密闭培养NaOH碱液吸收法,NaOH的浓度为0.1 mol·L−1,恒温培养24 h[29]。
-
各指标测定后所获得的数据转化为风干土计算。运用SPSS 22.0软件中的单因素方差分析和Duncan模型进行显著性检验(P ˂0.05);相关性分析利用Pearson检验;聚类分析采用系统聚类法;冗余分析(Redundancy analysis, RDA)利用Canoco 5.0软件分析。
-
对不同林龄、不同土层樟子松人工林土壤微生物指标进行经典统计分析,计算各指标变异系数,划分土壤微生物指标的变异程度。MBC、MBN、土壤24 h呼吸强度的变化范围分别为246.19—82.41 、11.39—2.71 、3.22—1.19 mg·kg−1,平均值分别为165.19、5.96 、1.92 mg·kg−1。MBC/MBN、土壤微生物碳熵、土壤微生物氮熵的变化范围分别为64.90%—18.17%、2.84%—1.44%、5.92%—1.26%,平均值分别为30.31%、1.99%、2.98%。不同微生物量指标的变异程度各不相同,其变异程度大小依次为MBN>土壤微生物氮熵>MBC/MBN>土壤呼吸强度>MBC>土壤微生物碳熵,指标变异范围为15.08%—30.70%。
-
不同林龄、不同土层土壤MBC、MBN、土壤呼吸强度特征如表2所示。在垂直方向上,荒草沙地(CK)与樟子松人工林林下土壤MBC、MBN含量及土壤呼吸强度均呈现表聚性。不同林龄樟子松人工林土壤MBC、MBN含量随着林龄增加总体呈现出先升高后平稳再下降的变化趋势,这与杨涛等[30]的研究结果相一致。樟子松林下土壤MBC含量显著高于荒草沙地(CK),10 a、20 a、60 a 土壤MBN含量与荒草沙地差异不显著,30—50 a MBN含量与其他林龄间具有显著性差异。在40 a时MBC含量达到最大值209.27 mg·kg−1,而MBN峰值则出现在50 a时,为8.21 mg·kg−1。上述结果表明幼龄期植物凋落物输入较低,对土壤养分的需求量较多。中龄期自疏作用会使冠层的郁闭度降低,光照增强,土壤微生物的繁殖速率有所增加[31]。土壤呼吸强度随林龄增加先增大后减小,荒草沙地土壤呼吸强度大于10 a,与20 a间无显著性差异。原因主要为土壤呼吸的强弱与微生物性质及对养分利用情况有关[32],樟子松林下枯落物C/N较荒草沙地枯落物高,而C/N比较高的枯落物分解较慢[33],且草本植物枯落物分解速率明显高于木质植物,因此营林初期樟子松土壤呼吸速率不高。60 a时土壤呼吸强度减弱可能是受到成熟林期樟子松冠幅较大的影响使林下土壤温度偏低,低温不利于枯落物的分解[34],导致呼吸作用减弱。
-
不同林龄、不同土层土壤MBC/MBN、土壤微生物碳、氮熵特征如表3所示。MBC/MBN总体上呈现出随着土层加深而增大的趋势。林下土壤MBC/MBN在各土层处均显著大于CK,表明在从荒草沙地到林地转变过程中,MBC/MBN显著提高。10—50 a樟子松人工林土壤MBC/MBN无显著性差异,其均值在20—40范围内,60 a时大幅上升,均值达到50.99。表明由成熟林向过熟林转变过程中,MBC/MBN再次大幅提高。在这两个转变过程中,土壤微生物群落中真菌比例大幅提高,这与牛小云等[35]、李陆平等[22]提出的真菌数量随林龄增大而增多结果一致。原因在于,其一,林地木质类枯枝落叶较荒草沙地丰富,纤维素是枯落物理化性质的代表物,分解纤维素导致真菌富集[36],因此林地MBC/MBN高于荒草沙地;其二,过熟林樟子松病害变多,而植物的病害多为真菌病害,因此MBC/MBN提高[37]。
土壤微生物碳熵和氮熵可以反映土壤微生物量对土壤营养库的贡献程度,熵值越高,微生物所固定的养分就越多[38]。土壤微生物碳熵与氮熵都用百分号来表示,可以有效避免因对不同土壤类型有机碳含量差异而导致的问题[39]。土壤微生物碳熵、氮熵均随土壤深度的增加而不断减小,最大碳熵值出现在0—20 cm土层处,最大氮熵值则出现在20—40 cm土层处。表明表层土单位数量有机碳、氮能维持的微生物生物量高,微生物活性强。
林地土壤微生物碳、氮熵显著大于荒草沙地,原因在于林地中枯落物积累量多,能够为土壤提供更加充足的营养,使土壤微生物变得更加活跃[40]。本研究发现土壤微生物碳、氮熵均随林龄的不断增加呈现出M型曲线变化,幼龄林和过熟林熵值低。表明幼龄林和过熟林固碳固氮能力弱,成熟林土壤微生物量活性较强。土壤微生物碳熵在40 a时达到最大,与其他林龄间具有显著性差异;土壤微生物氮熵在30 a达到最大,与其他林龄间差异显著。
土壤微生物碳、氮熵受土壤类型、气候等因素影响,土壤微生物碳熵变化范围一般为0.27%—7.0%[41]。微生物碳熵较大,说明土壤微生物的活性较高,加快了有机碳的周转速率。本研究中土壤微生物碳熵在各林龄之间变化范围较小,为1.66%—2.84%;土壤微生物氮熵在各林龄之间的变化范围较大,为1.51%—5.10%,其最小值均低于且最大值均大于温带森林土壤微生物碳熵(1.8%—2.8%)与氮熵(3.4%—5.9%)[42]。结果可能是由于本研究林龄跨度大,土壤类型、管理措施以及土壤样本采集的时间有所不同,因此土壤微生物碳、氮熵范围较大。
-
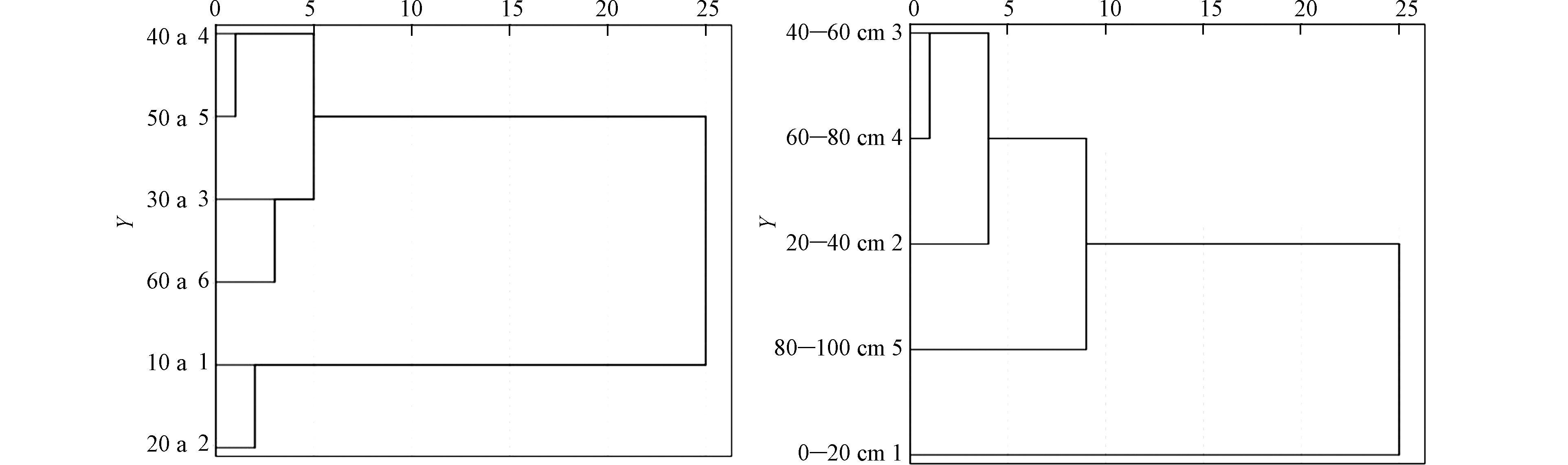
对不同林龄及土层的6个微生物指标进行聚类分析,结果如图1所示。从图1(a)可看出,分析结果将林龄分为4类。第一类为10 a和20 a,此时樟子松均为幼龄林期,樟子松人工林在生长初期大量吸收土壤养分,导致土壤生境的稳定性逐渐减弱;第二类中30 a处于中龄林,此时林木之间存在着对光、水以及养分等较为激烈的竞争;第三类为40 a和50 a,樟子松人工林处于稳定生长的成熟期,对土壤养分需求量基本趋于稳定,土壤微生物量有所积累;第四类为60 a,此时樟子松林已进入过熟林阶段,土壤微生物性质减弱。图1(b)是对不同土层进行聚类分析。第一类是0—20 cm,第二类是20—40 cm、40—60 cm和60—80 cm,第三类是80—100 cm。0—20 cm土层水热条件较好,更接近腐殖质层,土壤性质相近,为一类;80—100 cm属于底层土,可供土壤吸收利用的养分含量有所降低,为一类。从分类结果看出,林龄和土层对土壤微生物性质具有不同程度的影响,且该结果与前面所得结论即6个微生物指标的变化特征基本一致。
-
土壤微生物指标与樟子松人工林地上与地下因素的相关性分析见表4。从微生物与养分关系角度上,总体上,微生物指标与AP均未表现出显著相关性;除土壤微生物氮熵外,其他微生物指标与TN、HN养分相关性不显著;MBC、MBC/MBN与SOC显著正相关;除MBC/MBN外,剩余微生物指标与TP极显著正相关,表明TP是影响微生物指标的主要因素。从微生物指标与樟子松生长指标关系角度,MBC与生长指标均极显著正相关;MBN与胸径、冠幅显著正相关;MBC/MBN与株高极显著正相关;土壤微生物氮熵与胸径显著正相关,表明MBC与MBN对樟子松的生长发育有显著的促进作用。
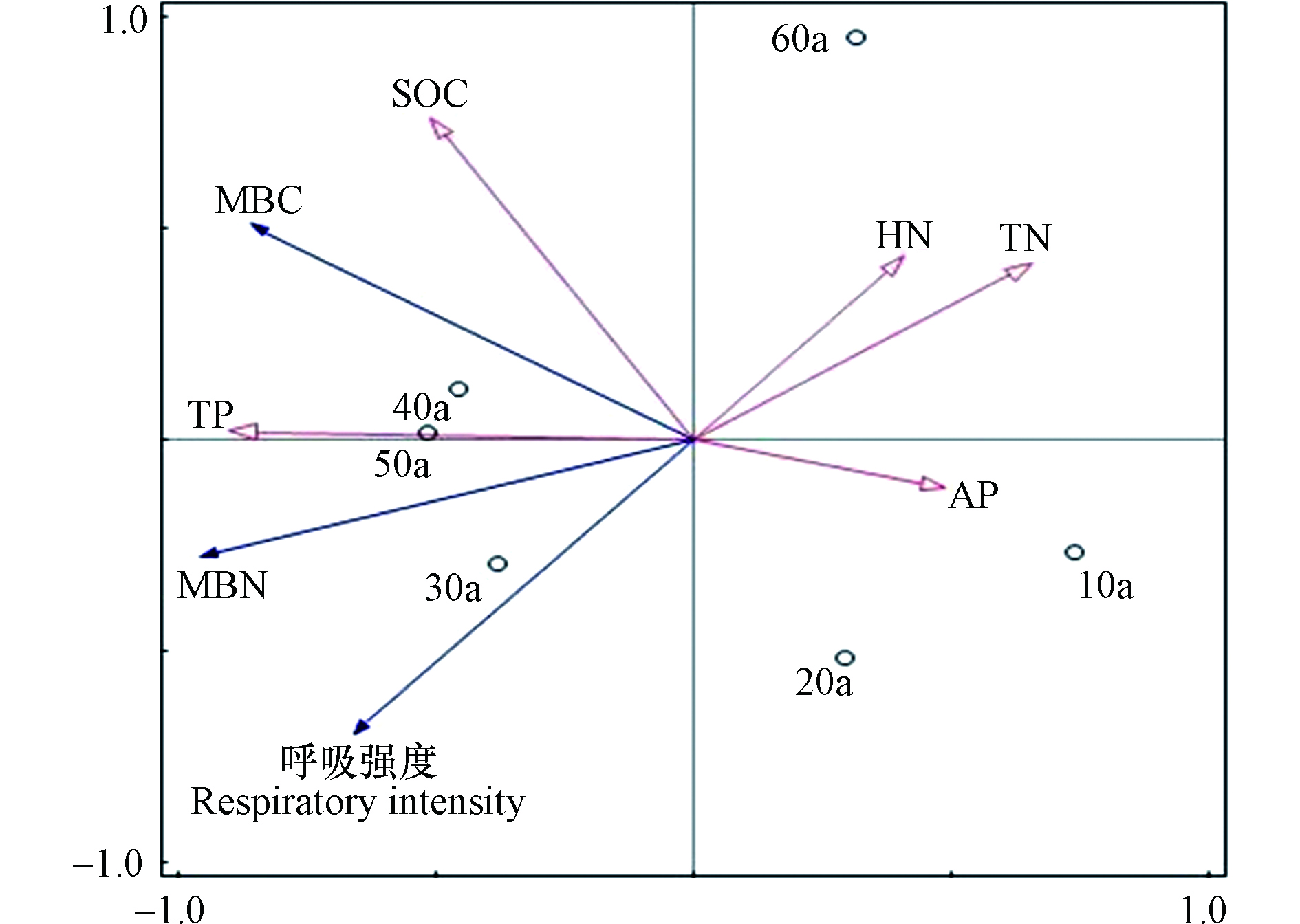
采用冗余分析(RDA)可以更好地揭示不同林龄和不同土层深度樟子松人工林土壤微生物指标与土壤养分指标之间的相关关系,结果如图2所示。第一排序轴和第二排序轴解释了土壤微生物指标与土壤养分关系总变异的98.67%,其中第一排序轴可以解释各指标与土壤养分总变异的79.22%,第二排序轴能解释微生物指标与土壤养分变异的19.45%。MBC、MBN、土壤呼吸强度总体与土壤TP、SOC呈较为显著的正相关,与AP呈负相关。从箭头的连线长度可以看出其对土壤微生物指标的影响程度,TP、SOC对不同林龄样地微生物指标的影响较大,其中TP对变异的解释度为63.3%。林龄为10 a、20 a、60 a的樟子松人工林与土壤微生物指标间的相关性不强,由此进一步反映出幼龄林与过熟林土壤养分水平不高。
-
随着土层深度增加,土壤MBC、MBN及土壤呼吸强度呈现表聚性。原因在于林地浅层土壤距离腐殖质层最近,能更有效地利用水分及养分。土壤氧气含量随土壤垂直深度增加而减少,氧气含量越大,为土壤微生物提供的可降解底物越多,更能促进土壤微生物活性。深层土氧气含量较少,好氧微生物活动耗氧导致氧化还原电位下降,抑制了土壤微生物的活性,呼吸作用减弱。土壤微生物熵随着土层深度增加呈现出“先增后减”的变化规律。深层土壤MBC/MBN大于表层土壤,因MBC/MBN能反映真菌和细菌的占比状况,真菌所占比例越大,其MBC/MBN则越大。所以表层土壤真菌比例相对较小,对枯落物的分解能力相对较弱。通过相关关系表明SOC与MBC/MBN显著正相关,因此需要施入有机肥以提高表层覆盖物的降解能力。
樟子松在近熟林和成熟林期土壤微生物性质最佳,而过熟林土壤微生物各指标显著下降。由此表明近熟林和成熟林根系分泌物及凋落物有所积累,为土壤微生物新陈代谢和自身合成提供了较多的能量来源,土壤微生物量持续增加。过熟林期由于樟子松出现衰退现象,死亡率和病害率增加,土壤性质恶化,导致土壤微生物量下降。
沙地不同林龄樟子松人工林土壤微生物量特征
Characteristics of soil microbial biomass in Pinus sylvestris var. mongolica plantations with different ages in sandy land
-
摘要: 为揭示不同林龄沙地樟子松人工林土壤微生物性质的变化规律,选择10、20、30、40、50、60 a生科尔沁沙地樟子松人工林为研究对象,测定分析了土壤微生物量碳(MBC)、土壤微生物量氮(MBN)、土壤呼吸强度、土壤微生物量碳氮比(MBC/MBN)、土壤微生物碳、氮熵等特征的变化。结果表明,随林龄增加,MBC和MBN均先增大后平稳再下降,二者最大值分别出现在40 a和50 a;土壤呼吸强度、土壤微生物碳、氮熵都呈现出上升-下降-上升-下降的变化趋势,且各指标均在60 a最小,表明过熟林微生物性质恶化;MBC/MBN先维持稳定,后期大幅度增大,在60 a时达到最大。随着土层深度增加,MBC、MBN及呼吸强度呈现表聚性;土壤微生物碳、氮熵呈现出先增后减的变化规律,深层MBC/MBN大于表层土壤。微生物各指标与樟子松人工林地上部分存在正相关关系,与全磷呈显著正相关关系。冗余分析表明,全磷、有机碳对不同林龄樟子松林下土壤微生物量影响显著。综上所述,樟子松近熟林和成熟林期微生物各指标达到最佳,过熟林时微生物活性差。Abstract: To reveal the changing laws of soil microbial properties of Pinus sylvestris var. mongolica plantation with different ages in sandy land, we determined and analyzed the changes of soil microbial biomass C(MBC) and N(MBN), soil respiratory intensity, soil microbial biomass C/N(MBC/MBN), soil microbial quotient and other characteristics changes in P. sylvestris var. mongolica plantations at 10, 20, 30, 40, 50, and 60 a in Horqin sandy land. The results showed that with the increase of forest age, both MBC and MBN first increased, then remained stable and finally decreased, and the maximum values of the two respectively appeared at 40 a and 50 a; The soil respiratory intensity, soil microbial carbon and nitrogen entropy all showed a change trend of increased—decreased—increased—decreased, and the minimum values of each index appeared at 60 years, indicating that the microbial properties of the over-mature stand have deteriorated; MBC/MBN remained stable at first, then increased substantially, and reached its maximum at 60 years. As the soil depth increased, MBC, MBN and respiratory intensity showed the surface aggregation; the change law of microbial quotient increased first and then decreased, and MBC/MBN of deep soil was greater than that of surface soil. Microbial indicators had a positive correlation with the above—ground part of P. sylvestris var. mongolica plantation, and had a significant positive correlation with total phosphorus. Redundancy analysis showed that TP and SOC had significant effects on soil microbial biomass at different stand ages of P. sylvestris var. mongolica. The microbial indicators reached the best in near—mature and mature stand, and its microbial activity was poor in over—mature stand.
-
Key words:
- sandy land /
- Pinus sylvestris var. mongolica plantation /
- stand age /
- microbial biomass
-
旋风分离器是一种常见的预除尘设备,广泛应用于环境工程、石油化工等领域。气流进入旋风分离器后先旋转向下运动,产生离心力并将颗粒甩向壁面使其被捕集后进入灰斗;灰斗中的气体反向向上旋转,而颗粒物最终沿着溢流管被排出[1]。
常见旋风分离器为单入口,因此入口结构本身在几何上不具备对称性。若入口不对称,会导致其内部流场不完全对称,从而影响旋风分离器的性能[2-3]。许多学者通过实验和数值模拟研究了对称多入口结构的旋风分离器,结果表明,该结构能提高流场的对称性和稳定性,从而提高气固分离效率[4-8]。而对于对称多入口结构的设计,目前尚未形成统一的标准或规范。
在设计多入口旋风分离器时,通常应保持入口流量和流速不变。这是因为实际应用的时候风量通常由前端决定,故入口流量应保持不变;而为了保证旋风分离器内部的旋流数和雷诺数不变,流速也应保持不变。因此,在入口流量和流速不变的前提下,入口总面积保持一定。对于多入口旋风分离器的设计,每一单个入口的面积则相应缩小。由于颗粒在入口时的位置会影响分离效率[9],所以,本研究采用数值模拟方法深入分析在设计多入口结构时,入口位置对旋风分离器流场和性能的影响,以确定较高分离效率下的最佳入口位置,以期为具体工程中多入口旋风分离器的设计提供参考。
1. 数值模拟方法
1.1 多入口结构的设计
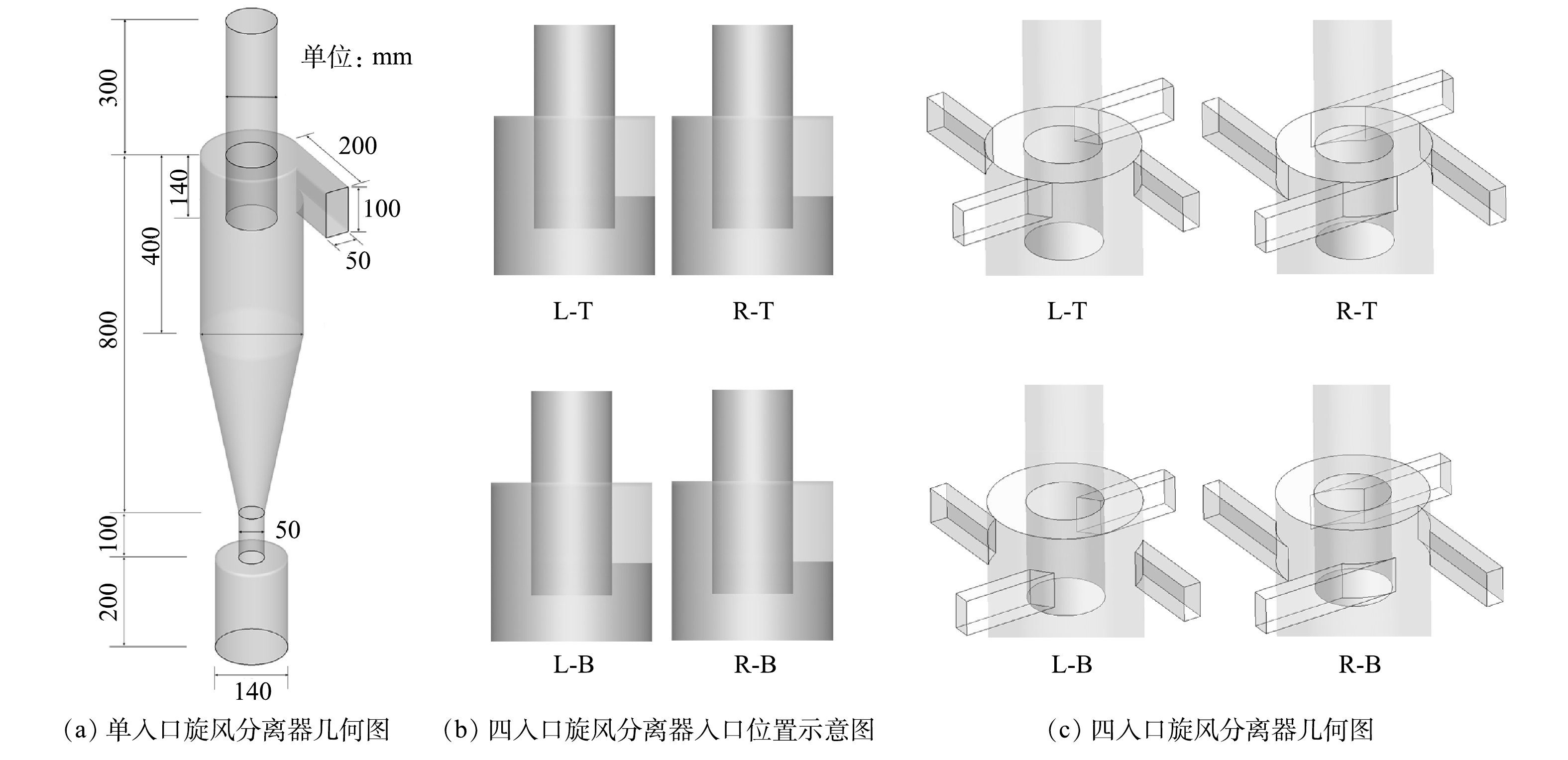
研究对象为Lapple型单入口旋风分离器,其筒体直径D为200 mm,其余尺寸以mm为单位标注(见图1(a))。以该旋风分离器的筒体结构为基础,设计了4种不同入口位置的四入口旋风分离器(见图1(b)和(c))。将原单入口的位置分为大小相等的4个区域,每个区域为四入口旋风分离器的入口位置,其余3个入口对称布置在相同的方位上。每个入口的面积为单入口旋风分离器入口面积的1/4。根据其上(Top)下(Bottom)左(Left)右(Right)的方位分别命名为L-T、R-T、L-B、R-B。图1(b)中的黑色虚线代表单入口旋风分离器的入口位置,红色实线表示多入口旋风分离器单个入口的位置。
1.2 数值模拟方法
旋风分离器内三维强旋流场的模拟方法[2, 10-11]分为以下3个步骤。
1) 采用ICEM软件以旋风分离器顶板中心为原点,创建几何模型并划分六面体网格。网格无关性已在前期研究[12]中进行了验证,最终确定的网格数在5×105左右。
2) 采用Fluent软件求解气相流场。湍流模型选择RSM模型,采用标准壁面函数,压力-速度耦合算法选择SIMPLEC,压力插补格式选择PRESTO,离散格式均采用QUICK格式。入口设置为速度入口,风速16 m·s−1;出口设置为压力出口,表压为0;壁面均设置为无滑移边界。时间步长取0.000 5 s,计算4 000步以保证流场达到稳定状态。
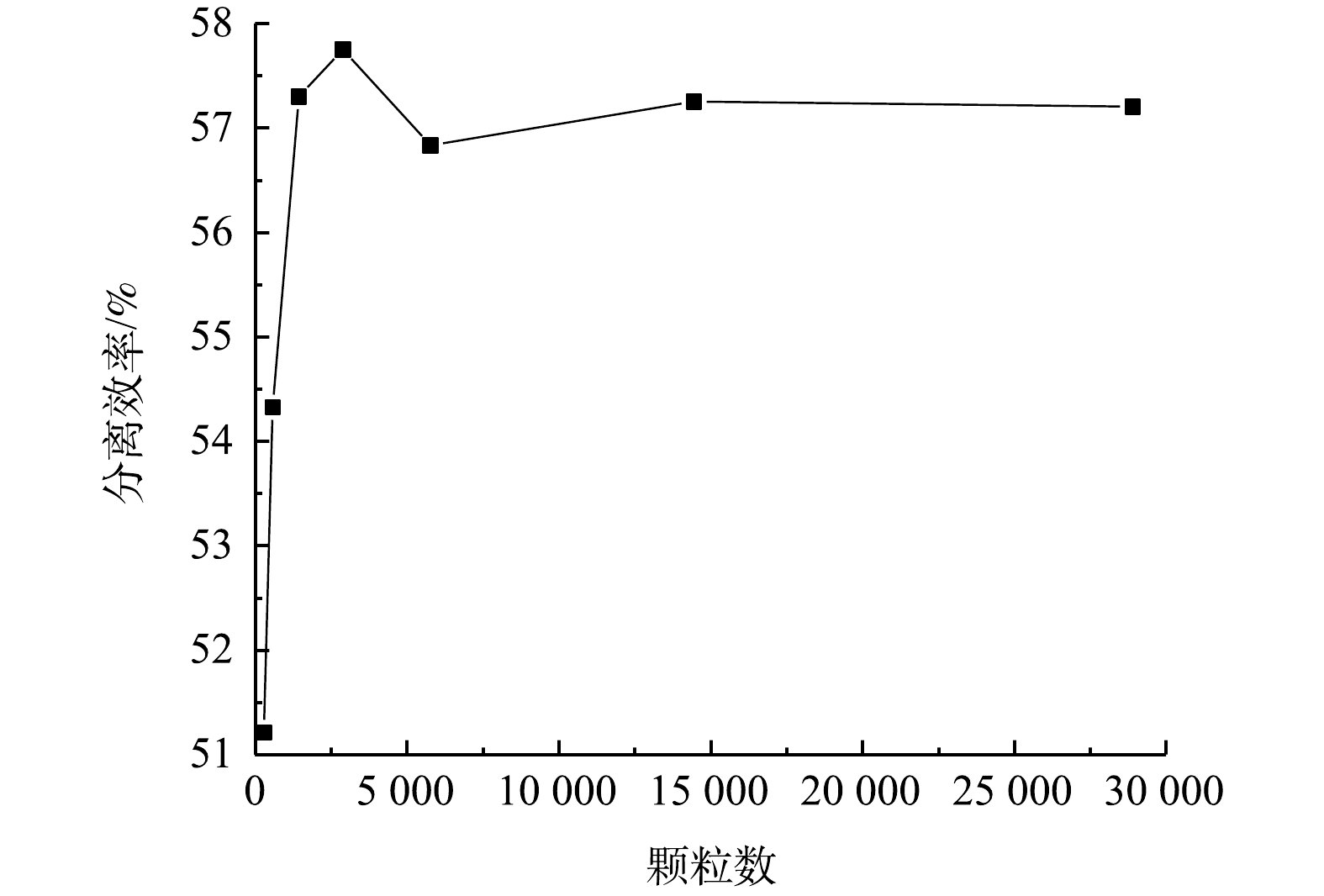
3) 假设颗粒为稀相流,采用DPM模型追踪颗粒运动。在入口处注入密度为800 kg·m−3的分子筛颗粒进行追踪。灰斗底部设为颗粒捕集面,出口设为颗粒逃逸面。分别注入不同粒径的颗粒,将捕集的颗粒数除以注入的总颗粒数即可得到该粒径的分离效率。由于采用了颗粒随机轨道模型来模拟湍流对颗粒轨迹的影响,所以,注入的颗粒数对于分离效率的计算有一定的影响。图2为1.0 μm颗粒分离效率随颗粒数变化的曲线,当颗粒数达到5 780以后,分离效率无明显波动。
2. 结果与讨论
2.1 入口位置对流场的影响
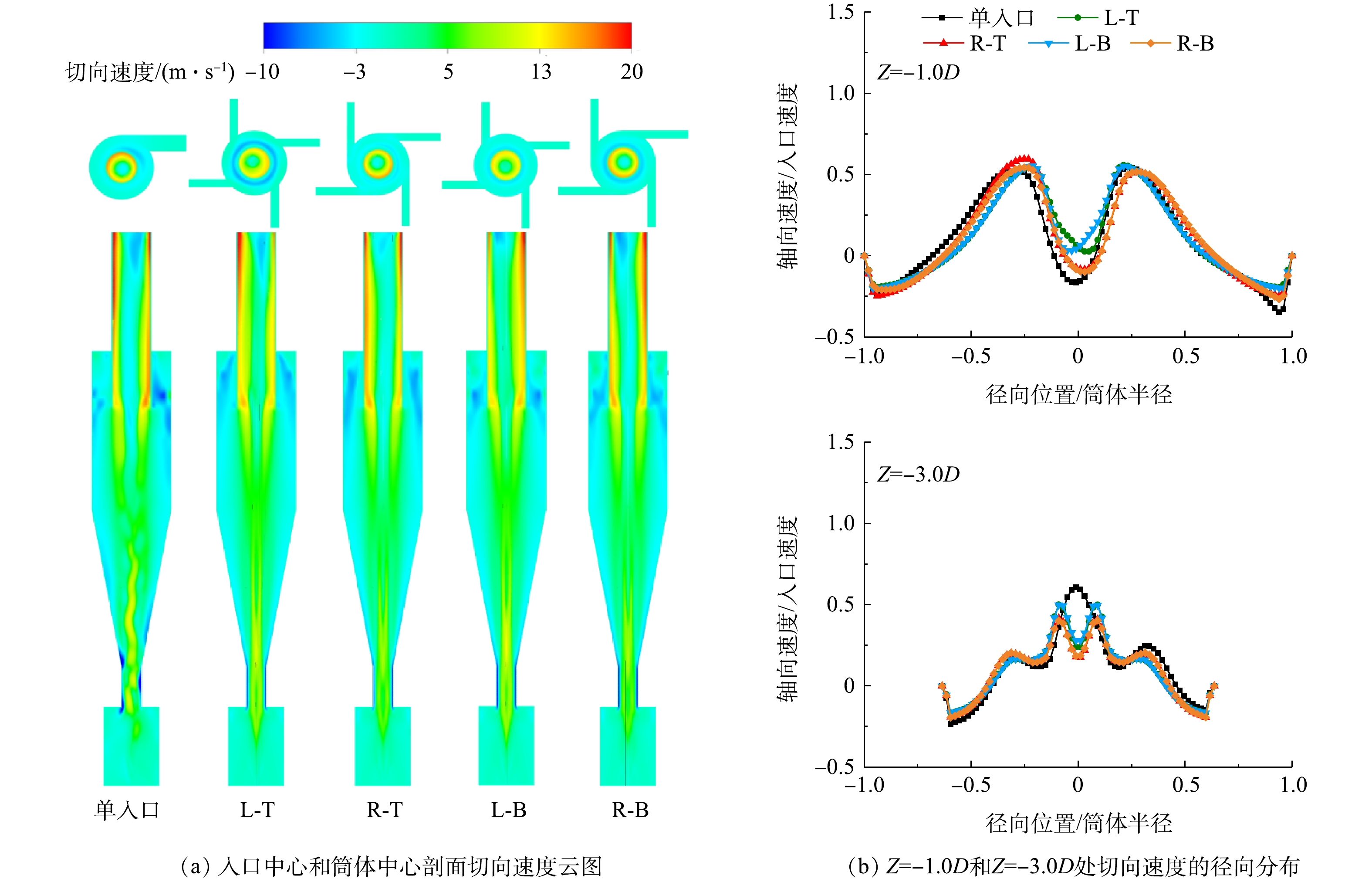
旋风分离器内切向速度的大小决定了离心力的大小,其数值的平方与离心力大小呈正比关系。因此,切向速度大小会影响旋风分离器的分离效率。本研究涉及旋风分离器的5种入口情况产生的内切向速度分布均呈现典型的“兰金涡”结构(见图3),即沿着径向向外的方向,内部形成速度近似线性增长的准强制涡,外部形成速度大致呈反比例减小的准自由涡。切向速度存在一个极大值,其出现的位置可视为内外旋涡的分界线[13]。由图3可知,本研究的不同入口位置的切向速度极大值大都出现在溢流管下端延长线附近,但大小有所不同。与单入口的切向速度相比,R-T和R-B型的切向速度基本一致,而L-T和L-B型的切向速度则整体偏小,且极大值出现的位置略微向中心移动,表明内旋涡有所收缩。此外,切向速度会有负值存在,在单入口中尤为明显,这与涡核偏心现象密切相关[12]。
旋风分离器中的轴向速度分布如图4所示。气流在外侧为下行流,内侧为上行流,中心还存在向下的回流。回流的产生与旋流强度有关,当旋流强度减弱到一定程度时,回流消失[14]。与单入口的轴向速度相比,其余4种四入口结构的轴向速度大致相同,仅在细节上有所差异。例如,在Z=-0.3D处,四入口中心位置的轴向速度明显小于单入口,结合云图分析可知,此处存在上行流与回流之间的碰撞,表明四入口的回流区域相对更大。这可能是由于入口对称性改善使得旋流强度增大导致的。
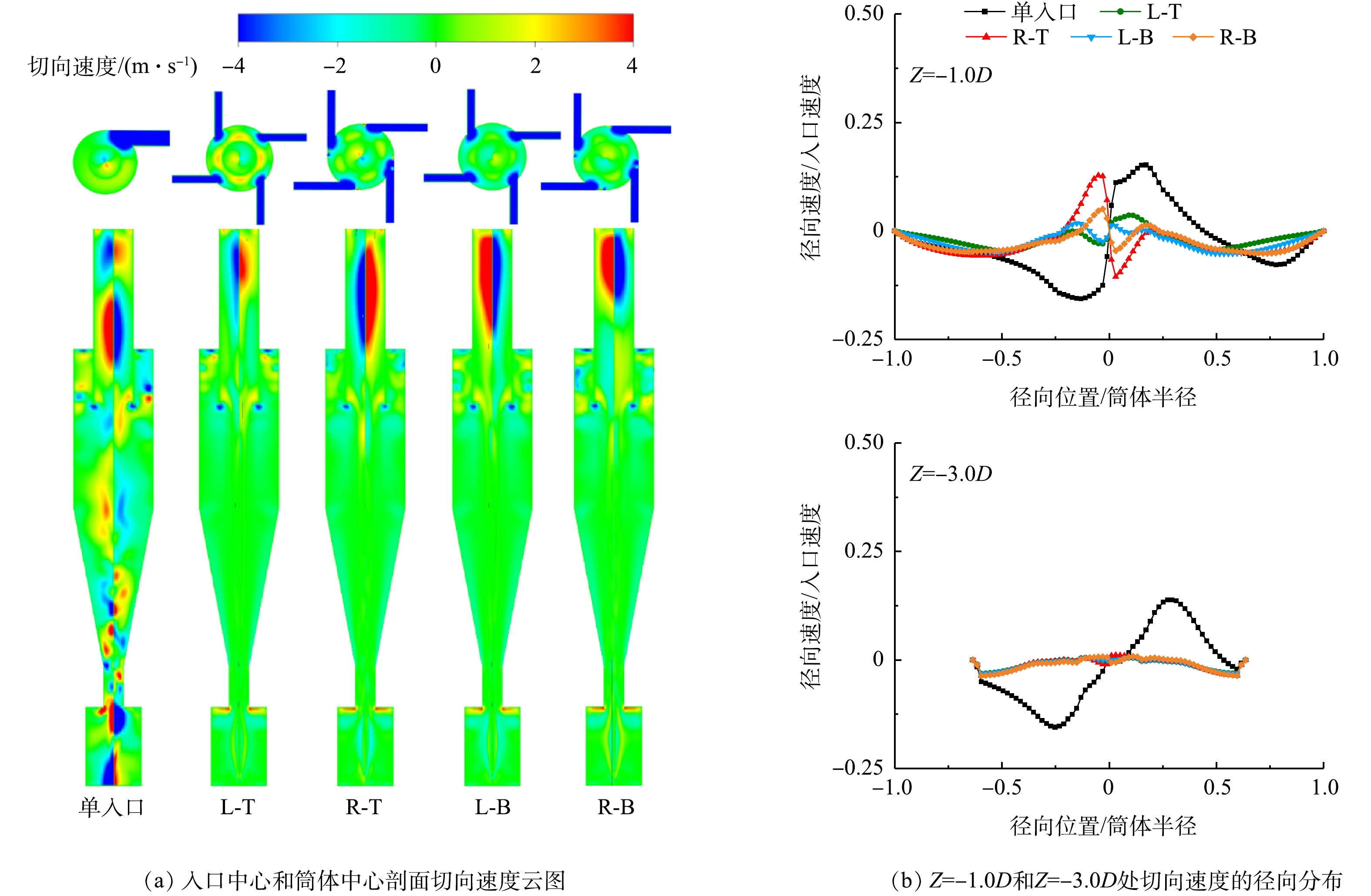
在单入口旋风分离器中,径向速度沿中轴线呈现正负交替分布,如图5所示。而在四入口旋风分离器中这一现象基本消失,仅在溢流管底部附近(Z=-0.1D处)和出口管内存在。径向速度的正负交替现象也与涡核偏心有关,通过提高入口对称性可在一定程度上改善这种情况[12]。此外,图5还表明,在溢流管下端始终存在径向向内的二次流。这种流动被称为短路流,会携带一部分颗粒直接逃逸,从而导致分离效率的降低[15]。由于小颗粒的斯托克斯数较小,易随着流体运动,所以短路流对小颗粒的分离效率影响更大[12]。
综上所述,除四入口设计比单入口提高了流场的对称性之外,4个入口之间不同入口位置对于整体流场结构并无明显影响,仅对切向速度的大小产生影响。具体来说,当入口位置在径向外侧时,切向速度与单入口时基本一致;当入口位置在径向内侧时,切向速度会降低;而入口位置的上下变动对切向速度无明显影响。
2.2 入口位置对分离性能的影响
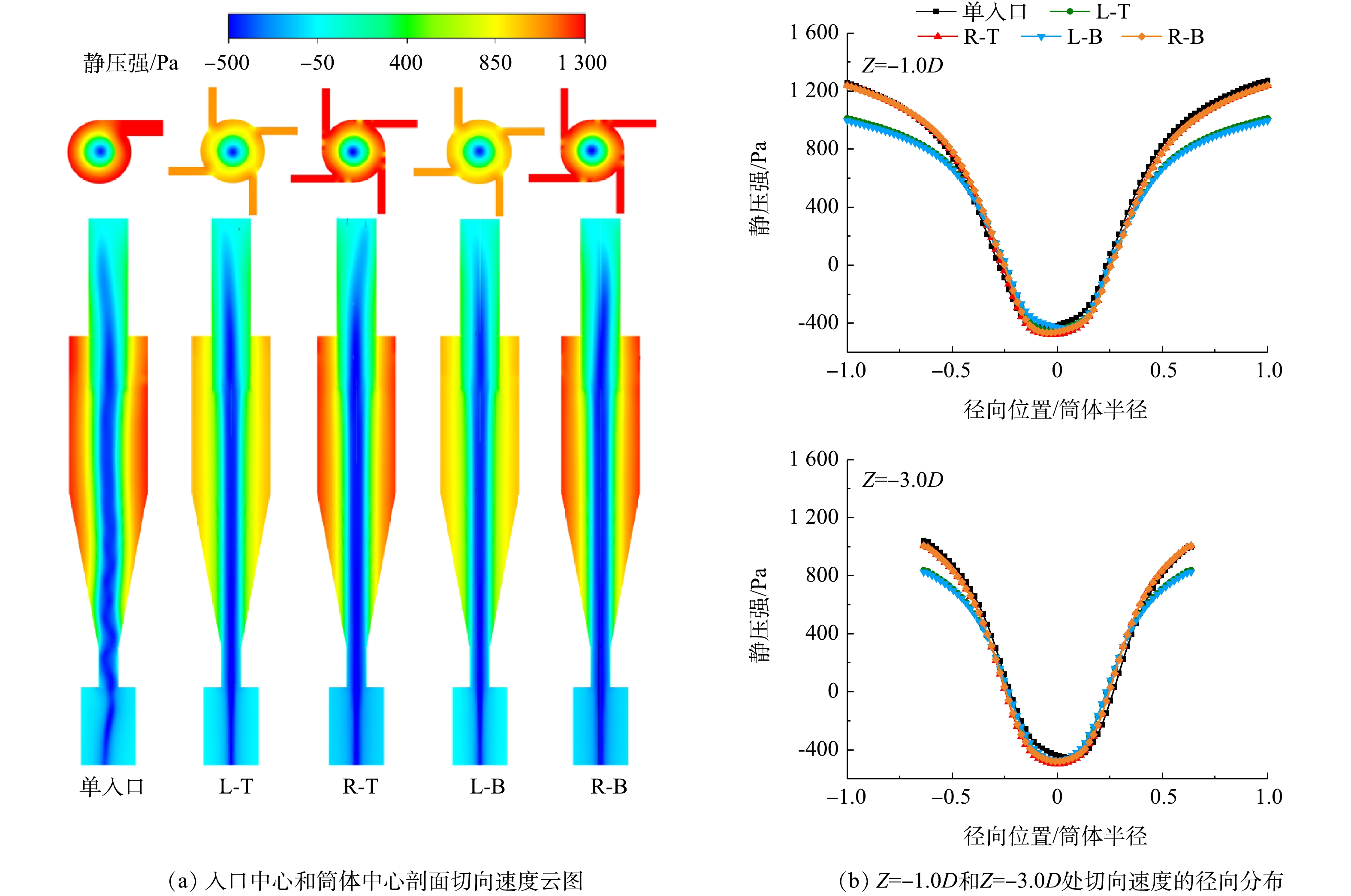
旋风分离器内的静压由器壁向中心逐渐减小,中心存在负压区域(见图6)。与单入口的静压相比,R-T和R-B型的静压基本一致,而L-T和L-B型的静压则整体偏小。由于本研究给定了压力出口边界条件,出口处的静压始终为0,故静压偏小意味着静压降也较小。而在旋风分离器内的总压一定的情况下,静压降越小,静压转换成的动压也越少,相应的切向速度也较小。因此,静压变化的规律与切向速度的变化规律是一致的。
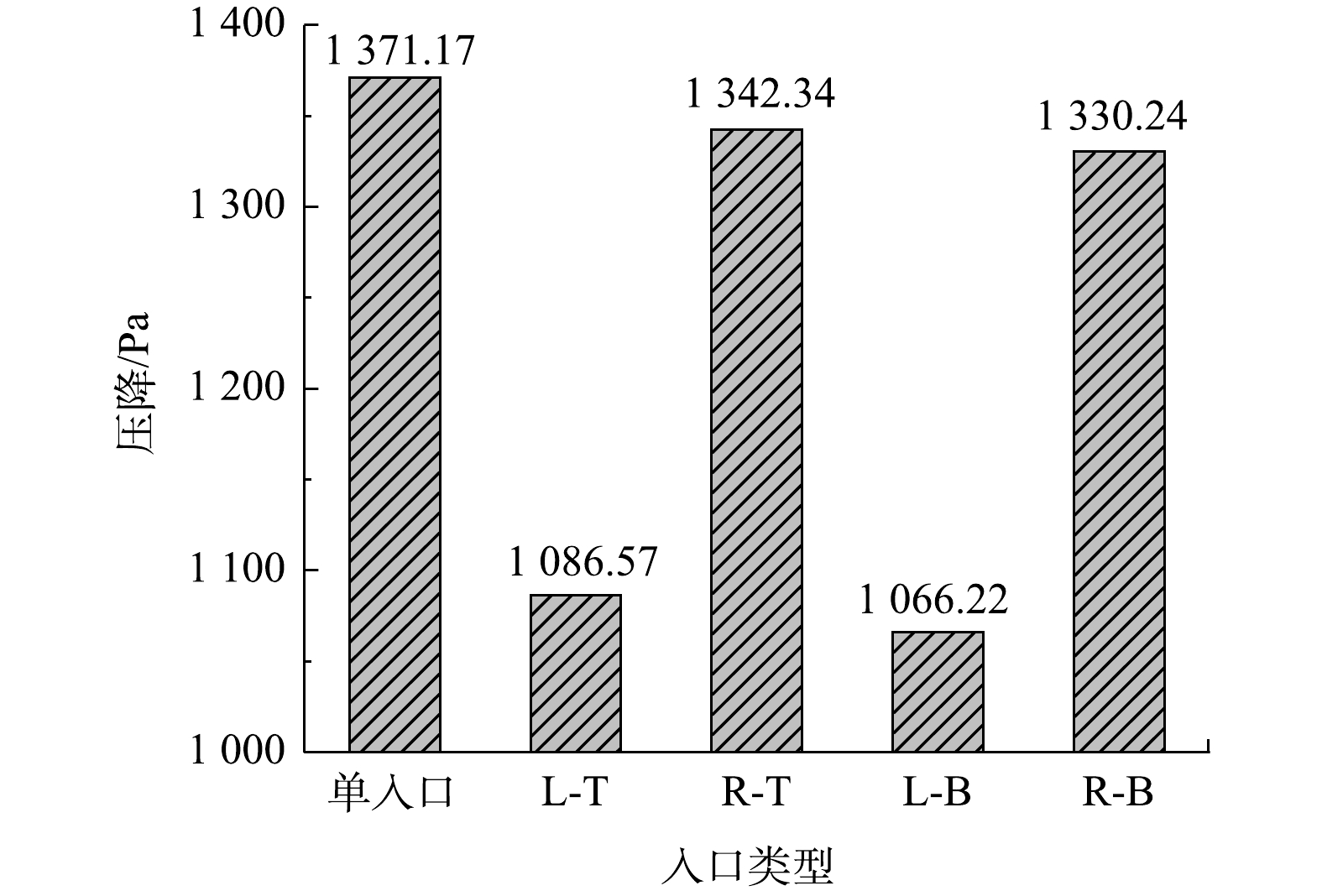
进出口的平均总压之差即旋风分离器的压降[1],其数值代表分离器内部气流的机械能损失。考虑到出口直接连通外界环境,气体的动压被直接耗散而无法产生静压恢复,故本研究采用进出口的平均静压差作为压降,代表旋风分离器的总能量损失。本研究中的5种旋风分离器的压降如图7所示。其中,单入口的压降最高,R-T和R-B型的压降分别降低了2%和3%左右,而L-T和L-B型的压降降幅较大,分别为21%和22%左右。后两者的静压降相较于单入口的静压降偏低,表明总的能量损失减小。其原因与切向速度密切相关:1)切向速度较低,意味着需要转换成压降的静压较少,最终耗散的动压能也越小;2)切向速度较低,气流与筒壁间的摩擦损失就越小。
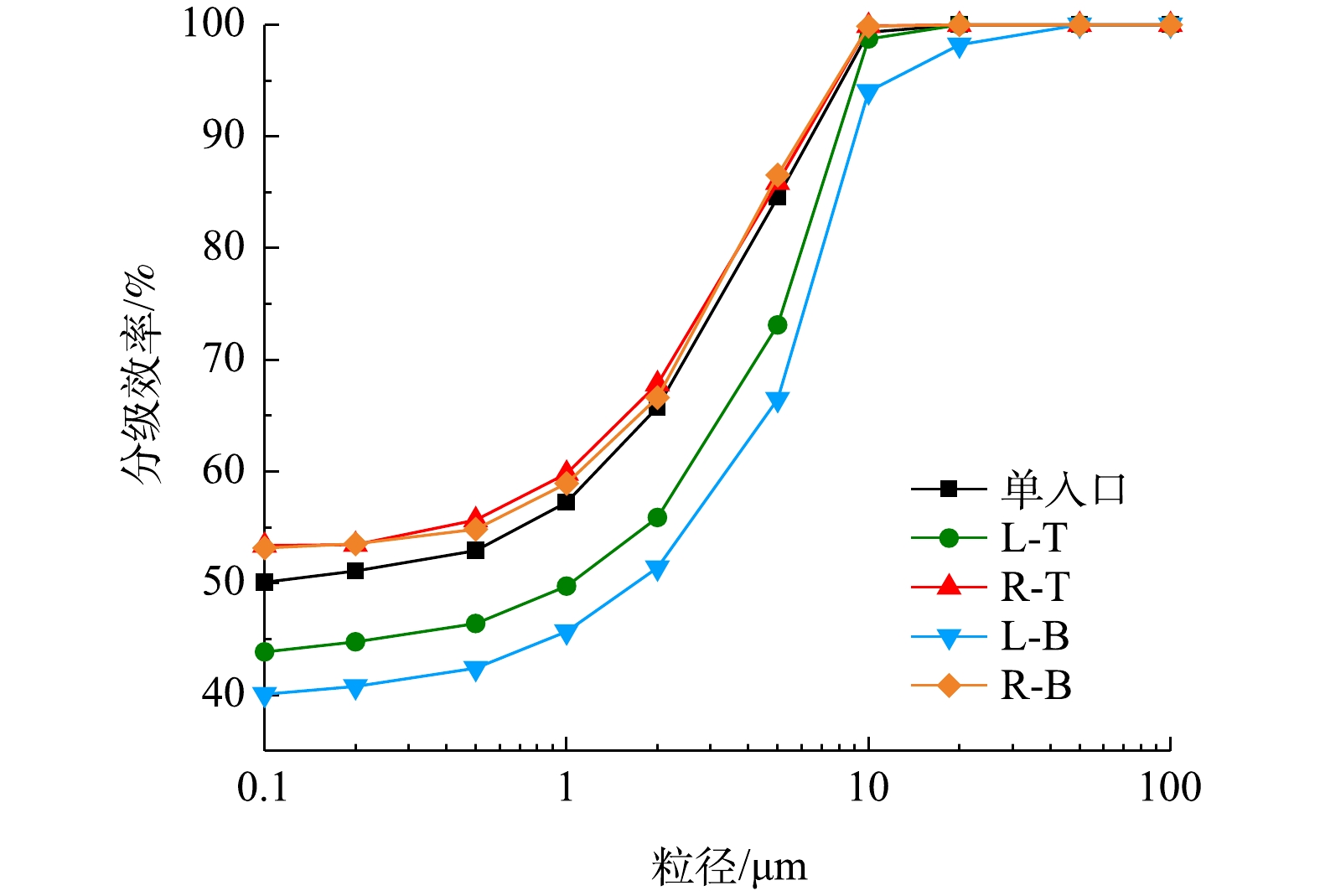
不同粒径颗粒的分离效率所连成的曲线称为分级效率,可用来表示旋风分离器的分离性能。旋风分离器的分离性能采用分级效率来表示(见图8)。当粒径小于10 μm时,与单入口的分级效率相比,R-T和R-B型的分级效率均整体升高了2%左右,而L-T型的分级效率则降低了6%左右,L-B型的分级效率更是降低了10%左右。主要原因仍然在于切向速度的大小决定了离心力的大小,后两者的切向速度较低,故颗粒的离心力较小,更难以被分离。当粒径大于10 μm时,颗粒的分离效率可达到或接近100%。由此可见,不同入口位置对于分级效率的影响主要体现对小粒径颗粒的分离效率影响。
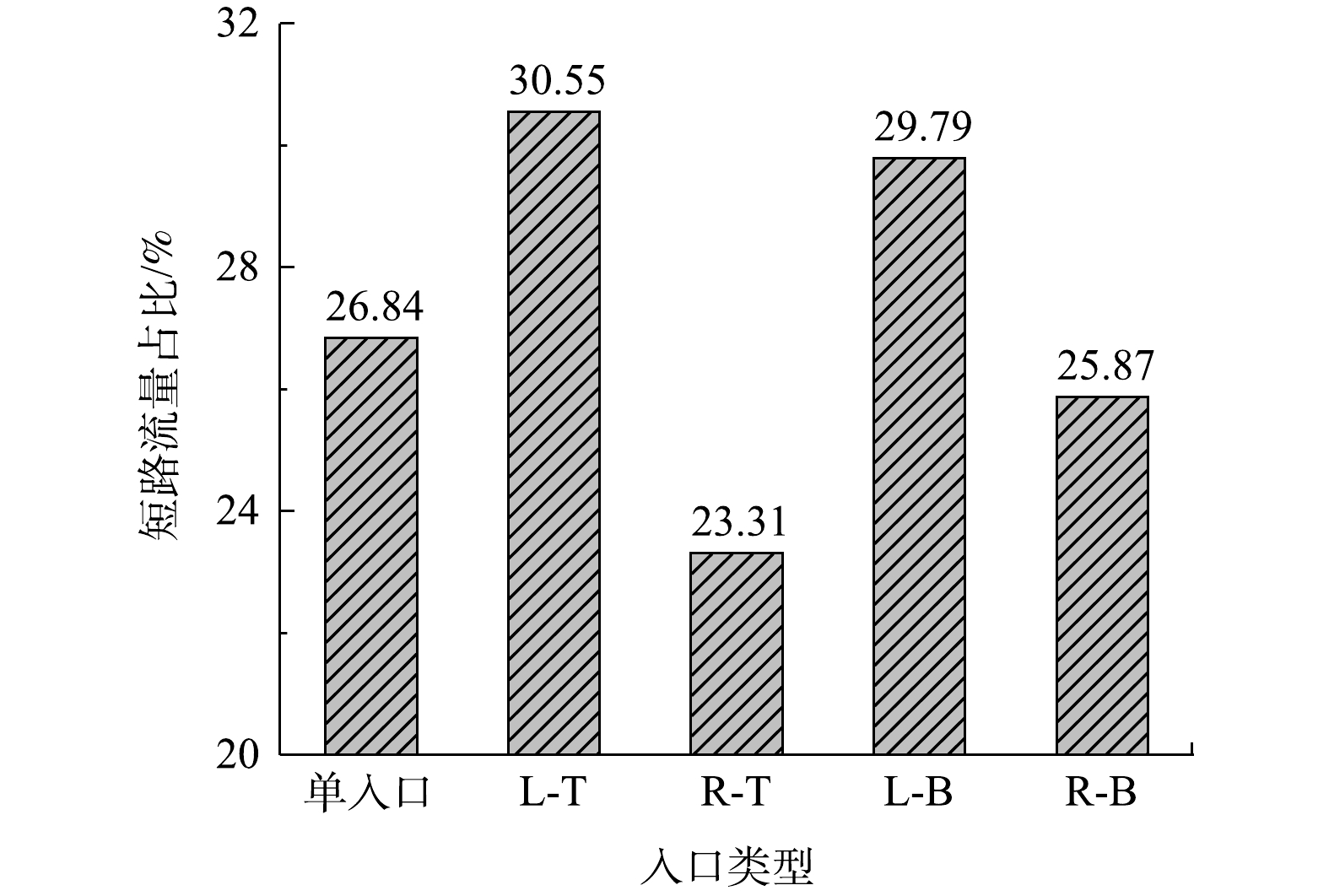
由于短路流对小颗粒的分离效率有重要影响,为进一步解释分级效率变化原因,统计了短路流量占总流量的比值。短路流量的计算参照付烜等[16]提出的方法,即按照图5(a)所示的短路流区域范围在溢流管下端的延伸面上切出一个截面(本研究中为Z=−0.7D至Z=−0.8D的一个环形截面),并计算通过该截面的流量。由图9可知,单入口的短路流量占比为26.84%,与之相比R-T和R-B型的短路流量占比相对较低,这也解释了其分级效率整体升高的原因;另外,L-T和L-B型的短路流量占比相对较高,会有更多小颗粒被短路流携带而逃逸,这也是导致分级效率降低的原因之一。
3. 结论
1)对多入口旋风分离器而言,入口位置的不同不会改变旋风分离器的整体流场结构,但会影响切向速度的大小。当入口在径向外侧,即保持入口切向进入时,切向速度大小与单入口时基本一致;当入口在径向内侧时,切向速度则会减小;当入口的径向位置相同时,其上下的位置对流场的影响并不显著。
2)入口位置的不同会影响旋风分离器的短路流占比。当入口在径向外侧时,短路流量占比减少;反之,在内侧则会增加。这是影响小颗粒分离效率的一个重要因素。
3)入口位置的不同会影响旋风分离器的压降和分离效率。当入口在径向外侧时,压降较低,分离效率较高;当入口在径向内侧时,压降虽然更低,但同时分离效率也有所下降。当入口的径向位置相同时,入口在轴向上方比在下方时压降略有增大,同时分级效率也略有升高。总体而言,径向外侧、轴向上方的入口设计是最优的。
-
表 1 标准地基本情况
Table 1. Basic overview of the plots
样地 Plot Z10 Z20 Z30 Z40 Z50 Z60 林龄/a Tree age 10 20 30 40 50 60 密度/(plants·hm−2) Density 625 625 675 675 650 650 树高/m Height 3.28 7.80 9.25 11.27 11.01 13.04 胸径/cm DBH 7.50 13.31 16.69 20.92 19.61 20.59 东西平均冠幅/m Wew 2.59 3.6 4.01 4.3 4.59 4.62 南北平均冠幅/m Wsn 2.42 4.21 4.10 4.69 4.72 4.92 枯落物厚度/cm Litter depth 8.11 10.04 12.67 16.89 16.66 13.11 郁闭度 Canopy density 0.5 0.7 0.8 0.7 0.8 0.6 有机碳/(g·kg−1) SOC 5.96 5.96 8.85 8.31 10.73 11.16 全氮/(g·kg−1) TN 0.26 0.24 0.16 0.21 0.24 0.27 碱解氮/(mg·kg−1) HN 7.25 4.77 2.54 4.89 7.30 6.97 全磷/(g·kg−1) TP 0.92 1.0 1.11 1.12 1.04 1.01 有效磷/(mg·kg−1) AP 10.52 4.59 7.94 6.33 4.74 6.41 注:Z10、Z20、Z30、Z40、Z50、Z60分别为10年生、20年生、30年生、40年生、50年生和60年生樟子松人工林. Note: Z10, Z20, Z30, Z40, Z50, Z60 were respectively 10, 20, 30, 40, 50, and 60 a P. sylvestris var. mongolica plantations. 表 2 不同林龄土壤微生物量碳、土壤微生物量氮、土壤呼吸强度特征
Table 2. Characteristics of MBC,MBN and soil respiration intensity with different stand ages
土壤微生物指标Soil microbial indexes 土层深度/cmSoil depth 林龄/aStand ages CK 10 20 30 40 50 60 土壤微生物量碳/(mg·kg−1) 0—20 60.74 Da 133.83 Ca 158.17 Ba 206.76 ABa 246.19 Aa 242.91 Aa 206.48 ABa 20—40 41.09 Db 103.09 Cb 142.30 Ba 186.63 ABb 213.49 Aab 207.70 Ab 191.31 Aab 40—60 32.43 Db 98.61 Cbc 117.25 Cb 171.33 Bb 206.68 Ab 201.60 Ab 174.25 Bb 60—80 32.51 Db 95.86 Cbc 100.65 Cb 163.76 Bb 194.37 Ab 186.05 Ac 175.83 ABb 80—100 32.60 Db 82.41 CDc 88.54 Cc 141.42 Bc 185.63 Ab 172.87 Ac 159.72 ABc 0—100 39.87 Db 102.76 Cb 121.38 Cb 173.98 Bb 209.27 Ab 202.23 ABb 181.52 ABb 土壤微生物量氮/(mg·kg−1) 0—20 4.72 Ca 4.85 Ca 6.72 ABa 11.39 Aa 10.08 Aa 10.23 Aa 5.43 Ba 20—40 4.40 Ca 4.28 Ca 5.94 BCb 9.47 Ab 7.56 Bb 9.04 Aab 4.78 Cb 40—60 2.73 Cb 3.24 Cb 4.84 Bbc 7.39 Abc 6.88 ABb 7.63 Ac 3.27 Cbc 60—80 2.27 Cb 3.78 BCb 4.41 Bc 5.29 Bc 6.48 ABb 8.22 Ab 2.71 Cc 80—100 2.68 Bb 2.71 Bc 3.27 Bc 5.26 Ac 4.85 Ac 5.95 Ac 2.72 Bc 0—100 3.36 Bab 3.77 Bb 5.04 Bb 7.76 Abc 7.17 Ab 8.21 Ab 3.78 Bbc 土壤呼吸强度/(mg·kg−1·24h−1) 0—20 2.28 Ba 1.70 Ca 2.30 Ba 3.22 Aa 1.55 Ca 3.03 Aa 1.62 Ca 20—40 2.19 ABa 1.44 Bb 2.19 ABa 2.60 Ab 1.21 Cb 2.63 Ab 1.47 Bab 40—60 1.92 ABab 1.46 Bb 1.94 ABb 2.38 Abc 1.19 Cb 2.94 Aa 1.22 Cb 60—80 1.92 Bab 1.70 Ba 2.23 Aa 2.14 ABc 1.21 Cb 2.46 Ab 1.23 Cb 80—100 1.69 Bb 1.22 Cc 1.72 Bc 2.61 Ab 1.45 BCab 2.44 Ab 1.24 Cb 0—100 2.00 Ba 1.50 Cab 2.07 Bab 2.59 Ab 1.33 Cb 2.70 Aa 1.36 Cb 注:不同大写字母表示同一土层不同林龄间差异显著,不同小写字母表示同一林龄不同土层间差异显著(下同)。 Note: Different capital letters indicate significant differences between different stand ages in the same soil layer, and different lowercase letters indicate significant differences between different soil layers of the same stand age (the same below). 表 3 不同林龄土壤微生物量碳氮比、土壤微生物碳熵、土壤微生物氮熵特征
Table 3. Characteristics of soil MBC/MBN, microbial C quotien and microbial N quotient with different stand ages
土壤微生物指标Soil microbial indexes 土层深度/cmSoil depth 林龄/aStand ages CK 10 20 30 40 50 60 土壤微生物量碳氮比MBC/MBN 0—20 12.86 Da 27.60 ABa 23.58 Bb 18.17 Cc 24.42 Bc 23.82 Bb 38.03 Ab 20—40 9.33 Db 24.08 Bb 23.97 Bab 19.72 Cc 28.25 Bb 22.96 Bb 40.00 Ab 40—60 11.87 Db 30.42 Ba 24.22 Ca 23.18 Cbc 30.03 Bb 26.44 BCa 53.24Aab 60—80 14.29 Da 25.35 BCb 22.82 Cb 30.93 Ba 30.00 Bb 22.65 Cb 64.90 Aa 80—100 12.17 Da 30.42 BCa 27.04 Ca 26.87 Cb 38.31 Ba 29.04 BCa 58.81 Aa 0—100 12.11 Ca 27.58 Ba 24.33 Ba 23.77 Bbc 30.20 Bb 24.98 Bb 50.99 Aab 土壤微生物碳熵/%Soil microbial C quotien 0—20 0.57 Ca 1.97 Ba 2.48 Aa 2.50 Aa 2.84 Aa 2.35 Aa 1.78 Ba 20—40 0.43 Ca 1.98 ABa 2.55 Aa 2.17 Aa 2.52 Aa 1.77 Bab 1.71 Ba 40—60 0.35 Cb 1.93 ABa 1.96 Aab 1.73 Bb 2.58 Aa 1.93 ABa 1.73 Ba 60—80 0.36 Cb 1.52 BCb 1.72 Bb 1.92 ABa 2.33 Ab 1.69 Bb 1.61 Bb 80—100 0.38 Cb 1.48 Bb 1.59 Bb 1.71 ABb 2.44 Aab 1.68 Bb 1.44 Bb 0—100 0.42 Da 1.78 BCab 2.06 Bab 2.01 BCa 2.54 Aa 1.88 BCa 1.66 Cab 土壤微生物氮熵/%Soil microbial N quotien 0—20 1.39 Cc 1.41 Cb 2.26 Ba 5.44 Aa 3.85 ABa 3.12 ABb 1.51 Cb 20—40 1.83 BCab 1.71 Ca 2.35 Ba 5.92 Aa 4.01 ABa 4.63 Aa 1.85 BCa 40—60 1.61 Cb 1.34 Db 2.31 BCa 5.65 Aa 3.76 Ba 3.92 Bb 1.60 Cb 60—80 1.62 BCb 1.86 BCa 2.13 Bab 3.89 Ab 3.52 ABa 4.50 Aa 1.26 Cc 80—100 2.23 Ba 1.38 Cb 1.80 BCb 4.60 Aab 3.06 ABb 3.38 ABb 1.34 Cc 0—100 1.74 Cb 1.54 Cb 2.17 Cab 5.10 Aa 3.64 Ba 3.91 Bb 1.51 Cb 表 4 土壤微生物指标与环境因素的相关性(n=360)
Table 4. Correlation between soil microbial indexes and environmental factors (n=360)
指标Indexes 株高Heigh 胸径Diameter 冠幅Crown 有机碳SOC 全氮TN 碱解氮HN 全磷TP 有效磷AP 土壤微生物量碳MBC 0.748** 0.816** 0.743** 0.685** 0.215 0.253 0.604** −0.303 土壤微生物量氮MBN 0.284 0.390* 0.354* 0.314 0.129 0.134 0.543** −0.258 土壤呼吸强度Soil respiratory intensity 0.012 0.114 0.124 −0.100 0.178 0.108 0.478** −0.218 土壤微生物碳熵Soil microbial C quotien 0.103 0.201 0.141 −0.273 0.051 0.021 0.459** −0.066 土壤微生物量碳氮比MBC/MBN 0.427** 0.323 0.309 0.347* −0.009 0.050 −0.132 0.143 土壤微生物氮熵Soil microbial N quotien 0.260 0.376* 0.319 0.173 −0.508** −0.429** 0.686** −0.144 注:*表示显著相关(P ˂ 0.05),**表示极显著相关(P ˂ 0.01). Note:*indicates significant correlation (P ˂0.05), **indicates extremely significant correlation (P ˂0.01). -
[1] 魏晓婷, 雷泽勇, 韩辉. 章古台沙地不同林龄樟子松人工林土壤水分研究 [J]. 干旱区资源与环境, 2016, 30(06): 115-121. WEI X T, LEI Z Y, HAN H. Soil moistures characteristics of different- aged Pinus sylvestris var. mongolica artificial forests in Zhanggutai sandy area [J]. Journal of Arid Land Resources and Environment, 2016, 30(06): 115-121(in Chinese).
[2] 张日升. 章古台沙地针叶人工林对土壤养分的影响 [J]. 防护林科技, 2016(12): 10-12. ZHANG R S. Effects of coniferous plantations in Zhanggutai sandland on soil nutrients [J]. Protection Forest Science and Technology, 2016(12): 10-12(in Chinese).
[3] 段民福, 廖超英, 孙长忠, 等. 毛乌素沙地樟子松人工林土壤物理性质的时空变异规律 [J]. 西北农业学报, 2012, 21(3): 188-192. doi: 10.3969/j.issn.1004-1389.2012.03.036 DUAN M F, LIAO C Y, SUN C Z, et al. Spatio-temporal variabilities of soil physical properties of Pinus sylvestris var. mongolica artificial forest in Mu Us desert [J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2012, 21(3): 188-192(in Chinese). doi: 10.3969/j.issn.1004-1389.2012.03.036
[4] 牛沙沙, 周永斌, 刘丽颖, 等. 不同林龄樟子松人工林土壤理化性质 [J]. 东北林业大学学报, 2015, 43(2): 47-50,62. doi: 10.3969/j.issn.1000-5382.2015.02.011 NIU S S, ZHOU Y B, LIU L Y, et al. Soil Properties in Pinus sylvestris var. mongolica Plantation of Different Ages [J]. Journal of Northeast Forestry University, 2015, 43(2): 47-50,62(in Chinese). doi: 10.3969/j.issn.1000-5382.2015.02.011
[5] 赵燕娜, 廖超英, 李晓明, 等. 毛乌素沙地不同林龄樟子松人工林土壤酶活性变化特征 [J]. 西北林学院学报, 2014, 29(2): 1-5,19. doi: 10.3969/j.issn.1001-7461.2014.02.01 ZHAO Y N, LIAO C Y, LI X M, et al. Evolution of soil enzyme activities of Pinus sytvestris var. mongolica plantation at different ages in muus sandland [J]. Journal of Northwest Forestry University, 2014, 29(2): 1-5,19(in Chinese). doi: 10.3969/j.issn.1001-7461.2014.02.01
[6] 于德良, 雷泽勇, 张岩松, 等. 沙地樟子松人工林土壤酶活性及其影响因子 [J]. 干旱区研究, 2019, 36(03): 621-629. YU D L, LEI Z Y, ZHANG Y S, et al. Soil enzyme activity and its affecting factors under Pinus sylvestris var. mongolica plantation in sandy land [J]. Arid Zone Research, 2019, 36(03): 621-629(in Chinese).
[7] LEGAY N, CLÉMENT J C, GRASSEIN F, et al. Plant growth drives soil nitrogen cycling and N-related microbial activity through changing root traits [J]. Fungal Ecology, 2020, 44: 100910. doi: 10.1016/j.funeco.2019.100910 [8] KHAN A G. Role of soil microbes in the rhizospheres of plants growing on trace metal contaminated soils in phytoremediation [J]. Journal of Trace Elements in Medicine and Biology, 2005, 18(4): 355-364. doi: 10.1016/j.jtemb.2005.02.006 [9] 刘爽, 王传宽. 五种温带森林土壤微生物生物量碳氮的时空格局 [J]. 生态学报, 2010, 30(12): 3135-3143. LIU S, WANG C K. Spatio-temporal patterns of soil microbial biomass carbon and nitrogen in five temperate forest ecosystems [J]. Acta Ecologica Sinica, 2010, 30(12): 3135-3143(in Chinese).
[10] 王宝荣, 杨佳佳, 安韶山, 等. 黄土丘陵区植被与地形特征对土壤和土壤微生物生物量生态化学计量特征的影响 [J]. 应用生态学报, 2018, 29(01): 247-259. WANG B R, YANG J J, AN S S, et al. Effects of vegetation and topography features on ecological stoichiometry of soil and soil microbial biomass in the hilly-gully region of the Loess Plateau, China [J]. Chinese Journal of Applied Ecology, 2018, 29(01): 247-259(in Chinese).
[11] 徐阳春, 沈其荣, 冉炜. 长期免耕与施用有机肥对土壤微生物生物量碳、氮、磷的影响 [J]. 土壤学报, 2002, 39(1): 89-96. XU Y C, SHEN Q R, RAN W. Effects of zero-tillage and application of manure on soil microbial biomass C, N, and P after sixteen years of cropping [J]. Acta Pedologica Sinica, 2002, 39(1): 89-96(in Chinese).
[12] 李陆平, 廖超英, 李晓明, 等. 毛乌素沙地樟子松人工林对土壤微生物及酶活性的影响 [J]. 西北林学院学报, 2012, 27(3): 12-16. doi: 10.3969/j.issn.1001-7461.2012.03.03 LI L P, LIAO C Y, LI X M, et al. Effects on soil microorganism and enzyme activities of artificial Pinus sylvestris var. mongolica in mu us sand land [J]. Journal of Northwest Forestry University, 2012, 27(3): 12-16(in Chinese). doi: 10.3969/j.issn.1001-7461.2012.03.03
[13] 仇少君, 彭佩钦, 刘强, 等. 土壤微生物生物量氮及其在氮素循环中作用 [J]. 生态学杂志, 2006, 25(4): 443-448. doi: 10.3321/j.issn:1000-4890.2006.04.018 QIU S J, PENG P Q, LIU Q, et al. Soil microbial biomass nitrogen and its role in nitrogen cycling [J]. Chinese Journal of Ecology, 2006, 25(4): 443-448(in Chinese). doi: 10.3321/j.issn:1000-4890.2006.04.018
[14] 严俊霞, 秦作栋, 李洪建, 等. 黄土高原地区柠条人工林土壤呼吸 [J]. 林业科学, 2010, 46(3): 1-8. doi: 10.11707/j.1001-7488.20100301 YAN J X, QIN Z D, LI H J, et al. Soil respiration characters in a Caragana plantation in loess plateau region [J]. Scientia Silvae Sinicae, 2010, 46(3): 1-8(in Chinese). doi: 10.11707/j.1001-7488.20100301
[15] 刘恩科, 赵秉强, 李秀英, 等. 长期施肥对土壤微生物量及土壤酶活性的影响 [J]. 植物生态学报, 2008, 32(1): 176-182. doi: 10.3773/j.issn.1005-264x.2008.01.020 LIU E K, ZHAO B Q, LI X Y, et al. Biological properties and enzymatic activity of arable soils affected by long-term different fertilization systems [J]. Journal of Plant Ecology, 2008, 32(1): 176-182(in Chinese). doi: 10.3773/j.issn.1005-264x.2008.01.020
[16] BURTON J, CHEN C R, XU Z H, et al. Soil microbial biomass, activity and community composition in adjacent native and plantation forests of subtropical Australia [J]. Journal of Soils and Sediments, 2010, 10(7): 1267-1277. doi: 10.1007/s11368-010-0238-y [17] ROVIRA P, JORBA M, ROMANYÀ J. Active and passive organic matter fractions in Mediterranean forest soils [J]. Biology and Fertility of Soils, 2010, 46(4): 355-369. doi: 10.1007/s00374-009-0437-0 [18] MORENO J L, TORRES I F, GARCÍA C, et al. Land use shapes the resistance of the soil microbial community and the C cycling response to drought in a semi-arid area [J]. Science of the Total Environment, 2019, 648: 1018-1030. doi: 10.1016/j.scitotenv.2018.08.214 [19] BARGALI K, MANRAL V, PADALIA K, et al. Effect of vegetation type and season on microbial biomass carbon in Central Himalayan forest soils, India [J]. CATENA, 2018, 171: 125-135. doi: 10.1016/j.catena.2018.07.001 [20] 林尤伟, 金光泽. 冻融期去根处理对小兴安岭6种林型土壤微生物量的影响 [J]. 生态学报, 2016, 36(19): 6159-6169. LIN Y W, JIN G Z. Effects of root resectioning on soil microbial biomass in six forest types in the Xiaoxing'an Mountains during freezing-thawing cycles [J]. Acta Ecologica Sinica, 2016, 36(19): 6159-6169(in Chinese).
[21] 丁令智, 满秀玲, 肖瑞晗, 等. 寒温带森林根际土壤微生物量碳氮含量生长季内动态变化 [J]. 林业科学, 2019, 55(7): 178-186. doi: 10.11707/j.1001-7488.20190720 DING L Z, MAN X L, XIAO R H, et al. Dynamics of soil microbial biomass carbon and nitrogen in the soil of rhizosphere during growing season in the cold temperate forests [J]. Scientia Silvae Sinicae, 2019, 55(7): 178-186(in Chinese). doi: 10.11707/j.1001-7488.20190720
[22] 李陆平, 廖超英, 李晓明, 等. 毛乌素沙地樟子松人工林土壤微生物数量变化 [J]. 干旱地区农业研究, 2013, 31(1): 157-160. doi: 10.3969/j.issn.1000-7601.2013.01.029 LI L P, LIAO C Y, LI X M, et al. Changes of soil microorganism of artificial Pinus sylvestris var. mongolica in Mu Us sandland [J]. Agricultural Research in the Arid Areas, 2013, 31(1): 157-160(in Chinese). doi: 10.3969/j.issn.1000-7601.2013.01.029
[23] 林雅超, 高广磊, 丁国栋, 等. 沙地樟子松人工林土壤理化性质与微生物生物量的动态变化 [J]. 生态学杂志, 2020, 39(5): 1445-1454. LIN Y C, GAO G L, DING G D, et al. Dynamics of soil physicochemical properties and microbial biomass in a Pinus sylvestris var. mongolica plantation [J]. Chinese Journal of Ecology, 2020, 39(5): 1445-1454(in Chinese).
[24] 国家林业局. 中华人民共和国林业行业标准: 主要树种龄级与龄组划分 LY/T 2908—2017[S]. 北京: 中国标准出版社, 2017: 4. State Forestry Administration of the People's Republic of China. Forestry Standard of the People's Republic of China: Regulations for age-class and age-group division of main tree-species. LY/T 2908—2017[S]. Beijing: Standards Press of China, 2017: 4(in Chinese).
[25] 胡婵娟, 刘国华, 吴雅琼. 土壤微生物生物量及多样性测定方法评述[J]. 生态环境学报, 2011, 20(Z1): 1161-1167. HU C J, LIU G H, WU Y Q. A review of soil microbial biomass and diversity measurements[J]. Ecology and Environmental Sciences, 2011, 20(Z1): 1161-1167(in Chinese).
[26] WU J, JOERGENSEN R G, POMMERENING B, et al. Measurement of soil microbial biomass C by fumigation-extraction—an automated procedure [J]. Soil Biology and Biochemistry, 1990, 22(8): 1167-1169. doi: 10.1016/0038-0717(90)90046-3 [27] VANCE E D, BROOKES P C, JENKINSON D S. An extraction method for measuring soil microbial biomass C [J]. Soil Biology and Biochemistry, 1987, 19(6): 703-707. doi: 10.1016/0038-0717(87)90052-6 [28] 鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000: 50-51. BAO S D. Soil and Agricultural Chemistry Analysis[M]. Beijing: Chinese Agriculture Press, 2000: 50-51(in Chinese).
[29] YIM M H, JOO S J, SHUTOU K, et al. Spatial variability of soil respiration in a larch plantation: Estimation of the number of sampling points required [J]. Forest Ecology and Management, 2003, 175(1-3): 585-588. [30] 杨涛, 徐慧, 李慧, 等. 樟子松人工林土壤养分、微生物及酶活性的研究 [J]. 水土保持学报, 2005, 19(3): 50-53. doi: 10.3321/j.issn:1009-2242.2005.03.013 YANG T, XU H, LI H, et al. Soil nutrient, microorganism and enzyme activity in Pinus sylvestris Plantations [J]. Journal of Soil Water Conservation, 2005, 19(3): 50-53(in Chinese). doi: 10.3321/j.issn:1009-2242.2005.03.013
[31] 吴祥云, 姜凤岐, 李晓丹, 等. 樟子松人工固沙林衰退的规律和原因 [J]. 应用生态学报, 2004, 15(12): 2225-2228. doi: 10.3321/j.issn:1001-9332.2004.12.006 WU X Y, JIANG F Q, LI X D, et al. Decline regularity and causes of Pinus sylvestris var. mongolica plantation on sandy land [J]. Chinese Journal of Applied Ecology, 2004, 15(12): 2225-2228(in Chinese). doi: 10.3321/j.issn:1001-9332.2004.12.006
[32] 卜涛, 张水奎, 宋新章, 等. 几个环境因子对凋落物分解的影响 [J]. 浙江农林大学学报, 2013, 30(5): 740-747. doi: 10.11833/j.issn.2095-0756.2013.05.017 BU T, ZHANG S K, SONG X Z, et al. Effects of several environmental factors on litter decomposition [J]. Journal of Zhejiang A & F University, 2013, 30(5): 740-747(in Chinese). doi: 10.11833/j.issn.2095-0756.2013.05.017
[33] 郭绪虎, 肖德荣, 田昆, 等. 滇西北高原纳帕海湿地湖滨带优势植物生物量及其凋落物分解 [J]. 生态学报, 2013, 33(5): 1425-1432. doi: 10.5846/stxb201208271209 GUO X H, XIAO D R, TIAN K, et al. Biomass production and litter decomposition of lakeshore plants in Napahai wetland, Northwestern Yunnan Plateau, China [J]. Acta Ecologica Sinica, 2013, 33(5): 1425-1432(in Chinese). doi: 10.5846/stxb201208271209
[34] 关阅章, 刘安田, 仲启铖, 等. 滨海围垦湿地芦苇凋落物分解对模拟增温的响应 [J]. 华东师范大学学报(自然科学版), 2013(5): 27-34. GUAN Y Z, LIU A T, ZHONG Q C, et al. Responses of decomposition of Phragmites australis litter to simulated temperature enhancement in the reclamed coastal wetland [J]. Journal of East China Normal University (Natural Science), 2013(5): 27-34(in Chinese).
[35] 牛小云, 孙晓梅, 陈东升, 等. 辽东山区不同林龄日本落叶松人工林土壤微生物、养分及酶活性 [J]. 应用生态学报, 2015, 26(9): 2663-2672. NIU X Y, SUN X M, CHEN D S, et al. Soil microorganisms, nutrients and enzyme activity of Larix kaempferi plantation under different ages in mountainous region of eastern Liaoning Province, China [J]. Chinese Journal of Applied Ecology, 2015, 26(9): 2663-2672(in Chinese).
[36] 杨曾奖, 曾杰, 徐大平, 等. 森林枯枝落叶分解及其影响因素 [J]. 生态环境, 2007, 16(2): 649-654. YANG Z J, ZENG J, XU D P, et al. The processes and dominant factors of forest litter decomposition: A review [J]. Ecology and Environment, 2007, 16(2): 649-654(in Chinese).
[37] 杨传波, 黄敬林, 李宝年, 等. 樟子松树栖真菌群落物种多样性及其与病害的关系 [J]. 东北林业大学学报, 2004, 32(5): 94-96. doi: 10.3969/j.issn.1000-5382.2004.05.034 YANG C B, HUANG J L, LI B N, et al. The relationship between the species diversity of dendrocola mycoflora on Pinus sylvestris var. mongolica and disease [J]. Journal of Northeast Forestry University, 2004, 32(5): 94-96(in Chinese). doi: 10.3969/j.issn.1000-5382.2004.05.034
[38] 杨成德, 龙瑞军, 陈秀蓉, 等. 东祁连山高寒草甸土壤微生物量及其与土壤物理因子相关性特征 [J]. 草业学报, 2007, 16(4): 62-68. doi: 10.3321/j.issn:1004-5759.2007.04.010 YANG C D, LONG R J, CHEN X R, et al. Study on microbial biomass and its correlation with the soil physical properties under the alpine grassland of the east of Qilian Mountains [J]. Acta Prataculturae Sinica, 2007, 16(4): 62-68(in Chinese). doi: 10.3321/j.issn:1004-5759.2007.04.010
[39] LIAO J D, BOUTTON T W. Soil microbial biomass response to woody plant invasion of grassland [J]. Soil Biology and Biochemistry, 2008, 40(5): 1207-1216. doi: 10.1016/j.soilbio.2007.12.018 [40] 陈婷, 郗敏, 孔范龙, 等. 枯落物分解及其影响因素 [J]. 生态学杂志, 2016, 35(7): 1927-1935. CHEN T, XI M, KONG F L, et al. A review on litter decomposition and influence factors [J]. Chinese Journal of Ecology, 2016, 35(7): 1927-1935(in Chinese).
[41] 任天志. 持续农业中的土壤生物指标研究 [J]. 中国农业科学, 2000, 33(1): 68-75. REN T Z. Soil bioindicators in sustainable agriculture [J]. Scientia Agricultura Sinica, 2000, 33(1): 68-75(in Chinese).
[42] DEVI N B, YADAVA P S. Seasonal dynamics in soil microbial biomass C, N and P in a mixed-oak forest ecosystem of Manipur, North-east India [J]. Applied Soil Ecology, 2006, 31(3): 220-227. doi: 10.1016/j.apsoil.2005.05.005 -




 下载:
下载: