-
从2004年“微塑料”被首次定义(小于5 mm的塑料颗粒)以来[1],有关微塑料的话题便逐步受到各国政府和学者的关注。微塑料污染普遍存在于淡水和海洋生态系统中,近年来研究人员在全球各个湖泊、河流、大洋、大洲、甚至极地地区都检测到了微塑料的存在[2-7]。据估计,每年约有800多万吨塑料残骸被排放到全球海洋环境中,这些塑料垃圾包括大块的塑料残骸以及直接排入环境的微塑料颗粒(比如化妆品中的塑料微珠)[8-9]。大塑料残骸作为微塑料的前驱体,在自然环境中经过长期的物理化学作用,也将逐渐形成微塑料颗粒。
微塑料被认为是水体环境污染物的重要组成部分[10],尽管其环境丰度与其它水体介质(如纤维素、溶解性有机质等)相比较小,但其对生物体可能产生的潜在风险却不容小觑。一则,微塑料粒径较小而易被生物摄入并在生物体内累积,对生物造成机械损伤或影响其生长发育,甚至造成死亡[11-14]。二则,微塑料可以吸附环境中的污染物质(特别是疏水性有机污染物)或自身携带添加剂,这些污染物在脱附作用下,会在生物体内累积、迁移和转化,并对生物产生毒性效应[15-18]。因此,研究微塑料与有机污染物的相互作用的强度和机理,对全面评估二者的环境风险,深入探索微塑料致毒机制十分重要。
由于微塑料本身的聚合物类型、粒径、比表面积和老化等情况复杂多样,水体环境中的有机污染物也具有不同的理化性质,这就导致两者之间的吸附作用机理复杂,并可能受到多种环境因素的影响。本文将从微塑料的基本特性、吸附有机污染物的作用机理、环境因素的影响以及吸附行为对有机污染物生物有效性的影响等方面展开详细阐述,并提出有机污染物在微塑料上吸附研究的未来发展方向。
-
塑料是典型的有机合成高分子聚合物,具有较高的疏水性能。由于生产的原材料不同,它们的密度多变(0.9—2.3 g·cm−3),而其中加入的各式添加剂又使之呈现出不同颜色和功能,此外环境的破碎、老化等作用还导致其形状各异[4]。纳米塑料和微塑料颗粒除了具有普通塑料制品的上述特性外,由于它们的粒径更小,比表面积更大,有效吸附位点更多,因而吸附有机污染物的能力更强。例如,Mattsson等[19]计算发现,一个普通的塑料袋(0.2 m2)完全分解成平均直径为40 nm的塑料颗粒后,其比表面积增大13000倍至2600 m2。通常粒径越小的塑料颗粒对有机污染物的吸附能力越强,在Wang等[20]的研究中比较了PE、PS、PVC等3种微塑料的比表面积,比表面积的大小对于其吸附芘的贡献非常大。比表面积的大小是PE>PS>PVC,与之相对应的是对于芘的吸附能力也随着比表面积的增大而增大。但并不是所有情况下微塑料的吸附能力都会随着粒径的减小而增大,Wang等[21]的研究报道了更小的尺寸,特别是纳米尺度时粒子的聚集性能增强,反而降低了粒子的比表面积和吸附能力,例如他们在研究中发现纳米级的PS对菲的吸附量明显低于微米级的,这可能就是由于纳米塑料的团聚,导致了有效吸附位点的减少。
塑料性质会影响其对有机污染物的吸附能力。表1列举了几种常见的影响吸附能力的理化特性。(1)接触角:这是衡量液体在塑料表面润湿性能的重要参数。通常接触角越小,塑料的表面越亲水,对有机污染物的吸附能力越弱;反之,接触角越大,塑料表面越疏水,对有机污染物的吸附能力越强。(2)结晶度:该指标可以提示聚合物中结晶区域所占的比例。通常微塑料的结晶度越高,分子排列越规则,可用于发生吸附反应的自由体积和有效位点就越少,吸附能力越低。而在无定形区,分子链无序缠绕形成大量的孔,该区域是吸附污染物的有效区域[22]。(3)玻璃化转变温度:此数值是指塑料无定形区从玻璃态转变为高弹态所对应的温度。在此温度以上塑料处于高弹态,此时塑料中的孔隙更多,可以对有机污染物进行孔隙截留,能有效吸附有机污染物;在此温度以下塑料的状态为玻璃态,分子受到外界束缚,排列齐整、流动性较低,对有机污染物的吸附能力较弱[23]。(4)原子比指标:例如((N+O)/C)原子比可以反映塑料的极性高低,而(H/C)原子比可以反映芳香性的强弱。这两个指标会随着塑料在环境中暴露时间的延长,发生老化和裂解等作用后,发生改变[24-25]。另外,破碎、降解、风化等作用可使微塑料表面积增大。上述(微)塑料的特性都与其对有机污染物的吸附能力密切相关。通过对这些基本特性的认知,也有助于理解和探索有机污染物在微塑料上的吸附行为及作用机理。
-
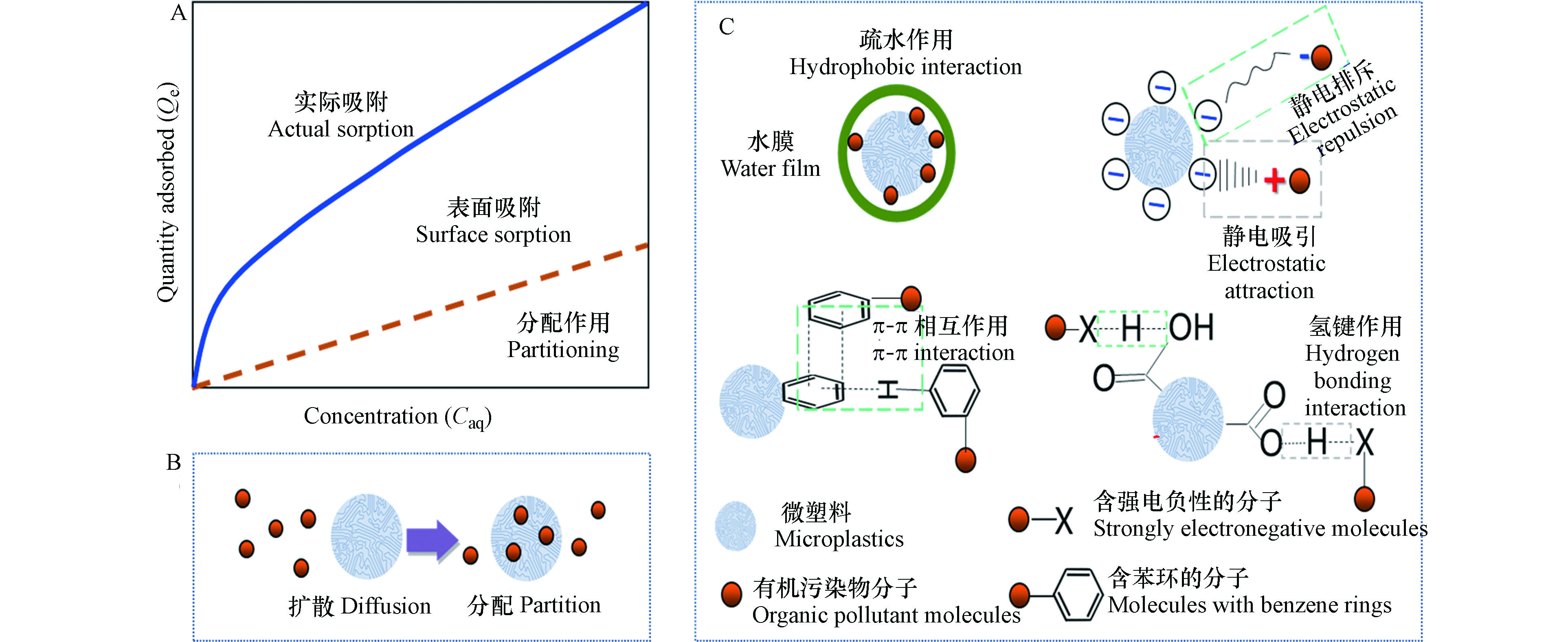
大量的研究发现,环境中的微塑料上往往负载着各类有机污染物,例如多环芳烃(PAHs)、多氯联苯(PCBs)、多溴联苯醚(PBDEs) 、内分泌干扰物(EDCs)、药品和个人护理用品(PPCPs)等[30-37]。这些有机污染物既包括塑料生产和使用过程中使用的添加剂或残留的中间体和降解产物,也包括从周围环境迁移进入微塑料的污染物。有机污染物在微塑料上的吸附往往受到分配作用、表面吸附、交互作用和其他微观机制的共同驱动,其中分配作用和表面吸附是两种最主要的作用机制(图1)。
-
分配作用是有机物在亲水相和疏水相之间的一种分配过程[38]。研究者认为分配作用是有机污染物根据“相似相溶”的原理在亲水相和疏水相之间达到一种平衡状态[39], 该过程主要取决于固体颗粒中疏水相的含量, 而与颗粒表面的吸附位点数量无关[36,40]。在微塑料-水体系中,分配作用主要指非离子型的有机污染物可通过溶解作用分配到微塑料中,并经过一定时间达到分配平衡,其吸附等温线为直线。而有机污染物在水相与微塑料相之间的平衡分配系数
(Kd) ,则是评价微塑料对有机污染物吸附能力的重要参数[39]。线性分配模型,即
Qe=Kd×Ce 常用于拟合有机污染物在微塑料上的分配吸附[41]。其中Qe 为有机污染物在微塑料上的平衡吸附量,Ce 为平衡时有机污染物的水相浓度。分配作用的强弱,受到多方面因素的影响。当微塑料颗粒与有机污染物的极性匹配程度较高时,主要发生分配吸附[42]。当微塑料中的无定形区比例较高,或水相有机污染物的浓度较低时,也以非竞争性的分配作用为主。此外,有机污染物在微塑料上的分配吸附也与微塑料的芳香性和极性紧密相关。
Kd 与(N+O)/C原子比往往呈负相关[39]。当塑料聚合物的(N+O)/C值越小,则其极性越弱,更易吸附非极性的有机污染物,因为非极性的有机污染物结合到塑料聚合物上时更易吸附和扩散到微塑料的基体中[3,11]。例如, PE、PP和PS的(N+O)/C原子比都为0,大多数疏水性有机污染物在这几种微塑料上都有较高的分配吸附量。Kd 与H/C通常呈正相关[39]。H/C值越大,微塑料的芳香性越弱,有机污染物在其上的分配作用越强烈[43]。微塑料的老化、裂解往往伴随着脱氢和脱氧反应,这将导致碳元素含量增加,从而使微塑料的芳香性和非极性都增强,改变其对有机污染物的分配吸附强度[44]。这是由于芳香碳不利于有机污染物的有效“溶解”,高度芳香性的微塑料由于体系能量低、性质稳定,表面不易发生加成和氧化反应,从而降低分配吸附作用[45]。例如PE和PP的H/C数值均为2,远大于其他塑料的H/C比值,它们对17β-雌二醇(E2)也的确有更高的吸附量,说明低芳香性的微塑料可以更好地“溶解”并分配吸附有机污染物[26]。 -
表面吸附作用指的是固体表面有吸附水相中溶解性有机污染物或胶体物质的能力[46-48]。通常,比表面积大的微塑料往往具有更强的吸附能力。对于表面吸附,Langmuir等温线常用于描述有限吸附位点和吸附单层有机污染物分子的情况[49];而Freundlich经验公式,更适合描述非均匀固相表面对有机污染物的吸附[50]。
式中,
Qe 为微塑料上的平衡吸附量;Ce 为水相中有机污染物的浓度;Q0 是在平衡状态下微塑料上有机污染物的浓度;b是与低浓度条件下结合强度和等温线斜率有关的常数。其中,n为表面非均匀性因子;
KF 为Freundlich常数;Ce 为水相中有机污染物的浓度。表面吸附可分为物理吸附和化学吸附。如果吸附剂与吸附质之间是通过分子间相互作用力产生吸附,称为物理吸附;如果吸附剂与吸附质之间产生化学作用,生成化学键而引起吸附,则称为化学吸附。环境有机污染物分子在微塑料上的表面吸附以物理吸附为主,其中疏水作用和静电相互作用是主要的作用机制[30,47,50-52]。微塑料的疏水性越强,其对有机污染物的疏水作用也越强。例如,Liu等[26]发现E2在PE、PP、PS、PET、PC、PMMA以及PVC上的吸附分配系数与微塑料的表面疏水性呈现出显著的正相关关系。静电相互作用是由于带相反电荷的分子相互吸引或带相同电荷的分子相互排斥而引起的,是有机污染物与微塑料表面含氧官能团之间的一种弱相互作用。通常,微塑料表面的零电荷点(pHpzc)值低于环境pH值而带负电[36,52-53],与带正电荷的吸附质发生静电吸引的相互作用[39]。
此外,氢键和π-π相互作用也是影响微塑料吸附有机污染物的重要作用力。氢键是一种特殊的分子间作用力[54-55],它也会显著影响微塑料对有机污染物的吸附强度[56]。π-π相互作用是一种芳香环之间的弱相互作用,当芳香环以面对面和面对边的构象存在时易于发生[57]。Hüffer等[58]发现由于π-π相互作用的存在,PS对芳香族化合物的平衡吸附量比PE、PA和PVC高出了1个数量级。
化学吸附会伴随化学键的形成或强烈的分子间相互作用的发生,较少见于微塑料对有机污染物的吸附。但在某些条件下,例如有机污染物在碱性环境中发生去质子化,与表面带有羧基官能团(—COOH)的物质也可形成化学键[59]。 因此将微塑料酸化处理后,可能有利于其对有机污染物的表面吸附能力。一方面,是由于表面酸性含氧官能团(羧基、羟基等)增加,可增进微塑料与极性有机物之间发生离子交换,形成化学键从而增强吸附能力;另一方面,酸化增强了溶液对微塑料的“溶解”,暴露出更多的有效吸附位点,也可促进表面吸附[59]。
总体而言,微塑料的疏水性、表面电负性,以及环境中溶液的酸碱性都可以影响微塑料与有机污染物的表面相互作用。此外,微塑料的含氧官能团和有机污染物的极性强弱等也会影响微塑料对有机污染物的表面吸附能力。
-
微塑料对有机污染物的吸附作用机理因其自身理化性质、有机物特性和吸附条件等的差异而不同[60],吸附是微塑料和吸附质的各种性质共同作用的结果[36]。很多研究发现仅采用单一的分配作用、表面吸附或孔隙截留作用来描绘微塑料对有机污染物的吸附现象,存在一定的局限性。在实际吸附过程中,通常以某种吸附作用为主,多种吸附作用共存。特别是分配和表面吸附作用一般会同时发生,很难将两个过程区分开[46,61]。比如,Weber等[62]提出了多元反应模型,认为大多数物质都是高度不均匀的吸附剂,对有机污染物的宏观吸附是由一系列线性的和非线性的微观吸附过程组合而成,线性部分的吸附服从分配机理,而非线性部分则与表面吸附有关[63]。通常表面吸附在微塑料对较低浓度的有机污染物的吸附中起主要作用;而当有机污染物的浓度较高时,由于微塑料表面吸附的位点有限,分配作用将占据主导地位[36,48]。
-
微塑料对有机污染物的吸附作用受到多种吸附机理的共同影响,同时也随着环境因素的变化而改变。本节就不同环境因素对微塑料吸附有机污染物的行为影响展开具体讨论(表2)。
-
pH是极其重要的环境参数,它对吸附过程的影响主要体现在对微塑料表面电荷及有机污染物存在形式的影响,究竟发生静电引力还是静电斥力,取决于环境介质的pH值、塑料的pHz值(Zeta电位)和有机污染物的pKa值(酸性解离常数)[57]。一般情况下,当pH<pHz时,微塑料表面带正电;当pH>pHz时,微塑料表面带负电。当pH=pKa时,有机污染物以分子态存在;当pH<pKa时,有机污染物带正电;当pH>pKa时,有机污染物带负电。因此,究竟发生静电引力还是静电斥力作用,取决于介质的pH值、聚合物塑料的pHpzc(零电荷点)和有机污染物的pKa等因素的综合效应[57]。
Wang等[51]研究了pH对全氟辛烷磺酸(PFOS)在PE、PS 和 PVC上的吸附行为的影响,结果表明在3.0—7.0的pH值范围内PFOS与微塑料之间以静电斥力为主。这是由于PFOS的pKa<3,微塑料和PFOS在此pH范围内均带负电,随着 pH 的增加,静电斥力增强而导致两者之间的吸附作用逐渐降低。类似地,有研究发现当pH值从3.0逐渐增加到7.0时,PS和PVC对泰乐菌素(TYL)的吸附量也逐渐减小[50]。这是因为当pH<7.1时,TYL(pKa=7.1)带正电,微塑料带负电,TYL与微塑料之间产生静电吸引。随着溶液pH的上升,TYL+在溶液中的比例逐渐减小,导致吸附量逐渐下降。
-
温度的变化可以改变微塑料的晶体结构组成,也可以改变有机污染物的溶解度和流动性,从而影响两者之间的分子间相互作用力。一般来说,当温度较低时,微塑料对有机污染物的吸附能力较弱;处于常见环境温度时,吸附能力通常随着温度的升高而增强;但当温度过高时,吸附能力又会随温度的升高而减弱。Dong等[11]通过研究发现PE和PVC微塑料对4种麝香的吸附能力随着温度变化有明显改变:当温度较低时(<15 ℃),温度的升高可增加麝香在溶液中的流动性和溶解度,导致麝香的吸附量下降。当温度处于环境温度(15—25 ℃)范围时,微塑料对麝香的吸附量随温度的升高而增加,这是由于吸附是一个吸热过程,温度的升高可增加系统的熵值,从而促进吸附。当温度较高(>25 ℃)时,吸附量会再次随着温度的升高而减小,这是由于高温有利于解吸的发生,而导致净吸附量下降。类似地,Zhang等[64]关于PP微塑料对合成麝香的吸附行为的研究也证实了上述观点:在15—25 ℃内,由于吸附过程吸热使系统熵增加,所以随着温度的升高微塑料对麝香吸附量逐渐增加;当温度大于25 ℃时,由于解吸加剧而导致吸附量下降。但也有例外,Li等[65]发现在15—45 ℃区间,三氯生(TCS)在PS微塑料上的平衡分配系数与温度之间并无显著关系。因此在考察温度对吸附作用的影响时,需要细致分析不同温度范围,同时关注微塑料和有机污染物各自的理化性质。
-
微塑料对有机污染物的吸附也受到盐度因子的影响,盐度可以改变吸附过程中静电相互作用强弱以及离子交换的程度。盐度升高,在多数情况下对有机污染物在微塑料上的吸附有促进作用。此类现象称为盐析效应,即水中无机盐浓度的增加会降低有机污染物的溶解度,从而增强其在微塑料表面的吸附[51,66-67]。例如,PE和PVC微塑料对麝香的吸附量随盐度的增大而增大,当盐度为14%时吸附量达到最大值[11]。同样地,微塑料对E2和双酚A等有机污染物的吸附作用,也由于盐度的增加导致这些有机污染物在溶液中的溶解度下降,而在微塑料上的吸附量上升[26, 55]。但也有例外,比如高盐度会抑制微塑料对磺胺甲噁唑(SMX)和DDT的吸附[68-69],其主要原因可能为Na+浓度随盐度的增加而增加,带正电荷的Na+容易通过静电吸引作用吸附在表面带负电的微塑料上,吸附能力的降低可能是由于无机可交换阳离子Na+可以取代酸性基团的氢离子,从而抑制氢键的形成。这种阳离子交换打破了电荷平衡,中和了吸附剂表面电荷,阻碍了静电相互作用,使得吸附量下降[36, 70]。总体而言,盐度对有机污染物在微塑料上的吸附作用的影响程度有限,其影响可能随污染物种类改变而改变,并且受多种吸附机制驱动[65,71-72]。
-
溶解性有机质(DOM)广泛存在于天然水体中,腐殖酸是其中的典型代表。腐殖酸是一种多相大分子,具有许多与有机污染物结合的位点,因此可以直接影响有机污染物在微塑料上的吸附行为[55]。多项研究表明在腐殖酸存在的情况下,微塑料对E2[26]、四环素[52]、PBDEs[72]等有机污染物的吸附能力下降,其主要原因可能是由于有机污染物和腐殖酸之间形成了复合物,从而促进有机小分子的溶解,导致有机污染物在微塑料上吸附量的下降[55]。但也存在不同现象和观点,例如Zhang等[53]研究结果显示腐殖酸可以促进微塑料对土霉素的吸附,其原因主要是由于微塑料和土霉素分子间形成了π-π共轭而增强了表面吸附作用。值得注意的是,腐殖质的降解程度也会影响微塑料对有机污染物的吸附能力。在降解程度较低的腐殖质形态中,持久性有机污染物在微塑料上的吸附量比在降解程度较高的腐殖质中更高,即腐殖质降解程度越低越有利于吸附[73]。此外,天然水体环境中还存在着广泛的食源性颗粒,这些食源性颗粒中的有机质含量通常较高(蛋白质+脂质≥50.0%)。因此在自然环境中,食源性颗粒与微塑料对有机污染物的竞争也是不可避免的[74]。有机污染物的亲脂性与其在微塑料或食源性颗粒上的吸附呈正相关[75],因此在实际环境中食源性颗粒的存在,也可在一定程度上竞争抑制有机污染物在微塑料上的吸附。
-
本文中老化的概念主要指微塑料在环境中,随着停留时间的增加而导致的自然氧化行为和紫外线辐射所导致的紫外老化行为。老化会导致微塑料的理化性质相对于原始颗粒发生改变,因此老化后的微塑料对有机污染物的吸附能力也将发生变化。
随着老化程度的增加,微塑料的表面逐渐产生裂纹,尺寸不断减小,使其比表面积不断增大。并且老化常导致微塑料表面的含氧基团增加,从而对某些有机污染物产生更强的吸附能力。Hüffer和Hofmann[58]认为老化会降低塑料的疏水性,从而增加了它们对亲水污染物的吸附能力。例如,研究表明紫外线加速老化后的PS和PVC微塑料相比原始颗粒,对环丙沙星具有更高的吸附能力[76]。这主要是因为老化作用在塑料表面引入了许多含氧官能团(如羧基、羟基、醛基、酮基等)[77],导致塑料表面的亲水性、极性和表面电荷增加,从而增强了其对极性较强的有机污染物的吸附能力。
对于疏水性有机污染物(HOC)而言,塑料老化的影响是双重的。老化既可以导致微塑料比表面积增加,从而促进微塑料对HOC的吸附;老化也可以引入含氧官能团,减少HOC在微塑料表面的吸附。例如,Müller和Hüffer等研究者发现老化后的PS微塑料对PAHs的吸附量下降,其原因就是老化使得微塑料表面引入许多含氧官能团,形成的氧化膜抑制了微塑料对PAHs的吸附[78-79]。此外,环境老化过程会破坏微塑料的无定形区,改变聚合物的分子链结构,使得微塑料的结晶度增加,从而使微塑料对疏水性有机污染物的吸附能力降低。但也有研究者发现了不同的现象,例如Endo等[80]认为老化对微塑料吸附 PCBs的能力无显著影响。因此,老化对微塑料吸附能力的最终影响,取决于哪方面因素占主导,要具体分析微塑料在不同条件下的环境行为和老化过程[81]。
-
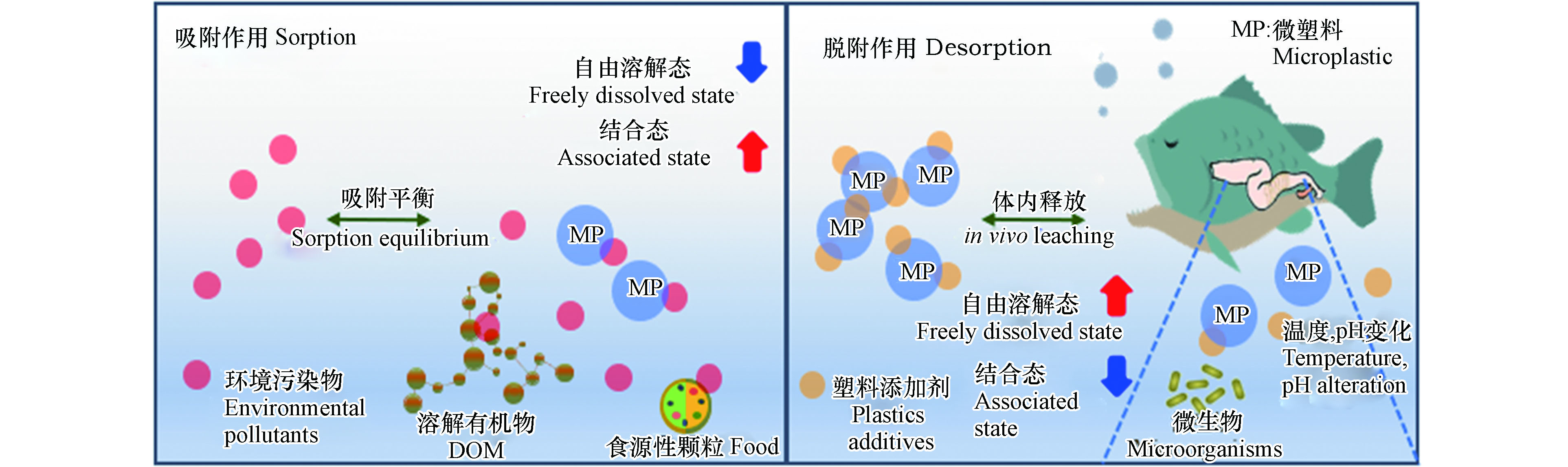
生物有效性可以用来表征污染物被生物吸收利用的程度及潜在的毒性,评价生物有效性最直接的方法是采用生物富集或毒性测试实验[84]。微塑料对有机污染物生物有效性的影响主要体现在对其浓度的影响上,图2描绘了微塑料通过对有机污染物的吸附和释放,改变有机污染物的自由溶解态浓度和生物有效性的示意图。
在自然环境中,微塑料可以通过分配和表面吸附等作用机制吸附周围环境中的各类有机污染物,降低局部环境中的有机污染物的水相自由溶解态浓度,从而改变这些有机污染物对水生生物的生物有效性[85]。例如,Yang等[86]的研究发现在微塑料和壬基酚对蛋白核小球藻的复合毒性实验中,由于微塑料对壬基酚具有较强的吸附能力,两者共存时壬基酚的自由溶解态浓度显著下降,因而两者对小球藻的联合毒性呈现拮抗作用。Zhu等[87]研究同样发现了在与PE、PS或PVC微塑料共存时,TCS对微藻的毒性明显下降。其主要原因是微塑料对TCS有较强的吸附能力,使得TCS的自由溶解态浓度显著下降所致。此外,环境中的其他介质,例如DOM和食源性颗粒也会与有机污染物发生结合和吸附作用,来影响有机污染物对水生生物的有效性。
微塑料从环境中吸附有机污染物的同时,也会在某些条件下向环境再释放出这些污染物,亦或是向周边环境释放出塑料自身携带的添加剂成分。任何不利于吸附的条件,例如减压、加热、改变pH,以及生物体的消化作用等,都有利于有机污染物从微塑料上脱附下来[88-89]。
脱附作用一方面会导致水体环境中有机污染物的自由溶解态浓度增加,增加水生生物的暴露风险;另一方面当负载有机污染物的微塑料经由摄食作用进入生物体消化道后, 在消化道特殊的pH和温度等条件下,被吸附的有机污染物更易从微塑料上释放出来,这些释放的有机污染物将被生物体吸收、累积、转化和迁移,产生一系列的生态毒理学效应[90]。例如,Chen等[91]在研究中发现,当塑料暴露于鱼类模拟胃液中时,其上的各类添加剂组分会大量释放出来,造成了日本青鳉幼鱼孵化率下降等急性毒性,并产生了内分泌干扰效应。Coffin等[92]也发现,经海鸟和鱼肠道模拟消化液处理后的微塑料,能释放出大量的雌激素类污染物质,双酚A和邻苯二甲酸酯类物质显著高于对照组。
-
负载有机污染物是微塑料的重要特性,微塑料对有机污染物有较强的吸附作用,其吸附机理以分配作用和表面吸附为主,并受到多种其他机制的共同调控。在真实环境水体中,水化学因子pH、温度、盐度、DOM和老化等也会在一定程度上改变微塑料对有机污染物吸附的强弱。最后,有机污染物在微塑料上的吸附和脱附,都将改变其水相或生物体内的溶解态浓度,从而降低或增强其生物有效性和毒性。特别值得引起我们注意的是,由于塑料制品在生产过程中往往会添加大量的阻燃剂、塑化剂、颜料等助剂[93],因此环境微塑料上负载的添加剂浓度往往没有和周围环境达到分配平衡,存在逸度扩散梯度。一旦这些微塑料被生物体摄入,加之消化道的脱附促进作用,微塑料上负载的添加剂的生物有效性将增强,微塑料像“源”一般向生物体释放有机污染物。
在今后的研究中,以下几方面值得展开进一步深入的探索。(1)微塑料吸附有机污染物的机理研究多数还处于定性描述阶段,阐明微塑料吸附过程中不同作用机制对吸附的贡献率,以及微塑料的结构或表面化学基团对吸附贡献的构效关系将是未来的一个研究重点。(2)由于不同微塑料的性质迥异,它们对有机污染物的吸附能力与特点也不尽相同,在今后的研究中应当进一步细致分析各环境因子对微塑料的吸附能力的影响,为环境特征微塑料对有机污染物的吸附行为提供更多的理论支撑。(3)塑料残骸及微塑料中添加剂释放的风险需要得到进一步的重视。由于添加剂的浓度往往高于环境本底值,因此当塑料添加剂成分随着微塑料的迁移而逐渐释放出来,会增加局部环境中污染物的自由溶解态浓度,并可能引发一系列的生态毒理学效应。
微塑料吸附有机污染物的研究进展
Research progress on sorption of organic pollutants by microplastics
-
摘要: 微塑料作为一种新型环境污染物在全球环境介质中普遍存在,其存在可能会影响传统有机污染物的分布、迁移和环境归趋。微塑料本身具有强疏水特性和较大的比表面积,使其能够有效地吸附有机污染物并将其输送到生物体内,从而改变微塑料潜在的环境风险。微塑料与有机污染物之间的相互作用机制主要受二者自身的理化性质,及溶液pH、温度、盐度、溶解性有机质和老化作用等环境因素的影响。本文从微塑料的基本特性、与有机污染物的作用机制、环境影响因素,以及二者复合对有机污染物生物有效性的影响等方面进行了综述,并提出微塑料与有机污染物相互作用研究中亟需解决的问题和未来的研究方向。Abstract: As a new type of environmental pollutant, microplastics are ubiquitous in global environmental media. Their presence can change the distribution, transportation and environmental fate of traditional organic pollutants. Microplastics have strong hydrophobic properties and large specific surface areas, which enables them to effectively sorb organic pollutants and later transport into organisms, thereby altering the potential environmental risks of both microplastics and the associated organic pollutants. The interaction mechanisms between microplastics and organic pollutants are mainly affected by their physical and chemical properties, as well as environmental influential factors such as pH, temperature, salinity, dissolved organic matter, and aging time. This paper reviews the basic characteristics of microplastics, the interaction mechanisms between microplastics and organic pollutants, effects of environmental influential factors, and the bioavailability of organic pollutants with the presence of microplastics, and finally puts forward the issues related to the interactions between microplastics and organic pollutants that needed for future studies.
-
Key words:
- microplastics /
- sorption /
- organic pollutants /
- interaction mechanism
-
地下水是地球宝贵的资源,是重要的生态环境因子和不可忽视的致灾因子[1 − 2],地下水水化学特征的变化往往会影响生态环境和人类社会的发展. 受多种因素的共同控制,地下水化学成分在空间和时间尺度上差异显著,主要有自然因素(降水、水岩相互作用等)[3]和人为因素(工农业污染等)[4],如何识别其主控因素,是地下水水化学形成研究的关键问题之一. Piper图、Gibbs图和离子比值法是研究地下水化学成分形成和演化的有效手段,近年来,同位素分析方法[5]、统计学方法[6]及水文地球化学模拟技术[7],将单一的地质和水文地质条件、水化学特征等因素结合起来,定性和定量揭示地下水的形成机制[8],也逐渐成为识别地下水来源及形成过程的关键方法[9].
中国南方岩溶地区分布广泛,面积约78万km2,发育了接近三千多个岩溶地下水系统[10 − 11],赋存了庞大的岩溶水资源,但受赋存环境、开采条件及水质情况的制约[12],区内仍严重缺水. 研究岩溶区地下水水化学特征及其形成机制,不仅有利于水环境保护和修复,而且对地下水的开发利用具有重要作用. 梅窖镇大石岭矿区位于中国南方岩溶地区中下部,岩溶地貌发育,蓄水能力弱,水资源可获取性差,可利用难度大,地下暗河和浅层地下水是居民主要的生活和饮用水源. 但近几年,区内浅层地下水水位急速下降、水质持续恶化,地下水化学特征及其形成机制等相关问题仍然未得到充分的研究和解决.
本文通过分析浅层地下水(埋深小于25 m)的基本理化参数和主要离子分布,利用数理统计、Piper图、Gibbs图、主成分分析法、正向演替模型和混合模型等方法,定性和定量地揭示了赣州梅窖镇岩溶区浅层地下水的水化学特征和水岩相互作用机制,为该区地下水资源的合理开发利用和管理提供科学依据.
1. 材料与方法(Materials and methods)
1.1 研究区概况
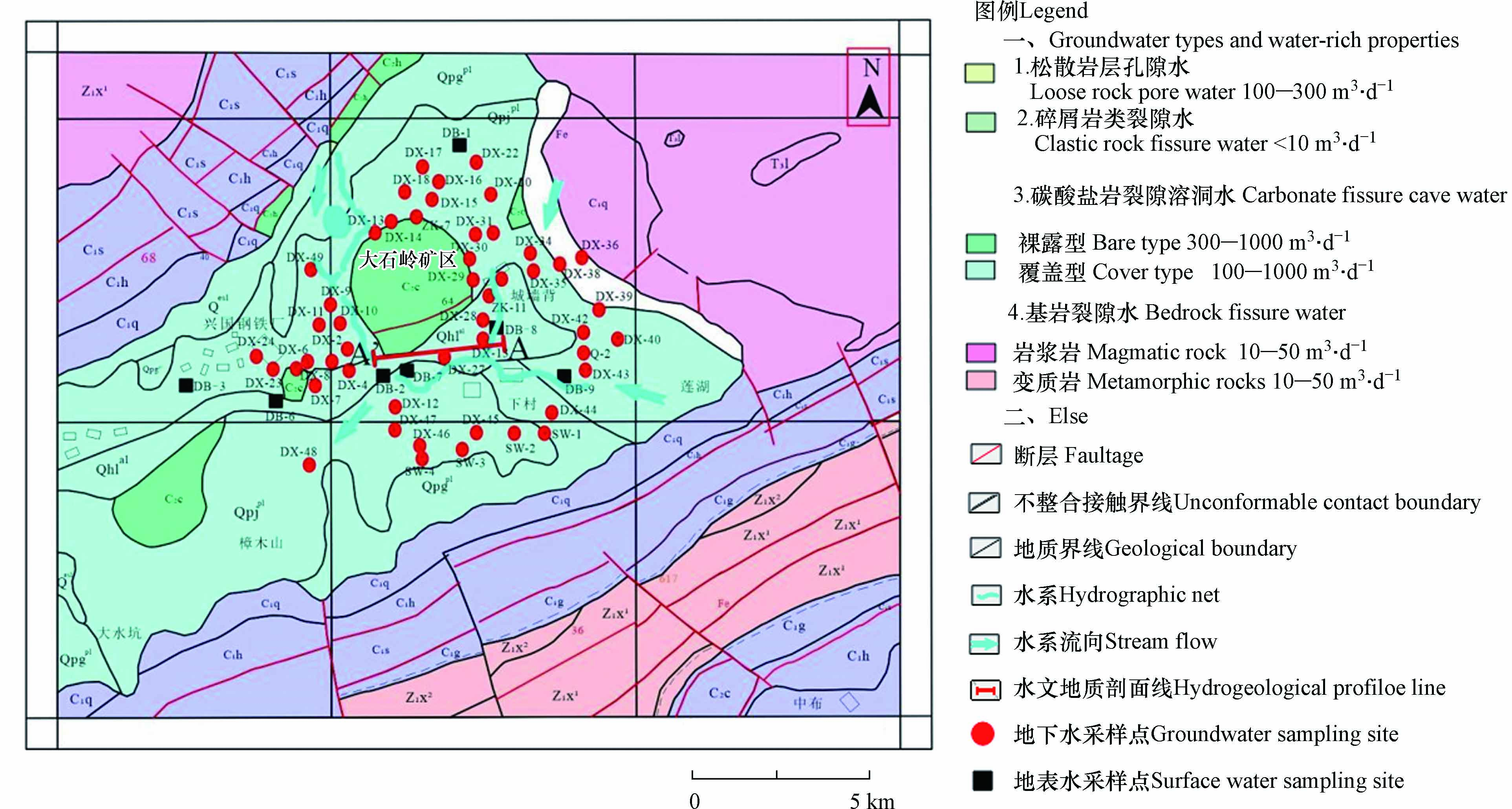
梅窖镇大石岭矿区(以下简称研究区)位于江西省赣州市兴国县梅窖镇(图1),地理坐标为:115°47′—115°42′ E,26°24′ —26°25′N,属岩溶盆地地貌,盆地呈北东向条带状展布,大石岭矿区位于盆地核心地带,属丘陵地形,基岩出露较好. 区内属亚热带东南季风气候区,年平均气温18.8 ℃,年平均降水量为1522.3 mm,年平均蒸发量1635.8 mm.
研究区出露的地层有第四系、石炭系、震旦系,依据地下水的赋存条件,地下水可划分为松散岩类孔隙水、基岩裂隙水、碎屑岩类裂隙水、碳酸盐岩岩溶裂隙水的4种类型,其中浅层地下水(埋深小于25 m)主要为第四系松散孔隙水和石炭系碳酸盐岩岩溶裂隙水(图2). 钻探浅孔共15个,遇溶洞钻孔13个,见溶洞率87%,共揭露21个溶洞,岩溶发育程度强. 浅部溶洞较为发育,一般隐伏于地表10 m以下的地方,主要集中在高程+290—+270 m,呈现半充填状态,充填物为第四系泥砂,个别溶洞见磨圆度较好的卵石.
区域碳酸盐岩岩溶裂隙水富水性较好,泉流量1.495—9.5573 L·s−1,暗河流量22.758 L·s−1,地下水位年变幅 1—8m,岩溶水主要赋存于石炭系船山组(C2c)和黄龙组(C2h),岩性主要以灰岩及白云岩为主. 其次为第四系松散孔隙水,含水层厚度5.8—29.4 m,平均17.4 m,岩性主要为粘土、含碎石粘土、碎石土及含泥砂砾石. 浅层地下水的主要补给源为大气降水的渗入补给、基岩裂隙水的侧向补给和汛期河水的反向补给,此外,经现场水文地质调查发现,研究区暗河(DB-2)流量丰水季节较枯水季节大,且雨后流量明显增加,说明暗河水受地表环境影响显著. 浅层地下水排泄方式为自然蒸发、就近向坡脚沟谷、洼地、河流排泄和以泉等形式排泄. 此外,研究区农作物丰富,以水稻、脐橙、油菜和甘蔗等为主,通过对脐橙中的重金属研究发现,施用化肥、农药等人为农业活动因素是土壤中重金属超标的主要原因[13]. 现场调查过程中,山上随处可见养殖场,据2014年赣州市疾病控制中心有关数据表明[14],农村水体污染严重,生活、农业生产及养殖是水体污染的主要来源. 因此,人为污染也是研究区地下水污染需要考虑的另一关键因素.
1.2 样品采集与测定
基于研究区的地质、构造、水文地质、水文、气象、地形地貌等基础资料, 进行水文地质踏勘,重点调查水井、暗河和泉出露点. 沿地下水的补径排路径,2021年8—9月,采集大气降水、地表水、水井地下水和泉水样品分别为1件、9件、49件和4件,采样点分布于研究区重要河流、水井、泉点和暗河出口,用于水质检分析63件、氢氧稳定同位素测试的样品49件.
利用意大利HANNA公司HI98194水质多参数测试仪现场测定水温、 pH、电导率等项目. 阳离子(K+、Ca2+、Na+、Mg2+)用原子吸收分光光度计( AAS800,美国PE公司)进行测定,阴离子(SO42−、Cl−、F−、NO3−)使用离子色谱仪测定,测试相对标准偏差在-5%到+5%之间,数据的精度和准确度均符合要求. HCO3−采用碱式滴定法测定,根据测试的阴阳离子含量计算水样的TDS. 氢氧同位素(δD、δ18O)的分析测试使用美国Picarro公司生产L2140-i液态水水汽同位素分析仪测试,δD、δ18O分析误差分别小于0.5‰、0.1‰,测定结果以相对V-SMOW标准给出.
1.3 数据分析
本文采用Piper图分析地下水水化学类型,结合氢氧稳定同位素反应地下水的补给来源[5]. 利用相关性和主成分分析法揭示地下水各离子间的相关性[15],并筛选影响地下水水化学组成的主要变量[16]. 基于Gibbs图定性的判断地下水水化学组成的来源,包括蒸发浓缩、岩石风化以及大气沉降[17],并利用[Mg2+/Na+]和[Ca2+/Na+]、[Mg2+/Ca2+]和[Na+/Ca2+]的物质的量比值[18]进一步揭示地下水水化学组成来源的主控因素. 结合[(Ca2++Mg2+)-(HCO3−+SO42−)]与[(Na++K+-Cl−)]的浓度关系分布图判断是否发生阳离子交替吸附[19],利用[(Ca2++Mg2+)-HCO3−]与[SO42−-Na++Cl−]的比值判断SO42−来源[20],并利用[NO3−/Cl−]与[Cl−]及[SO42−/Ca2+]与[NO3−/Na+]的关系判断NO3−的来源,查明人为因素对地下水化学成分的控制作用[21 − 22]. 最后,利用正向演替-端元混合模型量化大气输入、人类活动和岩石风化(碳酸盐岩、硅酸盐岩和蒸发盐岩)对地下水水化学组成的相对贡献[23 − 24],正向演替模型主要计算公式如下:
stringUtils.convertMath(!{formula.content}) (1) stringUtils.convertMath(!{formula.content}) (2) stringUtils.convertMath(!{formula.content}) (3) stringUtils.convertMath(!{formula.content}) (4) stringUtils.convertMath(!{formula.content}) (5) 式中,γ代表不同来源对地下水水化学组成的相对贡献(%),T代表阳离子与阴离子毫克当量和,大气输入、人类活动以及岩石风化中各离子组成利用元素X(K+、Na+、Ca2+、Mg2+、Cl−、NO3−、SO42−、HCO3−)的质量守恒进行计算(单位为毫克当量):
stringUtils.convertMath(!{formula.content}) (6) 为了进一步量化碳酸盐中灰岩和白云岩的贡献率,结合三端元回合模型,利用Mg2+/Ca2+比值,进行定量估算. 研究表明,低、中、高Mg2+/Ca2+比值(约0.1、0.7和1.05)分别作为石灰岩、硅酸盐和白云岩溶解物质的端元,方程如下:
stringUtils.convertMath(!{formula.content}) (7) stringUtils.convertMath(!{formula.content}) (8) 式中, f 代表地下水不同来源的贡献率(%),其中硅酸盐的贡献率可以通过正向演替模型获得,其他符号代表相应来源的端元值以及硅酸盐和碳酸盐贡献样品的Mg2+/Ca2+比值.
2. 结果与讨论(Results and discussion)
2.1 水化学组分分布特征
水体的水化学组成如表1所示. 可知,研究区地下水和地表水整体上呈弱碱性,地下水pH介于5.72—8.71,均值为7.21,地表水pH介于7.18—8.53,均值为7.82. 地下水电导率介于30—535 µs·cm−1,均值为240.72 µs·cm−1,地表水电导率介于44.9—381 µs·cm−1,均值为271.28 µs·cm−1. 区内地下水及地表水均为淡水,地下水TDS介于27.61—360.75 mg·L−1,平均值为179.13 mg·L−1,地表水TDS介于84.19—280.97 mg·L−1,平均值为201.59 mg·L−1,因地表水采样点大都位于径流和排泄区,且研究范围相对较小,出现地表水的TDS均值较地下水TDS略大. 地下水阴离子浓度表现为HCO3−>Cl−>NO3−>SO42−,以HCO3− 为主,占总阴离子浓度的79.5%,阳离子浓度表现为Ca2+>Mg2+>Na+>K+,以Ca2+为主,占总阳离子浓度的72.9%. 地表水阴离子浓度表现为HCO3−>NO3−>Cl−>SO42−,以HCO3− 为主,占总阴离子浓度的81%,阳离子浓度表现为Ca2+>Mg2+>Na+>K+,以Ca2+为主,占总阳离子浓度的71.1%. 根据Piper图(图3)显示,研究区地下水水化学类型主要为HCO3-Ca型,下部两个三角图中地下水、地表水和泉水整体较为集中,说明它们的水化学成分、含量变化较小,来源较为一致.
表 1 赣州梅窖镇大石岭矿区水体主要离子构成Table 1. Ion compositions of the water body in the Dashiling Mining Area of Meijiao Town, Ganzhou水类型 Water type 指标Index ρ/(mg·L−1) pH 电导率/(µs·cm −1)Electrical conductivity Ca2+ Mg2+ K+ Na+ Cl− SO42− NO3− HCO3− TDS 浅层地下水 最大值 71.12 15.64 18.82 16.40 20.71 20.45 27.08 244.00 360.75 8.71 535 最小值 4.20 0.13 0.33 0.16 ND. 0.09 ND. 10.00 27.61 5.72 30 平均值 31.48 4.02 2.65 4.31 4.38 4.62 8.06 113.21 179.13 7.21 240.72 标准差 19.65 3.63 3.91 4.23 4.60 5.07 6.94 65.74 89.49 0.75 120.98 地表水 最大值 55.77 13.29 8.19 3.37 18.77 20.94 33.66 195.20 280.97 8.53 381 最小值 15.93 1.07 0.75 0.84 ND. 2.77 ND. 61.00 84.19 7.18 44.9 平均值 40.71 8.20 2.84 1.89 4.81 6.78 6.45 136.34 201.59 7.82 271.28 标准差 14.16 3.25 2.55 0.65 5.06 5.13 9.83 37.46 53.74 0.40 104.65 2.2 地下水的补给来源
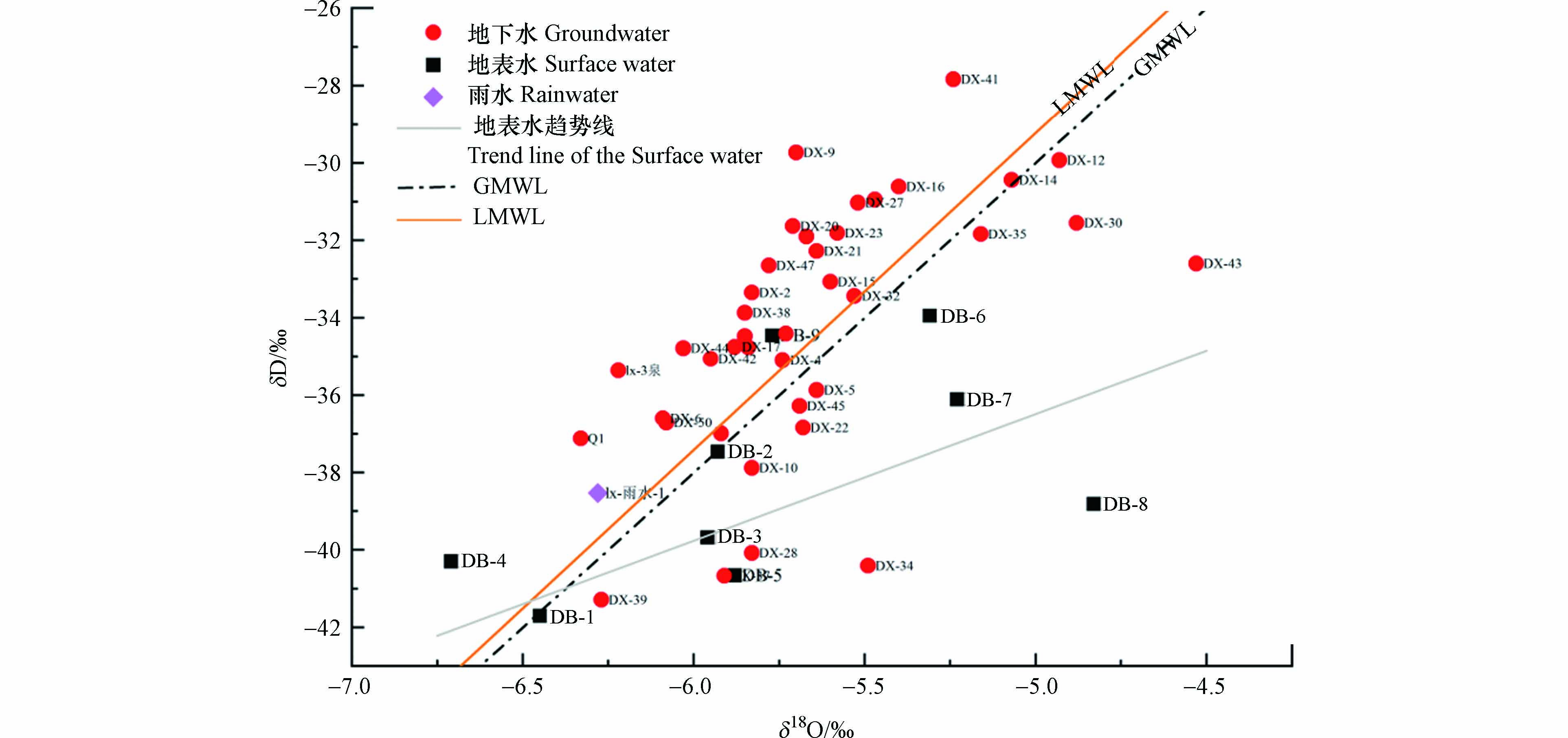
同位素分析方法广泛用于解译地下水的形成、地表水和地下水的转化和演化过程,对分析地下水的形成机制的演化规律具有重要的指示意义[5]. 地下水和地表水氢氧稳定同位素(δD和δ18O)分析结果表明,地下水δD值变化范围介于−41.29‰—−27.84‰之间,平均值为−34.26‰,标准差为3.22‰,δ18O值变化范围为−6.33‰—−4.53‰,平均值为−5.67‰,标准差为0.38‰;地表水δD值变化范围介于−41.7‰—−33.95‰之间,平均值为−38.13‰,标准差为2.79‰,δ18O值变化范围为−6.71‰—−4.83‰,平均值为−5.79‰,标准差为0.59‰. 整体上看,研究区浅层地下水δD和δ18O较地表水的分布范围大,且相对较为富集.
本文从国际原子能机构获得了位于赣州东部福州地区观测站长期的月平均大气降水δD、δ18O同位素数据(70组),回归拟合得到当地大气降水线(LMWL):δD=8.19δ18O+11.73. 该方程的斜率大于全球大气降水线(GMWL)[25](δD=8δ18O+10)斜率,表明研究区受局地水汽和二次蒸发影响小. 矿区地下水和地表水δD与δ18O均分布在大气降水线LMWL附近(图4),表明地下水及地表水主要源于大气降水的补给. 对比,地下水地表水水样点则大多分布于LMWL左下方,受蒸发作用影响较大,其中DB-4和DB-9为山上引水,具有山泉水的特征,蒸发作用不明显. 地下水的水样点大都分布在LMWL附近,部分点(点DX-28、DX-34、DX-39和DX-43)分布在LMWL线下方,经调查发现,DX-28和DX-43分布在小溪周边,DX-34和DX-39分布在坡脚水塘边,受地表水的混合作用影响,造成δD与δ18O具有蒸发作用的特征. 总体上,地下水δD与δ18O相对较为富集,说明地下水在径流过程中,除了受大气降水补给和地表水的混合作用外,还受到了其他水文地球化学作用的影响,如研究区岩溶个构造断层发育,暗河出露(DB-2),深部基岩裂隙水和岩溶水,通过孔隙、裂隙和断层,汇入浅层松散孔隙水,造成水中δD与δ18O富集.
2.3 水化学形成机制
2.3.1 地下水离子来源
主成分和相关性分析是揭示地下水水化学组成来源一致性、差异性及关联程度的有效数理统计方法[26]. 对研究区地下水水化学组成进行主成分及相关性分析,结果见表2和表3. 运用主成分分析法提取了3个主成分,累计解释了总因子的29.512%、53.349%和75.051%,揭示地下水离子3种不同的来源. 第一主成分包括Ca2+、Mg2+和HCO3−,其权重系数分别为0.513、0.517和0.522,3个指标对地下水化学成分的控制作用相当;第二主成分包括Cl−、SO42−、NO3−,其权重系数为0.298、0.267和0.399,NO3−对地下水组分的影响相对较大;第三主成分包括K+和Na+,其权重系数分别为0.343和0.272,说明K+是该主成分的主要控制指标.
表 2 研究区地下水水样旋转成分矩阵Table 2. Rotational composition matrix of groundwater samples in the study area指标 Index f1 f2 f3 Ca2+浓度 0.849 0.304 0.237 Mg2+浓度 0.856 -0.060 -0.108 K+浓度 0.063 -0.004 0.901 Na+浓度 0.171 0.349 0.715 Cl−浓度 0.152 0.680 0.475 SO42−浓度 0.321 0.608 0.164 NO3−浓度 -0.044 0.909 -0.012 HCO3−浓度 0.864 0.176 0.304 特征值 2.361 1.907 1.736 贡献率/% 29.512 23.837 21.702 累积贡献率/% 29.512 53.349 75.051 表 3 地下水水化学参数间的线性相关矩阵Table 3. Linear correlation matrix among groundwater hydrochemical parameters指标Index Ca2+ Mg2+ K+ Na+ Cl− SO42− NO3− HCO3− pH TDS Ca2+ 1 0.529** 0.206 0.518** 0.362* 0.476** 0.189 0.912** 0.425** 0.950** Mg2+ 1 -0.048 0.035 0.018 0.200 -0.108 0.545** 0.285 0.545** K+ 1 0.493** 0.631** 0.257 0.116 0.214 0.139 0.298* Na+ 1 0.455** 0.527** 0.274 0.464** 0.280 0.555** Cl− 1 0.370* 0.356* 0.352* -0.042 0.439** SO42− 1 0.215 0.394** 0.154 0.495** NO3− 1 0.081 -0.221 0.140 HCO3− 1 0.492** 0.985** pH 1 0.471** TDS 1 注:*表示P<0.05, **表示P<0.01 主成分f1中Ca2+与Mg2+和HCO3−之间具有显著的相关性,表明这3种离子主要来源于碳酸盐岩风化[27]. 主成分f2中Cl−、SO42−和NO3−三者具有相同的来源(23.837%),且研究区附近常年有居民居住,水稻的种植及牲畜的蓄养会存在化肥和农药的使用以及粪便和生活污水的排放[28],表明这3种离子主要来源于人为因素的影响[29 − 30]. 但Cl−、SO42−和NO3−间相关性不明显(r<0.4,P<0.05),指示Cl−和SO42−还可能存在其它来源,如蒸发盐岩和石膏的风化[31]. 主成分f3中K+和Na+具有一定的相关性(r>0.4,P<0.01),K+的权重系数较高,且主成分分析显示具有相同的来源(21.702%),表明这两种离子可能的来源为硅酸盐岩和(或)蒸发盐岩风化[32].
2.3.2 水岩相互作用
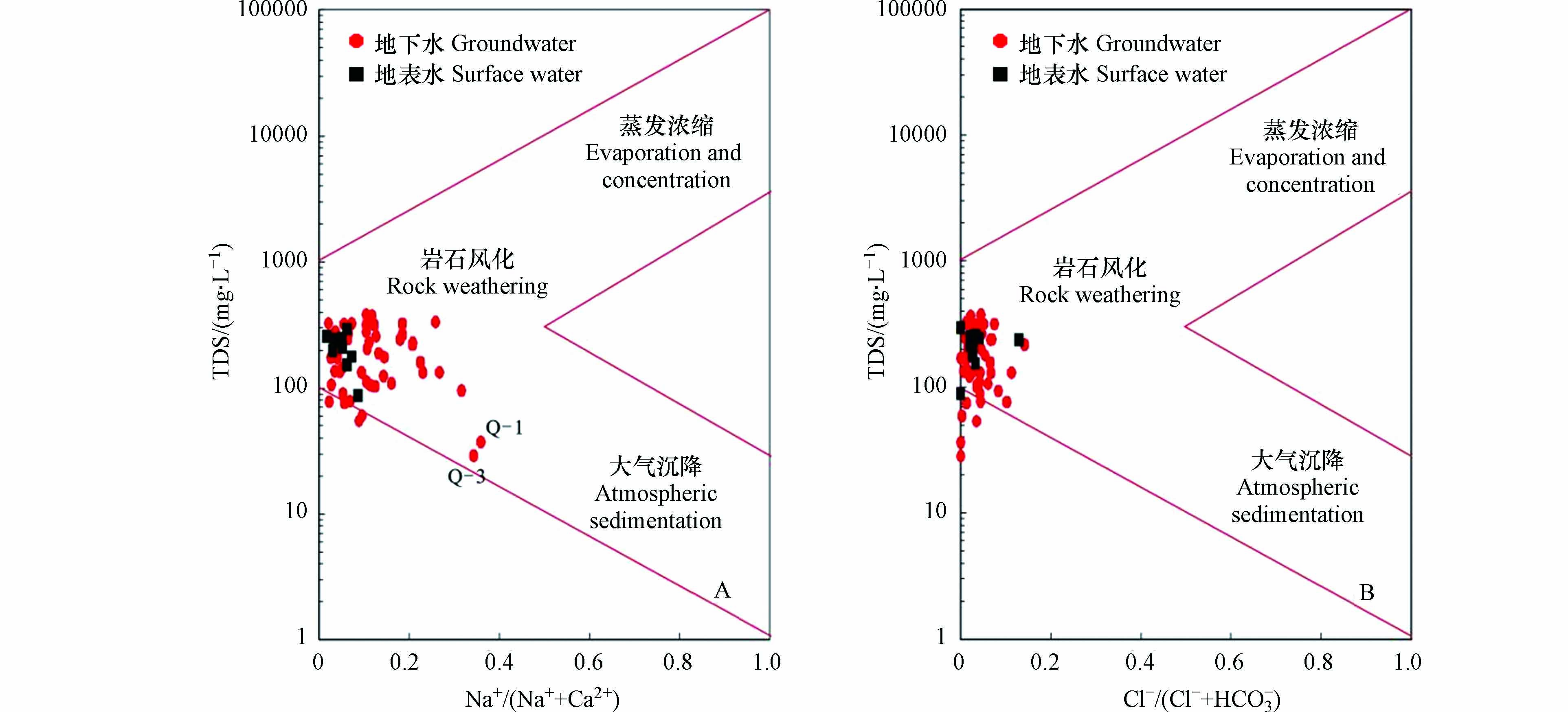
Gibbs图可宏观查清地下水水化学组成和演化过程的控制因素[17]. 如图5所示,水样的离子含量比Na+/(Na++Ca2+)为0.02—0.37,Cl−/(Cl−+HCO3−)为0—0.14,平均值分别为0.14和0.04. 样点基本集中在Gibbs图中部,说明地下水离子组分主要来自于岩石风化作用,但Q-1和Q-3为山泉水样,出露条件较好,径流路径较短,主要为大气降水入渗补给,故会受到大气沉降影响. 部分水样点落在Gibbs三角区域之外,指示人类活动的影响也是控制研究区地下水的主要因素之一. 地表水离子组分也主要来自于岩石风化作用,但蒸发盐岩溶解作用的影响较地下水弱. Mg2+/Na+和Ca2+/Na+、Mg2+/Ca2+和Na+/Ca2+的物质的量比值可以定性判别研究区内不同岩石风化溶解作用对水体溶质的影响[18]. 图6表明,地下水和地表水主要受到碳酸盐岩风化作用的影响,硅酸盐岩和蒸发盐岩风化作用较弱,碳酸盐岩中起作用的主要是灰岩及白云岩的溶解.
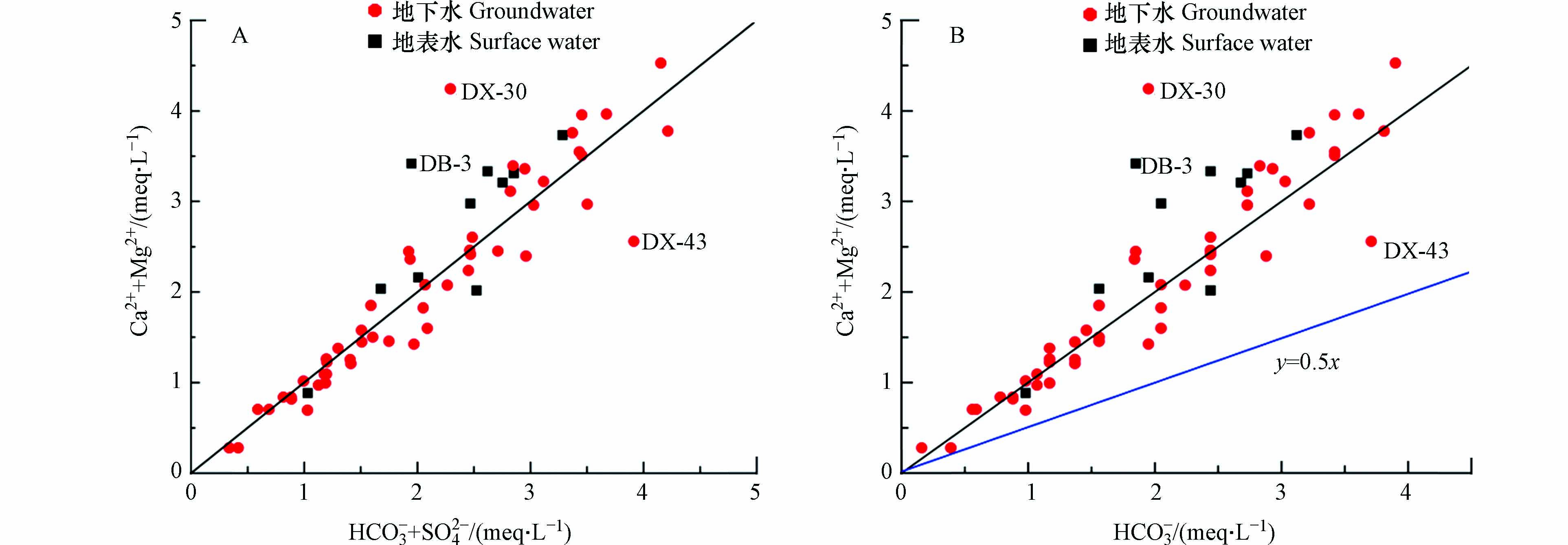
为进一步查清灰岩和白云岩对水体中Ca2+、Mg2+和HCO3−的控制作用,绘制(Ca2++Mg2+)/(HCO3−+SO42−)以及(Ca2++Mg2+)/HCO3−的毫克当量浓度比值图[33]. 根据图7可知,(A)中地下水和地表水离子比值大都位于1∶1等值线附近,说明地下水和地表水中的Ca2+、Mg2+和HCO3−主要来源于碳酸盐岩、硅酸盐岩和石膏、杂卤石等蒸发盐岩的溶解,(B)中地下水离子比值多数远离1∶0.5等值线,整体更为靠近1∶1等值线,由此可知以灰岩和白云岩为主的碳酸盐岩的溶解是Ca2+、Mg2+和HCO3−的主要来源,其中灰岩占主导作用[34]. 图7(A)中点DX-43处于1∶1等值线下方较远处,在图7(B)处于1∶1和1∶0.5之间,说明DX-43水化学成分受白云岩和灰岩的共同作用. 而DB-3及DX-30较偏离1∶1等值线,处于上方,即[Ca2++Mg2+]/[HCO3−+SO42−]远大于1,水体中Ca2+和Mg2+过剩,需要Cl−来平衡,表明水样点DB-3及DX-30中Ca2+和Mg2+不仅来自碳酸盐岩、硅酸盐岩和蒸发盐岩的溶解,还有其他重要来源,如阳离子交替吸附作用等[35]. 调查发现研究区存在大量水泥加工厂,CaCl2是白水泥生产过程中的有效矿化剂和增白剂,DB-3和DX-30分别位于人工沟渠和小池塘旁,推测DB-3及DX-30中Ca2+和Mg2+还可能来源于人类活动.
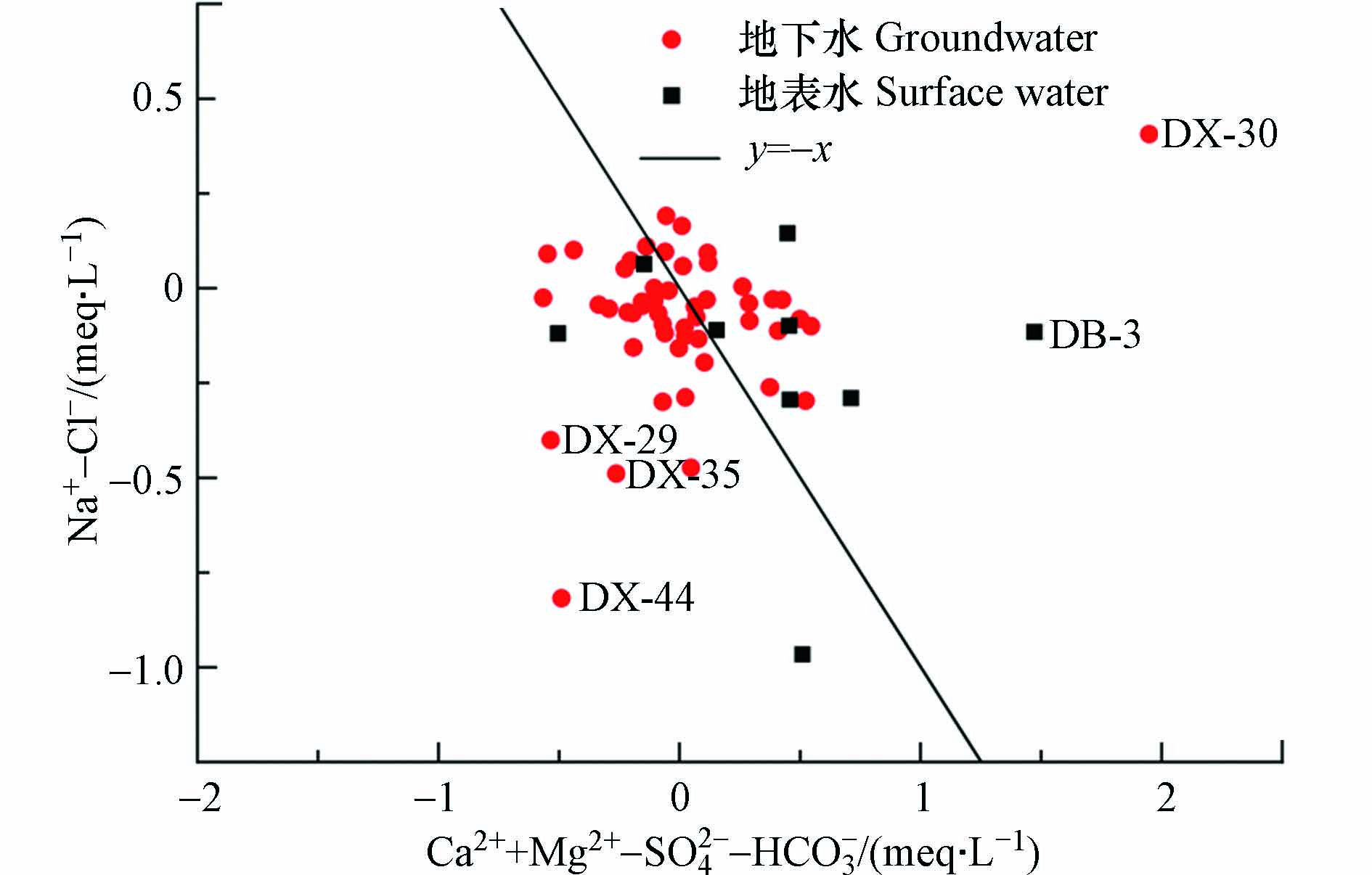
为进一步查明阳离子交替吸附作用对各水点水化学成分的影响,运用(Ca2++Mg2+)-(HCO3−+SO42−)与(Na+-Cl−)的毫克当量浓度关系揭示阳离子交替吸附作用的过程[36 − 37]. 据图8,研究区浅层地下水与地表水均大都处于1∶-1等值线的两侧,说明水文地球化学过程中阳离子交替吸附作用是控制地下水和地表水水化学的主要机制. 水样点DB-3和DX-30在1∶-1等值线右上方,是由于其Ca2+和Mg2+除来自于碳酸盐岩、硅酸盐岩和蒸发盐岩的溶解外,还有阳离子交替吸附和人类活动的影响[35],与图7结果一致. 部分水样点(DX-29、DX-35、DX-44)偏离1∶-1等值线位于左下方,说明Ca2+和Mg2+相较于SO42−处于贫化状态,且地下水中SO42−含量也较高,需要进一步探讨.
为此,利用(Ca2++Mg2+)-HCO3−与SO42−-Na++Cl−的毫克当量比值进一步分析SO42−来源[20]. (Ca2++Mg2+)-HCO3−代表水体中石膏溶解产生的Ca2+浓度,SO42−-Na++Cl−代表石膏溶解产生的SO42−浓度. 图9显示研究区大部分水样点均处于1∶1等值线两侧,表明水体中SO42−主要来自于石膏的溶解. 部分点位于1∶1等值线上方,如DB-3和DX-30,结合前期的分析结果(图7、图8),主要是地下水受到了水泥生产等人为因素的影响所致. 还有部分点处于直线较下方(DB-7、DX-29、DX-35、DX-44等),水点主要位于居民生活区,附近人类活动特征显著,如养殖、厕所等,且这些点的Cl−和SO42−呈现同步分布趋势,结合主成分分析推断,这部分水点也归因于人为污染的影响[38]. 因此,研究区地表水和地下水中SO42−主要受到石膏溶解和人为因素的控制.
2.3.3 人为因素的影响
自然状态下NO3−的环境本底浓度较低,NO3−是反应人类活动的特征离子[39],多来自于农业活动中化肥和农药的使用以及粪便和生活污水的排放[28]. 由表1可知,研究区域浅层地下水NO3−的浓度介于0—27.08 mg·L−1之间,平均值为8.06 mg·L−1,标准差为6.94‰,部分水点超过WHO的饮用水推荐值(20 mg·L−1);地表水NO3−的浓度介于0—33.66 mg·L−1之间,平均值为6.45 mg·L−1,标准差为9.83‰,10%的样品NO3−浓度超过20 mg·L−1. 主成分分析结果表明Cl−、SO42−和NO3−具有共同的人为污染来源(表2). 此外,研究区附近常年有居民居住,显然人为污染是研究区地表水和地下水水化学组成的另一重要影响因素.
[NO3−/Cl−]与[Cl−]及[SO42−/Ca2+]与[NO3−/Na+]的浓度关系常被用来判断NO3−的来源[21 − 22]. 如图10所示,地下水和地表水的[NO3−/Cl−]及[NO3−/Na+]大都大于0.5,而[Cl−]和[SO42−/Ca2+]则大都小于0.5,表明研究区内地下水和地表水中NO3−大部分来自于农业活动,少部分来自于工业活动、粪便和生活污水,与以往研究结果一致[40]. 调查发现,赣州市农村年氮肥使用量为265271 t,复合肥使用量为288906 t,均位于全省第一,磷肥使用量是131062 t,农药使用量达15444 t,也均位于全省前列. 随着化肥、农药的大量使用,农业污染是造成地下水NO3−污染的重要因素[41]. 野外调查也发现周边山体存在大量养殖场和果树,进一步证明了研究区地下水中NO3−主要来源于上游农业和养殖业受污染的水[42].
2.3.4 正向演替模型
为了量化大气输入、人类活动以及岩石风化(碳酸盐岩、硅酸盐岩和蒸发盐岩)对地下水水化学组分的相对贡献,采用正向演替模型分析各因素的主控作用[23]. Chetelat等[43]提出硅酸盐提供的Mg2+与Na+物质的量比值介于0.15—0.25之间,蒸发盐岩提供的Ca2+与Na+和Mg2+与Na+的比值分别介于0.15—5和0.01—0.5之间. Li等[24]认为蒸发盐岩风化末端构件的Na+/Cl−及SO42−/Ca2+的物质的量比均为1,Ca2+/Na+及Mg2+/K+则介于0.17—0.84和0.11—0.88之间. Gaillardet等[44]提出蒸发盐岩风化末端构件的HCO3−/Na+的物质的量比介于1—3之间. 根据上述相关文献,可知硅酸盐贡献各离子的比例关系为K+∶Ca2+∶Na+∶Mg2+∶HCO3−=2∶2∶5∶1∶12.5,蒸发盐贡献各离子的比例为SO42−∶Ca2+∶Mg2+∶Na+∶Cl−=15∶15∶9∶100∶100. 利用质量守恒计算出大气输入、人类活动以及岩石风化中各离子组成浓度,结果表明,大气输入、人类活动和岩石风化的相对贡献平均值分别为12.50%±7.75%、8.76%±4.94%以及78.74%±10.92%,说明岩石风化是该岩溶区浅层地下水成分的主要来源,与前文利用Gibbs模型判断地下水水化学组成来源的结果一致. 在岩石风化中碳酸盐岩、硅酸盐岩和蒸发盐岩的贡献平均值分别为67.64%±13.97%、7.33%±7.90%以及3.77%±3.62%,说明碳酸盐岩风化对地下水成分的贡献最大,硅酸盐岩与蒸发盐岩对于地下水成分的贡献较小. 前人研究也显示岩溶地下水化学组成主要受碳酸盐风化作用的影响,硅酸盐岩与蒸发盐岩的控制作用较弱[45 − 46],与本文研究结果吻合.
结合Mg2+/Ca2+和Na+/Ca2+的物质的量比值关系(图6B)可知,碳酸盐岩中的白云岩和灰岩对地下水成分贡献较大. 采用三端元混合模型,定量计算白云岩和灰岩对地下水化学组成来源的贡献率. 如表4所示,灰岩对研究区碳酸盐的贡献最大,平均贡献率达60.33%,白云岩平均贡献率达29.76%,硅酸盐平均贡献率仅有9.91%,表明岩溶区地下水化学组成主要受以灰岩和白云岩为主的碳酸盐岩溶解的控制. 通过本次研究,初步查明研究区浅层地下水的形成机制,揭示了研究区地下水的水质状况,为解决赣南岩溶区缺水问题提供了科学依据.
表 4 灰岩、白云岩和硅酸盐岩对地下水化学组成来源贡献率Table 4. Contribution rate of limestone, dolomite and silicate rock to chemical composition of groundwater类型Type 指标Index 不同来源平均贡献率/%Contribution rate of different sources/% 石灰岩Limestone 白云岩Dolomite 硅酸盐岩Carbonate rocks 碳酸盐岩 平均值 60.33 29.76 9.91 最大值 100.00 100.00 39.60 最小值 ND. ND ND. 标准差 1.56 1.58 0.10 3. 结论(Conclusion)
(1)研究区浅层地下水整体上呈弱碱性,阴离子浓度表现为HCO3−>Cl−>NO3−>SO42−,HCO3− 占总阴离子浓度的79.5%,阳离子浓度表现为Ca2+>Mg2+>Na+>K+,Ca2+占总阳离子浓度的72.9%,水化学类型以HCO3-Ca型为主.
(2)地下水氢氧稳定同位素分布在当地大气降水线附近,指示地下水主要受大气降水补给,且发生地表水和地下水的交互作用.
(3)地下水水化学组成来源的主控因素是岩石风化和人类活动,其中Ca2+、Mg2+以及HCO3−主要来源于碳酸盐、硅酸盐和蒸发盐的溶解,其次为阳离子交替吸附作用或人类活动的控制,Cl−、SO42−及NO3−反映了农业活动、工业活动、粪便和生活污水等人为因素的影响,Na+、K+主要来源于硅酸盐溶解.
(4)通过正向演替模型可知,岩石风化对地下水成分的平均贡献为78.74%,大气输入和人类活动相对较小,分别占12.50%和8.76%. 在岩石风化中碳酸盐岩所占贡献最大(平均值67.64%),硅酸盐岩(平均值7.33%)与蒸发盐岩(平均值3.77%)对于地下水成分的贡献较小;其中碳酸盐岩中灰岩的贡献最大,平均贡献率达60.33%,其次为白云岩,平均贡献率达29.76%.
-
表 1 几种常见塑料的理化特性
Table 1. The physical and chemical properties of several common plastics
塑料类型Plastic type 密度/ (g·cm−3)Density 接触角/(°)Contact angle 结晶度/%Crystallinity 玻璃化转变温度/℃Glass transition temperature (N+O)/C原子比Atomic ratio H/C原子比Atomic ratio 低密度聚乙烯(LDPE) 0.91—0.93 95.6±3.2[26] 55—65 −125 — 2.0 高密度聚乙烯(HDPE) 0.92—0.97 85.8±3.8[26] 80—95 −125 — 2.0 聚丙烯(PP) 0.90—0.91 106.3±2.3[26] 38.4 −10 — 2.0 聚苯乙烯(PS) 1.04—1.07 95.7±1.4[26] 3.7 100 0.02 1.0 聚碳酸酯(PC) 1.20 74.4±2.0[26] 16.2 145—150 0.13 1.1 聚酰胺(PA) 1.04—1.14 70.9±6.6[26] 30—40 55 0.33 1.8 聚氯乙烯(PVC) 1.35—1.45 73.32[27] 5—10 75—85 — 1.50 聚甲基丙烯酸甲酯(PMMA) 1.17—1.20 80.1±1.9[26] 6.1 104 0.40 1.60 聚对苯二甲酸乙二醇酯(PET) 1.37—1.38 74.03[27] 0.5 80—120 0.40 0.80 聚氨酯(PU) 1.045 96±2.2[28] — −17.1 0.384 2.01 聚丁二酸丁二醇酯(PBS) 1.26 119.4[29] 30—45 −33.8 0.444 1.75 注:表中数据来自PubChem数据库、摩贝化学平台、《高分子材料概论》及标注的文献. Note: The data in the table are taken from PubChem database, Mobei chemistry platform, Introduction to Polymer Materials Book, and annotated literature. 表 2 不同环境因子对有机污染物在微塑料上的吸附的影响及作用机理
Table 2. The effects and mechanisms of different environmental factors on the sorption of organic pollutants on microplastics
环境因子Environmental factors 微塑料Microplastics 有机污染物Organic pollutants 主要吸附机理Main sorption mechanism 影响结果Results 类型(粒径)Type( Particle size) 类型(浓度)Type(Concentration) pH PE (150 μm)PS (250 µm)PVC (230 μm) PFOS、FOSA(5—50 µg·L−1) 分配作用 pH:3.0—7.0,PFOS的吸附量随pH下降逐渐上升,对FOSA无影响[51] PE (150 μm) SMX(0.2—5 mg·L−1) 分配作用范德华力 pH:2.0—12.0,pH对吸附无明显影响[71] PE (150 μm)PP、PS (<280 mm) TC(0.2—5 mg·L−1) 静电作用 pH:2.0—12.0,吸附量先上升后下降,6.0时达到峰值[52] PE、PP、PS、PVC(<75 μm) TYL (1—30 mg·L−1) 静电作用 疏水作用 pH:3.0—7.0,吸附量随pH升高逐渐下降[50] PS (2、10、100 μm) HEX、MYC、TRI (100 µg·L−1) 静电作用 疏水作用 pH:3.0—11.0,吸附量随pH升高逐渐上升[70] PE、PP、PS、PC、PMMA、PA、PVC (>250 μm或<75 μm) E2 (500 ng·L−1—500 µg·L−1) 疏水作用 吸附量与微塑料的疏水性呈正相关[26] PE、PS、PVC(<75 μm) DEP、DBP (0.4—10 mg·L−1) 疏水作用 pH:5.5—8.5,pH对吸附无明显影响[82] PE、PET、PS、PP、PA、PVC、PU、PMMA (NA) BPA (100 µg·L−1) 静电作用 pH:2.8—11.0,吸附量随pH升高逐渐上升[55] PE、PVC (200—250 μm) DDT、PHE、DEHP(0.6—6.1 µg·L−1) 疏水作用 pH:7.5—8.4,吸附量随pH升高逐渐上升[68] PE、PP、PS、PA (4 mm) PBDEs (0.2—1 µg·L−1) 静电作用 pH:1.0—13.0,pH对吸附无明显影响[72] PE、PP、PET、PS、PVC、PA (100—150 μm) SMX (0—12 mg·L−1) 静电作用 pH:3.0—9.0,吸附量随pH升高逐渐下降[69] 温度 PE、PVC (≤0.15 mm) SM (1 mg·L−1) 疏水作用 温度:5—30 ℃,吸附量随温度的升高先下降后上升再下降[11] PS (75.4—214.6 μm) TCS (1—12 mg·L−1) 疏水作用 静电作用 温度:15—45 ℃,温度对吸附无明显影响影响[65] PE、PVC (200—250 μm) DDT、PHE、DEHP(0.6—6.1 µg·L−1) 疏水作用 温度:18—38 ℃,高温条件抑制吸附[68] PP (0.45—0.85 mm) SM (5 µg·L−1) 范德华力 温度:5—30 ℃,高温条件抑制吸附[64] PP (0.18—5.0 mm) PCB (0.2 mg·L−1) 离子交换 温度:4—32 ℃,高温条件抑制吸附[41] PP (0.45—0.85 mm) TBC (10 µg·L−1)HBCDs (2 µg·L−1) 离子交换 温度:5—45 ℃,随温度升高,吸附量先上升后下降[83] 盐度 PE、PP、PS、PA、PVC(75—180 µm) SDZ、AMX、TC、CIP、TMP (0.5—15 mg·L−1) 静电作用疏水作用范德华力氢键 高离子强度抑制吸附[36] PE (150 μm)、 PP、PS (<280 mm) TC (0.2—5.0 mg·L−1) 静电作用 盐度:0.05%—3.5%,盐度对吸附无明显影响[52] PS (2、10、100 μm) HEX、MYC、TRI (100 µg·L−1) 静电作用 疏水作用 盐度:0—50 mmol·L−1,高盐度促进吸附[70] PE、PP、PS、PVC(<75 μm) TYL (1—30 mg·L−1) 静电作用疏水作用 盐度:0—0.1 mol·L−1,随着盐度升高,吸附量先上升后下降[50] PS (75.4—214.6 μm) TCS (1—12 mg·L−1) 静电作用 疏水作用 盐度:0.001 mol·L−1—0.1 mol·L−1,盐度对吸附无明显影响[65] 盐度 PE、PVC (≤0.15 mm) SM (1 mg·L−1) 疏水作用 盐度:1%—21%,随着盐度升高,吸附量先上升后下降再上升[11] PE、PP、PS、PC、PMMA、PA、PVC (>250 μm、<75 μm) E2 (500 ng·L−1—500 µg·L−1) 疏水作用 盐度:0.05%—3.5%,高盐度促进吸附[26] PE、PS、PVC (<75 μm) DEP、DBP(0.4—10 mg·L−1) 疏水作用 盐度:0—0.3 mol·L−1,高盐度促进吸附[82] PE (150 μm)、PS (250 μm)、PVC (230 μm) PFOS、FOSA(5—50 µg·L−1) 疏水作用 盐度:0—1 mol·L−1,高盐度促进对PFOS的吸附,对FOSA无影响[51] PP (0.45—0.85 mm) SM (5 µg·L−1) 离子交换 盐度:1%—21%,盐度对吸附无明显影响[64] PE、PP、PS、PA(4 mm) PBDEs (0.2—1 µg·L−1) 静电作用 盐度:0—3.5%,盐度对吸附无明显影响[72] PEc (2.0—3.3 mm)、PEv (400 µm)、PS (250 μm)、PBAT (1.9—2.8 μm) PHE(178.4—623.7 µg·L−1) 疏水作用 盐度:0—35‰,高盐度促进吸附[67] PE (150 μm) SMX (0.2—5 mg·L−1) 分配作用范德华力 盐度:0.05%—3.5%,盐度对吸附无明显影响[71] PE、PET、PS、PP、PA、PVC、PU、PMMA (NA) BPA (10 µg·L−1) 氢键 盐度:12‰—35‰,高盐度促进吸附[55] PE、PP、PET、PA、PET、PVC(100—150 μm) SMX (0—12 mg·L−1) 静电作用 盐度:0—35‰,高盐度抑制吸附[69] PP (0.45—0.85 mm) TBC (10 µg·L−1)HBCDs (2 µg·L−1) 离子交换 盐度:0—24.5%,随盐度升高,吸附量先上升后下降[83] 溶解性有机质(DOM) PE、PP、PS、PC、PMMA、PA、PVC(>250 μm或<75 μm) E2 (500 ng·L−1—500 µg·L−1) 疏水作用 高DOM含量抑制吸附[26] PE (150 μm)、PP、PS (<280 mm) TC (0.2—5 mg·L−1) 疏水作用 静电作用 DOM抑制吸附[52] PE、PS、PVC (<75 μm) DEP、DBP(0.4—10 mg·L−1) 疏水作用 DOM对吸附无显著影响[82] PEc (2.0—3.3 mm)、PEv (400 μm)、PS (250 μm)、PBAT (1.9—2.8 μm) PHE(178.4—623.7 µg·L−1) 疏水作用 高DOM含量抑制吸附[67] PE (150 μm) SMX(0.2—5 mg·L−1) 分配作用范德华力 DOM对吸附无显著影响[71] PE、PET、PS、PP、PA、PVC、PU、PMMA (NA) BPA(100—200 µg·L−1) 静电作用 BPA/DOM复合物的形成促进BPA的溶解,吸附能力降低[55] PE、PP、PS、PA (4 mm) PBDEs(0.2—1 µg·L−1) 静电作用 DOM对吸附有轻微抑制[72] PE (250—280 μm) EE2、TCS(100 µg·L−1) 疏水作用 DOM抑制吸附[66] 注:表格中的缩写:PE:聚乙烯;PP:聚丙烯;PS:聚苯乙烯; PVC:聚氯乙烯; PA:聚酰胺; PU:聚氨酯; PET:聚对苯二甲酸乙二醇酯; PMMA:聚甲基丙烯酸甲酯; PBAT:对苯二甲酸丁二酯; PEc:可降解聚乙烯; PEv:聚乙烯粉; DOM:溶解性有机质; TC:四环素; TYL:泰乐菌素; HEX:乙唑醇; MYC:腈菌唑; TRI:三唑醇; E2:17β-雌二醇; PFOS:全氟辛烷磺酸盐; FOSA:全氟辛烷磺酰胺; DEP:邻苯二甲酸二乙酯; DBP:邻苯二甲酸二丁酯; BPA:双酚A; DDT:有机氯农药; PHE:菲; DEHP:邻苯二甲酸酯; PBDEs:多溴联苯醚; SMX: 磺胺甲噁唑; SM:合成麝香; TCS:三氯生; PCB:多氯联苯; TBC:三(2,3-二溴丙基)异氰脲酸盐; HBCDs:六溴环十二烷; SDZ:磺胺嘧啶; AMX:阿莫西林; CIP:环丙沙星; TMP:甲氧苄啶; EE2:17α-乙炔雌二醇;NA:无法获得. Note:Abbreviations in the table: PE: polyethylene; PP: polypropylene; PS: polystyrene; PVC: polyvinyl chloride; PA: polyamide; PU: polyurethane; PET: polyethylene terephthalate; PMMA: Polymethyl methacrylate; PBAT: Butylene terephthalate; PEc: degradable polyethylene; PEv: polyethylene powder; DOM: soluble organic matter; TC: tetracycline; TYL: tylosin; HEX: B Conazole; MYC: Myclobutanol; TRI: Triadimenol; E2: 17β-estradiol; PFOS: Perfluorooctane Sulfonate; FOSA: Perfluorooctane Sulfonamide; DEP: Diethyl Phthalate Esters; DBP: dibutyl phthalate; BPA: bisphenol A; DDT: organochlorine pesticides; PHE: phenanthrene; DEHP: phthalates; PBDEs: polybrominated diphenyl ethers; SMX: sulfamethoxazole; SM : Synthetic musk; TCS: triclosan; PCB: polychlorinated biphenyls; TBC: tris(2,3-dibromopropyl) isocyanurate; HBCDs: hexabromocyclododecane; SDZ: sulfadiazine; AMX: Amoxicillin; CIP: Ciprofloxacin; TMP: Trimethoprim; EE2: 17α-ethinyl estradiol; NA: not available. -
[1] RICHARD C T, YLVA O, RICHARD P M, et al. Lost at sea: Where is all the plastic? [J]. Science, 2004, 304: 838. doi: 10.1126/science.1094559 [2] YU Q, HU X J, YANG B, et al. Distribution, abundance and risks of microplastics in the environment [J]. Chemosphere, 2020, 249: 126059. doi: 10.1016/j.chemosphere.2020.126059 [3] AUTA H S, EMENIKE C U, FAUZIAH S H. Distribution and importance of microplastics in the marine environment: A review of the sources, fate, effects, and potential solutions [J]. Environment International, 2017, 102: 165-176. doi: 10.1016/j.envint.2017.02.013 [4] CHEN Q Q, REISSER J, CUNSOLO S, et al. Pollutants in plastics within the North Pacific Subtropical Gyre [J]. Environmental Science & Technology, 2017, 52(2): 446-456. [5] LEBRETON L, SLAT B, FERRARI F F, et al. Evidence that the Great Pacific Garbage Patch is rapidly accumulating plastic [J]. Scientific Reports, 2018, 8(1): 4666. doi: 10.1038/s41598-018-22939-w [6] BERGMANN M, SOPHIA M, PRIMPKE S, et al. White and wonderful? Microplastics prevail in snow from the Alps to the Arctic [J]. Science Advances, 2019, 5: 1157. doi: 10.1126/sciadv.aax1157 [7] KOELMANS A A, NOR N H M, HERMSEN E, et al. Microplastics in freshwaters and drinking water: Critical review and assessment of data quality [J]. Water Research, 2019, 155: 410-422. doi: 10.1016/j.watres.2019.02.054 [8] JAMBECK J R, GEYER R, WILCOX C, et al. Plastic waste inputs from land into the ocean [J]. Science, 2015, 347(6223): 768-771. doi: 10.1126/science.1260352 [9] ERNI-CASSOLA G, ZADJELOVIC V, GIBSON M I, et al. Distribution of plastic polymer types in the marine environment; A meta-analysis [J]. Journal of Hazardous Materials, 2019, 369: 691-698. doi: 10.1016/j.jhazmat.2019.02.067 [10] ARTHUR C, BAKER J, BAMFORD H, et al. Summary of the international research workshop on the occurrence, effects, and fate of microplastic marine debris [R]. Department of Commerce: National Oceanic and Atmospheric Administration. Technocal Memorandum NOS-OR&R-30. 2009. [11] DONG X F, ZHENG M G, QU L Y, et al. Sorption of tonalide, musk xylene, galaxolide, and musk ketone by microplastics of polyethylene and polyvinyl chloride [J]. Marine Pollution Bulletin, 2019, 144: 129-133. doi: 10.1016/j.marpolbul.2019.04.046 [12] WRIGHT S L, ROWE D, THOMPSON R C, et al. Microplastic ingestion decreases energy reserves in marine worms [J]. Current Biology, 2013, 23(23): R1031-R1033. doi: 10.1016/j.cub.2013.10.068 [13] BROWNE M A, NIVEN S J, GALLOWAY T S, et al. Microplastic moves pollutants and additives to worms, reducing functions linked to health and biodiversity [J]. Current Biology, 2013, 23(23): 2388-2392. doi: 10.1016/j.cub.2013.10.012 [14] BIHANIC F L, CLÉRANDEAU C, CORMIER B, et al. Organic contaminants sorbed to microplastics affect marine medaka fish early life stages development [J]. Marine Pollution Bulletin, 2020, 154: 111059. doi: 10.1016/j.marpolbul.2020.111059 [15] PEREZ-LOBATO R, MUSTIELES V, CALVENTE I, et al. Exposure to bisphenol A and behavior in school-age children [J]. NeuroToxicology, 2016, 53: 12-19. doi: 10.1016/j.neuro.2015.12.001 [16] HAL N V D, YERUHAM E, SHUKIS D, et al. Uptake and incorporation of PCBs by eastern Mediterranean rabbitfish that consumed microplastics [J]. Marine Pollution Bulletin, 2020, 150: 110697. doi: 10.1016/j.marpolbul.2019.110697 [17] PAULINE P, JEROME C, CHRISTELLE C, et al. Toxicity assessment of pollutants sorbed on environmental sample microplastics collected on beaches: Part Ⅰ-adverse effects on fish cell line [J]. Environmental Pollution, 2019, 248: 1088-1097. doi: 10.1016/j.envpol.2018.12.091 [18] XIA B, ZHANG J, ZHAO X G, et al. Polystyrene microplastics increase uptake, elimination and cytotoxicity of decabromodiphenyl ether (BDE-209) in the marine scallop Chlamys farreri [J]. Environmental Pollution, 2020, 258: 113657. doi: 10.1016/j.envpol.2019.113657 [19] MATTSSON K, HANSSON L A, CEDERVALL T. Nano-plastics in the aquatic environment [J]. Environmental Science Processes & Impacts, 2015, 17: 1712-1721. [20] WANG W F, WANG J. Comparative evaluation of sorption kinetics and isotherms of pyrene onto microplastics [J]. Chemosphere, 2018, 193: 567-573. doi: 10.1016/j.chemosphere.2017.11.078 [21] WANG J, LIU X H, LIU G N, et al. Size effect of polystyrene microplastics on sorption of phenanthrene and nitrobenzene [J]. Ecotoxicology and Environmental Safety, 2019, 173: 331-338. doi: 10.1016/j.ecoenv.2019.02.037 [22] HALE S E, CORNELISSEN G, ARP H P H. Comment on "partition coefficients of organic contaminants with carbohydrates" [J]. Environmental Science & Technology, 2011, 45(3): 1158. [23] ROCHMAN C M, HOH E, HENTSCHEL B T, et al. Long-term field measurement of sorption of organic contaminants to five types of plastic pellets: Implications for plastic marine debris [J]. Environmental Science & Technology, 2013, 47(3): 1646-1654. [24] TERZYK A P, GAUDEN P A, FURMANIAK S, et al. Molecular dynamics simulation insight into the mechanism of phenol adsorption at low coverages from aqueous solutions on microporous carbons [J]. Physical Chemistry Chemical Physics, 2010, 12(4): 812-817. doi: 10.1039/B919794J [25] ROCHMAN C M, MANZANO C, HENTSCHEL B T, et al. Polystyrene plastic: A source and sink for polycyclic aromatic hydrocarbons in the marine environment [J]. Environmental Science & Technology, 2013, 47(24): 13976-13984. [26] LIU X M, XU J, ZHAO Y P, et al. Hydrophobic sorption behaviors of 17β-Estradiol on environmental microplastics [J]. Chemosphere, 2019, 226: 726-735. doi: 10.1016/j.chemosphere.2019.03.162 [27] 彭盼盼, 杨建军, 吴庆云, 等. 硅基和氨酯基协同改性水性丙烯酸树脂的制备与性能 [J]. 精细化工, 2020, 37: 1710-1715. PENG P P, YANG J J, WU Q Y, et al. Preparation and properties of waterborne acrylic resin synergistic modification by silicon and polyurethane groups [J]. Fine Chemicals, 2020, 37: 1710-1715(in Chinese).
[28] RAZANAJATOVO R M, DING J N, ZHANG S S, et al. Sorption and desorption of selected pharmaceuticals by polyethylene microplastics [J]. Marine Pollution Bulletin, 2018, 136: 516-523. doi: 10.1016/j.marpolbul.2018.09.048 [29] 王晖, 顾帼华, 邱冠周. 接触角法测量高分子材料的表面能 [J]. 中南大学学报, 2006, 37(5): 942-947. WANG H, GU G H, QIU G Z. Evaluation of surface free energy of polymers by contact angle goniometry [J]. Journal of Central South University, 2006, 37(5): 942-947(in Chinese).
[30] YUKIE M, TOMOHIKO I, HIDESHIGE T, et al. Plastic resin pellets as a transport medium for toxic chemicals in the marine environment [J]. Environmental Science & Technology, 2001, 35(2): 318-324. [31] JENNY W, MOHAMMED B, TOMAS R, et al. Additives and other hazardous compounds in electronic products and their waste [M]. 2011. The Handbook of Environmental Chemistry, vol 18: Global Risk-Based Management of Chemical Additives I: Production, Usage and Environmental Occurrence. [32] ROCHMAN C M, HOH E, KUROBE T, et al. Ingested plastic transfers hazardous chemicals to fish and induces hepatic stress [J]. Scientific Reports, 2013, 3(1): 3263. doi: 10.1038/srep03263 [33] RIOS M L M, R J P. Characterisation of microplastics and toxic chemicals extracted from microplastic samples from the North Pacific Gyre [J]. Environmental Chemistry, 2015, 12(5): 611-617. doi: 10.1071/EN14236 [34] BRENNECKE D, DUARTE B, PAIVA F, et al. Microplastics as vector for heavy metal contamination from the marine environment [J]. Estuarine, Coastal and Shelf Science, 2016, 178: 189-195. doi: 10.1016/j.ecss.2015.12.003 [35] WANG W F, WANG J. Different partition of polycyclic aromatic hydrocarbon on environmental particulates in freshwater: Microplastics in comparison to natural sediment [J]. Ecotoxicology and Environmental Safety, 2017, 147: 648-655. [36] ZHANG J, HUA K N. Adsorption of antibiotics on microplastics [J]. Environmental Pollution, 2018, 237: 460-467. doi: 10.1016/j.envpol.2018.02.050 [37] WANG Z, CHEN M L, ZHANG L W. Sorption behaviors of phenanthrene on the microplastics identified in a mariculture farm in Xiangshan Bay, southeastern China [J]. Science of the Total Environment, 2018, 628–629: 1617-1626. [38] CHIOU C T, FREED V H, SCHMEDDING D W, et al. Partition coefficient and bioaccumulation of selected organic chemicals [J]. Environmental Science & Technology, 1977, 11(5): 475-478. [39] 李晓娜, 宋洋, 贾明云, 等. 生物质炭对有机污染物的吸附及机理研究进展 [J]. 土壤学报, 2017, 54(6): 1313-1325. LI X N, SONG Y, JIA M Y, et al. A review of researches on biochar adsorbing organic contaminants and its mechanism [J]. Acta Pedologica Sinica, 2017, 54(6): 1313-1325(in Chinese).
[40] HWANG L, JOON S W, HWAN K J. Sorption capacity of plastic debris for hydrophobic organic chemicals [J]. Science of the Total Environment, 2014, 470-471: 1545-1552. doi: 10.1016/j.scitotenv.2013.08.023 [41] ZHAN Z W, WANG J D, PENG J P, et al. Sorption of 3,3',4,4'-tetrachlorobiphenyl by microplastics: A case study of polypropylene [J]. Marine Pollution Bulletin, 2016, 110(1): 559-563. doi: 10.1016/j.marpolbul.2016.05.036 [42] HUANG W H, CHEN B L. Interaction mechanisms of organic contaminants with burned straw ash charcoal [J]. Journal of Environmental Sciences, 2010, 22(10): 1586-1594. doi: 10.1016/S1001-0742(09)60293-X [43] ZHANG P, HUANG P, SUN H W, et al. The structure of agricultural microplastics (PT, PU and UF) and their sorption capacities for PAHs and PHE derivates under various salinity and oxidation treatments [J]. Environmental Pollution, 2020, 257: 113525. doi: 10.1016/j.envpol.2019.113525 [44] 王菲, 孙红文. 生物炭对极性与非极性有机污染物的吸附机理 [J]. 环境化学, 2016, 35(6): 1134-1141. doi: 10.7524/j.issn.0254-6108.2016.06.2015122404 WANG F, SUN H W. Sorption mechanisms of polar and apolar organic contaminants onto biochars [J]. Environmental Chemistry, 2016, 35(6): 1134-1141(in Chinese). doi: 10.7524/j.issn.0254-6108.2016.06.2015122404
[45] LI Z W, HU X L, QIN L X, et al. Evaluating the effect of different modified microplastics on the availability of polycyclic aromatic hydrocarbons [J]. Water Research, 2019, 170: 115290. [46] DABROWSKI A. Adsorption-from theory to practice [J]. Advances in Colloid and Interface Science, 2001, 93(1-3): 135-224. doi: 10.1016/S0001-8686(00)00082-8 [47] WU P F, CAI Z W, JIN H B, et al. Adsorption mechanisms of five bisphenol analogues on PVC microplastics [J]. Science of the Total Environment, 2018, 650: 671-678. [48] VELEZ J F M, SHASHOU Y, SYBERG K, et al. Considerations on the use of equilibrium models for the characterisation of HOC-microplastic interactions in vector studies [J]. Chemosphere, 2018, 210: 359-365. doi: 10.1016/j.chemosphere.2018.07.020 [49] BAKIR A, ROWLAND S J, THOMPSON R C. Competitive sorption of persistent organic pollutants onto microplastics in the marine environment [J]. Marine Pollution Bulletin, 2012, 64(12): 2782-2789. doi: 10.1016/j.marpolbul.2012.09.010 [50] GUO X T, PANG J W, CHEN S Y, et al. Sorption properties of tylosin on four different microplastics [J]. Chemosphere, 2018, 209: 240-245. doi: 10.1016/j.chemosphere.2018.06.100 [51] WANG F, SHIH K M, LI X Y. The partition behavior of perfluorooctanesulfonate (PFOS) and perfluorooctanesulfonamide (FOSA) on microplastics [J]. Chemosphere, 2015, 119: 841-847. doi: 10.1016/j.chemosphere.2014.08.047 [52] XU B L, LIU F, BROOKES P C, et al. Microplastics play a minor role in tetracycline sorption in the presence of dissolved organic matter [J]. Environmental Pollution, 2018, 240: 87-94. doi: 10.1016/j.envpol.2018.04.113 [53] ZHANG H B, WANG J Q, ZHOU B Y, et al. Enhanced adsorption of oxytetracycline to weathered microplastic polystyrene: Kinetics, isotherms and influencing factors [J]. Environmental Pollution, 2018, 243: 1550-1557. doi: 10.1016/j.envpol.2018.09.122 [54] NG H Y, ELIMELECH M. Influence of colloidal fouling on rejection of trace organic contaminants by reverse osmosis [J]. Journal of Membrane Science, 2004, 244(1-2): 215-226. doi: 10.1016/j.memsci.2004.06.054 [55] LIU X M, SHI H H, XIE B, et al. Microplastics as both a sink and a source of Bisphenol A in the marine environment [J]. Environmental Science & Technology, 2019, 53(17): 10188-10196. [56] ENDO S, DROGE S T J, GOSS K U. Polyparameter linear free energy models for polyacrylate fiber−water partition coefficients to evaluate the efficiency of solid-phase microextraction [J]. Analytical Chemistry, 2011, 83(4): 1394-1400. doi: 10.1021/ac102868e [57] LUDMILLA A, CLAIRE M, JOCELYNE M-B, et al. Interactions of oxytetracycline with a smectite clay: A spectroscopic study with molecular simulations [J]. Environmental Science & Technology, 2010, 44(20): 7839-7845. [58] HÜFFER T, HOFMANN T. Sorption of non-polar organic compounds by micro-sized plastic particles in aqueous solution [J]. Environmental Pollution, 2016, 214: 194-201. doi: 10.1016/j.envpol.2016.04.018 [59] MARC T, J P J, L B J, et al. Speciation of the ionizable antibiotic sulfamethazine on black carbon (biochar) [J]. Environmental Science & Technology, 2011, 45(23): 10020-10027. [60] KARANFIL T, KILDUFF J E. Role of granular activated carbon surface chemistry on the adsorption of organic compounds. 1. Priority Pollutants [J]. Environmental Science & Technology, 1999, 33(18): 3217-3224. [61] SATOSHI E, PETER G, C S T. Absorption or adsorption? Insights from molecular probes n-alkanes and cycloalkanes into modes of sorption by environmental solid matrices [J]. Environmental Science & Technology, 2008, 42(11): 3989-3995. [62] WEBER W J, HUANG W. A distributed reactivity model for sorption by soils and sediments. 4. Intraparticle heterogeneity and phase-distribution relationships under nonequilibrium conditions - Response [J]. Environmental Science & Technology, 1996, 30(10): 3130-3131. [63] 王宁, 侯艳伟, 彭静静, 等. 生物炭吸附有机污染物的研究进展 [J]. 环境化学, 2012, 31(3): 287-295. WANG N, HOU Y W, PENG J J, et al. Research progess on sorption of orgnic contaminants to biochar [J]. Environmental Chemistry, 2012, 31(3): 287-295(in Chinese).
[64] ZHANG X J, ZHENG M G, WANG L, et al. Sorption of three synthetic musks by microplastics [J]. Marine Pollution Bulletin, 2017, 126: 606-609. [65] LI Y D, LI M, LI Z, et al. Effects of particle size and solution chemistry on Triclosan sorption on polystyrene microplastic [J]. Chemosphere, 2019, 231: 308-314. doi: 10.1016/j.chemosphere.2019.05.116 [66] WU C X, ZHANG K, HUANG X L, et al. Sorption of pharmaceuticals and personal care products to polyethylene debris [J]. Environmental Science and Pollution Research, 2016, 23: 1-8. doi: 10.1007/s11356-015-5714-x [67] ZUO L Z, LI H X, LIN L, et al. Sorption and desorption of phenanthrene on biodegradable poly(butylene adipate co-terephtalate) microplastics [J]. Chemosphere, 2018, 215: 25-32. [68] ADIL B, J R S, C T R. Enhanced desorption of persistent organic pollutants from microplastics under simulated physiological conditions [J]. Environmental Pollution, 2014, 185: 16-23. doi: 10.1016/j.envpol.2013.10.007 [69] GUO X, CHEN C, WANG J L. Sorption of sulfamethoxazole onto six types of microplastics [J]. Chemosphere, 2019, 228: 300-308. doi: 10.1016/j.chemosphere.2019.04.155 [70] FANG S, YU W S, LI C L, et al. Adsorption behavior of three triazole fungicides on polystyrene microplastics [J]. Science of the Total Environment, 2019, 691: 1119-1126. doi: 10.1016/j.scitotenv.2019.07.176 [71] XU B L, LIU F, BROOKES P C, et al. The sorption kinetics and isotherms of sulfamethoxazole with polyethylene microplastics [J]. Marine Pollution Bulletin, 2018, 131: 191-196. doi: 10.1016/j.marpolbul.2018.04.027 [72] XU P C, GE W, CHAI C, et al. Sorption of polybrominated diphenyl ethers by microplastics [J]. Marine Pollution Bulletin, 2019, 145: 260-269. doi: 10.1016/j.marpolbul.2019.05.050 [73] PANDELOVA M, HENKELMANN B, BUSSIAN B M, et al. Results of the second national forest soil inventory in Germany - Interpretation of level and stock profiles for PCDD/F and PCB in terms of vegetation and humus type [J]. Science of the Total Environment, 2018, 610-611: 1-9. doi: 10.1016/j.scitotenv.2017.07.246 [74] 于艳新, 李奇, 王慧, 等. 食物中典型持久性有机污染物(POPs)的生物可给性研究综述 [J]. 生态环境学报, 2015, 24(8): 1406-1414. YU Y X, LI Q, WANG H, et al. The bioaccessibility of typical persistent organic pollutants (POPs) in food matrix: A review [J]. Ecology and Environment, 2015, 24(8): 1406-1414(in Chinese).
[75] HEINRICH P, BRAUNBECK T. Bioavailability of microplastic-bound pollutants in vitro: The role of adsorbate lipophilicity and surfactants [J]. Comparative Biochemistry and Physiology C-Toxicology & Pharmacology, 2019, 221: 59-67. [76] LIU G Z, ZHU Z L, YANG Y X, et al. Sorption behavior and mechanism of hydrophilic organic chemicals to virgin and aged microplastics in freshwater and seawater [J]. Environmental Pollution, 2018, 246: 26-33. [77] LIU P, QIAN L, WANG H Y, et al. New insights into the aging behavior of microplastics accelerated by advanced oxidation processes [J]. Environmental Science & Technology, 2019, 53(7): 3579-3588. [78] HÜFFER T, WENIGER A K, HOFMANN T. Sorption of organic compounds by aged polystyrene microplastic particles [J]. Environmental Pollution, 2018, 236: 218-225. doi: 10.1016/j.envpol.2018.01.022 [79] MÜLLER A, BECKER R, DORGERLOH U, et al. The effect of polymer aging on the uptake of fuel aromatics and ethers by microplastics [J]. Environmental Pollution, 2018, 240: 639-646. doi: 10.1016/j.envpol.2018.04.127 [80] ENDO S, TAKIZAWA R, OKUDA K, et al. Concentration of polychlorinated biphenyls (PCBs) in beached resin pellets: Variability among individual particles and regional differences [J]. Marine Pollution Bulletin, 2005, 50(10): 1103-1114. doi: 10.1016/j.marpolbul.2005.04.030 [81] DING L, MAO R F, MA S R, et al. High temperature depended on the ageing mechanism of microplastics under different environmental conditions and its effect on the distribution of organic pollutants [J]. Water Research, 2020, 174: 115634. doi: 10.1016/j.watres.2020.115634 [82] LIU F F, LIU G Z, ZHU Z L, et al. Interactions between microplastics and phthalate esters as affected by microplastics characteristics and solution chemistry [J]. Chemosphere, 2018, 214: 688-694. [83] LIU X W, ZHENG M G, WANG L, et al. Sorption behaviors of tris-(2, 3-dibromopropyl) isocyanurate and hexabromocyclododecanes on polypropylene microplastics [J]. Marine Pollution Bulletin, 2018, 135: 581-586. doi: 10.1016/j.marpolbul.2018.07.061 [84] 潘伟健, 康园. 环境介质中有机污染物生物有效性研究综述 [J]. 广东化工, 2020, 47(6): 147-148,134. doi: 10.3969/j.issn.1007-1865.2020.06.063 PAN W J, KANG Y. Review on the bioavailability of organic pollutants in environmental media [J]. Guangdong Chemical Industry, 2020, 47(6): 147-148,134(in Chinese). doi: 10.3969/j.issn.1007-1865.2020.06.063
[85] 张凯, 孙红文. (可降解)微塑料颗粒吸附有机污染物及对其生物有效性的影响 [J]. 环境化学, 2018, 37(3): 375-382. doi: 10.7524/j.issn.0254-6108.2018020509 ZHANG K, SUN H W. Adsorption of organic pollutants on (degradable) microplastics and the influences on their bioavailability [J]. Environmental Chemistry, 2018, 37(3): 375-382(in Chinese). doi: 10.7524/j.issn.0254-6108.2018020509
[86] YANG W F, GAO X X, WU Y X, et al. The combined toxicity influence of microplastics and nonylphenol on microalgae Chlorella pyrenoidosa [J]. Ecotoxicology and Environmental Safety, 2020, 195: 110484. doi: 10.1016/j.ecoenv.2020.110484 [87] ZHU Z L, WANG S C, ZHAO F F, et al. Joint toxicity of microplastics with triclosan to marine microalgae Skeletonema costatum [J]. Environmental Pollution, 2018, 246: 509-517. [88] GUO X Y, WANG X L, ZHOU X Z, et al. Sorption of four hydrophobic organic compounds by three chemically distinct polymers: Role of chemical and physical composition [J]. Environmental Science & Technology, 2012, 46(13): 7252-7259. [89] SUHRHOFF T J, SCHOLZ-BöTTCHER B M. Qualitative impact of salinity, UV radiation and turbulence on leaching of organic plastic additives from four common plastics - A lab experiment [J]. Marine Pollution Bulletin, 2016, 102(1): 84-94. doi: 10.1016/j.marpolbul.2015.11.054 [90] 杨婧婧, 徐笠, 陆安祥, 等. 环境中微(纳米)塑料的来源及毒理学研究进展 [J]. 环境化学, 2018, 37(3): 383-396. YANG J J, XU L, LU A Y, et al. Research progress on the sources and toxicology of micro (nano) plastics in environment [J]. Environmental Chemistry, 2018, 37(3): 383-396(in Chinese).
[91] CHEN Q Q, SANTOS M M D, TANABE P, et al. Bioassay guided analysis coupled with non-target chemical Screening in polyethylene plastic shopping bag fragments after exposure to simulated gastric juice of fish [J]. Journal of Hazardous Materials, 2020, 401: 123421. [92] COFFIN S, HUANG G Y, LEE I, et al. Fish and seabird gut conditions enhance desorption of estrogenic chemicals from commonly-ingested plastic items [J]. Environmental Science & Technology, 2019, 53: 4588-4599. [93] CORCORAN P L, NORRIS T, CECCANESE T, et al. Hidden plastics of Lake Ontario, Canada and their potential preservation in the sediment record [J]. Environmental Pollution, 2015, 204: 17-25. doi: 10.1016/j.envpol.2015.04.009 -






 下载:
下载: