-
土霉素(oxytetracycline, OTC)属于四环素类抗生素。由于其抗菌谱广、价格低廉,OTC被广泛用于治疗人类和动物疾病。此外,OTC还可作为饲料添加剂用于促进动物生长发育。2013年,我国OTC的用量为1360 t,其中约86%的OTC被用于畜牧养殖业[1]。OTC在生物体内的代谢率较低,大部分以母体的形式随排泄物排出体外。调查表明,畜禽粪肥中普遍含有OTC[2-3]。在我国传统农业模式下,残留的OTC将通过粪污还田进入农田土壤。Zhang等[4]调查发现,长期施用粪肥的菜地土壤中OTC的平均含量为397.6 μg·kg−1。该值超过了兽药国际协调委员会(VICH)提出的土壤抗生素生态毒害效应触发值(100 μg·kg−1),这对于土壤生态系统构成了潜在威胁。例如,OTC能杀死土壤中的部分微生物并干扰其在自然界物质循环中的作用;诱发产生OTC耐药细菌;沿食物链富集并毒害敏感性动植物等[5-7]。OTC造成的土壤环境污染及其生态毒害效应受到国际社会的广泛关注。
吸附是控制OTC在土壤-水界面转化的重要过程,它可以决定OTC的赋存形态,从而影响其在土壤中的迁移过程和生物有效性[8]。目前,关于OTC在土壤中吸附的研究已有大量报道[9-16]。这些研究表明,OTC主要通过疏水性分配、范德华力、离子交换、氢键、化学键、表面络合、孔道内扩散等吸附机制与土壤颗粒结合。OTC的吸附量与土壤理化性质密切相关,如粘土矿物含量高、有机质含量高、离子交换能力强的土壤对OTC的亲和力更强。此外,pH、离子强度、温度、共存离子和胶体等因素也会影响OTC在土壤中的吸附行为。上述研究成果为理解OTC在土壤中的环境行为提供了理论支撑。但是,现有的研究并没有考虑广泛存在于土壤中的微塑料对OTC吸附行为的影响。
微塑料是指“粒径小于5 mm的塑料类污染物”,它们广泛分布在海洋和陆地环境中[17-19]。其中,土壤是微塑料重要的长期储存库,每年排入土壤中的微塑料的量远大于海洋[20]。调查显示,在中国、澳大利亚、瑞士和智利的土壤中均可检测到微塑料,最高浓度为67.5 g·kg−1[21-24]。尽管目前关于国内农田土壤中微塑料污染调查的研究较少,但在采集的所有土壤样品中均可检测到微塑料,其最高丰度达到40000 N·kg−1[24-26]。这表明微塑料广泛存在于农田土壤中,且含量较高,是不应被忽视的一部分。
近期多项研究表明,微塑料可吸附水环境中的OTC。如张凯娜等[27]指出聚乙烯(PE)和聚苯乙烯(PS)微塑料可通过范德华力和微孔填充机制吸附OTC,且OTC的吸附量与盐度呈负相关;Zhang等[28]发现经过老化的PS对OTC的吸附量明显增强,主要吸附机制包括静电引力和氢键;此外,他们还指出腐殖酸能够促进PS对OTC的吸附。由于土壤颗粒与微塑料在理化性质上存在较大差异,二者对OTC的亲和力可能不同,当土壤受到微塑料污染时,其对OTC的吸附和固着能力可能受到较大影响。由此改变OTC的赋存形态及其迁移行为。
OTC在微塑料污染土壤中的吸附行为却未见报道,微塑料对于土壤吸附OTC的影响仍是未知的,这将限制人们准确评估土壤抗生素污染引发的毒性效应。鉴于此,本文选择土壤环境中常见的PE、PS和聚酰胺(PA)为典型微塑料[29-31],以壤土为供试土壤;基于批实验初步研究3种微塑料对OTC在土壤中吸附行为的影响,并探究其影响机制,以期为后续深入研究微塑料污染土壤中抗生素的关键运移过程及机制奠定基础。
-
OTC标准品(纯度≥98%)购自上海麦克林生化科技有限公司。甲醇(色谱纯)和乙腈(色谱纯)购自美国Tedia公司;实验用水为超纯水;无水氯化钙(分析纯)购自国药集团化学试剂有限公司;聚丙烯离心管(15 mL)购自美国Corning公司;针头过滤器(0.22 μm)购自天津津腾实验设备有限公司。
-
根据土壤质地,土壤一般分为砂质土、壤土和黏质土。其中,壤土的含沙量、粘土含量介于砂质土和黏质土之间。因此,本文选择土壤质地居中的壤土为供试土壤。在山东省烟台市某农田(121°25′34.12″E,37°35′9.56″N)通过对角线采样法采集表层土壤样品。将样品混匀后转移至实验室,冷冻干燥,用镊子挑出肉眼可辨的植物残体和沙砾;将剩余样品置于玛瑙研钵内研磨,过80目标准筛备用。供试土壤基本理化性质如表1所示。
本文选取广泛存在于土壤环境中的PE、PS和PA作为供试微塑料,3种微塑料样品均为白色粉末状,粒径<80目,购自上海阳励机电科技有限公司。利用60—300目的不锈钢标准土壤筛测量供试微塑料的粒径分布。利用扫描电镜(S-4800, 日本Hitachi公司)对微塑料表面形态进行表征。
-
高效液相色谱仪(Primaide,日本Hitachi公司)、水浴恒温振荡器(SHZ-GW,常州朗越仪器制造有限公司)、冷冻干燥机(FD-1A-50,北京博医康实验仪器有限公司)、分析天平(BSA224S,德国Sartorius集团)等。
-
本文参照OECD(No. 106)标准开展批实验,分别研究OTC在土壤、微塑料及含有微塑料土壤中的吸附行为。土壤中微塑料的添加比例(10%,质量分数) 和投加方法(直接混合并充分搅匀)参照Hüffer等[32]的报道进行设置。
-
称取(0.0500±0.0003) g土壤样品置于15 mL聚丙烯离心管中,或称取(0.0450±0.0003) g土壤样品和(0.0050±0.0002) g微塑料样品置于离心管中,用移液枪加入9.0 mL背景溶液(1.11 g·L−1 CaCl2),然后加入1.0 mLOTC工作液(100 mg·L−1)。拧紧瓶盖后,将离心管置于水浴恒温振荡器中,于25℃条件下振荡,转速设置为210 r·min−1。分别在1.0、1.5、3.0、6.0、18、24、48、72 h进行取样,样品经0.22 μm滤膜过滤后,装入棕色进样瓶中保存,立即用高效液相色谱仪进行分析。每组实验设置3个平行。
-
为研究OTC在土壤、微塑料、土壤和微塑料混合物上的等温吸附行为,分别称取(0.0500±0.0003) g土壤样品、(0.0500±0.0003) g微塑料样品、(0.0450±0.0003) g土壤样品和(0.0050±0.0002) g微塑料样品置于15 mL聚丙烯离心管中。将OTC的浓度梯度设置为1.0、5.0、10、15、20 mg·L−1,根据此浓度梯度,先用移液枪向离心管中加入适量背景溶液(1.11 g·L−1 CaCl2),然后加入OTC工作液(100 mg·L−1),使每个离心管中的溶液总体积为10 mL。拧紧瓶盖后,将离心管置于水浴恒温振荡器中,转速设置为210 r·min−1,于25℃条件下振荡。根据本文动力学吸附实验结果,OTC在土壤及微塑料和土壤混合物上的吸附时间设为24 h;根据文献报道[27-28],将OTC在微塑料上的吸附时间设为48 h。样品经0.22 μm滤膜过滤后,装入棕色进样瓶中保存,立即用高效液相色谱仪进行分析。每组实验设置3个平行。分别设置只添加吸附剂(即土壤或微塑料或土壤与微塑料的混合物)或只添加OTC溶液的空白实验作为对照,以确定吸附剂中有无OTC析出以及实验过程中OTC的降解情况。
-
溶液中的OTC利用高效液相色谱仪(Primaide, 日本Hitachi公司)进行检测。样品经WondaSil C18 Superb色谱柱(4.6 mm× 150 mm, 5.0 μm)进行分离。具体参数如下:流动相A为乙腈,流动相B体积分数为0.4%的乙酸溶液,二者的体积比为24:76;流速为1.0 mL·min−1;柱温设置为35℃,进样体积为20 μL;检测波长为355 nm。基于上述方法,OTC的保留时间为2.75 min,检出限为0.05 mg·L−1,标准曲线线性范围为0.2—20 mg·L−1 (R2>0.99)。
-
为了降低不同组别移液过程中产生的误差,本文在实验过程中采用称重法进行校准,利用公式(1)计算OTC的吸附量。
式中,qe(mg·kg−1)为平衡时OTC的吸附量;C(mg·L−1)为OTC工作液的浓度;Ce(mg·L−1)为平衡时OTC的浓度;ρ1和ρ2(g·mL−1)分别为背景溶液和OTC工作液的密度;m(g)是吸附剂的质量;m0(g)是吸附剂和反应容器的质量和;m1(g)是加入背景溶液后反应容器的总质量(即m1=m0+m背景溶液);m2(g)是加入OTC工作液后反应容器的总质量(即m2=m1+mOTC工作液);Δ(mg·kg−1)为空白损失量。
为了揭示OTC在不同吸附剂上的吸附动力学行为,本文分别利用准一级动力学模型、准二级动力学模型和颗粒内扩散模型对吸附动力学实验数据进行拟合。3个模型的表达式如下:
式中,qt(mg·g−1)和qe(mg·g−1)分别为t时刻和平衡时OTC的吸附量;k1(h−1)和k2(g·(mg·h)−1)分别为准一级吸附速率常数和准二级吸附速率常数;ki(mg·(g·min0.5)−1)为颗粒内扩散速率常数;C为截距,用于表征液膜厚度。
分别利用Linear模型、Freundlich 模型、Temkin模型和D-R模型对等温吸附实验结果进行拟合。4种模型的表达式如下:
式中,qe(mg·g−1)和Ce(mg·L−1)分别为平衡时固相和液相中OTC的浓度;Kd(L·g−1)为分配系数;KF(L·g−1)为Freundlich分配系数;n为表征线性程度的参数;R(8.314 J·(mol·K−1) -1)为热力学常数;T(K)为反应温度;bT(kJ·mol−1)为Temkin常数;KT(L·g−1)为Temkin吸附常数;β(mol2·kJ−2)为吸附能常数。
-
3种供试微塑料的粒径分布情况如图1所示。88.7%的PA的粒径介于160—250 μm范围内,84.1%的PS的粒径介于75—180 μm范围内,89.1%的PE的粒径介于75—160 μm范围内。总体而言,PE微塑料的粒径最小,其次是PS微塑料,PA微塑料的粒径相对较大。根据扫描电镜图(图2)可知,PA微塑料的表面粗糙,存在较多的孔隙结构;而PS和PE微塑料的表面相对光滑,孔隙结构较少。
-
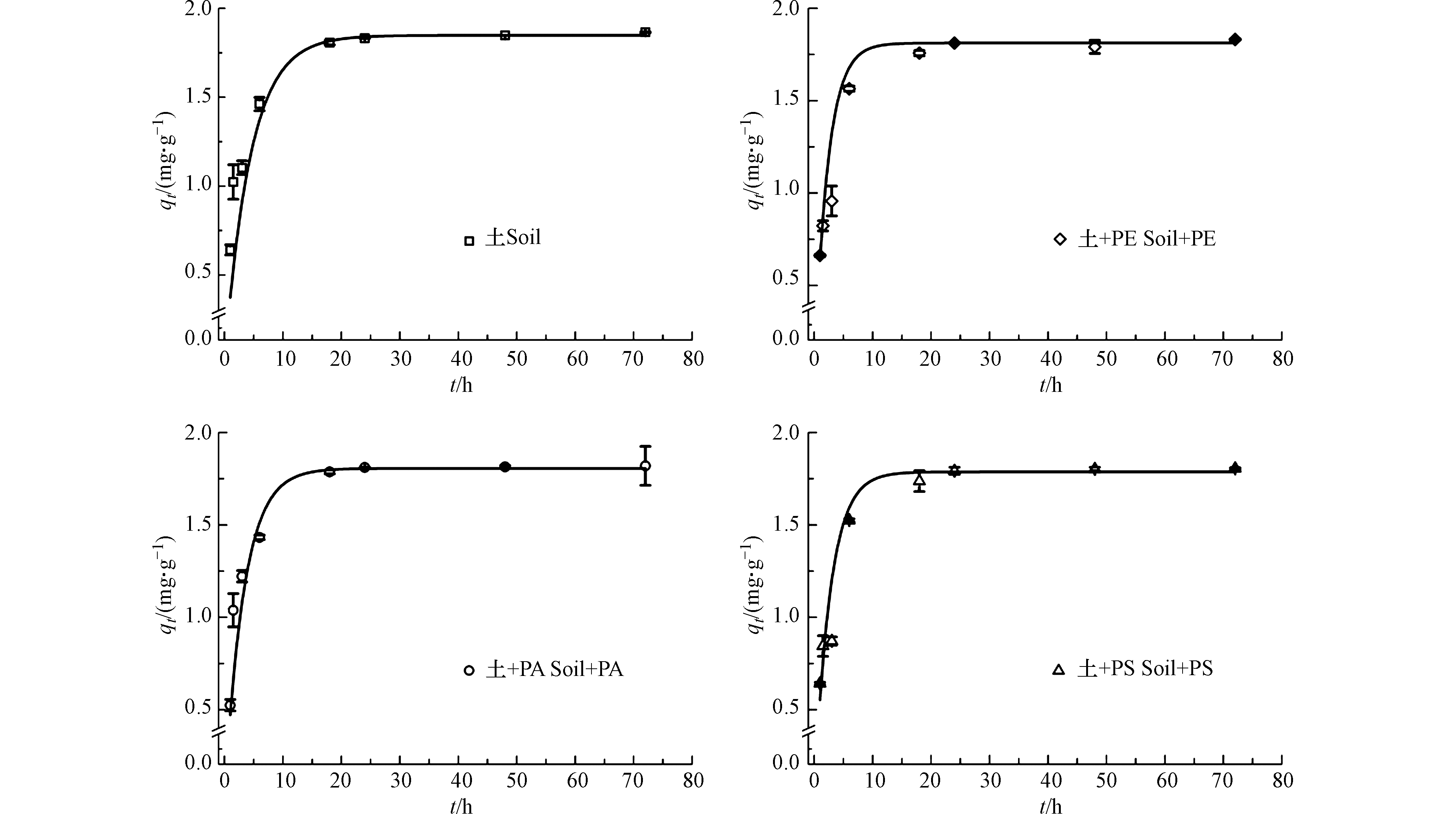
OTC在纯土壤及含10%微塑料土壤中的吸附动力学结果如图3所示。
OTC在纯土壤或含微塑料土壤上的吸附动力学过程可概括为3个阶段:(1)快速吸附阶段(0—6 h),该阶段OTC在不同吸附剂上的吸附量约占其总吸附量的79%—86%;Sun等[33]指出,在实验起始阶段,OTC的浓度相对较高,由此产生了较强的驱动力,从而促进液相中的OTC分子向吸附剂表面移动;(2)缓慢吸附阶段(6—24 h),随着吸附剂外表面活性吸附位点数量的减少及扩散阻力增加,OTC的吸附速率逐渐减缓[34-35];(3)平衡阶段(24—72 h),此时OTC在土壤或含微塑料土壤上的吸附量趋于平衡。总体上,向土壤中添加10%的微塑料并没有明显改变OTC的吸附趋势。
为进一步探讨微塑料对OTC吸附动力学行为的影响,利用准一级动力学模型和准二级动力学模型对OTC的吸附动力学结果进行了拟合,相关拟合参数如表2所示。根据相关系数(R2)可知,准一级动力学模型能够较好地拟合OTC在纯土壤上的吸附动力学过程,而OTC在含有微塑料土壤上的吸附动力学过程同时符合准一级动力学模型和准二级动力学模型,其中准二级动力学模型的拟合效果略优。但是,准一级动力学模型拟合得到的平衡吸附量(qe)更接近于实测值(qe,exp)。因此,本文根据准一级动力学模型的拟合结果进行讨论。相较于纯土壤,向土壤中加入微塑料后,土壤对OTC的吸附速率(k1)均略有增加(P>0.05)。同时,加入微塑料后,OTC的平衡吸附量(qe)较其在纯土壤中减少。
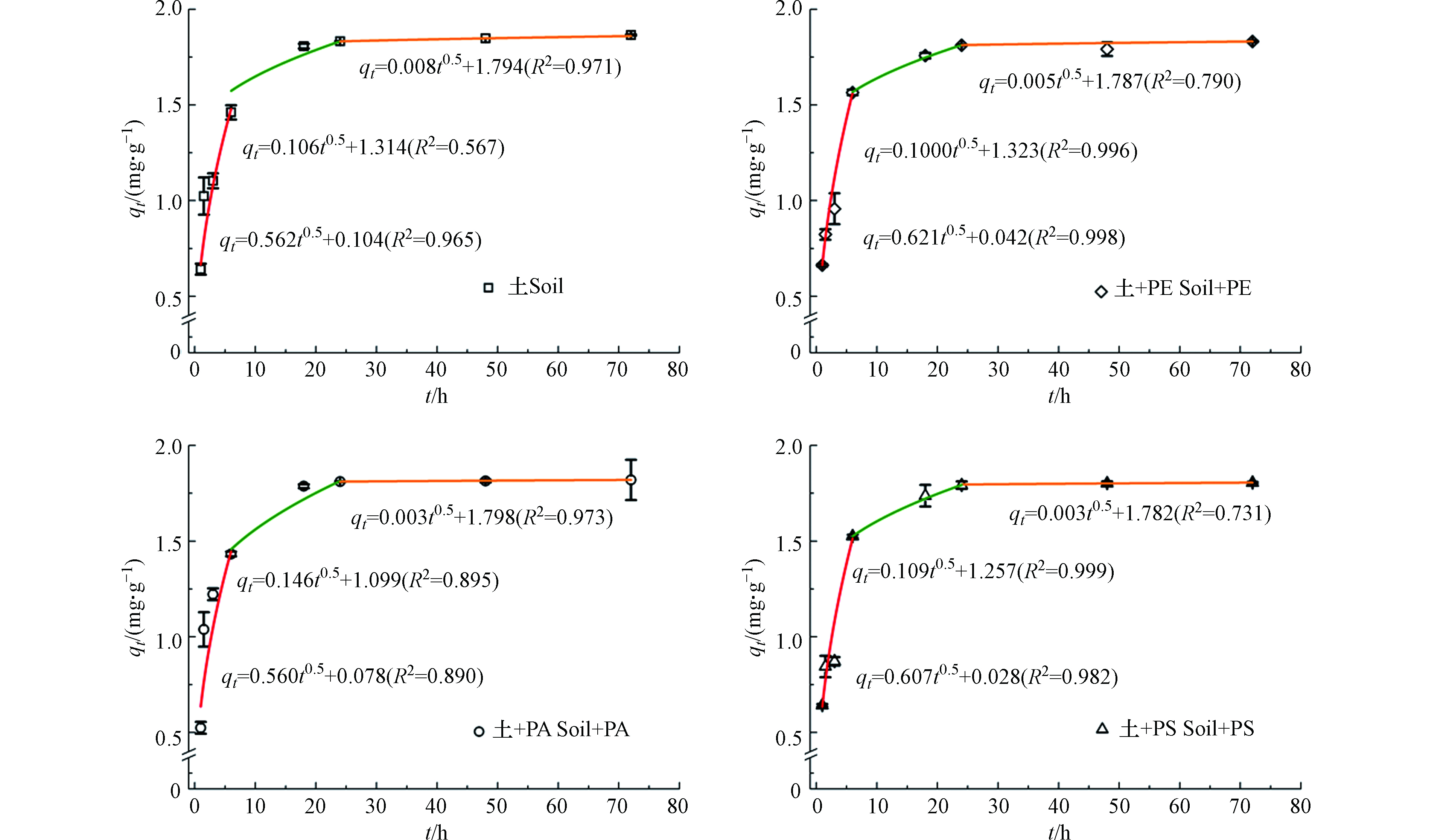
OTC在纯土壤或含微塑料土壤上的吸附过程可被拟合成三段曲线(图4)。第一阶段代表液膜扩散过程,在此阶段,OTC分子与吸附剂外表面的吸附位点结合[36]。当向土壤中加入微塑料后,土壤颗粒表面的液膜厚度(C)减小,OTC分子可更快到达吸附剂颗粒外表面。
因此,该阶段OTC在微塑料-土壤-水体系中的扩散速率参数(ki)比其在土壤-水体系中的大。第二阶段为颗粒表面的OTC进入颗粒内部孔道并进行扩散[35]。此阶段若吸附剂颗粒内部孔道越发达,则OTC分子扩散的阻力越小,即ki的值越大。如图4所示,OTC在含有PA微塑料土壤中的孔内扩散程度更大,其ki值明显(P<0.01)大于其它三组。如图2所示,PA微塑料表面粗糙,存在大量孔隙结构,而PE和PS微塑料表面较为光滑、完整。由第三段曲线拟合得到的扩散速率参数明显小于前两段,因为该阶段主要体现的是OTC到达吸附位点并发生吸附反应的过程[37]。在该阶段,加入微塑料后,OTC的扩散速率参数均减少。这可能是因为加入微塑料减少了土壤中的吸附位点,导致相同时间内OTC的吸附量减少,因此表征拟合曲线斜率的ki值减小。总体而言,OTC在土壤上的吸附速率受多个过程控制,而微塑料主要通过改变液膜厚度、颗粒内部孔道数量和吸附位点数量来影响土壤对OTC的吸附速率。
-
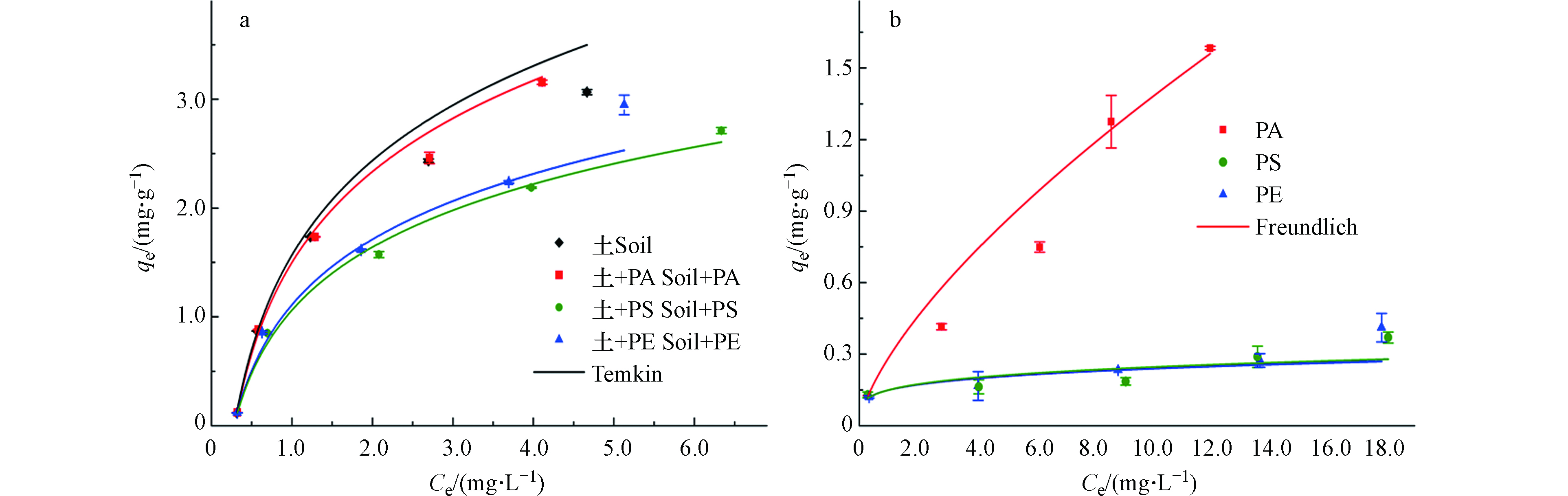
OTC在土壤、含有微塑料土壤及微塑料中的吸附等温线如图5所示。本文分别利用Linear模型、Freundlich 模型、Temkin模型和D-R模型对实验数据进行拟合,相关拟合参数列于表3。对于OTC在土壤和含微塑料土壤中的吸附而言,3种非线性模型的拟合效果(R2=0.936—0.998)优于线性模型(R2=0.612—0.959),且参数n的值介于0.581—0.667之间,说明OTC在土壤中的等温吸附呈非线性,这与文献报道的结果一致[38-39]。3种非线性模型中,Temkin模型的拟合效果最优,相关系数R2在0.993—0.998之间;其次为D-R模型和Freundlich模型。Temkin常数bT表征吸附能的变化,当bT>1时表示吸附为放热过程,当bT<1时表示吸附为吸热过程[40]。如表3所示,bT>1,根据该模型的假设,OTC在该土壤上的吸附为放热过程。另外,根据D-R模型的吸附能常数(β)可计算吸附平均自由能E(kJ·mol−1)(
E=1√2β ),当E的值介于0—8 kJ·mol−1时,表示物理吸附过程,当E的值介于8—16 kJ·mol−1时,表示化学吸附过程。根据表3中的β值计算得出,土壤和含微塑料土壤的E值为1.414—1.443 kJ·mol−1,表明OTC在土壤和含微塑料土壤中的吸附为物理吸附。相对而言,OTC在3种微塑料上的等温吸附更符合Freundlich模型,相关系数为0.738—0.981,表明该吸附过程趋于双分子层吸附且吸附位点分布不均[41]。
-
通常,Kf值越大,表明吸附能力越强。如表3所示,含有微塑料土壤的Kf值小于纯土壤,表明加入微塑料后土壤对OTC的吸附能力减弱。此外,D-R模型的理论饱和吸附量(qm)的变化也印证了该结论,即加入微塑料后,qm的值减少(表3)。该结果与Hüffer等[32]的报道类似,他们发现PE微塑料能够降低土壤对阿特拉津和2,4-滴丁酸的吸附量。含有微塑料的土壤对抗生素、农药等有毒污染物的吸附能力下降意味着这些污染物的游离态比重将提高,这可能会增强这些有毒污染物的生物可利用性;同时,含微塑料的土壤对污染物的吸附能力降低为污染物向深层土壤迁移创造了条件,并可能增加其淋溶风险[32]。
如表3所示,含有PE和PS微塑料的土壤对OTC的吸附能力明显减弱,二者的Kf值相近,但明显小于纯土壤的Kf值(P<0.05);而含有PA微塑料的土壤对OTC的吸附能力与纯土壤较为接近,表明向土壤中加入质量分数10%的PA不会明显改变土壤对OTC的吸附能力。由此可见,当向土壤中加入等量不同类型的微塑料后,其对OTC吸附量的抑制程度是不同的。这可能是因为不同类型的微塑料对OTC的吸附量不同。为了验证该结论,分别研究了OTC在3种微塑料上的等温吸附行为。如图5b所示,PE和PS对OTC的吸附量相近,但明显小于PA对OTC的吸附量。此外,Freundlich模型拟合结果显示,PA微塑料吸附OTC的能力(Kf =0.152 L·g−1)明显高于PE(Kf =0.103 L·g−1)和PS (Kf =0.110 L·g−1),这与我们之前的研究结果一致,即PA对四环素的亲和力要强于PE和PS[42]。此结果归因于1) PA微塑料粗糙多孔的表面结构有利于OTC吸附;2) PA表面的酰胺基团可以与OTC的羧基形成氢键,从而增加OTC的吸附量。因此,PE和PS微塑料对OTC的亲和力较PA弱,导致PE和PS微塑料对土壤吸附OTC的抑制强于PA微塑料。
-
现有研究[32, 43]指出,PE微塑料对阿特拉津、2,4-滴丁酸和镉的吸附量弱于土壤,向土壤中加入PE微塑料引发了稀释效应,即减少了土壤中的吸附位点,从而导致含有微塑料的土壤对这些污染物的吸附量降低。本文认为,这也是导致含有微塑料土壤对OTC吸附量降低的原因之一。对比可知,土壤对OTC的吸附能力(Kf =1.297 L·g−1)明显(P<0.01)强于3种微塑料(Kf =0.103—0.152 L·g−1)(表3),表明加入微塑料在一定程度上减少了整体的吸附位点,从而导致OTC的吸附量减少。
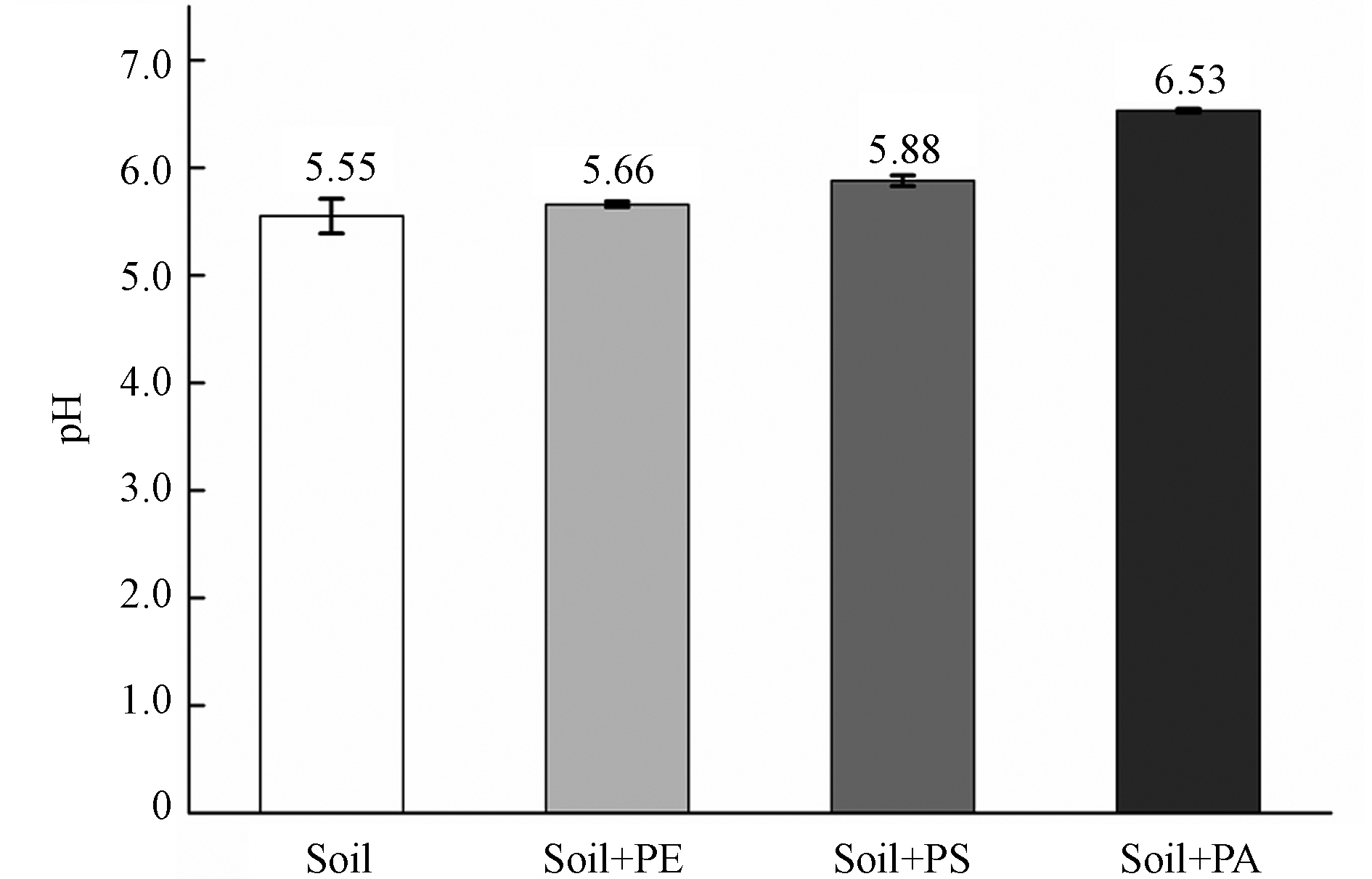
OTC属于可解离化合物,即在不同pH下,其离子形态不同。因此,反应体系pH对OTC的吸附具有重要影响。为了探究微塑料是否会通过改变反应体系pH值而影响OTC的吸附量,本文分别测试了土壤-OTC溶液体系和土壤-微塑料-OTC溶液体系的pH值。如图6所示,加入质量分数10%的不同类型微塑料均导致反应体系的pH值增大。由于本文选用的供试土壤偏酸性,当加入微塑料后,土壤比重减少,导致整体的缓冲能力降低,因此土壤-微塑料-OTC溶液体系的pH值上升。另外,微塑料表面容易发生质子化[44],这也会使溶液的pH增大。PA微塑料对体系的pH值影响最大,这可能与其特有的酰胺基结合氢离子有关。根据不同pH下OTC的形态分布特征[45],在pH=5.0—7.0范围内,OTC主要呈现零价和负一价;且随着pH增加,零价态比例减少,负一价态比例增加。本实验中,反应体系的pH (5.55—6.53)大于供试土壤的电荷零点pHPZC(5.28),因此供试土壤颗粒表面带负电荷。随着负一价OTC比例的增加,OTC分子与土壤颗粒间的静电斥力增强,不利于OTC的吸附。由此可知,3种微塑料可通过改变反应体系的pH值,间接影响OTC的吸附行为。
此外,微塑料也可能通过竞争吸附的方式减弱土壤对OTC的吸附能力。研究表明,微孔截留是微塑料颗粒滞留在多孔介质中的主要机制之一[46],即微塑料可以进入土壤颗粒内部微孔。该过程将侵占OTC的扩散通道,从而导致OTC的吸附量下降。Luo等[47]研究发现,PS微球可通过静电引力和疏水性作用与土壤颗粒结合,这与OTC在土壤中吸附的机制相似。因此,微塑料也可能通过争夺土壤颗粒上的吸附位点来抑制OTC的吸附。
-
本文通过批实验研究了PE、PS、PA 的3种微塑料对OTC在土壤中吸附行为的影响,主要得到以下结论:
(1)微塑料可通过改变液膜厚度、颗粒内部孔道数量和吸附位点数量等条件影响土壤对OTC的吸附动力学行为。但是,向土壤中添加质量分数10%的微塑料并不会显著(P>0.05)改变其对OTC的吸附速率。
(2)等温吸附实验结果表明,向土壤中添加质量分数10%的微塑料可导致其对OTC的吸附能力下降,但不同类型微塑料对土壤吸附OTC的抑制程度不同,这是因为不同微塑料对OTC的亲和力有所差异。
(3)微塑料影响土壤对OTC吸附的机制主要包括减少吸附位点(即稀释作用)和改变反应体系pH等。
未来,在揭示微塑料对土壤吸附污染物的影响方面仍需要开展大量研究,尤其需重点关注微塑料的含量、属性(如粒径、表面结构、老化程度等)、土壤理化性质及环境因素的影响,并探究关键影响机制。
微塑料对土壤吸附土霉素的影响初探
Influence of microplastics on sorption behaviors of oxytetracycline onto soils: A preliminary study
-
摘要: 为揭示微塑料对土壤吸附抗生素的影响,以聚酰胺(PA)、聚乙烯(PE)、聚苯乙烯(PS)等3种微塑料和土霉素(OTC)为研究对象,通过批实验研究了OTC在土壤、添加微塑料的土壤及微塑料中的吸附行为。结果表明,微塑料可通过改变液膜厚度、内部孔道数量和吸附位点数量影响土壤对OTC的吸附动力学行为。Temkin模型能够较好地拟合OTC在土壤和含微塑料土壤上的吸附等温线,而OTC在微塑料上的等温吸附更符合Freundlich模型。向土壤中添加微塑料(质量分数10%)可抑制土壤对OTC的吸附,但不同类型微塑料对土壤吸附OTC的抑制程度不同,含有PE或PS的土壤对OTC的吸附量显著降低(P<0.05),而添加等量PA的土壤对OTC的吸附量未明显减少(P>0.05),这可能与3种微塑料对OTC的亲和力不同有关。3种微塑料对OTC的吸附能力(Kf=0.103—0.152 L·g−1)显著(P<0.01)弱于土壤(Kf=1.297 L·g−1),因此向土壤中添加微塑料将减少吸附位点,从而导致OTC的吸附量减少;微塑料能改变反应体系的pH值,由此干扰OTC的形态分布,并间接影响OTC的吸附行为;此外,微塑料还可能通过侵占土壤颗粒内部孔道和竞争吸附位点的方式影响土壤对OTC的吸附。Abstract: In order to reveal the effects of microplastics on sorption behaviors of antibiotics onto soils, polyamide (PA), polyethylene (PE), polystyrene (PS), and oxytetracycline (OTC) were selected as the target, and batch experiments were conducted to investigate sorption of OTC onto the soil, soil containing 10% (mass fraction) of microplastics, and microplastics. Results show that microplastics could influence the sorption rate of OTC by altering the thickness of liquid film, the number of internal channels, and the number of sorption sites. The sorption isotherms of OTC onto the single soil and mixtures of soil and microplastics were in accordance with the Temkin model, while Freundlich model could fit the sorption isotherms of OTC onto microplastics well. Adding microplastics into the soil inhibited sorption of OTC. However, various types of microplastics have different inhibitory effects on OTC sorption. That is, the sorption capacity of soil containing PE or PS microplastics reduced significantly (P<0.05), while the soil containing the same amount of PA microplastics had similar sorption amount of OTC with the soil. This may be related to the different affinity of the three types of microplastics to OTC. Sorption amounts of OTC onto the three types of microplastics (Kf =0.103—0.152 L·g−1) were significantly (P<0.01) smaller than that onto the soil (Kf =1.297 L·g−1). Therefore, adding microplastics to the soil will reduce the overall sorption sites, which in turn will decrease the sorption capacity of the soil containing microplastics to OTC. Microplastics can alter the pH of the reaction system, which will affect speciation of OTC, thereby sorption of OTC is influenced. Further, the influencing mechanisms of microplastics on OTC sorption may also include competing sorption sites and occupying internal pores of soil particles.
-
Key words:
- microplastics /
- oxytetracycline /
- soil /
- sorption /
- batch experiments
-
土霉素(oxytetracycline, OTC)属于四环素类抗生素。由于其抗菌谱广、价格低廉,OTC被广泛用于治疗人类和动物疾病。此外,OTC还可作为饲料添加剂用于促进动物生长发育。2013年,我国OTC的用量为1360 t,其中约86%的OTC被用于畜牧养殖业[1]。OTC在生物体内的代谢率较低,大部分以母体的形式随排泄物排出体外。调查表明,畜禽粪肥中普遍含有OTC[2-3]。在我国传统农业模式下,残留的OTC将通过粪污还田进入农田土壤。Zhang等[4]调查发现,长期施用粪肥的菜地土壤中OTC的平均含量为397.6 μg·kg−1。该值超过了兽药国际协调委员会(VICH)提出的土壤抗生素生态毒害效应触发值(100 μg·kg−1),这对于土壤生态系统构成了潜在威胁。例如,OTC能杀死土壤中的部分微生物并干扰其在自然界物质循环中的作用;诱发产生OTC耐药细菌;沿食物链富集并毒害敏感性动植物等[5-7]。OTC造成的土壤环境污染及其生态毒害效应受到国际社会的广泛关注。
吸附是控制OTC在土壤-水界面转化的重要过程,它可以决定OTC的赋存形态,从而影响其在土壤中的迁移过程和生物有效性[8]。目前,关于OTC在土壤中吸附的研究已有大量报道[9-16]。这些研究表明,OTC主要通过疏水性分配、范德华力、离子交换、氢键、化学键、表面络合、孔道内扩散等吸附机制与土壤颗粒结合。OTC的吸附量与土壤理化性质密切相关,如粘土矿物含量高、有机质含量高、离子交换能力强的土壤对OTC的亲和力更强。此外,pH、离子强度、温度、共存离子和胶体等因素也会影响OTC在土壤中的吸附行为。上述研究成果为理解OTC在土壤中的环境行为提供了理论支撑。但是,现有的研究并没有考虑广泛存在于土壤中的微塑料对OTC吸附行为的影响。
微塑料是指“粒径小于5 mm的塑料类污染物”,它们广泛分布在海洋和陆地环境中[17-19]。其中,土壤是微塑料重要的长期储存库,每年排入土壤中的微塑料的量远大于海洋[20]。调查显示,在中国、澳大利亚、瑞士和智利的土壤中均可检测到微塑料,最高浓度为67.5 g·kg−1[21-24]。尽管目前关于国内农田土壤中微塑料污染调查的研究较少,但在采集的所有土壤样品中均可检测到微塑料,其最高丰度达到40000 N·kg−1[24-26]。这表明微塑料广泛存在于农田土壤中,且含量较高,是不应被忽视的一部分。
近期多项研究表明,微塑料可吸附水环境中的OTC。如张凯娜等[27]指出聚乙烯(PE)和聚苯乙烯(PS)微塑料可通过范德华力和微孔填充机制吸附OTC,且OTC的吸附量与盐度呈负相关;Zhang等[28]发现经过老化的PS对OTC的吸附量明显增强,主要吸附机制包括静电引力和氢键;此外,他们还指出腐殖酸能够促进PS对OTC的吸附。由于土壤颗粒与微塑料在理化性质上存在较大差异,二者对OTC的亲和力可能不同,当土壤受到微塑料污染时,其对OTC的吸附和固着能力可能受到较大影响。由此改变OTC的赋存形态及其迁移行为。
OTC在微塑料污染土壤中的吸附行为却未见报道,微塑料对于土壤吸附OTC的影响仍是未知的,这将限制人们准确评估土壤抗生素污染引发的毒性效应。鉴于此,本文选择土壤环境中常见的PE、PS和聚酰胺(PA)为典型微塑料[29-31],以壤土为供试土壤;基于批实验初步研究3种微塑料对OTC在土壤中吸附行为的影响,并探究其影响机制,以期为后续深入研究微塑料污染土壤中抗生素的关键运移过程及机制奠定基础。
1. 材料与方法(Materials and methods)
1.1 供试材料
1.1.1 试剂与耗材
OTC标准品(纯度≥98%)购自上海麦克林生化科技有限公司。甲醇(色谱纯)和乙腈(色谱纯)购自美国Tedia公司;实验用水为超纯水;无水氯化钙(分析纯)购自国药集团化学试剂有限公司;聚丙烯离心管(15 mL)购自美国Corning公司;针头过滤器(0.22 μm)购自天津津腾实验设备有限公司。
1.1.2 土壤与微塑料
根据土壤质地,土壤一般分为砂质土、壤土和黏质土。其中,壤土的含沙量、粘土含量介于砂质土和黏质土之间。因此,本文选择土壤质地居中的壤土为供试土壤。在山东省烟台市某农田(121°25′34.12″E,37°35′9.56″N)通过对角线采样法采集表层土壤样品。将样品混匀后转移至实验室,冷冻干燥,用镊子挑出肉眼可辨的植物残体和沙砾;将剩余样品置于玛瑙研钵内研磨,过80目标准筛备用。供试土壤基本理化性质如表1所示。
表 1 供试土壤理化性质Table 1. Physicochemical properties of the tested soilpHpzc 有机质/(mg·g−1)Organic matter 阳离子交换量 /(cmol(+)·kg−1)Cation exchange capacity 颗粒组成/%Particle composition 黏粒Clay(<2 μm) 粉粒Silt(2—50 μm) 砂粒Sand(>50 μm) 5.28 12.3 12.4 20.16 33.60 46.24 本文选取广泛存在于土壤环境中的PE、PS和PA作为供试微塑料,3种微塑料样品均为白色粉末状,粒径<80目,购自上海阳励机电科技有限公司。利用60—300目的不锈钢标准土壤筛测量供试微塑料的粒径分布。利用扫描电镜(S-4800, 日本Hitachi公司)对微塑料表面形态进行表征。
1.1.3 仪器设备
高效液相色谱仪(Primaide,日本Hitachi公司)、水浴恒温振荡器(SHZ-GW,常州朗越仪器制造有限公司)、冷冻干燥机(FD-1A-50,北京博医康实验仪器有限公司)、分析天平(BSA224S,德国Sartorius集团)等。
1.2 批实验
本文参照OECD(No. 106)标准开展批实验,分别研究OTC在土壤、微塑料及含有微塑料土壤中的吸附行为。土壤中微塑料的添加比例(10%,质量分数) 和投加方法(直接混合并充分搅匀)参照Hüffer等[32]的报道进行设置。
1.2.1 吸附动力学实验
称取(0.0500±0.0003) g土壤样品置于15 mL聚丙烯离心管中,或称取(0.0450±0.0003) g土壤样品和(0.0050±0.0002) g微塑料样品置于离心管中,用移液枪加入9.0 mL背景溶液(1.11 g·L−1 CaCl2),然后加入1.0 mLOTC工作液(100 mg·L−1)。拧紧瓶盖后,将离心管置于水浴恒温振荡器中,于25℃条件下振荡,转速设置为210 r·min−1。分别在1.0、1.5、3.0、6.0、18、24、48、72 h进行取样,样品经0.22 μm滤膜过滤后,装入棕色进样瓶中保存,立即用高效液相色谱仪进行分析。每组实验设置3个平行。
1.2.2 等温吸附实验
为研究OTC在土壤、微塑料、土壤和微塑料混合物上的等温吸附行为,分别称取(0.0500±0.0003) g土壤样品、(0.0500±0.0003) g微塑料样品、(0.0450±0.0003) g土壤样品和(0.0050±0.0002) g微塑料样品置于15 mL聚丙烯离心管中。将OTC的浓度梯度设置为1.0、5.0、10、15、20 mg·L−1,根据此浓度梯度,先用移液枪向离心管中加入适量背景溶液(1.11 g·L−1 CaCl2),然后加入OTC工作液(100 mg·L−1),使每个离心管中的溶液总体积为10 mL。拧紧瓶盖后,将离心管置于水浴恒温振荡器中,转速设置为210 r·min−1,于25℃条件下振荡。根据本文动力学吸附实验结果,OTC在土壤及微塑料和土壤混合物上的吸附时间设为24 h;根据文献报道[27-28],将OTC在微塑料上的吸附时间设为48 h。样品经0.22 μm滤膜过滤后,装入棕色进样瓶中保存,立即用高效液相色谱仪进行分析。每组实验设置3个平行。分别设置只添加吸附剂(即土壤或微塑料或土壤与微塑料的混合物)或只添加OTC溶液的空白实验作为对照,以确定吸附剂中有无OTC析出以及实验过程中OTC的降解情况。
1.3 OTC检测方法
溶液中的OTC利用高效液相色谱仪(Primaide, 日本Hitachi公司)进行检测。样品经WondaSil C18 Superb色谱柱(4.6 mm× 150 mm, 5.0 μm)进行分离。具体参数如下:流动相A为乙腈,流动相B体积分数为0.4%的乙酸溶液,二者的体积比为24:76;流速为1.0 mL·min−1;柱温设置为35℃,进样体积为20 μL;检测波长为355 nm。基于上述方法,OTC的保留时间为2.75 min,检出限为0.05 mg·L−1,标准曲线线性范围为0.2—20 mg·L−1 (R2>0.99)。
1.4 数据分析
为了降低不同组别移液过程中产生的误差,本文在实验过程中采用称重法进行校准,利用公式(1)计算OTC的吸附量。
qe=m2−m1ρ2(C−Ce)−m1−m0ρ1Cem−Δ (1) 式中,qe(mg·kg−1)为平衡时OTC的吸附量;C(mg·L−1)为OTC工作液的浓度;Ce(mg·L−1)为平衡时OTC的浓度;ρ1和ρ2(g·mL−1)分别为背景溶液和OTC工作液的密度;m(g)是吸附剂的质量;m0(g)是吸附剂和反应容器的质量和;m1(g)是加入背景溶液后反应容器的总质量(即m1=m0+m背景溶液);m2(g)是加入OTC工作液后反应容器的总质量(即m2=m1+mOTC工作液);Δ(mg·kg−1)为空白损失量。
为了揭示OTC在不同吸附剂上的吸附动力学行为,本文分别利用准一级动力学模型、准二级动力学模型和颗粒内扩散模型对吸附动力学实验数据进行拟合。3个模型的表达式如下:
qt=qe(1−e−k1t) (2) tqt=tqe+1k2q2e (3) qt=kit0.5+C (4) 式中,qt(mg·g−1)和qe(mg·g−1)分别为t时刻和平衡时OTC的吸附量;k1(h−1)和k2(g·(mg·h)−1)分别为准一级吸附速率常数和准二级吸附速率常数;ki(mg·(g·min0.5)−1)为颗粒内扩散速率常数;C为截距,用于表征液膜厚度。
分别利用Linear模型、Freundlich 模型、Temkin模型和D-R模型对等温吸附实验结果进行拟合。4种模型的表达式如下:
qe=KdCe (5) qe=KFCne (6) qe=RTbTln(KTCe) (7) qe=qme[−β(RTln(1+1Ce))2] (8) 式中,qe(mg·g−1)和Ce(mg·L−1)分别为平衡时固相和液相中OTC的浓度;Kd(L·g−1)为分配系数;KF(L·g−1)为Freundlich分配系数;n为表征线性程度的参数;R(8.314 J·(mol·K−1) -1)为热力学常数;T(K)为反应温度;bT(kJ·mol−1)为Temkin常数;KT(L·g−1)为Temkin吸附常数;β(mol2·kJ−2)为吸附能常数。
2. 结果与讨论(Results and discussion)
2.1 微塑料表征
3种供试微塑料的粒径分布情况如图1所示。88.7%的PA的粒径介于160—250 μm范围内,84.1%的PS的粒径介于75—180 μm范围内,89.1%的PE的粒径介于75—160 μm范围内。总体而言,PE微塑料的粒径最小,其次是PS微塑料,PA微塑料的粒径相对较大。根据扫描电镜图(图2)可知,PA微塑料的表面粗糙,存在较多的孔隙结构;而PS和PE微塑料的表面相对光滑,孔隙结构较少。
2.2 微塑料对OTC吸附动力学行为的影响
OTC在纯土壤及含10%微塑料土壤中的吸附动力学结果如图3所示。
OTC在纯土壤或含微塑料土壤上的吸附动力学过程可概括为3个阶段:(1)快速吸附阶段(0—6 h),该阶段OTC在不同吸附剂上的吸附量约占其总吸附量的79%—86%;Sun等[33]指出,在实验起始阶段,OTC的浓度相对较高,由此产生了较强的驱动力,从而促进液相中的OTC分子向吸附剂表面移动;(2)缓慢吸附阶段(6—24 h),随着吸附剂外表面活性吸附位点数量的减少及扩散阻力增加,OTC的吸附速率逐渐减缓[34-35];(3)平衡阶段(24—72 h),此时OTC在土壤或含微塑料土壤上的吸附量趋于平衡。总体上,向土壤中添加10%的微塑料并没有明显改变OTC的吸附趋势。
为进一步探讨微塑料对OTC吸附动力学行为的影响,利用准一级动力学模型和准二级动力学模型对OTC的吸附动力学结果进行了拟合,相关拟合参数如表2所示。根据相关系数(R2)可知,准一级动力学模型能够较好地拟合OTC在纯土壤上的吸附动力学过程,而OTC在含有微塑料土壤上的吸附动力学过程同时符合准一级动力学模型和准二级动力学模型,其中准二级动力学模型的拟合效果略优。但是,准一级动力学模型拟合得到的平衡吸附量(qe)更接近于实测值(qe,exp)。因此,本文根据准一级动力学模型的拟合结果进行讨论。相较于纯土壤,向土壤中加入微塑料后,土壤对OTC的吸附速率(k1)均略有增加(P>0.05)。同时,加入微塑料后,OTC的平衡吸附量(qe)较其在纯土壤中减少。
表 2 准一级和准二级动力学模型拟合参数Table 2. Fitting parameters of Pseudo-first-order and Pseudo-second-order kinetic models吸附剂Sorbents q(e,exp)/(mg·g−1) 准一级动力学模型Pseudo-first-order kinetic model 准二级动力学模型Pseudo-second-order kinetic model qe/(mg·g−1) k1/h−1 R2 qe/(mg·g−1) k2/(g·(mg·h−1) -1) R2 土 1.832 1.848 0.226 0.902 1.879 0.665 0.773 土+PA 1.811 1.813 0.283 0.968 1.898 0.233 0.990 土+PS 1.803 1.787 0.371 0.974 1.871 0.295 0.982 土+PE 1.813 1.811 0.435 0.994 1.921 0.289 0.992 OTC在纯土壤或含微塑料土壤上的吸附过程可被拟合成三段曲线(图4)。第一阶段代表液膜扩散过程,在此阶段,OTC分子与吸附剂外表面的吸附位点结合[36]。当向土壤中加入微塑料后,土壤颗粒表面的液膜厚度(C)减小,OTC分子可更快到达吸附剂颗粒外表面。
因此,该阶段OTC在微塑料-土壤-水体系中的扩散速率参数(ki)比其在土壤-水体系中的大。第二阶段为颗粒表面的OTC进入颗粒内部孔道并进行扩散[35]。此阶段若吸附剂颗粒内部孔道越发达,则OTC分子扩散的阻力越小,即ki的值越大。如图4所示,OTC在含有PA微塑料土壤中的孔内扩散程度更大,其ki值明显(P<0.01)大于其它三组。如图2所示,PA微塑料表面粗糙,存在大量孔隙结构,而PE和PS微塑料表面较为光滑、完整。由第三段曲线拟合得到的扩散速率参数明显小于前两段,因为该阶段主要体现的是OTC到达吸附位点并发生吸附反应的过程[37]。在该阶段,加入微塑料后,OTC的扩散速率参数均减少。这可能是因为加入微塑料减少了土壤中的吸附位点,导致相同时间内OTC的吸附量减少,因此表征拟合曲线斜率的ki值减小。总体而言,OTC在土壤上的吸附速率受多个过程控制,而微塑料主要通过改变液膜厚度、颗粒内部孔道数量和吸附位点数量来影响土壤对OTC的吸附速率。
2.3 OTC在不同吸附剂上的等温吸附行为
OTC在土壤、含有微塑料土壤及微塑料中的吸附等温线如图5所示。本文分别利用Linear模型、Freundlich 模型、Temkin模型和D-R模型对实验数据进行拟合,相关拟合参数列于表3。对于OTC在土壤和含微塑料土壤中的吸附而言,3种非线性模型的拟合效果(R2=0.936—0.998)优于线性模型(R2=0.612—0.959),且参数n的值介于0.581—0.667之间,说明OTC在土壤中的等温吸附呈非线性,这与文献报道的结果一致[38-39]。3种非线性模型中,Temkin模型的拟合效果最优,相关系数R2在0.993—0.998之间;其次为D-R模型和Freundlich模型。Temkin常数bT表征吸附能的变化,当bT>1时表示吸附为放热过程,当bT<1时表示吸附为吸热过程[40]。如表3所示,bT>1,根据该模型的假设,OTC在该土壤上的吸附为放热过程。另外,根据D-R模型的吸附能常数(β)可计算吸附平均自由能E(kJ·mol−1)(
E=1√2β 表 3 等温吸附模型拟合参数Table 3. Fitting parameters of models吸附剂Sorbents Freundlich模型 D-R模型 Temkin模型 Linear模型 Kf/(L·g−1) n R2 qm/(mg·g−1) β/(mol2·kJ−2) R2 bT/(kJ·mol−1) KT/(L·g−1) R2 Kd/(L·g−1) R2 土 1.297 0.584 0.945 3.810 0.243 0.950 1.975 3.487 0.993 0.980 0.726 土+PA 1.257 0.665 0.963 3.193 0.250 0.936 2.053 3.457 0.997 0.710 0.612 土+PS 0.955 0.581 0.966 2.426 0.249 0.990 2.960 3.545 0.998 0.453 0.940 土+PE 0.981 0.667 0.971 2.311 0.240 0.983 2.849 3.580 0.996 0.388 0.959 PA 0.152 0.949 0.981 1.751 2.987 0.504 6.884 4.662 0.926 0.156 0.743 PS 0.110 0.368 0.738 0.236 0.044 0.267 72.68 122.1 0.466 0.021 0.754 PE 0.103 0.429 0.812 0.057 0.057 0.973 71.40 94.14 0.982 0.026 0.997 根据表3中的β值计算得出,土壤和含微塑料土壤的E值为1.414—1.443 kJ·mol−1,表明OTC在土壤和含微塑料土壤中的吸附为物理吸附。相对而言,OTC在3种微塑料上的等温吸附更符合Freundlich模型,相关系数为0.738—0.981,表明该吸附过程趋于双分子层吸附且吸附位点分布不均[41]。
2.4 微塑料对土壤吸附OTC的能力的影响
通常,Kf值越大,表明吸附能力越强。如表3所示,含有微塑料土壤的Kf值小于纯土壤,表明加入微塑料后土壤对OTC的吸附能力减弱。此外,D-R模型的理论饱和吸附量(qm)的变化也印证了该结论,即加入微塑料后,qm的值减少(表3)。该结果与Hüffer等[32]的报道类似,他们发现PE微塑料能够降低土壤对阿特拉津和2,4-滴丁酸的吸附量。含有微塑料的土壤对抗生素、农药等有毒污染物的吸附能力下降意味着这些污染物的游离态比重将提高,这可能会增强这些有毒污染物的生物可利用性;同时,含微塑料的土壤对污染物的吸附能力降低为污染物向深层土壤迁移创造了条件,并可能增加其淋溶风险[32]。
如表3所示,含有PE和PS微塑料的土壤对OTC的吸附能力明显减弱,二者的Kf值相近,但明显小于纯土壤的Kf值(P<0.05);而含有PA微塑料的土壤对OTC的吸附能力与纯土壤较为接近,表明向土壤中加入质量分数10%的PA不会明显改变土壤对OTC的吸附能力。由此可见,当向土壤中加入等量不同类型的微塑料后,其对OTC吸附量的抑制程度是不同的。这可能是因为不同类型的微塑料对OTC的吸附量不同。为了验证该结论,分别研究了OTC在3种微塑料上的等温吸附行为。如图5b所示,PE和PS对OTC的吸附量相近,但明显小于PA对OTC的吸附量。此外,Freundlich模型拟合结果显示,PA微塑料吸附OTC的能力(Kf =0.152 L·g−1)明显高于PE(Kf =0.103 L·g−1)和PS (Kf =0.110 L·g−1),这与我们之前的研究结果一致,即PA对四环素的亲和力要强于PE和PS[42]。此结果归因于1) PA微塑料粗糙多孔的表面结构有利于OTC吸附;2) PA表面的酰胺基团可以与OTC的羧基形成氢键,从而增加OTC的吸附量。因此,PE和PS微塑料对OTC的亲和力较PA弱,导致PE和PS微塑料对土壤吸附OTC的抑制强于PA微塑料。
2.5 微塑料影响土壤吸附OTC的机制探究
现有研究[32, 43]指出,PE微塑料对阿特拉津、2,4-滴丁酸和镉的吸附量弱于土壤,向土壤中加入PE微塑料引发了稀释效应,即减少了土壤中的吸附位点,从而导致含有微塑料的土壤对这些污染物的吸附量降低。本文认为,这也是导致含有微塑料土壤对OTC吸附量降低的原因之一。对比可知,土壤对OTC的吸附能力(Kf =1.297 L·g−1)明显(P<0.01)强于3种微塑料(Kf =0.103—0.152 L·g−1)(表3),表明加入微塑料在一定程度上减少了整体的吸附位点,从而导致OTC的吸附量减少。
OTC属于可解离化合物,即在不同pH下,其离子形态不同。因此,反应体系pH对OTC的吸附具有重要影响。为了探究微塑料是否会通过改变反应体系pH值而影响OTC的吸附量,本文分别测试了土壤-OTC溶液体系和土壤-微塑料-OTC溶液体系的pH值。如图6所示,加入质量分数10%的不同类型微塑料均导致反应体系的pH值增大。由于本文选用的供试土壤偏酸性,当加入微塑料后,土壤比重减少,导致整体的缓冲能力降低,因此土壤-微塑料-OTC溶液体系的pH值上升。另外,微塑料表面容易发生质子化[44],这也会使溶液的pH增大。PA微塑料对体系的pH值影响最大,这可能与其特有的酰胺基结合氢离子有关。根据不同pH下OTC的形态分布特征[45],在pH=5.0—7.0范围内,OTC主要呈现零价和负一价;且随着pH增加,零价态比例减少,负一价态比例增加。本实验中,反应体系的pH (5.55—6.53)大于供试土壤的电荷零点pHPZC(5.28),因此供试土壤颗粒表面带负电荷。随着负一价OTC比例的增加,OTC分子与土壤颗粒间的静电斥力增强,不利于OTC的吸附。由此可知,3种微塑料可通过改变反应体系的pH值,间接影响OTC的吸附行为。
此外,微塑料也可能通过竞争吸附的方式减弱土壤对OTC的吸附能力。研究表明,微孔截留是微塑料颗粒滞留在多孔介质中的主要机制之一[46],即微塑料可以进入土壤颗粒内部微孔。该过程将侵占OTC的扩散通道,从而导致OTC的吸附量下降。Luo等[47]研究发现,PS微球可通过静电引力和疏水性作用与土壤颗粒结合,这与OTC在土壤中吸附的机制相似。因此,微塑料也可能通过争夺土壤颗粒上的吸附位点来抑制OTC的吸附。
3. 结论(Conclusion)
本文通过批实验研究了PE、PS、PA 的3种微塑料对OTC在土壤中吸附行为的影响,主要得到以下结论:
(1)微塑料可通过改变液膜厚度、颗粒内部孔道数量和吸附位点数量等条件影响土壤对OTC的吸附动力学行为。但是,向土壤中添加质量分数10%的微塑料并不会显著(P>0.05)改变其对OTC的吸附速率。
(2)等温吸附实验结果表明,向土壤中添加质量分数10%的微塑料可导致其对OTC的吸附能力下降,但不同类型微塑料对土壤吸附OTC的抑制程度不同,这是因为不同微塑料对OTC的亲和力有所差异。
(3)微塑料影响土壤对OTC吸附的机制主要包括减少吸附位点(即稀释作用)和改变反应体系pH等。
未来,在揭示微塑料对土壤吸附污染物的影响方面仍需要开展大量研究,尤其需重点关注微塑料的含量、属性(如粒径、表面结构、老化程度等)、土壤理化性质及环境因素的影响,并探究关键影响机制。
-
表 1 供试土壤理化性质
Table 1. Physicochemical properties of the tested soil
pHpzc 有机质/(mg·g−1)Organic matter 阳离子交换量 /(cmol(+)·kg−1)Cation exchange capacity 颗粒组成/%Particle composition 黏粒Clay(<2 μm) 粉粒Silt(2—50 μm) 砂粒Sand(>50 μm) 5.28 12.3 12.4 20.16 33.60 46.24 表 2 准一级和准二级动力学模型拟合参数
Table 2. Fitting parameters of Pseudo-first-order and Pseudo-second-order kinetic models
吸附剂Sorbents q(e,exp)/(mg·g−1) 准一级动力学模型Pseudo-first-order kinetic model 准二级动力学模型Pseudo-second-order kinetic model qe/(mg·g−1) k1/h−1 R2 qe/(mg·g−1) k2/(g·(mg·h−1) -1) R2 土 1.832 1.848 0.226 0.902 1.879 0.665 0.773 土+PA 1.811 1.813 0.283 0.968 1.898 0.233 0.990 土+PS 1.803 1.787 0.371 0.974 1.871 0.295 0.982 土+PE 1.813 1.811 0.435 0.994 1.921 0.289 0.992 表 3 等温吸附模型拟合参数
Table 3. Fitting parameters of models
吸附剂Sorbents Freundlich模型 D-R模型 Temkin模型 Linear模型 Kf/(L·g−1) n R2 qm/(mg·g−1) β/(mol2·kJ−2) R2 bT/(kJ·mol−1) KT/(L·g−1) R2 Kd/(L·g−1) R2 土 1.297 0.584 0.945 3.810 0.243 0.950 1.975 3.487 0.993 0.980 0.726 土+PA 1.257 0.665 0.963 3.193 0.250 0.936 2.053 3.457 0.997 0.710 0.612 土+PS 0.955 0.581 0.966 2.426 0.249 0.990 2.960 3.545 0.998 0.453 0.940 土+PE 0.981 0.667 0.971 2.311 0.240 0.983 2.849 3.580 0.996 0.388 0.959 PA 0.152 0.949 0.981 1.751 2.987 0.504 6.884 4.662 0.926 0.156 0.743 PS 0.110 0.368 0.738 0.236 0.044 0.267 72.68 122.1 0.466 0.021 0.754 PE 0.103 0.429 0.812 0.057 0.057 0.973 71.40 94.14 0.982 0.026 0.997 -
[1] ZHANG Q Q, YING G G, PAN C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance [J]. Environmental Science & Technology, 2015, 49(11): 6772-6782. [2] ZHAO L, DONG Y H, WANG H. Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China [J]. Science of the Total Environment, 2010, 408(5): 1069-1075. doi: 10.1016/j.scitotenv.2009.11.014 [3] 张慧敏, 章明奎, 顾国平. 浙北地区畜禽粪便和农田土壤中四环素类抗生素残留 [J]. 生态与农村环境学报, 2008, 24(3): 69-73. doi: 10.3969/j.issn.1673-4831.2008.03.014 ZHANG H M, ZHANG M K, GUO G P. Residues of tetracyclines in livestock and poultry and agricultural soils from North Zhejiang Province [J]. Journal of Ecology and Rural Environment, 2008, 24(3): 69-73(in Chinese). doi: 10.3969/j.issn.1673-4831.2008.03.014
[4] ZHANG H B, ZHOU Y, HUANG Y J, et al. Residues and risks of veterinary antibiotics in protected vegetable soils following application of different manures[J]. Chemosphere. 2016, 152(6): 229-237. [5] AHMED M B M, RAJAPAKSHA A U, LIM J E, et al. Distribution and accumulative pattern of tetracyclines and sulfonamides in edible vegetables of cucumber, tomato, and lettuce [J]. Journal of Agricultural and Food Chemistry, 2015, 63(2): 398-405. doi: 10.1021/jf5034637 [6] 曾巧云, 丁丹, 檀笑. 中国农业土壤中四环素类抗生素污染现状及来源研究进展 [J]. 生态环境学报, 2018, 27(9): 1774-1782. ZENG Q Y, DING D, TAN X. Pollution status and sources of tetracycline antibiotics in agricultural soil in China: A review [J]. Ecology and Environmental Sciences, 2018, 27(9): 1774-1782(in Chinese).
[7] 仇天雷, 高敏, 韩梅琳, 等. 鸡粪堆肥过程中四环素类抗生素及抗性细菌的消减研究 [J]. 农业环境科学学报, 2015, 34(4): 795-800. doi: 10.11654/jaes.2015.04.027 QIU T L, GAO M, HAN M L, et al. Decreases of tetracyclines and antibiotics-resistant bacteria during composting of chicken manure [J]. Journal of Agro-Environment Science, 2015, 34(4): 795-800(in Chinese). doi: 10.11654/jaes.2015.04.027
[8] WANG Y J, SUN R J, XIAO A Y, et al. Phosphate affects the adsorption of tetracycline on two soils with different characteristics [J]. Geoderma, 2010, 156(3/4): 237-242. [9] BAO Y Y, WAN Y, ZHOU Q X, et al. Competitive adsorption and desorption of oxytetracycline and cadmium with different input loadings on cinnamon soil [J]. Journal of Soils and Sediments, 2013, 13(2): 364-374. doi: 10.1007/s11368-012-0600-3 [10] LEE J, SEO Y, ESSINGTON M E. Sorption and transport of veterinary pharmaceuticals in soil-A laboratory study [J]. Soil Science Society of America Journal, 2014, 78(5): 1531-1543. doi: 10.2136/sssaj2013.11.0490 [11] 曹志磊, 俞花美, 葛成军, 等. 可溶性有机物对土霉素在土壤中吸附-解吸的影响 [J]. 热带作物学报, 2018, 39(4): 825-831. doi: 10.3969/j.issn.1000-2561.2018.04.034 CAO Z L, YU H M, GE C J, et al. Eeffects of dissolved organic matter on adsorption-desorption behavior of oxytetracycline in soil system [J]. Chinese Journal of Tropical Crops, 2018, 39(4): 825-831(in Chinese). doi: 10.3969/j.issn.1000-2561.2018.04.034
[12] KOCAREK M, KODESOVA R, VONDRACKOVA L, et al. Simultaneous sorption of four ionizable pharmaceuticals in different horizons of three soil types [J]. Environmental Pollution, 2016, 218(11): 563-573. [13] PAN M, CHU L M. Adsorption and degradation of five selected antibiotics in agricultural soil [J]. Science of the Total Environment, 2016, 545-546(3): 48-56. [14] 石磊平, 蒋煜峰, 广阿龙, 等. 天然有机质对土霉素在西北灰钙土上吸附行为的影响 [J]. 环境科学研究, 2019, 32(9): 1584-1593. SHI L P, JIANG Y F, GUANG A L, et al. Effect of natural organic matter on adsorption behavior of oxytetracycline onto sierozem soils in Northwest China [J]. Research of Environmental Sciences, 2019, 32(9): 1584-1593(in Chinese).
[15] 鲍艳宇, 周启星, 张浩. 阳离子类型对土霉素在2种土壤中吸附-解吸影响 [J]. 环境科学, 2009, 30(2): 551-556. doi: 10.3321/j.issn:0250-3301.2009.02.040 BAO Y Y, ZHOU Q X, ZHANG H. Influences of cation species on adsorption and desorption of oxytetracycline in two typical soils of China [J]. Environmental Science, 2009, 30(2): 551-556(in Chinese). doi: 10.3321/j.issn:0250-3301.2009.02.040
[16] RABOLLE M, SPLIID N H. Sorption and mobility of metronidazole, olaquindox, oxytetracycline and tylosin in soil [J]. Chemoshpere, 2000, 40(7): 715-722. doi: 10.1016/S0045-6535(99)00442-7 [17] ROCHMAN C M. Microplastics research - from sink to source [J]. Science, 2018, 360(6384): 28-29. doi: 10.1126/science.aar7734 [18] 骆永明, 周倩, 章海波, 等. 重视土壤中微塑料污染研究 防范生态与食物链风险 [J]. 中国科学院院刊, 2018, 33(10): 1021-1030. LUO Y M, ZHOU Q, ZHANG H B, et al. Pay attention to research on microplastic pollution in soil for prevention of ecological and food chain risks [J]. Bulletin of Chinese Academy of Sciences, 2018, 33(10): 1021-1030(in Chinese).
[19] 李道季. 海洋微塑料污染研究现状及其应对措施建议 [J]. 环境科学研究, 2019, 32(2): 197-202. LI D J. Research advance and countermeasures on marine microplastic pollution [J]. Research of Environmental Sciences, 2019, 32(2): 197-202(in Chinese).
[20] NIZZETOO L, Langaas S, Futter M. Do microplastics spill on to farm soils? [J]. Nature, 2016, 537(7621): 488-488. [21] FULLER S, GAUTAM A. A procedure for measuring microplastics using pressurized fluid extraction [J]. Environmental Science & Technology, 2016, 50(11): 5774-5780. [22] SCHEURER M, BIGALKE M. Microplastics in Swiss floodplain soils [J]. Environmental Science & Technology, 2018, 52(6): 3591-3598. [23] CORRADINI F, EGUILUZ R, CASADO F, et al. Evidence of microplastic accumulation in agricultural soils from sewage sludge disposal [J]. Science of the Total Environment, 2019, 671(6): 411-420. [24] ZHANG G S, LIU Y F. The distribution of microplastics in soil aggregate fractions in southwestern China [J]. Science of the Total Environment, 2018, 642(11): 12-20. [25] LIU M T, LU S B, SONG Y, et al. Microplastic and mesoplastic pollution in farmland soils in suburbs of Shanghai, China [J]. Environmental Pollution, 2018, 242(11): 855-862. [26] LU X M, LU P Z, LIU X P. Fate and abundance of antibiotic resistance genes on microplastics in facility vegetable soil [J]. Science of the Total Environment, 2020, 709(3): 136276. [27] 张凯娜, 李嘉, 李晓强, 等. 微塑料表面土霉素的吸附-解吸机制与动力学过程 [J]. 环境化学, 2017, 36(12): 2531-2540. doi: 10.7524/j.issn.0254-6108.2017032703 ZHANG K N, LI J, LI X Q, et al. Mechanisms and kinetics of oxytetracycline adsorption-desorption onto microplastics [J]. Environmental Chemistry, 2017, 36(12): 2531-2540(in Chinese). doi: 10.7524/j.issn.0254-6108.2017032703
[28] ZHANG H B, WANG J Q, ZHOU B Y, et al. Enhanced adsorption of oxytetracycline to weathered microplastic polystyrene: Kinetics, isotherms and influencing factors [J]. Environmental Pollution, 2018, 243(12): 1550-1557. [29] ZHOU Q, ZHANG H B, FU C C, et al. The distribution and morphology of microplastics in coastal soils adjacent to the Bohai Sea and the Yellow Sea [J]. Geoderma, 2018(7): 201-208. [30] LV W, ZHOU W Z, LU S B, et al. Microplastic pollution in rice-fish co-culture system: A report of three farmland stations in Shanghai, China [J]. Science of the Total Environment, 2019, 652(1): 1209-1218. [31] ZHOU Y F, LIU X N, WANG J. Characterization of microplastics and the association of heavy metals with microplastics in suburban soil of central China [J]. Science of the Total Environment, 2019, 694(12): 133798. [32] HUFFER T, METZELDER F, SIGMUND G, et al. Polyethylene microplastics influence the transport of organic contaminants in soil [J]. Science of the Total Environment, 2019, 657(3): 242-247. [33] SUN Y, YUE Q, GAO B, et al. Preparation of activated carbon derived from cotton linter fibers by fused NaOH activation and its application for oxytetracycline (OTC) adsorption [J]. Journal of Colloid and Interface Science, 2012, 368(1): 521-527. doi: 10.1016/j.jcis.2011.10.067 [34] JANG H M, YOO S, CHOI Y K, et al. Adsorption isotherm, kinetic modeling and mechanism of tetracycline on Pinus taeda-derived activated biochar [J]. Bioresource Technology, 2018, 259(7): 24-31. [35] HARJA M, CIOBANU G. Studies on adsorption of oxytetracycline from aqueous solutions onto hydroxyapatite [J]. Science of the Total Environment, 2018, 628/629(7): 36-43. [36] 王静, 朱晓丽, 韩自玉, 等. 3种典型多孔高温改性固废材料对磺胺二甲嘧啶的吸附特性 [J]. 环境科学, 2020, 41(3): 1319-1328. WANG J, ZHU X L, HAN Z Y, et al. Adsorption characteristics of sulfamethazine on three typical porous high-temperature modified solid waste materials [J]. Environmental Science, 2020, 41(3): 1319-1328(in Chinese).
[37] LU J B, XU K, LI W L, et al. Removal of tetracycline antibiotics from aqueous solutions using easily regenerable pumice: Batch and column study [J]. Water Quality Research Journal of Canada, 2018, 53(3): 143-155. doi: 10.2166/wqrj.2018.012 [38] 王东升, 张婷, 晁宇. 离子强度和离子类型对土霉素在草甸土中被吸附的影响 [J]. 生态环境学报, 2014, 23(5): 870-875. doi: 10.3969/j.issn.1674-5906.2014.05.022 WANG D S, ZHANG T, CHAO Y. Influence of different strength and species of cation on adsorption of oxytetracycline in meadow soils [J]. Ecology and Environmental Sciences, 2014, 23(5): 870-875(in Chinese). doi: 10.3969/j.issn.1674-5906.2014.05.022
[39] 齐瑞环, 李兆君, 龙健, 等. 土壤粉碎粒径对土霉素在土壤中吸附的影响 [J]. 环境科学, 2011, 32(2): 589-595. QI R H, LI Z J, LONG J, et al. Effects of soil trituration size on adsorption of oxytetracycline on soils [J]. Environmental Science, 2011, 32(2): 589-595(in Chinese).
[40] HADI, M, SAMARGHANDI, M R, MCKAY, G. Equilibrium two-parameter isotherms of acid dyes sorption by activated carbons: study of residual errors[J]. Chemical Engineering Journal , 2010, 160(2): 408-416. [41] GUNAY A, ARSLANKAYA E, TOSUN İ. Lead removal from aqueous solution by natural and pretreated clinoptilolite: Adsorption equilibrium and kinetics [J]. Journal of Hazardous Materials, 2007, 146(1/2): 362-371. [42] LI J, ZHANG K N, ZHANG H. Adsorption of antibiotics on microplastics [J]. Environmental pollution, 2018, 237(6): 460-467. [43] ZHANG S, HAN B, SUN Y et al. Microplastics influence the adsorption and desorption characteristics of Cd in an agricultural soil[J]. Journal of Hazardous Materials, 2020, 388(4): 121775. [44] WANG F, SHIH K M, LI X Y. The partition behavior of perfluorooctanesulfonate(PFOS) and perfluorooctanesulfonamide(FOSA) on microplastics [J]. Chemosphere, 2015, 119(2): 841-847. [45] 张翠, 胡学锋, 骆永明. 模拟太阳光下水中土霉素的光化学降解 [J]. 环境化学, 2016, 35(3): 430-438. doi: 10.7524/j.issn.0254-6108.2016.03.2015101303 ZHANG C, HU X F, LUO Y M. Aqueous photodegradation of oxytetracycline under simulated sunlight irradiation [J]. Environmental Chemistry, 2016, 35(3): 430-438(in Chinese). doi: 10.7524/j.issn.0254-6108.2016.03.2015101303
[46] TORKZABAN S, BRADFORD S A, van GENUCHTEN M T, et al. Colloid transport in unsaturated porous media: The role of water content and ionic strength on particle straining [J]. Journal of Contaminant Hydrology, 2008, 96(1): 113-127. [47] LUO Y Y, ZHANG Y Y, XU Y B, et al. Distribution characteristics and mechanism of microplastics mediated by soil physicochemical properties [J]. Science of the Total Environment, 2020, 726(7): 138389. -






 DownLoad:
DownLoad: