-
抗生素的发现与应用是人类历史上一个重要的里程碑,其被广泛应用于医疗、畜牧业及水产养殖业,治疗疾病和提高动物的生长速度[1]。目前使用较多的抗生素种类有喹诺酮类、β内酰胺类、大环内酯类和氨基糖苷类等[2]。据统计,2016年美国用于兽药的四环素类、磺胺类和大环内酯类抗生素销售总量为11025吨[3]。2013年我国消耗的抗生素量达162000吨,其中48%用于医疗,其余用于家禽和水产等[4]。然而,进入人类和动物体内的抗生素不会被全部吸收,约有30%−90%会随着尿液或粪便排出[5]。因未被完全利用和处理,每年约53800吨抗生素被排放到环境中,其中约46%的抗生素排至水体中,剩余部分则通过农业施肥和污泥回用扩散到土壤环境中[4]。
进入土壤后,一部分抗生素通过生物及非生物的作用被降解甚至矿化[5],另一部分抗生素母体及其转化产物则残留于土壤或土壤生物(植物、动物)中,其中部分残留在不破坏基质结构的前提下无法用有机溶剂提取出来,这部分残留为不可提取态残留(non-extractable residues, NERs)[6]。NERs的形成曾被认为是土壤应对外源污染物的一种解毒机制,当土壤环境条件变化时,NERs可能会被重新释放并带来风险[7]。然而,目前抗生素在土壤中形成NERs的机制及其生物可利用性尚不明确。本文旨在综述抗生素在土壤中的归趋,重点阐明NERs的形成、影响因素及其稳定性和生物可利用性,并对未来研究方向提出展望。
-
环境中抗生素的主要来源有:制药工厂、医院、居民区和养殖场产生的污水和固体废弃物[8](图1)。制药工厂含抗生素的废水以及医院和家庭排出的污水通过城市污水管网进入污水处理厂[9],但污水处理厂的传统处理工艺并不是针对抗生素类新兴有机污染物所设计,对抗生素的去除率较低,在污水处理厂的出水中常能检测到一定浓度的抗生素残留。Gao等[10]对北京8家污水处理厂抗生素去除效率的调查结果表明,喹诺酮类、磺酰胺类和大环内酯类抗生素的去除效率分别为48%−72%、39%−64%和34%−69%,其中磺胺嘧啶和磺胺甲恶唑在出水中的浓度分别为0.12−0.56 μg·L−1和0.13−0.46 μg·L−1,这些未被完全去除的抗生素残留即随处理后的出水排入地表水中。医院治疗和家庭生活中部分抗生素未经使用,即随生活垃圾被当作固废填埋,通过垃圾渗滤液进入到土壤中[11]。畜牧养殖场中施用的抗生素并不能被动物完全吸收,大部分会随着粪便或尿液排出[12],或被收集后进入污水处理厂处理,或被作为肥料施用于土壤中。水产养殖中抗生素作为饲料添加剂被直接施用于水体中,这些水体通常与河流或海洋相连,导致抗生素直接进入地表水中[13]。土壤是抗生素在环境中重要的汇,抗生素在其中的迁移需要格外关注。
-
抗生素在地表水、地下水和土壤等环境介质中都有被广泛检出,一般在ng·L−1或μg·L−1水平(表1)。如Luo等[9]在海河主流和支流的27个采样点中检出了12种抗生素,其中磺胺类抗生素的检出频率最高,检出浓度为24−385 μg·L−1。通过对全球各地环境介质中红霉素分布情况进行总结,Schafhauser等[14]发现红霉素在淡水系统中的浓度分布范围从低于检测限至75500 ng·L−1,海洋系统中红霉素的浓度最高可达1900 ng·L−1。土壤是环境中抗生素残留重要的汇。中国北方有机蔬菜基地土壤中四环素类、磺胺类和喹诺酮类抗生素的总浓度范围为0.1–2683 μg·kg−1[15];奥地利养殖场附近土壤中环丙沙星的浓度可达370 μg·kg−1[16]。
植物和动物生长在被抗生素污染的土壤中,会吸收其中的抗生素并在体内富集。Hu等[15]在调研天津4个有机蔬菜基地后发现,当对多种蔬菜施用含8.3−43.5 mg·kg−1四环素、0.4−26.8 mg·kg−1金霉素、0.1−32.7 mg·kg−1磺胺多辛和0.12−3.8 mg·kg−1林可霉素的粪肥时,萝卜、油菜、芹菜和香菜叶片中四环素、金霉素、磺胺多辛和林可霉素的浓度分别为1.4−5.6 μg·kg−1、6−532 μg·kg−1、0.2−1.2 μg·kg−1和0.7−20 μg·kg−1。向土壤中施用100 mg·kg−1的恩诺沙星时,土壤中的蚯蚓体内检出大约2 mg·kg−1的恩诺沙星,当施用浓度为500 mg·kg−1时,蚯蚓体内检出浓度约为14 mg·kg−1[17]。
虽然抗生素在土壤环境中的浓度远低于一些传统的有机污染物,但是其环境风险不容忽视。抗生素残留对土壤中植物和动物的生长会产生一定的影响。如对黄瓜、莴苣、菜豆和萝卜施用浓度为0.05−5 mg·L−1的恩诺沙星时,会改变植株的初生根、下胚轴和子叶的长度[18]。Yang等[19]的研究中发现10 mg·kg−1的环丙沙星能够诱导蚯蚓体内的氧化应激,并影响其mRNA的表达,导致DNA的损伤。Dong等[20]的研究中发现3 mg·kg−1的四环素会引起蚯蚓DNA的损伤。动植物体内的抗生素还会通过食物链传递到人体中,进而对人体健康造成潜在危害[21]。
除自身的风险外,抗生素的长期滥用会诱导细菌产生抗性基因,再通过水平转移在环境中扩散[22],导致不同环境介质中均有抗性基因的检出。例如,长期施用含抗生素残留的污泥和鸡粪的田间土壤中检出了130种抗生素抗性基因,未施加鸡粪和污泥的土壤、施加鸡粪的土壤以及施加污泥处理的土壤中,抗性基因丰度分别约为0.01 copies·cell−1、0.045 copies·cell−1和0.015−0.04 copies·cell−1[23];Munir等[24]在土壤中检测到浓度分别为3.61×104 copies·g−1、1.05×106 copies·g−1和4.19×104 copies·g−1的抗性基因Tet(W)、Tet(O)和Sul-1;Munir等[25]在密歇根污水处理厂出水中,也检出了磺胺和四环素的抗性基因,最高丰度达2.33×107 copies·L−1,出水用于农业灌溉会直接导致抗性基因向土壤中的转移。具有抗性基因的细菌中会出现对多种抗生素同时具有耐性的菌株,即“超级细菌”。耐甲氧西林金黄色葡萄球菌(MRSA)是目前研究较多的一种超级细菌,全球各地都有人体感染MRSA的病例报道[26]。MRSA有多种进化和突变菌株,目前人类还不能控制其传播感染,因此“超级细菌”会对人类的健康构成持续的威胁[27]。
-
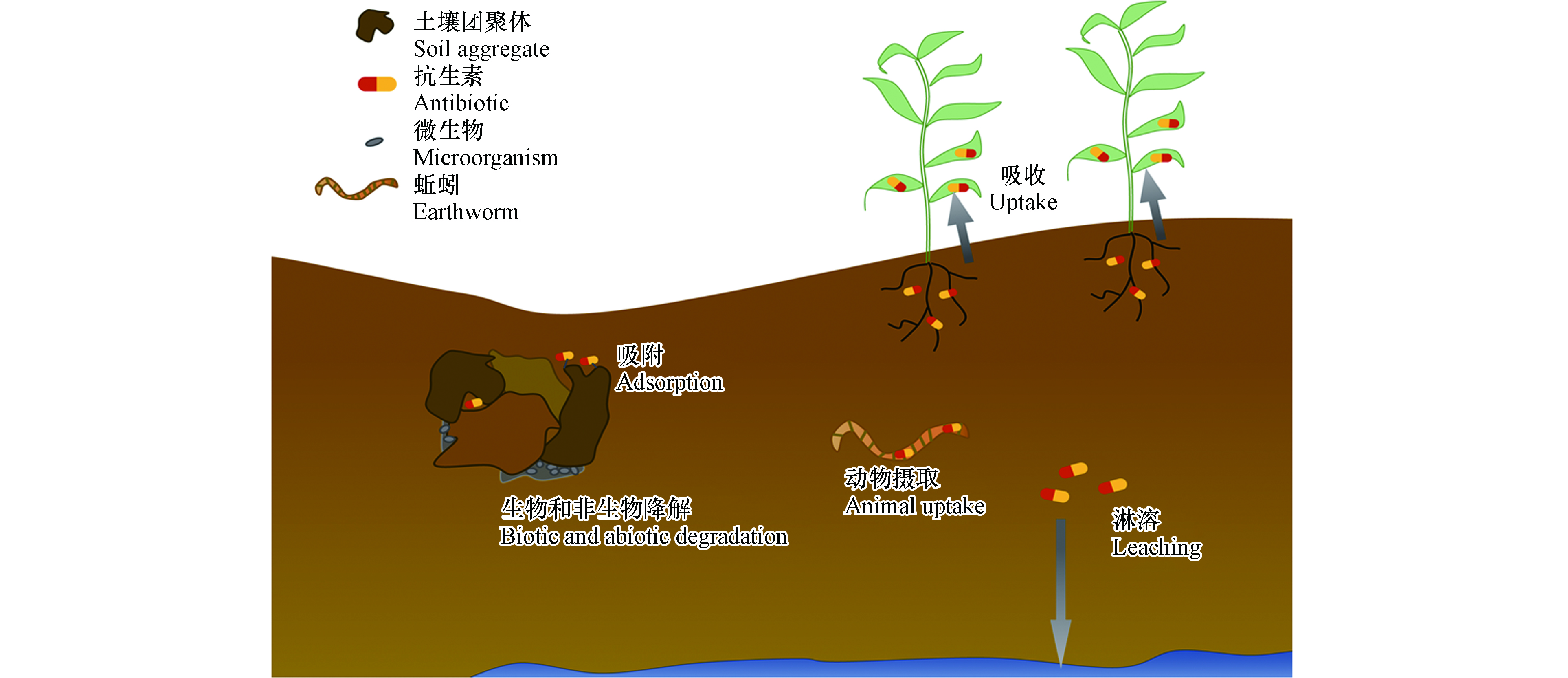
含有抗生素的粪便以及污水处理厂的污泥和出水常被作为有机肥料和灌溉水施加至农田土壤中,成为土壤中抗生素污染的主要来源[52]。进入土壤后,抗生素会被生物或非生物作用转化,或被吸附至土壤基质中,或淋溶迁移到地表水及地下水中,或被土壤植物和动物吸收富集,其中吸附和降解是抗生素在土壤中消散的主要途径[22](图2)。在吸附和降解的过程中,抗生素在土壤中的(有机溶剂)可提取态会减少,转而被矿化或通过物理化学包埋作用、共价键作用与土壤颗粒结合或被生物同化形成NERs[53]。
-
抗生素在土壤中的吸附和降解与土壤特性有关,如土壤组分、土壤有机质含量和pH等[54]。已有研究表明,不同深度土壤中阳离子和有机质的含量有差异,导致同种抗生素在不同深度土层中的吸附常数Kd 差异较大[55]。在有机碳含量分别为17.6、15.5 、10.2 g·kg−1 的土壤中培养,3 d后磺胺甲恶唑易提取馏分(羟丙基-β-环糊精提取)降低至20%左右,NERs占最初加入量的50%左右,后续培养153 d内NERs含量变化不大[56]。磺胺甲恶唑在不同土壤中的矿化量分别为6.6%、8.9%和10.5%,即随着土壤有机质含量的降低,磺胺甲恶唑的可降解性增加[56]。土壤的pH会影响抗生素的解离度,从而影响抗生素在土壤中的行为。土壤pH值高于弱酸性抗生素的pKa值时,会促进某些抗生素的迁移[57]。例如,在高pH条件下,阴离子磺胺类抗生素和土壤表面的负电荷之间的静电斥力会减弱其疏水吸附[58]。
抗生素在土壤中的吸附降解也与其本身的性质有关,如疏水性、稳定性和溶解度等[5]。例如,磺胺甲恶唑在土壤中的分布系数Kd为3.2—3.3 L·kg −1,环丙沙星Kd为161—546 L·kg −1,土霉素Kd为503—1278 L·kg −1[55]。由于磺胺类抗生素仅具有苯胺和酰胺基,与土壤表面结合位点之间的相互作用较弱,因此在土壤中的迁移性和生物可利用性较高;而四环素、大环内酯和氟喹诺酮类抗生素具有多个官能团,能通过多种吸附机制(如阳离子交换、阳离子桥键和氢键、以及与土壤中金属氧化物的表面络合等)与土壤组分之间建立较强的相互作用[59]。同样的培养条件下,磺胺甲恶唑在土壤中的矿化量为6.6%–10.5%,环丙沙星的矿化量仅为0.5%–0.6%[56]。在土壤中培养7 d后,约65%的红霉素和20%磺胺二甲嘧啶矿化,而环丙沙星未矿化[60]。相比磺胺甲恶唑、红霉素和磺胺二甲嘧啶,环丙沙星在土壤颗粒上的吸附更强,稳定性更高,从而导致其生物可利用性更低。
土壤是一个非均质体,存在好氧/厌氧微域,微生物种类丰富,从而为抗生素的生物降解提供了有利条件。Pan等[61]发现土壤中四环素半衰期为31.8−43.3 d,磺胺二甲嘧啶半衰期为24.8−34.7 d,诺氟沙星、红霉素和氯霉素半衰期都在11 d以下;而灭活土壤中,所有5种抗生素均表现出中度或高度的持久性,半衰期为40.8−86.6 d。Zhang等[62]的研究中同样发现磺胺嘧啶和磺胺甲恶唑在活性土壤中的降解速度大于灭活土壤,降解的主要中间产物来自羟基化,磺胺S-N键裂解和苯胺部分氧化。不同氧化还原条件下抗生素的降解程度亦不同。Liu等[63]的实验中,有氧条件下磺胺甲恶唑、甲氧苄啶和泰乐菌素的耗散速度大于无氧条件;Yang等[64]也观察到好氧和缺氧条件下土霉素的降解有类似规律。为促进土壤中抗生素的降解转化,Riaz等[65]向土壤中添加了3种从污泥中分离出的具有抗生素抗性的菌株后,与对照组相比,添加菌株的处理组中可提取的环丙沙星、恩诺沙星和左氧氟沙星含量显著降低。
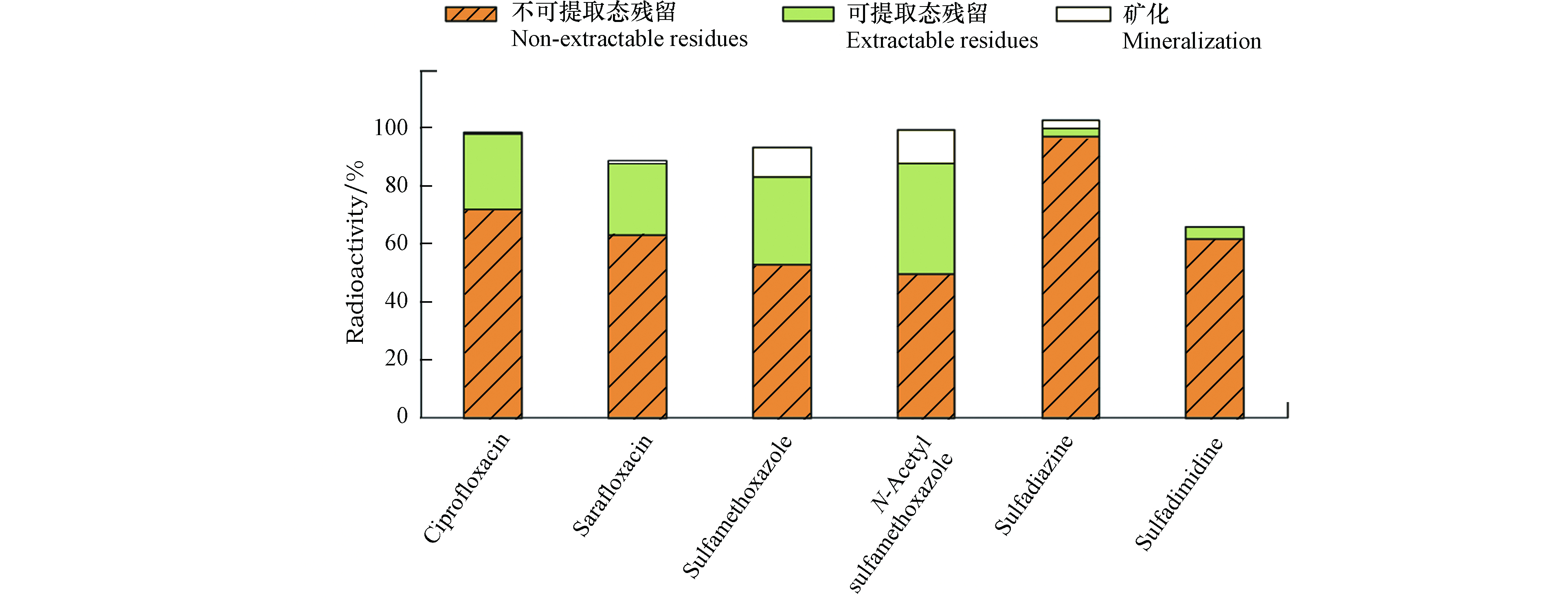
放射性同位素示踪技术表明,抗生素在吸附和降解的过程中,会形成大量的NERs,甚至构成了抗生素在土壤中的主要归趋(图3)。如Hoeltge 等[53]的研究表明,随着培育时间增加,磺胺甲恶唑和乙酰磺胺甲恶唑在施加污泥和粪便的土壤中可提取部分逐渐减少,与之对应的NERs增加,矿化量递增至2%左右。Schmidt等[66]的研究中,含磺胺嘧啶的粪肥与土壤混合后,可提取态的磺胺嘧啶及其代谢产物随着培育时间的增加逐渐减少,从42%降至8%左右,培育218 d后NERs的生成量达90%以上,矿化量低于2%。
-
土壤对抗生素的吸附作用在一定程度上截留了进入土壤的抗生素,但是降雨导致的淋溶和干湿交替会使抗生素随着径流迁移到更深层的土壤以及地下水中。Mehrtens等[67]通过监测田间不同深度的土壤孔隙水和地下水中抗生素的浓度来跟踪施加的8种抗生素进入土壤后的去向,在土壤孔隙水中检测到7种目标化合物,其中4种(磺胺嘧啶、磺胺二甲嘧啶、四环素和提洛米林)进入地下水。在土壤中施加含抗生素的粪肥后,Hamscher等[68]在地面1.4 m以下的地下水中检测到了0.18 μg·L−1磺胺二甲嘧啶。Balzer等[69]调查了德国养殖牲畜密度较大的农场附近48处地下水中抗生素污染的情况,其中有9处检出了3类磺胺类抗生素,最高浓度为950 ng·L−1。
抗生素在土壤中的迁移能力与抗生素的分配系数有关,如林可霉素和磺胺二甲嘧啶相对亲水,在土壤中比较容易迁移;而莫能菌素疏水性较强,因此容易吸附在土壤中不容易迁移[57]。Blackwell等[70]开展野外实验发现,土霉素和泰乐菌素都被截留在土壤中,在土壤渗出液中仅检测出磺胺氯哒嗪。这些在土壤中自由迁移的抗生素是生物可给的,会被动物和植物吸收。
-
农田土壤被抗生素污染后,生长于其中的植物在蒸腾作用的驱动下会吸收富集抗生素[71](图2),植物体内抗生素的浓度一般在几十到几百μg·kg−1。抗生素在作物可食部分的累积会对动物和人类健康带来潜在风险[72]。进入植物体内后,外源污染物会经历3个阶段:第一阶段为修饰反应,污染物可能发生氧化、水解或脱烷基等反应;第二阶段污染物与葡萄糖、氨基酸等小分子结合,极性增加;第三阶段极性增加的污染物会在植物体内运输、降解、与细胞壁结合或储存在液泡中[73]。
抗生素在植物中的吸收和转移主要与其疏水性和解离度有关[74]。中性抗生素在植物根部的吸收与其lg Dow(经pH修正的后的辛醇-水分配系数)呈正相关关系;酸性抗生素化合物则可能通过离子阱等机制被捕获、积累在根部细胞中;而碱性抗生素可解离产生阳离子,所带正电荷与植物原生质膜上的负电荷会相互吸引从而可促进其被根部吸收,也可通过离子阱机制积累到液泡中,其中亲脂性的碱性化合物还易被分配到根壁上进而促进根部吸收[73]。吸收进入根部后,抗生素在植物中的转运转移与其疏水性总体呈负相关关系,亲水性的化合物(lg Dow = 0.5−3)更容易被转运至植物叶片部分,而疏水性化合物多集中在根部[73]。除吸收和转运外,植物还可以通过体内的一些酶降解抗生素,例如细胞色素P450依赖性单加氧酶和漆酶[75]。在酶的作用下,抗生素会被水解或与生物分子结合,还可进一步被紧密结合在细胞壁或隔离在液泡中,达到解毒的作用[76]。
除植物外,动物体内亦会富集抗生素。在使用含环丙沙星和阿奇霉素的生物固体改良土壤后,土壤中蚯蚓体内这两种抗生素的浓度分别为土壤中抗生素浓度的4倍和7倍,蚯蚓吸收的大部分抗生素被排泄,大约20%环丙沙星和40%阿奇霉素被生物积累[77]。Huang等[78]发现,环丙沙星不仅会被蚯蚓吸收,还会促进Cu等金属离子在蚯蚓体内的积累。目前动物吸收和富集抗生素的研究对象多为人和畜禽,非靶向动物体内抗生素的吸收和富集情况研究较少,值得进一步探究。
-
多数抗生素在环境中的主要归趋是残留在土壤中形成NERs[56, 79- 80](图3),须采用14C同位素示踪法对NERs展开研究。14C同位素示踪法可对目标污染物进行标记,在不改变化合物分子结构及其环境行为的前提下准确定量基质中目标污染物NERs的放射性,而传统的提取方法无法表征这些组分[81] 。为量化NERs组分,需将基质中可提取态的组分去除。Schaeffer等[7]提出的提取步骤分为三步:使用盐/缓冲液(如CaCl2溶液、硝酸盐或乙酸盐的水溶液)萃取生物可利用的部分;然后使用有机溶剂混合物(例如乙腈/水溶液)提取易于解吸的部分;最后使用索氏提取、加速溶剂萃取(ASE)、加压溶剂萃取(PLE)、超临界流体萃取(SEF)或微波辅助萃取(MAE)彻底萃取以释放出可提取馏分[7]。经提取后NERs留在基质中,再通过氧化燃烧仪将其转化成14CO2 ,并捕集在cocktail溶剂中,利用液体闪烁计数器(LSC)测定NERs的总量。然而,该方法中ASE, PLE, SEF, MAE等方法对基质有破坏,不符合NERs的定义。目前还没有统一标准的NERs提取方法(表2),尚需要进一步探索。
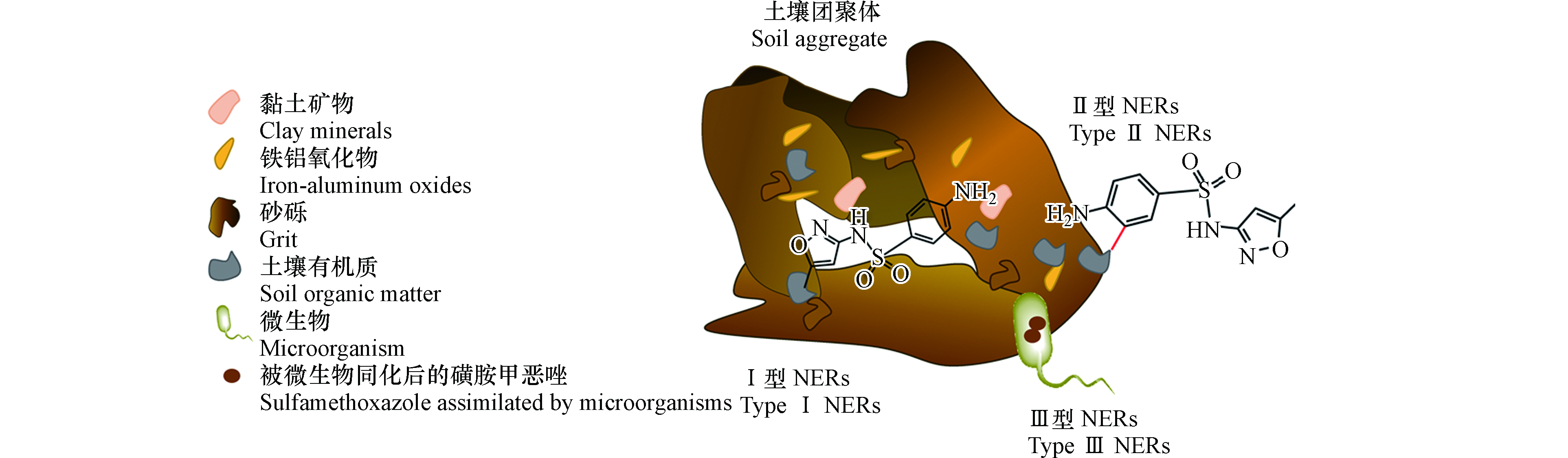
根据形成机制的不同,抗生素的NERs一般可分为三类(图4):锁定态(Ⅰ型),即化合物通过静电相互作用、氢键、范德华力或疏水相互作用等吸附在土壤基质或被包埋于土壤孔隙中的残留;共价结合态(Ⅱ型),即化合物和基质间形成性质稳定C—O键、C—C键、C—N键等共价键的残留;生物质源态(Ⅲ型),即化合物被土壤微生物利用,同化为生物质后以生物分子或腐殖质形式被固定在土壤中的残留[22, 82]。例如,Junge等[54]利用尺寸排阻色谱法分离纯化后的富里酸,从中提取出被物理包裹在土壤有机质中的二氟沙星或其代谢产物的NERs。Cao等[83]利用硅烷化试剂(二甲亚砜、吡啶和三甲基氯硅烷配制而成)提取了双酚S在土壤中形成的Ⅰ型NER,形成量占NERs总量的20%左右,液相色谱和液体闪烁计数(HPLC-14C-LSC)结果表明Ⅰ型NERs为母体化合物以及少量的极性代谢产物,经过硅烷基化处理后的土壤进行碱水解后,双酚S释放了约16%酯键和醚键连接的NERs。在Yao等[84]的研究中,Ⅰ型NERs仅检测到母体化合物单溴二苯醚(BDE 3),酯键连接的NERs仅检测到其代谢产物4′-OH-BDE3。在氧化酶的作用下,磺胺类抗生素会与腐殖质中的醌和羰基基团发生亲核加成,形成共价结合态NERs[85]。
土壤中NERs的形成受抗生素自身物理化学性质和土壤性质影响[86](表2)。土壤中的腐殖质具有许多活性官能团,含有羟基、羧基、羰基或氨基等官能团的污染物容易与其发生反应形成NERs[87]。在相同的条件下培养156 d后,含氨基的磺胺甲恶唑约有50%转化为NERs,而环丙沙星(同含羧基、羰基和氨基)则有72.2%–77.6%形成NERs[56]。沙拉沙星在壤土、粉壤土和砂壤土中培养66 d后,分别有63%、22%和14%形成NERs,形成量随土壤有机质含量降低而减少[79]。外源性有机质的添加会促进抗生素NERs的形成。在添加了10%生物固体(biosolid)的土壤中,81%的磺胺甲恶唑形成了NERs,而在未添加生物固体的土壤中仅有37%的NERs生成[87];N-乙酰基磺胺甲恶唑在添加粪肥和污泥后的土壤中形成的NERs量(56%–60%)也高于未添加土壤(50%)[56]。
土壤中微生物活性和生物活动也是影响抗生素NERs形成的重要因素。微生物能够将污染物转化为易与土壤基质反应的产物,从而将其固定在土壤中。磺胺嘧啶在活性土壤中形成的NERs量约为灭菌土壤的3倍[88];有氧条件下嘧菌环胺形成的NERs总量比灭菌或厌氧条件下更高[89]。生物活动也会影响土壤中污染物的分布和转化,例如,在未种植植物的土壤中约有60.8%最初投加的四溴双酚A形成NERs,而种植水稻和芦苇后仅有50.1%和40%的四溴双酚A形成NERs,可能是植物根系改变了土壤的氧化还原条件[90]。蚯蚓等土壤生物可富集土壤中的四溴双酚A、双酚F等污染物并通过同化作用使其形成NERs,从而减少土壤中污染物NERs的产生量[91-93]。然而,目前尚无生物活动影响土壤中抗生素形成的NERs的研究,因此有必要进一步探究土壤中抗生素NERs与生物活动之间的关系。
-
NERs的形成使得抗生素被截留在土壤中,降低了其生物可利用性。若形成较稳定的NERs,则该过程可降低抗生素的环境风险;若形成的NERs不稳定,则抗生素污染物仍有被重新释放的可能性,从而会再度对环境造成威胁。因此,对抗生素NERs稳定性和生物可利用性的研究至关重要。三种类型的NERs中,生物质源态NERs中污染物分子中的碳已被生物同化,被认为对环境无风险;共价结合形成的NERs相对稳定,而物理化学包埋形成的NERs可能会被缓慢释放到环境中[82]。
土壤环境(如水分)的变化,尤其是植物、土壤动物和微生物的活动会改变土壤有机质的结构[94],可能使得NERs从基质中释放,并进一步被生物利用[95]。Bao等[96]发现在含土霉素NERs的土壤中分别加入蚯蚓和种植蚕豆后,蚕豆处理组可提取的土霉素量高于蚯蚓处理组,作者推测可能是由于蚕豆处理组水分蒸发更快因此需要不断添加去离子水,土壤干湿交替过程导致土霉素NERs的释放。红壤土中种植了菜苔(Brassica parachinensis)后,约31%的红霉素NERs释放转化为可提取态,NERs释放后能够被植物利用,菜苔吸收了约0.5%的初始放射性量;在未种植植物的处理组中仅有约15%的红霉素NERs转化为可提取态,而鸡粪和污泥类生物固体的添加会抑制红霉素NERs的释放[97]。Heise等[94]发现在含磺胺嘧啶NERs的土壤中种植芜菁(Brassica rapa)以及添加蚯蚓(Lumbricus terrestris)后,土壤中磺胺嘧啶NERs约有3%−11%释放,芜菁能摄取NERs总量的0.2%,蚯蚓可以摄取1%−4%,而添加牛粪的蚯蚓和芜青处理组中磺胺嘧啶NERs的释放相对较少。微生物则会消耗土壤中的有机质,使结合在腐殖质分子上的污染物分子释放,从而破坏NERs的稳定性[95]。由此可见,抗生素形成NERs后其环境风险依然存在,尤其是当土壤环境改变时,NERs会再次释放到环境中,并且会被生物吸收。抗生素NERs释放出的组分可能是抗生素母体,也可能是其代谢产物,而目前关于这类组分鉴定的研究较少。释放到环境中的NERs组分如不能被生物所利用,则会对环境产生潜在的威胁。因此,抗生素NERs的稳定性及其释放组分的鉴定研究有助于准确评估抗生素的环境风险。
-
抗生素可以治疗人类和动物疾病,但生产、生活和养殖业中抗生素的大量使用以及污水处理厂较低的处理效率导致了环境介质(水体、土壤)和生物体(植物、动物)中抗生素的累积。虽然抗生素的环境浓度相对较低,但其污染来源广泛、污染排放持续,且会对生物产生毒害作用,还会引发抗性基因问题。土壤是抗生物在环境中重要的汇,其在土壤中的归趋主要受其物理化学性质(如疏水性、稳定性和溶解度等)和环境介质特性(如pH、组分等)的影响,主要被吸附降解并形成NERs,少部分被淋溶迁移到地表水及地下水中,或被土壤植物和动物吸收富集。根据形成机理的不同,抗生素的NERs可分为锁定态、共价结合态和生物质源态。易与基质组分(如土壤有机质)发生反应的抗生素更容易形成NERs。土壤中抗生素NERs的稳定性与环境条件有关,环境条件的改变如土壤含水量变化以及生物活动(植物、动物和微生物)可能导致NERs从环境介质中释放出来。
NERs作为抗生素在土壤环境中的重要归趋,还未得到足够的关注。抗生素NERs的定量很大程度上取决于从介质中分离NERs的方法,然而目前还没有统一的分离步骤,特别是针对不同类型NERs的分离方法还需要进一步研究。生物活动会影响土壤中污染物的分布和转化,目前尚缺少有关生物活动影响土壤中抗生素NERs形成、以及抗生素在非靶向生物体内富集和NERs形成的研究。抗生素形成NERs后,一定程度上降低了其环境风险,但当环境条件变化时,NERs可能再次释放抗生素或其转化产物。为准确评估抗生素的环境风险,需要阐明环境中NERs的稳定性和生物可利用性。14C同位素示踪法可以准确地定量分析复杂介质中污染物的归趋,与色谱-质谱和核磁共振谱法等技术相结合,可以实现NERs组份的鉴定,从而为全面了解环境中抗生素的归趋、准确评估抗生素的环境风险提供有效的技术手段。
抗生素在土壤中的归趋及不可提取态残留
Fate and non-extractable residues of antibiotics in soil
-
摘要: 抗生素是近年来备受关注的一种新兴环境污染物,进入环境后会被降解或残留在环境介质和环境生物体内。在土壤中形成不可提取态残留(NERs)是抗生素重要的环境归趋,然而有关土壤中抗生素NERs形成机理和环境风险的研究尚处于起步阶段。NERs的形成能在一定程度上降低抗生素的环境危害,但当土壤环境条件改变时NERs仍有重新释放的潜在风险。本文在综述环境中抗生素的污染来源、浓度和风险的基础上,总结了土壤中抗生素的归趋,讨论了 NERs的形成机理及影响因素、稳定性和生物可利用性,并指出了环境中抗生素的归趋尤其是NERs的研究中尚存在的科学问题。未来研究中应关注土壤生物活动对抗生素NERs形成的影响,以及非靶向生物内的抗生素转化,建立标准化的NERs分析方法,为全面揭示土壤中抗生素的归趋、准确评估抗生素的环境风险提供理论和技术支撑。Abstract: Recently antibiotics receive extensive attention as emerging organic contaminants. They are either degraded or remained in environmental matrices after entering the environment. Formation of non-extractable residues (NERs) is the key fate of antibiotics in the soil environment, which reduces environmental risks of antibiotics. However, NERs are very likely to release and become extractable in the soil when the soil conditions change and related research is still in its infancy. Here, we reviewed sources, concentrations, and environmental risks of various antibiotics in the environment, and summarized the fate of antibiotics in soil. The formation mechanism and influencing factors of NERs as well as their stability and bioavailability were discussed. Finally, challenges were proposed for studies on fate of antibiotics and especially their NERs in soil, including impact of organisms on the formation of NERs, fate of antibiotics in non-target organisms, standardization of NER extraction methods and qualification of NER formation and release. This review helps for comprehensive understanding of fate of antibiotics in soil, which provides theoretical and technical supports for evaluation of environmental risks of antibiotics.
-
Key words:
- antibiotics /
- soil /
- organisms /
- fate /
- non-extractable residues /
- environmental risks
-
抗生素的发现与应用是人类历史上一个重要的里程碑,其被广泛应用于医疗、畜牧业及水产养殖业,治疗疾病和提高动物的生长速度[1]。目前使用较多的抗生素种类有喹诺酮类、β内酰胺类、大环内酯类和氨基糖苷类等[2]。据统计,2016年美国用于兽药的四环素类、磺胺类和大环内酯类抗生素销售总量为11025吨[3]。2013年我国消耗的抗生素量达162000吨,其中48%用于医疗,其余用于家禽和水产等[4]。然而,进入人类和动物体内的抗生素不会被全部吸收,约有30%−90%会随着尿液或粪便排出[5]。因未被完全利用和处理,每年约53800吨抗生素被排放到环境中,其中约46%的抗生素排至水体中,剩余部分则通过农业施肥和污泥回用扩散到土壤环境中[4]。
进入土壤后,一部分抗生素通过生物及非生物的作用被降解甚至矿化[5],另一部分抗生素母体及其转化产物则残留于土壤或土壤生物(植物、动物)中,其中部分残留在不破坏基质结构的前提下无法用有机溶剂提取出来,这部分残留为不可提取态残留(non-extractable residues, NERs)[6]。NERs的形成曾被认为是土壤应对外源污染物的一种解毒机制,当土壤环境条件变化时,NERs可能会被重新释放并带来风险[7]。然而,目前抗生素在土壤中形成NERs的机制及其生物可利用性尚不明确。本文旨在综述抗生素在土壤中的归趋,重点阐明NERs的形成、影响因素及其稳定性和生物可利用性,并对未来研究方向提出展望。
1. 抗生素(Antibiotics)
1.1 主要来源
环境中抗生素的主要来源有:制药工厂、医院、居民区和养殖场产生的污水和固体废弃物[8](图1)。制药工厂含抗生素的废水以及医院和家庭排出的污水通过城市污水管网进入污水处理厂[9],但污水处理厂的传统处理工艺并不是针对抗生素类新兴有机污染物所设计,对抗生素的去除率较低,在污水处理厂的出水中常能检测到一定浓度的抗生素残留。Gao等[10]对北京8家污水处理厂抗生素去除效率的调查结果表明,喹诺酮类、磺酰胺类和大环内酯类抗生素的去除效率分别为48%−72%、39%−64%和34%−69%,其中磺胺嘧啶和磺胺甲恶唑在出水中的浓度分别为0.12−0.56 μg·L−1和0.13−0.46 μg·L−1,这些未被完全去除的抗生素残留即随处理后的出水排入地表水中。医院治疗和家庭生活中部分抗生素未经使用,即随生活垃圾被当作固废填埋,通过垃圾渗滤液进入到土壤中[11]。畜牧养殖场中施用的抗生素并不能被动物完全吸收,大部分会随着粪便或尿液排出[12],或被收集后进入污水处理厂处理,或被作为肥料施用于土壤中。水产养殖中抗生素作为饲料添加剂被直接施用于水体中,这些水体通常与河流或海洋相连,导致抗生素直接进入地表水中[13]。土壤是抗生素在环境中重要的汇,抗生素在其中的迁移需要格外关注。
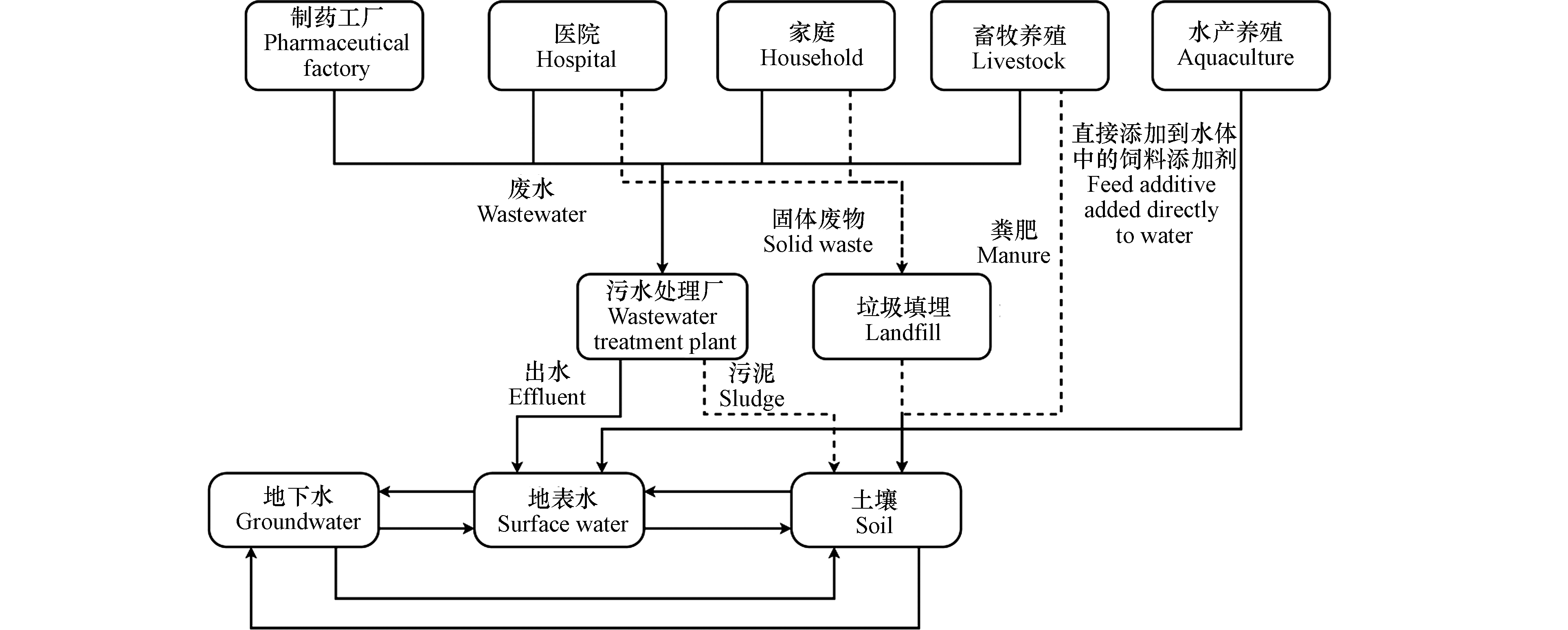 图 1 环境中抗生素污染的主要来源,其中土壤是抗生素重要的汇[8]Figure 1. Major sources of antibiotic pollution in the environment, among which soil is a crucial sink of the antibiotics
图 1 环境中抗生素污染的主要来源,其中土壤是抗生素重要的汇[8]Figure 1. Major sources of antibiotic pollution in the environment, among which soil is a crucial sink of the antibiotics1.2 环境浓度和环境风险
抗生素在地表水、地下水和土壤等环境介质中都有被广泛检出,一般在ng·L−1或μg·L−1水平(表1)。如Luo等[9]在海河主流和支流的27个采样点中检出了12种抗生素,其中磺胺类抗生素的检出频率最高,检出浓度为24−385 μg·L−1。通过对全球各地环境介质中红霉素分布情况进行总结,Schafhauser等[14]发现红霉素在淡水系统中的浓度分布范围从低于检测限至75500 ng·L−1,海洋系统中红霉素的浓度最高可达1900 ng·L−1。土壤是环境中抗生素残留重要的汇。中国北方有机蔬菜基地土壤中四环素类、磺胺类和喹诺酮类抗生素的总浓度范围为0.1–2683 μg·kg−1[15];奥地利养殖场附近土壤中环丙沙星的浓度可达370 μg·kg−1[16]。
表 1 常用四类抗生素在不同环境介质中的检测浓度水平Table 1. Concentrations of four commonly used classes of antibiotics in environmental matrices抗生素种类Class 用途Usage 抗生素名称Name 环境介质Environment matrices 地表水/(ng·L−1)Surface water 地下水/(ng·L−1)Groundwater 土壤/(ng·kg−1)Soil 喹诺酮类 广谱性抗菌药物,常用于革兰阴性细菌感染的治疗[28] 环丙沙星 ND−390 [29-31] ND−43[15, 32-33] ND−652[34-36] 诺氟沙星 ND−253[29- 30, 37] ND−1900[32, 33, 38] ND−288[34-36] 恩诺沙星 ND−70[30, 32, 39] ND−42[32, 33, 38] ND−167[34-36] 氧氟沙星 ND−633[9, 29- 30] ND−8[15, 32, 37] ND−113[15, 35, 40] 磺胺类 广谱性抗菌药物,可用于治疗各种细菌性感染的疾病[41] 磺胺甲恶唑 ND−1484[9, 30, 42] ND−1110[27, 33, 43] ND−55[15, 35, 44] 磺胺嘧啶 ND−170[9, 42, 45] ND−54[32, 33, 43] ND−86[35, 40, 44] 磺胺二甲嘧啶 ND−940[30, 42, 46] ND−616[32, 33, 43] ND−1688[40, 44, 47] 大环内酯类 治疗革兰阳性菌感染,畜禽支原体感染的预防和治疗[48] 罗红霉素 ND−741[9, 30, 42] ND−11[33, 37] ND−6[49-50] 红霉素 ND−2834[9, 30, 42] ND−2380[33, 37, 43] ND−4[40, 50- 51] 四环素类 治疗革兰阳性菌感染[48] 四环素 ND−130[9, 30, 46] ND−115[15, 32-33] ND−105[15, 40, 44] 土霉素 ND−1210[31, 42, 46] ND−29[15, 32-33] ND−3683[15, 40, 44] 金霉素 ND−122[30, 32] ND−87[15, 32-33] ND−12900[15, 40, 44] 注:ND,未检出;not detected. 植物和动物生长在被抗生素污染的土壤中,会吸收其中的抗生素并在体内富集。Hu等[15]在调研天津4个有机蔬菜基地后发现,当对多种蔬菜施用含8.3−43.5 mg·kg−1四环素、0.4−26.8 mg·kg−1金霉素、0.1−32.7 mg·kg−1磺胺多辛和0.12−3.8 mg·kg−1林可霉素的粪肥时,萝卜、油菜、芹菜和香菜叶片中四环素、金霉素、磺胺多辛和林可霉素的浓度分别为1.4−5.6 μg·kg−1、6−532 μg·kg−1、0.2−1.2 μg·kg−1和0.7−20 μg·kg−1。向土壤中施用100 mg·kg−1的恩诺沙星时,土壤中的蚯蚓体内检出大约2 mg·kg−1的恩诺沙星,当施用浓度为500 mg·kg−1时,蚯蚓体内检出浓度约为14 mg·kg−1[17]。
虽然抗生素在土壤环境中的浓度远低于一些传统的有机污染物,但是其环境风险不容忽视。抗生素残留对土壤中植物和动物的生长会产生一定的影响。如对黄瓜、莴苣、菜豆和萝卜施用浓度为0.05−5 mg·L−1的恩诺沙星时,会改变植株的初生根、下胚轴和子叶的长度[18]。Yang等[19]的研究中发现10 mg·kg−1的环丙沙星能够诱导蚯蚓体内的氧化应激,并影响其mRNA的表达,导致DNA的损伤。Dong等[20]的研究中发现3 mg·kg−1的四环素会引起蚯蚓DNA的损伤。动植物体内的抗生素还会通过食物链传递到人体中,进而对人体健康造成潜在危害[21]。
除自身的风险外,抗生素的长期滥用会诱导细菌产生抗性基因,再通过水平转移在环境中扩散[22],导致不同环境介质中均有抗性基因的检出。例如,长期施用含抗生素残留的污泥和鸡粪的田间土壤中检出了130种抗生素抗性基因,未施加鸡粪和污泥的土壤、施加鸡粪的土壤以及施加污泥处理的土壤中,抗性基因丰度分别约为0.01 copies·cell−1、0.045 copies·cell−1和0.015−0.04 copies·cell−1[23];Munir等[24]在土壤中检测到浓度分别为3.61×104 copies·g−1、1.05×106 copies·g−1和4.19×104 copies·g−1的抗性基因Tet(W)、Tet(O)和Sul-1;Munir等[25]在密歇根污水处理厂出水中,也检出了磺胺和四环素的抗性基因,最高丰度达2.33×107 copies·L−1,出水用于农业灌溉会直接导致抗性基因向土壤中的转移。具有抗性基因的细菌中会出现对多种抗生素同时具有耐性的菌株,即“超级细菌”。耐甲氧西林金黄色葡萄球菌(MRSA)是目前研究较多的一种超级细菌,全球各地都有人体感染MRSA的病例报道[26]。MRSA有多种进化和突变菌株,目前人类还不能控制其传播感染,因此“超级细菌”会对人类的健康构成持续的威胁[27]。
2. 抗生素在土壤中的归趋(Fate of antibiotics in soil)
含有抗生素的粪便以及污水处理厂的污泥和出水常被作为有机肥料和灌溉水施加至农田土壤中,成为土壤中抗生素污染的主要来源[52]。进入土壤后,抗生素会被生物或非生物作用转化,或被吸附至土壤基质中,或淋溶迁移到地表水及地下水中,或被土壤植物和动物吸收富集,其中吸附和降解是抗生素在土壤中消散的主要途径[22](图2)。在吸附和降解的过程中,抗生素在土壤中的(有机溶剂)可提取态会减少,转而被矿化或通过物理化学包埋作用、共价键作用与土壤颗粒结合或被生物同化形成NERs[53]。
2.1 吸附降解
抗生素在土壤中的吸附和降解与土壤特性有关,如土壤组分、土壤有机质含量和pH等[54]。已有研究表明,不同深度土壤中阳离子和有机质的含量有差异,导致同种抗生素在不同深度土层中的吸附常数Kd 差异较大[55]。在有机碳含量分别为17.6、15.5 、10.2 g·kg−1 的土壤中培养,3 d后磺胺甲恶唑易提取馏分(羟丙基-β-环糊精提取)降低至20%左右,NERs占最初加入量的50%左右,后续培养153 d内NERs含量变化不大[56]。磺胺甲恶唑在不同土壤中的矿化量分别为6.6%、8.9%和10.5%,即随着土壤有机质含量的降低,磺胺甲恶唑的可降解性增加[56]。土壤的pH会影响抗生素的解离度,从而影响抗生素在土壤中的行为。土壤pH值高于弱酸性抗生素的pKa值时,会促进某些抗生素的迁移[57]。例如,在高pH条件下,阴离子磺胺类抗生素和土壤表面的负电荷之间的静电斥力会减弱其疏水吸附[58]。
抗生素在土壤中的吸附降解也与其本身的性质有关,如疏水性、稳定性和溶解度等[5]。例如,磺胺甲恶唑在土壤中的分布系数Kd为3.2—3.3 L·kg −1,环丙沙星Kd为161—546 L·kg −1,土霉素Kd为503—1278 L·kg −1[55]。由于磺胺类抗生素仅具有苯胺和酰胺基,与土壤表面结合位点之间的相互作用较弱,因此在土壤中的迁移性和生物可利用性较高;而四环素、大环内酯和氟喹诺酮类抗生素具有多个官能团,能通过多种吸附机制(如阳离子交换、阳离子桥键和氢键、以及与土壤中金属氧化物的表面络合等)与土壤组分之间建立较强的相互作用[59]。同样的培养条件下,磺胺甲恶唑在土壤中的矿化量为6.6%–10.5%,环丙沙星的矿化量仅为0.5%–0.6%[56]。在土壤中培养7 d后,约65%的红霉素和20%磺胺二甲嘧啶矿化,而环丙沙星未矿化[60]。相比磺胺甲恶唑、红霉素和磺胺二甲嘧啶,环丙沙星在土壤颗粒上的吸附更强,稳定性更高,从而导致其生物可利用性更低。
土壤是一个非均质体,存在好氧/厌氧微域,微生物种类丰富,从而为抗生素的生物降解提供了有利条件。Pan等[61]发现土壤中四环素半衰期为31.8−43.3 d,磺胺二甲嘧啶半衰期为24.8−34.7 d,诺氟沙星、红霉素和氯霉素半衰期都在11 d以下;而灭活土壤中,所有5种抗生素均表现出中度或高度的持久性,半衰期为40.8−86.6 d。Zhang等[62]的研究中同样发现磺胺嘧啶和磺胺甲恶唑在活性土壤中的降解速度大于灭活土壤,降解的主要中间产物来自羟基化,磺胺S-N键裂解和苯胺部分氧化。不同氧化还原条件下抗生素的降解程度亦不同。Liu等[63]的实验中,有氧条件下磺胺甲恶唑、甲氧苄啶和泰乐菌素的耗散速度大于无氧条件;Yang等[64]也观察到好氧和缺氧条件下土霉素的降解有类似规律。为促进土壤中抗生素的降解转化,Riaz等[65]向土壤中添加了3种从污泥中分离出的具有抗生素抗性的菌株后,与对照组相比,添加菌株的处理组中可提取的环丙沙星、恩诺沙星和左氧氟沙星含量显著降低。
放射性同位素示踪技术表明,抗生素在吸附和降解的过程中,会形成大量的NERs,甚至构成了抗生素在土壤中的主要归趋(图3)。如Hoeltge 等[53]的研究表明,随着培育时间增加,磺胺甲恶唑和乙酰磺胺甲恶唑在施加污泥和粪便的土壤中可提取部分逐渐减少,与之对应的NERs增加,矿化量递增至2%左右。Schmidt等[66]的研究中,含磺胺嘧啶的粪肥与土壤混合后,可提取态的磺胺嘧啶及其代谢产物随着培育时间的增加逐渐减少,从42%降至8%左右,培育218 d后NERs的生成量达90%以上,矿化量低于2%。
2.2 淋溶迁移
土壤对抗生素的吸附作用在一定程度上截留了进入土壤的抗生素,但是降雨导致的淋溶和干湿交替会使抗生素随着径流迁移到更深层的土壤以及地下水中。Mehrtens等[67]通过监测田间不同深度的土壤孔隙水和地下水中抗生素的浓度来跟踪施加的8种抗生素进入土壤后的去向,在土壤孔隙水中检测到7种目标化合物,其中4种(磺胺嘧啶、磺胺二甲嘧啶、四环素和提洛米林)进入地下水。在土壤中施加含抗生素的粪肥后,Hamscher等[68]在地面1.4 m以下的地下水中检测到了0.18 μg·L−1磺胺二甲嘧啶。Balzer等[69]调查了德国养殖牲畜密度较大的农场附近48处地下水中抗生素污染的情况,其中有9处检出了3类磺胺类抗生素,最高浓度为950 ng·L−1。
抗生素在土壤中的迁移能力与抗生素的分配系数有关,如林可霉素和磺胺二甲嘧啶相对亲水,在土壤中比较容易迁移;而莫能菌素疏水性较强,因此容易吸附在土壤中不容易迁移[57]。Blackwell等[70]开展野外实验发现,土霉素和泰乐菌素都被截留在土壤中,在土壤渗出液中仅检测出磺胺氯哒嗪。这些在土壤中自由迁移的抗生素是生物可给的,会被动物和植物吸收。
2.3 生物富集
农田土壤被抗生素污染后,生长于其中的植物在蒸腾作用的驱动下会吸收富集抗生素[71](图2),植物体内抗生素的浓度一般在几十到几百μg·kg−1。抗生素在作物可食部分的累积会对动物和人类健康带来潜在风险[72]。进入植物体内后,外源污染物会经历3个阶段:第一阶段为修饰反应,污染物可能发生氧化、水解或脱烷基等反应;第二阶段污染物与葡萄糖、氨基酸等小分子结合,极性增加;第三阶段极性增加的污染物会在植物体内运输、降解、与细胞壁结合或储存在液泡中[73]。
抗生素在植物中的吸收和转移主要与其疏水性和解离度有关[74]。中性抗生素在植物根部的吸收与其lg Dow(经pH修正的后的辛醇-水分配系数)呈正相关关系;酸性抗生素化合物则可能通过离子阱等机制被捕获、积累在根部细胞中;而碱性抗生素可解离产生阳离子,所带正电荷与植物原生质膜上的负电荷会相互吸引从而可促进其被根部吸收,也可通过离子阱机制积累到液泡中,其中亲脂性的碱性化合物还易被分配到根壁上进而促进根部吸收[73]。吸收进入根部后,抗生素在植物中的转运转移与其疏水性总体呈负相关关系,亲水性的化合物(lg Dow = 0.5−3)更容易被转运至植物叶片部分,而疏水性化合物多集中在根部[73]。除吸收和转运外,植物还可以通过体内的一些酶降解抗生素,例如细胞色素P450依赖性单加氧酶和漆酶[75]。在酶的作用下,抗生素会被水解或与生物分子结合,还可进一步被紧密结合在细胞壁或隔离在液泡中,达到解毒的作用[76]。
除植物外,动物体内亦会富集抗生素。在使用含环丙沙星和阿奇霉素的生物固体改良土壤后,土壤中蚯蚓体内这两种抗生素的浓度分别为土壤中抗生素浓度的4倍和7倍,蚯蚓吸收的大部分抗生素被排泄,大约20%环丙沙星和40%阿奇霉素被生物积累[77]。Huang等[78]发现,环丙沙星不仅会被蚯蚓吸收,还会促进Cu等金属离子在蚯蚓体内的积累。目前动物吸收和富集抗生素的研究对象多为人和畜禽,非靶向动物体内抗生素的吸收和富集情况研究较少,值得进一步探究。
3. 土壤中抗生素的不可提取态残留(Non-extractable residues of antibiotics in soil )
3.1 形成机理与影响因素
多数抗生素在环境中的主要归趋是残留在土壤中形成NERs[56, 79- 80](图3),须采用14C同位素示踪法对NERs展开研究。14C同位素示踪法可对目标污染物进行标记,在不改变化合物分子结构及其环境行为的前提下准确定量基质中目标污染物NERs的放射性,而传统的提取方法无法表征这些组分[81] 。为量化NERs组分,需将基质中可提取态的组分去除。Schaeffer等[7]提出的提取步骤分为三步:使用盐/缓冲液(如CaCl2溶液、硝酸盐或乙酸盐的水溶液)萃取生物可利用的部分;然后使用有机溶剂混合物(例如乙腈/水溶液)提取易于解吸的部分;最后使用索氏提取、加速溶剂萃取(ASE)、加压溶剂萃取(PLE)、超临界流体萃取(SEF)或微波辅助萃取(MAE)彻底萃取以释放出可提取馏分[7]。经提取后NERs留在基质中,再通过氧化燃烧仪将其转化成14CO2 ,并捕集在cocktail溶剂中,利用液体闪烁计数器(LSC)测定NERs的总量。然而,该方法中ASE, PLE, SEF, MAE等方法对基质有破坏,不符合NERs的定义。目前还没有统一标准的NERs提取方法(表2),尚需要进一步探索。
表 2 抗生素在土壤中形成NERs的量Table 2. The amount of antibiotic NERs formed in soil抗生素Antibiotic 土壤类型Soil type 培养时间/dIncubation time 提取方法Extraction method NERs形成量/%The amount of NERs 磺胺甲恶唑 砂壤土 156 环糊精、乙腈、NaOH、Mc Ilvaine缓冲溶液3次提取,离心前超声2次 50[56] 环丙沙星 砂壤土 156 同上 72.2—77.6[56] 沙拉沙星 壤土 66 1∶1(V∶V) 的乙腈和水萃取 63[79] 粉壤土 66 22[79] 砂壤土 66 14[79] 磺胺甲恶唑 添加10%生物固体(biosolid) 84 60/40(V/V)乙酸乙酯/甲醇萃取2次 81[87] 未添加生物固体 84 37[87] N-乙酰基磺胺甲恶唑 添加粪肥和污泥 156 环糊精、乙腈、NaOH、Mc Ilvaine缓冲溶液3次提取,离心前超声2次 56–60[56] 未添加改良剂 156 50[56] 根据形成机制的不同,抗生素的NERs一般可分为三类(图4):锁定态(Ⅰ型),即化合物通过静电相互作用、氢键、范德华力或疏水相互作用等吸附在土壤基质或被包埋于土壤孔隙中的残留;共价结合态(Ⅱ型),即化合物和基质间形成性质稳定C—O键、C—C键、C—N键等共价键的残留;生物质源态(Ⅲ型),即化合物被土壤微生物利用,同化为生物质后以生物分子或腐殖质形式被固定在土壤中的残留[22, 82]。例如,Junge等[54]利用尺寸排阻色谱法分离纯化后的富里酸,从中提取出被物理包裹在土壤有机质中的二氟沙星或其代谢产物的NERs。Cao等[83]利用硅烷化试剂(二甲亚砜、吡啶和三甲基氯硅烷配制而成)提取了双酚S在土壤中形成的Ⅰ型NER,形成量占NERs总量的20%左右,液相色谱和液体闪烁计数(HPLC-14C-LSC)结果表明Ⅰ型NERs为母体化合物以及少量的极性代谢产物,经过硅烷基化处理后的土壤进行碱水解后,双酚S释放了约16%酯键和醚键连接的NERs。在Yao等[84]的研究中,Ⅰ型NERs仅检测到母体化合物单溴二苯醚(BDE 3),酯键连接的NERs仅检测到其代谢产物4′-OH-BDE3。在氧化酶的作用下,磺胺类抗生素会与腐殖质中的醌和羰基基团发生亲核加成,形成共价结合态NERs[85]。
土壤中NERs的形成受抗生素自身物理化学性质和土壤性质影响[86](表2)。土壤中的腐殖质具有许多活性官能团,含有羟基、羧基、羰基或氨基等官能团的污染物容易与其发生反应形成NERs[87]。在相同的条件下培养156 d后,含氨基的磺胺甲恶唑约有50%转化为NERs,而环丙沙星(同含羧基、羰基和氨基)则有72.2%–77.6%形成NERs[56]。沙拉沙星在壤土、粉壤土和砂壤土中培养66 d后,分别有63%、22%和14%形成NERs,形成量随土壤有机质含量降低而减少[79]。外源性有机质的添加会促进抗生素NERs的形成。在添加了10%生物固体(biosolid)的土壤中,81%的磺胺甲恶唑形成了NERs,而在未添加生物固体的土壤中仅有37%的NERs生成[87];N-乙酰基磺胺甲恶唑在添加粪肥和污泥后的土壤中形成的NERs量(56%–60%)也高于未添加土壤(50%)[56]。
土壤中微生物活性和生物活动也是影响抗生素NERs形成的重要因素。微生物能够将污染物转化为易与土壤基质反应的产物,从而将其固定在土壤中。磺胺嘧啶在活性土壤中形成的NERs量约为灭菌土壤的3倍[88];有氧条件下嘧菌环胺形成的NERs总量比灭菌或厌氧条件下更高[89]。生物活动也会影响土壤中污染物的分布和转化,例如,在未种植植物的土壤中约有60.8%最初投加的四溴双酚A形成NERs,而种植水稻和芦苇后仅有50.1%和40%的四溴双酚A形成NERs,可能是植物根系改变了土壤的氧化还原条件[90]。蚯蚓等土壤生物可富集土壤中的四溴双酚A、双酚F等污染物并通过同化作用使其形成NERs,从而减少土壤中污染物NERs的产生量[91-93]。然而,目前尚无生物活动影响土壤中抗生素形成的NERs的研究,因此有必要进一步探究土壤中抗生素NERs与生物活动之间的关系。
3.2 稳定性和生物可利用性
NERs的形成使得抗生素被截留在土壤中,降低了其生物可利用性。若形成较稳定的NERs,则该过程可降低抗生素的环境风险;若形成的NERs不稳定,则抗生素污染物仍有被重新释放的可能性,从而会再度对环境造成威胁。因此,对抗生素NERs稳定性和生物可利用性的研究至关重要。三种类型的NERs中,生物质源态NERs中污染物分子中的碳已被生物同化,被认为对环境无风险;共价结合形成的NERs相对稳定,而物理化学包埋形成的NERs可能会被缓慢释放到环境中[82]。
土壤环境(如水分)的变化,尤其是植物、土壤动物和微生物的活动会改变土壤有机质的结构[94],可能使得NERs从基质中释放,并进一步被生物利用[95]。Bao等[96]发现在含土霉素NERs的土壤中分别加入蚯蚓和种植蚕豆后,蚕豆处理组可提取的土霉素量高于蚯蚓处理组,作者推测可能是由于蚕豆处理组水分蒸发更快因此需要不断添加去离子水,土壤干湿交替过程导致土霉素NERs的释放。红壤土中种植了菜苔(Brassica parachinensis)后,约31%的红霉素NERs释放转化为可提取态,NERs释放后能够被植物利用,菜苔吸收了约0.5%的初始放射性量;在未种植植物的处理组中仅有约15%的红霉素NERs转化为可提取态,而鸡粪和污泥类生物固体的添加会抑制红霉素NERs的释放[97]。Heise等[94]发现在含磺胺嘧啶NERs的土壤中种植芜菁(Brassica rapa)以及添加蚯蚓(Lumbricus terrestris)后,土壤中磺胺嘧啶NERs约有3%−11%释放,芜菁能摄取NERs总量的0.2%,蚯蚓可以摄取1%−4%,而添加牛粪的蚯蚓和芜青处理组中磺胺嘧啶NERs的释放相对较少。微生物则会消耗土壤中的有机质,使结合在腐殖质分子上的污染物分子释放,从而破坏NERs的稳定性[95]。由此可见,抗生素形成NERs后其环境风险依然存在,尤其是当土壤环境改变时,NERs会再次释放到环境中,并且会被生物吸收。抗生素NERs释放出的组分可能是抗生素母体,也可能是其代谢产物,而目前关于这类组分鉴定的研究较少。释放到环境中的NERs组分如不能被生物所利用,则会对环境产生潜在的威胁。因此,抗生素NERs的稳定性及其释放组分的鉴定研究有助于准确评估抗生素的环境风险。
4. 总结与展望(Conclusions and future perspectives)
抗生素可以治疗人类和动物疾病,但生产、生活和养殖业中抗生素的大量使用以及污水处理厂较低的处理效率导致了环境介质(水体、土壤)和生物体(植物、动物)中抗生素的累积。虽然抗生素的环境浓度相对较低,但其污染来源广泛、污染排放持续,且会对生物产生毒害作用,还会引发抗性基因问题。土壤是抗生物在环境中重要的汇,其在土壤中的归趋主要受其物理化学性质(如疏水性、稳定性和溶解度等)和环境介质特性(如pH、组分等)的影响,主要被吸附降解并形成NERs,少部分被淋溶迁移到地表水及地下水中,或被土壤植物和动物吸收富集。根据形成机理的不同,抗生素的NERs可分为锁定态、共价结合态和生物质源态。易与基质组分(如土壤有机质)发生反应的抗生素更容易形成NERs。土壤中抗生素NERs的稳定性与环境条件有关,环境条件的改变如土壤含水量变化以及生物活动(植物、动物和微生物)可能导致NERs从环境介质中释放出来。
NERs作为抗生素在土壤环境中的重要归趋,还未得到足够的关注。抗生素NERs的定量很大程度上取决于从介质中分离NERs的方法,然而目前还没有统一的分离步骤,特别是针对不同类型NERs的分离方法还需要进一步研究。生物活动会影响土壤中污染物的分布和转化,目前尚缺少有关生物活动影响土壤中抗生素NERs形成、以及抗生素在非靶向生物体内富集和NERs形成的研究。抗生素形成NERs后,一定程度上降低了其环境风险,但当环境条件变化时,NERs可能再次释放抗生素或其转化产物。为准确评估抗生素的环境风险,需要阐明环境中NERs的稳定性和生物可利用性。14C同位素示踪法可以准确地定量分析复杂介质中污染物的归趋,与色谱-质谱和核磁共振谱法等技术相结合,可以实现NERs组份的鉴定,从而为全面了解环境中抗生素的归趋、准确评估抗生素的环境风险提供有效的技术手段。
-
图 1 环境中抗生素污染的主要来源,其中土壤是抗生素重要的汇[8]
Figure 1. Major sources of antibiotic pollution in the environment, among which soil is a crucial sink of the antibiotics
表 1 常用四类抗生素在不同环境介质中的检测浓度水平
Table 1. Concentrations of four commonly used classes of antibiotics in environmental matrices
抗生素种类Class 用途Usage 抗生素名称Name 环境介质Environment matrices 地表水/(ng·L−1)Surface water 地下水/(ng·L−1)Groundwater 土壤/(ng·kg−1)Soil 喹诺酮类 广谱性抗菌药物,常用于革兰阴性细菌感染的治疗[28] 环丙沙星 ND−390 [29-31] ND−43[15, 32-33] ND−652[34-36] 诺氟沙星 ND−253[29- 30, 37] ND−1900[32, 33, 38] ND−288[34-36] 恩诺沙星 ND−70[30, 32, 39] ND−42[32, 33, 38] ND−167[34-36] 氧氟沙星 ND−633[9, 29- 30] ND−8[15, 32, 37] ND−113[15, 35, 40] 磺胺类 广谱性抗菌药物,可用于治疗各种细菌性感染的疾病[41] 磺胺甲恶唑 ND−1484[9, 30, 42] ND−1110[27, 33, 43] ND−55[15, 35, 44] 磺胺嘧啶 ND−170[9, 42, 45] ND−54[32, 33, 43] ND−86[35, 40, 44] 磺胺二甲嘧啶 ND−940[30, 42, 46] ND−616[32, 33, 43] ND−1688[40, 44, 47] 大环内酯类 治疗革兰阳性菌感染,畜禽支原体感染的预防和治疗[48] 罗红霉素 ND−741[9, 30, 42] ND−11[33, 37] ND−6[49-50] 红霉素 ND−2834[9, 30, 42] ND−2380[33, 37, 43] ND−4[40, 50- 51] 四环素类 治疗革兰阳性菌感染[48] 四环素 ND−130[9, 30, 46] ND−115[15, 32-33] ND−105[15, 40, 44] 土霉素 ND−1210[31, 42, 46] ND−29[15, 32-33] ND−3683[15, 40, 44] 金霉素 ND−122[30, 32] ND−87[15, 32-33] ND−12900[15, 40, 44] 注:ND,未检出;not detected. 表 2 抗生素在土壤中形成NERs的量
Table 2. The amount of antibiotic NERs formed in soil
抗生素Antibiotic 土壤类型Soil type 培养时间/dIncubation time 提取方法Extraction method NERs形成量/%The amount of NERs 磺胺甲恶唑 砂壤土 156 环糊精、乙腈、NaOH、Mc Ilvaine缓冲溶液3次提取,离心前超声2次 50[56] 环丙沙星 砂壤土 156 同上 72.2—77.6[56] 沙拉沙星 壤土 66 1∶1(V∶V) 的乙腈和水萃取 63[79] 粉壤土 66 22[79] 砂壤土 66 14[79] 磺胺甲恶唑 添加10%生物固体(biosolid) 84 60/40(V/V)乙酸乙酯/甲醇萃取2次 81[87] 未添加生物固体 84 37[87] N-乙酰基磺胺甲恶唑 添加粪肥和污泥 156 环糊精、乙腈、NaOH、Mc Ilvaine缓冲溶液3次提取,离心前超声2次 56–60[56] 未添加改良剂 156 50[56] -
[1] ZUCCATO E, CASTIGLIONI S, BAGNATI R, et al. Source, occurrence and fate of antibiotics in the Italian aquatic environment [J]. Journal of Hazardous Materials, 2010, 179(1-3): 1042-1048. doi: 10.1016/j.jhazmat.2010.03.110 [2] GOTHWAL R, SHASHIDHAR T. Antibiotic pollution in the environment: A review [J]. Clean–Soil, Air, Water, 2015, 43(4): 479-489. doi: 10.1002/clen.201300989 [3] CHARUAUD L, JARDE E, JAFFREZIC A, et al. Veterinary pharmaceutical residues from natural water to tap water: Sales, occurrence and fate [J]. Journal of Hazardous Materials, 2019, 361(5): 169-186. [4] ZHANG Q Q, YING G G, PAN C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance [J]. Environmental Science & Technology, 2015, 49(11): 6772-6782. [5] SARMAH A K, MEYER M T, BOXALL A B. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics (VAs) in the environment [J]. Chemosphere, 2006, 65(5): 725-759. doi: 10.1016/j.chemosphere.2006.03.026 [6] GEVAO B, SEMPLE K T, JONES K C. Bound pesticide residues in soils: A review [J]. Environmental Pollution, 2000, 108(1): 3-14. doi: 10.1016/S0269-7491(99)00197-9 [7] SCHAEFFER A, KAESTNER M, TRAPP S. A unified approach for including non-extractable residues (NER) of chemicals and pesticides in the assessment of persistence [J]. Environmental Sciences Europe, 2018, 30: 1-14. doi: 10.1186/s12302-017-0129-6 [8] LI W C. Occurrence, sources, and fate of pharmaceuticals in aquatic environment and soil [J]. Environmental Pollution, 2014, 187: 193-201. doi: 10.1016/j.envpol.2014.01.015 [9] LUO Y, XU L, RYSZ M, et al. Occurrence and transport of tetracycline, sulfonamide, quinolone, and macrolide antibiotics in the Haihe River Basin, China [J]. Environmental Science & Technology, 2011, 45(5): 1827-1833. [10] GAO L H, SHI Y L, LI W H, et al. Occurrence of antibiotics in eight sewage treatment plants in Beijing, China [J]. Chemosphere, 2012, 86(6): 665-671. doi: 10.1016/j.chemosphere.2011.11.019 [11] WU D, HUANG Z T, YANG K, et al. Relationships between antibiotics and antibiotic resistance gene levels in municipal solid waste leachates in Shanghai, China [J]. Environmental Science & Technology, 2015, 49(7): 4122-4128. [12] WEI R C, GE F, HUANG S Y, et al. Occurrence of veterinary antibiotics in animal wastewater and surface water around farms in Jiangsu Province, China [J]. Chemosphere, 2011, 82(10): 1408-1414. doi: 10.1016/j.chemosphere.2010.11.067 [13] SZYMANSKA U, WIERGOWSKI M, SOLTYSZEWSK I, et al. Presence of antibiotics in the aquatic environment in Europe and their analytical monitoring: Recent trends and perspectives [J]. Microchemical Journal, 2019, 147: 729-740. doi: 10.1016/j.microc.2019.04.003 [14] SCHAFHAUSER B H, KRISTOFCO L A, DE OLIVEIRA C M R, et al. Global review and analysis of erythromycin in the environment: occurrence, bioaccumulation and antibiotic resistance hazards [J]. Environmental Pollution, 2018, 238: 440-451. doi: 10.1016/j.envpol.2018.03.052 [15] HU X G, ZHOU Q X, LUO Y. Occurrence and source analysis of typical veterinary antibiotics in manure, soil, vegetables and groundwater from organic vegetable bases, northern China [J]. Environmental Pollution, 2010, 158(9): 2992-2998. doi: 10.1016/j.envpol.2010.05.023 [16] MARTINEZ-CARBALLO E, GONZALEZ-BARREIRO C, SCHARF S, et al. Environmental monitoring study of selected veterinary antibiotics in animal manure and soils in Austria [J]. Environmental Pollution, 2007, 148(2): 570-579. doi: 10.1016/j.envpol.2006.11.035 [17] LU X, LI Y, THUNDERS M, et al. Effect of enrofloxacin on the proteome of earthworms [J]. Science of the Total Environment, 2018, 616: 531-542. [18] MIGLIORE L, COZZOLINO S, FIORI M. Phytotoxicity to and uptake of enrofloxacin in crop plants [J]. Chemosphere, 2003, 52(7): 1233-1244. doi: 10.1016/S0045-6535(03)00272-8 [19] YANG X, LI Y, WANG X. Effects of ciprofloxacin exposure on the earthworm Eisenia fetida [J]. Environmental Pollution, 2020, 262: 1-9. [20] DONG Lr, GAO J, XIE X, et al. DNA damage and biochemical toxicity of antibiotics in soil on the earthworm Eisenia fetida [J]. Chemosphere, 2012, 89(1): 44-51. doi: 10.1016/j.chemosphere.2012.04.010 [21] LIU X, STEELE J C, MENG X Z. Usage, residue, and human health risk of antibiotics in Chinese aquaculture: a review [J]. Environmental Pollution, 2017, 223: 161-169. doi: 10.1016/j.envpol.2017.01.003 [22] JECHALKE S, HEUER H, SIEMENS J, et al. Fate and effects of veterinary antibiotics in soil [J]. Trends in Microbiology, 2014, 22(9): 536-545. doi: 10.1016/j.tim.2014.05.005 [23] CHEN Q L, AN X L, LI H, et al. Long-term field application of sewage sludge increases the abundance of antibiotic resistance genes in soil [J]. Environment International, 2016, 92/93: 1-10. doi: 10.1016/j.envint.2016.03.026 [24] MUNIR M, XAGORARAKI I. Levels of antibiotic resistance genes in manure, biosolids, and fertilized soil [J]. Journal of Environmental Quality, 2011, 40(1): 248-255. doi: 10.2134/jeq2010.0209 [25] MUNIR M, WONG K, XAGORARAKI I. Release of antibiotic resistant bacteria and genes in the effluent and biosolids of five wastewater utilities in Michigan [J]. Water Research, 2011, 45(2): 681-693. doi: 10.1016/j.watres.2010.08.033 [26] IPPOLITO G, LEONE S, LAURIA F N, et al. Methicillin-resistant Staphylococcus aureus: the superbug [J]. International Journal of Infectious Diseases, 2010, 14: S7-S11. [27] YAMAMOTO T, WAN T, KHOKHLOVA O, et al. Methicillin-resistant Staphylococcus Aureus in community settings: spread of drug resistance and uncontrollable infections[J]. 2019, 2(4): 115-124. [28] PHAM T D M, ZIORA Z M, BLASKOVICH M A T. Quinolone antibiotics [J]. Medchemcomm, 2019, 10(10): 1719-1739. doi: 10.1039/C9MD00120D [29] LI W H, SHI Y L, GAO L H, et al. Occurrence of antibiotics in water, sediments, aquatic plants, and animals from Baiyangdian Lake in North China [J]. Chemosphere, 2012, 89(11): 1307-1315. doi: 10.1016/j.chemosphere.2012.05.079 [30] BAI Y W, MENG W, XU J, et al. Occurrence, distribution and bioaccumulation of antibiotics in the Liao River Basin in China [J]. Environmental Science-Processes & Impacts, 2014, 16(3): 586-593. [31] ZOU S C, XU W H, ZHANG R J, et al. Occurrence and distribution of antibiotics in coastal water of the Bohai Bay, China: Impacts of river discharge and aquaculture activities [J]. Environmental Pollution, 2011, 159(10): 2913-2920. doi: 10.1016/j.envpol.2011.04.037 [32] TONG L, HUANG S B, WANG Y X, et al. Occurrence of antibiotics in the aquatic environment of Jianghan Plain, central China [J]. Science of the Total Environment, 2014, 497: 180-187. [33] BARNES K K, KOLPIN D W, FURLONG E T, et al. A national reconnaissance of pharmaceuticals and other organic wastewater contaminants in the United States - I) Groundwater [J]. Science of the Total Environment, 2008, 402(2/3): 192-200. [34] WU X L, XIANG L, YAN Q Y, et al. Distribution and risk assessment of quinolone antibiotics in the soils from organic vegetable farms of a subtropical city, Southern China [J]. Science of the Total Environment, 2014, 487: 399-406. doi: 10.1016/j.scitotenv.2014.04.015 [35] SHI Y L, GAO L H, LI W H, et al. Investigation of fluoroquinolones, sulfonamides and macrolides in long-term wastewater irrigation soil in Tianjin, China [J]. Bulletin of Environmental Contamination and Toxicology, 2012, 89(4): 857-861. doi: 10.1007/s00128-012-0761-1 [36] XIE Y f, LI X W, WANG J F, et al. Spatial estimation of antibiotic residues in surface soils in a typical intensive vegetable cultivation area in China [J]. Science of the Total Environment, 2012, 430: 126-131. doi: 10.1016/j.scitotenv.2012.04.071 [37] YANG Y Y, ZHAO J L, LIU Y S, et al. Pharmaceuticals and personal care products (PPCPs) and artificial sweeteners (ASs) in surface and ground waters and their application as indication of wastewater contamination [J]. Science of the Total Environment, 2018, 616: 816-823. [38] FICK J, SOEDERSTROM H, LINDBERG R H, et al. Contamination of surface, ground, and drinking water from pharmaceutical production [J]. Environmental Toxicology and Chemistry, 2009, 28(12): 2522-2527. doi: 10.1897/09-073.1 [39] LIANG X M, CHEN B W, NIE X P, et al. The distribution and partitioning of common antibiotics in water and sediment of the Pearl River Estuary, South China [J]. Chemosphere, 2013, 92(11): 1410-1416. doi: 10.1016/j.chemosphere.2013.03.044 [40] ZHOU L J, YING G G, LIU S, et al. Excretion masses and environmental occurrence of antibiotics in typical swine and dairy cattle farms in China [J]. Science of the Total Environment, 2013, 444: 183-195. doi: 10.1016/j.scitotenv.2012.11.087 [41] SCHAUSS K, FOCKS A, HEUER H, et al. Analysis, fate and effects of the antibiotic sulfadiazine in soil ecosystems [J]. Trac-Trends in Analytical Chemistry, 2009, 28(5): 612-618. doi: 10.1016/j.trac.2009.02.009 [42] KIM S-C, CARLSON K. Temporal and spatial trends in the occurrence of human and veterinary antibiotics in aqueous and river sediment matrices [J]. Environmental Science & Technology, 2007, 41(1): 50-57. [43] BARTELT-HUNT S, SNOW D D, DAMON-POWELL T, et al. Occurrence of steroid hormones and antibiotics in shallow groundwater impacted by livestock waste control facilities [J]. Journal of Contaminant Hydrology, 2011, 123(3/4): 94-103. [44] LI Y W, WU X L, MO C H, et al. Investigation of sulfonamide, tetracycline, and quinolone antibiotics in vegetable farmland soil in the Pearl River delta area, southern China [J]. Journal of Agricultural & Food Chemistry, 2011, 59(13): 7268-7276. [45] CHEN K, ZHOU J L. Occurrence and behavior of antibiotics in water and sediments from the Huangpu River, Shanghai, China [J]. Chemosphere, 2014, 95: 604-612. doi: 10.1016/j.chemosphere.2013.09.119 [46] CHEN H, JING L, TENG Y, et al. Characterization of antibiotics in a large-scale river system of China: occurrence pattern, spatiotemporal distribution and environmental risks [J]. Science of the Total Environment, 2018, 618: 409-418. doi: 10.1016/j.scitotenv.2017.11.054 [47] WEI R C, GE F, ZHANG L L, et al. Occurrence of 13 veterinary drugs in animal manure-amended soils in Eastern China [J]. Chemosphere, 2016, 144: 2377-2383. doi: 10.1016/j.chemosphere.2015.10.126 [48] 汤雨晴, 叶倩, 郑维义. 抗生素类药物的研究现状和进展 [J]. 国外医药(抗生素分册), 2019, 40(4): 295-301. TANG Y Q, YE Q, ZHENG W Y. Research status and development of antibiotics [J]. World Notes on Antibiotics, 2019, 40(4): 295-301(in Chinese).
[49] LI C, CHEN J Y, WANG J H, et al. Occurrence of antibiotics in soils and manures from greenhouse vegetable production bases of Beijing, China and an associated risk assessment [J]. Science of the Total Environment, 2015, 521: 101-107. [50] GAO L H, SHI Y L, LI W H, et al. Occurrence and distribution of antibiotics in urban soil in Beijing and Shanghai, China [J]. Environmental Science and Pollution Research, 2015, 22(15): 11360-11371. doi: 10.1007/s11356-015-4230-3 [51] PAN M, WONG C K C, CHU L M. Distribution of antibiotics in wastewater-irrigated soils and their accumulation in vegetable crops in the Pearl River delta, southern China [J]. Journal of Agricultural & Food Chemistry, 2014, 62(46): 11062-11069. [52] 王冲, 罗义, 毛大庆. 土壤环境中抗生素的来源、转归、生态风险以及消减对策 [J]. 环境化学, 2014, 33(1): 19-29. doi: 10.7524/j.issn.0254-6108.2014.01.005 WANG C, LUO Y, MAO D Q. Sources, fate, ecological risks and mitigation strategies of antibiotics in the soil environment [J]. Environmental Chemistry, 2014, 33(1): 19-29(in Chinese). doi: 10.7524/j.issn.0254-6108.2014.01.005
[53] HOELTGE S, KREUZIG R. Laboratory testing of sulfamethoxazole and its metabolite acetyl-sulfamethoxazole in soil [J]. Clean-Soil Air Water, 2007, 35(1): 104-110. doi: 10.1002/clen.200600019 [54] JUNGE T, CLAßEN N, SCHäFFER A, et al. Fate of the veterinary antibiotic 14C-difloxacin in soil including simultaneous amendment of pig manure with the focus on non-extractable residues [J]. Journal of Environmental Science and Health Part B, 2012, 47(9): 858-868. doi: 10.1080/03601234.2012.693868 [55] 伊丽丽, 焦文涛, 陈卫平. 不同抗生素在剖面土壤中的吸附特征 [J]. 环境化学, 2013, 32(12): 2357-2363. doi: 10.7524/j.issn.0254-6108.2013.12.020 YI L L, JIAO W T, CHEN W P. Adsorption characteristics of three types of antibiotics in the soil profiles [J]. Environmental Chemistry, 2013, 32(12): 2357-2363(in Chinese). doi: 10.7524/j.issn.0254-6108.2013.12.020
[56] ANDRIAMALALA A, VIEUBLE-GONOD L, DUMENY V, et al. Fate of sulfamethoxazole, its main metabolite N-ac-sulfamethoxazole and ciprofloxacin in agricultural soils amended or not by organic waste products [J]. Chemosphere, 2018, 191: 607-615. doi: 10.1016/j.chemosphere.2017.10.093 [57] D'ALESSIO M, DURSO L M, MILLER D N, et al. Environmental fate and microbial effects of monensin, lincomycin, and sulfamethazine residues in soil [J]. Environmental Pollution, 2019, 246: 60-68. doi: 10.1016/j.envpol.2018.11.093 [58] PARK J Y, HUWE B. Effect of pH and soil structure on transport of sulfonamide antibiotics in agricultural soils [J]. Environmental Pollution, 2016, 213: 561-570. doi: 10.1016/j.envpol.2016.01.089 [59] CONDE-CID M, FERREIRA-COELHO G, FERNANDEZ-CALVINO D, et al. Single and simultaneous adsorption of three sulfonamides in agricultural soils: Effects of pH and organic matter content [J]. Science of the Total Environment, 2020, 744: 1-14. [60] GOULAS A, SABOURIN L, ASGHAR F, et al. Explaining the accelerated degradation of ciprofloxacin, sulfamethazine, and erythromycin in different soil exposure scenarios by their aqueous extractability [J]. Environmental Science and Pollution Research, 2018, 25(16): 16236-16245. doi: 10.1007/s11356-018-1834-4 [61] PAN M, CHU L M. Adsorption and degradation of five selected antibiotics in agricultural soil [J]. Science of the Total Environment, 2016, 545: 48-56. [62] ZHANG Y, HU S, ZHANG H, et al. Degradation kinetics and mechanism of sulfadiazine and sulfamethoxazole in an agricultural soil system with manure application [J]. Science of the Total Environment, 2017, 607: 1348-1356. [63] LIU F, YING G G, YANG J F, et al. Dissipation of sulfamethoxazole, trimethoprim and tylosin in a soil under aerobic and anoxic conditions [J]. Environmental Chemistry, 2010, 7(4): 370-376. doi: 10.1071/EN09160 [64] YANG J F, YING G G, ZHOU L J, et al. Dissipation of oxytetracycline in soils under different redox conditions [J]. Environmental Pollution, 2009, 157(10): 2704-2709. doi: 10.1016/j.envpol.2009.04.031 [65] RIAZ L, MAHMOOD T, YANG Q X, et al. Bacteria-assisted removal of fluoroquinolones from wheat rhizospheres in an agricultural soil [J]. Chemosphere, 2019, 226: 8-16. doi: 10.1016/j.chemosphere.2019.03.081 [66] SCHMIDT B, EBERT J, LAMSHOEFT M, et al. Fate in soil of 14C-sulfadiazine residues contained in the manure of young pigs treated with a veterinary antibiotic [J]. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes, 2008, 43(1): 8-20. [67] MEHRTENS A, LICHA T, BROERS H P, et al. Tracing veterinary antibiotics in the subsurface-A long-term field experiment with spiked manure [J]. Environmental Pollution, 2020, 265: 1-14. [68] HAMSCHER G, PAWELZICK H T, HOPER H, et al. Different behavior of tetracyclines and sulfonamides in sandy soils after repeated fertilization with liquid manure [J]. Environmental Toxicology & Chemistry, 2005, 24(4): 861-868. [69] BALZER F, ZUEHLKE S, HANNAPPEL S. Antibiotics in groundwater under locations with high livestock density in Germany [J]. Water Science and Technology-Water Supply, 2016, 16(5): 1361-1369. doi: 10.2166/ws.2016.050 [70] BLACKWELL P A, KAY P, BOXALL A B A. The dissipation and transport of veterinary antibiotics in a sandy loam soil [J]. Chemosphere, 2007, 67(2): 292-299. doi: 10.1016/j.chemosphere.2006.09.095 [71] DODGEN L K, UEDA A, WU X, et al. Effect of transpiration on plant accumulation and translocation of PPCP/EDCs [J]. Environmental Pollution, 2015, 198: 144-153. doi: 10.1016/j.envpol.2015.01.002 [72] CARTER L J, HARRIS E, WILLIAMS M, et al. Fate and uptake of pharmaceuticals in soil-plant systems [J]. Journal of Agricultural and Food Chemistry, 2014, 62(4): 816-825. doi: 10.1021/jf404282y [73] WU X Q, DODGEN L K, CONKLE J L, et al. Plant uptake of pharmaceutical and personal care products from recycled water and biosolids: a review [J]. Science of the Total Environment, 2015, 536: 655-666. doi: 10.1016/j.scitotenv.2015.07.129 [74] WU X Q, ERNST F, CONKLE J L, et al. Comparative uptake and translocation of pharmaceutical and personal care products (PPCPs) by common vegetables [J]. Environment International, 2013, 60: 15-22. doi: 10.1016/j.envint.2013.07.015 [75] SENGUPTA A, SARKAR D, DAS P, et al. Tetracycline uptake and metabolism by vetiver grass (Chrysopogon zizanioides L. Nash) [J]. Environmental Science & Pollution Research, 2016, 23(24): 24880-24889. [76] MATHEWS S, REINHOLD D. Biosolid-borne tetracyclines and sulfonamides in plants [J]. Environmental Science & Pollution Research, 2013, 20(7): 4327-4338. [77] SIDHU H, O'CONNOR G, OGRAM A, et al. Bioavailability of biosolids-borne ciprofloxacin and azithromycin to terrestrial organisms: Microbial toxicity and earthworm responses [J]. Science of the Total Environment, 2019, 650: 18-26. doi: 10.1016/j.scitotenv.2018.09.004 [78] HUANG R X, WEN B, PEI Z G, et al. Accumulation, subcellular distribution and toxicity of copper in earthworm (Eisenia fetida) in the presence of ciprofloxacin [J]. Environmental Science & Technology, 2009, 43(10): 3688-3693. [79] MARENGO J R, KOK R A, OBRIEN K, et al. Aerobic biodegradation of 14C-sarafloxacin hydrochloride in soil [J]. Environmental Toxicology & Chemistry, 1997, 16(3): 462-471. [80] CARSTENS K L, GROSS A D, MOORMAN T B, et al. Sorption and photodegradation processes govern distribution and fate of sulfamethazine in freshwater-sediment microcosms [J]. Environmental Science & Technology, 2013, 47(19): 10877-10883. [81] DUDLEY S, SUN C, JIANG J, et al. Metabolism of sulfamethoxazole in Arabidopsis thaliana cells and cucumber seedlings [J]. Environmental Pollution, 2018, 242: 1748-1757. doi: 10.1016/j.envpol.2018.07.094 [82] KAESTNER M, NOWAK K M, MILTNER A, et al. Classification and modelling of nonextractable residue (NER) formation of xenobiotics in soil-a synthesis [J]. Critical Reviews in Environmental Science & Technology, 2014, 44(19): 2107-2171. [83] CAO S Q, WANG S F, ZHAO Y Y, et al. Fate of bisphenol S (BPS) and characterization of non-extractable residues in soil: Insights into persistence of BPS [J]. Environment International, 2020, 143: 105908-105908. doi: 10.1016/j.envint.2020.105908 [84] YAO Y, WANG B, HE Y J, et al. Fate of 4-bromodiphenyl ether (BDE3) in soil and the effects of co-existed copper [J]. Environmental Pollution, 2020, 261: 1-9. [85] GULKOWSKA A, SANDER M, HOLLENDER J, et al. Covalent binding of sulfamethazine to natural and synthetic humic acids: assessing laccase catalysis and covalent bond stability [J]. Environmental Science & Technology, 2013, 47(13): 6916-6924. [86] 曾跃春, 高彦征, 凌婉婷. 土壤中有机污染物的形态及植物可利用性 [J]. 土壤通报, 2009, 40(6): 1479-1484. ZENG Y C, GAO Y Z, LING W T. The residual forms and plant availabilities of organic pollutants in soils [J]. Chinese Journal of Soil Science, 2009, 40(6): 1479-1484(in Chinese).
[87] LI J Y, YE Q F, GAN J. Influence of organic amendment on fate of acetaminophen and sulfamethoxazole in soil [J]. Environmental Pollution, 2015, 206: 543-550. doi: 10.1016/j.envpol.2015.08.019 [88] SITTIG S, KASTEEL R, GROENEWEG J, et al. Long-term sorption and sequestration dynamics of the antibiotic sulfadiazine: a batch study [J]. Journal of Environmental Quality, 2012, 41(5): 1497-1506. doi: 10.2134/jeq2011.0467 [89] DEC J, HAIDER K, RANGASWAMY V, et al. Formation of soil-bound residues of cyprodinil and their plant uptake [J]. Journal of Agricultural & Food Chemistry, 1997, 45(2): 514-520. [90] SUN F F, KOLVENBACH B A, NASTOLD P, et al. Degradation and metabolism of tetrabromobisphenol A (TBBPA) in submerged soil and soil-plant systems [J]. Environmental Science & Technology, 2014, 48(24): 14291-14299. [91] GUO X R, LIU Y H, SUN F F, et al. Fate of 14C-bisphenol F isomers in an oxic soil and the effects of earthworm [J]. Science of the Total Environment, 2019, 657: 254-261. doi: 10.1016/j.scitotenv.2018.12.032 [92] GU J, JING Y, MA Y, et al. Effects of the earthworm Metaphire guillelmi on the mineralization, metabolism, and bound-residue formation of tetrabromobisphenol A (TBBPA) in soil [J]. Science of the Total Environment, 2017, 595: 528-536. doi: 10.1016/j.scitotenv.2017.03.273 [93] SHAN J, WANG Y F, WANG L H, et al. Effects of the geophagous earthworm Metaphire guillelmi on sorption, mineralization, and bound-residue formation of 4-nonylphenol in an agricultural soil [J]. Environmental Pollution, 2014, 189: 202-207. doi: 10.1016/j.envpol.2014.03.007 [94] HEISE J, HOELTGE S, SCHRADER S, et al. Chemical and biological characterization of non-extractable sulfonamide residues in soil [J]. Chemosphere, 2006, 65(11): 2352-2357. doi: 10.1016/j.chemosphere.2006.04.084 [95] GEVAO B, MORDAUNT C, SEMPLE K T, et al. Bioavailability of nonextractable (bound) pesticide residues to earthworms [J]. Environmental Science & Technology, 2001, 35(3): 501-507. [96] BAO Y Y, LI Y X, PAN C R. Effects of the removal of soil extractable oxytetracycline fractions on its bioaccumulation in earthworm and horsebean [J]. Water Air and Soil Pollution, 2018, 229(3): 1-12. [97] 顾鑫. 土壤中14C-红霉素的归趋及其结合残留生物有效性研究[D]. 杭州: 浙江大学, 2019, 77. GU X. Fate of 14C-erythromycin in soils and bioavailability of its bound residues[J]. Hangzhou: Zhejiang University, 2019, 77.
-




 下载:
下载: