-
滨海湿地是陆地生态系统和海洋生态系统之间的交错过渡地带,湿地通过物理沉降、动植物和微生物吸收作用、化学吸附沉淀等过程对污染物进行有效去除[1-2]。沉积速率是湿地沉积研究的一个重要内容,是确定沉积环境的定量指标,长期的平均沉积速率反映了三角洲沉积体的发育和成矿作用,而短期的平均沉积速率可以反映研究区域现代沉积动力以及水体与沉积物的交换过程,沉积速率的研究对于掌握湿地的持续处理效率和维持湿地的长期养分储存至关重要[3-5]。碳、氮、磷等元素不仅是生物体所必需的营养元素,也是湿地生态系统物质循环的关键元素,其含量与沉积速率影响着湿地乃至整个生态系统的地球化学过程[6-7]。
沉积速率的测定方法主要包括:河流输沙法、地层对比法、海图对比与GIS法、放射性同位素测年法以及长石粉或埋板标记法。河流输沙法多应用于河口海岸区域沉积速率的测定,需要长期的水文观测站积累流量和输沙量的资料,但这种方法不能确切地估算沉积物与外界的交换量而存在误差;地层对比和海面变动曲线对比需要一定量的文物考古和测定年代的资料,同时对于计算机技术和测绘技术的精度要求极高[8]。目前,国内外大多学者采用放射性核素(210Pb、137Cs、228Th、7Be等)方法,其中210Pb测年适用于百年尺度内,137Cs半衰期较长被用于长时间尺度沉积速率的测定,228Th常与210Pb结合应用于沉积速率较快的研究区域,而7Be半衰期极短,常与210Pb对比应用于不同时间尺度沉积速率的测定[9-11]。上述方法测出的数值一般是长期的沉积速率,对于短期(6—12个月)沉积速率的测定往往采用长石粉或埋板标记法,标记法对于沉积物表层存在扰动和污染[12-13]。
薛春汀等[14]提出的应用历史地理学和沉积地质学综合分析法获得了黄河三角洲新生湿地的沉积速率。这种方法采用沉积物剖面观察方法,通过对剖面植物根系和生物活动加以判断来确定沉积物沉积深度,结合沉积物形成历史确定沉积速率。该方法提出了一种短期湿地沉积物速率的计算方法,但是该方法比较粗糙、误差大、操作可行性较差。本研究在此基础上,利用湿地恢复前原有沉积物(即 “原生层”)和湿地恢复后外来输入或植被凋落形成的新沉积物(即 “新生层”)理化性质的差异在两层之间产生强烈的对比边界,通过湿地恢复前后土壤理化性质变化的“突变点”确定恢复湿地新生层沉积深度,结合恢复湿地形成历史计算湿地沉积速率,并与其他沉积速率测定方法进行比较,探讨了恢复湿地元素源汇功能,研究结果对于湿地保护和利用具有重要意义。
-
研究区位于山东省东营市黄河三角洲国家级自然保护区,地理坐标范围为37°42'— 37°46' N,119°0' — 119°6' E。处于中纬度地区,背陆面海,受欧亚大陆和太平洋的共同影响,属于暖温带半湿润大陆性季风气候区,四季分明,雨热同期,温差明显,年平均气温11.7—12.6 ℃;年均降水量530—630 mm(70%分布在夏季),年平均蒸发量为750—2400 mm[15-16];研究区水深0—1.2 m,6—8月大部分水淹,而其他月份出露。
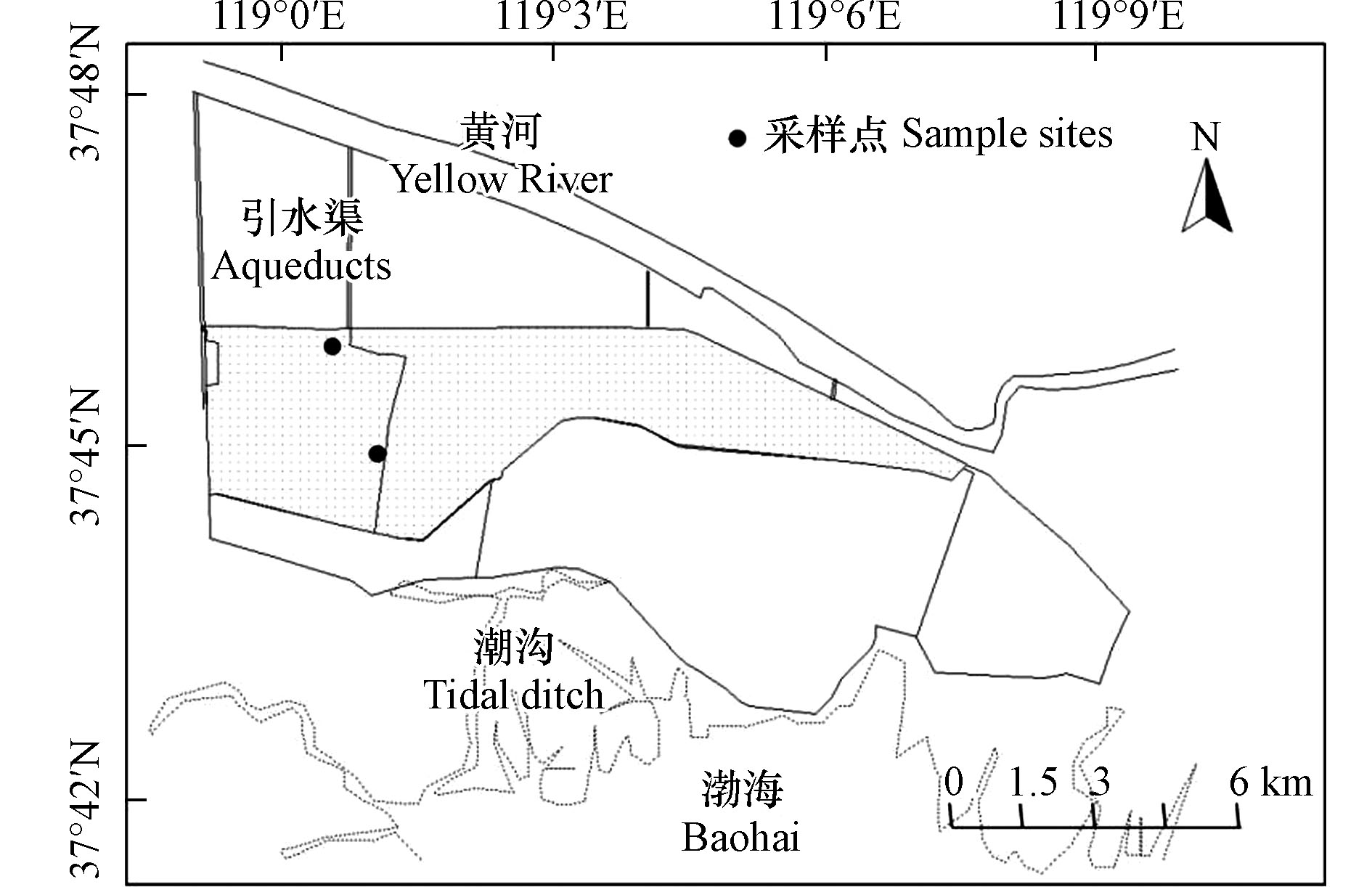
图1(灰色部分)为2002年恢复湿地,位于黄河三角洲保护区核心区,每年通过黄河定期生态补水,生态恢复较好,该湿地在黄河三角洲保护区内恢复时间最长。于2017年,采用柱状沉积物采集器在黄河三角洲恢复湿地采集了沉积物柱样(编号01和02),芯长50 cm。野外现场分割分样,0—10 cm以1 cm为间隔进行分割,10—20 cm以2 cm为间隔进行分割,20—50 cm以5 cm为间隔进行分割。获得的样品密封在自封袋内,带回实验室分析。土壤样品按照HJ/T 166的标准进行风干、研磨和过2 mm筛备用。
-
土壤pH按国家标准NY/T 1377—2007水土比2.5∶1浸提,pH计测定;电导率按照HJ 802—2016水土比2.5∶1浸提,电导率仪测定;采用过硫酸钾氧化-钼锑抗分光光度法[17]测定待测液总磷;参照HZ/HJ/SZ 0050火焰原子吸收分光光度法测定水溶性钾和钠离子浓度;参照GB 11905—89火焰原子吸收分光光度法测定水溶性钙和镁离子浓度。
样品在70 ℃恒温下干燥 48 h至恒重,充分研磨,采用稳定同位素质谱仪(美国Thermo Fisher公司,MAT253)测定δ13C、δ15N,测试精度为±0.2‰;采用元素分析仪(德国Elementar公司,Vario Micro)测定TOC、TN,测试精度为±0.5‰[18]。
-
用SegReg程序拟合土壤剖面理化性质随土壤深度变化的分段折线,采用SPSS 24.0软件中单变量一般线性模型的描述统计和齐性检验分析对分段折线进行拟合优度评价,并通过成对数据T检验确定显著性。
分段折线的“突变点”对应深度即为湿地“新生层”沉积深度。根据湿地“新生层”沉积深度和湿地建成时间(2017—2002=15年)比值,计算湿地“新生层”的沉积速率。公式如下:
式中,SR:土壤沉积速率,cm·a−1;RAS:湿地“新生层”深度,cm。
元素的沉积速率计算公式[19]如下:
式中,BR:元素沉积速率,g·m−2·a−1;Ci:元素含量,mg·g−1;SR:沉积物沉积速率,cm·a−1;BD:土壤容重,g·cm−3(本研究取1.33 g·cm−3 [20])。
-
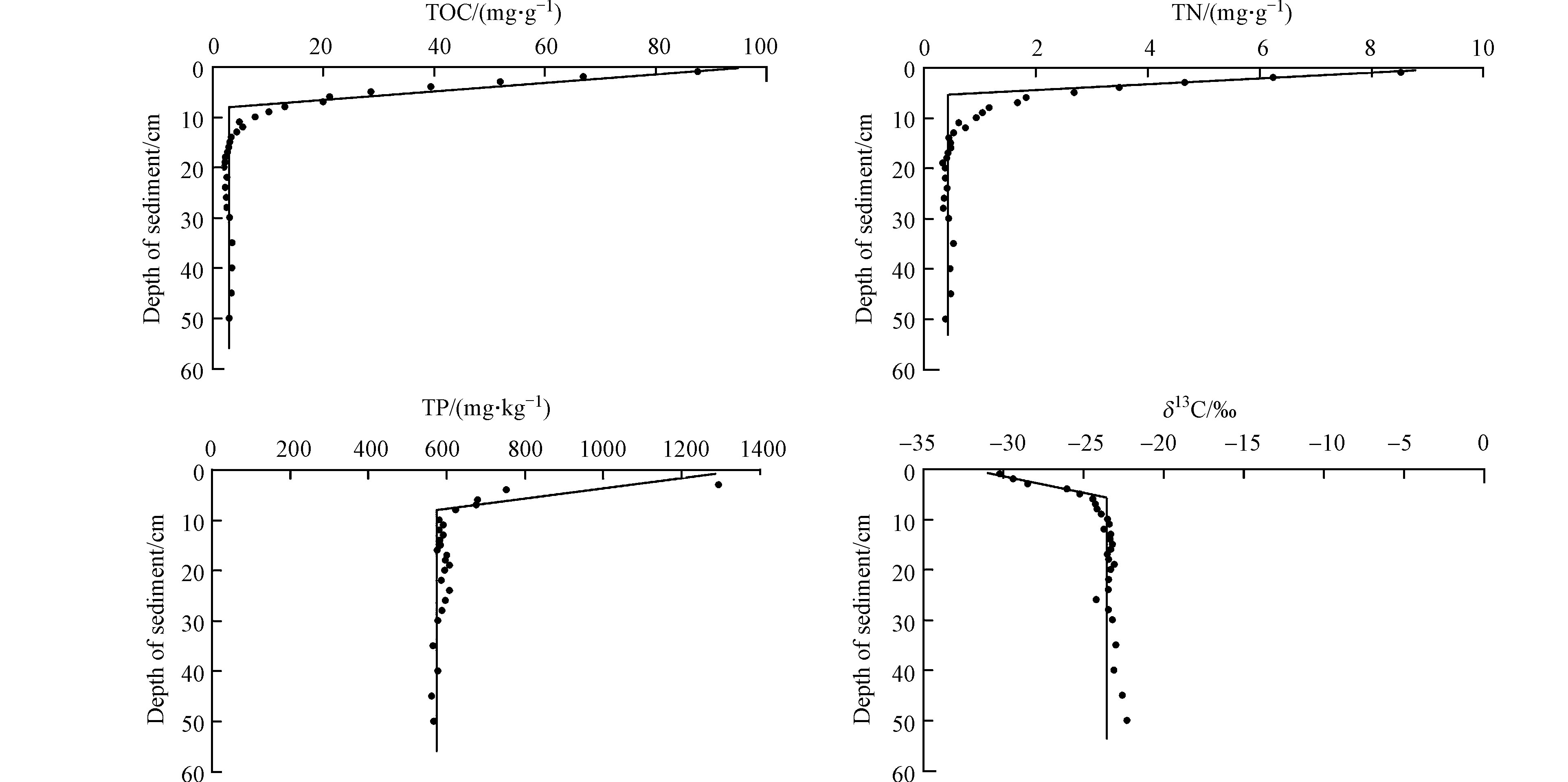
本研究选取两个土壤剖面,测定的土壤理化性质包括pH、电导率、K+、Ca2+、Na+、Mg2+、TP、δ13C、δ15N、TOC和TN。由图2可知,土壤理化性质随沉积深度表层变化剧烈,到一定深度后土壤理化性质趋于稳定,本研究即采用土壤理化性质随剖面深度的变化存在“突变点”确定恢复湿地沉积深度,根据恢复湿地建成时间确立的时间标计算沉积速率。结果表明,Na+、Mg2+和电导率随深度呈上升趋势,pH、K+、Ca2+、TP、δ13C、δ15N、TOC和TN呈下降趋势,利用SegReg程序拟合得到土壤理化性质随剖面深度的分段曲线,除pH(P>0.05)外,其他理化性质的拟合曲线相关性较好(P<0.02),两剖面各指标的拟合优度(R2)及均值见表1。
由表1可知,K+含量和电导率拟合曲线的拟合优度R2>0.95,且在两个剖面重现性好。滨海湿地由于淡水的引入土壤脱盐作用增强,表层电导率降低,但是由于地下水位浅,容易受地下水顶托和海水入侵的影响,造成表层土壤返盐作用,因此恢复湿地沉积物可能同时存在土壤脱盐和积盐过程,不建议采用如K+和电导率作为计算沉积物沉积速率的指标[21]。其次,TOC、TN、δ13C、δ15N的4个指标拟合曲线的拟合优度R2>0.90,且在两个剖面重现性较好。黄河水体颗粒物、植被凋落物分解归还,为沉积物提供了丰富的碳源[22]。根据野外沉积剖面观察,沉积物表层有大量的凋落物,0—10 cm分布有明显深色腐殖层,表层土壤颜色明显区别于下层黄色沙土层。根据土壤颜色可大致区分湿地“新生层”和“原生层”。有机质含量的表层富集现象暗示了沉积物有机质主要来源于凋落物分解归还[23]。本实验测得黄河三角洲恢复湿地新生层C/N 11.2,原生层C/N 6.8,存在显著差异(P<0.01)。两剖面新生层δ13C分别为−28.303‰±1.669‰、−27.865‰±0.297‰,接近黄河三角洲柽柳、芦苇等C3植物平均值−28‰[24],两剖面原生层的δ13C分别为−23.276‰±0.383‰、−21.916‰±0.798‰,接近湿地沉积物−25.18‰—21.49‰[18],因此,湿地“新生层”有机质主要来源于湿地植被,而“原生层”有机质主要来源黄河颗粒物。湿地“新生层”凋落物的逐步分解归还造成了沉积物有机质含量的表层富集现象。Ca2+、Mg2+含量拟合出的分段曲线R2>0.85,但在两剖面上重现性略差;而Na+含量和pH拟合优度差,不适合作为拟合沉积深度的指标。因此,跟沉积物有机质积累有关的TOC或TN或δ13C或δ15N4个指标更适用于拟合恢复湿地新生层沉积深度。
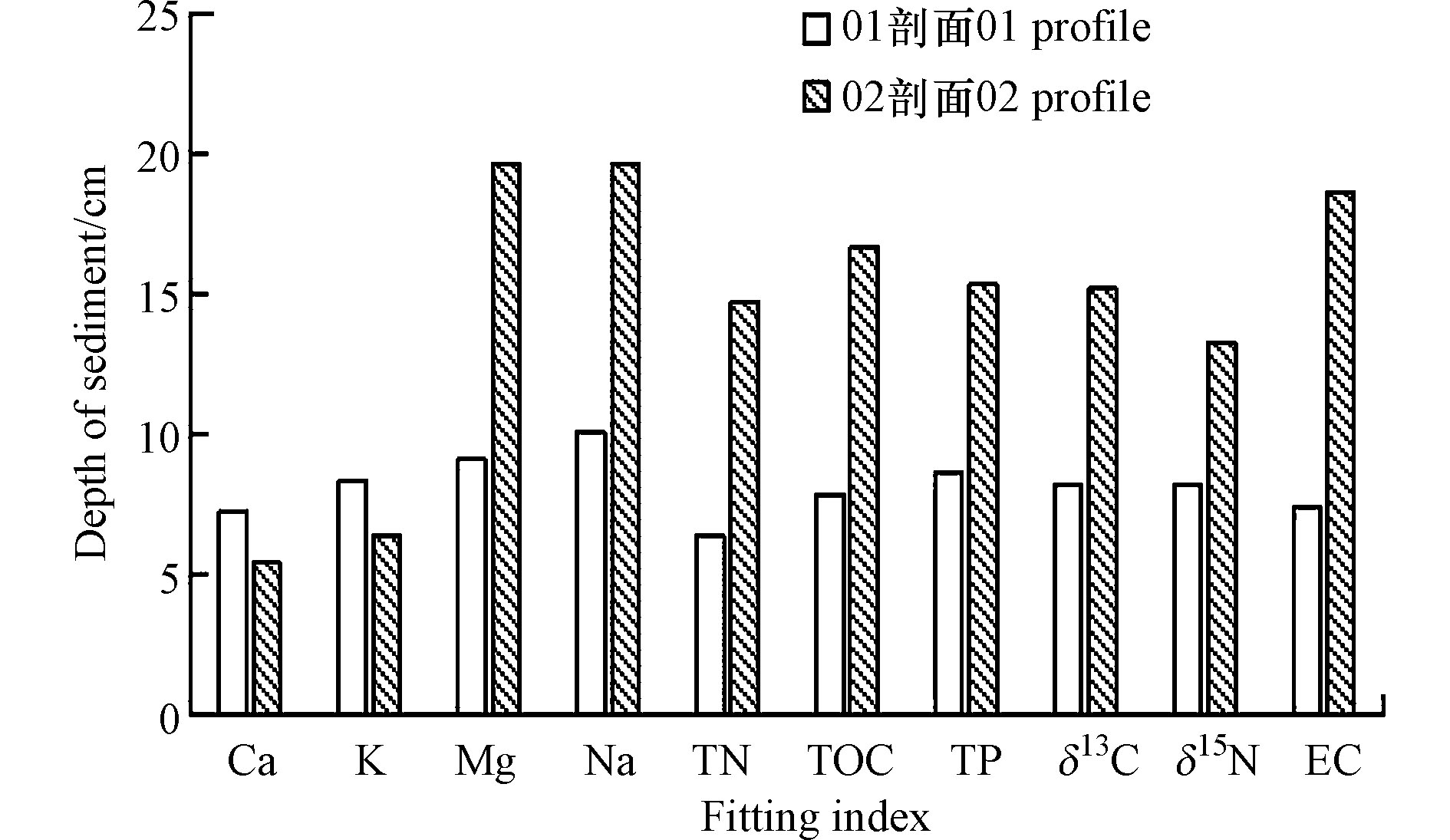
两个土壤剖面10项指标拟合的新生沉积物深度如图3所示,结合表1的拟合优度选取TOC、TN、TP、δ13C4个指标,采用SegReg拟合得到2002恢复湿地(R2002)两个剖面湿地新生层的沉积深度分别为(7.648±0.737) cm、(14.965±1.225 )cm,由沉积深度和沉积年限(15年)比值计算得到2002恢复湿地新生层沉积物沉积速率分别为(0.509±0.049 )cm·a−1、(0.998±0.082) cm·a−1。
根据恢复湿地新生层沉积物的沉积速率和沉积物中元素含量可以计算得到新生层01、02两剖面C素沉积速率分别为278.47、138.83 g·m−2·a−1,N素沉积速率分别为25.68、15.79 g·m−2·a−1,P素沉积速率分别为5.45、2.76 g·m−2·a−1。恢复湿地元素的平均沉积速率分别为C:208.65 g·m−2·a−1、N:20.74 g·m−2·a−1、P:4.11 g·m−2·a−1。
恢复湿地沉积物沉积速率和元素沉积速率在两个剖面柱芯之间存在差异,这说明恢复湿地新生层深度不均一,变异程度较大。变异的原因可能是受地形、植被和盐分的空间异质性以及所处位置的影响。另外,01剖面沉积物和营养素沉积速率均大于02剖面,可能与01剖面更接近进水口处,沉积物和元素更易沉积有关。
-
利用沉积物剖面理化性质随剖面深度变化“突变点”技术,测得黄河三角洲恢复湿地沉积物沉积速率为(0.751±0.199 )cm·a−1,该值同美国佛罗里达州大沼泽地恢复湿地的沉积速率(1±0.3 )cm·a−1 [25]相比较,方法相似、结果相近(表2)。采用长石粉标记法测定美国恢复湿地沉积物沉积速率的变化范围为0.2—13.7 cm·a−1 [26],本研究测定的结果与之基本吻合,这说明“突变点”技术测定湿地“新生层”沉积速率准确、可靠。
从湿地类型的角度来看,河口滩涂湿地的泥沙来量大于恢复湿地泥沙输入量,因此沉积物沉积速率恢复湿地低于滩涂湿地。同时,有机碳和氮磷等元素沉积速率恢复湿地要低于滩涂湿地。但是,河口湿地受人类活动和全球变化的双重影响,大江大河(如黄河等)上游来水来沙日趋减少[28]。一方面,河口淡水输入的减少可能加重土壤盐渍化,降低生物量积累,减少土壤有机质的归还,降低土壤营养元素的含量;另一方面,河口来沙减少会明显降低土壤的沉积速率。总之,未来河口滩涂湿地对营养元素的“扣留”效应可能有所降低。而恢复湿地持续的元素“扣留”效应可能随有机质积累而增强,其重要性应该引起足够重视。
-
本研究提出一种利用湿地形成前后土壤理化性质变化“突变点”,计算湿地短期沉积速率的方法。为研究黄河三角洲地区新生层深度以及短期沉积物和元素沉积速率提供了一种准确简便的方法。研究结果表明,跟湿地有机质积累有关的TOC、TN、δ13C、δ15N含量适合于拟合湿地“新生层”深度。黄河三角洲恢复湿地“新生层”沉积深度为11.31 cm,沉积速率为0.75 cm·a−1。
从黄河三角洲湿地元素的沉积速率来看,目前滩涂湿地明显大于恢复湿地。但是在未来滩涂湿地受人类活动和全球变化的影响加速的背景下,对恢复湿地“碳汇”或“磷汇”的重要性应当引起足够重视。
黄河三角洲恢复湿地沉积物和生源要素的沉积速率
The deposition rate of sediments and biogenic elements in the restored wetland in the Yellow River Delta
-
摘要: 沉积速率是湿地沉积研究的重要内容,是指示湿地沉积物和生源要素存储效率的定量指标。本研究在黄河三角洲恢复湿地采集了沉积深度为50 cm剖面高分辨率沉积物样品,测定10余种土壤理化特征,采用湿地形成前后土壤理化性质变化“突变点”,结合湿地恢复确定的时间标,计算了湿地沉积物和生源要素(C、N、P)元素的沉积速率。研究结果表明,跟湿地有机质积累有关的总有机碳(TOC)、总氮(TN)、碳稳定同位素比率(δ13C)、氮稳定同位素比率(δ15N)含量适合于拟合湿地“新生层”的沉积深度。黄河三角洲湿地(R2002)恢复15年形成的湿地“新生层”的平均沉积速率为0.75 cm·a−1,各元素的沉积速率分别为C:208.65 g·m−2·a−1、N:20.74 g·m−2·a−1、P:4.11 g·m−2·a−1。“突变点”技术可准确测定恢复湿地新生层深度及沉积速率,在未来人类活动和全球变化影响加速的背景下,对恢复湿地生源要素(如碳磷等)“扣留效应”的重要意义应当引起足够重视。Abstract: Sedimentation rate plays an important role in wetland deposition because it indicates the storage capacity of wetland sediment and biogenic element. In this study, two sediment columns with a depth of 50 cm were collected in the restored wetland in the Yellow River Delta, and 10 soil physical and chemical properties were measured. The “change point” of the soil properties and the age since wetland restoration were used to determine the sedimentation rate. The results showed that the variables such as TOC, TN, δ13C, and δ15N, which were related to the accumulation of soil organic matter, were more suitable for calculating the deposition depth of the “new layer” of sediment in the restored wetland. As a result, the average sedimentation rate of the “new layer” in R2002 was calculated as 0.75 cm·a−1, and the deposition rates of C, N, and P were 208.65 g·m−2·a−1, 20.74 g·m−2·a−1, and 4.11 g·m−2·a−1, respectively. In conclusion, the “change point” technique can be accurately used to determine the sedimentation rate of the “new layer” in restored wetland. In the future, the restored wetland will play more and more important role in sequester excess nutrient (such as N or P) due to human activities and global climate change.
-
滨海湿地是陆地生态系统和海洋生态系统之间的交错过渡地带,湿地通过物理沉降、动植物和微生物吸收作用、化学吸附沉淀等过程对污染物进行有效去除[1-2]。沉积速率是湿地沉积研究的一个重要内容,是确定沉积环境的定量指标,长期的平均沉积速率反映了三角洲沉积体的发育和成矿作用,而短期的平均沉积速率可以反映研究区域现代沉积动力以及水体与沉积物的交换过程,沉积速率的研究对于掌握湿地的持续处理效率和维持湿地的长期养分储存至关重要[3-5]。碳、氮、磷等元素不仅是生物体所必需的营养元素,也是湿地生态系统物质循环的关键元素,其含量与沉积速率影响着湿地乃至整个生态系统的地球化学过程[6-7]。
沉积速率的测定方法主要包括:河流输沙法、地层对比法、海图对比与GIS法、放射性同位素测年法以及长石粉或埋板标记法。河流输沙法多应用于河口海岸区域沉积速率的测定,需要长期的水文观测站积累流量和输沙量的资料,但这种方法不能确切地估算沉积物与外界的交换量而存在误差;地层对比和海面变动曲线对比需要一定量的文物考古和测定年代的资料,同时对于计算机技术和测绘技术的精度要求极高[8]。目前,国内外大多学者采用放射性核素(210Pb、137Cs、228Th、7Be等)方法,其中210Pb测年适用于百年尺度内,137Cs半衰期较长被用于长时间尺度沉积速率的测定,228Th常与210Pb结合应用于沉积速率较快的研究区域,而7Be半衰期极短,常与210Pb对比应用于不同时间尺度沉积速率的测定[9-11]。上述方法测出的数值一般是长期的沉积速率,对于短期(6—12个月)沉积速率的测定往往采用长石粉或埋板标记法,标记法对于沉积物表层存在扰动和污染[12-13]。
薛春汀等[14]提出的应用历史地理学和沉积地质学综合分析法获得了黄河三角洲新生湿地的沉积速率。这种方法采用沉积物剖面观察方法,通过对剖面植物根系和生物活动加以判断来确定沉积物沉积深度,结合沉积物形成历史确定沉积速率。该方法提出了一种短期湿地沉积物速率的计算方法,但是该方法比较粗糙、误差大、操作可行性较差。本研究在此基础上,利用湿地恢复前原有沉积物(即 “原生层”)和湿地恢复后外来输入或植被凋落形成的新沉积物(即 “新生层”)理化性质的差异在两层之间产生强烈的对比边界,通过湿地恢复前后土壤理化性质变化的“突变点”确定恢复湿地新生层沉积深度,结合恢复湿地形成历史计算湿地沉积速率,并与其他沉积速率测定方法进行比较,探讨了恢复湿地元素源汇功能,研究结果对于湿地保护和利用具有重要意义。
1. 材料与方法(Materials and methods)
1.1 样品采集
研究区位于山东省东营市黄河三角洲国家级自然保护区,地理坐标范围为37°42'— 37°46' N,119°0' — 119°6' E。处于中纬度地区,背陆面海,受欧亚大陆和太平洋的共同影响,属于暖温带半湿润大陆性季风气候区,四季分明,雨热同期,温差明显,年平均气温11.7—12.6 ℃;年均降水量530—630 mm(70%分布在夏季),年平均蒸发量为750—2400 mm[15-16];研究区水深0—1.2 m,6—8月大部分水淹,而其他月份出露。
图1(灰色部分)为2002年恢复湿地,位于黄河三角洲保护区核心区,每年通过黄河定期生态补水,生态恢复较好,该湿地在黄河三角洲保护区内恢复时间最长。于2017年,采用柱状沉积物采集器在黄河三角洲恢复湿地采集了沉积物柱样(编号01和02),芯长50 cm。野外现场分割分样,0—10 cm以1 cm为间隔进行分割,10—20 cm以2 cm为间隔进行分割,20—50 cm以5 cm为间隔进行分割。获得的样品密封在自封袋内,带回实验室分析。土壤样品按照HJ/T 166的标准进行风干、研磨和过2 mm筛备用。
1.2 样品测定
土壤pH按国家标准NY/T 1377—2007水土比2.5∶1浸提,pH计测定;电导率按照HJ 802—2016水土比2.5∶1浸提,电导率仪测定;采用过硫酸钾氧化-钼锑抗分光光度法[17]测定待测液总磷;参照HZ/HJ/SZ 0050火焰原子吸收分光光度法测定水溶性钾和钠离子浓度;参照GB 11905—89火焰原子吸收分光光度法测定水溶性钙和镁离子浓度。
样品在70 ℃恒温下干燥 48 h至恒重,充分研磨,采用稳定同位素质谱仪(美国Thermo Fisher公司,MAT253)测定δ13C、δ15N,测试精度为±0.2‰;采用元素分析仪(德国Elementar公司,Vario Micro)测定TOC、TN,测试精度为±0.5‰[18]。
1.3 数据处理
用SegReg程序拟合土壤剖面理化性质随土壤深度变化的分段折线,采用SPSS 24.0软件中单变量一般线性模型的描述统计和齐性检验分析对分段折线进行拟合优度评价,并通过成对数据T检验确定显著性。
分段折线的“突变点”对应深度即为湿地“新生层”沉积深度。根据湿地“新生层”沉积深度和湿地建成时间(2017—2002=15年)比值,计算湿地“新生层”的沉积速率。公式如下:
SR=RAS/15 (1−1) 式中,SR:土壤沉积速率,cm·a−1;RAS:湿地“新生层”深度,cm。
元素的沉积速率计算公式[19]如下:
BR=Ci×SR×BD×10 (1−2) 式中,BR:元素沉积速率,g·m−2·a−1;Ci:元素含量,mg·g−1;SR:沉积物沉积速率,cm·a−1;BD:土壤容重,g·cm−3(本研究取1.33 g·cm−3 [20])。
2. 结果与讨论(Results and discussion)
2.1 黄河三角洲恢复湿地沉积物沉积速率和元素C、N、P的沉积速率
本研究选取两个土壤剖面,测定的土壤理化性质包括pH、电导率、K+、Ca2+、Na+、Mg2+、TP、δ13C、δ15N、TOC和TN。由图2可知,土壤理化性质随沉积深度表层变化剧烈,到一定深度后土壤理化性质趋于稳定,本研究即采用土壤理化性质随剖面深度的变化存在“突变点”确定恢复湿地沉积深度,根据恢复湿地建成时间确立的时间标计算沉积速率。结果表明,Na+、Mg2+和电导率随深度呈上升趋势,pH、K+、Ca2+、TP、δ13C、δ15N、TOC和TN呈下降趋势,利用SegReg程序拟合得到土壤理化性质随剖面深度的分段曲线,除pH(P>0.05)外,其他理化性质的拟合曲线相关性较好(P<0.02),两剖面各指标的拟合优度(R2)及均值见表1。
表 1 各指标的拟合优度(R2)Table 1. Fitness of soil properties(R2)理化性质指标Physical and chemical properties 01剖面Profile 01 02剖面Profile 02 平均值±标准差Mean ± standard deviation Ca 0.945 0.800 0.873±0.073 K 0.960 0.952 0.956±0.004 Mg 0.966 0.771 0.869±0.098 Na 0.784 0.791 0.788±0.004 pH 0.456 0.213 0.335±0.122 TN 0.965 0.911 0.938±0.027 TOC 0.968 0.896 0.932±0.036 δ13C 0.920 0.899 0.910±0.011 δ15N 0.888 0.914 0.901±0.013 EC 0.950 0.961 0.956±0.006 由表1可知,K+含量和电导率拟合曲线的拟合优度R2>0.95,且在两个剖面重现性好。滨海湿地由于淡水的引入土壤脱盐作用增强,表层电导率降低,但是由于地下水位浅,容易受地下水顶托和海水入侵的影响,造成表层土壤返盐作用,因此恢复湿地沉积物可能同时存在土壤脱盐和积盐过程,不建议采用如K+和电导率作为计算沉积物沉积速率的指标[21]。其次,TOC、TN、δ13C、δ15N的4个指标拟合曲线的拟合优度R2>0.90,且在两个剖面重现性较好。黄河水体颗粒物、植被凋落物分解归还,为沉积物提供了丰富的碳源[22]。根据野外沉积剖面观察,沉积物表层有大量的凋落物,0—10 cm分布有明显深色腐殖层,表层土壤颜色明显区别于下层黄色沙土层。根据土壤颜色可大致区分湿地“新生层”和“原生层”。有机质含量的表层富集现象暗示了沉积物有机质主要来源于凋落物分解归还[23]。本实验测得黄河三角洲恢复湿地新生层C/N 11.2,原生层C/N 6.8,存在显著差异(P<0.01)。两剖面新生层δ13C分别为−28.303‰±1.669‰、−27.865‰±0.297‰,接近黄河三角洲柽柳、芦苇等C3植物平均值−28‰[24],两剖面原生层的δ13C分别为−23.276‰±0.383‰、−21.916‰±0.798‰,接近湿地沉积物−25.18‰—21.49‰[18],因此,湿地“新生层”有机质主要来源于湿地植被,而“原生层”有机质主要来源黄河颗粒物。湿地“新生层”凋落物的逐步分解归还造成了沉积物有机质含量的表层富集现象。Ca2+、Mg2+含量拟合出的分段曲线R2>0.85,但在两剖面上重现性略差;而Na+含量和pH拟合优度差,不适合作为拟合沉积深度的指标。因此,跟沉积物有机质积累有关的TOC或TN或δ13C或δ15N4个指标更适用于拟合恢复湿地新生层沉积深度。
两个土壤剖面10项指标拟合的新生沉积物深度如图3所示,结合表1的拟合优度选取TOC、TN、TP、δ13C4个指标,采用SegReg拟合得到2002恢复湿地(R2002)两个剖面湿地新生层的沉积深度分别为(7.648±0.737) cm、(14.965±1.225 )cm,由沉积深度和沉积年限(15年)比值计算得到2002恢复湿地新生层沉积物沉积速率分别为(0.509±0.049 )cm·a−1、(0.998±0.082) cm·a−1。
根据恢复湿地新生层沉积物的沉积速率和沉积物中元素含量可以计算得到新生层01、02两剖面C素沉积速率分别为278.47、138.83 g·m−2·a−1,N素沉积速率分别为25.68、15.79 g·m−2·a−1,P素沉积速率分别为5.45、2.76 g·m−2·a−1。恢复湿地元素的平均沉积速率分别为C:208.65 g·m−2·a−1、N:20.74 g·m−2·a−1、P:4.11 g·m−2·a−1。
恢复湿地沉积物沉积速率和元素沉积速率在两个剖面柱芯之间存在差异,这说明恢复湿地新生层深度不均一,变异程度较大。变异的原因可能是受地形、植被和盐分的空间异质性以及所处位置的影响。另外,01剖面沉积物和营养素沉积速率均大于02剖面,可能与01剖面更接近进水口处,沉积物和元素更易沉积有关。
2.2 “突变点”技术测定沉积速率和其他方法的比较
利用沉积物剖面理化性质随剖面深度变化“突变点”技术,测得黄河三角洲恢复湿地沉积物沉积速率为(0.751±0.199 )cm·a−1,该值同美国佛罗里达州大沼泽地恢复湿地的沉积速率(1±0.3 )cm·a−1 [25]相比较,方法相似、结果相近(表2)。采用长石粉标记法测定美国恢复湿地沉积物沉积速率的变化范围为0.2—13.7 cm·a−1 [26],本研究测定的结果与之基本吻合,这说明“突变点”技术测定湿地“新生层”沉积速率准确、可靠。
表 2 湿地沉积速率不同测定方法比较Table 2. Comparisons of soil and nutrient deposition rates from different wetlands研究区域Research area 研究方法Method 沉积物沉积速率/(cm·a−1)Soil deposition rate 有机碳沉积速率/(g·m−2·a−1)TOC deposition rate 参考文献References 滩涂湿地 黄河三角洲湿地 历史地理学和沉积地质学综合分析法 3.87—9.68 58—228 丁玉蓉等[28] 黄河三角洲湿地 137Cs 1.15 — 王启栋[29] 长江河口崇明东滩湿地 210Pb 1.0 — 张敬[30] 228Th 6.4 — 7Be 7.6 — 长石粉标记 11.6 760.2 吴绽蕾[31] 埋板 20 — Yang 等[12] 恢复湿地 萨克拉曼多-圣华金三角洲湿地 长石粉标记 0.2—13.7 0.6 Coveney 等[26] 佛罗里达大沼泽盆地 “突变点”法 1±0.3 — Bhomia 等[25] 黄河三角洲恢复湿地 “突变点”法 0.5—1 138.8—278.5 本研究 从湿地类型的角度来看,河口滩涂湿地的泥沙来量大于恢复湿地泥沙输入量,因此沉积物沉积速率恢复湿地低于滩涂湿地。同时,有机碳和氮磷等元素沉积速率恢复湿地要低于滩涂湿地。但是,河口湿地受人类活动和全球变化的双重影响,大江大河(如黄河等)上游来水来沙日趋减少[28]。一方面,河口淡水输入的减少可能加重土壤盐渍化,降低生物量积累,减少土壤有机质的归还,降低土壤营养元素的含量;另一方面,河口来沙减少会明显降低土壤的沉积速率。总之,未来河口滩涂湿地对营养元素的“扣留”效应可能有所降低。而恢复湿地持续的元素“扣留”效应可能随有机质积累而增强,其重要性应该引起足够重视。
3. 结论(Conclusion)
本研究提出一种利用湿地形成前后土壤理化性质变化“突变点”,计算湿地短期沉积速率的方法。为研究黄河三角洲地区新生层深度以及短期沉积物和元素沉积速率提供了一种准确简便的方法。研究结果表明,跟湿地有机质积累有关的TOC、TN、δ13C、δ15N含量适合于拟合湿地“新生层”深度。黄河三角洲恢复湿地“新生层”沉积深度为11.31 cm,沉积速率为0.75 cm·a−1。
从黄河三角洲湿地元素的沉积速率来看,目前滩涂湿地明显大于恢复湿地。但是在未来滩涂湿地受人类活动和全球变化的影响加速的背景下,对恢复湿地“碳汇”或“磷汇”的重要性应当引起足够重视。
-
表 1 各指标的拟合优度(R2)
Table 1. Fitness of soil properties(R2)
理化性质指标Physical and chemical properties 01剖面Profile 01 02剖面Profile 02 平均值±标准差Mean ± standard deviation Ca 0.945 0.800 0.873±0.073 K 0.960 0.952 0.956±0.004 Mg 0.966 0.771 0.869±0.098 Na 0.784 0.791 0.788±0.004 pH 0.456 0.213 0.335±0.122 TN 0.965 0.911 0.938±0.027 TOC 0.968 0.896 0.932±0.036 δ13C 0.920 0.899 0.910±0.011 δ15N 0.888 0.914 0.901±0.013 EC 0.950 0.961 0.956±0.006 表 2 湿地沉积速率不同测定方法比较
Table 2. Comparisons of soil and nutrient deposition rates from different wetlands
研究区域Research area 研究方法Method 沉积物沉积速率/(cm·a−1)Soil deposition rate 有机碳沉积速率/(g·m−2·a−1)TOC deposition rate 参考文献References 滩涂湿地 黄河三角洲湿地 历史地理学和沉积地质学综合分析法 3.87—9.68 58—228 丁玉蓉等[28] 黄河三角洲湿地 137Cs 1.15 — 王启栋[29] 长江河口崇明东滩湿地 210Pb 1.0 — 张敬[30] 228Th 6.4 — 7Be 7.6 — 长石粉标记 11.6 760.2 吴绽蕾[31] 埋板 20 — Yang 等[12] 恢复湿地 萨克拉曼多-圣华金三角洲湿地 长石粉标记 0.2—13.7 0.6 Coveney 等[26] 佛罗里达大沼泽盆地 “突变点”法 1±0.3 — Bhomia 等[25] 黄河三角洲恢复湿地 “突变点”法 0.5—1 138.8—278.5 本研究 -
[1] 陈曦. 辽河三角洲滨海湿地生态系统功能提升研究[D]. 吉林: 延边大学, 2015. CHEN X. Research on the function improvement of coastal wetland ecosystem in Liaohe Delta[D]. Jilin: Yanbian University, 2015(in Chinese).
[2] 李文华. 潮滩湿地植物-微生物对磷素形态转化影响的研究[D]. 北京: 中国林业科学研究院, 2013. LI W H. Study on the effect of plant-microbe on phosphorus form transformation in Tidal Flat Wetland[D]. Beijing: China Academy of Agricultural Sciences, 2013(in Chinese).
[3] 王永红, 沈焕庭. 河口海岸环境沉积速率研究方法 [J]. 海洋地质与第四纪地质, 2002, 22(2): 115-120. WANG Y H, SHEN H T. Research methods of environmental sedimentation rate in estuary and coast [J]. Marine Geology and Quaternary Geology, 2002, 22(2): 115-120(in Chinese).
[4] INGLETT P W, REDDY K R. Investigating the use of macrophyte stable C and N isotopic ratios as indicators of wetland eutrophication: Patterns in the P-affected Everglades [J]. Limnology & Oceanogr, 2006, 51(5): 2380-2387. [5] 赵锁志, 孔凡吉, 王喜宽, 等. 内蒙古乌梁素海210Pb和137Cs测年与现代沉积速率 [J]. 现代地质, 2008, 22(6): 909-914. doi: 10.3969/j.issn.1000-8527.2008.06.002 ZHAO S Z, KONG F J, WANG X K, et al. 210Pb and 137Cs dating and modern sedimentation rate on the Wuliangsu Lake of Inner Mongolia [J]. Modern Geology, 2008, 22(6): 909-914(in Chinese). doi: 10.3969/j.issn.1000-8527.2008.06.002
[6] 王亚平, 黄廷林, 周子振, 等. 金盆水库表层沉积物中营养盐分布特征与污染评价 [J]. 环境化学, 2017, 36(3): 659-665. doi: 10.7524/j.issn.0254-6108.2017.03.2016071305 WANG Y P, HUANG Y L, ZHOU Z Z, et al. Istribution and pollution evaluation of nutrients in surface sediments of Jinpen Reservoir [J]. Environmental Chemistry, 2017, 36(3): 659-665(in Chinese). doi: 10.7524/j.issn.0254-6108.2017.03.2016071305
[7] 张全军, 于秀波, 钱建鑫, 等. 鄱阳湖南矶湿地优势植物群落及土壤有机质和营养元素分布特征 [J]. 生态学报, 2012(12): 3656-3669. ZHANG Q J, YU X B, QIAN J X, et al. Distribution characteristics of plant communities and soil organic matter and main nutrients in the Poyang Lake Nanji Wetland [J]. Acta Ecologica Sinica, 2012(12): 3656-3669(in Chinese).
[8] 李从先. 三角洲沉积率及其地质意义 [J]. 海洋科学, 1981, 5(3): 30-33. LI C X. Delta deposition rate and its geological significance [J]. Acta Oceanologica Sinica, 1981, 5(3): 30-33(in Chinese).
[9] 陈文寄, 计凤桔, 王非, 等. 年轻地质体系的年代测定(续)[M]. 北京: 地震出版社, 1999: 131-135. CHEN W J, JI F J, WANG F, et al. Dating determination of young geological systems (Continued) [M]. Beijing: Seismological Press, 1999: 131-135(in Chinese).
[10] RUIZ-FERNANDEZ A C, HILLAIRE-MARCEL C, GHALEB B, et al. Isotopic constraints (228Th, 210Pb) on the age of resuspension episodes of contaminated sediments in a coastal lagoon from northwestern Mexico [J]. Environmental Changes & Radioactive Tracers, 2002, 89(36): 39-46. [11] DU J, WU Y, HUANG D, et al. Use of 7Be, 210Pb and 137Cs tracers to the transport of surface sediments of the Changjiang Estuary, China [J]. Journal of Marine Systems, 2010, 82(4): 286-294. doi: 10.1016/j.jmarsys.2010.06.003 [12] YANG S L, EISMA D, DING P X. Sedimentary processes on an estuarine marsh island within the turbidity maximum zone of the Yangtze River mouth [J]. Geo Marine Letters, 2000, 20(2): 87-92. doi: 10.1007/s003670000042 [13] CAHOON D R, TURNER R E. Accretion and canal impacts in a rapidly subsiding wetland. Ⅱ. Feldspar marker horizon technique [J]. Estuaries, 1989, 12(4): 269-283. doi: 10.2307/1351906 [14] 薛春汀, 叶思源, 高茂生, 等. 现代黄河三角洲沉积物沉积年代的确定 [J]. 海洋学报, 2009, 31(1): 117-124. XUE C T, YE S Y, GAO M S, et al. Determination of depositional age in the Huanghe Delta in China [J]. Acta Oceanologica Sinica, 2009, 31(1): 117-124(in Chinese).
[15] 王宇, 武亚楠, 鄢郭馨, 等. 黄河三角洲滨海湿地芦苇、碱蓬混生群落空间点格局分析 [J]. 生态科学, 2020, 39(1): 51-59. WANG Y, WU Y N, YAN G X, et al. Spatial point pattern analysis of mixed communities of Phragmites australis and Suaeda salsa in coastal wetland of the Yellow River Delta [J]. Ecological Science, 2020, 39(1): 51-59(in Chinese).
[16] 莫雪, 陈斐杰, 游冲, 等. 黄河三角洲不同植物群落土壤酶活性特征及影响因子分析 [J]. 环境科学, 2020, 41(2): 895-904. MO X, CHEN F J, YOU C, et al. Characteristics and factors of soil enzyme activity for different plant communities in Yellow River Delta [J]. Environmental Science, 2020, 41(2): 895-904(in Chinese).
[17] 于群英, 李孝良, 陈世勇. 过硫酸钾消化法测定土壤有机磷组分含量的研究 [J]. 安徽农业科学, 2004(5): 928-930. doi: 10.3969/j.issn.0517-6611.2004.05.046 YU Q Y, LI X L, CHEN S Y. Determination of soil organic phosphorus fractions using peroxodisulfate oxidation [J]. Journal of Anhui Agricultural Sciences, 2004(5): 928-930(in Chinese). doi: 10.3969/j.issn.0517-6611.2004.05.046
[18] 丁喜桂, 叶思源, 王吉松. 黄河三角洲湿地土壤、植物碳氮稳定同位素的组成特征 [J]. 海洋地质前沿, 2011, 27(2): 66-71. DING X G, YE S Y, WANG J S. Compositional characteristics of stable carbon and nitrogen isotopes of soil and plants in the wetlands of the Yellow River Delta [J]. Marine Geology Frontiers, 2011, 27(2): 66-71(in Chinese).
[19] ZHAO G M, YE S Y, LIU G X, et al. Late quaternary strata and carbon burial records in the Yellow River Delta, China [J]. Journal of Ocean University of China, 2015, 14(3): 446-456. doi: 10.1007/s11802-015-2773-z [20] 姚荣江, 杨劲松, 刘广明. 黄河三角洲地区土壤容重空间变异性分析 [J]. 灌溉排水学报, 2006, 25(4): 11-15. YAO R J, YANG J S, LIU G M. Spatial variability of soil bulk density in the Yellow River Delta [J]. Journal of Irrigation and Drainage, 2006, 25(4): 11-15(in Chinese).
[21] 何斌. 湿润气候下滨海盐土水盐动态及影响因素研究[D]. 上海: 华东师范大学, 2014. HE B. Study on dynamic of soil moisture content and salinity and its influencing factors in coastal saline soil under humid climate[D]. Shanghai: East China Normal University, 2014(in Chinese).
[22] 宫超. 改变碳输入对沼泽湿地碳排放的影响及其微生物学机制研究[D]. 长春: 中国科学院东北地理与农业生态研究所, 2018. GONG C. Effects of sltered carbon input on carbon emision of the marshy wetlands and the microbiological mechanisms[D]. Changchun: Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, 2018(in Chinese).
[23] 曹磊. 山东半岛北部典型滨海湿地碳的沉积与埋藏[D]. 青岛: 中国科学院海洋研究所, 2014. CAO L. Carbon deposition and burial in typical coastal wetlands of the northern Shandong peninsula[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2014(in Chinese).
[24] 尹红珍. 应用多参数示踪方法研究黄河口湿地沉积有机质来源和分布[D]. 青岛: 中国海洋大学, 2011. YIN H Z. Disentangling the sources and distribution of sedimentary organic matters in the Yellow River Estuarine Wetlands using multi-tracer approach[D]. Qingdao: Ocean University of China, 2011(in Chinese).
[25] BHOMIA R K, INGLETT P W, REDDY K R. Soil and phosphorus accretion rates in sub-tropical wetlands: Everglades stormwater treatment areas as a case example [J]. Science of The Total Environment, 2015, 533: 297-306. doi: 10.1016/j.scitotenv.2015.06.115 [26] COVENEY M F, STITES D L, LOWE E F, et al. Nutrient removal from eutrophic lake water by wetland filtration [J]. Ecological Engineering, 2003, 19(2): 141-159. [27] 王国庆, 管晓祥, 王乐扬, 等. 气候变化和人类活动对黄河重点区间径流的影响 [J]. 人民黄河, 2019, 41(10): 26-30. doi: 10.3969/j.issn.1000-1379.2019.10.006 WANG G Q, GUAN X X, WANG L Y, et al. Impact of climate change and human activities on stream flow of the key runoff generation areas of the Yellow River Basin [J]. Yellow River, 2019, 41(10): 26-30(in Chinese). doi: 10.3969/j.issn.1000-1379.2019.10.006
[28] 丁玉蓉, 叶思源, 赵全升, 等. 黄河三角洲新生湿地土壤对营养成分和碳的扣留 [J]. 地质论评, 2012, 58(1): 183-189. doi: 10.3969/j.issn.0371-5736.2012.01.016 DING Y R, YE S Y, ZHAO Q S, et al. Nutrients and carbon sequestration in the newly created wetlands of Yellow River Delta [J]. Geological Review, 2012, 58(1): 183-189(in Chinese). doi: 10.3969/j.issn.0371-5736.2012.01.016
[29] 王启栋. 基于放射性核素的山东半岛北部滨海湿地沉积环境演变与有机碳储库的讯息解析[D]. 青岛: 中国科学院海洋研究所, 2016. WANG Q D. Sedimentary records of environmental evolutions reflected by the radionuclides and organic carbon storage in the coastal wetlands of the northern Shandong peninsula[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2016(in Chinese).
[30] 张敬. 长江口及邻近海域沉积速率比较研究[D]. 上海: 华东师范大学, 2008. ZHANG J. A comparative study of the sedimentation rates in the Yangtze Estuary and Adjacent Sea[D]. Shanghai: East China Normal University, 2008(in Chinese).
[31] 吴绽蕾. 长江河口湿地沉积物中有机碳及微量元素的沉积埋藏特征[D]. 上海: 华东师范大学, 2015. WU Z L. Sedimentary and buried characteristics of organic carbon and trace elements in the sediments at Yangtze Estuarine Wetland[D]. Shanghai: East China Normal University, 2015(in Chinese).
-






 下载:
下载: