-
重金属在水生生态系统中有着非常广泛的分布. 其主要来源包括地球化学结构、采矿活动、金属冶炼、工业废物、废物焚烧和城市污水排放[1]. 由于重金属不会自然降解,它们通常沉淀在沉积物中,溶解在天然水中,或富集在生物体中[2]. 值得注意的是,重金属在食物链中富集,一旦达到生物利用度的阈值,就会对生物体造成毒性影响[3].
水体环境的物理化学特征对沉积物积累重金属的行为存在显著影响[4]. 由于湖泊沉积物是水体环境中重要的重金属库,沉积物中积累的重金属成了水体环境重金属污染的一个重要来源,因此对于水生生态系统中沉积物中重金属含量的检测,也是了解水环境重金属污染的重要环节[5]. 湖泊沉积物提供了环境变化的信息,显示了流域内不同重金属浓度的时空差异[6-7]. 通过测定不同深度的沉积物岩芯中重金属的浓度可以推测重金属污染史[8-10]. 然而,重金属生物积累和放大的信息不能只通过测定水体和沉积物中重金属来衡量[11].
随着时间的推移,水生生物会吸收其生存环境中的各种污染物,另外,鱼类在水生环境食物网中占据重要地位. 因此,检测鱼类重金属的富集情况可以作为水体环境重金属污染的生物监测手段[10]. 更重要的是,鱼体内富集的重金属可以通过食物链转移到人体. 一般来说,重金属可以分为有毒元素(如Pb、Cd、Cr)和生物必需元素(如Cu、Zn),但即使是生物必需元素在高浓度条件下也会产生毒性效应[12]. 测定鱼体中的重金属含量,对评估人类食用鱼的潜在健康风险具有重要意义[13-14]. 研究鱼类组织中重金属的含量,将有助于评价水环境中重金属的污染状况. 鱼类的肌肉组织是人类消费的主要部分;肝脏是金属最重要的代谢和储存器官[15];鳃可以直接反映水中的金属含量,因为它们是直接暴露在水环境中的呼吸器官,可以调节酸碱和离子转移[16]. 因此,本研究检测鱼类的肌肉、肝脏、鳃部位的重金属含量,来了解鱼类体内重金属污染情况.
滇池作为水资源保护区以及中国最大的高原淡水湖,同时也是昆明市主要的储备水源. 根据《云南省环境保护厅关于印发云南省地表水水环境功能区划(2010—2020年)的通知(云环发〔2014〕34号)》一般鱼类保护区和游泳区,执行地表水环境质量Ⅲ类标准. 在经济快速发展的几十年中,该湖受到了工业、农业和城市日常生活污水和废物的严重污染. 滇池是一个富营养化程度很高的湖泊,具有弱碱性环境和较高的溶解氧浓度[17]. 在弱碱性条件下,即使存在相当大的物理干扰,沉积物中的重金属也很难释放出来进入水体[18]. 在较高溶解氧条件下,金属氧化物和氢氧化物与可溶性重金属离子结合形成共沉淀.[19]悬浮沉积物从水中吸附重金属污染物,从而降低其在水中的浓度[20],使得沉积物中重金属含量高于地表水. 尽管之前有研究表明,在滇池沉积物中存在大量重金属[21],但它们在水体和沉积物中的空间分布和历史变化,以及随环境条件变化在特有野生鱼类组织中的生物蓄积量知之甚少.
本文对滇池水环境、底泥和3种典型野生鱼类(鲤鱼、鲫鱼和银鱼)中Pb、Zn、Cu、Cd、Cr的含量进行了比较研究. 本研究旨在研究水体和沉积物中重金属的含量及其空间变化,阐明其在鱼类器官中的富集水平,为重金属污染防治提供基础资料. 在此基础上,对滇池重金属污染对周边居民可能造成的危害进行了评价. 这些研究有助于更好地了解重金属在自然水环境中的迁移转化以及在生物体内的富集情况,为合理管理和控制重金属污染提供有效信息.
全文HTML
-
本研究所用溶剂均为分析纯级或色谱纯级. 以Pb、Zn、Cu、Cd、Cr为储备标准溶液(1000 μg·mL−1),经适当稀释后制成标准曲线制备液. 所有塑料容器和玻璃器皿在使用前用稀硝酸(1+9,V/V)浸泡并用蒸馏水冲洗. 微波辅助消解(MAD)由ETHOS 1高级微波消解系统(Milestone,Italy)进行,该系统配有12个样品盘和温度控制系统[22]. 采用火焰/石墨原子吸收光谱仪(AAS,Varian instruments AA240)和电感耦合等离子体质谱仪(ICP-MS,Thermo)进行样品分析.
-
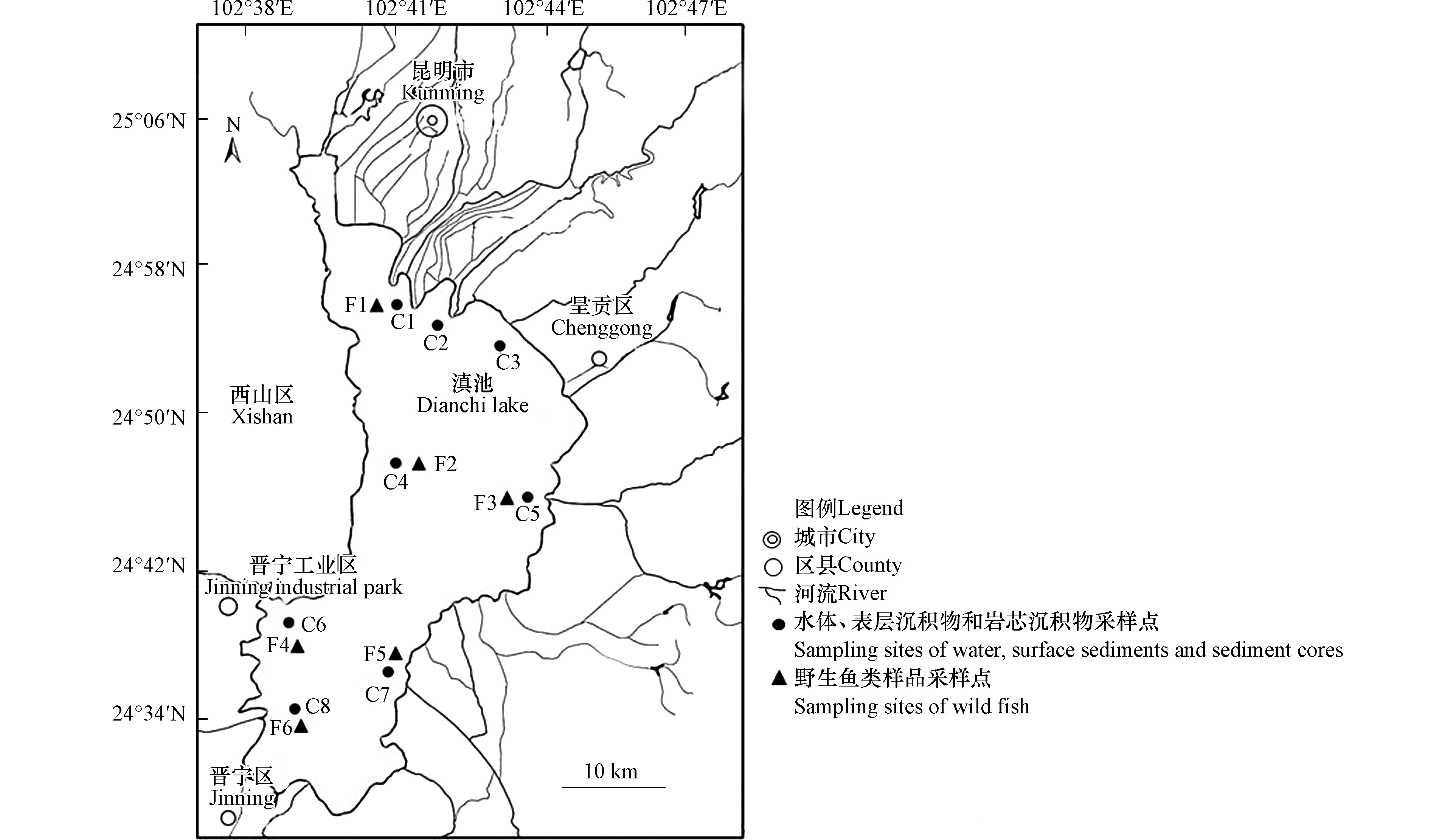
滇池(东经102°10′—103°440′,北纬24°23′—26°22′)是位于我国西南地区的高原湖泊. 该湖海拔1886 m,水面面积330 km2,湖的平均和最大水深分别为4.4 m和10.4 m[23],研究区域和采样点布置图如图1所示.
本研究综合考虑采样点的总体覆盖范围,并结合滇池典型地表水水质监测断面(生态环境部,2012年),选择以下8个采样点(C1:晖湾、C2:宝象、C3:罗家营、C4:观音山西、C5:大鱼乡、C6:海口西、C7:白鱼、C8:滇池南)采集水样和沉积物样品,其中晖湾、罗家营、观音山西、海口西及滇池南5个点位为地表水水质国家重点监控断面. 采样点的坐标采用全球定位系统(GPS,Spectra Precision,America)记录. 用4 L棕色玻璃瓶采集水样,立即向水样中加入1%硝酸,以抑制金属与容器壁的结合. 表层沉积物样品是从湖床顶部以下10 cm处使用不锈钢抓斗取样器采集. 用不锈钢重力取芯器取样容器从110 cm深度采集沉积物岩芯样品. 沉积物岩芯被分成22层,每层5 cm高. 沉积物岩芯的所有部分都放在一个贴有相应标签的塑料袋中. 水样以4 ℃的温度储存,沉积物样品以−35 ℃的温度储存.
-
从湖的6个采样点(F1:晖湾、F2:观音山西、F3:大鱼乡、F4:海口西、F5:白鱼、F6:滇池南)采集鱼类样品. 由于鱼存在活动行为,来自某个“地点”的样本实际上代表了一段距离取样地点大约3 km的水域. 表1列出了每个地点每个物种的分析样本信息.
所分析的鱼类种类有鲤鱼、鲫鱼和银鱼,它们是滇池中常见的鱼类,在食物链中占有相同的位置. 这3种鱼类被当地居民广泛食用,具有较大的研究价值. 本研究从6个地点共采集到90个标本,包括3个物种.
-
水样用2 mL浓硝酸(65%)和1 mL过氧化氢(30%)在180 ℃条件下消解10 min后用微孔0.45 μm玻璃纤维过滤器(Billerica,MA,USA)过滤去除藻类、浮游动物和悬浮颗粒,然后储存在4 ℃下. 沉积物样品冷冻干燥后用孔径为1 mm清洁塑料筛,筛除大块石头、贝壳等碎片. 筛过的沉积物在玛瑙研钵中研磨,直到所有颗粒通过100目尼龙筛(0.147 mm).在本研究中使用4 mL硝酸(65%)、2 mL过氧化氢(20%)、1 mL氢氟酸(40%)配合微波辅助消解法对沉积物样品进行前处理[3]. 完全消解后,冷却至室温,并用超纯水(Mili-Q 18.2 MΩ·cm电阻率)稀释至所需体积,待测重金属含量.
用致死剂量的麻醉剂(MS-222)杀鱼后,用手术刀解剖,将组织与骨骼分离. 对鱼个体的肌肉解剖、汇集、匀浆和冻干(Eyela FDU-1200,Japan),器官组织均化并分开保存. 银鱼体形较小(<15 cm),只分离肌肉和内脏. 冻干后,将样品磨成粉末,筛至<1 mm,然后在室温下密封储存. 在微波消解系统中,用浓硝酸(65%)和过氧化氢(30%)消化干鱼样品,并用超纯水(Milli-Q 电阻率>18.2 MΩ·cm)稀释样品.
-
生物浓缩因子(BCFs)的计算形式如下:BCF=CF/CW,其中CF为鱼组织中的目标污染物浓度,CW是水中的浓度[24]. 鱼的重量以湿重(ww)计算,单位为L·kg−1. 本研究将BCFdw通过含水率换算成BCFww(用于分析鱼样品的含水量为82.5%—86%,本文按85%进行转换).
目标危险系数(THQ)是暴露量与参考剂量之间的比率,用于表示非致癌作用的风险. 如果该比率小于1,则无明显风险,当剂量大于或等于RfD时,受关注的暴露人群将面临健康风险.
式中,EF是暴露频率(365 d·a−1);ED是暴露持续时间(按平均寿命70年算);FIR是食物摄入率(g·d−1);C是鱼类中的重金属浓度(μg·g−1);RfD是重金属口服参考剂量(mg·kg−1·d−1,参考美国环保局标准为Cd、Pb、Cr、Cu、Zn(0.001、0.004、1.5、0.04、0.3));BW是成人的平均体重(按60 kg算);ATn是非致癌物平均暴露时间(365 d·a−1×ED).
由于暴露于两种或多种污染物可能会导致加和或相互作用从而产生潜在健康危害的潜在风险[25]. 本研究用危险指数(HI)来表示各个金属THQ值的算术总和.
式中, THQn分别为THQPb、THQZn、THQCu、THQCd、THQCr.
所有统计分析均采用IBMSPSS 20.0版进行. 采用单因素方差分析(ANOVA)对各类样品间的差异进行了检验. 秩相关分析(RHO)探讨了金属浓度与其他水化学变量之间的关系. 用单因素方差分析(ANOVA)比较了物种、组织和地点之间的平均金属浓度差异. 采用方差分析程序,采用Tukey显著性差异检验(HSD)进行多重比较. 如果P<0.05,则差异显著. 所有数据均表示为平均值的±标准误差.
1.1. 试剂和仪器
1.2. 水和沉积物样品采集
1.3. 鱼类样品采集
1.4. 样品制备和分析
1.5. 数据分析和统计分析
-
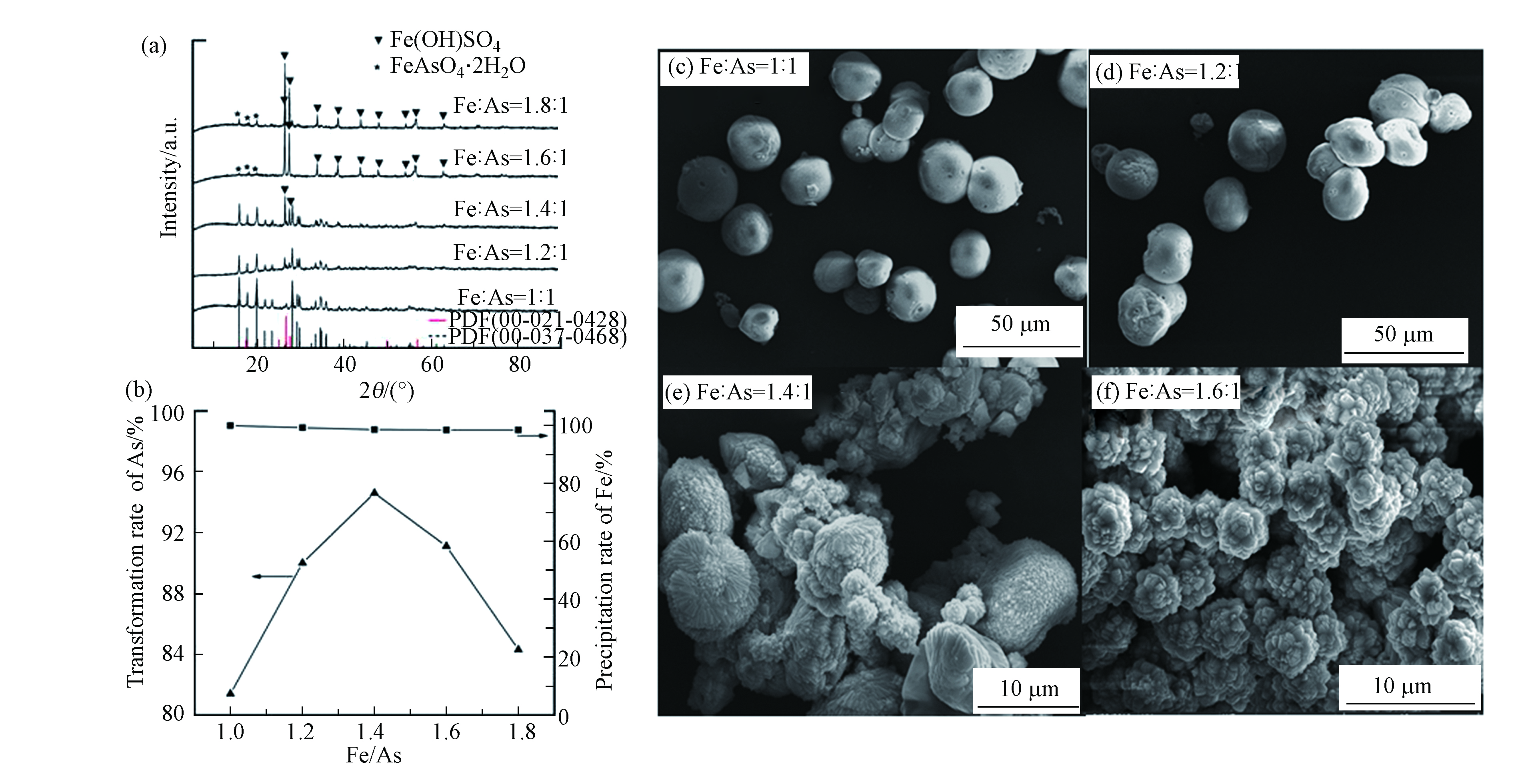
表2显示了滇池各采样点水体中重金属的浓度,不同的采样点的水体的重金属浓度存在着明显的差异(ANOVA,P<0.05). 8个水体取样点重金属的浓度顺序可大体概括为Zn>Cr>Cu>Pb>Cd. 宝象(C2)的水体中Zn、Cd、Cr(六价)浓度最高(P<0.05),罗家营(C3)的Pb浓度最高(P<0.05),采样点C2、C3所在地均十分靠近昆明市. 靠近晋宁工业园区的C8采样点水体中的Cu浓度最高(P<0.05). 水体中重金属的浓度可能与这些地点周围的城市径流、污水排放口和废水排放有关.总的来说,人为因素很大程度上影响了滇中水体重金属的浓度[26]. 根据国家环境保护总局2002年颁布的《地表水环境质量标准》(GB3838—2002),滇池水体中Pb浓度超Ⅱ类水标准,Cr(六价)浓度超Ⅴ类水标准. 除Cu(r=0.147,P=0.05)和Pb(r=−0.039,P=0.928)外,pH值与水中其他重金属浓度呈负相关(r<−0.454,P<0.258). pH值的平均值为9.12,在这种情况下,重金属很容易结合到沉积物中,不会从沉积物中释放出来[17].
表2显示了各采样点表层沉积物中重金属的含量. 各个采样点间虽然存在着明显的差异(ANOVA,P<0.001),但在各采样点重金属中遵循着Zn>Cr>Cu>Pb>Cd的含量顺序. 在滇池北部的晖湾(C1)及宝象(C2)点位具有较高的Zn、Cr和Cd含量,相反在滇池南部的滇池南(C8)点位具有较高的Pb含量,此外大渔乡(C5)Cu元素含量也明显高于其他位点.表2中给出了当地重金属的土壤背景值(1990年),发现各采样点的表层沉积物中重金属的含量均高于土壤背景值,存在严重的重金属污染. 表层沉积物中的重金属来自于水体重金属. 宝象(C2)水体Zn和Cr污染严重的同时表层沉积物中也存在较高的Zn和Cr含量. 由于滇池富营养化的特点,使得沉积物中产生了大量有机质,其中腐殖酸类物质可以与部分重金属形成天然聚电解质的络合金属离子从而结合迁移并沉淀到沉积物中[17]. 同时根据水体及表层沉积物中重金属浓度的相关性分析表3也可以看出,同一采样点表层沉积物Zn、Cr含量与水体Zn、Cr含量呈显著正相关(r=0.873,P<0.001和r=0.716,P<0.05).
-
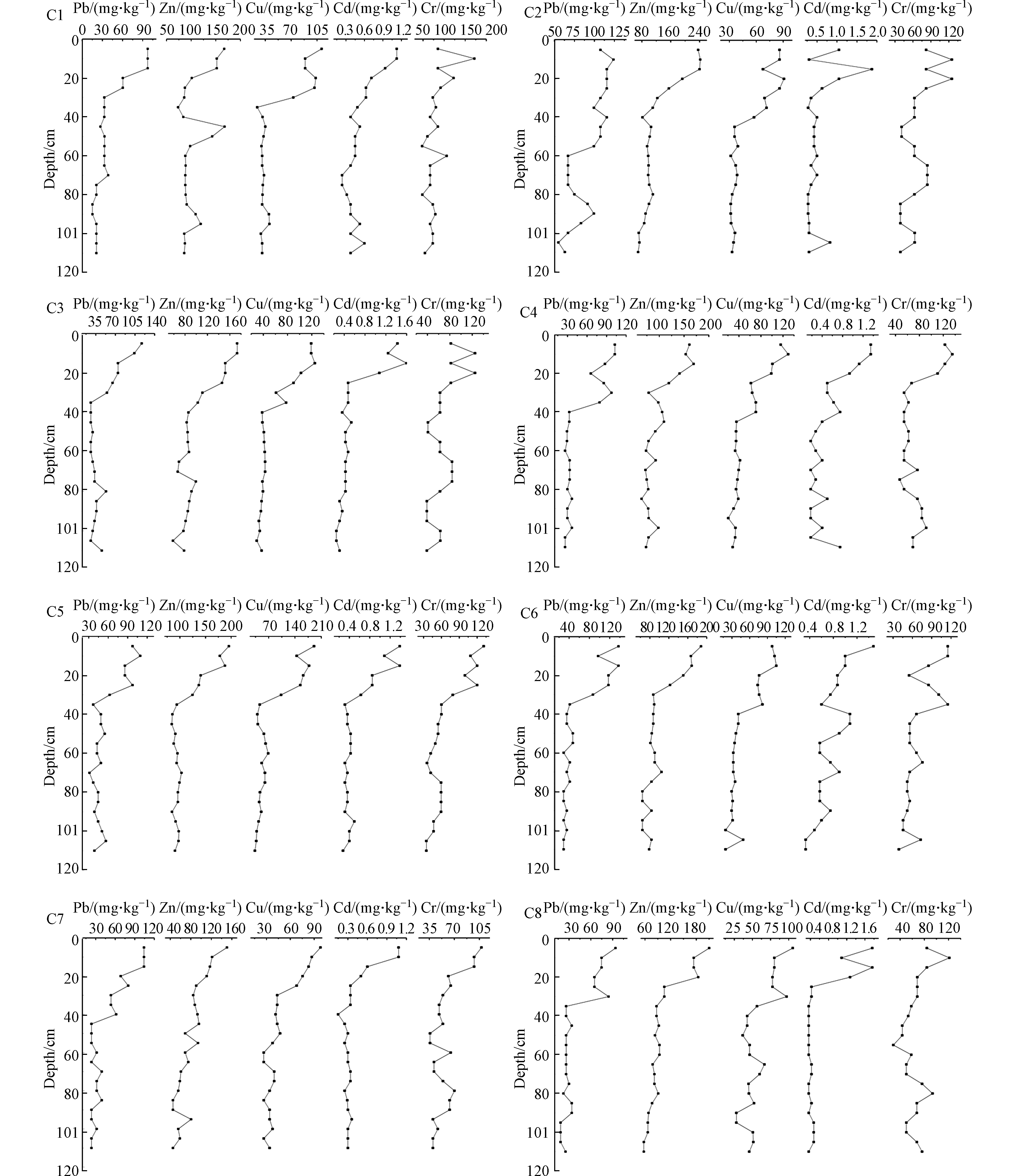
滇池沉积物中Pb、Zn、Cu、Cd、Cr共5种重金属的垂向分布情况如图2所示. 总的来说,30—110 cm的沉积物中重金属的平均浓度近似等于当地土壤的背景水平(国家环保总局,1900年).沉积物岩芯的重金属浓度从30—10 cm明显增加,从10 cm到表层平稳增加. 每个沉积岩芯层段内的重金属含量可以代表某一个时间段内的沉积物重金属污染情况. 通过有关滇池的210Pb和137Cs年代测定[10,27]和滇池沉积物长期的沉积记录来看,0—5 cm的表层沉积物的沉积速率大约为1.40 cm·a−1,5—55 cm的岩芯沉积物的沉积速率约为0.75 cm·a−1,55—110 cm的深层岩芯沉积物的沉积速率为0.26 cm·a−1[27-28].
由此可以判断不同深度的岩芯沉积物的沉积年代,深度在5—10 cm岩芯沉积物大约在21世纪初10年间沉积下来的,而深度在25—30 cm岩心沉积物大约在20世纪70年代沉积下来的,可以推测岩心沉积物的最深层有150多年的历史. 20世纪70年代以来,Pb、Zn、Cu、Cd、Cr的含量上升,对应于10—30 cm的沉积物岩芯. 显然,自20世纪70年代以来,滇池沉积物受到人为源重金属的污染较为严重,这一时期滇池周边地区城市化和工业化的快速发展造成了重金属污染. 此外,研究结果还表明,自2000年以来,这些金属的浓度变化幅度较小,相当于沉积岩芯与表层之间的距离为10 cm.这可能是因为昆明市政府从2003年开始实施环境管理工程,包括调水节水工程、截污工程、河道整治工程、生态修复工程等,农村和农业改良工程、建设工程和生态疏浚工程[29].
-
地方野生鱼类中重金属含量分析,点位(F5、12>12.761、P<0.01、ANOVA)和组织(F2、51>7.410、P<0.01、ANOVA)有显著差异,但物种间的差异显著性较低. 鱼类肌肉中重金属的含量如图3所示. 所有金属含量均以干重为基础测定. 靠近济宁工业园区的F4周围3种鱼类肌肉中Pb、Zn、Cu、Cd、Cr含量均显著高于F1、F2、F3、F5和F6.与其他采样点位(F2、F3、F5、F6)相比,采样点F1鱼肌肉中Pb、Zn、Cu的含量显著较高(P<0.05).
根据国家食品安全标准(GB 2762—2012),以样品单位湿重浓度为指标,提出了食品中Zn(GB 13106—91)和Cu(GB 15199—94)的限量标准. 国家食品安全标准规定的Pb、Cd、Cr湿重浓度阈值分别为0.5、0.1、2.0 mg·kg−1,食品中Zn、Cu的限量分别为50、10 mg·kg−1. 分别测定了鱼样品中的水分含量,并测定了鱼肌肉中重金属Pb、Zn、Cu、Cd和Cr的最大湿重浓度,分别为0.12、10.18、0.22、0.02、0.14 mg·kg−1. 所采鱼类Pb、Zn、Cu、Cd、Cr含量均未超过卫生部规定的标准(GB 2762—2012).
具体来说,鱼肌肉中Pb的最低和最高水平分别为:鲫鱼在F2位点的(0.10±0.01) mg·kg−1和鲤鱼在F4位点的(0.78±0.01 )mg·kg−1. 通过对所有鱼类的研究,发现肌肉中Zn(21.79—67.87 mg·kg−1)和Cu(0.48—1.47 mg·kg−1)的含量均高于其他金属,但鱼肌肉中Zn和Cu的含量均低于限值. 所有鱼类品种的肌肉中Cd(0.03—0.16 mg·kg−1)含量均较低. 而距离济宁工业园区最近的F4点,3种特有野生鱼类中Cd含量均比其他点高2—3倍,说明工业废水是造成该区Cd污染的主要原因. 鲤鱼肌肉中Cr含量最低,为(0.13±0.01 )mg·kg−1,银鱼中Cr含量最高,为(0.89±0.15 )mg·kg−1.
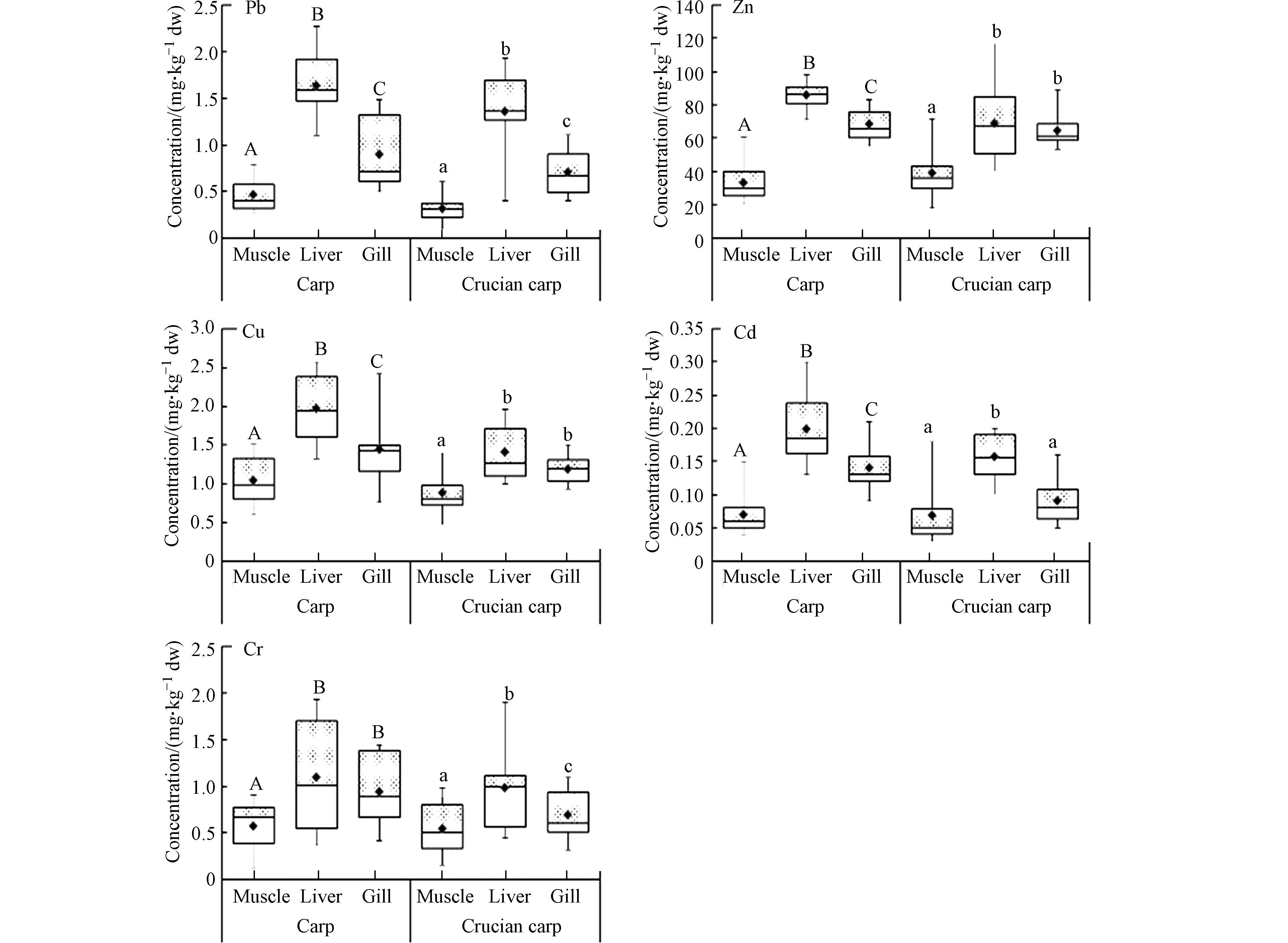
在所有采样点,对同一物种(鲤鱼和鲫鱼)的器官(肌肉、肝脏和鳃)进行解剖和收集,以测定Pb、Zn、Cu、Cd和Cr的浓度. 鲤鱼和鲫鱼肝脏、鳃和肌肉中的金属含量分析结果如图4所示. 鲤鱼和鲫鱼组织中重金属含量均无异常值. 其中,相较于其他组织,鱼类(鲤鱼和鲫鱼)肝脏中各种中重金属的平均含量最高,分别为鲤鱼:Pb(1.63±0.32) mg·kg−1、Zn(85.67±7.70 )mg·kg−1、Cu(1.97±0.42) mg·kg−1、Cd(0.20±0.05) mg·kg−1、Cr(1.09±0.54) mg·kg−1,鲫鱼:Pb(1.35±0.45 )mg·kg−1、Zn(68.68±21.23 )mg·kg−1、Cu(1.41±0.35) mg·kg−1、Cd(0.16±0.03 )mg·kg−1和Cr(0.98±0.43) mg·kg−1.从结果上看,鱼类肝脏具有最高重金属含量,可食用部分肌肉中重金属含量最低,而鳃的重金属含量介于肌肉与肝脏中间. 根据研究表明[30],肝脏是重金属最佳的储存器官,且在鲤鱼和鲫鱼各组织中遵循肝脏>鳃>肌肉的平均重金属含量顺序. 鱼鳃作为与水环境直接接触换气的器官,直接接触受污染水体也是导致其含量较高的原因[31]. 此外还发现,鲤鱼中各重金属含量均较高于鲫鱼,可能是由于其不同的生长习性、环境行为以及鱼龄等的差异才导致鲤鱼对于重金属的富集能力强于鲫鱼.
-
生物富集是化学物质从周围环境中吸收到生物体中的一个过程. BCF值通常被认为是反映污染物在生物体内富集程度的一个相关指标[32]. 在比较金属吸收顺序时,用BCF值来表示生物富集的结果是具有参考价值的. 表4总结了本研究中鲤鱼、鲫鱼和银鱼肌肉、肝脏和鳃的BCF值. 根据计算结果,这3种鱼类肌肉组织的BCF值最低,其重金属的富集顺序为Zn>Cd>Pb>Cu>Cr.总的来说,滇池鱼类的BCF值均较低,表明滇池鱼类没有受到严重的重金属污染. 但滇池鱼类的金属生物富集受多种因素的影响,需要进一步的研究来解释其生物富集模式的可能机制.
-
THQ和HI可以为在污染环境中的暴露物提供判断其健康风险水平的信息[33]. 由表5可得知,滇池3种鱼类的HI和THQ均小于1,表明接触者没有明显的健康风险. 综合比较每种鱼类的THQ值看到,Pb和Zn为最高值,且分别占人类健康的31%和39%,Cr为最低值. 这说明,Pb和Zn元素为滇池鱼类对人类健康风险的两种主要贡献者. 3种野生鱼类中Cr元素的THQ值在0.00039—0.00044之间,所以消费这3种野生鱼类的健康风险微乎其微的. 表5显示,鲤鱼、鲫鱼和银鱼的重金属HI值分别为0.376、0.350和0.400.其中,银鱼的HI值略高于鲤鱼和鲫鱼,说明食用银鱼较另两种鱼有更高的非致癌风险. 虽然单个鱼类样品的HI不超过1,但由于重金属的积累和降解抗性. 长期食用这三种鱼类,可能存在一定的非致癌风险. 滇池鱼类重金属积累不可忽视,当其富集程度达到生物毒性水平时,将可能对长期暴露物甚至人群造成一定的健康风险. 本研究所研究的鱼类作为人类饮食的重要组成,为了保证滇池周边居民的健康不受影响,需要加大滇池重金属污染的防治力度.
2.1. 水和表层沉积物中重金属的分布
2.2. 沉积物岩芯重金属的分布特征
2.3. 典型野生鱼类重金属污染特征
2.4. 重金属的生物富集
2.5. 人体健康风险评价
-
在8个滇池水体和表层沉积物采样点中,靠近城市径流和工业园区的点位如C1(晖湾)、C3(罗家营)、C5(大鱼乡)、C8(滇池南)重金属含量均较高,说明人为因素大大影响了重金属含量. C2(宝象)点位的Zn、Cr、Cd均在滇池水体和表层沉积物中体现出最高含量水平,且重金属在水体中的浓度顺序与在表层沉积物中的含量顺序大体一致,均体现为Zn>Cr>Cu>Pb>Cd,这都充分体现了重金属在水体和沉积物之间的相互补充关系. 通过分析滇池8个采样点岩芯沉积物中重金属元素浓度水平及污染特征,得到了重金属元素在滇池污染的历史数据,揭示了滇池重金属污染历史的三个阶段,并发现是由于工业和经济的迅速发展才使得柱状沉积物重金属含量发生变化. 对采集的3种鱼类的肌肉分析中,所检测的5种重金属均没有超过国家规定的限值,并且这3种鱼类重金属的THQ和HI值都小于1,这意味着,人类单一消费其中一种鱼类而摄入的重金属元素对其潜在非致癌性健康风险较低. 鲤鱼和鲫鱼不同组织中重金属的含量也遵循着肝脏>鳃>肌肉的平均重金属含量顺序. 但由于重金属的积累特性可能对人体带来的危害,用有效的措施对滇池进行保护也是刻不容缓的.



 下载:
下载: