-
砷(As)是一种重要的非金属元素,其在自然界中广泛存在。砷可与肌体细胞中的酶结合,使酶失活造成代谢障碍[1]。自然界中的砷可通过食物链在水产品富集,和庆等研究发现,长江三角洲区域处于池塘养殖环境的水产品体内会存在Cd、Cr和As等重金属,养殖池塘内沉积物的重金属污染与其含量有较大关系[2]。严国等研究表明,海蟹的砷含量高富集,158个蟹类样品中含有0.37—35.81 mg·kg−1总砷[3]。所以人体摄入砷的主要途径之一为水产品的摄入[4-5]。水产品中的砷有砷酸根(arsenate,As(Ⅴ))、亚砷酸根(arsenite,As(Ⅲ))、一甲基砷(monomethyl arsenic acid,MMA)、二甲基砷(dimethyl arsenic acid,DMA)、砷甜菜碱(arsenobetaine,AsB)、砷胆碱(arsenocholine,AsC)、砷糖、砷脂等存在形式,其中As(Ⅴ)和As(Ⅲ)为无机砷,其他的为有机砷[6]。食品和环境中砷超标的情况时有发生,砷的总含量和存在形态决定其的生物毒性强弱,其中砷的存在形态占主要作用[7-9]。研究表明,砷元素在水产品种以AsB和砷糖的形式主要存在,其无毒或低毒[10]。所以,砷在环境中的现实残留状况一直是研究关注的热点。
皖中地区大型水域包括巢湖和长江水域,巢湖连淮通江,近年来的“引江济巢”工程将长江提水注入巢湖,形成水体流动,流域区域水安全保障能力得以提高[11]。沈黎等研究发现,一甲基砷在淡水刁子鱼中含量较高,亚砷酸根和砷酸根在淡水胖头鱼、鲇鱼中含量较高,亚砷酸根在海水鱼虾中含量较高,而砷酸根、一甲基砷、二甲基砷的含量在海水鱼虾中几乎没有[12]。鲍方印等研究发现,重金属在巢湖的鱼、虾、贝体内虽然含量极微,,但也存在一定程度的污染,只是程度较轻[13]。以上研究表明,水产品中重金属的含量和水域重金属污染存在着一定关系,可以作为重要的参考指标。开展砷形态的分析研究,可以对水产品质量进行有效保证、对养殖环境的污染进行有效控制。
目前砷形态分析大部分采用原子荧光光谱法、原子吸收光谱法、液相色谱与原子荧光光谱仪或电感耦合等离子体质谱仪联用等技术。与其它分析方法相比, 高效液相色谱-电感耦合等离子体质谱法(HPLC-ICP-MS)具有灵敏性高,分离效果好的特点[14],可以对水产品中含有较低含量的砷进行形态分析。前处理方法是分析方法的关键,相关文献多采用低浓度酸[15-19]、甲醇-水[20-22]、甲醇-氯仿[23]等体系来提取目标物,但针对水产品中砷形态的提取报道较少,原因可能是水产品中的砷形态会随着提取方式的不同而发生改变。
本实验选择了几种方法进行了对比和优化,建立了一种在超声辅助提取下对水产品中砷形态的分析方法。本文利用建立的砷形态分析方法,重点对长江和巢湖水域4种代表性水产品(草鱼、河虾、河蟹、鮰鱼)中的砷形态进行测定,分析了砷在两大水域的淡水养殖水产品中残留状况,对指导水产品生产和食用安全以及风险评估提供了参考依据。
全文HTML
-
超高效液相色谱-电感耦合等离子体质谱仪 Dlexar ELAN DRC-e 美国 PerkinElmer公司;Milli-Q Element 纯水机 美国密理博公司;水浴控温摇床 德国优莱博公司。
磷酸、磷酸二氢铵溶液、磷酸氢二铵溶液、柠檬酸溶液、氨水(分析纯)国药集团化学试剂有限公司;盐酸(色谱纯)Merck公司;氯仿(色谱纯)Merck公司;无水甲醇(色谱纯)Merck公司;有机滤膜(0.22 μm)上海安谱科技有限公司;C18小柱(500 mg/3 mL)上海安谱科技有限公司。
标准储备液:国家标准物质研究中心购买,包含砷酸根(As(Ⅴ))、亚砷酸根(As(Ⅲ))、二甲基砷酸(DMA)、一甲基砷酸(MMA)和砷甜菜碱(AsB)。
砷标准工作液:用前将标准储备液用1%HNO3稀释定容,避光保存于4 ℃环境中。
-
HPLC色谱条件:色谱柱:AS19阴离子交换柱,10 µm, 4. 1 mm×250 mm;
流动相:100% 15 mmol·L−1磷酸二氢铵,pH=9.0;流速:1.0 mL·min−1;进样量:10 µL。
ICP-MS的工作参数:入射功率1550 W;石英双通道雾化室;采样深度9 mm,载气流速1.04 L·min−1;同位素:As75;积分时间:As(质量数75):1 s。
-
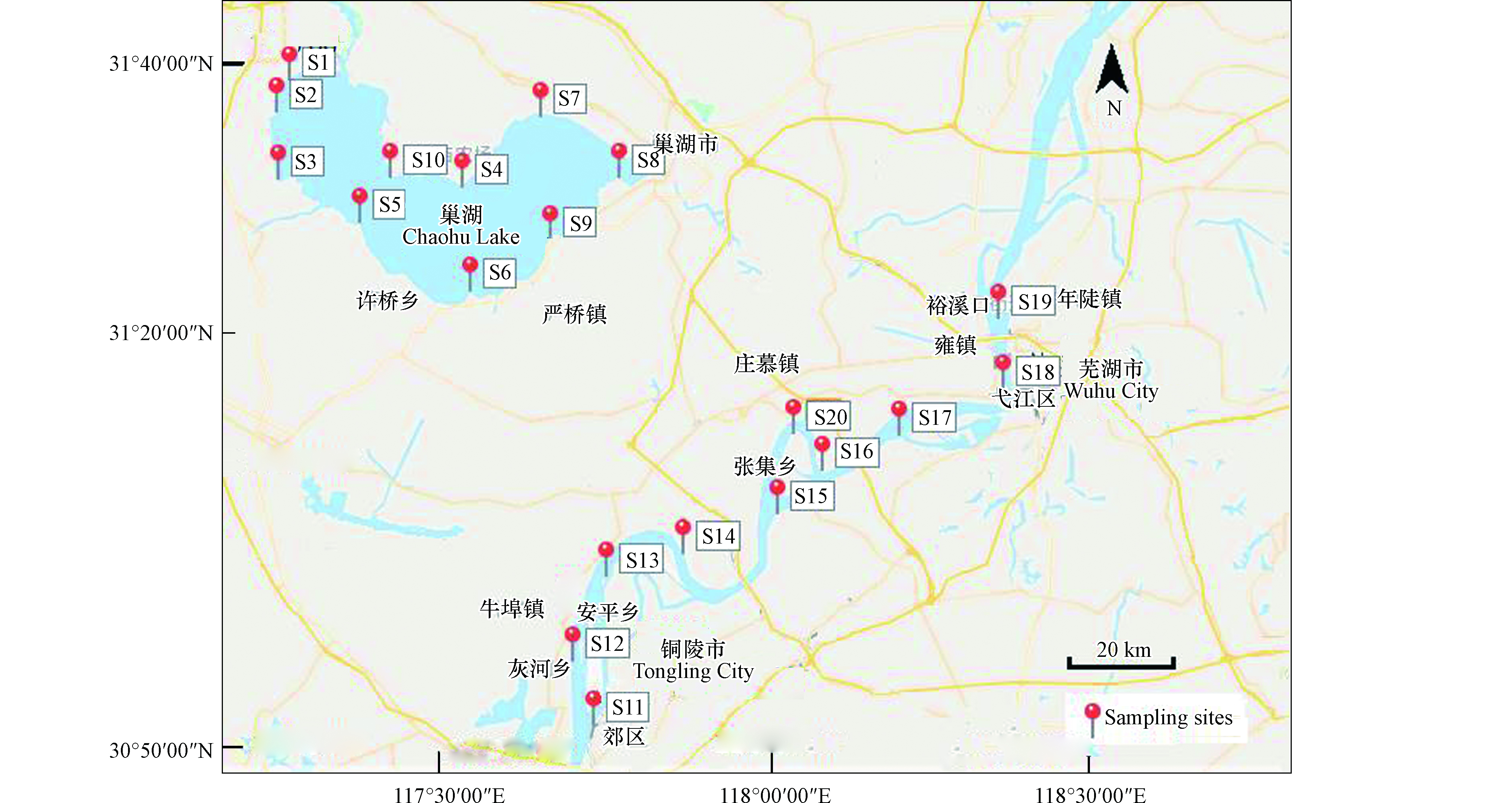
综合考虑相关因素后,分别在长江流域和巢湖水域附近的10个淡水养殖池塘采集样品(图1)。采样时间分别为2018年11月、2019年3月和2019年7月,每次采样数量相同,不同养殖品种在同一水域随机抽取,专业养殖人员按要求随机捕捞后,筛选一致重量、大小的成熟淡水产品(表1)。按水产品抽样方法[23]规定的破坏性检验抽样要求,每批次草鱼、鮰鱼随机抽取至少3条,河虾抽取至少10只,河蟹至少5只,同时检验样品量必须大于400 g。鱼类和蟹类清洗后,将可食部分绞碎,充分混合均匀;虾类清洗后,去除虾肉以外的虾头、虾皮、肠腺等不可食用部分,绞碎混合。样品制备后立即称重分装于聚乙烯自封袋中−20 ℃保存。
-
称取可食部分的样品约1.00 g于50 mL离心管中,加入35 mL乙酸溶液混匀,于冰浴中超声萃取25 min后,于4 ℃离心15 min,取上清液过C18小柱去除油脂,过0.22 μm滤膜后进HPLC-ICP-MS分析[24].
参照GB/T5009.11—2003《食品中总砷及无机砷的测定》[25]进行无机砷的测定。
-
采用单因子污染指数法和均值型污染指数法评价两大水域中虾、蟹体内重金属元素污染状况,主要污染因子由污染负荷比评价。单因子污染指数法可以评价某一重金属元素的单一污染状况,其计算见式(1)[26]。
式中,Pi:单因子污染指数;Ci:该重金属在样品体内的平均含量,mg·kg−1;Si:该重金属的评价标准值,mg·kg−1,评价标准值参照GB2762—2017《食品中污染物限量》[27]。
Pi<0.2时,说明检验品未被该因子污染;0.2≤Pi≤0.6时,说明检验品受到该因子污染,污染程度较轻;0.6<Pi<1.0时,说明检验品受到该因子污染,污染程度中等;Pi≥1.0时,说明检验品受到该因子污染,污染程度较重。
-
结果表明,根据公式(2)得出居民的每周实际重金属摄入质量(mg),并与世卫组织与联合国粮农组织制定的每周暂定可耐受摄入量(provisional tolerable weekly intake,PTWI)标准进行比较,评价两大水域中虾和蟹的食用安全性。
式中,0.403 kg为我国居民平均每人每周的水产品摄入量,参考值从2016年中国居民膳食指南中获得[28].
1.1. 仪器与试剂
1.2. 高效液相色谱及ICP-MS条件
1.3. 样品采集
1.4. 样品前处理
1.5. 评价标准与方法
1.5.1. 污染程度评价
1.5.2. 食用安全性评价
-
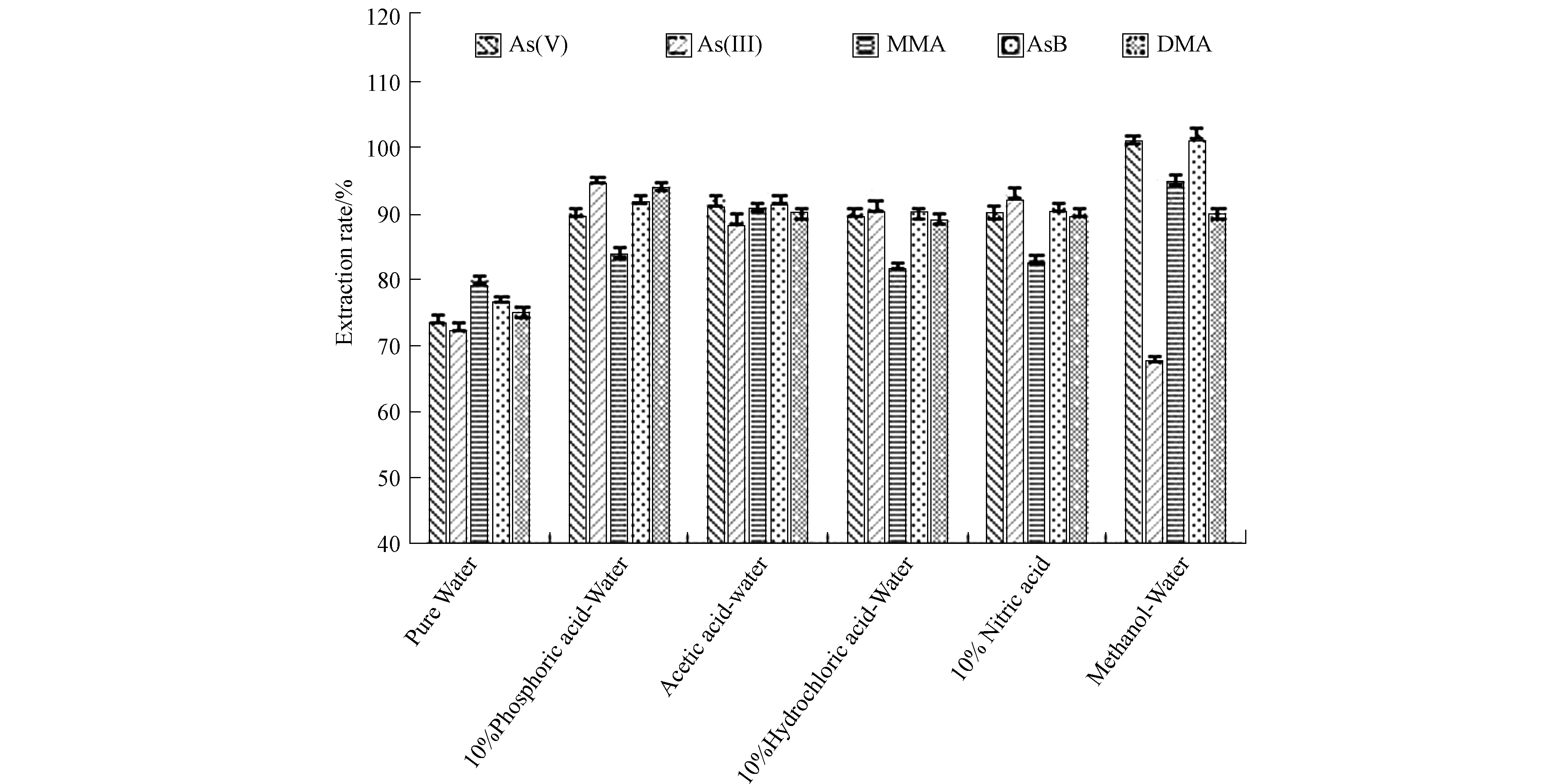
对5种砷形态进行提取,分别考察了水、10%盐酸、10%硝酸、10%磷酸、乙酸-水(1∶19,V/V)、甲醇-水(1∶1,V/V)等6个体系效果。由图2可知,以其他体系为提取剂的回收率相比水略高,水的回收率73%—80%;50%甲醇溶液的回收率偏高[29],回收率68%—102%。
原因如下:(1)50%甲醇体系虽然避免了形态之间的转化[30-31],但该体系操作过程多,且浓缩时间长,砷形态会因此损失,使回收率偏低。(2)提取剂为酸,酸的标准溶液pH值和实际样品提取液pH值不同,所以砷形态在标准溶液和提取液中保留时间会出现一定程度上的偏移[32]。(3)以乙酸-水体系作为样品前处理的提取剂时,回收率90%—92%,由于提取液pH值和标准溶液pH值接近,避免了砷相互转化为各形态和不同砷化合物保留时间的差异。同时提取过程不需要蒸发浓缩,操作简单[33]。
通过综合考虑,本实验提取剂确定为乙酸-水,同时,通过相关文献可知,未进行冰浴中萃取的,砷酸回收率130%,同时As(Ⅴ)的回收率较低。可能会发生部分转化,因此选择在冰浴中进行超声萃取。
-
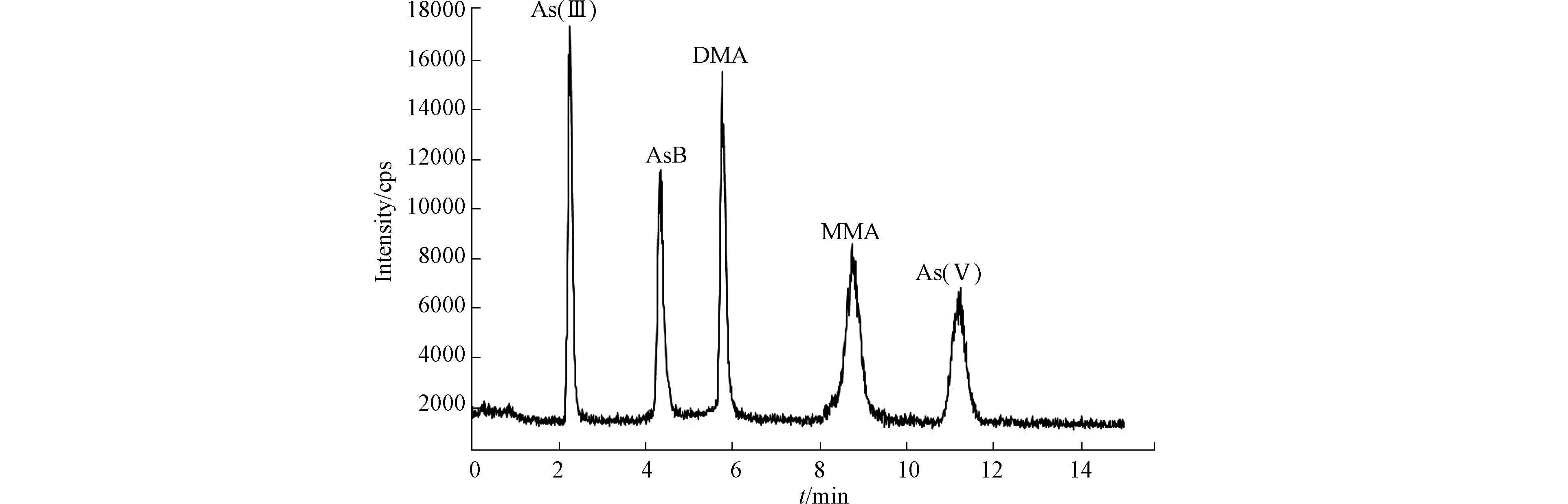
通过对柠檬酸、(NH4)2HPO4、NH4H2PO4流动相对砷形态分离的比较,确定NH4H2PO4溶液作为流动相。流动相浓度分别为5、15、20、30 mmol·L−1,考察流动相浓度对砷化合物分离的影响。研究发现,当NH4H2PO4浓度为15 mmol·L−1时,12 min内砷的5种化合物能够分离,且分离效果较好,结果如图3所示。本试验选择流动相的浓度为15 mmol·L−1。
-
分别配制质量浓度为2.5、5.0、10、20、50、100、200 µg·L−1混合标准溶液,绘制标准曲线,得到的相关系数及回归方程及表2。由表2可知,5种砷化合物的线性范围在2.5—200 µg·L−1范围内,相关系数r均在0.999以上。亚砷酸 As(Ⅲ)、砷酸 As(Ⅴ)、一甲基砷MMA、二甲基神(DMA)、砷甜菜碱AsB的检出限依次为0.020、0.040、0.035、0.030、0.045 mg·kg−1。
-
分别把3种不同浓度的砷形态加入到空白鱼样品和蟹样品中,对5种砷化合物的加标回收率进行检测。由表3可知,5种砷化合物在不同浓度的加标回收率分别为As(Ⅲ) 81.0%—103.0%、As(Ⅴ) 78.0%—99.5%、MMA 80.0%—104.0%、AsB 78.0%—94.2%、DMA 78.4%—98.4%,相对标准偏差均小于10%(表3)。5种砷化合物在鱼、蟹两种样品中的加标回收率较高,说明该方法可靠。
-
采用建立的方法对不同月份的长江和巢湖水域中草鱼、河虾、河蟹、鮰鱼砷元素形态进行测定,以考察水域和季节等因素对不同水产品中砷富集存在形态的影响。从研究区域所采样本的砷形态来看,砷化合物检出率同砷化合物浓度范围水平一样,整体较低,结果如表4所示。
从所有样品的检测结果看,长江和巢湖水域内的受检水产品体内有机砷形态主要为AsB、MMA和DMA,但是均以毒性较低的砷甜菜碱(AsB)形式为主。长江水域内的受检水产品中河虾和河蟹检出了无机砷(As(Ⅴ)),其中河虾检出的无机砷最高达0.151 mg·kg−1,河蟹检出的无机砷最高为0.0570 mg·kg−1;巢湖水域内的受检水产品中只有河虾检出了无机砷,最高达0.0630 mg·kg−1;长江和巢湖水域中的受检水产品中鱼类均未检出无机砷。
在对长江和巢湖水域受检水产品(草鱼、河虾、河蟹、鮰鱼)的砷的形态分析时得出:草鱼、河虾、河蟹、鮰鱼均未检出亚砷酸根As(Ⅲ);河虾和河蟹检出了砷酸根As(Ⅴ),且河虾检出率高于河蟹检出率;而鱼类为未检出砷酸根As(Ⅴ);一甲基砷(MMA)和二甲基砷(DMA)多存在于河虾和河蟹以内,鱼类较少检出;砷甜菜碱(AsB)在草鱼、河虾、河蟹、鮰鱼等4种水产品中均有检出,但是河虾和河蟹的含量较高于鱼类。这些可能与河虾和河蟹的富集作用有关。
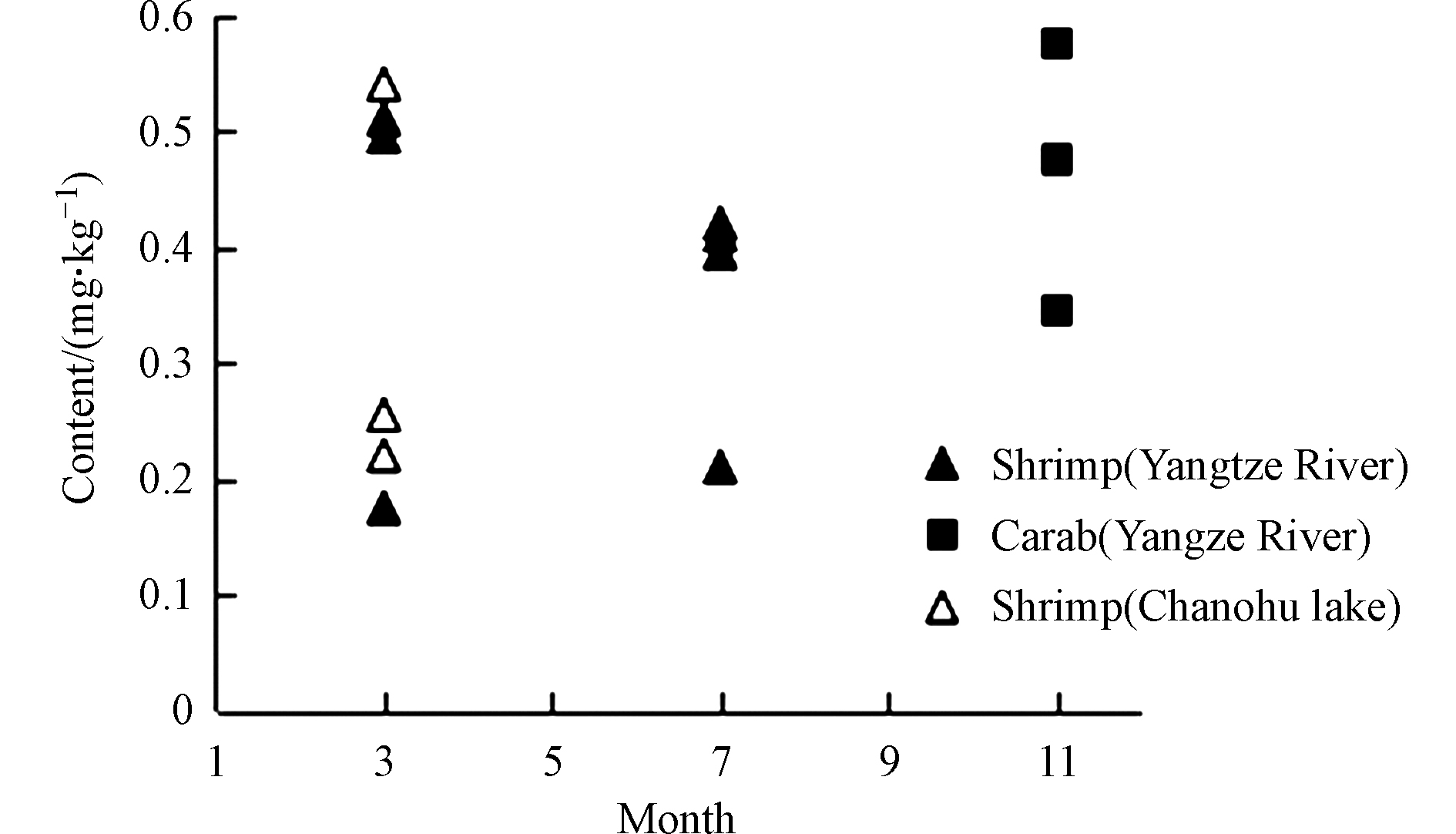
通过图4可知,长江水域的河虾和河蟹中无机砷检出率整体略高于巢湖水域。对不同时间采集的样本分析来看,3月份采集的水产品砷尤其是无机砷含量略高于其他采样月份。综合环境因素考虑,可能是因为枯水期环境污染较其他季节略微严重一些,从而导致水体砷含量较高,经水生生物吸收富集后,积累形成的[34]。
根据检测结果,结合有关地理位置、环境影响等信息分析,长江采样点沿线附近,采矿、航道运输等工业发展带来的水域砷污染,可能导致砷元素成分通过水体循环渗入到水环境中,经各类水生生物富集吸收代谢,最终导致沿线水产品无机砷含量略高于巢湖流域水产品,且在枯水期虾蟹等水产品的无机砷含量整体高于全年其他时期。
-
参照GB2762—2017《食品中污染物限量》,水产动物及其制品中无机砷的限量为0.5 mg·kg−1。由表5可知,长江和巢湖水域样品中存在无机砷,其平均含量均在安全限量以内。
-
由表6可知,长江、巢湖水域虾蟹无机砷的污染指数均小于0.2,其浓度不超过正常的背景值范围。
-
2016年中国居民膳食指南指出,我国居民平均每人每周水产品摄入为0.403 kg,以此为指标分析人均重金属实际摄入量与食用安全性之间的关系。由表7可知,长江、巢湖水域的虾蟹无机砷均小于PTWI的10%,安全性评价结果表明砷污染对于长江、巢湖水域虾蟹食用风险性贡献很小。
2.1. 前处理方法的选择
2.2. 流动相的选择及最佳浓度的确定
2.3. 砷形态方法学验证
2.3.1. 方法的线性范围和检出限
2.3.2. 方法的重复性及加标回收率
2.4. 样品分析
2.5. 长江和巢湖水域河虾和河蟹可食部分无机砷含量
2.6. 无机砷在长江和巢湖水域河虾和河蟹中的风险评价
2.7. 长江和巢湖水域水产品食用安全性评价
-
(1)本文针对巢湖和长江水域建立了一种水产品中砷酸根(As(Ⅴ))、亚砷酸根(As(Ⅲ))、二甲基砷酸(DMA)、一甲基砷酸(MMA)和砷甜菜碱(AsB)等5种砷元素形态共检测的分析方法。提取剂为乙酸-水(1∶19,V/V),可有效提取砷形态化合物;流动相为15 mmol·L−1 NH4H2PO4,在12 min内实现5种砷形态化合物的快速检测。该方法有较好的准确性,较宽的线性范围,较高的精密度,前处理方法简便,加标回收等方法学实验证明本法适用于水产品中砷形态化合物的快速测定。
(2)采用该方法对巢湖和长江水域的实际样品进行分析,结果表明,目标区域中水产品的砷化合物不管在检出率方面还是浓度范围方面,均处于较低的水平状态;其中砷形态主要为AsB、MMA和DMA,河虾和河蟹检出了高风险的无机砷,鱼类未检出无机砷成分。从季节来看,春季的水产品砷含量略高于其他季节。长江水域的河虾、河蟹中无机砷略高于巢湖水域。长江采样点沿线附近,采矿、航道运输等工业发展带来的水域砷污染,可能导致砷元素进入水体,并通过水体循环进入到水环境中,被各类水生生物吸收,从而产生富集,最终导致沿线水产品无机砷含量略高于巢湖流域水产品,且在枯水期虾蟹等水产品的无机砷含量整体高于全年其他时期。
(3)安全性评价结果表明砷污染对于长江、巢湖水域虾蟹食用风险性贡献很小。本文为水产品中砷形态的快速测定、水产品质量评价和养殖环境的污染控制都提供了重要的参考价值。





 下载:
下载: