-
生物质燃烧是我国华北区域秋冬季大气颗粒物污染的重要来源之一,燃烧过程中释放大量的CO、CO2、CH4、VOCs等气体和有机碳成分为主的气溶胶颗粒物,对局地和区域空气质量以及人体健康具有重要的影响[1-2]。据模式估算,由生物质燃烧排放的气溶胶约占全球一次有机碳的90%[3]。虽然2013年国务院颁布了“大气十条”治理空气污染,严格禁止秸杆露天焚烧,但是由于生物质锅炉、家用取暖等人为活动,导致生物质燃烧依然是我国大气颗粒物的重要来源[4-5],且近年来我国频发的重霾污染与生物质燃烧也密切相关[6]。
糖类化合物是大气颗粒物中广泛存在的有机物质[7],其中以左旋葡聚糖为代表的脱水糖(左旋葡聚糖、甘露聚糖、半乳聚糖)是含量最高的组分[8-9],左旋葡聚糖由于性质稳定且为纤维素在高温燃烧时产生,常被用作生物质燃烧的示踪物[10-11],生物质燃烧同时还释放少量的甘露聚糖和半乳聚糖[7]。大量的研究表明,在生物质燃烧较多的秋冬季,左旋葡聚糖的浓度显著高于其他两个季节[10]。其他糖类如葡萄糖主要通过植物的光合作用产生,多由植物的呼吸作用进入大气[12];阿拉伯糖醇和山梨醇和纤维醇主要来源于真菌和孢子的排放,常在源解析中用作真菌孢子排放的示踪物[13-14]。
石家庄市是京津冀地区重要工业城市,进入秋冬季节,灰霾污染频繁发生。姜建彪等[15]研究表明,石家庄市大气颗粒物中碳质组分浓度非常高,而糖类化合物在碳质组分中占有很大比例。因此,深入研究大气细粒子中糖类化合物的化学组成和来源,对控制石家庄市大气细粒子污染、减少灰霾污染的发生具有重要的意义。
-
采集点设在石家庄市中心广场(114°28′E、38°04′N),海拔15 m。采样仪器为天虹中流量颗粒物采样器(TH-100),流速为100L·min−1。采样滤膜选用石英滤膜(Whatman, d=90mm),采样前滤膜置于马弗炉中450 ℃焙烧4 h,样品称重前置于25 ℃,相对湿度为50%的恒温恒湿箱中平衡24 h,然后低温保存。将采样期分为秋、冬两个季节,每个季节选取一个月进行连续采样。其中秋季采样时间为2016年9月18日—10月17日;冬季采样时间为2016年12月15日—2017年1月13日。每日分昼夜采集,白天采集时间为8:00—19:30,夜晚采集时间为20:00—次日早上7:30,每次采集时间为11.5 h,釆样天气状况一般以晴,阴为主,避免雨雪过后的天气。采样期间温度和相对湿度变化见图1。由图1可见,采样期间平均气温秋季为(20.2±2.9)℃(白天)和(14.8±3.3)℃ (晚上),冬季分别为(4.2±1.5)℃(白天)和(0.49±2.6)℃(晚上);昼夜相对湿度秋季分别为66.0%±14.8%(白天)和87.0%±8.8% (晚上),,冬季分别为58.6%±14.1%(白天)和75.1%±13.9% (晚上),,夜间平均相对湿度均高于白天。
-
切取每张样品的1/4,剪成细条状置于10 mL提取瓶内,然后加入同位素标记的回收率指示物(13C-左旋葡聚糖),依次使用二氯甲烷和正己烷的混合试剂(V∶V=1∶1)、二氯甲烷和甲醇的混合试剂(V∶V=1∶1)各超声两遍,试剂加至采样膜被完全浸泡,盖好瓶盖,40 Hz超声15 min,将4次的提取液合并。利用旋转蒸发仪减压浓缩至0.5 mL左右(旋转蒸发时控制水浴温度为35 ℃),然后用二氯甲烷将样品转移到2 mL反应瓶中,用氮气吹干仪吹至近干,加入50 μL BSTFA+1% TMCs衍生化试剂和10 μL无水吡啶;70 ℃下恒温加热反应3 h,取出放至室温;加入浓度为2 mg·mL−1的六甲基苯20 μL作为内标,用正己烷定容至400 μL后进GC-MS分析。
-
本实验样品分析所采用的仪器为日本岛津气相色谱-质谱联用仪(2010plus/TQ8040, gas chromatograph-mass spectrometer, GC-MS),色谱柱为HP-5MS (30 m×0.25 mm×0.25 μm),载气为高纯氦气,流速为1.0 mL·min−1,进样量为1 μL,不分流模式。色谱柱温箱的升温程序为:初始温度50 ℃,保持2 min;以5 ℃·min−1的速率升至290 ℃,保持20 min。
本次实验对左旋葡聚糖(levoglucosan)、半乳聚糖(galactan)、甘露聚糖(mannosan)、果糖(fructose)、葡萄糖(glucose)、蔗糖(sucrose)、海藻糖(trehalose)、阿拉伯糖醇(arabitol)、山梨醇(sorbitol)、纤维醇(inositol)共10种糖醇进行了测定。本实验根据特性离子进行定性,内标法进行定量。各化合物的特征离子和定量离子信息见表1。
-
回收率指示物13C标记左旋葡聚糖的回收率范围为70%—110%,满足环境样品分析的要求。实验室空白和野外空白中都未检测到目标化合物,平行样的分析结果显示本方法具有良好的重现性,检测偏差小于15%。
-
本研究共检测出10种糖醇化合物,分别为半乳聚糖、甘露聚糖、左旋葡聚糖、果糖、葡萄糖、海藻糖、蔗糖、山梨醇、阿拉伯醇和纤维醇,浓度结果见图2。从图2可以看出,石家庄市秋、冬季大气细粒子中糖醇总浓度分别为(629.57±446.05) ng·m−3和(950.45±821.63) ng·m−3,糖类物质总浓度变化范围是57.01—2411.5 ng·m−3,冬季平均总浓度要高于秋季。与国内外其它区域的相关研究对比发现,石家庄市秋冬季细粒子中糖类化合物的总浓度与中国香港大学校园[16]、美国德州Clarksville乡村[17]和中国上海郊区的浓度接近,低于北京[18]、广州城区[19],但要高于如美国、挪威等一些采样点[20-22]。
-
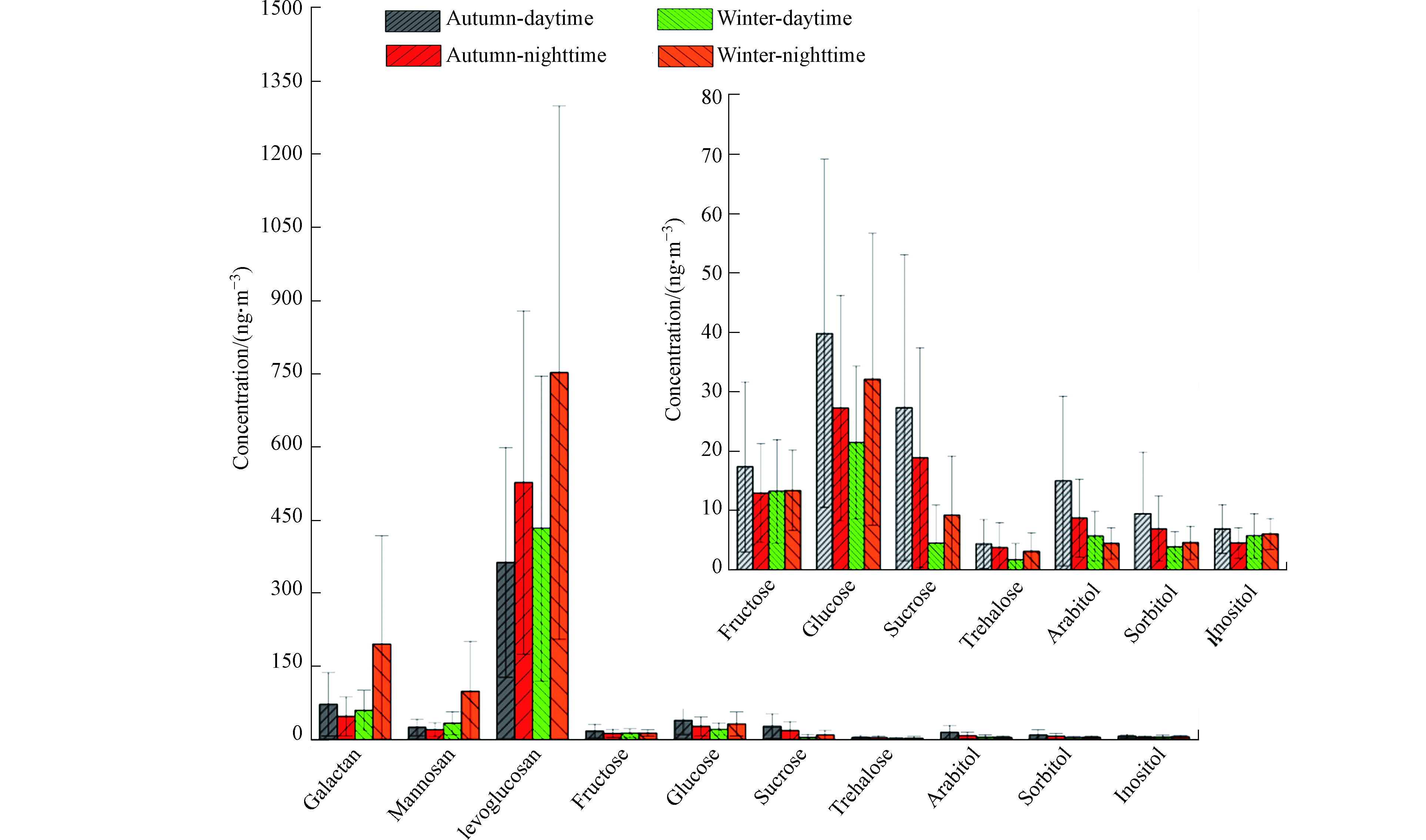
所采集的PM2.5样品中检测到的脱水糖主要包括左旋葡聚糖,半乳聚糖和甘露聚糖,是检测到的糖醇类化合物中的主要组成部分,分别占总浓度的87.4%(秋季)和91.9%(冬季)。其中左旋葡聚糖是最主要的糖类化合物质,约占检测糖醇总浓度的70%。左旋葡聚糖是纤维素燃烧的重要示踪物。纤维素分子是由7000—12000个右旋葡萄糖单体组成的长链线性聚合物[13],在高于300 ℃的高温下燃烧时经过高温裂变、歧化反应和不均反应产生独特的热解产物-左旋葡聚糖[12],以及少量的半乳聚糖和甘露聚糖。脱水糖的浓度均表现出夜晚高于白天的变化趋势,可能是因为秋天农民多在夜晚燃烧农作物秸秆,而冬天夜晚取暖造成的燃烧会产生比白天更多的脱水糖;同时夜晚大气混合层高度的降低也会使得糖类物质的浓度升高。不同脱水糖(左旋葡聚糖、甘露聚糖和半乳聚糖)之间浓度的比值可用来区分生物质燃烧的类型。Sang等[23]总结了软木、硬木、作物残渣的左旋葡聚糖/甘露聚糖(L/M)比值的均值依次为4.0±1.0、21.5±8.3、32.6±19.1;范围依次为2.5—8.8、13—35、12—56。在石家庄市秋冬季L/M的值分别为24.68±12.87(3.34—56.78)和20.87±9.10(7.46—55.54),表明石家庄市秋季作物残渣对大气中脱水糖类物质的贡献更多一些,而冬季硬木的贡献更多。
-
单糖和二糖在自然界中广泛存在,这主要是由于绿色植物的光合作用会产生大量的糖,比如葡萄糖、果糖、蔗糖等[10]。在石家庄市站点中所检测出的单糖和二糖类化合物主要是果糖、葡萄糖、蔗糖和海藻糖。蔗糖和海藻糖是大气颗粒物中主要的二糖,其中蔗糖是植物光合作用的主要产物,是植物储藏、积累和运输糖分的主要形式[15],Dahlman等[24]和Simoneit等[25]通过研究认为,蔗糖进入大气的主要途径是通过土壤的再悬浮作用,因此可将蔗糖作为一个土壤再悬浮的示踪物。海藻糖的性质十分稳定,是天然二糖中最稳定的非还原性糖[26],也常作为土壤再悬浮的重要示踪物用于大气颗粒物的源解析[27]。本研究中蔗糖和海藻糖在秋季白天的平均浓度分别为(27.28±25.74) ng·m−3和(4.31±4.14 )ng·m−3,夜间平均浓度分别为(18.83±18.54) ng·m−3和(3.72±4.18) ng·m−3,白天浓度高于夜间,而在冬季,这两种二糖的昼夜浓度表现为夜间浓度(蔗糖:(9.14±9.98 )ng·m−3,海藻糖:(3.05±3.16) ng·m−3)略高于白天的趋势(蔗糖:(4.44±6.43) ng·m−3,海藻糖:(1.65±2.72) ng·m−3),表明这两种糖类在秋季受植物活动排放的影响较大,而在冬季受气象条件的影响较大。
果糖和葡萄糖是植物中最常见的单糖,是多种花粉中含量最高的化合物,可将其作为花粉的示踪物质。秋天是农作物和水果成熟的季节,农作物收割、水果采摘和农田耕作都可向大气中排放果糖和葡萄糖。其次,生物质燃烧也对葡萄糖的浓度有一定贡献[26]。本研究中果糖和葡萄糖秋季的昼夜平均浓度表现为果糖白天((17.31±14.32) ng·m−3)高于夜间((12.90±8.33) ng·m−3)、葡萄糖白天((39.77±29.35) ng·m−3)高于夜间((27.2±18.99 )ng·m−3)的趋势;冬季的昼夜平均浓度表现为果糖白天((13.19±8.74) ng·m−3)和夜间((13.33±6.75) ng·m−3)基本持平、葡萄糖夜间((32.07±24.56 )ng·m−3)高于白天((21.39±12.87) ng·m−3)的趋势。这可能是由于秋季时白天植物光合作用和呼吸作用剧烈,而夜晚停止光合作用的原因导致。冬季温度低,植物的生命活动减弱,而夜晚取暖燃煤会排出少量的葡萄糖,所以导致冬季果糖基本持平,而葡萄糖夜晚明显高于白天。
-
在石家庄市大气细粒子中检测出的糖醇类化合物主要有阿拉伯糖醇、山梨醇和纤维醇,由图2可以看出,在石家庄市站点PM2.5样品中秋冬季节糖醇类物质的平均浓度分别为:(45.11±39.10) ng·m−3(白天)和(28.79±20.56) ng·m−3(夜间)、(24.57±16.82) ng·m−3(白天)和(30.91±20.51 )ng·m−3(夜间)。其中山梨醇和阿拉伯糖醇主要来源于真菌,多存在于绿色藻类、地衣真菌和低等植物中,高温高湿且阳光充足的环境有利于它们的活动,因此山梨醇和阿拉伯糖醇常被看作是真菌气溶胶的分子示踪物。秋季山梨醇和阿拉伯糖醇白天浓度明显高于夜间,主要原因是白天温度较高,藻类和真菌生命活动旺盛,代谢效率高。而冬季昼夜浓度差别不大,主要原因是冬季温度和湿度降低,使藻类和真菌代谢变弱。
-
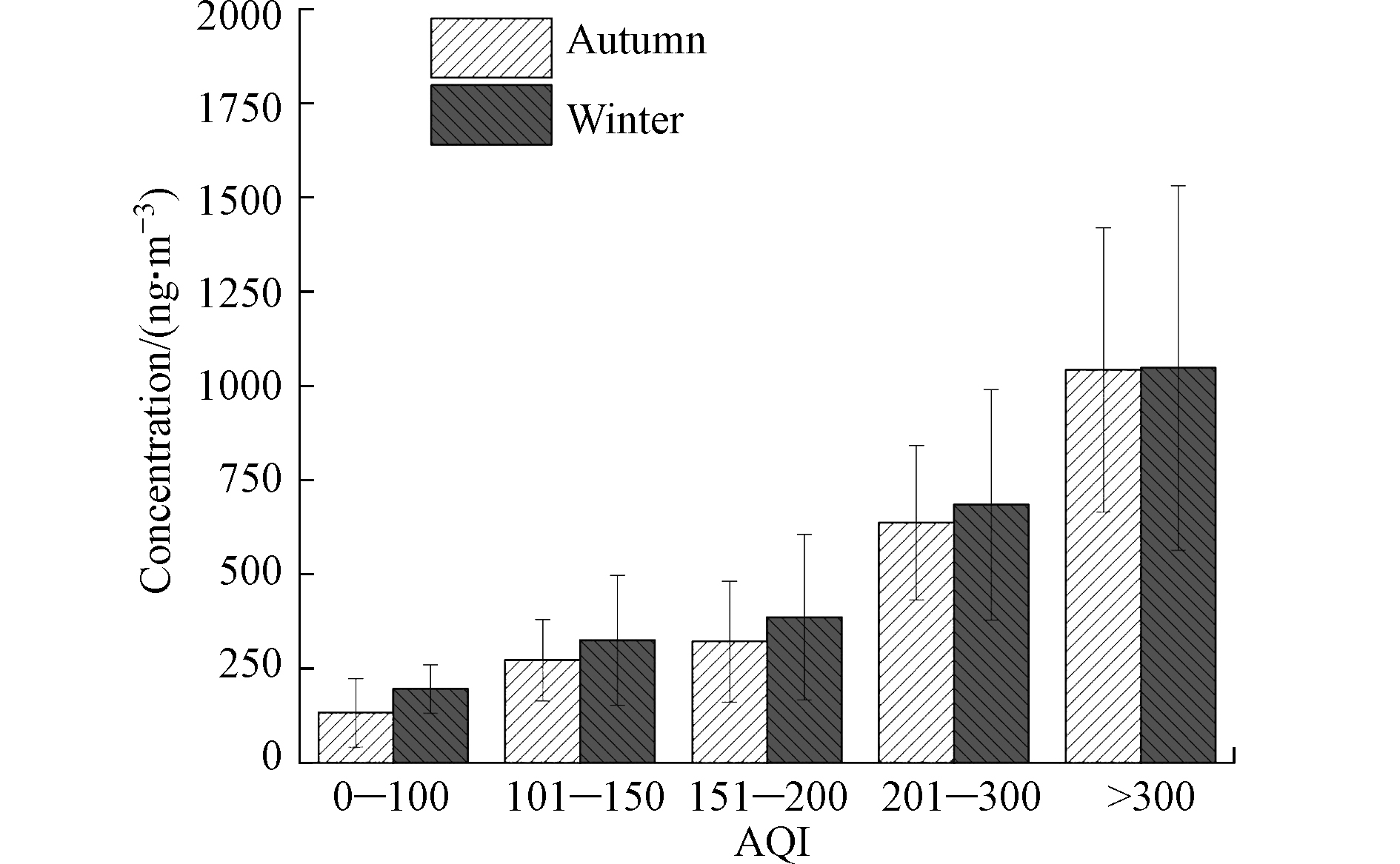
脱水糖是检测出来的最主要糖类,占糖类总浓度的80%以上,因此本研究重点分析了脱水糖在不同污染状况下的浓度特征,将空气质量指数AQI<100、101—150、151—200、201—300所对应的优良天、轻微污染、轻度污染、中度重污染和重度污染,将对应的脱水糖浓度进行分类统计,结果见图3。从图3可以看出,随着污染程度的加重,脱水糖的浓度也呈现上升的趋势,表明生物质燃烧对石家庄市大气污染的贡献不容忽视。
-
本研究应用PMF源解析模型对石家庄市采集的PM2.5中糖类化合物的来源进行分析,共120个样品。在PMF模型分析中,确定各种组分的不确定度,设定3—7个因子分别运行PMF,每种因子各计算50次。根据PMF模型分析结果的稳定性[28],得出4因子是石家庄市大气气溶胶中糖类化合物最优化的来源解析,结果如图4所示。
从图4中可以看出,因子1中的特征物是半乳聚糖、甘露聚糖和左旋葡聚糖,分别占其总量的81.6%、77.1%和70.7%,左旋葡聚糖等是生物质中纤维素在高温燃烧条件下生成的稳定性较高的特征产物,因此,因子1是指示生物质燃烧的贡献。因子2中阿拉伯糖醇和山梨醇为特征物质,分别占其总量的85.9%和84.3%,阿拉伯糖醇、山梨醇等糖醇类化合物多由真菌产生,因此,因子2是指示真菌孢子的贡献。因子3中果糖、葡萄糖为特征物质,分别占其总量的77.0%和62.5%,葡萄糖和果糖由植物自身产生,广泛分布在植物细胞中,是植物体内最常见的糖类化合物,且果糖通常被作为花粉的指示物,因此,因子3是指示农作物收割和花粉的贡献。因子4中蔗糖和海藻糖为特征物质,占其总量的72.6%和81.2%,海藻糖蔗糖可作为土壤再悬浮的指示物,因此,因子4是指示土壤再悬浮的贡献。同时因子4中还含有部分果糖和葡萄糖的贡献,暗示这两种糖类也可以通过土壤再悬浮的方式进入大气中。
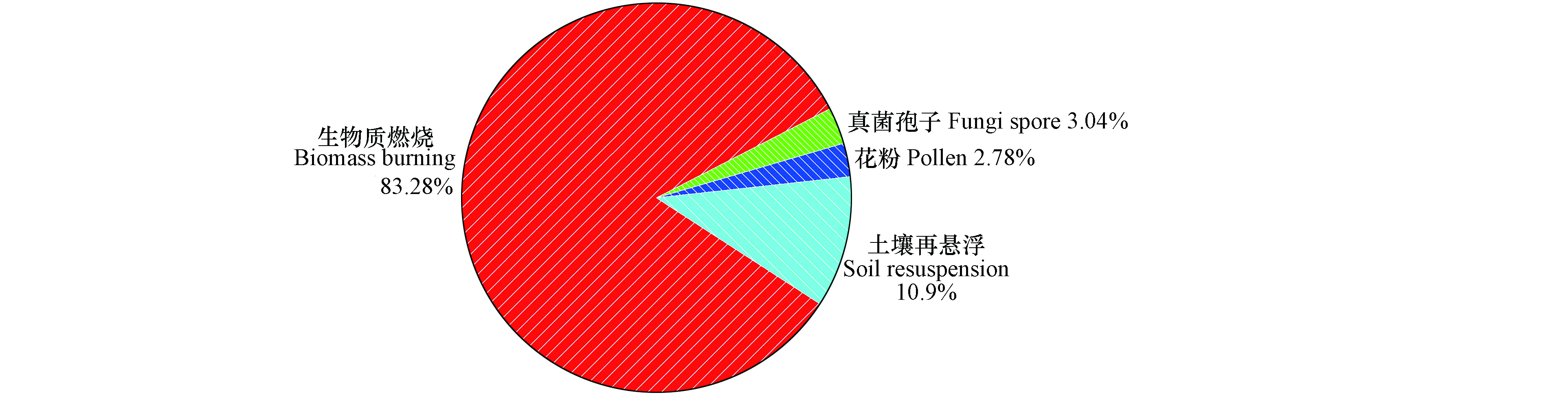
解析出来的4种来源对PM2.5中糖类的贡献率见图5。由图5可知,生物质燃烧排放对PM2.5中糖类的贡献最大,约占83%;其余3种排放源贡献较小,其中土壤再悬浮贡献约11%,真菌孢子源和花粉源各约占3%,表明石家庄市秋冬季受生物质燃烧的影响较大,土壤再悬浮也是一个不可忽视的因子。
-
(1)在2016—2017年秋冬季采样期间,石家庄市大气样品中均可监测出10种糖类物质,且脱水糖在所检测出的糖类化合物中是主要的糖类化合物。
(2)采集的石家庄市大气PM2.5样品中检测出的糖类化合物总浓度呈现出冬季>秋季的季节变化趋势,秋冬季糖类物质总浓度范围为57.01—2411.5 ng·m−3,平均浓度分别为(629.57±446.05) ng·m−3和(950.45±821.63) ng·m−3。
(3)石家庄市秋季以作物残渣为主要的生物质燃烧类型,冬季以硬木为主要的生物质燃烧类型。
(4)脱水糖类季节总浓度表现为冬季>秋季,且秋冬季均表现为夜间高于白天;单糖和二糖季节总浓度表现为秋季>冬季,其中,蔗糖秋季浓度明显高于冬季,其他糖类物质秋季浓度略高于冬季;糖醇类季节总浓度表现为秋季>冬季,阿拉伯糖醇浓度呈现为秋季明显高于冬季,其他糖醇的秋冬季浓度基本持平,且仅阿拉伯糖醇冬季平均浓度呈现为白天>夜间。
(5)应用PMF源解析模型对石家庄市秋冬季糖类化合物进行来源解析,得出石家庄市糖类化合物主要有生物质燃烧、真菌孢子、花粉、土壤再悬浮等来源,其中生物质燃烧是最主要的来源。
石家庄市秋冬季大气细粒子中糖类化合物的组成和来源
Studies on the composition and source of saccharides in autumn and winter PM2.5 in Shijiazhuang
-
摘要: 糖类化合物是大气颗粒物的重要组成部分,对局地甚至是全球气候变化有着重要的影响。本研究利用中流量颗粒物采样器分别于2016年9月18日—10月17日(秋季)和2016年12月15日—2017年1月13日(冬季)对石家庄市大气PM2.5样品进行了昼夜采集,并利用气相色谱质谱联用仪分析了样品中的10种糖类化合物,包括脱水糖、糖和糖醇。结果表明,石家庄市大气PM2.5中的糖类物质在秋冬季平均总浓度分别为(629.57±446.05 )ng·m−3和(950.45±821.63) ng·m−3,浓度变化范围是57.01—2411.5 ng·m−3。其中脱水糖类(包括左旋葡聚糖、半乳聚糖和甘露聚糖),冬季浓度要明显高于秋季,其主要来源于生物质燃烧,是秋冬季最主要的糖类物质,分别占糖类总浓度的87.4%(秋季)和91.9%(冬季);左旋葡聚糖/甘露聚糖(L/M)比值表明,石家庄市秋季以作物残渣为主要的生物质燃烧类型,而冬季以硬木为主要的生物质燃烧类型。单糖和二糖浓度变化趋势一致,均为秋季明显高于冬季,秋季白天高于夜间,冬季白天低于夜间。阿拉伯糖醇、山梨醇、纤维醇主要来源于真菌和孢子的排放,秋季浓度略高于冬季。PMF源解析结果表明,生物质燃烧(83%),真菌孢子排放(3%),花粉(3%)及土壤再悬浮(11%)是石家庄市大气细粒子中糖类物质的重要来源。Abstract: Saccharides are significant components of atmospheric particulate matter, and have an important impact on local and even global climate change. In this study, medium flow sampler was used to collect samples on diurnal/nocturnal basis in Shijiazhuang from September 18, 2016 to October 17, 2016 (autumn) and December 15, 2016 to January 13, 2017 (winter). 12 saccharides including dehydrated sugars, sugars, and sugar alcohols were detected using gas chromatography-mass spectrometry (GC-MS). The results showed that the average total concentrations of saccharides in the atmospheric PM2.5 in Shijiazhuang in autumn and winter were (629.57±446.05) ng·m−3 and (950.45±821.63) ng·m−3, ranging from 57.01 ng·m−3 to 2411.5 ng·m−3. Dehydrated saccharides (including levoglucosan, galactosan and mannosan) which mainly come from biomass combustion, were the most important saccharides, accounting for 87.4% (autumn) and 91.9% (winter) of the total detected saccharides. The ratio of Levoglucosan/mannosan (L/M) indicated that crop residues were the main burning type in autumn and hardwood was the main burning type in winter in shijiazhuang. Sucrose and trehalose were typical disaccharides which mainly derive from soil resuspension. The monosaccharide and disaccharide concentrations have the same change trend, both of which were significantly higher in autumn than in winter, autumn daytime was higher than nighttime, and winter daytime was lower than nighttime. Arabinol, sorbitol, and fibronol were common sugar alcohols, which mainly come from fungus and spore. The concentration of those sugar alcohols showed slightly higher level than that in winter. The results of PMF source analysis showed that biomass combustion (83%), fungal spore discharge (3%), pollen (3%) and soil re-suspension (11%) were important sources of detected saccharides in Shijiazhuang.
-
Key words:
- atmospheric fine particles /
- saccharides /
- Shijiazhuang /
- sources
-
六氯丁二烯(hexachlorobutadiene, HCBD)是一种卤代脂肪族化合物,于2017年被增列入斯德哥尔摩公约管控名单,是一类新持久性有机污染物(POPs). HCBD没有天然来源 [1 − 2],曾被广泛生产并应用于工业生产橡胶、传热液体、变压器、液压液体、杀虫剂、除草剂和杀菌剂 [1,3]. 欧洲于二十世纪七十年代末终止HCBD的有意生产和大部分使用. 1982年,全球HCBD的有意生产量估计为1 万t,而作为副产品无意产生的HCBD量要高得多,仅美国一国在含氯化学品生产过程中无意产生的HCBD就高达1.4 万t [4]. 氯碱化工等有机化工生产对工业无意生产HCBD总产量贡献为99%以上 [3 − 4]. 美国环保局(EPA)目前正在最终确定《有毒物质控制法》下的关于对持久性、生物累积性和有毒化学品的监管规则,提出在2021年3月8日之后,禁止所有在商业中制造、加工和分销HCBD和含HCBD的产品或物品,但以下情况除外:(1)氯化溶剂生产过程中作为副产物的HCBD的无意生产;(2)作为废燃料燃烧的HCBD的商业加工和分销 [5]. 鉴于氯化溶剂生产过程中极易产生HCBD副产物,氯化溶剂生产过程样品和氯化溶剂产品中的HCBD赋存现状尚不明确,对其赋存现状的认识对HCBD有效管控至关重要.
目前对于二噁英等斯德哥尔摩公约管控名单中典型POPs的分析检测方法已经比较成熟,有一些国际统一的标准分析方法,如用于二噁英分析的美国EPA的方法23、8280、1613、欧盟的EN1948等. 而对于HCBD等新POPs相关研究较少,并未形成统一的分析方法. 目前对HCBD的分析检测研究主要集中于水、土壤、污泥等环境介质,其研究方法也有所差异[6 − 8]. 现有研究的仪器检测方法主要有气相色谱-电子捕获检测(GC-ECD)、气相色谱-质谱检测(GC-MS)、气相色谱-串联质谱联用检测(GC-MS/MS)等. Chen等利用GC-MS/MS法首次报道了太原大气PM2.5中存在HCBD,平均浓度为3.69 pg·m−3,方法的回收率为87.4%—143% [9]. Fang等利用GC-ECD技术检测了污染场地土壤中的HCBD,浓度为0.02—0.37 ng·g−1[10]. 有研究应用GC-MS法分析了污泥和土壤样品中的HCBD [11],方法的加标回收率范围为51.3—119%,相对标准偏差小于15%,仪器检出限为0.015 ng·g−1,说明应用GC-MS分析方法检测环境介质中的HCBD是可行的. 有研究总结了环境中多种介质(如空气、水体、土壤、污泥、生物组织)中HCBD的分析方法 [12],提出GC-MS能很好的去除HCBD分析过程中干扰物质的影响,能够达到HCBD准确定性定量的标准,因此目前研究大多应用GC-MS法分析环境介质中的HCBD.
HCBD的主要排放源大多与化工生产有关,目前大部分研究都围绕化工生产厂周围的土壤、大气等环境样品中的HCBD展开研究,对化工生产过程中本身的化工产品或过程样品中HCBD的研究很少. 本研究将建立化工样品中HCBD的GC-MS分析检测方法,重点对化工生产过程,尤其是氯乙烯类化工样品中HCBD进行分析,以期为化工生产过程中HCBD的排放水平研究提供技术支撑,为化工行业HCBD的管理控制提供参考.
1. 实验部分(Experimental section)
选取我国4家典型的氯乙烯、氯苯化工生产企业,采集了化工生产过程中不同工艺阶段的15个化工样品,包括原料样、中间产品样、釜底液样(指经精馏塔分离后留下的较高沸点的残液)、产品样. 原料样和产品样为纯度较高的液态化合物,中间产品样和釜底液样为多种有机化合物混合液. 准确称取1 mL样品,经硅胶-弗罗里硅土复合柱净化. 硅胶-弗罗里硅土净化柱(内径为2 cm)填料由下至上依次为玻璃棉、6 g弗罗里硅土、4 g活化硅胶和3 cm无水硫酸钠,上样前用70 mL正己烷预淋洗净化柱,加入样品后用150 mL正己烷洗脱,洗脱液通过旋转蒸发仪浓缩至约3 mL,采用氮吹仪浓缩至1 mL,样品转移至进样小瓶中. 由于釜底液等样品HCBD浓度较高,将其稀释了1000倍再上机检测. 本实验中13C4-HCBD标准样品购自剑桥同位素实验室(美国),正己烷等均为农残级溶剂,购自国药集团化学试剂有限公司. 弗罗里硅土和活性炭购自Sigma-Aldrich(美国),硅胶购自Merck(德国). 无水硫酸钠购自天津科密欧化学试剂有限公司. 采用气相色谱-质谱联用仪(Agilent 8890-5977B,美国)进行化工产品中HCBD的定性和定量分析.
采用HP-5MS(30 m×250 μm i.d.×0.25 μm)(Agilent,美国)色谱柱对HCBD和干扰物进行分离. 进样口温度、载气流速、升温程序等优化过程见下文. 接口温度为280 ℃,进样方式为不分流进样,采用恒流模式,柱流量为1.0 mL·min−1,碰撞气为氦气(流速为2.25 mL·min−1)和氮气(流速为1.5 mL·min−1). 采用EI源电离,电离能量为70 eV,四极杆温度为150 ℃. 使用多重反应监测模式(MRM)检测. 样品前处理过程中,每组样品分析的同时添加1个实验室空白样品,空白样品检测结果表明,目标物测定值均小于实际样品浓度的5%,说明实验室前处理过程对HCBD分析的干扰较小,实验结果可靠. 样品的最低检出限(LOD)以3倍信噪比(S/N)来计算,定量限(LOQ)以10倍信噪比计算. 对于低于检出限的样品数据本研究采用LOD的1/2来表示.
2. 结果与讨论 (Results and discussion)
2.1 色谱条件优化
2.1.1 进样口温度和载气流速优化
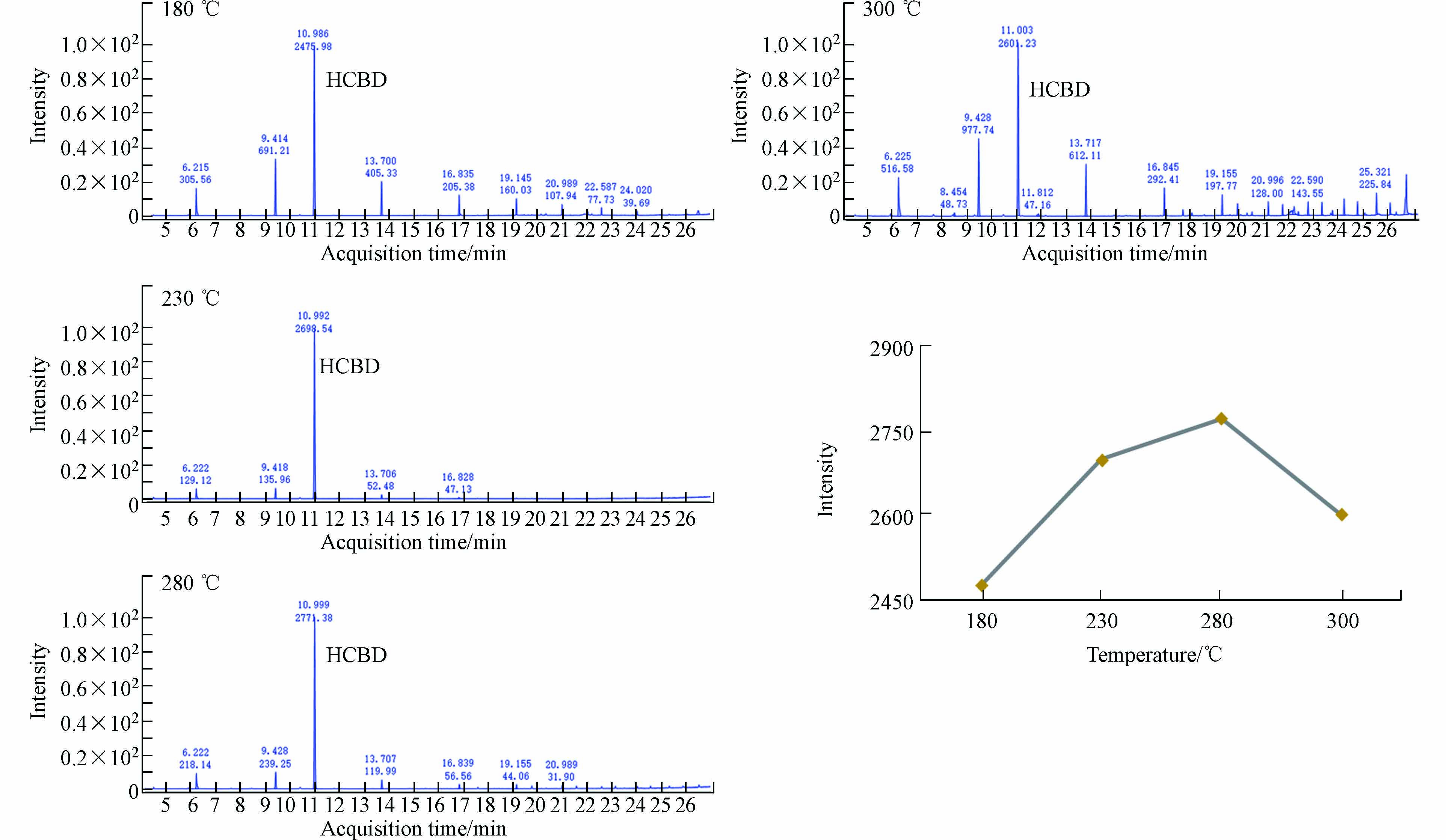
本方法设置了4个不同进样口温度,分别为180、230、280、300 ℃. 在4个进样口温度下对10 ng·mL−1的HCBD标准品进行GC-MS分析. 采集色谱图如图1所示,进样口温度从180 ℃升至280 ℃时,HCBD的响应逐渐增大;而从280 ℃再升高至300 ℃时,其响应又开始降低,这可能是因为温度过高导致HCBD降解,从而降低了响应. 进样口温度为180 ℃和300 ℃时流出的杂峰数量和峰响应明显高于进样口温度为280 ℃时的杂峰. 因此选择280 ℃为进样口温度.
探讨了0.8、0.9、1.0、1.1、1.2 mL·min−1 的5种载气流速对10 ng·mL−1浓度的HCBD标准品检测效果的影响. 当载气流速为1.0 mL·min−1时,获得的HCBD色谱峰峰面积和峰高均达到最大值,因此选择1.0 mL·min−1作为载气流速.
2.1.2 升温程序优化
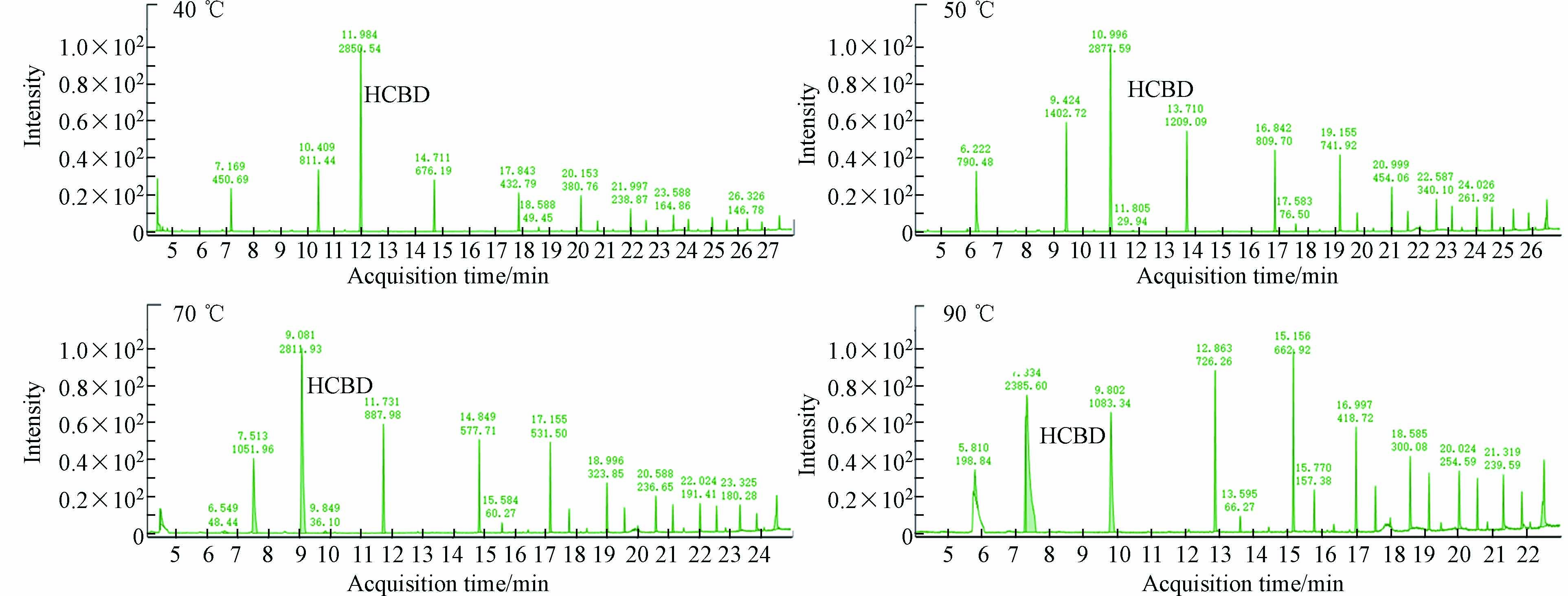
首先考察了不同的初始温度对目标物质分析的影响. 图2所示为40、50、70、90 ℃初始温度时化工产品中化合物的色谱峰,结果表明,初始温度为50 ℃时色谱峰的分离度和响应均优于40、70、90 ℃,且70 ℃和90 ℃时峰型明显变宽,分离度变差. 因此将升温程序的初始温度设为50 ℃.
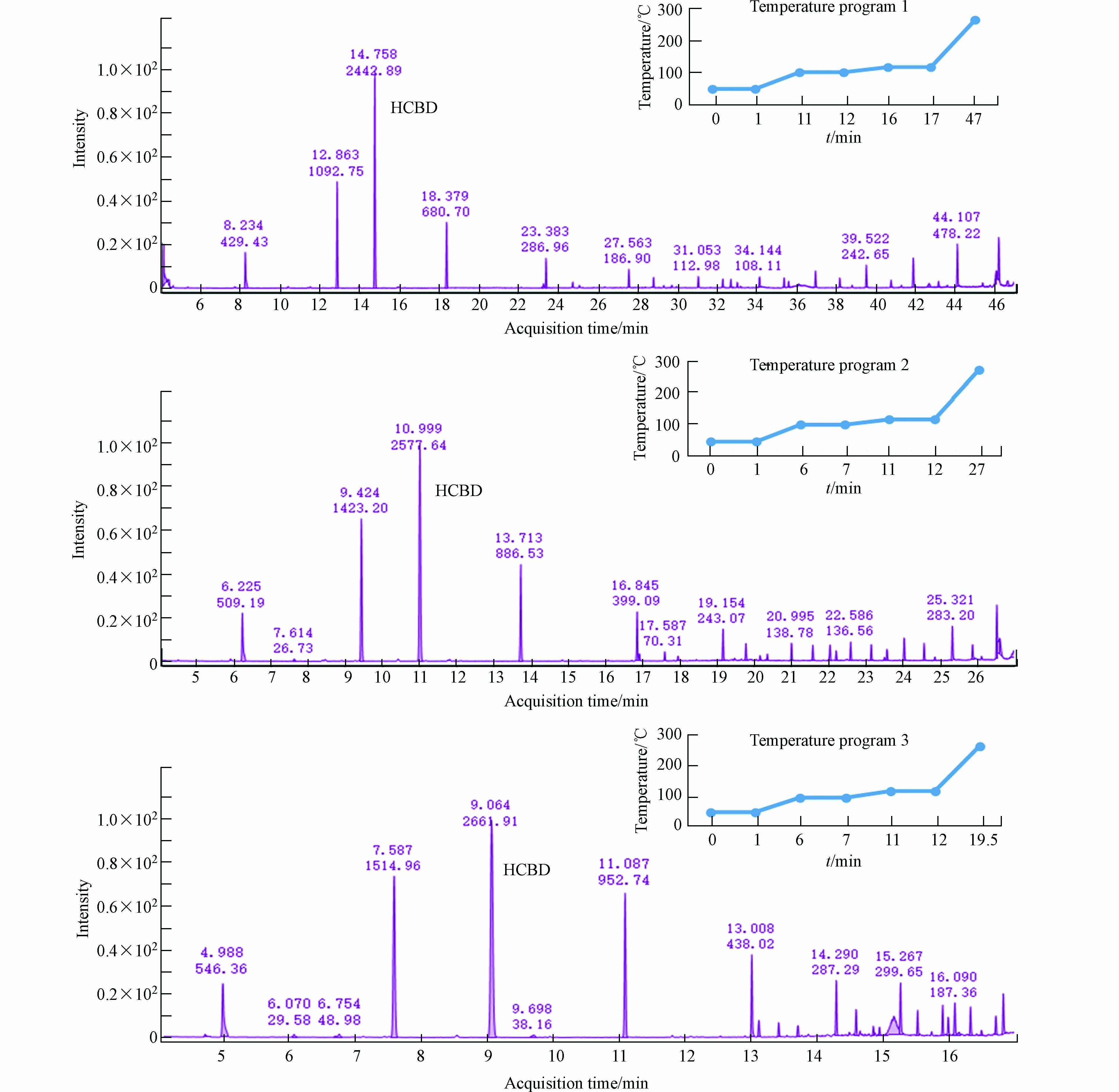
其次考察了3种不同升温程序对目标物质分析的影响,升温程序1:初始温度50 ℃,保持1 min;以5 ℃·min−1升至100 ℃,保持1 min;以5 ℃·min−1升至120 ℃,保持1 min;以5 ℃·min−1升至270 ℃. 升温程序2:初始温度50 ℃,保持1 min;以10 ℃·min−1升至100 ℃,保持1 min;以5 ℃·min−1升至120 ℃,保持1 min;以10 ℃·min−1升至270 ℃. 升温程序3:初始温度50 ℃,保持1 min;以20 ℃·min−1升至100 ℃,保持1 min;以5 ℃·min−1升至120 ℃,保持1 min;以20 ℃·min−1升至270 ℃. 如图3所示,升温程序1和升温程序2下,色谱峰的分离度和峰型无明显的差异,而升温程序3下色谱峰变宽,分离度变差. 从分析时间来看,程序升温1、2和3的分析时间分别为47 min、27 min和17 min,考虑到分离效率和分析时间成本,选择升温程序2(图3).
2.2 质谱条件优化
2.2.1 定性、定量离子和扫描模式的选择
对HCBD标准溶液进行全扫描(SCAN)分析,其色谱、质谱谱图如图4所示,提取每个色谱峰的质谱图后与NIST 14谱库进行检索比对,确定HCBD保留时间,同时根据质谱图选择质荷比大且响应较高的离子作为定性定量离子. HCBD的保留时间和特征离子如图4a所示. SCAN模式下干扰物质的杂峰较多,甚至有杂质峰响应高于目标物质峰,影响HCBD的定性定量分析. 进一步采用选择离子(SIM)分析,只扫描选定质量数的离子,很好的排除了其他离子干扰,极大的提高了检测的灵敏度(图4b). SIM模式下的谱图更加简单清晰,几乎无杂质峰影响,噪音干扰明显减少. 采用SIM模式扫描分析HCBD,HCBD定性离子和定量离子质量数分别为260(定性)、190(定性)和225(定量).
2.2.2 标准曲线与检出限
配制浓度梯度为0.1、1、10、50、100、300、500 ng·mL−1的HCBD标准溶液,绘制标准曲线(图5). HCBD的标准曲线相关系数R2 为0.9998,方法检出限(LOD)以3倍信噪比时的浓度计算,为0.049 ng·mL−1,定量限(LOQ)以10倍信噪比时的浓度计算,为0.16 ng·mL−1.
2.2.3 精密度与基质加标回收率
选取两个实验样品,在优化后的仪器参数下平行测定6次,1# 样品的平均浓度为1.72 ng·mL−1,相对标准偏差为1.4%;2# 样品的平均浓度为47.9 ng·mL−1,相对标准偏差为2.7%. 在空白样品中加入低(1 ng·mL−1)、中(50 ng·mL−1)、高(300 ng·mL−1)3个不同浓度的HCBD标准溶液,混匀后进行基质加标样品前处理和上机检测. 每个浓度水平的样品重复测定6次. 加标回收率为77.8%—102%,相对标准偏差为3.6%—6.0%. 加标回收率良好,可用于化工样品中HCBD的分析检测.
2.3 实际化工样品中HCBD的定性、定量分析
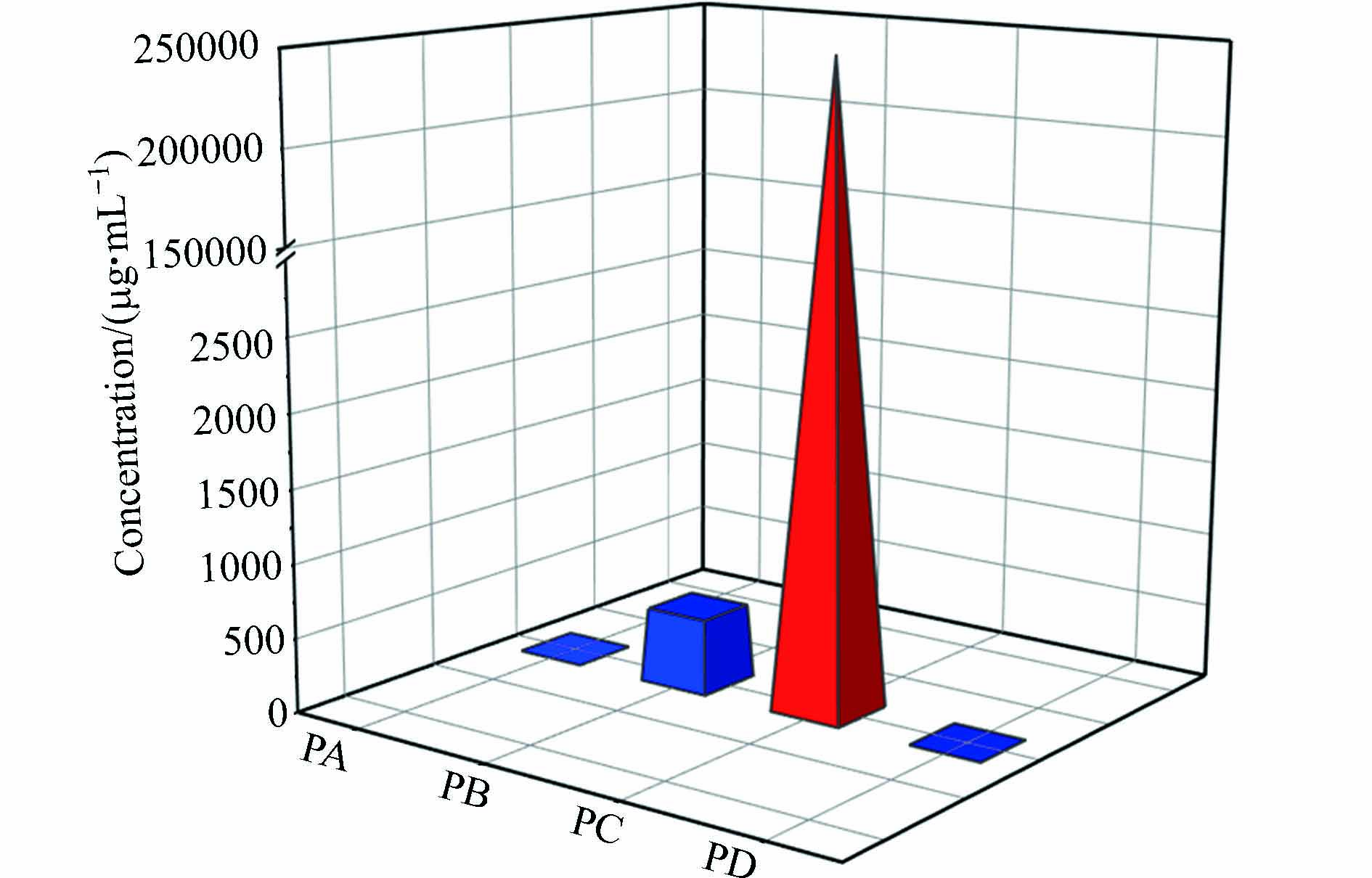
采集我国生产一氯苯(PA、PD)、三、四氯乙烯(PB、PC)的化工厂的原料、产品、釜底液等样品进行HCBD分析. 如图6所示,三、四氯乙烯生产过程中产生的HCBD浓度远高于氯苯生产过程,这与此前文献报道的三氯乙烯、四氯乙烯等化学品生产过程是HCBD的重要来源相一致 [1, 13-14]. 氯苯(PA、PD)化工厂样品中HCBD的浓度范围为0.0004—0.023 μg·mL−1,三氯乙烯(PB)化工厂HCBD的浓度范围是0.003—506 μg·mL−1,四氯乙烯(PC)化工厂HCBD的浓度范围是0.071—243000 μg·mL−1. 化工样品中HCBD的浓度水平由高到低依次为釜底液>中间产品>产品>原料. 釜底液样品中HCBD浓度最高,PB和PC化工厂釜底液样品中的浓度分别为506 μg·mL−1和243000 μg·mL−1. 这些研究结果将有助于识别化工生产中HCBD的来源,为实现HCBD有效管控、履行斯德哥尔摩公约提供数据支撑.
3. 结论(Conclusion)
HCBD是一类新持久性有机污染物(POPs),目前关于化工生产过程中HCBD的赋存水平现状认识不清. 本研究建立了氯乙烯、氯苯等典型化工生产过程中HCBD的GC-MS分析方法,方法加标回收率为77.8%—102%,相对标准偏差小于6.0%,标准曲线相关系数R2为0.9998,方法检出限为0.049 ng·mL−1,定量限为0.16 ng·mL−1,能够满足化工样品中HCBD的准确定性和定量要求. 本研究将建立的GC-MS分析方法应用于我国氯乙烯、氯苯等典型化工生产过程中HCBD的检测分析,发现三、四氯乙烯生产过程中HCBD浓度远高于氯苯,浓度范围为0.003—243000 μg·mL−1.
随着我国氯代烃工业的发展,HCBD的无意生产量可能有所增加,其环境影响也将逐渐引起关注,氯乙烯等氯代烃生产过程中HCBD副产物的浓度和产量有待系统考察. 本方法的建立能够为化工生产工程中HCBD的排放水平研究和排放源识别提供技术支撑,为我国履行斯德哥尔摩公约,实现HCBD管控提供重要信息.
-
表 1 糖类硅烷化混合物的特征离子及定量离子
Table 1. Characteristic and quantitative ions of saccharides (derivatized by TMCs)
名称Name 分子式 Molecular formula 特征离子Qualitative ions 定量离子Quantitative ion Galactan C15H34O5Si3 73,147,204,217,333 217 Mannosan C15H34O5Si3 73,147,204,217,333 217 13C-Levoglucosan C15H34O5Si3 73,147,206,220,338 220 Levoglucosan C15H34O5Si3 73,147,204,217,333 217 Arabitol C20H52O5Si5 73,103,147,217,307 217 α-Fructose C21H52O6Si5 73,147,191,204,217 217 β-Fructose C21H52O6Si5 73,147,191,204,217 217 α-Glucose C21H52O6Si5 73,147,191,204,217 217 β-Glucose C21H52O6Si5 73,147,191,204,217 217 Sorbitol C24H62O6Si6 73,147,205,217,319 217 Inositol C24H62O6Si6 73,147,217,305,318 217 Sucrose C33H78O11Si7 73,147,191,217,361 217 Trehalose C33H78O11Si7 73,147,191,217,361 217 -
[1] SIMONEIT B R T. Biomass burning - A review of organic tracers for smoke from incomplete combustion [J]. Appl Geochem, 2002, 17(3): 129-162. doi: 10.1016/S0883-2927(01)00061-0 [2] ZHAO H M, ZHANG X L, ZHANG S C, et al. Effects of agricultural biomass burning on regional haze in China: A review [J]. Atmosphere-Basel, 2017, 8(5): 88-97. [3] ITO A, PENNER J E. Historical emissions of carbonaceous aerosols from biomass and fossil fuel burning for the period 1870-2000 [J]. Global Biogeochem Cycles, 2005, 19(2): 1-14. [4] CHENG Y, ENGLING G, HE K B, et al. The characteristics of Beijing aerosol during two distinct episodes: Impacts of biomass burning and fireworks [J]. Environ Pollut, 2014, 185: 149-157. doi: 10.1016/j.envpol.2013.10.037 [5] 高雅琴, 王红丽, 景盛翱, 等. 上海夏季PM2.5中有机物的组分特征、空间分布和来源 [J]. 环境科学, 2018, 39(5): 1978-1986. GAO Y Q, WANG H L, JING S A, et al. Chemical characterization, spatial distribution, and source identification of organic matter in PM2.5 in summertime Shanghai, China [J]. Environmental Science, 2018, 39(5): 1978-1986(in Chinese).
[6] CHEN J M, LI C L, RISTOVSKI Z, et al. A review of biomass burning: Emissions and impacts on air quality, health and climate in China [J]. Sci Total Environ, 2017, 579: 1000-1034. doi: 10.1016/j.scitotenv.2016.11.025 [7] SCARAMBONI C, URBAN R C, LIMA-SOUZA M, et al. Total sugars in atmospheric aerosols: An alternative tracer for biomass burning [J]. Atmospheric Environment, 2015, 100: 185-192. doi: 10.1016/j.atmosenv.2014.11.003 [8] ZHANG T, CLAEYS M, CACHIER H, et al. Identification and estimation of the biomass burning contribution to Beijing aerosol using levoglucosan as a molecular marker [J]. Atmospheric Environment, 2008, 42(29): 7013-7021. doi: 10.1016/j.atmosenv.2008.04.050 [9] SIMONEIT B R T, SCHAUER J J, NOLTE C G, et al. Levoglucosan, a tracer for cellulose in biomass burning and atmospheric particles [J]. Atmospheric Environment, 1999, 33(2): 173-182. doi: 10.1016/S1352-2310(98)00145-9 [10] LI X R, WEN T X, XIN J Y, et al. Spatial and seasonal variations of sugars (alcohol) in China: Emerging results from the CARE-China network [J]. Atmospheric Environment, 2019, 209: 136-143. doi: 10.1016/j.atmosenv.2019.04.029 [11] LI X R, LIU Y S, LI D, et al. Molecular composition of organic aerosol over an agricultural site in North China Plain: Contribution of biogenic sources to PM2.5 [J]. Atmospheric Environment, 2017, 164: 448-457. doi: 10.1016/j.atmosenv.2017.06.018 [12] KANAKIDOU M, SEINFELD J H, PANDIS S N, et al. Organic aerosol and global climate modelling: A review [J]. Atmospheric Chemistry and Physics, 2005, 5(4): 1053-1123. doi: 10.5194/acp-5-1053-2005 [13] ELBERT W, TAYLOR P E, ANDREAE M O, et al. Contribution of fungi to primary biogenic aerosols in the atmosphere: wet and dry discharged spores, carbohydrates, and inorganic ions [J]. Atmos Chem Phys, 2007, 7(17): 4569-4588. doi: 10.5194/acp-7-4569-2007 [14] 王鑫彤, 鞠法帅, 韩德文, 等. 大气颗粒物中生物质燃烧示踪化合物的研究进展 [J]. 环境化学, 2015, 34(10): 1885-1894. doi: 10.7524/j.issn.0254-6108.2015.10.2015040704 WANG X T, JU F S, HAN D W, et al. Research progress on the organic tracers of biomass burning in atmospheric aerosols [J]. Enviromental Chemistry, 2015, 34(10): 1885-1894(in Chinese). doi: 10.7524/j.issn.0254-6108.2015.10.2015040704
[15] 姜建彪, 常青, 冯媛, 等. 石家庄市大气颗粒物中有机碳和元素碳的季节变化特征 [J]. 环境监控与预警, 2017, 9(2): 41-45. doi: 10.3969/j.issn.1674-6732.2017.02.011 JIANG J B, CHANG Q, FENG Y, et al. Seasonal variation of organic carbon and elemental carbon in atmospheric particles in Shijiazhuang [J]. Environmental Monitoring and Forewarning, 2017, 9(2): 41-45(in Chinese). doi: 10.3969/j.issn.1674-6732.2017.02.011
[16] WAN E C H, YU J Z. Analysis of sugars and sugar polyols in atmospheric aerosols by chloride attachment in liquid chromatography / negative ion electrospray mass spectrometry [J]. Environmental Science& Technology, 2007, 41(7): 2459-2466. [17] JIA Y, CLEMENTS A L, FRASER M P. Saccharide composition in atmospheric particulate matter in the southwest US and estimates of source contributions [J]. Journal of Aerosol Science, 2010, 41(1): 62-73. doi: 10.1016/j.jaerosci.2009.08.005 [18] 梁林林, ENGLING G, 段凤魁, 等. 北京市大气气溶胶中糖类化合物的组成及来源 [J]. 环境科学, 2015, 36(11): 3935-3942. LIANG L L, ENGLING G, DUAN F K, et al. Composition and source apportionments of saccharides in atmospheric particulate matter in Beijing [J]. Environmental Sciences, 2015, 36(11): 3935-3942(in Chinese).
[19] 马社霞, 王真真, 毕新慧, 等. 广州大气气溶胶中糖类化合物的组成及主要来源 [J]. 科学通报, 2009, 5454(17): 2562-2567. MA S X, WANG Z Z, BI X H, et al. Composition and source of saccharides in aerosols in Guangzhou [J]. Chinese Sci Bull, 2009, 5454(17): 2562-2567(in Chinese).
[20] GRAHAM B, GUYON P, TAYLOR P E, et al. Organic compounds present in the natural Amazonian aerosol: Characterization by gas chromatography-mass spectrometry [J]. Journal of Geophysical Research: Atmospheres, 2003, 108(D24): 1-13. [21] NIEMALKAP J, DESHMUKH D K, DEB M K, et al. Mass loading and episodic variation of molecular markers in PM2.5 aerosols over a rural area in eastern central India [J]. Atmospheric Environment, 2015, 117: 41-50. doi: 10.1016/j.atmosenv.2015.07.003 [22] YTTRI K E, DYE C, KISS G. Ambient aerosol concentrations of sugars and sugar-alcohols at four different sites in Norway [J]. Atmos Chem Phys, 2007, 7(2): 5769-5803. [23] SANG X, ZHANG Z, CHAN C, et al. Source categories and contribution of biomass smoke to organic aerosol over the southeastern Tibetan Plateau [J]. Atmospheric Environment, 2013, 78: 113-123. doi: 10.1016/j.atmosenv.2012.12.012 [24] DAHLMAN L, PERSSON J, N SHOLM T, et al. Carbon and nitrogen distribution in the green algal lichens hypogymnia physodes and Platismatia glauca in relation to nutrient supply [J]. Planta, 2003, 217(1): 41-48. doi: 10.1007/s00425-003-0977-8 [25] SIMONEIT B R T, ELIASVO, KOBAYASHI M, et al. Sugars dominant water-soluble organic compounds in soils and characterization as tracers in atmospheric particulate matter [J]. Environmental Science& Technology, 2004, 38(22): 5939-5949. [26] MEDEIROS P M, CONTE M H, WEBER J C, et al. Sugars as source indicators of biogenic organic carbon in aerosols collected above the Howland Experimental Forest, Maine [J]. Atmospheric Environment, 2006, 40(9): 1694-1705. doi: 10.1016/j.atmosenv.2005.11.001 [27] 靳文斌, 李克文, 胥九兵, 等. 海藻糖的特性、功能及应用 [J]. 精细与专用化学品, 2015, 23(1): 30-33. doi: 10.3969/j.issn.1008-1100.2015.01.008 JIN W B, LI K W, XU J B, et al. The character and function of trehalose and its application [J]. Fine and Specialty Chemicals, 2015, 23(1): 30-33(in Chinese). doi: 10.3969/j.issn.1008-1100.2015.01.008
[28] BAUER H E, SCHUELLER G, WEINKE, et al. Significant contributions of fungalspores to the organic carbon and to the aerosol mass balance of the urban atmospheric aerosol [J]. Atmospheric Environment, 2008, 42(22): 5542-5549. doi: 10.1016/j.atmosenv.2008.03.019 -






 下载:
下载: