-
塑料因其优异的物理化学性能、低成本、使用便利成为全球最常用的基础材料之一[1]。2021年联合国环境规划署发布数据显示,目前全球累计生产的塑料有8.3×1010 t。在过去40年中,产量增两倍多,但总体回收率小于10%。海洋中现存近亿吨的塑料垃圾,且每年仍有约9×107~1.4×108 t塑料持续排放,给全球海洋生态系统造成的经济损失高达80亿美元,仅水产品损失就达31亿美元(UNEP,2021)。塑料污染是一个严重的问题,特别是尺寸小于5 mm的塑料[2]。微塑料(microplastics, MPs)是由大塑料碎裂化形成,或者原始生产的塑料微珠[3-5]。微塑料的大小、形状和颜色与天然沉积物和饲料的相似性可能会误导生物摄入。这会引发营养不良,甚至导致饥饿效应,表现为受影响生物的生长速度改变、健康状况降低和行为改变[5-9],进而可能影响渔业养殖产量和利润。形状不规则且边缘锋利的微塑料可磨损并破坏生物体中胃肠道黏膜的完整性[10]。此外,由于消化道酶促作用等,摄入的微塑料可能会释放单体和塑料添加剂,造成更多潜在危害[11-12]。另一方面,微塑料可作为某些环境污染物和致病菌的载体,摄入微塑料可促进它们转移到生物体内,并导致不良健康影响甚至死亡[11,13-15]。
红树林区海水养殖活动频繁,是粮食供应重要来源。微塑料赋存特征与海产品质量相关,是评估食品安全需要考虑的关键问题。虾等甲壳类动物会摄入其生长环境中的桡足类、鱼类幼虫,以及水生环境中的微塑料[16-18]。当虾被鱼类等更高营养级捕食者或人类食用时,可通过食物链转移和富集。虽然人类不食用虾的头部,但肌肉与消化组织微塑料赋存威胁水产品质量安全和人体健康。况且许多人在不去除肠道(虾线)的情况下将它们整个食用。人类食用被微塑料污染的虾形成直接的接触(传播)途径,对粮食安全和公共健康构成威胁。这些矛头指向如何研究微塑料在虾类海产品中赋存特征,以及在营养转移和积累中的潜在作用[18-19]。现有研究主要关注贝类和鱼类,对于虾类的报道比较有限。之前在几项研究中报道世界不同地区虾体内普遍检出微塑料[20-22]。这些研究中,选择虾是因为它们在食物链中发挥着重要作用,为从鱼类到人类的各种营养级生物提供食物。南美白对虾(Penaeus vannamei)是一种高度消费的海产品。2020年,世界对虾养殖年产量约为6×106 t,南美白对虾是其中养殖量最大的品种,约为5×106 t [23]。2020年,中国南美白对虾养殖产量同比增加4.41%,已占全球南美白对虾养殖产量的80%以上(《2020年全国渔业经济统计公报》)。10年来,南美白对虾的产量涨幅79.96%,2020年,福建省南美白对虾养殖产量为1.16×106 t(《2021年中国渔业年鉴》)。漳州是福建重要的南美白对虾养殖基地,养殖过程不可避免使用塑料养殖设施、渔具等。研究漳州红树林区海水养殖中南美白对虾微塑料的赋存特征,来源和影响因素对进一步评估水产品质量安全与养殖经济效益具有重要意义。
-
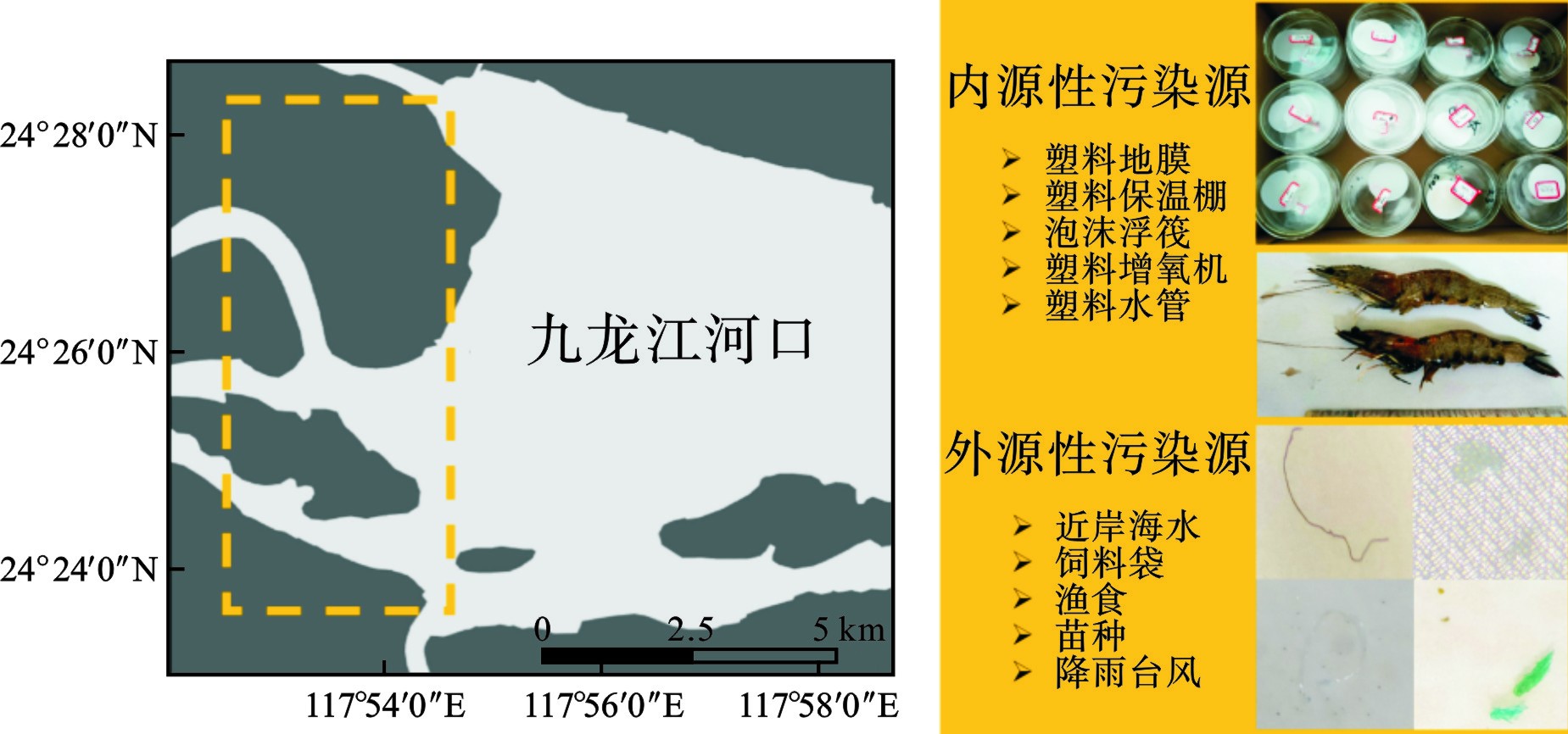
南美白对虾是对虾科、滨对虾属水生动物。体长最长可达24 cm,虾壳较薄,正常体色为青蓝色或浅青灰色,外观无斑纹,步足常呈白垩状[24]。本文选择南美白对虾为研究对象,因其是世界三大产量最高的虾类之一,是典型商业水产品。漳州是福建南美白对虾主要养殖基地,具有一定代表性,见图1。
-
光学显微镜(Moitc,SMZ168,中国)、烘箱(上海精宏,DHG-9140A,中国)、徕卡体式显微镜(Leica M165,德国)、傅里叶变换显微红外光谱仪(Thermo Fisher Scientific Nicolet iN10,美国)、电子分析天平(R&D,HR-250A,日本)、干燥箱(上海齐欣,DHG-9240A,中国)、超声清洗机(昆山舒美,KQ5200DE,中国)、游标卡尺,恒温振荡器(上海精宏,THZ-320,中国)、锥形瓶、搅拌器、烧杯、培养皿、解剖工具盒、pH试纸、锡箔纸、滤膜(Whatman,孔径0.70、1和50 μm,直径47 mm,英国)、10% 氢氧化钾溶液、超纯水、氯化钠、1.5 mol柠檬酸等。
-
2022年8月,从漳州市红树林区南美白对虾海水养殖基地3个不同养殖池(图1)采集南美白对虾样品共计900 g(每池各300 g),未洗涤状态直接装入铝膜袋储存在冷藏箱后第一时间带回厦门大学嘉庚学院生化大楼实验室。分别从3个不同养殖池随机选择3只虾,标记为养殖池1号的样品虾1~3,养殖池2号的样品虾4~6,养殖池3号的样品虾7~9。
-
为收集体液,每只虾先用超纯水清洗(先前通过0.70 μm孔径滤膜过滤),并根据SEVERINI[19]等描述的方法确定生物特征数据(长、宽、高、体重)。测量可量性状如下:
体长:由虾眼的前端到虾尾带有肌肉末端的直线长度
头长:由虾眼的前端到虾头壳末端的直线长度
体宽:虾身的最大宽度
体高:虾身的最大高度
体重:虾的质量(湿重)
然后,根据虾壳(虾壳与体液附着物)、肌肉,内脏组织(虾线与虾头)3大类来解剖。解剖过程避免破损,分离后分别装入锥形瓶中。在电子分析天平上分别测量重量并记录,−5 °C冷藏直至分析。
-
将25 mL的10% KOH溶液分别倒入锥形瓶中,立即用锡箔纸将瓶口覆盖, 防止空气中微塑料干扰。密封后的锥形瓶置于恒温振荡器中,设置振荡频率80 r/min,温度设置为65 ℃,振荡时间48 h,直到组织完全消化。在消化过程中消解液蒸发时加入额外的KOH溶液。样品冷却后,用1.5 mol柠檬酸中和到中性。每个样品通过玻璃纤维滤膜(0.70 μm孔径)真空过滤,然后放置在清洁过的培养皿中。消解过程注意观察瓶壁上是否黏附生物组织,将锥形瓶进行摇晃确保组织进入溶液中。使用饱和NaCl溶液(1.2 g/mL)作为浮选液分离微塑料,饱和NaCl溶液允许密度较低的颗粒分离,而未溶解的无机材料沉入底部。使用抽滤方式过滤上清液。玻璃纤维膜孔径1和50 μm,直径47 mm。最后,将每张滤膜置于干净的培养皿中,用锡箔纸覆盖,并在干燥柜中于50 °C干燥24 h。
-
(1)先使用普通光学显微镜分析每张滤膜是否存在微塑料,然后使用带数码显示的体式显微镜根据其颜色和形状识别拍照[25]。微塑料形状被分类为纤维、颗粒、泡沫、薄膜或碎片等[26],大小分为1~50和50 μm以上。根据微塑料的大小、颜色和形状进行识别、记录、拍照和分类。
(2)使用傅里叶变换红外光谱(FTIR)鉴定微塑料聚合物成分。采用中红外波段扫描多次,随后将所有光谱与聚合物参考光谱库进行比较,以验证聚合物类型。仅接受相似度为>70%的聚合物匹配[21],以确保结果的可靠性。通过FTIR分析验证微塑料聚合物类型后,重新计算丰度,排除具有相似形貌但未验证为微塑料观测物。
-
(1)分析和测量每只虾的微塑料尺寸、形状和颜色,并进行计数拍照。使用SPSS软件版本20.0(IBM, 美国)和Microsoft Excel 2022(微软,美国)对样本微塑料丰度进行统计分析。此外,还进行了One-way ANOVA方差分析,将生物学指标作为因变量,微塑料丰度作为自变量以进行微塑料丰度与生物指标Spearman相关性分析。
(2)在质量控制方面,实验前使用70%乙醇和纯净水彻底清洁所有实验桌台面和玻璃器皿。此外,为防止标本之间的微塑料交叉污染,每个标本上取出后须仔细冲洗镊子。为防止空气中的微塑料干扰,含有生物组织的锥形瓶或者放置滤膜的培养皿立即用锡箔纸覆盖。实验室期间穿着棉质实验服、口罩和丁腈手套。此外,用于制备这些溶液的反应溶液和蒸馏水在使用前通过0.7 μm孔径的滤膜过滤,以确保从试剂中消除微塑料。在样品处理分析过程中,使用对照空白评估实验室环境微塑料污染水平。
-
漳州南美白对虾样本生物学指标,见表1。
通过One-way ANOVA单因素分析,发现漳州南美白对虾样本生物学指标呈现显著差异(P<0.01),F值946.2。虽然同一时间投放的虾苗,且苗种来自同一个厂家。但是,养殖过程摄取的饲料量、饲料转化率不一。养殖环境微塑料赋存可影响其生长率。
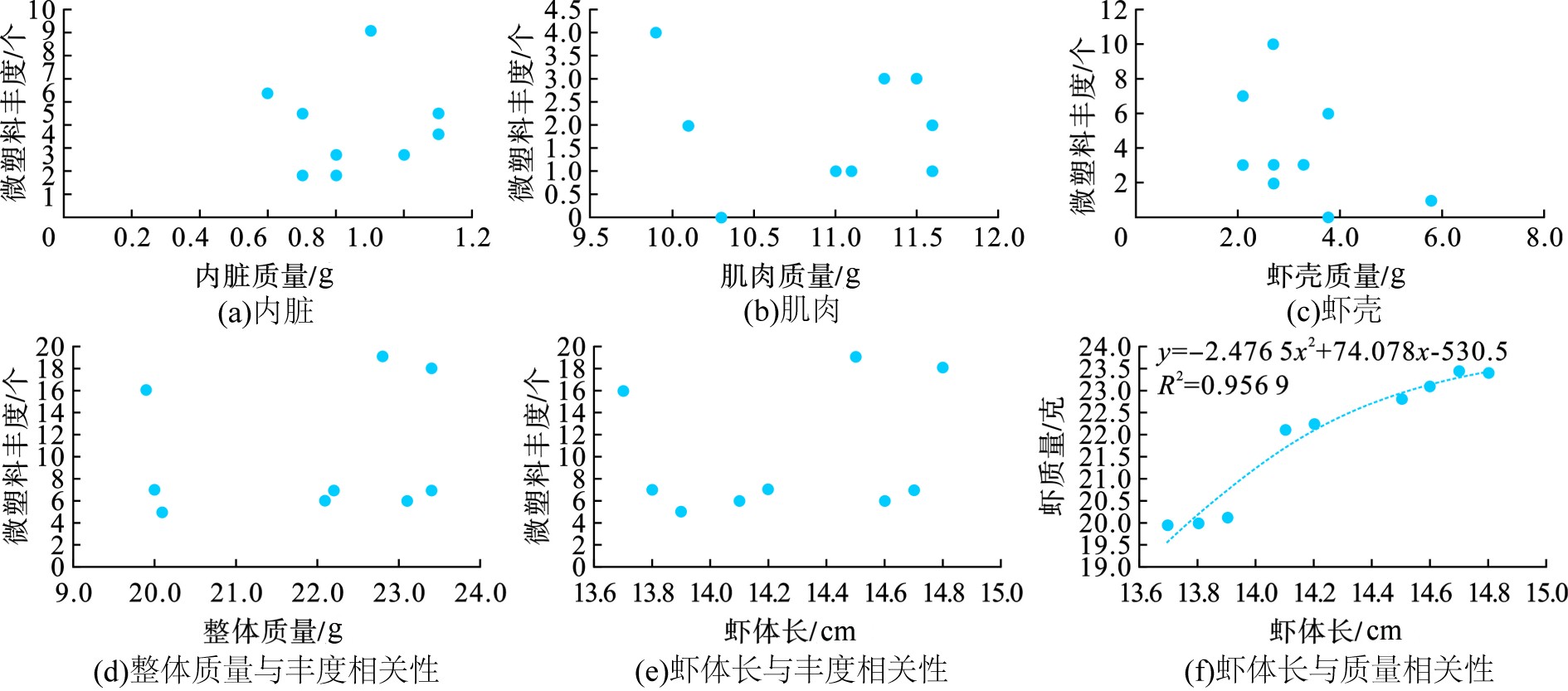
Spearman相关性分析发现,漳州南美白对虾样本在体重和体长方面具有良好的相关性,Spearman相关系数为0.995 8。所有样品体长在13.7~14.8 cm之间变化,而体重在19.9 ~23.4 g之间,见图2。肌肉组织的重量在9.9~11.6 g之间。根据趋势线描述生长方程计算,其R² = 0.956 9,这意味着虾在生长时保持形状,即使在微塑料赋存的环境中。虾体长与虾重量呈一定正相关,其关系为y = − 2.4765x2 + 74.078x − 530.5。这是首次对南美白对虾生长体征相关因子与微塑料丰度相关性分析的研究。
图2显示内脏质量与微塑料丰度相关系数0.068 9、肌肉质量与微塑料丰度相关系数0.033 9、虾壳质量与微塑料丰度的相关性相关系数0.350 5,并没有发现其显著性关系。进一步分析整体质量以及虾体长与微塑料丰度关系,也没有发现其相关性特征。这可能因为样本数量不够,也可能因为养殖环境微塑料来源复杂,南美白对虾摄食行为与其体内微塑料赋存特征并不能直接从生物学特征上反映。整体上看,研究表明虾体长和重量呈现正相关关系,并未发现微塑料丰度与生物学特征的相关性特征。
-
从尺寸特征上看,见表2。
主要以小尺寸微塑料为主(1~50 μm),占比74.7%,这与其他学者采集的野生深水虾的尺寸特征不同。ESTER et al[27]观察到,从地中海西北部收集的深水虾(Aristeus antennatus)的胃中有13种微塑料,尺寸最长的高达6.6 mm[27]。本研究虾壳中检出30个小尺寸微塑料,占比最多(85.7%),50 μm以上微塑料检出5个。虾壳中检出的微塑料主要来自养殖水环境中赋存的微塑料或者饲料等。小尺寸的微塑料可能嵌入或吸附于虾壳,特别是虾脚和虾头容易携带微塑料。但是,虾类等甲壳类生物在生长发育过程需要蜕壳,这会去除大量的微塑料附着。蜕壳后的虾壳会漂浮在养殖水池表面,养殖户一般会打捞清除。
内脏中检出的微塑料最多,合计39个。各个样品中,最高检出9个,最低2个。其中,小颗粒微塑料(1~50 μm)是50 μm以上的颗粒数量的2倍多。文献[28]报道大西洋长臂虾(Palaemon varians)很容易摄入尺寸为0.1~9.9 µm的聚苯乙烯微珠,摄入的微塑料在消化器官通过复杂的过滤系统按大小分离,一些最小的颗粒(0.1 µm)可进入肠道。一般来说,虾线即消化系统是食用时会去除的部位,虾头内也有丰富的器官。由于本研究没有再细分器官,无法进一步区分具体什么器官的含量更高。但是,本研究所定义的虾头包括各种内脏器官(心脏、胃、肝等),小颗粒微塑料更容易被摄入并进入代谢系统。LUSHER et al[29]研究发现尺寸小于150 μm的微塑料在通过食物摄入后,主要通过易位进入循环组织和内脏,包括肾脏、大脑、肝脏和性腺。
最后,从肌肉中检出的微塑料尺寸特征上看,小颗粒1~50 和50 μm以上大颗粒的检出数量差异不大,合计分别是10和7个。因为微米尺寸级别上,微塑料已经可以通过新陈代谢进入各个器官组织,进而进入肌肉[29]。值得注意的是,肌肉是人类食用虾类主要部位,其微塑料检出预示着潜在水产品质量安全风险。
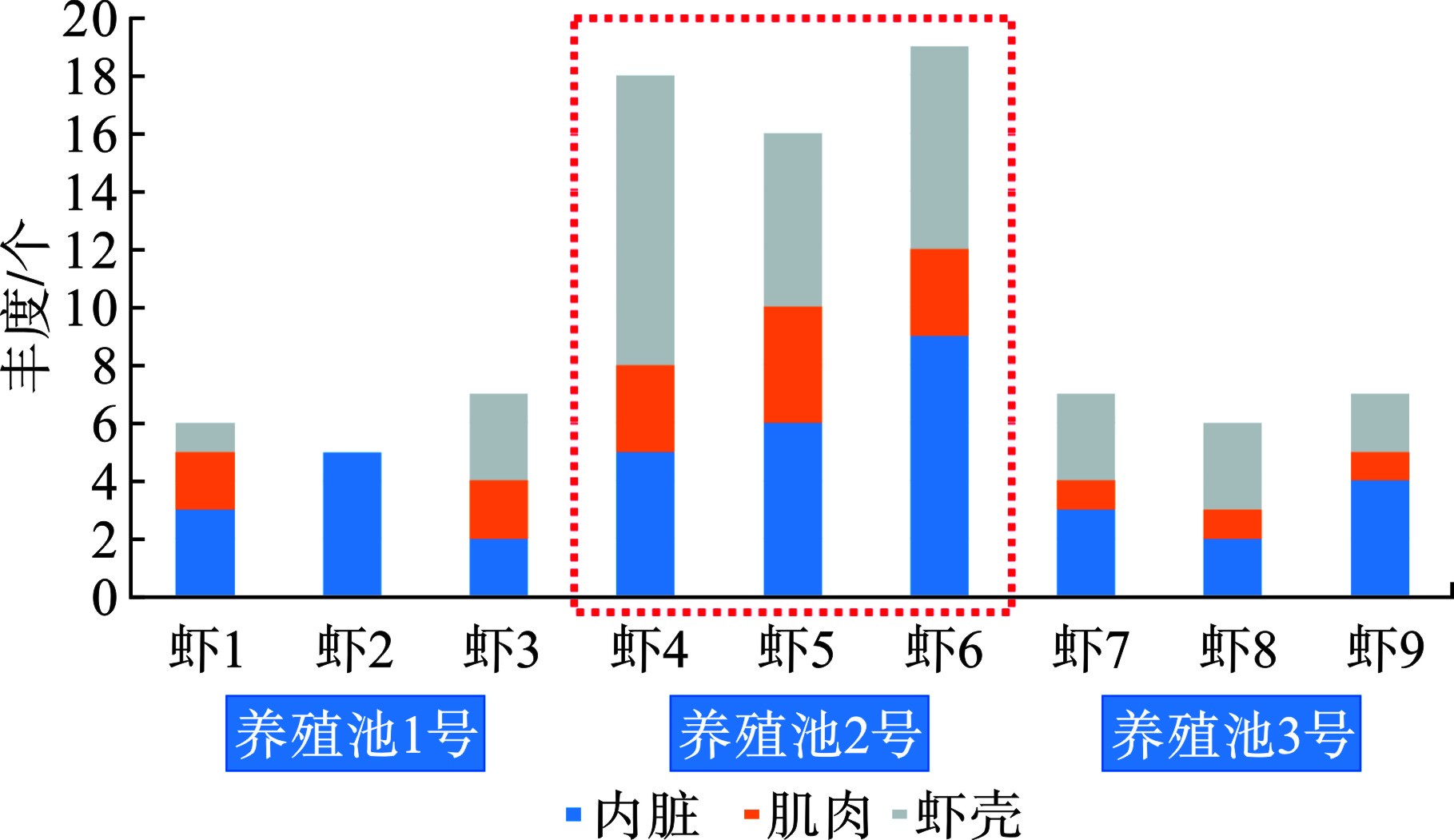
从微塑料丰度整体分布特征上看,见图3。
1号和3号养殖池的微塑料丰度较低,最高检出7个,最低5个。2号养殖池丰度最高(图3红色框标记),最高检出19个,最低16个,占比达到所有养殖池的检出量的58.2%。2号养殖池是较早投建的一批养殖池,靠近内陆(距离村居最近),其抽水管线路最长,且养殖池面最宽,养殖密度相对较大。由于投建时间较长,养殖池内铺设的塑料地膜和保温棚年久老化,可能是内环境微塑料来源。从器官分布特征上看,除虾2样品的肌肉和虾壳中未检出微塑料外,其余样品均在各个器官组织检出微塑料。虾6样品检出的微塑料最高,达到19个,其中内脏检出9个,虾壳检出7个,肌肉检出3个。虾壳检出微塑料说明养殖环境中普遍赋存微塑料。内脏组织的微塑料检出说明南美白对虾可通过摄食等生物行为摄入微塑料。肌肉组织微塑料检出说明摄食的微塑料并无法完全排泄出,可进一步代谢迁移。整体上看,内脏和虾壳中的微塑料检出量占比最高,肌肉相对较少(平均1.89 n/a),这与其他研究报道结论一致[18,20-21,30-31]。按照食用南美白对虾的习惯,去除掉虾头、虾壳、虾线等组织器官,单独食用肌肉是相对安全的。
-
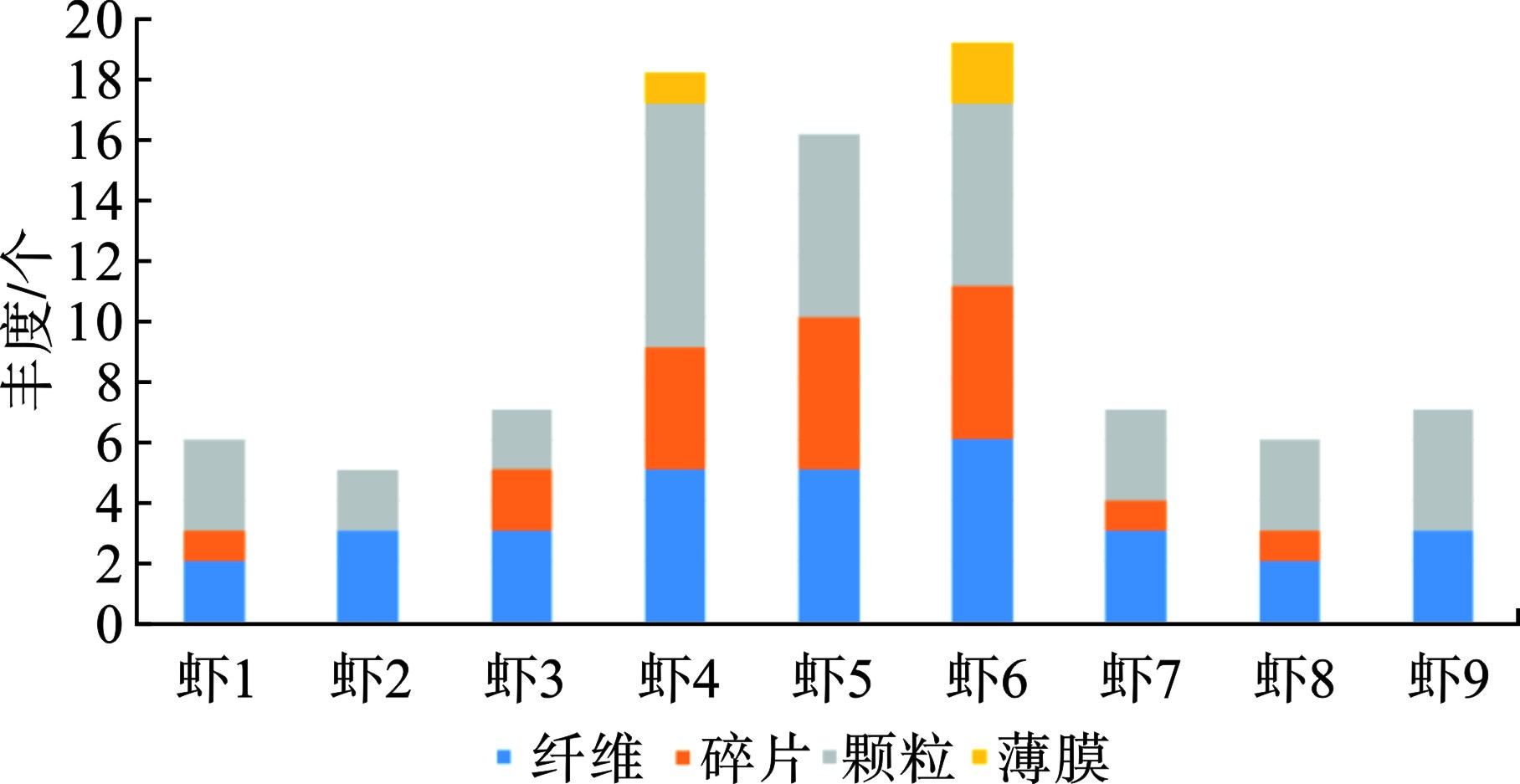
从形状特征上看,见图4。
图4可知,共检出4种形状的微塑料,分别是纤维32个、碎片19个、颗粒37个和薄膜3个。薄膜状只在2号养殖池采集的样本中检出,分别是虾4检出1个,虾6检出2个。薄膜状微塑料检出率较低,整体占比只有3.3%。只有2号养殖池的虾4和虾6样本检出4种形状,其他样本只检出2种或者3种形状。2号养殖池也是微塑料平均丰度最高的样本来源,这说明微塑料形状的多样性与微塑料丰度有一定的相关性,微塑料丰度越高可能检出更多种类的形状。不管是几号样本,均检出纤维状和颗粒状微塑料。纤维状和颗粒状合计检出69个,占总微塑料检出数量的75.8%。其高占比可归因于南美白对虾摄食习惯以及研究区域的人为活动。据报道,纤维状微塑料是全球海水中最丰富的形态[32]。本研究观察结果与之前报道的甲壳类动物(Crusta)[7]、蓝贻贝(Mytilus edulis)[33]和褐虾(Crangonidae)[33]的研究一致。这些研究显示这些物种的肠道中纤维状微塑料占主导地位[33-34]。HOSSAIN et al[21]确定纤维状微塑料在斑节对虾(Penaeus monodon)中占主导地位(57%),其次是颗粒(29%)和碎片(14%);而褐虾则以颗粒状(42%)为主,其次是纤维(32%)和碎片(26%)。渔业养殖过程中需要使用大量塑料渔绳和渔网,这可能是纤维状的主要来源。颗粒形状的微塑料在海洋环境中广泛赋存,样本中检出的颗粒状微塑料可能来自换水带来的周边近海表层水体,也可能是饲料或者塑料包装袋等来源。纤维和颗粒状微塑料更可能被南美白对虾误食。建议未来进一步观测其摄食行为和器官组织形态,以评估是否具有显著相关性。整体上看,漳州南美白对虾检出的4种形状微塑料具有一定代表性。薄膜是检出量最少的微塑料,其次是碎片。环境中塑料废物是养殖微塑料主要来源[35-36]。各种塑料材料和养殖设备,如塑料地膜、保温棚、泡沫浮阀、绳索、渔网、增氧机等是环境中微塑料的潜在来源(图1)。据调查,漳州红树林区海水养殖池塘是封闭或半封闭的,这导致微塑料的持续的保留和积累。此外,养殖池底部沉积物可作为微塑料的沉积区[37]。
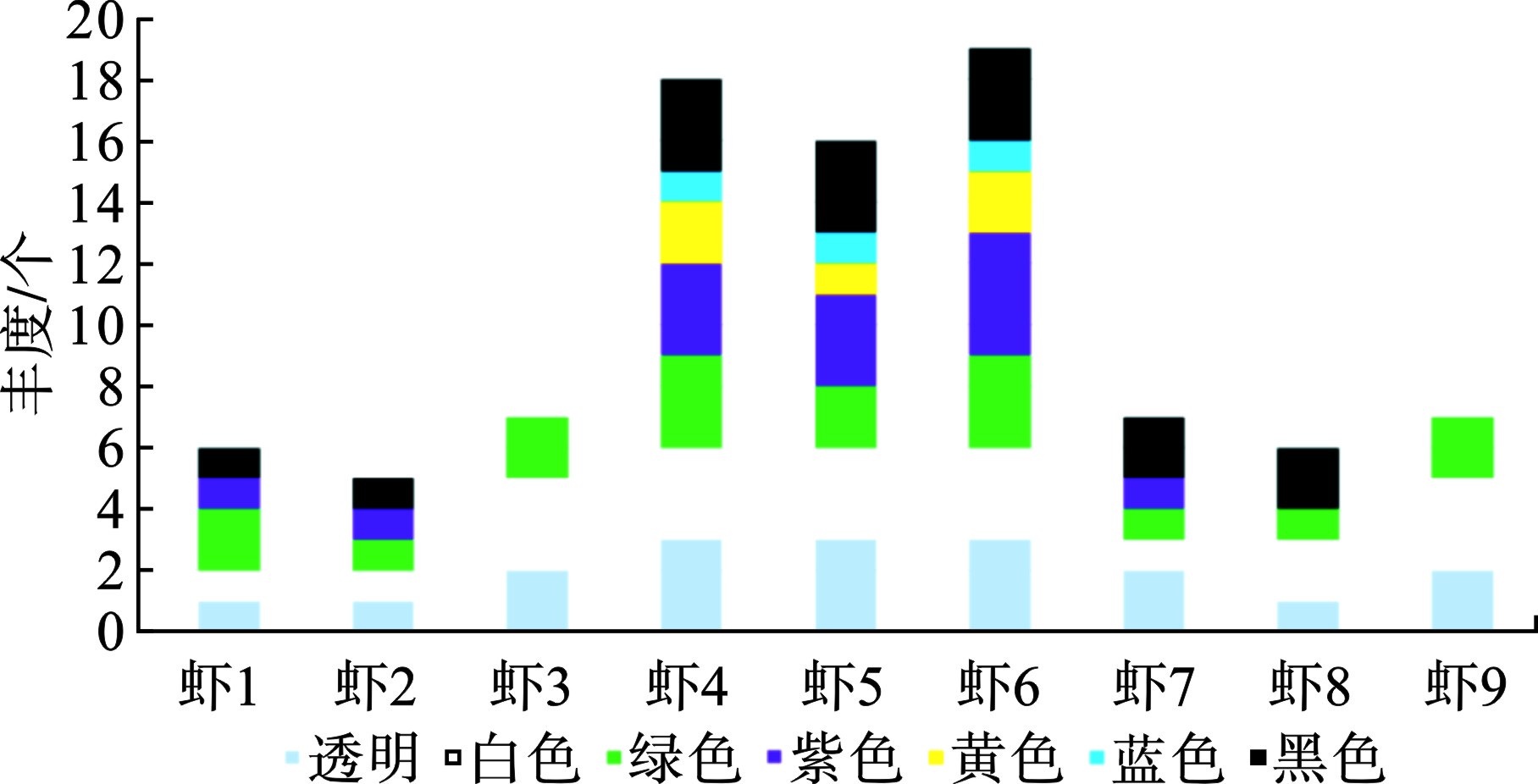
从颜色特征上看,见图5。
所有样本共检出7种颜色。占比最高的是白色和透明色,分别达22%和20%,其次是绿色(17个)和黑色(15个),最少的是蓝色(3个)。在从孟加拉国水域收集的老虎虾和棕色虾中也观察到类似的微塑料颜色特征[21]。微塑料可以直接被虾类摄食,因它们与饲料或天然沉积物相似;或者因为微塑料对食物(饲料)颗粒的粘附被间接食用。鉴于微塑料在视觉上与虾的天然食物和猎物相似,这些生物对微塑料的生物利用度相对较高[38]。并不是所有养殖池都检出多样性颜色的微塑料,比如1号养殖池虾3号样本只检出3种颜色,3号养殖池虾9样本检出3种颜色,只有2号养殖池的所有样本检出7种颜色微塑料。但是,不管几号养殖池,白色、绿色和透明颜色在所有养殖池的虾样本中都有检出。在虾类样品中检出透明的颜色,预示着其微塑料相对较新,养殖过程中使用的塑料保温棚可能是其来源。绿色微塑料比较引发关注,通过对现场养殖设备和养殖工具调查,发现养殖过程中需要定期通过吊挂绿色渔网观察南美白对虾进食情况,这些网袋可能是绿色微塑料来源。另据报道,褐虾主要摄取黄绿色的微塑料(50%),其次是紫蓝色(43%),半透明(15%)等[34]。
黑色微塑料也是海洋环境中常见的颜色。养殖池底部大面积铺设的塑料地膜年久老化脱落,可能是其来源。整体上看,本研究样本中微塑料颜色特征,预示着漳州红树林区南美白对虾体内微塑料来源更多来自内源性污染,受养殖设施和工具中使用的塑料制品影响。值得注意的是,微塑料颜色的可变性。由于塑料产品生产时使用着色剂,例如包装、渔具等[39]。着色剂可能老化脱落,透明颜色的微塑料在环境中可能因为氧化而变得不透明,显出白色。最后,紫色的塑料在养殖池中并无检出,但是样本中部分检出可能预示着养殖换水过程带来的外部污染。
-
本研究证实漳州红树林区海水养殖南美白对虾体内普遍检出各种形状、尺寸和颜色的微塑料。研究表明虾体长和重量的正相关关系,并未发现微塑料丰度与生物学特征的相关性。从尺寸特征上看,主要以小尺寸微塑料为主(1~50 μm),占比74.7%。内脏中检出的微塑料最多,39个;肌肉中检出的小颗粒(1~50 μm)和50 μm以上大颗粒数量差异不大。内脏和虾壳中的微塑料检出量占比最高,肌肉相对较少(平均1.89 n/a)。按照食用南美白对虾的习惯,去除掉虾头、虾壳、虾线等组织器官,单独食用肌肉是相对安全的。从形状特征上看,共检出4种形状的微塑料,纤维状和颗粒状微塑料占比75.8%。从颜色特征上看,占比最高的是白色和透明色,分别达22%和20%。漳州红树林区南美白对虾体内微塑料更多来自内源性污染,受养殖设施和工具中使用的塑料制品影响。封闭或半封闭的养殖池塘促进微塑料持续的保留和积累。微塑料的检出预示着潜在海产品质量安全风险,未来需要进一步研究其毒理以评估人体健康危害。
红树林海水养殖南美白对虾微塑料赋存特征、来源和影响因素
Occurrence characteristics, sources and influencing factors of microplastics in Penaeus vannamei from mangrove wetland
-
摘要: 微塑料污染威胁海水养殖与人体健康。南美白对虾(Penaeus vannamei)是一种高度消费海产品,文章首次对福建漳州红树林区南美白对虾微塑料赋存特征、来源和影响因素进行研究。结果证实南美白对虾体内普遍检出各种形状、尺寸和颜色的微塑料,未发现微塑料丰度与生物学特征的相关性。从尺寸特征上看,主要以小尺寸微塑料为主(1~50 μm),占比74.7%。内脏和虾壳中的微塑料检出量占比最高,肌肉相对较少(平均1.89 n/a),单独食用肌肉相对安全。共检出4种形状微塑料,纤维状和颗粒状占比75.8%。颜色占比最高的是白色和透明色,分别达22%和20%。漳州南美白对虾体内微塑料更多来自内源性污染,封闭或半封闭的养殖池塘促进微塑料积累。微塑料普遍检出预示着潜在海产品安全风险,建议进一步研究毒理以评估其对人体健康的影响。Abstract: Microplastic pollution threatens mariculture and human health. Penaeus vannamei is a highly consumed seafood. The characteristics, sources, and influencing factors of microplastics in Penaeus vannamei in the mangrove forest area of Zhangzhou, Fujian were studied at the first time. The results showed that microplastics of various shapes, sizes, and colors were commonly detected. No correlation between microplastic abundance and biological characteristics was found. From the perspective of size characteristics, small-size microplastics (1~50 μm) mainly accounted for 74.7%. The proportion of microplastics detected in viscera and shrimp shells was the highest, the microplastics in the muscle was relatively small (average 1.89 n/a), indicating that the muscle was relatively safe to eat alone. A total of 4 kinds of microplastics were detected, and fibrous and granular microplastics accounted for 75.8%. The highest proportion was white and transparent, accounting for 22 % and 20 % respectively. The source of microplastics in Penaeus vannamei of Zhangzhou could be from endogenous pollution. Closed or semi-closed aquaculture ponds promoted the accumulation of microplastics. The detection of microplastics indicated a potential risk to the quality and safety of seafood, and further toxicological studies were recommended to assess their human health.
-
Key words:
- Penaeus vannamei /
- microplastics /
- characteristics /
- mariculture /
- seafood safety /
- influencing factors
-
表 1 样品生物学指标
Table 1. Biological indicators of samples
样本 体长/cm 头长/cm 体宽/cm 体高/cm 湿重/g 壳/g 肌肉/g 内脏/g 虾1 14.6 5.9 1.3 2.2 23.1 5.8 11.6 64.5 虾2 13.9 5.2 1.2 1.9 20.1 3.8 10.3 0.7 虾3 13.8 5.1 1.1 1.9 20.0 3.3 10.1 0.7 虾4 14.8 5.7 1.4 2.1 23.4 2.7 11.5 1.1 虾5 13.7 4.9 0.9 1.8 19.9 3.8 9.9 0.6 虾6 14.5 5.8 1.2 2.1 22.8 2.1 11.3 0.9 虾7 14.2 5.2 1.0 2.1 22.2 2.7 11.1 0.8 虾8 14.1 5.2 1.0 2.0 22.1 2.1 11.0 0.8 虾9 14.7 5.7 1.3 2.0 23.4 2.7 11.6 1.1 表 2 微塑料尺寸器官分布表
Table 2. Distribution of microplastic size in different organs
尺寸特征/μm 内脏/个 肌肉/个 虾壳/个 >50 11 7 5 1~50 28 10 30 -
[1] ARDUSSO M, LOPEZ A, BUZZI N S, et al. Journal pre-proof covid-19 pandemic repercussions on plastic and antiviral polymeric textile causing pollution on beaches and coasts of south america[J]. Science of The Total Environment, 2020, 763: 144365. [2] THOMPSON RC, OLSEN Y, MITCHELL RP, et al. Lost at sea: where is all the plastic?[J]. Science, 2004, 304(5672): 838. [3] NAPPER I E, BAKIR A, ROWLAND S J, et al. Characterisation, quantity and sorptive properties of microplastics extracted from cosmetics[J]. Marine Pollution Bulletin, 2015, 99(1-2): 178 − 185. [4] ANTHONY L A. Microplastics in the marine environment[J]. Marine Pollution Bulletin, 2011, 62: 1596 − 1605. [5] GRAHAM E R, THOMPSON J T. Deposit- and suspension-feeding sea cucumbers (echinodermata) ingest plastic fragments[J]. Journal of Experimental Marine Biology & Ecology, 2009, 368(1): 22 − 29. [6] MAZURAIS D, ERNANDE B, QUAZUGUEL P, et al. Evaluation of the impact of polyethylene microbeads ingestion in european sea bass (dicentrarchus labrax) larvae[J]. Marine Environmental Research, 2015, 112(DEC. PT. A): 78 − 85. [7] FIONA M, PHILLIP R C. Plastic contamination in the decapod crustacean nephrops norvegicus (linnaeus, 1758)[J]. Marine Pollution Bulletin, 2011, 62(6): 1207 − 1217. [8] WELDEN N A C, COWIE P R. Long-term microplastic retention causes reduced body condition in the langoustine, nephrops norvegicus[J]. Environmental Pollution, 2016, 218(nov.): 895 − 900. [9] WRIGHT S L, THOMPSON R C, GALLOWAY T S. The physical impacts of microplastics on marine organisms: a review[J]. Environmental Pollution, 2013, 178: 483 − 492. [10] BROWNE M A, DISSANAYAKE A, GALLOWAY T S, et al. Ingested microscopic plastic translocates to the circulatory system of the mussel, mytilus edulis (l)[J]. Environmental Science & Technology, 2008, 42(13): 5026 − 5031. [11] AHRENDT C, PEREZ-VENEGAS DJ, URBINA M, et al. Microplastic ingestion cause intestinal lesions in the intertidal fish girella laevifrons[J]. Marine pollution bulletin, 151(Feb. ), 2020: 110795.1 − 110795.6. [12] DELILAH L, ÅKE L, GÖRAN D. Environmental and health hazard ranking and assessment of plastic polymers based on chemical composition[J]. Science of the Total Environment(18), 2011(4): 038. doi: 10.1016/j.scitotenv [13] ROCHMAN C M, HOH E, KUROBE T, et al. Ingested plastic transfers hazardous chemicals to fish and induces hepatic stress[J]. Scientific Reports, 2013, 3: 3263. [14] WARDROP P, SHIMETA J, NUGEGODA D, et al. Chemical pollutants sorbed to ingested microbeads from personal care products accumulate in fish[J]. Environmental Science and Technology, 2016, 50(7): 4037 − 4044. [15] MARK A B, STEWART J N, TAMARA S G, et al. Microplastic Moves Pollutants and Additives to Worms, Reducing Functions Linked to Health and Biodiversity[J]. Current Biology, 2013, 23(2013): 2388 − 2392. [16] GUZZETTI E, SUREDA A, TEJADA S, et al. Microplastic in marine organism: environmental and toxicological effects[J]. Environmental Toxicology and Pharmacology, 2018, 64(12): 164 − 171. [17] NAIK R K, NAIK M M, D'COSTA P M, et al. Microplastics in ballast water as an emerging source and vector for harmful chemicals, antibiotics, metals, bacterial pathogens and hab species: a potential risk to the marine environment and human healt[J]. Marine Pollution Bulletin, 2019, 149: 110525. [18] CURREN E, LEAW C P, LIM P T, et al. Evidence of marine microplastics in commercially harvested seafood[J]. Frontiers in Bioengineering and Biotechnology, 2020, 8: 562760. [19] SEVERINI F, BUZZI N S, LOPEZ A F, et al. Chemical composition and abundance of microplastics in the muscle of commercial shrimp pleoticus muelleri at an impacted coastal environment (southwestern atlantic)[J]. Marine Pollution Bulletin(Dec. Pt. A), 2020: 161. [20] DANIEL D B, ASHRAF P M, THOMAS S N. Abundance, characteristics and seasonal variation of microplastics in indian white shrimps (fenneropenaeus indicus) from coastal waters off cochin, kerala, india[J]. Science of The Total Environment, 2020, 737(11): 139839. [21] HOSSAIN M S , RAHMAN M S , UDDIN M N , et al. Microplastic contamination in penaeid shrimp from the northern bay of bengal[J]. Chemosphere, 2020, 238: 124688. [22] GURJAR U R, XAVIER M, NAYAK B B, et al. Microplastics in shrimps: a study from the trawling grounds of north eastern part of arabian sea[J]. Environmental Science and Pollution Research., 2021, 28: 48494 − 48504. [23] FAO. The State of World Fisheries and Aquaculture Food and Agriculture[J]. Organization of the United Nations, Rome, 2021. [24] 张伟权. 世界重要养殖品种——南美白对虾生物学简介[J]. 海洋科学, 1990(3): 69 − 73. [25] HIDALGO-RUZ V, GUTOW L, THOMPSON RC, et al. Microplastics in the marine environment: a review of the methods used for identification and quantification[J]. Environmental Science & Technology, 2012, 46(6): 3060 − 3075. [26] LEI S, HUIWEN C, PRABHU K, et al. Using the Asian clam as an indicator of microplastic pollution in freshwater ecosystems[J]. Environmental Pollution, 2018: 234. [27] ESTER CC, MARIA C, ANNA SM, et al. Spatial occurrence and effects of microplastic ingestion on the deep-water shrimp aristeus antennatus[J]. Marine Pollution Bulletin, 2018: 133. [28] SABOROWSKI R, KOREZ P, RIESBECK S, et al. Shrimp and microplastics: a case study with the atlantic ditch shrimp palaemon varians[J]. Ecotoxicology and Environmental Safety, 2022, 234: 113394. [29] LUSHER A, HOLLMAN P, MENDOZA-HILL J. Microplastics in fisheries and aquaculture: Status of knowledge on their occurrence and implications for aquatic organisms and food safety[J]. FAO Fisheries and Aquaculture Technical Paper, 2017, 615: 1 − 126. [30] HARA J, FRIAS J, NASH R. Quantification of microplastic ingestion by the decapod crustacean nephrops norvegicus from irish waters[J]. Marine Pollution Bulletin, 2020: 152. [31] YAN M, LI W, CHEN X, et al. A preliminary study of the association between colonization of microorganism on microplastics and intestinal microbiota in shrimp under natural conditions[J]. Journal of Hazardous Materials, 2020, 408: 124882. [32] WALKINSHAW C, LINDEQUE P K, THOMPSON R, et al. Microplastics and seafood: lower trophic organisms at highest risk of contamination[J]. Ecotoxicology and Environmental Safety, 2019, 190: 110066. [33] DEVRIESE L I , DMMD V , MAES T , et al. Microplastic contamination in brown shrimp (crangon crangon, linnaeus 1758) from coastal waters of the southern north sea and channel area[J]. Marine Pollution Bulletin, 2015, 98(1-2): 179 − 187. [34] WITTE B D, DEVRIESE L, BEKAERT K, et al. Quality assessment of the blue mussel (mytilus edulis): comparison between commercial and wild types[J]. Marine Pollution Bulletin, 2014, 85(1): 146 − 155. [35] GBA B, BU B, AM A., et al. Identification of microplastics in fish ponds and natural freshwater environments of the carpathian basin, europe[J]. Chemosphere, 2019, 216: 110 − 116. [36] NICOLAS C O, PAULA S, JOANA L F, et al. Amberstripe scad decapterus muroadsi (carangidae) fish ingest blue microplastics resembling their copepod prey along the coast of rapa nui (easter island) in the south pacific subtropical gyre[J]. Science of The Total Environment, 2017, 586: 430 − 437. [37] CHEN M , JIN M , TAO P , et al. Assessment of microplastics derived from mariculture in xiangshan bay, china[J]. Environmental Pollution, 2018, 242(PT. B): 1146 − 1156. [38] LOTTE K, CASADO-COY N., VALLE C, et al. Plastic debris accumulation in the seabed derived from coastal fish farming[J]. Environmental Pollution, 2019, 257: 113336. [39] WANG J, PENG J, TAN Z, et al. Microplastics in the surface sediments from the beijiang river littoral zone: composition, abundance, surface textures and interaction with heavy metals[J]. Chemosphere, 2017, 171: 248 − 258. -






 下载:
下载: