-
有机负荷率(OLRs)是影响形成好氧颗粒污泥(AGS)关键因素[1]。不同的OLRs不仅影响AGS高密度的生物结构、沉降性能、对冲击负荷的抵抗能力,还影响对氮、磷的同步去除效果[2-3]。HE et al[4]研究发现在SBR反应器中选择OLRs(1.44 kg/(m3·d))时,可实现单体反应器对污水中的TN和TP同步去除,体现AGS在低OLRs下的应用潜力。而TAY et al[5]研究表明当OLRs为1.2 kg/(m3·d)时无法直接形成AGS,说明在低OLRs下应用AGS技术,需要对低OLRs的可应用性实施验证。HAMZA et al[6]通过SBR实验发现,提高OLRs时超过系统耐受能力会造成反应器内异养生物快速增长,絮状微生物覆盖了AGS的表面,AGS失稳破碎。可见,反应器内OLRs影响AGS形成,培养AGS过程中需要对其环境OLRs进行限制。REN et al[7]研究表示,不同OLRs培养的AGS形态、稳定性和微生物种属均有差异,反应器中生物活性和TN、TP去除效果也随之受影响。HAMZA et al[8]发现升高OLR时可加快污泥颗粒化但颗粒却不稳定,而低OLRs培养的颗粒能长时间稳定运行[4]。而目前污水厂进水有机负荷率较低,为该技术支撑实际应用而开展低有机负荷区间内OLRs升降对AGS形成影响研究及揭示AGS抗冲击性具有明显意义。
本实验将于较低OLRs负荷内,先提高OLRs而后降低,研究体系内污泥结构变化,考察过程中系统生物量,污染物去除效能的响应,及微生物群落结构演化,以期探究AGS抵抗冲击负荷的特征。
-
试验用水为人工模拟废水,进水NH+4-N 60 mg/L,TP 8 mg/L,Ca2+、Mg2+为10 mg/L;其他组分浓度如下(g/L):NH4HCO3 0.339,KH2PO4 0.045,CaCl2 0.03,MgCl2·6H2O 0.0845;微量元素 1 mL/L,组成成分(g/L):EDTA 0.05,MnSO4·H2O 0.05,ZnSO4·7H2O 0.05,H3BO3 0.05,KI 0.05,CoCl2·6H2O 0.05,CuSO4·5H2O 0.05,(NH4)6Mo7O24 0.05。进水pH为7.0~8.5,温度为(25±5)℃,接种的絮状污泥源自长沙市新开铺污水厂二沉池进水污泥,其核心工艺采用A/A/O。种污泥性质,见表1。
-
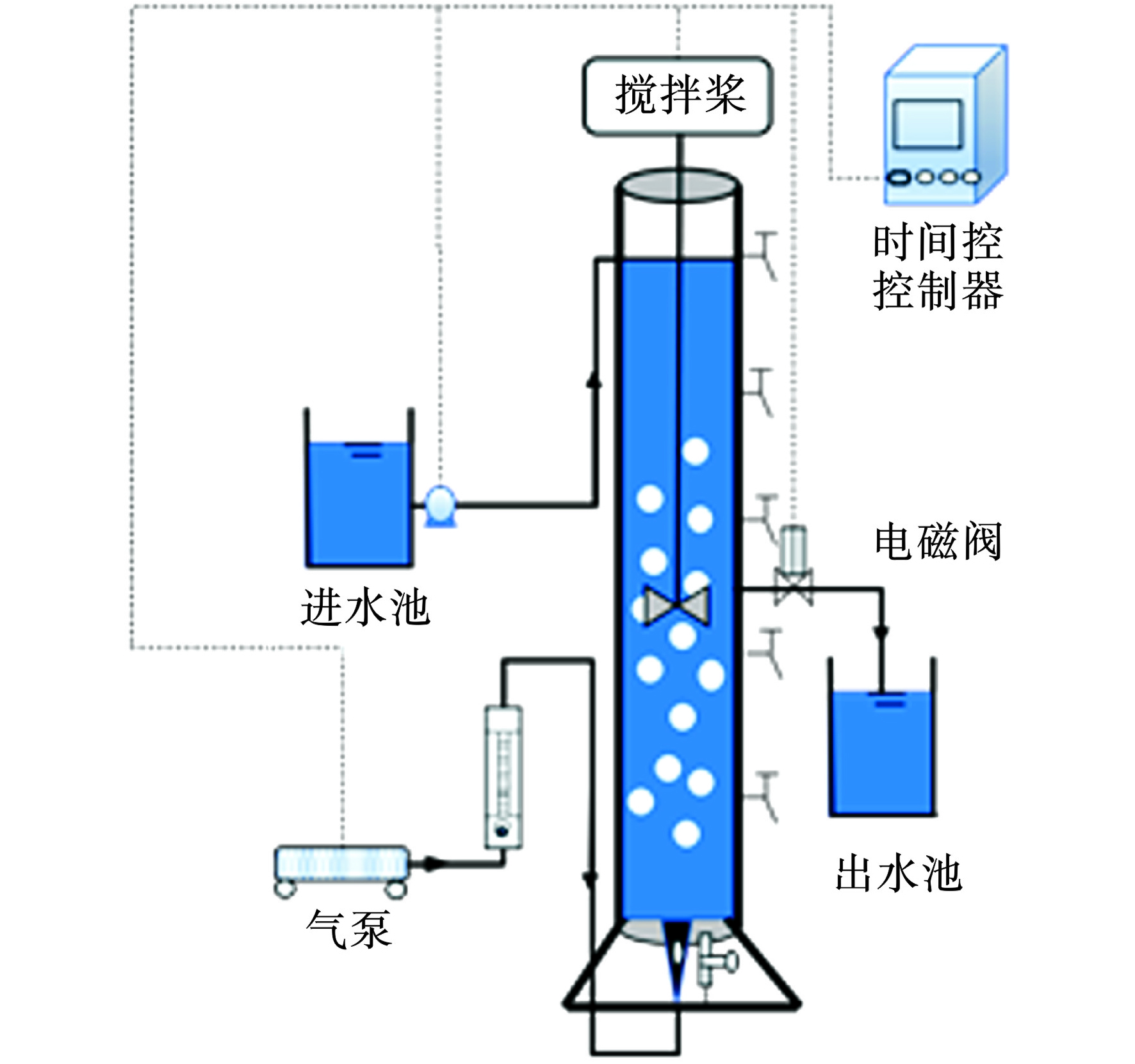
试验装置采用圆柱型SBR反应器,由有机玻璃制成,内径10 cm,高度60 cm,装置内液面高50 cm,高径比5∶1,有效容积4 L。用气泵连接曝气头从底部进行曝气,通过转子流量计控制曝气量,表面气速1.41 cm/s。反应器运行周期为4 h,进水5 min,曝气225 min,静置沉淀5 min,排水5 min,体积交换比50%,各阶段采用时间控制器调节,污泥龄为30 d。接种絮状污泥后,对反应器进行2 d的闷爆,见图1。
-
将反应器内OLRs由低升高至成粒后再降低,考察整个过程中,系统内污染物去除能力变化及微生物群落结构演化。采用乙酸钠作为唯一碳源。对AGS从成形到第一次解体到再成形过程进行连续培养,测定AGS粒径、生物量、出水COD、
${\rm {NH}}_4^+ $ -N、${\rm {NO}}_2^- $ -N、${\rm {NO}}_3^- $ -N、TN及TP浓度,对AGS进行微生物群落多样性检测,试验设置参数,见表2。 -
COD、
${\rm {NH}}_4^+ $ -N、${\rm {NO}}_2^- $ -N、${\rm {NO}}_3^- $ -N、TP、TN、SVI5(5 min的污泥体积指数)、MLSS采用标准方法测定[9];pH、DO采用便携式pH值、DO测定仪测定;污泥形成过程观察采用光学显微镜;颗粒污泥结构观察采用SEM;颗粒粒径的测定采用马尔文激光粒度仪[9]。 -
选用样本为接种污泥与实验后期成熟(第50 d)的颗粒污泥,采用E.Z.N.A™ Mag-Bind Soil DNA Kit提取试剂盒,采集DNA,第一轮PCR扩增采用引物Nobar_341F及Nobar_805R,第二轮扩增引入Illumina桥式PCR兼容引物,最后使用Qubit3.0荧光定量仪进行文库浓度测定。通过barcode区分样品序列,并对各样本序列做QC,去除非特异性扩增序列及嵌合。采用OTU聚类分析,选择丰度最高的序列作为代表性序列并且绘制物种丰度组分图,最后对检测结果进行对比分析。
-
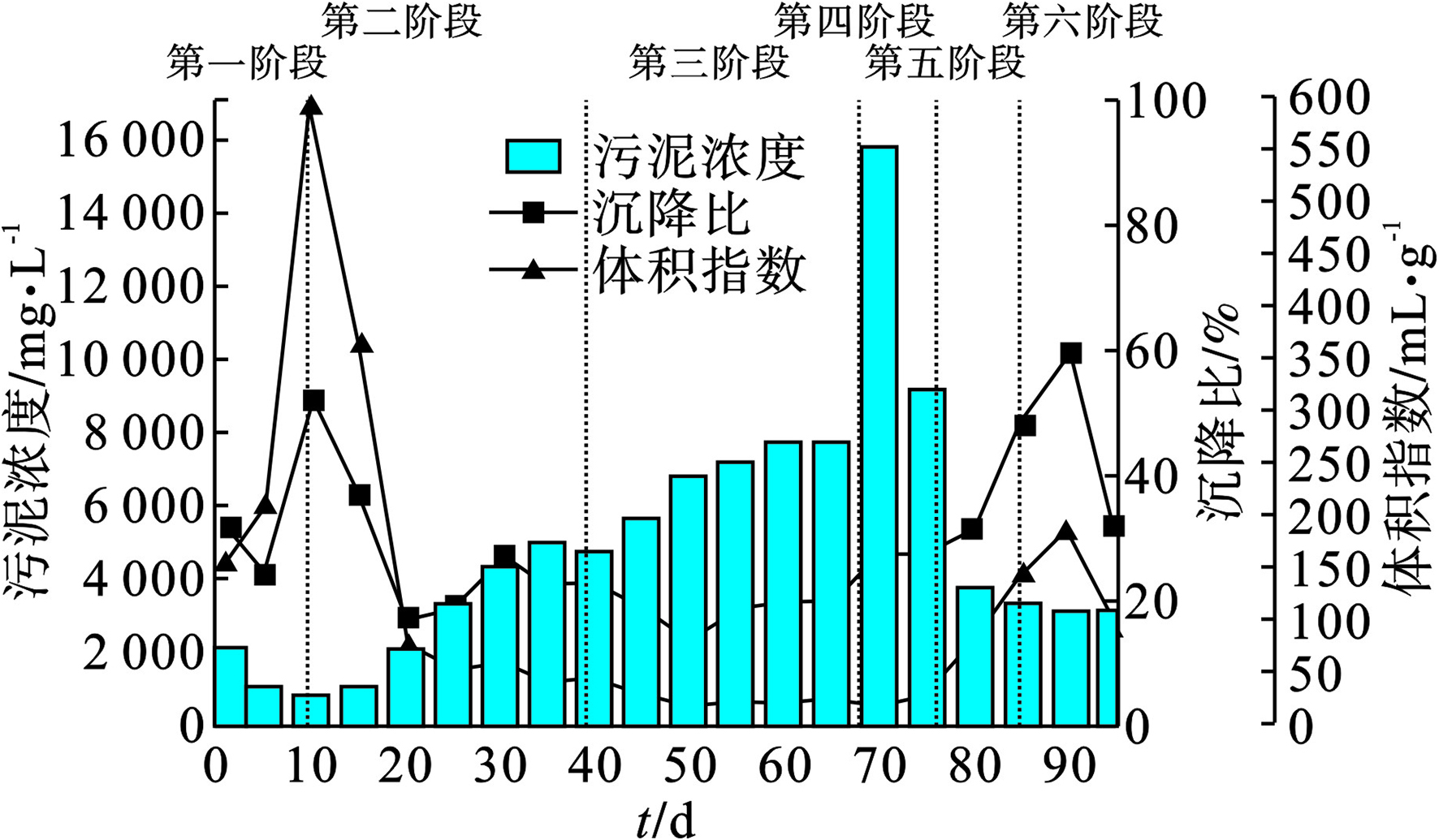
各阶段AGS的MLSS和SVI5值变化,见图2。
Stage I-II-III属于OLRs提升阶段,分别为1.2,2.4 和3.6 kg/(m3·d)。系统内MLSS、SVI5值分别为880 mg/L、 590.90 mL/g(第10 d);2132 mg/L、79.73 mL/g(第30 d);7219 mg/L、26.32 mg/L(第50 d)。由于培养起始时,污泥需适应环境,产生适量的污泥膨胀,导致污泥流失。运行过程中,污泥颜色由黑褐色逐渐转为黄褐色,污泥缓慢恢复活性,第20 d出现细小颗粒,污泥不再膨胀并表现出AGS所具备的高沉降性能。第56 d系统完成污泥颗粒化,结果表明逐渐提高OLRs可帮助污泥适应环境,并且加快成粒,与HAMZA et al研究结果一致[8]。Stage IV-V-VI为OLRs降低阶段,分别:2.4 、1.8和1.2 kg/(m3·d),系统内MLSS、 SVI5分别为15 796 mg/L、29.86 mL/g(第70 d);3 401 mg/L、144.07 ml/g(第80 d);3193 mg/L、100.21 mL/g(第90 d)。Stage IV污泥状态未发生明显变化,但污染物的去除效果出现明显改变;Stage V污泥部分解体并随着排水流出反应器,导致了反应器内生物量的流失;Stage VI观察到裂解的AGS开始重新形成新细小的AGS,该发现可支撑AGS工艺的长期持续稳定运行。该过程中系统内生物量随OLRs降低而减少,沉降性能也逐渐恶化。在AGS培养过程中,提高OLRs(Stage I-III)可加快微生物生长繁殖,增加系统内生物量,改善污泥沉降性能,加快AGS形成,降低OLRs(Stage IV-VI)会使成熟的AGS解体并且恶化污泥沉降性能,污泥也随排水流出反应器。
实验证明,提高OLRs能加速微生物的繁殖且表现出对微生物的状态有明显的稳固作用,降低OLRs时,反应器微生物稳定性出现波动且提高OLRs而培养出来的AGS发生裂解,然而裂解的AGS可作为再次形成AGS的核区帮助形成AGS,但仍有少部分碎裂的AGS被排出反应器。
-
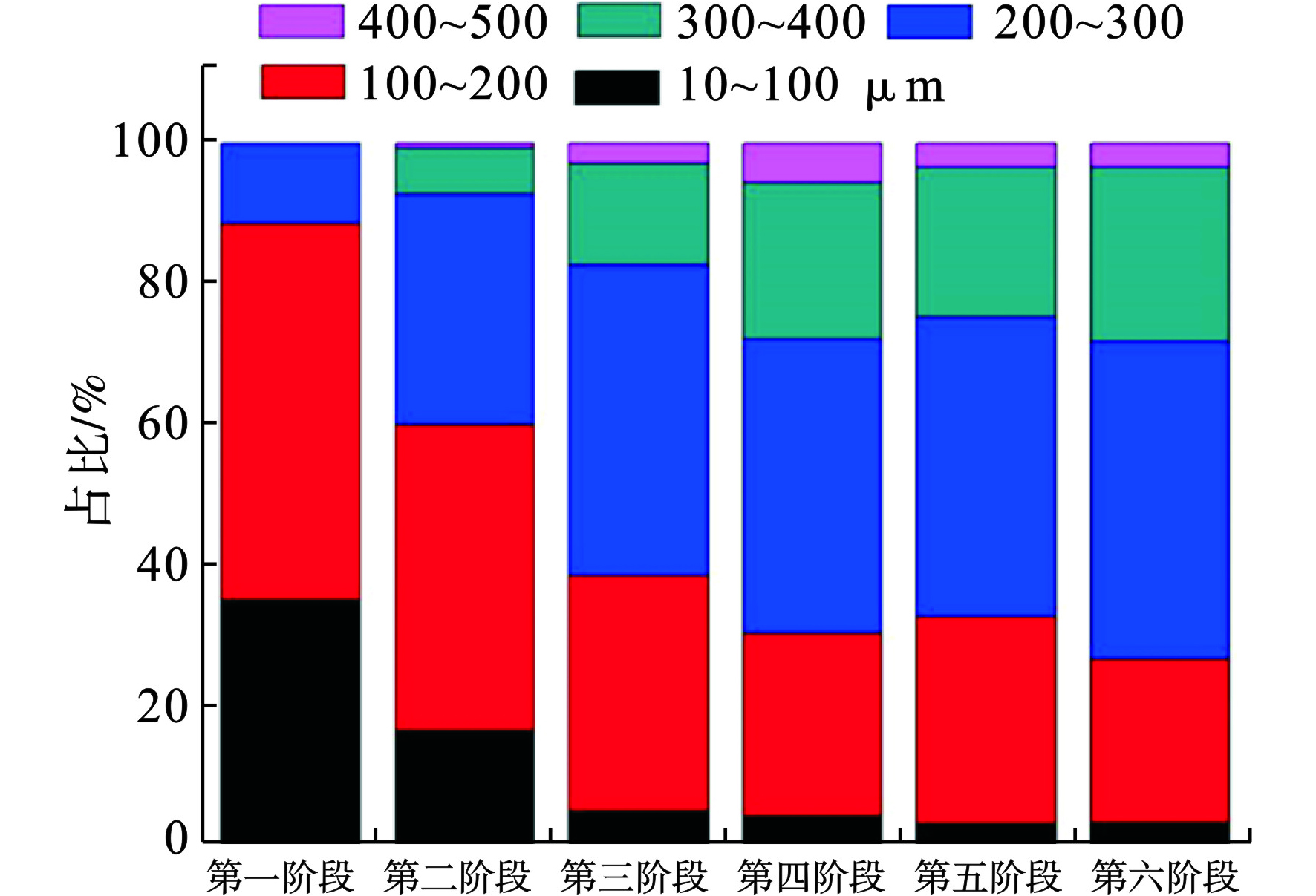
升降OLRs对AGS的尺寸变化存在显著影响。在Stage I-II-III内,污泥粒径明显随OLRs升高而增加,而在Stage IV-V-VI内,AGS发生解体,较大粒径污泥密度减少,中间粒径占比无明显变化,见图3。
Stage I内污泥尺寸10~100、100~200 μm占比为35.04%、53.53%;Stage II内污泥尺寸100~200、200~300 μm,占比为43.58%、32.68%;Stage III内AGS尺寸大于100 μm占比95%。得知,随OLRs提高,絮体尺寸增加,表明提高OLRs会刺激AGS形成,污泥沉降性能也因此得以提升,与2.1结果相同。通过SEM观察发现,AGS表现出规则的椭圆形见图4。外表边缘光滑且缠绕紧密,反应器内无可见絮体污泥,颗粒化基本完成[10]。Stage IV- V-VI阶段内颗粒污泥粒径于100~200、200~300、300~400和400~500 μm各占比为26.18%、29.37%、23.26%;41.72%、42.57%、45.17%;22.23%、21.45%、24.74 %;5.66 %、3.21%、3.02%。反应器内先出现微弱细小的絮体,表明AGS出现解体,但AGS尺寸分布并没有发生较大改变,而粒径于400~500 μm的AGS占比减少,说明解体的AGS主要来源于该尺寸部分。在降低OLRs过程中,系统内碎块污泥和絮体污泥明显增多,却始终未影响主要颗粒尺寸占比。在实验的最后,系统内的SVI5min降低,表明絮体污泥再次密实,这是再颗粒化的表现 [10] 。
Stage I-III提高OLRs可促进AGS加速形成,但培养出的AGS稳定性差,降低OLRs时,反应器内大尺寸AGS会发生裂解。Stage IV-VI,较大粒径AGS发生裂解,产生的小块AGS补充小粒径的比重,这些可作为再次形成AGS的核,协助成粒[7]。
-
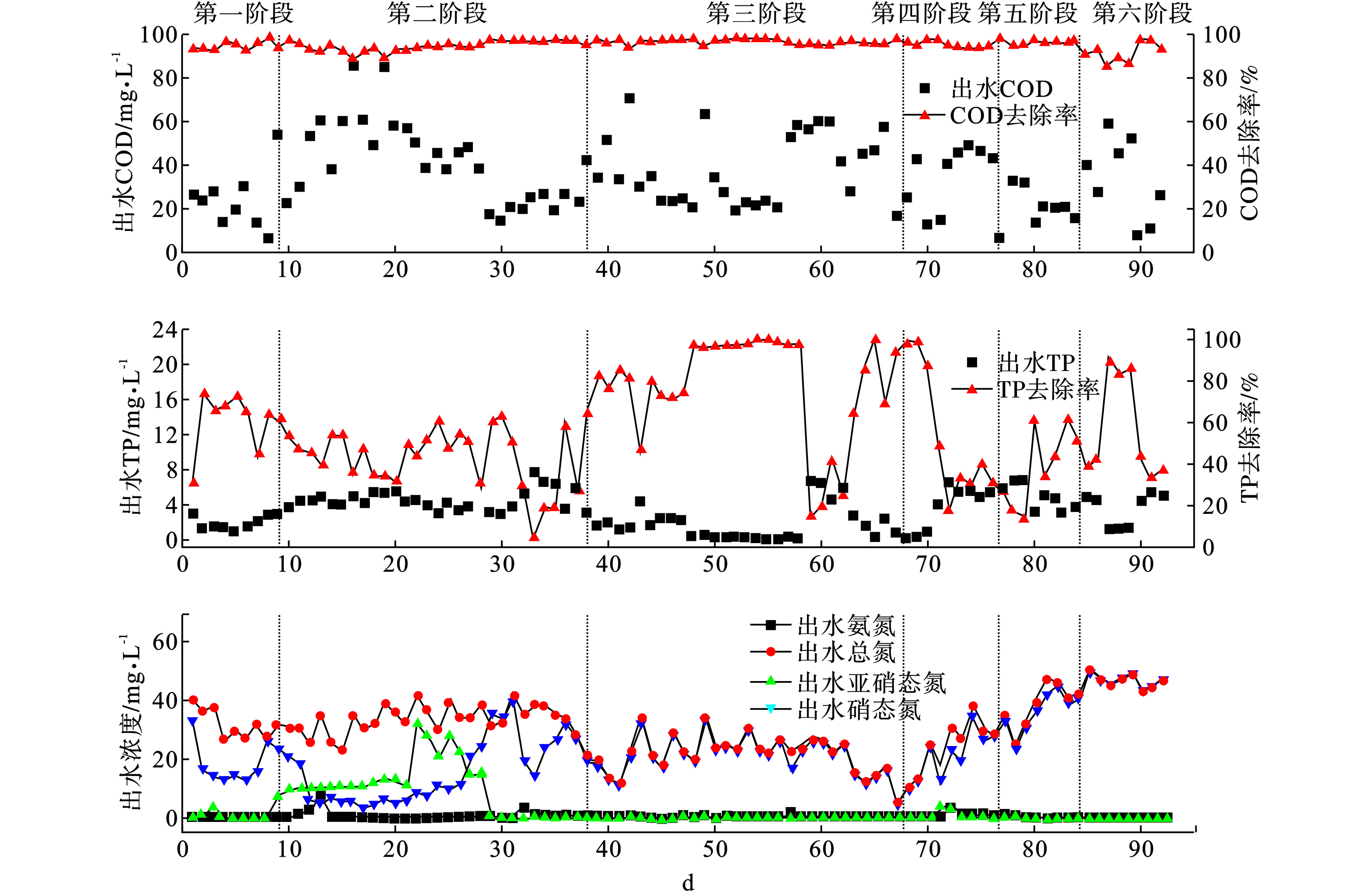
区间内低OLRs波动对COD、TP的去除效果变化,见图5 (a~b)。
提高OLRs过程中,有机物加强了异养微生物活性,且进水负荷冲击并没有影响异养微生物降解有机物,然而每次改变OLRs时,TP去除率都会有较大削弱。而降低OLRs过程中, AGS仍表现出对有机物的高效降解能力,TP去除率却下降至最低。
不同OLRs阶段,COD平均去除率分别为94.52%、94.92%、96.87%、95.92%、93.87%和93.87%,始终保持着较高的去除率,微生物也表现出良好适应能力,具有较高活性,但出水的COD浓度有少许波动。每阶段的运行稳定期,出水COD浓度稳定于20 mg/L, 证明在培养AGS过程中,微生物自我修复能力可抵御冲击负荷带来的影响。REN et al[7]研究也表明AGS具有一定的修复能力去适应环境变化。TP平均去除率分别为60.29%、44.92%、78.85%、33.39%、39.38%、56.89%,表明提高OLRs可增强系统对TP去除,为好氧吸磷提供足够碳源,而当OLRs降低后,颗粒结构的改变,引起聚磷菌生存环境发生变化,其活性急剧下降,系统对TP的去除能力恶化。LIAO et al[11]研究也说明维持聚磷菌活性需要稳定的生存环境,当颗粒解体或粒径增加时,都会影响聚磷菌活性。而在StageV-VI时,发现颗粒再形成,TP去除率却逐渐增加,聚磷菌活性得到恢复,这可能与破碎颗粒重新再颗粒化有关[6]。
反应器内含氮化合物变化结果,见图5c。提高OLRs时,系统内含氮化合物的形态由
${\rm{NH}}^+_4 $ -N逐渐变为${\rm {NO}}_3^- $ -N,使${\rm {NO}}_3^- $ -N浓度增加,而由适应环境到形成颗粒过程中,因反硝化效果逐提高,导致${\rm {NO}}_3^- $ -N出水浓度降低。降低OLRs时,AGS产生破裂,系统内由AGS所形成的特殊生存环境被破坏,反硝化菌脱氮能力明显下降,虽然破裂的AGS再聚合但是却不能恢复系统反硝化能力,异于系统内TP去除能力变化。提升OLRs的每个阶段内,系统TN平均去除率为43.78%、67.15%、79.83%,表明提升OLRs能够增强系统的脱氮效果,而形成的颗粒特殊结构也能强化系统脱氮效果。运行初期TN高于TIN,是由于接种初期的活性污泥为适应新环境而消亡,导致细胞内有机氮裂解,溶解于污水中[2]。整个实验过程,
${\rm {NH}}_4^+ $ -N的去除率均高于95%,表现反应器在全曝气模式下具有良好的${\rm {NH}}_4^+ $ -N去除性能。${\rm {NO}}_2^- $ -N出水浓度在Stage I- II-III的变化说明氨氧化菌在期初适应环境时,无法正常进行代谢致使环境中${\rm {NO}}_2^- $ -N浓度含量较低。当适应环境后,${\rm {NO}}_2^- $ -N浓度增加而后又降低,表明亚硝化菌的活性恢复[4]。Stage IV-V-VI内${\rm {NO}}_2^- $ -N出水浓度低于0.1 mg/L,说明降OLRs没有削弱亚硝化菌活性。${\rm {NO}}_3^- $ -N在整个过程中出水平均浓度为26.96、28.34、10.39、32.65和48.62 mg/L,此变化趋势从微生物适应环境角度和AGS结构变化过程分析,与系统内TP变化结果相呼应。而降低OLRs时发现AGS破碎后可再颗粒化,粒径尺寸分布没有改变而反硝化效果却不能得到维持,故可知AGS破碎会引起系统反硝化能力下降。 -
在活性污泥与颗粒污泥样本中分别检测到49482、49513个序列标签,见表3,所得到的序列数高于膨胀的AGS[11],海洋沉积物[12]和加入厌、缺氧段培养得到的AGS[13]。虽然其序列标签数相差不大,但接种污泥的聚类OUTs数高于颗粒污泥,说明接种污泥中物种的多样性高于所培养的颗粒污泥。另外,在活性污泥样品中所得Ace指数为43161.45低于颗粒污泥,表明反应器内所形成的颗粒污泥丰富度高于接种污泥,这与Chao指数所表示的结果一致。系统的多样性指数Shanon与Simpson也具有相同的趋势,反应器的微生物的多样性随着培养持续而递减。表明人工配置的模拟生活污水会削减污泥中原有微生物的多样性,但提高了反应器内生物量的丰富度。
-
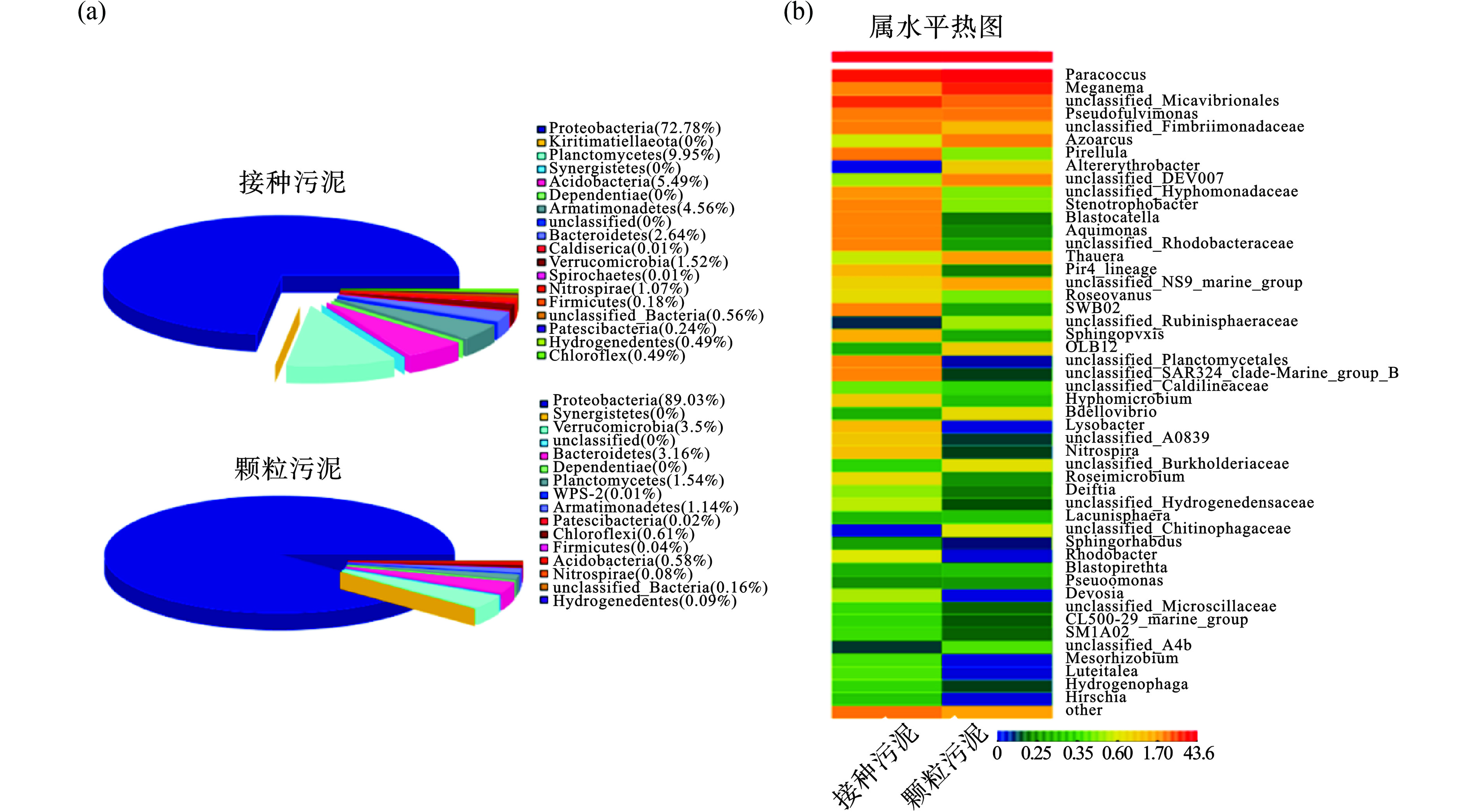
将接种污泥样品与颗粒污泥样品所得有效序列归属到不同的分类群,从属到门,见图6。在接种污泥与颗粒污泥样品中分别鉴定出18、16个门,在两个群落中Proteobacteria为优势菌,(相对丰度)分别高达72.78%、89.03%。颗粒污泥样品生物群落内Proteobacteria与Bacteroidetes丰富度占比达92.19%。根据文献[11-12,14-15],Proteobacteria与Bacteroidetes是土壤和污泥中普遍存在的门类且常占有优势丰度。随进水OLRs的提高,反应器内Proteobacteria与Bacteroidetes所占比例增加,说明OLRs提升可能刺激两菌种的生长且快速适应环境变化,其富集速度与OLRs的提升具有一定的相关性。系统内其他主导菌门类为Chloroflexi、Planctomycetes、Armatimonadates,其在碳水化合物和细胞材料的生物降解、硝化和反硝化中起着生态作用[16]。另外,在AGS的生物群落中检测出少量丝状菌和Nitrospirae菌,表明在接种初期由于环境改变而引起丝状菌增长导致污泥膨胀;而Nitrospirae是一类自养代谢的亚硝酸盐氧化菌[15],由接种污泥的1.07%减至0.08%,说明提升OLRs时增加异养微生物的比重会抑制自养菌在系统内的活性。系统内检测出初级微生物主要为Verrucomicrobia 与 Acidobacteria,所占比例为:3.5%与0.58%,为异养菌且可降解复杂的多糖[16]。
图6b根据种属对所检测微生物进行分类,列出了前50种优势微生物菌属。常见菌属为Paracoccus、Meganema,相对丰富度分别占比43.6%、21.45%,均为异养菌,可实现反硝化,是全曝气模式下提高脱氮的关键菌种。随OLRs波动,Azoarcus与Thauera的相对丰度逐步增加至4.48%、1.61%,其是实现固氮与同步硝化反硝化的重要菌属[17-18],说明在Stage IV阶段,反应器仍能恢复较高的脱氮水平。接种污泥相对丰度(>3%)有Paracoccus(24.61%)、unclassified_Micavibrionales(19.14%)、Pirellula(5.45%)、unclassified Fimbriimonadaceae(4.56%)、Pseudofulvimonas(4.4%),其他微生物菌属相对丰度都大于1%;而培养的AGS中菌株相对丰度高(>3%)有:Paracoccus(43.6%)、Meganema(21.45%)、unclassified_Micavibrionales(7.71%)、Pseudofulvimonas(4.89%),对比接种的活性污泥与培养出的颗粒污泥菌属,OLRs波动和人工模拟生活污水可能会导致微生物的菌属多样性降低,减弱了对不同环境的抵抗能力。但OLRs波动,促进颗粒污泥筛选作用,形成AGS过程中仍然实现污染物高效去除,可能原因为颗粒的特殊结构实现了单体反应器对污染物的去除,并具有一定抗冲击水平。
以基因水平将微生物群落进行功能分类,GAOs、DNBs、AOBs、NOBs、DNPAOs结果,见表4。
Paracoccus是接种污泥与颗粒污泥中的优势菌,丰度为24.61%、43.6%,表明在全曝气模式下,提升OLRs可富集此菌种,从而提高系统的脱氮除磷效果,解释了反应器Stage III表现出TP与TN的高效去除水平。Meganema(DNB),在全曝气模式下提高OLRs也可实现富集,强化了系统的脱氮能力。Nitrospira(NOB),由于无法适应OLRs波动的新环境,逐渐消失,表现出自养微生物在全曝气模式下无法与异养微生物竞争。AOBs丰度较低,但是结合氨氮的表观去除效率,说明AOBs的活性较高,结果与HE et al[25]结论一致。由表内的功能菌分类可知,实验运行模式决定了系统中脱氮除磷主要依赖于DNBs与DNPAOs,而在低限域内全曝气波动OLRs可以富集功能菌paracoccus与Meganema,为定向培养AGS功能提供了依据。
-
(1)低有机负荷区间内,提高OLRs可加快微生物生长代谢,也可加速AGS形成,但培养出的AGS稳定性不高,当OLRs降低时,易导致粒径较大的颗粒破碎。
(2)对于COD与TP的去除效果变化,低有机负荷区间内,升降OLRs不会影响AGS去除COD,但是会通过影响颗粒结构变化削弱自养微生物活性,而影响聚磷菌的活性。再颗粒化过程中,TP去除率逐渐上升,表明颗粒尺寸的变化与TP去除率具有相关性。
(3)对于含氮化合物的去除效果变化,低有机负荷区间内,OLRs的改变不会影响氨氮的去除,且硝化菌会逐渐适应新的环境,反应器内氨氮与亚硝氮并无累积阶段,但当升降OLRs时,当NO- 3-N的变化较为缓慢,只有当颗粒成形后,反应器内具有足够的厌氧空间,脱氮效率才能稳步提升。
(4)低有机负荷区间内,提高OLRs培养出的AGS,优势菌属为Paracoccus、Meganema,都具有反硝化能力,这得益于AGS的特殊结构,然而通过升降OLRs导致颗粒结构变化进而致使AGS内部环境发生变化,影响系统内菌种相对丰度,使得反应器内生态系统变得脆弱。
区间内低有机负荷波动对好氧颗粒污泥的响应
Response of aerobic granular sludge to fluctuation of low organic load in a limited range
-
摘要: 在低有机负荷区间(1.2~3.6 kg/(m3·d))内升降有机负荷率(OLRs),探究其对好氧颗粒污泥(AGS)的形成及污染物的去除影响。结果表明:连续提高OLRs,可促进颗粒污泥形成系统生物量增加;AGS形成过程,TP与TN去除效果逐步提高至98.75%与91.40%,且COD与
${\rm {NH}}_4^+ $ -N去除率均高于95%。连续降低OLRs时,大颗粒污泥出现裂解,TP与TN去除率降低;碎片再颗粒化时,TP去除率有上升趋势,而TN去除率随OLRs降低而降低。微生物多样性检测结果表明:OLRs波动系统培养出的优势菌为Paracoccus、Meganema,而其他类菌属相对丰度缩小,反应器内的生态系统变得脆弱。Abstract: The organic load rate (OLRs) was raised or reduced within the limit of 1.2~3.6 kg/(m3·d) to explore its influence on the formation of the aerobic granular sludge (AGS) and the removal of pollutants. The results showed that the persistent increase of OLRs could promote the particle formation and enrich the biomass. During the formation operation, the removal efficiency of TP and TN gradually elevated to 98.75% and 91.40%, and the removal efficiency of COD and${\rm {NH}}_4^+ $ -N were both greater than 95%. When OLRs was continuously reduced, large particles were cracked and the removal rates of TP and TN were decreased. When the fragments were granulated, the TP removal rate showed a positive trend, while the TN removal rate decreased with the decrease of OLRs. The microbial diversity test results showed that the dominant bacteria cultivated by OLRs were Paracoccus and Meganema, while the relative abundance of other bacteria decreased, resulting in a fragile ecosystem in the reactor.-
Key words:
- OLRs /
- particle structure /
- pollutants /
- nitrogen compounds /
- microbial diversity
-

-
表 1 接种污泥的基本特性
MLSS/g·L−1 MLVSS/MLSS 污泥粒径小于0.2 mm 污泥颜色 沉降速度/m·h−1 3.14 0.85 98% 棕黄色 15~25 表 2 试验条件设置
方案 t/d COD/mg·L−1 OLRs/kg·(m3·d)−1 第一阶段 0~9 400 1.2 第二阶段 10~38 800 2.4 第三阶段 39~67 1200 3.6 第四阶段 68~76 800 2.4 第五阶段 78~85 600 1.8 第六阶段 85~95 400 1.2 表 3 接种污泥与颗粒污泥细菌类型的丰富度和多样性比较
污泥 测序数目 OUT 数目 Shannon 指数 ACE 指数 Chao 指数 覆盖范围 Simpson指数 活性污泥 49482 2116 3.73 43161.45 21180.14 0.96 0.09 颗粒污泥 49513 1740 2.49 63023.63 20214.24 0.97 0.24 表 4 关键功能菌列表
基因水平关键功能菌属 相对丰度/% 参考
文献接种
污泥颗粒
污泥GAOs Sphingopyxis 1.32 0.2 [19] AOBs Nitrosomonas 0.093 0.004 [20] DNBs Rhodobacteraceae genus 2.09 0.18 [20] Roseovarius 0.62 0.38 [21] Rhodobacter 0.55 [20] Micavibrionales genus 19.14 7.71 [21] Meganema 2.03 21.45 [22] Hyphomicrobium 0.87 0.23 [21] Devosia 0.46 [23] Pseudofulvimonas 4.4 4.89 [21] Aquimonas 2.74 0.14 [21] Lysobater 1.15 [21] Azoarcus 0.52 4.48 [20] Thauera 0.51 1.61 [24] Total 36.4 85.04 NOBs Nitrospira 1.07 [24] DNPAOs Paracoccus 24.61 43.6 [21,23] Pseudomonas 0.17 [24,14] 注:*GAOs 聚糖菌;AOBs氨氧化菌;DNBs 反硝化菌;NOBs 硝化菌;DNPAOs 脱氮除磷菌。 -
[1] VAN LOOSDRECHT M C M, BRDJANOVIC D. Anticipating the next century of wastewater treatment[J]. Science, 2014, 344(6191): 1452 − 1453. doi: 10.1126/science.1255183 [2] ADAV S S, LEE D J, SHOW K Y, et al. Aerobic granular sludge: recent advances[J]. Biotechnology Advances, 2008, 26(5): 411 − 423. doi: 10.1016/j.biotechadv.2008.05.002 [3] NANCHARAIAH Y V, REDDY G K K. Aerobic granular sludge technology: mechanisms of granulation and biotechnological applications[J]. Bioresource Technology, 2018, 247: 1128 − 1143. doi: 10.1016/j.biortech.2017.09.131 [4] HE Q, ZHANG W, ZHANG S, et al. Enhanced nitrogen removal in an aerobic granular sequencing batch reactor performing simultaneous nitrification, endogenous denitrification and phosphorus removal with low superficial gas velocity[J]. Chemical Engineering Journal, 2017, 326: 1223 − 1231. doi: 10.1016/j.cej.2017.06.071 [5] TAY J H, PAN S, HE Y, et al. Effect of organic loading rate on aerobic granulation. II: Characteristics of aerobic granules[J]. Journal of Environmental Engineering, 2004, 130(10): 1102 − 1109. doi: 10.1061/(ASCE)0733-9372(2004)130:10(1102) [6] HAMZA R A, IORHEMEN O T, ZAGHLOUL M S, et al. Rapid formation and characterization of aerobic granules in pilot-scale sequential batch reactor for high-strength organic wastewater treatment[J]. Journal of Water Process Engineering, 2018, 22: 27 − 33. doi: 10.1016/j.jwpe.2018.01.002 [7] REN Y, FERRAZ F, KANG A J, et al. Treatment of old landfill leachate with high ammonium content using aerobic granular sludge[J]. Journal of Biological Engineering, 2017, 11(1): 42. doi: 10.1186/s13036-017-0085-0 [8] HAMZA R A, SHENG Z, IORHEMEN O T, et al. Impact of food-to-microorganisms ratio on the stability of aerobic granular sludge treating high-strength organic wastewater[J]. Water Research, 2018, 147: 287 − 298. doi: 10.1016/j.watres.2018.09.061 [9] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社. 2002. [10] 彭永臻, 吴蕾, 马勇, 等. 好氧颗粒污泥的形成机制、特性及应用研究进展[J]. 环境科学, 2010, 31(2): 273 − 281. [11] LIAO R, LI Y, WANG Z, et al. 454 pyrosequencing analysis on microbial diversity of an expanded granular sludge bed reactor treating high NaCl and nitrate concentration wastewater[J]. Biotechnology and Bioprocess Engineering, 2014, 19(1): 183 − 190. doi: 10.1007/s12257-013-0387-0 [12] ZHU D, TANABE S H, YANG C, et al. Bacterial community composition of South China Sea sediments through pyrosequencing-based analysis of 16S rRNA genes[J]. PloS ONE, 2013, 8(10): 496 − 501. [13] LUO J, HAO T, WEI L, et al. Impact of influent COD/N ratio on disintegration of aerobic granular sludge[J]. Water Research, 2014, 62: 127 − 135. doi: 10.1016/j.watres.2014.05.037 [14] HE Q, ZHOU J, WANG H, et al. Microbial population dynamics during sludge granulation in an A/O/A sequencing batch reactor[J]. Bioresource Technology, 2016, 214: 1 − 8. doi: 10.1016/j.biortech.2016.04.088 [15] LUO J, LIANG H, YAN L, et al. Microbial community structures in a closed raw water distribution system biofilm as revealed by 454-pyrosequencing analysis and the effect of microbial biofilm communities on raw water quality[J]. Bioresource Technology, 2013, 148: 189 − 195. doi: 10.1016/j.biortech.2013.08.109 [16] ZHOU Z, QIAO W, XING C, et al. Microbial community structure of anoxic–oxic-settling-anaerobic sludge reduction process revealed by 454-pyrosequencing[J]. Chemical Engineering Journal, 2015, 266: 249 − 257. doi: 10.1016/j.cej.2014.12.095 [17] ZHOU J H, ZHOU Y C, YU H C, et al. Determining the effects of aeration intensity and reactor height to diameter (H/D) ratio on granule stability based on bubble behavior analysis[J]. Environmental Science and Pollution Research, 2019, 26(1): 784 − 796. doi: 10.1007/s11356-018-3666-7 [18] KANG A J, YUAN Q. Long-term stability and nutrient removal efficiency of aerobic granules at low organic loads[J]. Bioresource Technology, 2017, 234: 336 − 342. doi: 10.1016/j.biortech.2017.03.057 [19] JIAO S, CHEN W, WANG E, et al. Microbial succession in response to pollutants in batch-enrichment culture[J]. Scientific Reports, 2016, 6: 21791. doi: 10.1038/srep21791 [20] MILLER M B, Bassler B L. Quorum sensing in bacteria[J]. Annual Reviews in Microbiology, 2001, 55(1): 165 − 199. doi: 10.1146/annurev.micro.55.1.165 [21] DU S, YU D, ZHAO J, et al. Achieving deep-level nutrient removal via combined denitrifying phosphorus removal and simultaneous partial nitrification-endogenous denitrification process in a single-sludge sequencing batch reactor[J]. Bioresource Technology, 2019, 289: 121690. doi: 10.1016/j.biortech.2019.121690 [22] SZABÓ E, LIÉBANA R, HERMANSSON M, et al. Microbial population dynamics and ecosystem functions of anoxic/aerobic granular sludge in sequencing batch reactors operated at different organic loading rates[J]. Frontiers in Microbiology, 2017, 8: 770. doi: 10.3389/fmicb.2017.00770 [23] RAMOS C, SUÁREZ-OJEDA M E, CARRERA J. Long-term impact of salinity on the performance and microbial population of an aerobic granular reactor treating a high-strength aromatic wastewater[J]. Bioresource Technology, 2015, 198: 844 − 851. doi: 10.1016/j.biortech.2015.09.084 [24] WANG H, SONG Q, WANG J, et al. Simultaneous nitrification, denitrification and phosphorus removal in an aerobic granular sludge sequencing batch reactor with high dissolved oxygen: effects of carbon to nitrogen ratios[J]. Science of the Total Environment, 2018, 642: 1145 − 1152. doi: 10.1016/j.scitotenv.2018.06.081 [25] HE Q, CHEN L, ZHANG S, et al. Hydrodynamic shear force shaped the microbial community and function in the aerobic granular sequencing batch reactors for low carbon to nitrogen (C/N) municipal wastewater treatment[J]. Bioresource Technology, 2019, 271: 48 − 58. doi: 10.1016/j.biortech.2018.09.102 -





 下载:
下载: