-
有机磷、氨基甲酸酯类农药具有广谱杀虫性、降解快、生物积累量低等特点,因此在粮食生产、果蔬栽培等领域得到了广泛应用[1]。近年来,由于农药被过度使用,导致其在粮食、果蔬和环境水体中残留程度不一,对环境和人体健康造成了潜在危害[2]。因此,建立一种快速、简便的定量方法来提纯富集环境水样中农药的含量尤为重要[3]。
在进行农药富集过程时,样品前处理技术显得尤为重要[4]。常用方法有固相萃取(SPE)[5]、磁性固相萃取(MSPE)[6]、液相微萃取(LPME)[7]和分散液相微萃取(DLLME)[8-11]。但这些方式仍存在缺点,如DLLME的萃取过程会降低分析物与萃取剂的分配系数,导致萃取效率下降[12-14]。为克服这一问题,磁力搅拌[15]、超声波[16]和涡旋[17]等技术的运用可有效改善分析物与萃取剂的分配系数。因此,开发一种合理的样品前处理技术显得尤为重要。
离子液体的应用是分析化学领域的一个研究热点,主要是因为离子液体(ILs)是非分子溶剂,在低于100 ℃的温度下保持液态,具有许多独特的性质,如可变粘度、高导电性和高热稳定性等[18]。例如,研究人员提出的基于离子液体-分散液液微萃取(IL-DLLME)方法来替代传统的分散液液微萃取(DLLME)方法[19-20],该方法不仅扩大了萃取溶剂的范围,还降低了有毒挥发性溶剂对操作人员的潜在危害。YOU et al[21]结合AALLME和IL-DLLME的优点,提出空气辅助液-液微萃取-离子液体(IL-AALLME)技术,该技术仅使用了少量的离子液体作为萃取溶剂,便得到了良好的实验结果。而空气辅助液-液微萃取-离子液体联用高效液相色谱-紫外法(HPLC-UV)还没有应用于水样中农药的分析。
因此,本文利用液-液微萃取技术和离子液体作为样品前处理,对水样中7种农药进行提取,再利用高效液相色谱测定目标物含量。此外,该实验还将对检测波长、流动相比、离子液体类型和体积、萃取时间、盐效应、pH等实验变量进行评估和优化。
-
所有化学品均为试剂级。甲砜霉素、氟苯尼考、水胺硫磷、甲基-对硫磷、三唑磷、甲基-毒死蜱和毒死蜱购自Sigma(美国)。[BMIM]PF6、[HMIM]PF6和[OMIM]PF6均购自Energy Chemical。NaCl是从Merck (Darmstadt, Germany)购买的。实际水样:自来水(重庆,西南大学实验室)和崇德湖(绵阳,中国),二者分别经滤纸过滤后储存于冰箱内。
称取一定量的各对照品于10 mL容量瓶中,甲醇稀释至刻度得到标准溶液(甲砜霉素、氟苯尼考、水胺硫磷、甲基-对硫磷、三唑磷、甲基-毒死蜱和毒死蜱)。最后将得到的标准品溶液作为储备液,置于4 ℃冰箱避光保存备用。
-
日本岛津LC-20A高效液相色谱仪(包括SPD-20A紫外检测器、CTO-10AS柱温箱、LC-20AT泵),KH-3200B型超声波清洗器购买于昆山禾创超声仪器有限公司,SZ-2自动双重纯化水蒸馏装置购买于上海泸西分析仪器厂,XY型电热恒温干燥箱购买于上海精宏实验设备有限公司,FA2004A型分析天平购买于上海精天电子仪器有限公司,微量注射器(100 µL)。
色谱条件:RP-InertSustain C18 (150 mm×4.6 mm, 5 μm)。流动相A:甲醇,流动相B:0.1%乙酸溶液(pH 3.0),进行线性梯度洗脱;流速:0.8 mL/min;进样量:20 μL;检测波长:225 nm;柱温:35 ℃。
-
将一定量的水样和0.4 g NaCl同时放入15 mL含螺旋盖玻璃试管中,再取40 μL离子液体 ([BMIM] PF6)注入试管混匀;在此过程中,用针管将混合物不断地反复抽动,促使离子液体以细小的液滴形式分散在水样中;再对试管进行超声和离心,保留下层液体相并将其溶解于50 μL甲醇中。最后,微量注射器取20 μL注入高效液相色谱系统进行分析。
-
为得到最佳的萃取条件,本实验进行了检测波长、流动相比、离子液体类型和体积、萃取时间和盐效应等一系列条件评估及优化,所有实验均为3次(n=3)。
-
本实验分析了7种目标分析物的最佳波长,并决定研究波长为210、215、220、225和230 nm。结果表明,在225 nm处,7种目标物的峰面积最大,峰形最佳。因此,后续实验研究选择225 nm作为检测波长。
-
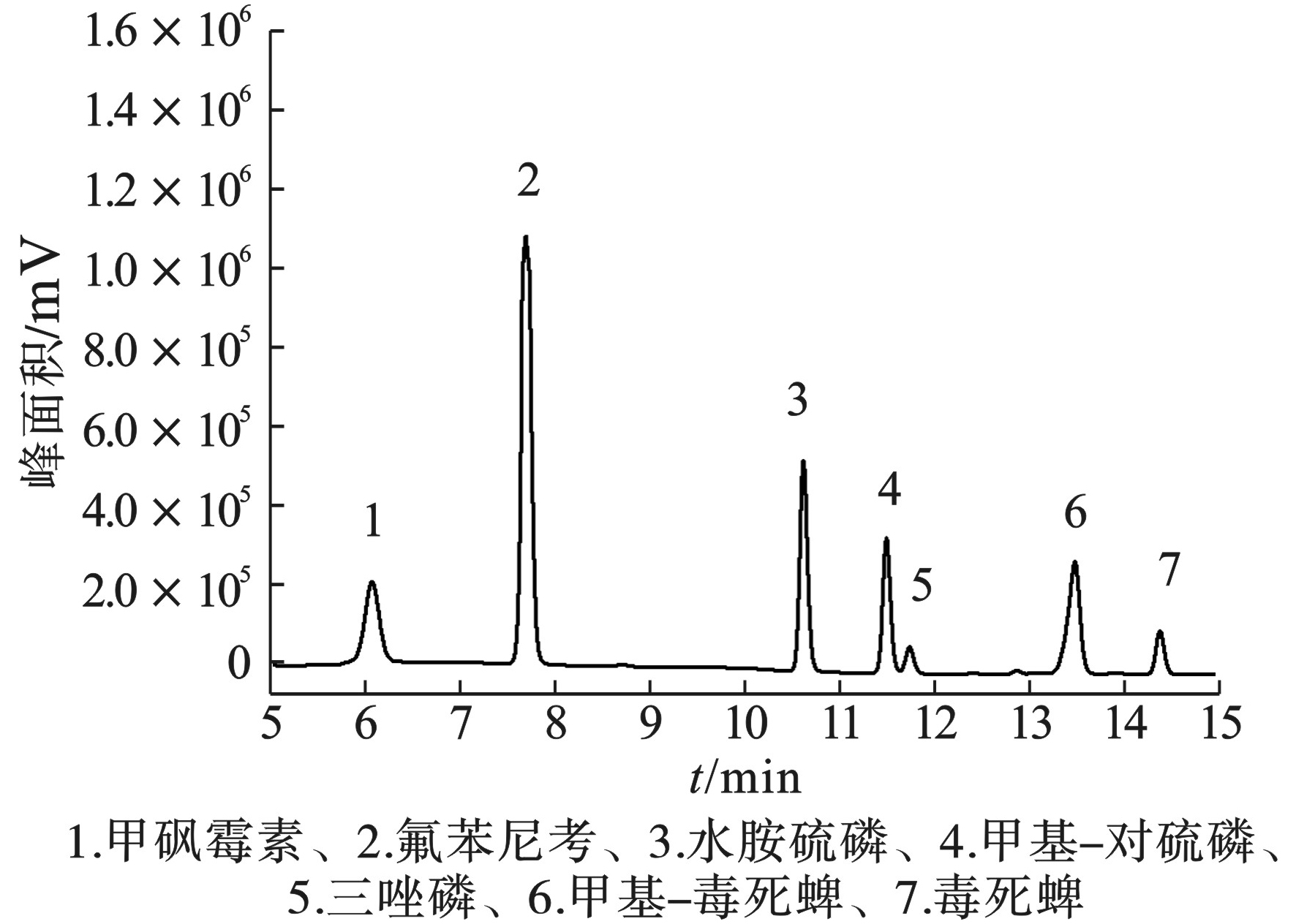
高效液相色谱中流动相的选择是影响分辨率的关键因素。本实验研究了甲醇水溶液的不同体积比(甲醇-0.3%乙酸、甲醇-0.2%乙酸、甲醇-0.1%乙酸)。结果显示,当选择甲醇-0.1%乙酸为流动相时,7种目标物的分离效果最好。因此,选择甲醇-0.1%乙酸作为流动相进行实验。在最佳色谱条件下,得到最佳色谱图,见图1。
-
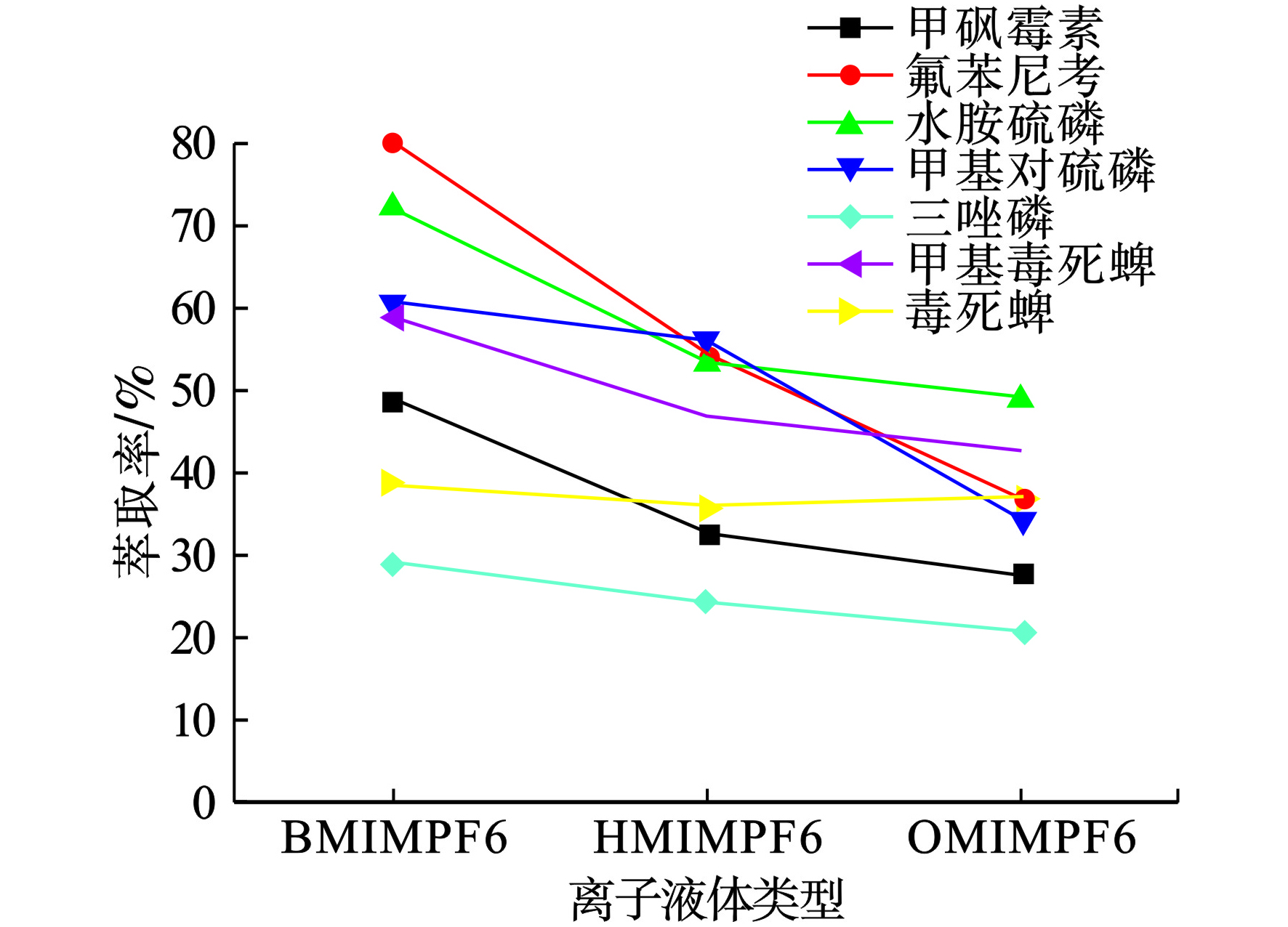
萃取溶剂在萃取过程中起着重要的作用,萃取溶剂必须具备低毒性、密度比水低、分析物萃取效率高、室温下熔点低且与HPLC色谱分离相容等特征[15, 22]。为了选择合适的萃取溶剂,本文研究了离子液体([BMIM]PF6、[OMIM]PF6和[HMIM]PF6)的影响,见图2。
图2可见,[BMIM]PF6的萃取效率优于其他两种,这可能是因为它对目标分析物有更好的溶解能力。因此,后续试验选择[BMIM]PF6作为萃取溶剂。
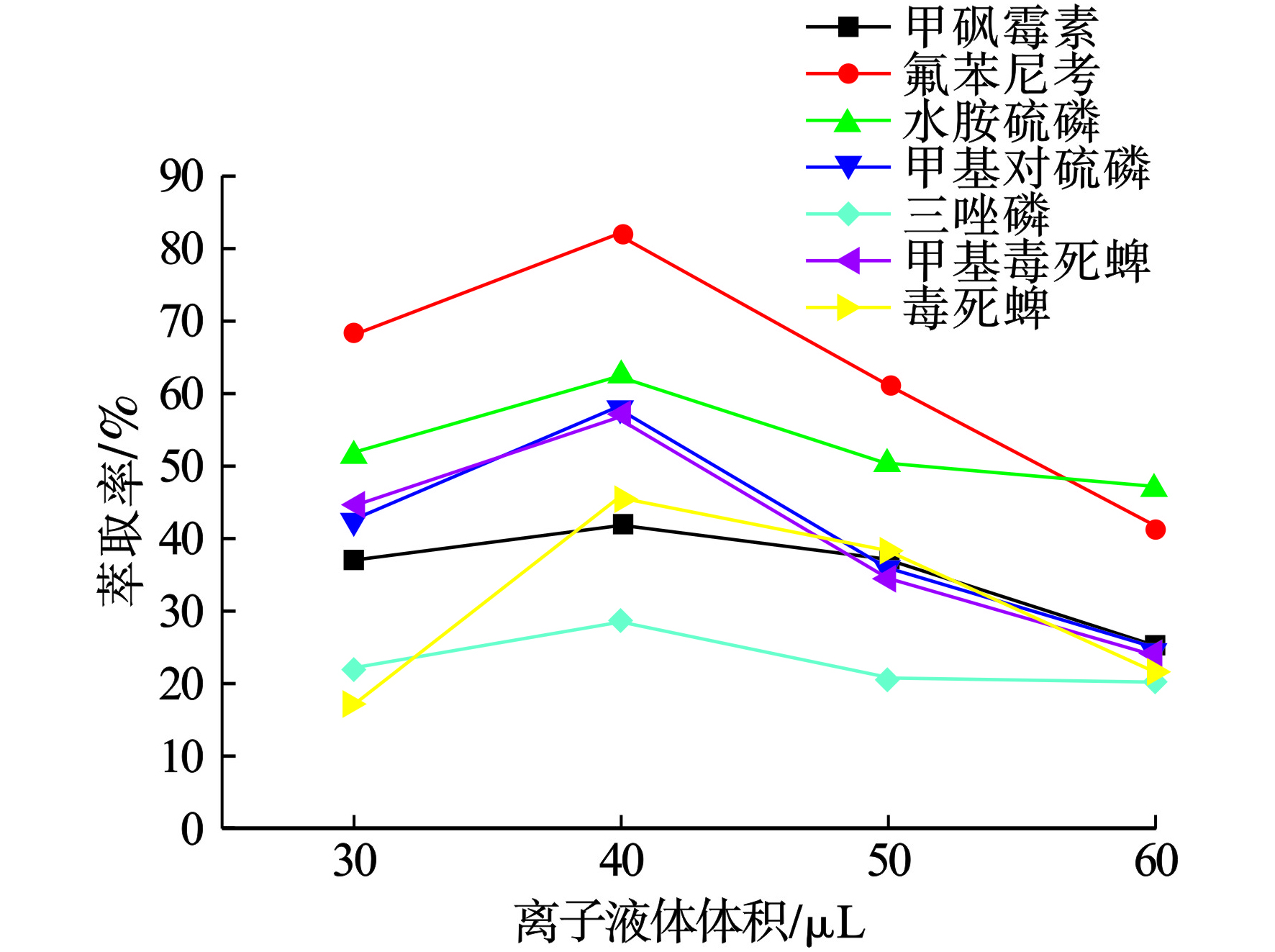
为了获得最优萃取体积,考察了不同体积[BMIM] PF6(30~60 μL)的影响。当体积从30增加到40 μL时,目标分析物的萃取率逐渐上升,当再增加离子液体体积时,目标分析物的萃取率逐渐降低。因此,后续实验研究选择[BMIM] PF6体积为40 μL,见图3。
-
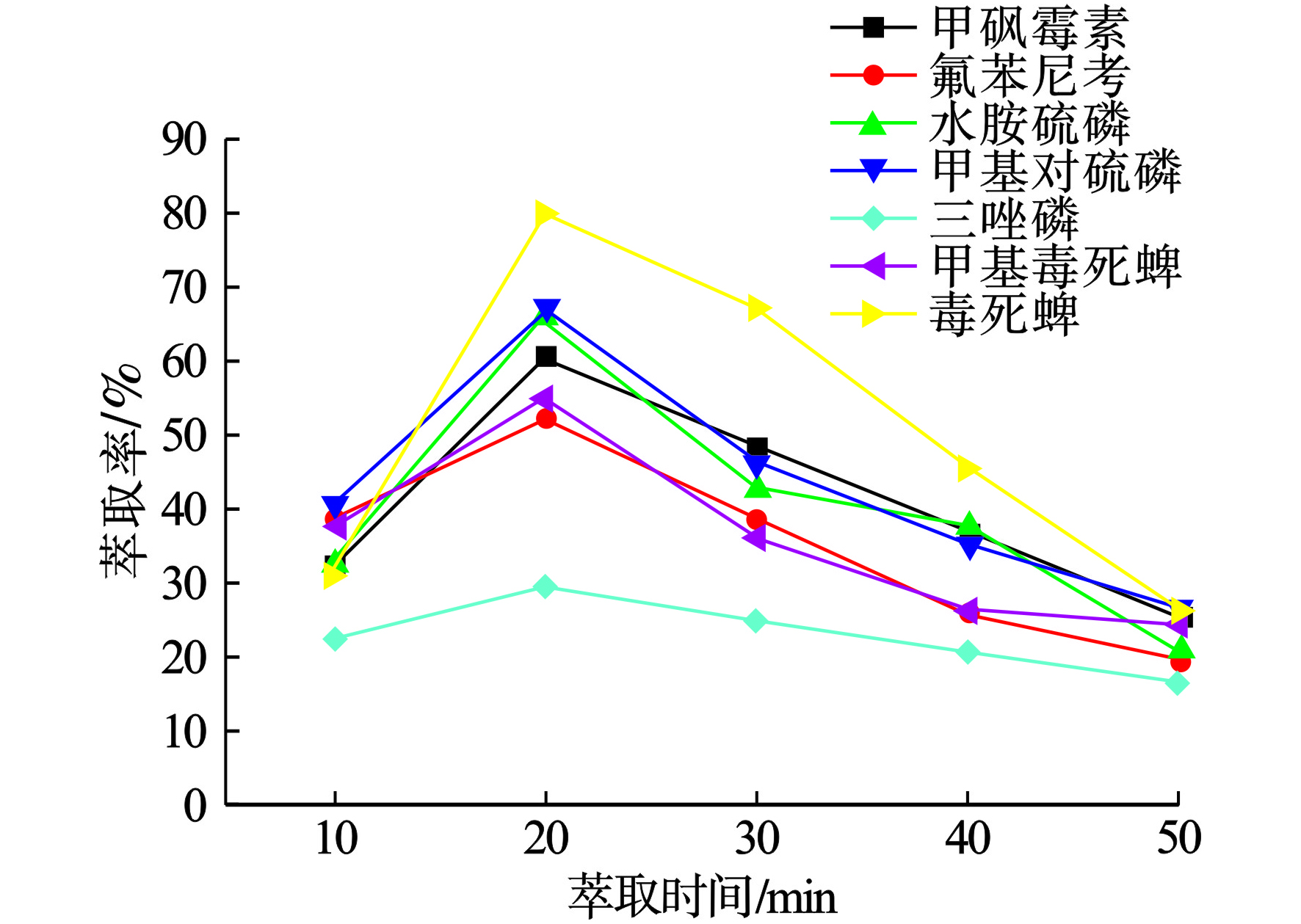
实验探讨了萃取时间(10~50 min)对实验结果的影响。当提取时间从10增加到20 min时,各种农药均有较好的峰面积及萃取率。然而,当时间被延长后,目标分析物不能得到良好的峰面积且部分目标物萃取率逐渐降低,因此,在后续研究中选取萃取时间为20 min见图4。
-
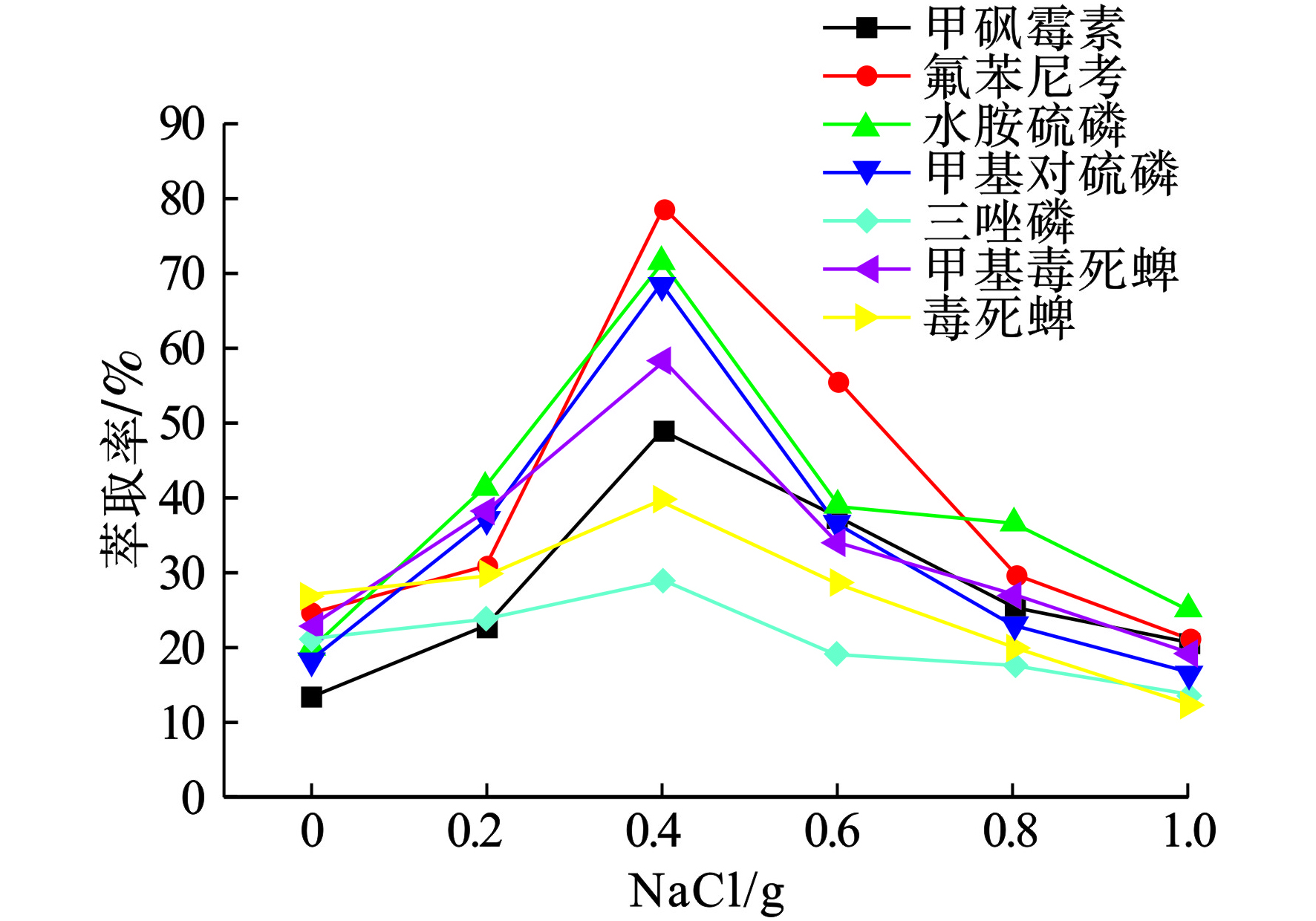
无机盐的加入会对提取结果产生不同的影响[22-23]。一方面,盐效应可能会降低分析物在水溶液中的溶解度,进而改变在有机相中的分配[24-26]。另一方面,随着离子强度增加,水溶液的粘度和密度也增强,从而降低传质效率过程[27]。此外,离子交换过程可以增强ILs在水相中的溶解度并降低提取效率[28]。因此,本文研究了氯化钠的量(0~1.0 g)对实验的影响,见图5。
图5可见,当盐的用量从0增加到0.4 g时,有利于提高水相中萃取溶剂的萃取效率,而随着盐的增加(0.4~1.0 g),许多目标分析物在高离子强度下受到抑制,并呈现出降低趋势。因此,后续实验使用0.4 g NaCl进行。
-
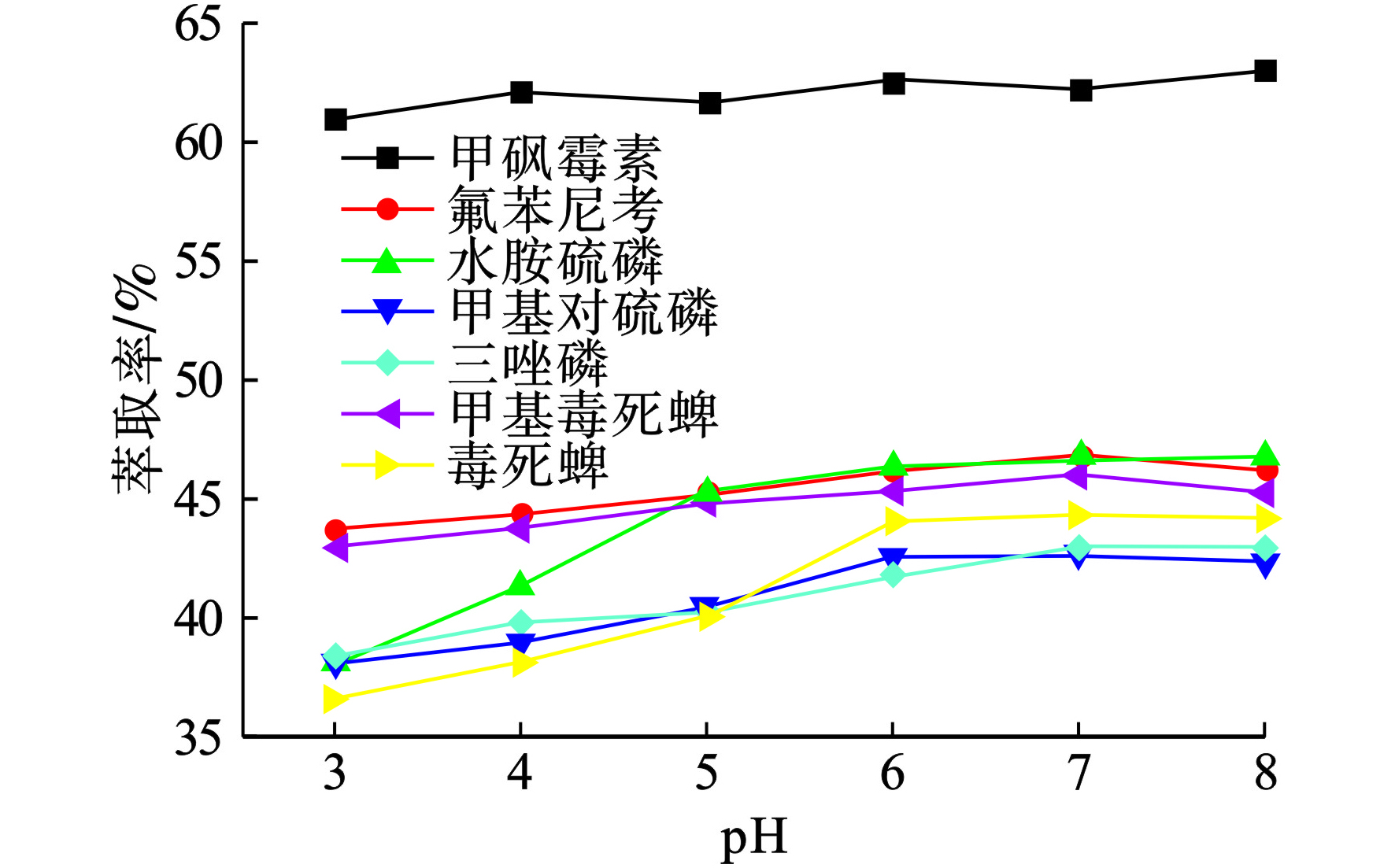
pH影响目标分析物的存在形式,因此探究了pH对IL-AALLME萃取效率的影响。该过程用CH3COOH和NaOH调节pH。当pH在3~7之间时,目标分析物的萃取率呈上升趋势;而随着pH从7增加到8时萃取率略有下降,见图6。
图6可见,pH值选择6~7进行后续研究且不需要对样品进行pH调整。
-
为了对该方法进行评估,在优化的提取条件下进行了一系列线性和重复性实验,研究了该方法的可行性。最后,通过绘制平均峰面积与样品质量浓度的关系,得到了标准曲线。各目标分析物的线性方程及线性范围,见表1。7种农药在各自的线性范围内线性关系良好,相关系数(γ
)均不小于0.999 3。 -
为了在实际样品分析中对所提出的方法进行评价,本实验对绵阳市崇德湖和实验室自来水进行了水样分析。该过程向选择的两种样品溶液中分别加入标准分析物量10、20和30 μL并计算其回收率,结果见表2。
表2可知,两种水样中7种分析物的平均回收率分别为95.52%~97.12%和96.90%~104.06%。与此同时,崇德湖和自来水的RSD分别为1.88%~4.24%和2.57%~4.86%。结果表明,该方法用于环境水样中农药的分析是可靠的。
-
移取混合标准品溶液在相同色谱条件下重复进样6次,测定各个标准品的峰面积,结果表明甲砜霉素、氟苯尼考、水胺硫磷、甲基-对硫磷、三唑磷、甲基-毒死蜱和毒死蜱对照品的峰面积相对标准偏差均在123%~1.39%之间,试验结果表明仪器精密度良好。
-
用同一供试品溶液在两天内每间隔6 h连续进样测定,结果表明7种有效成分峰面积的相对标准偏差均在0.98%~2.12%之间,试验结果表明供试品溶液稳定性良好。
-
取同一时间点,同一地方水样6份,制备供试品溶液,进样分析,计算得到7种有效成分峰面积的相对标准偏差(n=6)在1.32%~1.72%之间,试验结果表明高效液相色谱仪仪器重复性良好。
-
本研究结合AALLME与IL-DLLME的优点成功检测出水样中7种农药成分含量。其中离子液体作为主要萃取溶剂,再结合液-液微萃取技术作为样品前处理,富集提纯目标物,HPLC技术进行分离分析。该过程与传统的前处理方法相比,不仅有助于解决预处理过程中耗时、劳动强度大的问题,还具有简便、快速和高效等特点,满足水样中农药的有效提取和准确测定,是一种环境友好型的分析方法。因此,该法有望成为水样中农药检测的新方法。
液-液微萃取技术测定环境水样中7种农药
Liquid–liquid Microextraction for the Determination of Seven Pesticides in Environmental Water Samples
-
摘要: 该研究建立了一种新型高效液相色谱-紫外分光光度法(HPLC-UV) 测定环境水样中7种农药含量。在优化后的条件下,使用离子液体作为萃取溶剂,与水样混合均匀促使其形成乳液,再利用液-液微萃取技术提取出目标物,该过程对环境友好无害。在最佳条件下,7种农药分离良好、标准曲线线性良好、相关系数(γ)均不小于0.999 3。结果还表明,自来水和崇德湖的相对标准偏差(RSD)分别为1.88%~4.24%和2.57%~4.86%。自来水和崇德湖的加标回收率分别为95.52%~97.12%和96.90%~104.06%。Abstract: An improved effective high performance liquid chromatography coupled to a ultraviolet detection (HPLC-UV) was developed for the determination of seven pesticides in environmental water samples in the study. The ionic liquid was used as the extraction solvent and mixed with the aqueous sample solution, thus forming the emulsion under the improved conditions. The target objects of the mixed solution were extracted by liquid-liquid microextraction technology. The process was harmless to the environment. Under the optimized conditions, the seven pesticides were well separated. The standard curves were in a good linear curve with the correlation coefficient r≥0.999 3. The results shown that the relative standard deviations (RSD) for tap water and Chongde Lake were 1.88%~4.24% and 2.57%~4.86%, respectively. And the recovery rates of spiked samples was in the range from 95.52% to 97.12% and from 96.90% to 104.06%, respectively.
-
Key words:
- Liquid–liquid Microextraction /
- Ionic Liquid /
- HPLC-UV /
- Pesticides
-
我国是世界上畜禽养殖第一大国,畜禽养殖业排放化学需氧量(chemical oxygen demand, COD)、氨氮和总氮的量占农业污染排放总量的比例分别达到了95.2%、76.8%和62.4%[1]。畜禽养殖过程产生大量高氨氮有机废水,已成为水体污染的最主要来源,对这部分废水的有效处理成为畜禽养殖业污染控制的关键[2]。对于畜禽养殖废水的处理通常采用除碳+脱氮的耦合工艺,其中除碳过程通过厌氧消化将有机物转化为甲烷回收,而脱氮过程往往采用生物脱氮方法。传统的生物脱氮技术需要结合自养菌的好氧硝化作用和异养菌的缺氧反硝化作用,但是,当硝化和反硝化在2个独立单元中进行时(如A/O工艺),需要进行混合液回流,通常具有占地面积大和建设投资成本高等缺点。虽然当硝化和反硝化在同一个反应器内(SBR工艺)进行时,能够节省占地和成本,但需要分时段控制曝气和投加碳源,增加了操作复杂性。在处理畜禽养殖废水的厌氧消化液时,一方面,高氨氮质量浓度易对自养硝化产生抑制;另一方面,厌氧消化处理后出水中仍会残留很多有机物,这将进一步抑制自养硝化效果。因此,十分有必要开发更适宜的高氨氮有机废水处理技术。
异养硝化-好氧反硝化(heterotrophic nitrification-aerobic denitrification, HN-AD)菌能够适应高质量浓度的氨氮和有机物,通过异养硝化与好氧反硝化作用的耦合,在好氧条件下能够将废水中的氨氮转化为氮气,实现高效脱氮,整个代谢过程几乎没有亚硝态氮/硝态氮的积累,同时有机物也得到了降解和去除。1984年,ROBERTSON等[3]将首株HN-AD菌Thiosphaera pantotropha从硫氧化脱硝废水处理装置中分离出来。近年来,越来越多的HN-AD菌被发现,它们大多具有世代时间短和耐受性强等优势,对高质量浓度的氨氮和有机物有较好的耐受和处理效果[4]。HN-AD菌Comamonas WXZ-17可耐受817 mg·L−1的氨氮质量浓度,Acinetobacter sp. TN-14能在氨氮质量浓度高达1 200 mg·L−1的环境下生长[5]。HN-AD菌耐受高氨氮的同时能实现对其转化脱除,如Thauera sp. SND5的平均氮去除速率约为2.85 mg·(L·h)−1[6];Bacillus methylotrophicus L7在初始氨氮质量浓度为1 121.2 mg·L−1的条件下,总氮去除速率可达3.8 mg·(L·h)−1[7]。因此,HN-AD技术可以适应高氨氮有机废水的脱氮处理,反应速率高、处理时间短,同时能够在同一个处理单元中在好氧条件下实现有机物和氨氮、总氮的同步去除,降低工艺复杂度,有望为高氨氮有机废水提供一种具有更高效率和更低成本的新技术。目前相关的研究以纯菌HN-AD系统较多,而实际工程中很难做到纯菌环境,那么具有HN-AD功能的污泥驯化就非常重要,是实现技术应用的关键,然而相关的研究仍然较为缺乏。SONG等[8]针对高盐榨菜废水的处理,经过105 d驯化建立了HN-AD混菌系统,COD和总氮去除率分别达到了93.2%和82.4%。但是,上述方法的驯化时间长,系统启动较慢,迫切需要一种在实际应用场景中低成本、快速、有效驯化具有HN-AD功能活性污泥的方法以及有机碳源对系统运行的影响及其优化相关的研究。
因此,本研究考察了在固定C/N比条件下驯化HN-AD活性污泥的方法,并进行了HN-AD效果验证,选择了3种碳源以探究碳源种类和C/N比对系统运行效果的影响,分析了系统中有机物降解和脱氮的动力学特征,揭示了系统中的优势功能菌,以期为实际工程中畜禽养殖废水厌氧消化液等高氨氮有机废水的高效处理提供技术支撑。
1. 材料与方法
1.1 实验装置与材料
本研究采用间歇式反应器,材质为有机玻璃,内径为150 mm,主体高170 mm,有效容积为3.0 L。在反应器底部放置曝气盘,外接空气曝气泵,同时,在反应器上方设搅拌桨充分混合活性污泥和废水,以确保溶解氧(DO)分布均匀。反应器中插有pH和DO电极,用于在线监测pH和DO。
实验用水选用模拟配水,以NH4Cl(100~600 mg·L−1, 以氮浓度计)作为氮源,添加KH2PO4(20 mg·L−1, 以磷浓度计)补充磷源,添加微量元素(1 mL·L−1),添加乙酸钠、柠檬酸钠、丁二酸钠的混合碳源(溶液中三者的COD比=1:1:1)作为生物可利用有机碳源(2 000~12 000 mg·L−1,以COD计)。通过调整进水碳源和氮源质量浓度以控制配水的碳氮比。
1.2 实验装置运行实验
反应器采用序批式运行模式,每个周期分为5个阶段:进水(10 min)、曝气加搅拌运行、沉降(20 min)、出水(10 min)、空闲(1 h)。反应在室温下运行,通过实时监测DO来控制曝气阶段的运行时长,采用蠕动泵进水和排水,出水阶段排水比为0.25。实验装置共运行175 d,设置了系统启动、进水负荷提升和C/N比优化3个阶段。
第Ⅰ阶段:启动HN-AD系统,将北京某污水厂二沉池的活性污泥投入反应器,通过定期排泥(污泥龄12~15 d)排出部分死菌和细胞分泌物,以维持微生物的新陈代谢活性。初始进水COD和氨氮质量浓度分别为2 000 mg·L−1 和100 mg·L−1。根据自养氨氧化过程,每氧化1 g氨氮需要消耗7.14 g碱度(以碳酸钙计),在进水中投加NaHCO3补充至所需碱度。保持C/N比为20,逐步提高进水氨氮质量浓度(每5个周期提升100 mg·L−1)来驯化HN-AD菌群。验证HN-AD系统,当系统启动成功后不再额外补充碱度。第Ⅱ阶段:HN-AD系统的进水氨氮质量浓度进一步提升到300 mg·L−1,待系统运行稳定后,每5个周期提升100 mg·L−1,逐步将进水氨氮提升至600 mg·L−1。第Ⅲ阶段:保持进水氨氮质量浓度为600 mg·L−1,探究不同C/N比(15、20、25)对HN-AD系统脱氮效率的影响,优化出最佳运行条件。
1.3 异养硝化-好氧反硝化验证实验
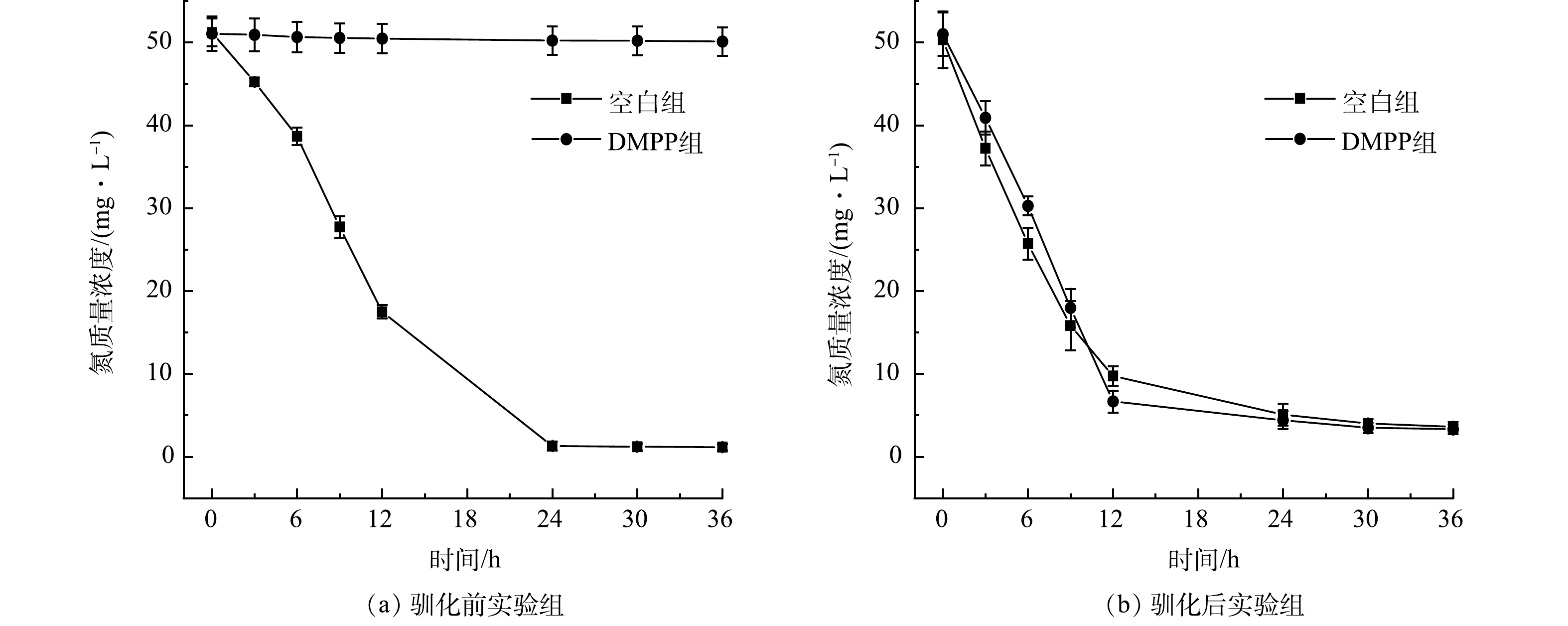
从反应器中取出50 mL活性污泥,移至250 mL锥形瓶,随后加入50 mL模拟配水进行实验。设置模拟配水中C/N=20,采用混合碳源(乙酸钠、丁二酸钠和柠檬酸钠的COD比=1:1:1)。模拟配水中进水氨氮质量浓度为100 mg·L−1。在实验组中添加自养硝化抑制剂3,4-二甲基吡唑磷酸盐(C5H8N2·H3O4P,DMPP),于25 ℃、160 r·min−1振荡培养36 h,每间隔一段时间取水样测试氨氮、硝态氮、亚硝态氮的质量浓度。
1.4 有机碳源影响实验
相比于糖类等大分子物质,乙酸钠、柠檬酸钠和丁二酸钠等小分子更容易被HN-AD菌所利用,能够直接参与三羧酸循环代谢过程。考虑到畜禽养殖废水厌氧消化液中常含有小分子挥发性脂肪酸的特点,因此,本研究选用乙酸钠、柠檬酸钠和丁二酸钠作为实验所用碳源,以研究碳源种类的影响。
从反应器中取出50 mL活性污泥,移至250 mL锥形瓶,随后加入50 mL模拟配水(含氨氮200 mg·L−1)进行实验。在模拟配水中,分别采用乙酸钠、丁二酸钠、柠檬酸钠及3种有机物作为混合碳源,以确保锥形瓶内在进水后的初始COD和氨氮质量浓度分别为2 000 mg·L−1和100 mg·L−1,于25 ℃、160 r·min−1振荡培养36 h,每间隔一段时间取水样测试氨氮、硝态氮、亚硝态氮的质量浓度。
1.5 氨氮和有机物去除动力学
HN-AD系统启动成功并稳定运行后,在初始有机物和氨氮质量浓度分别为3 000 mg·L−1和150 mg·L−1的单个周期,实时监测COD值、氮质量浓度变化。采用修正的Gompertz模型[9](式(1))对底物去除过程进行拟合,解析底物质量浓度与反应时间的关系。
stringUtils.convertMath(!{formula.content}) (1) 式中:S为t时刻底物质量浓度,mg·L−1;S0为初始底物质量浓度,mg·L−1;Rm为最大去除速率,mg·(L·h)−1;t0为迟滞时间,h。
1.6 分析检测方法
1)常规水质分析方法。COD值和各种氮化合物的质量浓度用标准方法测定。用纳氏分光光度法在425 nm处测定氨氮,用比色法在540 nm处测定亚硝态氮,用紫外分光光度法在220 nm和275 nm处测量硝态氮。用手持便携式分析仪测量pH和溶解氧(德国WTW Multi 3320)。铵(NH4+-N)由于水解反应会转化为分子态氨,也称为游离氨(free ammonia, FA),FA质量浓度由NH4+-N、pH和温度确定,根据式(2)[10]进行计算。
stringUtils.convertMath(!{formula.content}) (2) 式中:ρFA为游离氨质量浓度,mg·L−1;
CNH+4-N 2)微生物群落结构测定。从反应器中取一定量的活性污泥,根据E.Z.N.A.® soil DNA kit(Omega Bio-tek, Norcross,美国)说明书进行微生物群落总DNA抽提,用NanoDrop2000(赛默飞世尔科技,美国)测定DNA的浓度和纯度。使用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)对16S rRNA基因V3~V4可变区进行PCR扩增,并用琼脂糖凝胶电泳检测PCR结果。使用Illumina MiSeq平台(美吉生物医药科技有限公司,上海)对纯化的聚合酶链反应产物进行测序。
2. 结果与讨论
2.1 异养硝化系统的启动与验证
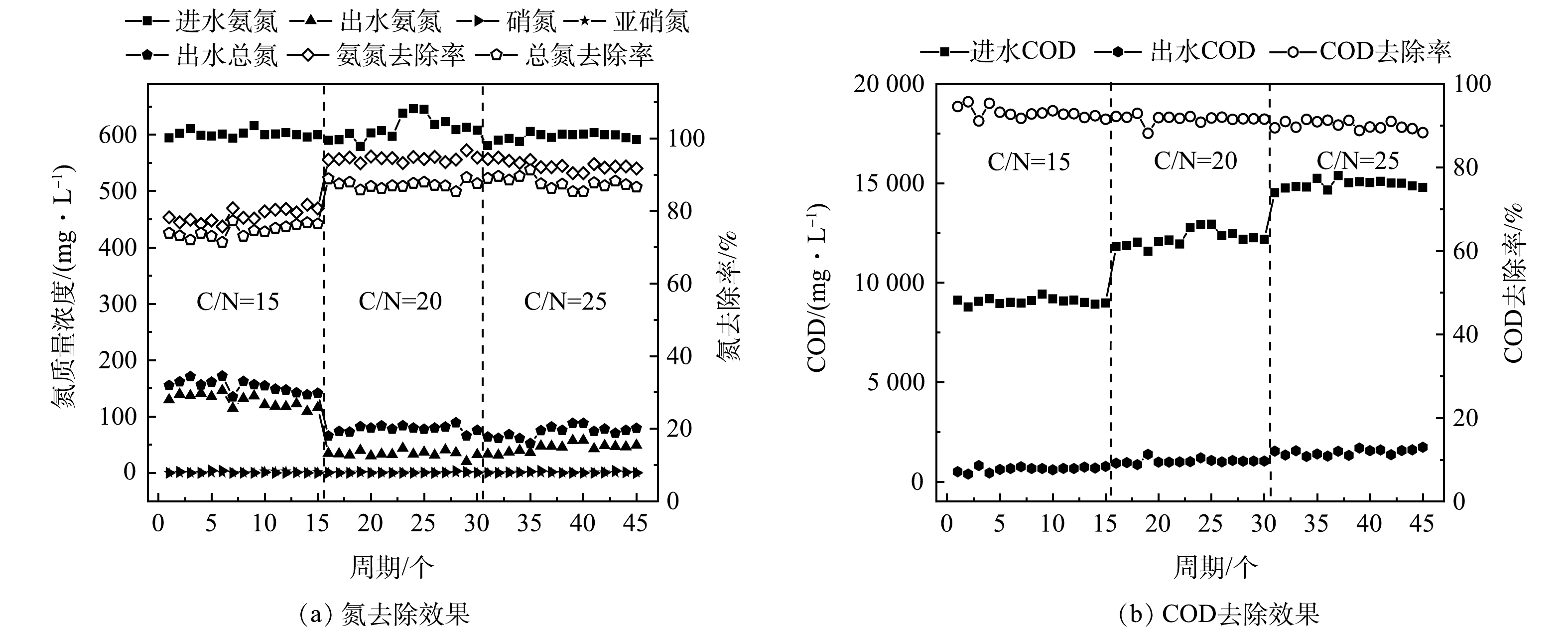
在C/N比为20的条件下,通过进水氨氮质量浓度的梯度提升来驯化活性污泥,增加HN-AD菌的相对丰度,进而构建HN-AD脱氮系统,结果如图1所示。结果表明,系统启动初始,进水氨氮质量浓度为100 mg·L−1,逐步提升进水氨氮质量浓度,在1~10周期(进水氨氮≤200 mg·L−1),氨氮去除率(>95%)较高,出水中亚硝态氮质量浓度(<0.1 mg·L−1)较低,但积累了一定质量浓度的硝态氮(>20 mg·L−1),推测系统中发生了以自养硝化为主的硝化过程,此时总氮去除率只有约38%。由图2(a)可见,在系统启动初期(第7周期)的反应过程可以看出,随着氨氧化的进行,亚硝态氮质量浓度先升高后降低,硝态氮质量浓度逐步升高并出现积累。在该周期的反应过程中,游离氨质量浓度在6 h时升至20 mg·L−1,高于抑制亚硝酸盐氧化菌(nitrite oxidizing bacteria, NOB)的FA阈值(0.1~5.0 mg·L−1),亚硝态氮出现积累且质量浓度到达峰值(9 mg·L−1),但随着反应的进行,FA质量浓度迅速降低至5 mg·L−1以下,亚硝态氮积累消失且硝态氮质量浓度不断上升。
由图1可见,在第11周期,将进水氨氮质量浓度提升至300 mg·L−1,对应进水FA达到76.8 mg·L−1,已高于大多数研究报道的自养氨氧化菌(ammonia oxidizing bacteria, AOB)和NOB的抑制阈值。虽然该周期氨氮去除率降低至76%,但出水中不再有硝态氮累积(<2 mg·L−1),总氮去除率达到67.8%,从这一周期开始,系统不再额外补充碱度。当FA质量浓度为20~40 mg·L−1时,自养AOB的氨氧化性能会受到严重影响[11],而HN-AD菌属,如Acinetobacter YB、Bacillus WXZ-8和Zobellella DN-7等,在较高质量浓度FA时(>100 mg·L−1)仍能正常发挥氨氧化功能[12-13]。由此可知,异养硝化菌对FA的耐受能力远高于自养硝化菌,推断此时系统中较高质量浓度的FA抑制了自养AOB,硝化作用主要由HN-AD菌贡献。随着反应器运行,HN-AD系统脱氮性能不断提升。由图2(b)可见,第15周期的氨氮去除率和总氮去除率分别提升至92%和83%,有机物和氨氮实现了同步降解,并且未出现硝态氮和亚硝态氮的积累。在该周期FA质量浓度始终维持在40 mg·L−1以上,且在6 h时达到70.5 mg·L−1,从而较稳定地实现对自养AOB和NOB的抑制,有利于HN-AD菌的富集。当第16周期进水氨氮质量浓度进一步提升至400 mg·L−1,氨氮去除率和总氮去除率依然保持在91%和85%,至此认为HN-AD系统启动成功。
通过投加抑制剂DMPP抑制自养硝化,根据氨氮转化性能验证了系统中发生的主要硝化反应类型。由图3(a)可知,驯化前,投加DMPP实验组氨氮质量浓度基本没有下降,而空白组则正常进行氨氧化过程,这表明抑制剂显著抑制了氨氮的转化。由图3(b)可知,驯化后,投加DMPP实验组与空白组的氨氮质量浓度呈现相似下降趋势,表明氨氧化过程并未受到抑制。综上所述,系统启动成功后,体系中硝化反应的主要类型是异养硝化。
2.2 有机碳源对异养硝化脱氮的影响
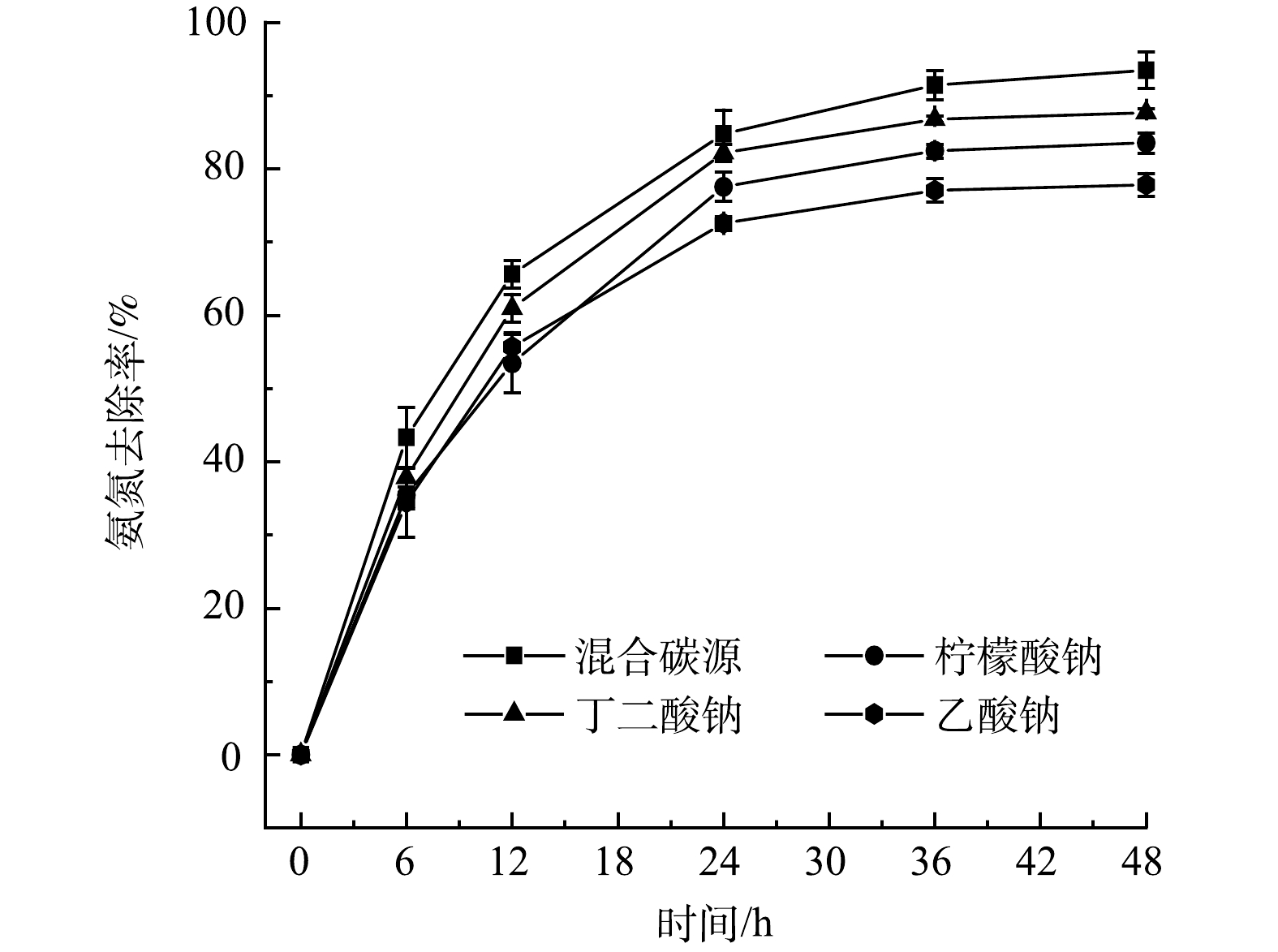
选择合适的碳源有利于实现最佳的菌体生长和脱氮性能,可以提高反应效率并缩短反应时间。本研究选用乙酸钠、柠檬酸钠和丁二酸钠作为实验所用碳源,在混菌系统中研究了有机碳源种类的影响。从图4可以看出,用乙酸钠、柠檬酸钠、丁二酸钠作唯一碳源时,48 h的氨氮去除率分别达到了79.5%、83.3%和87.9%;而将上述3种碳源混合使用时,48 h的氨氮去除率达到了96.1%。不同种类碳源的分子构成和氧化还原电位存在差异,因此,HN-AD菌对他们的利用程度各不相同[13]。有研究表明,以丁二酸钠为碳源时,Thauera sp. SND5菌株对氮的去除效果较好[6];利用柠檬酸钠为碳源时,Alcaligenes faecalis C16菌株的脱氮效率最高[14];而对于Paracoccus pantotrophus菌株,乙酸钠是发挥最佳脱氮性能的碳源[15]。因此,在本研究的HN-AD系统中,不同的单一碳源会表现出脱氮性能的差异,而混合碳源可以更好地满足混菌体系中不同种HN-AD菌属的需求,从而使系统具有更好的脱氮性能。由于畜禽养殖废水中存在大量乙酸等小分子有机酸,所以当用HN-AD系统处理该类废水时,有望能够保证较高的脱氮效率。
2.3 C/N比对异养硝化脱氮的影响
在HN-AD系统采用混合碳源的基础上,进一步研究了系统进水C/N比的影响。结果表明,C/N比对HN-AD菌的脱氮效率有显著影响。
如图5(a)所示,当C/N比为15时,系统的氨氮去除率为80.3%,同时出水中几乎没有硝态氮或亚硝态氮积累;将C/N比提升为20后,HN-AD系统脱氮效率明显上升,随着系统运行,HN-AD系统运行稳定,氨氮去除率提高到了95%;将C/N比提高到25后,脱氮性能有所下降,氨氮去除率降低为90%。总氮的去除率也随着C/N比的优化而发生变化,在C/N比为20时,总氮去除率达到了89.6%,之后继续提升C/N比并不能显著提升总氮去除率。不同HN-AD菌的最优C/N比不同,Aliidiomarina在C/N比为9时,氨氮去除率达到93.7%[16];Thauera sp.TN9在C/N比为22时氮去除效率最高,达到99.2%[17];Paracoccus versutus LYM在C/N比为20时,氮去除率达到97.09%[18]。一方面,C/N比过低会导致碳源不足,使得细胞生长受限以及缺乏电子供体,进而导致脱氮效率下降;另一方面,C/N比过高可在一定程度上抑制脱氮效果[19]。因此,合适的C/N比对于HN-AD系统的低耗高效运行至关重要,后续可将C/N比设为20~25进一步优化,以确定HN-AD系统的最佳C/N比。
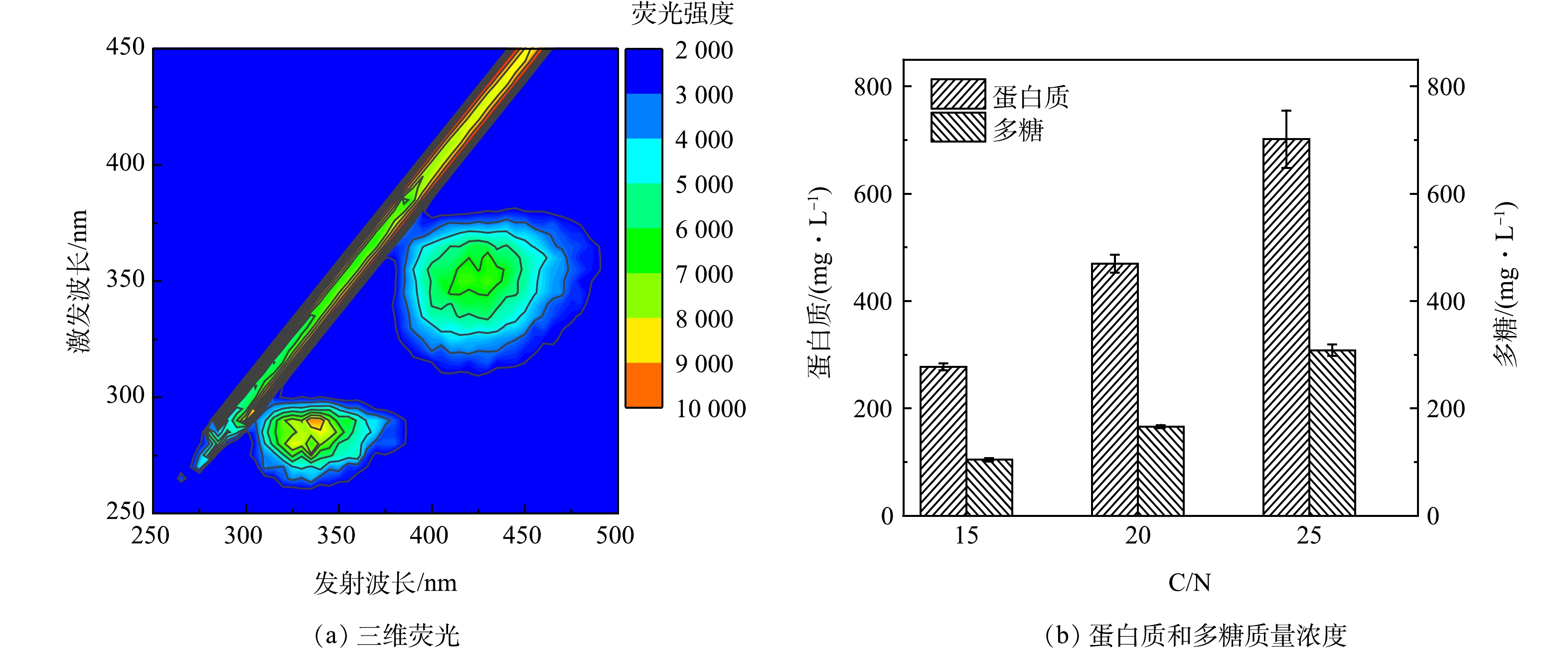
如图5(b)所示,随着进水C/N比的提高,系统出水的COD值不断增加,由于出水中没有检测到进水所用碳源,因此推测出水中的COD来源于微生物的细胞分泌物。对出水进行三维荧光测试,结果显示较明显的荧光峰(Ex/Em=260~300 nm/300~370 nm)为色氨酸荧光蛋白峰,同时,另一个较明显的荧光峰(Ex/Em=330~370 nm/400~475 nm)为类腐殖酸的峰,表明蛋白质和腐殖酸是出水中有机物的组成部分。这可能是由于高C、N质量浓度环境刺激了微生物产生大量细胞代谢产物,形成高浓度的胞外聚合物(extracellular polymeric substances, EPS),EPS主要由多糖和蛋白质组成,可分为溶解态和结合态2种形态,其中大部分溶解态EPS可以随出水排出系统[20]。WANG等[21]研究表明,在微生物处于极端的生存环境时,EPS中色氨酸和芳香类蛋白荧光强度会显著增强。
本研究进一步对出水中的蛋白质和多糖进行了测定,结果如图6(b)所示,发现其含量随着C/N比提高而不断增加,换算成COD当量后发现,蛋白质和多糖分别占出水总COD的60%~70%。当对高碳质量浓度有机废水进行脱氮处理时,HN-AD菌的繁殖速度远远快于自养硝化菌,但其生长过程产生的大量溶解态EPS很可能导致出水有机物超标,后续可以通过增加膜组件构成膜-生物反应器对这些大分子物质截留,从而保证出水水质达到排放标准。
2.4 异养硝化系统的动力学研究
HN-AD系统具有同步除碳脱氮的特性,通过修正的Gompertz模型[9]来进一步解析底物去除过程。针对典型周期,分别对COD和氨氮质量浓度随时间的变化进行动力学拟合,结果如图7所示。COD的最大去除速率为174.1 mg·(L·h)−1(R2=0.992),氨氮的最大去除速率为8.66 mg·(L·h)−1 (R2=0.999)。已有研究[22]表明,大部分HN-AD纯菌的氨氮去除速率为3~8 mg·(L·h)−1,而本研究所构建HN-AD系统显示出比纯菌体系更高的氨氮去除速率。此外,对典型周期各时间点的COD和氨氮质量浓度进行相关性拟合。如图7(c)所示,反应过程中两者呈现出较好的相关性(R2=0.997),从而间接证明了HN-AD过程氨氮转化需要碳源,有助于实现碳氮协同降解。上述拟合结果有助于深入了解系统性能,并优化HN-AD系统在实际应用时的设计和运行参数,以实现高质量浓度含氮有机废水处理过程高效稳定的除碳脱氮。
2.5 微生物群落结构分析
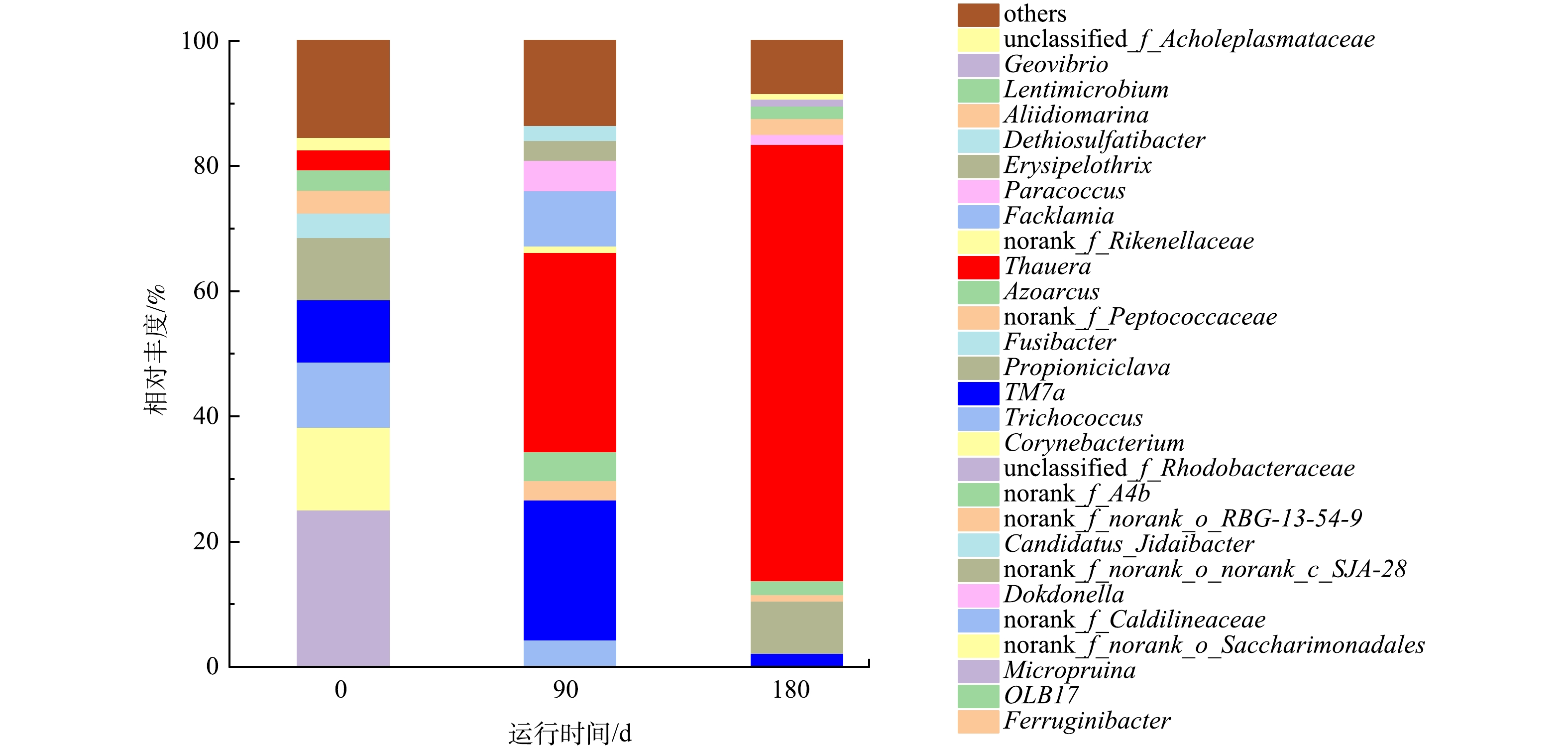
在属水平上的污泥物种组成分析结果如图8所示,HN-AD系统中的优势菌为Thauera(69.7%),而自养硝化菌的丰度较低(<1%)。已有研究[6,17]表明,Thauera细菌可以参与氮循环过程,具有异养硝化-好氧反硝化功能,通常存在于极端环境中,对高COD和高氨氮环境具有较强的适应能力,Thauera细菌具有降解有机物的能力,特别是一些具有环境污染潜力的有机污染物,如芳香烃类化合物和氯化有机化合物,其代谢能力可以用于生物修复和废水处理等环境应用。相对丰度第2高的Propioniciclava(8.3%),该菌属是一种潜在聚磷菌,能够在厌氧阶段完成聚磷代谢[23]。属水平微生物群落分析结果表明,在驯化过程中,Thauera相对丰度显著增加,成为主导性的菌种。以上结果对于深入了解HN-AD系统的微生物群落动态和功能特性具有重要意义。
3. 结论
1)通过逐渐提升进水COD和氨氮质量浓度的方法可以快速实现HN-AD污泥的驯化,并通过单个周期的COD和氨氮质量浓度监测证实了HN-AD功能的启动。
2)有机碳源对系统的脱氮效果有重要影响,柠檬酸钠、乙酸钠和丁二酸钠的混合碳源更有利于异养硝化脱氮,当C/N比为20时,HN-AD系统的脱氮效率最高。采用Gompertz动力学模型分别拟合了氨氮和COD底物的去除过程,模型相关系数R2均在0.9以上,证实了氨氮去除和有机物去除的相关性。
3)在优化条件下,HN-AD系统实现了95%的氨氮去除率、89.6%的总氮去除效率和92%的COD去除率,这表明该工艺可同步实现高效脱氮和有机物的去除。高通量分析结果表明,Thauera相对丰度显著增加,并成为了HN-AD系统中的优势菌种。
-
表 1 7种被测成分的线性方程、线性范围和相关系数
μg·mL−1 化合物 线性方程 γ 线性范围 LOQ−1 LOD−1 甲砜霉素 Y=110 406.89+75 281.78X 0.999 6 0.32~32 0.230 0.069 氟苯尼考 Y=93 897.99+1 416 141.06X 0.999 8 0.46~46 0.110 0.033 水胺硫磷 Y=−5 412.01+480 569.50X 0.999 8 0.60~6 0.017 0.050 甲基−对硫磷 Y=−1 816.01+431 160.53X 0.999 8 0.60~6 0.061 0.018 三唑磷 Y=−1 293.29+22 111.26X 0.999 8 0.25~25 0.038 0.011 甲基−毒死蜱 Y=−5 075.90+154 460.57X 0.999 7 0.35~35 0.053 0.016 毒死蜱 Y=−8 826.02+42 658.68X 0.999 3 0.36~36 0.055 0.016 注:相关系数,γ;LOQ,定量限; LOD,检测限。 表 2 样品含量测定及加标回收率
化合物 加入量/μL 自来水 崇德湖 测得量/μg·mL−1 回收率/% RSD/% 测得量/μg·mL−1 回收率/% RSD/% 甲砜霉素 0 ND NA NA ND NA NA 10 13.26 93.38 — 14.29 100.63 — 20 13.45 94.72 2.25 14.63 103.03 3.88 30 13.98 98.45 — 15.41 108.52 — 氟苯尼考 0 ND NA NA ND NA NA 10 20.47 91.79 — 20.45 91.70 — 20 21.80 97.76 3.62 21.89 98.16 3.96 30 21.83 97.89 — 22.49 100.85 — 水胺硫磷 0 ND NA NA ND NA NA 10 13.98 91.97 — 14.94 98.29 — 20 14.79 97.30 2.20 15.68 103.16 3.20 30 15.00 98.68 — 15.88 104.47 — 甲基−对硫磷 0 ND NA NA ND NA NA 10 20.23 95.42 — 19.98 94.24 — 20 20.56 96.98 1.88 20.79 98.07 4.86 30 21.00 99.06 — 22.00 103.77 — 三唑磷 0 ND NA NA ND NA NA 10 21.46 95.38 — 20.66 91.82 — 20 21.79 96.84 1.96 21.79 96.84 3.48 30 22.49 99.96 — 22.49 99.95 — 甲基−毒死蜱 0 ND NA NA ND NA NA 10 13.23 90.62 — 14.98 102.60 — 20 13.97 95.68 4.24 15.38 105.34 2.57 30 14.68 100.55 — 15.77 108.01 — 毒死蜱 0 ND NA NA ND NA NA 10 23.21 93.59 — 23.42 94.44 — 20 24.70 99.60 3.97 24.67 99.48 4.01 30 25.02 100.89 — 25.36 102.26 — 注:ND,未检测到; NA,无法使用。 -
[1] WANG X, QIAO X, MA Y, et al. Simultaneous determination of nine trace organophosphorous pesticide residues in fruit samples using molecularly imprinted matrix solid-phase dispersion followed by gas Chromatography[J]. Journal of Agricultural & Food Chemistry, 2013, 61(16): 3821 − 3827. [2] FARAJZADEH,MA, BAMOROWAT, M, MOGADDAM, MRA. Development of a dispersive liquid-liquid microextraction method based on solidification of a floating ionic liquid for extraction of carbamate pesticides from fruit juice and vegetable samples[J]. RSC Advances, 2016, 6(114): 112939 − 112948. doi: 10.1039/C6RA20103B [3] 张蓓蓓, 章勇, 赵永刚, 等. 水中14种氨基甲酸酯类农药残留测定[J]. 广州化工, 2013, 41(23): 98 − 100. doi: 10.3969/j.issn.1001-9677.2013.23.037 [4] 孙鹏, 高玉玲, 王金梅, 等. 漂浮固化分散液-液微萃取-气相色谱法测定液态奶中5种拟除虫菊酯类农药残留[J]. 农药学学报, 2016, 18(4): 497 − 502. [5] 吴丽, 李刚, 李媛. SPE固相萃取-高效液相色谱联用测定生活废水中烷基酚[J]. 新疆环境保护, 2018, 40(4): 17 − 23. doi: 10.3969/j.issn.1008-2301.2018.01.004 [6] 李兴红, 江静, 杨莉纳, 等. 钴铁氧体磁性固相萃取结合高效液相色谱法测定果蔬汁中4种人工合成色素[J]. 河北大学学报(自然科学版), 2019, 39(1): 41 − 48. [7] FARAHANI H, SHOKOUHI M, RAHIMI-NASRABADI M, et al. Green chemistry approach to analysis of formic acid and acetic acid in aquatic environment by headspace water-based liquid-phase microextraction and high-performance liquid chromatography[J]. Toxicological & Environmental Chemistry, 2016, 98(7): 714 − 726. [8] 于佳佳, 曹娅, 王强, 等. 分散液相微萃取-气相色谱联用测定苹果汁中6种有机磷农药残留[J]. 中国园艺文摘, 2015(8): 40 − 42. doi: 10.3969/j.issn.1672-0873.2015.08.017 [9] REZAEE M, ASSADI Y, MILANIHOSSEINI M R M, et al. Determination of organic compounds in water using dispersive liquid-liquid microextraction[J]. Journal of Chromatography A, 2006, 1116(1/2): 1 − 9. [10] WU C, LIU H, LIU W, et al. Determination of organophosphorus pesticides in environmental water samples by dispersive liquid-liquid microextraction with solidification of floating organic droplet followed by high-performance liquid chromatography[J]. Analytical & Bioanalytical Chemistry, 2010, 397(6): 2543 − 2549. [11] PENG G, HE Q, MMEREKI D, et al. Dispersive solid-phase extraction followedby vortex-assisted dispersive liquid-liquidmicroextraction based onthesolidificationof a floating organic droplet for thedetermination of benzoylureainsecticidesin soil and sewage sludge[J]. Journal of Separation Science, 2016, 39(7): 1213 − 1398. [12] SARAJI M, BOROUJENI M K, BIDGOLI A A H. Comparison of dispersive liquid-liquid microextraction and hollow fiber liquid-liquid-liquid microextraction for the determination of fentanyl, alfentanil, and sufentanil in water and biological fluids by high-performance liquid chromatography[J]. Analytical and Bioanalytical Chemistry, 2011, 400(7): 2149 − 2158. doi: 10.1007/s00216-011-4874-x [13] LEONG M I, HUANG S D. Dispersive liquid-liquid microextraction method based on solidification of floating organic drop combined with gas chromatography with electron-capture or mass spectrometry detection[J]. Journal of Chromatography A, 2008, 1211(1/2): 8 − 12. [14] AHMADI-JOUIBARI T, FATTAHI N, SHAMSIPUR M, et al. Dispersive liquid-liquid microextraction followed by high-performance liquid chromatography-ultraviolet detection to determination of opium alkaloids in human plasma[J]. Journal of Pharmaceutical & Biomedical Analysis, 2013, 85(11): 14 − 20. [15] CHATZIMITAKOS T, BINELLAS C, MAIDATSI K, et al. Magnetic ionic liquid in stirring-assisted drop-breakup microextraction: Proof-of-concept extraction of phenolic endocrine disrupters and acidic pharmaceuticals[J]. Analytica Chimica Acta, 2016, 910(12): 53 − 59. [16] SALEH A, YAMINI Y, FARAJI M, et al. Ultrasound-assisted emulsification microextraction method based on applying low density organic solvents followed by gas chromatography analysis for the determination of polycyclic aromatic hydrocarbons in water samples[J]. Journal of Chromatography A, 2009, 1216(39): 6673 − 6679. doi: 10.1016/j.chroma.2009.08.001 [17] SEEBUNRUENGK, SANTALADCHAIYAKIT Y, SRIJARANAI S. Vortex-assisted low density solvent liquid-liquid microextraction and salt-induced demulsification coupled to high performance liquid chromatography for the determination of five organophosphorus pesticide residues in fruits[J]. Talanta, 2015, 132(42): 769 − 774. [18] FARAJZADEH M A, MOGADDAM M R. Air-assisted liquid-liquid microextraction method as a novel microextraction technique; application in extraction and preconcentration of phthalate esters in aqueous sample followed by gas chromatography-flame ionization detection[J]. Analytica Chimica Acta, 2012, 728(6): 31 − 38. [19] YAN W, KWOK Y C, HE Y, et al. Application of dynamic liquid-Phase microextraction to the analysis of chlorobenzenes in water by using a conventional microsyringe[J]. Analytical Chemistry, 1998, 70(21): 4610 − 4614. doi: 10.1021/ac9804339 [20] FARAJZADEH M A, KHOSHMARAM L. Air-assisted liquid-liquid microextraction-gas chromatography-flame ionisation detection: a fast and simple method for the assessment of triazole pesticides residues in surface water, cucumber, tomato and grape juices samples[J]. Food Chemistry, 2013, 141(3): 1881 − 1887. doi: 10.1016/j.foodchem.2013.05.088 [21] YOU X, CHEN X, LIU F, et al. Ionic liquid-based air-assisted liquid-liquid microextraction followed by high performance liquid chromatography for the determination of five fungicides in juice samples[J]. Food Chemistry, 2018, 239(24): 354 − 359. [22] 廖且根, 张大文, 罗林广. 超声辅助悬浮固化分散液液微萃取-液相色谱-串联质谱法测定环境水样中氯硝柳胺[J]. 分析科学学报, 2018, 34(6): 834 − 836. [23] HUANG Z, CHUA P E, LEE H K. Carbonized polydopamine as coating for solid-phase microextraction of organochlorine pesticides[J]. Journal of Chromatography A, 2015, 1399(23): 8 − 17. [24] ZHANG Y, LEE H K. Low-density solvent-based vortex-assisted surfactant-enhanced-emulsification liquid-liquid microextraction combined with gas chromatography-mass spectrometry for the fast determination of phthalate esters in bottled water[J]. Journal of Chromatography A, 2013, 1274(32): 28 − 35. [25] CHENGJ, XIA Y, ZHOU Y, et al. Application of an ultrasound-assisted surfactant-enhanced emulsification microextraction method for the analysis of diethofencarb and pyrimethanil fungicides in water and fruit juice samples[J]. Analytica Chimica Acta, 2011, 701(1): 86 − 91. doi: 10.1016/j.aca.2011.04.058 [26] ZHOU Q, GAO Y, BAI H, et al. Preconcentration sensitive determination of pyrethroid insecticides in environmental water samples with solid phase extraction with SiO2 microspheres cartridge prior to high performance liquid chromatography[J]. Journal of Chromatography A, 2010, 1217(31): 5021 − 5025. doi: 10.1016/j.chroma.2010.05.060 [27] CHEN L, CHEN W, MA C, et al. Electropolymerizedmultiwalled carbon nanotubes/polypyrrole fiber for solid-phase microextraction and its applications in the determination of pyrethroids[J]. Talanta, 2011, 84(1): 104 − 108. doi: 10.1016/j.talanta.2010.12.027 [28] ZHOU Q, GAO Y, XIE G. Determination of bisphenol A, 4--nonylphenol, and 4--octylphenol by temperature-controlled ionic liquid dispersive liquid-phase microextraction combined with high performance liquid chromatography-fluorescence detector[J]. Talanta, 2011, 85(3): 1598 − 1602. doi: 10.1016/j.talanta.2011.06.050 -






 下载:
下载: