-
世界卫生组织(world health organization, WHO)称,癌症是全球第二大死亡原因。2020年全球有1 930×104新癌症病例、1 000×104癌症死亡,预计到2032年,每年新增癌症病例将上升到2 200×104,这意味着抗癌类抗生素的消费量将急剧增加[1]。但抗生素使用后不会被生物体完全吸收,其以原药或代谢物的形式通过粪便或者尿液排出体外[2],导致环境中存在大量残留抗生素及其衍生物,并迁移至地表水、地下水并进入饮用水处理及输送系统中[3-4]。在市政污水、污水处理厂、地表水和地下水中,经常可以检测到μg·L−1级的环丙沙星、磺胺类药物、罗红霉素、脱水红霉素等药物[5-7]。抗生素类药物一般都是非特异性的、缺乏选择性,一方面在任何真核生物体中都会引起细胞毒性、基因毒性、诱变、致畸和内分泌干扰作[8-13],改变水环境中的微生物群落,并且导致耐药基因的产生[14-16];另一方面抗生素通过食物链在人体内富集,对人体的肠道疾病产生过敏影响,甚至有些还会产生“三致效应”[17],长期富集抗生素会损害人体的免疫系统,甚至严重的影响各项生理功能[18]。
蒽环类抗生素是一种新型污染物,其代表物柔红霉素、多柔比星、表柔比星等在水环境中的半衰期时间较长,属于难以降解的有机物。目前利用生物降解[19]、吸附[20-21]、光催化氧化[22]、电化学氧化[23-24]等高级氧化技术对该类抗生素进行氧化降解的相关研究较多。FRANQUET等[19]利用序批式反应器(sequencing batch reactor, SBR)对废水中的柔红霉素、多柔比星进行降解实验发现,柔红霉素的降解速率要比多柔比星快很多,反应15 min内,柔红霉素被降解致检测下限,多柔比星仅降解了60%。但生物降解技术在利用微生物处理高浓度抗生素废水的过程时,会对微生物产生毒性作用并且诱导一些致病菌产生耐药性的风险。GHODRATI等[20]使用氧化石墨烯、活性炭和多壁碳纳米管作为吸附材料对柔红霉素进行吸附动力学的比较研究,发现石墨烯具有较短的吸附平衡时间及较高的吸附率,其吸附平衡时间为30 min,能够吸附88%的柔红霉素,而活性炭和多壁碳纳米管材料的吸附平衡时间长达300 min和1 400 min,吸附率仅达到51%和68%。但吸附过程只是将污染物富集,并没有实质性的将污染物进行降解矿化,因此,会存在二次污染的风险。DUMITRU等[22]通过热解草酸铋铁配合物制得BiFeO3,探究其在光催化与单纯的紫外照射对多柔比星的降解差异。结果表明,BiFeO3的光催化在150 min后可去除79%的多柔比星,而单纯紫外照射仅可去除33%。但由于光催化技术对于透光度要求较高,如果水体中的悬浮物较多、色度较高就会影响光催化效果,进而会影响处理效果。
二氧化氯(ClO2)是一种环境友好型的强氧化剂和消毒剂,在水处理工艺中作为氯消毒的替代产品可以有效降解水中有机污染物,去除还原态铁、锰及硫化物等无机污染物,同时不会产生具有三致作用的有机卤代物[25];也可在防疫灭疫、水产畜牧养殖和造纸制浆漂泊等领域中广泛应用。ClO2通过单电子转移的形式与有机物发生氧化还原反应,能够有效降解吡唑酮[26]、氟喹诺酮[27]、磺胺类[28]等药物,因此具有降解抗生素的潜在能力。侯智昊等[29]利用ClO2降解磺胺甲基噁唑和磺胺脒,初始浓度为0.5~2.5 μmol·L−1的磺胺甲基噁唑与初始浓度大于20 μmol·L−1的ClO2反应30 s后,去除率可达到83%以上;而磺胺脒在ClO2初始浓度大于50 μmol·L−1时,反应120 s去除率达到95%;并且酸性条件下会抑制ClO2对磺胺类抗生素的降解,而在碱性条件下反应120 s后几乎都能够完全被降解。
为了充分利用优良消毒剂ClO2的氧化效果,减轻抗生素对环境污染,本研究通过考察ClO2对盐酸多柔比星(DOX)的去除效果、影响因素、反应动力学以及降解机理,可供同类有机污染物的反应参考,也可为进一步确定工程应用参数提供科学依据。对控制环境中的新型抗生素的污染、生物毒性等潜在的环境威胁具有重要的理论意义和应用价值。
-
采用GB26366-2021《二氧化氯消毒剂卫生要求》A1.4.2的方法制备高纯二氧化氯。二氧化氯母液质量浓度为500 mg·L−1,使用前进行标定。DOX购买于上海阿拉丁生化科技有限公司,色谱纯,纯度为98%。制备DOX标准溶液时,称取0.05 g DOX,用少量超纯水溶解后转至50 mL的容量瓶中,将制得质量浓度为1.0 g·L−1的标准溶液放在4 ℃的冰箱中避光存储。
-
1) ClO2初始浓度对降解效果的影响实验。反应容器采用体积为100 mL的聚四氟乙烯玻璃瓶,用锡纸包裹住避光。量取60 mL质量浓度5 mg·L−1的DOX于聚四氟乙烯玻璃瓶中,调节pH为7.5±0.1,放在恒温水浴磁力搅拌器中,设定温度为(25±1) ℃。加入质量浓度为0.2、0.4、0.6、0.8、1.0 mg·L−1的ClO2对DOX进行降解。开启磁力搅拌器,控制转速为200 r·min−1,用移液枪分别在0、5、10、20、30 min吸取5 mL的反应溶液于已经盛有20 μL的0.05 mol·L−1的硫代硫酸钠溶液的棕色小瓶中终止反应。
2)温度对降解效果的影响实验。ClO2质量浓度为0.6 mg·L−1,溶液pH控制在7.5±0.1。对于实验过程中低温条件,利用恒温磁力搅拌器进行加热控制;对于高温条件,利用冰块水浴降温。
3) pH对降解效果的影响实验。实验过程基本与上述方法基本相同,ClO2质量浓度为0.6 mg·L−1,用HCl和NaOH对DOX溶液进行调节所需pH条件,同时控制溶液温度为(25±1) ℃。
4)抗生素浓度对降解效果的影响实验。ClO2质量浓度为0.6 mg·L−1,量取60 mL质量浓度为2、5、10、15、20 mg·L−1的DOX于聚四氟乙烯玻璃瓶中,控制pH为7.5±0.1、温度为(25±1) ℃,放在恒温水浴磁力搅拌器中,使用移液枪分别在0、5、10、20、30 min吸取5 mL的反应溶液,用硫代硫酸钠进行淬灭。
-
1) ClO2降解DOX反应速率常数及反应级数实验。取60 mL质量浓度为5 mg·L−1的DOX浓度于100 mL聚四氟乙烯玻璃瓶中,再加入高浓度的ClO2溶液,使其混合后溶液中ClO2质量浓度大于50 mg·L−1,即超过DOX初始浓度的10倍以上,在水浴中保持反应温度为(25±1) ℃,开启磁力搅拌器,控制转速为200 r·min−1。使用移液枪分别在0、20、40、60、120 s时吸取5 mL反应DOX后的溶液,用硫代硫酸钠进行淬灭。
2) pH对DOX的反应速率常数影响实验。DOX质量浓度为5 mg·L−1,ClO2质量浓度为6.5 mg·L−1,控制反应温度为(25±1) ℃,溶液pH分别为5.2、7.5、8.2、9.0。
3)温度对DOX的反应速率常数影响实验。DOX初始质量浓度为5 mg·L−1,ClO2质量浓度为6.5 mg·L−1条件下,溶液pH为7.5±0.1,控制反应温度为7、14、20、30 ℃。
本文中各参数采用孤立变量法确定,使ClO2浓度大于DOX的10倍以上,可视为ClO2在反应的整个过程中浓度几乎不变,因此ClO2降解DOX的反应动力学方程根据式(1)和式(2)计算。
式中:
dcDOXdt 为DOX浓度随时间的变化速率;kobs 为准一级反应速率常数;kapp 为表观二级反应速率常数;[ClO2]和[DOX]分别为ClO2和DOX的浓度。 -
本研究利用高效液相色谱(HPLC,LC-10AT)对DOX的标准样品和降解后样品的残留含量进行检测,根据峰面积的进行定量分析,所用色谱柱型号为ZORBAX SB-C18。每次做3组平行实验,取平均值。
检测DOX的色谱条件如下。流动相为甲醇∶ 0.01 mol·L−1磷酸二氢铵(NH4H2PO3)∶乙酸=30∶20∶0.1。色谱条件:检测波长为254 nm,进样量为20 μL,柱温为25 ℃,流速为1.0 mL·min−1,DOX的保留时间为4.5 min。
-
DOX降解产物采用高效液相色谱-质谱联用仪,仪器型号为赛默飞世尔公司静电场轨道阱质谱联用仪(HPLC—MS),色谱柱为Themo Scientific TM Hypersil GOLD C18 Column(50×2.1 mm,1.9 μm)。DOX采用梯度洗脱,流动相A为水,B为乙腈,0~1 min 5% B,1~8 min 5%~70% B,8~9 min 70%~100% B,9~14 min 100% B,14~14.1 min 100%~50% B,14.1~17 min 5% B,流速为0.3 mL·min−1,进样量10 μL,柱温为30 ℃。质谱方法为ESI+正离子模式;气帘气,35 Pa;Gas 1,45 psi;Gas 2,45 psi;温度为500 ℃;离子化压力为5 000 V,去簇电压为70 V;全扫描范围,m/z 150~
1800 ;裂解电压为5 V;CE Spread, 0 V。 -
本研究利用Gaussian 16软件的B3LYP/6-31G(d,p)方法对DOX分子进行结构优化,再利用更精密的基组6-311++G(2d,p)进一步分析,选用高级别基组的目的是在研究化学反应的机理,特别是过渡态和反应路径时,高级别的基组可以提供更可靠的能量梯度和几何结构;使用DFT方法,经B3LYP密度泛函的6-311++G(2d,p)基组进行结构优化;再利用Gaussian View以三维形式查看分子轨道,找到分子中能量最高的占据轨道(HOMO)和能量最低的未占据轨道(LUMO)。选用极化连续介质模型,所选溶剂为水进行相关的化学计算。本文所用到的量子化学计算描述符有最高占据分子轨道(HOMO)、最低未占据分子轨道(LUMO)、前线轨道能隙(ΔE)(式(3))、化学势(μ)(式(4))、硬度(η)(式(5))、亲电指数(ω)(式(6)),利用这些参数分析DOX的相关反应特性。
式中:ΔE为前线轨道能隙,eV;EHOMO为最高占据分子轨道的能量,eV;ELUMO为最低未占据分子轨道的能量,eV;μ为化学势,eV;η为硬度,eV;ω为亲电指数,eV;I为电离势,eV;A为电子亲和能,eV。
-
为了探究不同分子中不同位点的反应活性,FUKUI等 [30]引入了福井函数(Fukui)这一理论。分子中每个原子的亲电攻击、亲核攻击、自由基攻击的Fukui函数分别根据式(7)、式(8)和式(9)计算。
式中:
qi(N)、qi(N−1)、qi(N+1) 表示中性分子、失去1个电子、得到1个电子的带电分布状态;f+(r) 表示原子的亲核反应活性的大小、f−(r) 表示原子的亲电反应活性的大小、f0(r) 表示自由基攻击的活性大小。 -
本文通过计算每种降解产物的分配系数(logP)来判断产物的脂溶性,进而推断ClO2对DOX降解后的产物潜在的健康风险。logP数值越大,说明该物质具有亲脂性越强,数值越小说明亲水性越强。一般情况下,当logP≤5时,对生物的致死性和慢性毒性随着数值的增大而增大[31]。本文采用中国科学院上海有机化学研究所开发的XLOGP3工具[32],对优化后蒽环类抗生素分子本身、以及被ClO2降解后产物的logP进行计算,通过分析降解前后毒性变化来评估潜在的风险。
-
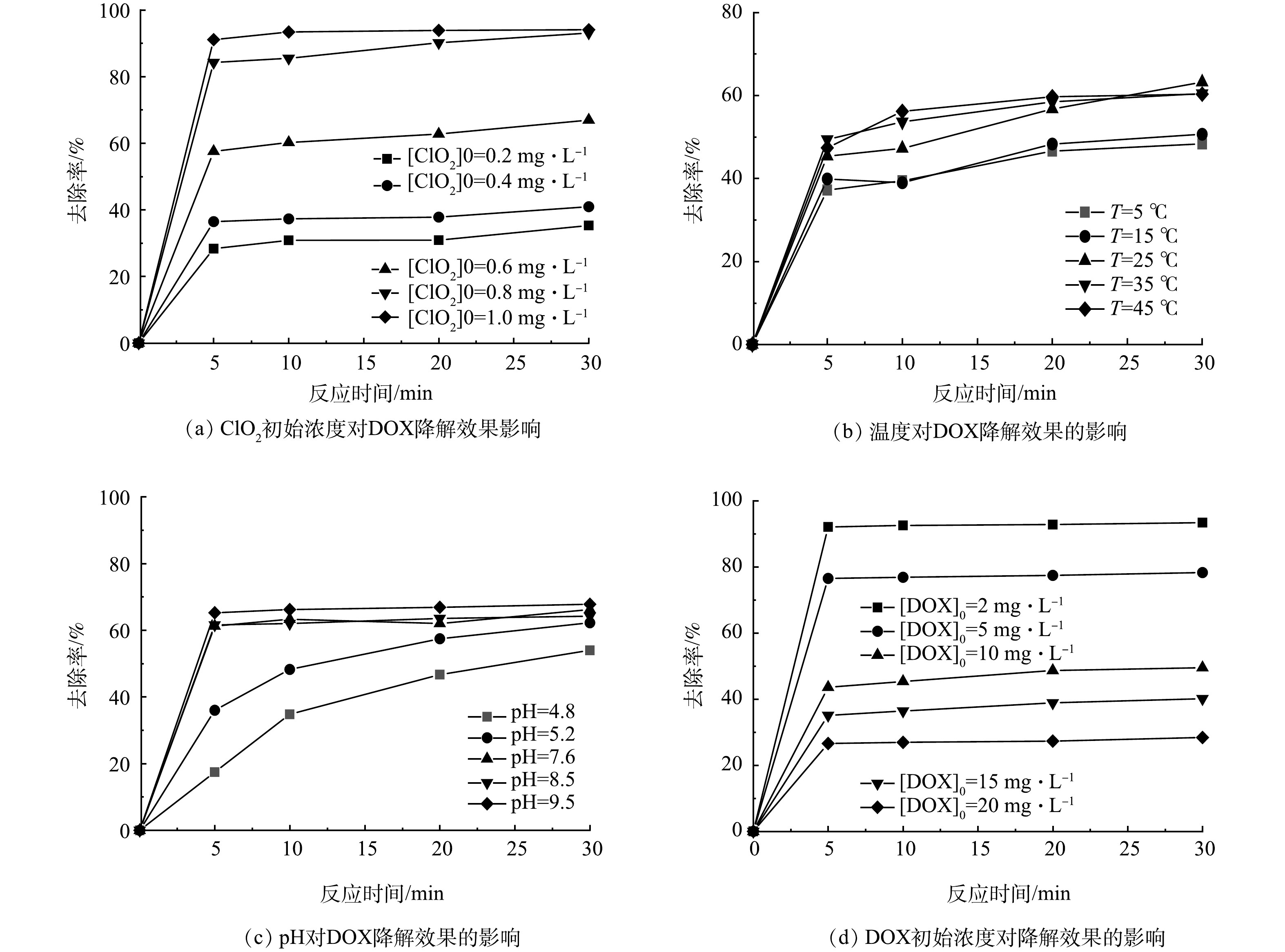
1) ClO2初始浓度对降解效果的影响。当温度为(25±1) ℃、pH为7.5±0.1、DOX初始质量浓度为5 mg·L−1时,ClO2初始浓度对降解效果的影响情况如图1(a)所示。由图1(a)可以看出,随着ClO2的浓度增加,DOX的去除率均有上升,当ClO2质量浓度高于0.6 mg·L−1后,DOX去除率上升趋势减缓。这是由于ClO2的氧化能力随其浓度的增加而显著提升,从而有效地攻击和破坏DOX分子中的化学键,但当ClO2质量浓度超过0.6 mg·L−1后,几乎所有的DOX分子均已与ClO2充分反应,导致反应体系趋近于饱和状态,因此,进一步增加ClO2浓度并不会显著提高去除率。此外反应时间在5 min内去除效果显著,5 min后反应几乎达到平衡状态。DOX在接触0.2、0.4、0.6、0.8、1.0 mg·L−1的ClO2 30 min后,降解率分别为35.31%、40.95%、66.97%、93.09%、94.07%,增加ClO2浓度能够有效地去除DOX。
2)温度对降解效果的影响。当pH为7.5±0.1、DOX初始质量浓度为5 mg·L−1、ClO2初始质量浓度为0.6 mg·L−1时,温度对降解效果的影响结果如图1(b)所示。由图1(b)可看出,随着温度的升高,ClO2对DOX的去除率没有显著变化,30 min后去除率分别达到48.32%、50.65%、63.22%、60.45%、60.33%,这表明ClO2去除DOX的能力受温度影响很小。
3) pH对降解效果的影响。当温度为(25±1) ℃,DOX初始质量浓度为5 mg·L−1,ClO2初始质量浓度为0.6 mg·L−1时,pH对降解效果的影响结果如图1(c)所示。由图1(c)可以看出,随着溶液pH的增加ClO2对DOX的降解效果显著增加。DOX溶液在pH为4.8、5.2、7.5、8.5、9.5接触30 min后去除率分别达到54.02%、62.25%、66.18%、64.22%、67.80%。酸性条件下对DOX的降解率要弱于碱性,这是因为ClO2的氧化还原电位与pH呈线性关系,当pH每增加1,其氧化还原电位增加0.062 V[33],因此ClO2氧化能力也随之增加。
4) DOX浓度对降解效果的影响。当温度为(25±1) ℃、pH为7.5±0.1、ClO2初始质量浓度为0.6 mg·L−1时,DOX浓度对降解效果的影响结果如图1(d)所示。由图1(d)可以看出,DOX的去除率随着其初始浓度的增加而明显降低,DOX初始质量浓度为2、5、10、15、20 mg·L−1时,与ClO2反应30 min后去除率分别达到93.41%、78.28%、49.5%、40.16%、28.43%。因为ClO2初始质量浓度较低仅为0.6 mg·L−1,去除率过低有可能是由于ClO2添加量过低,大量DOX未能与ClO2反应而残留导致降解效率低。
-
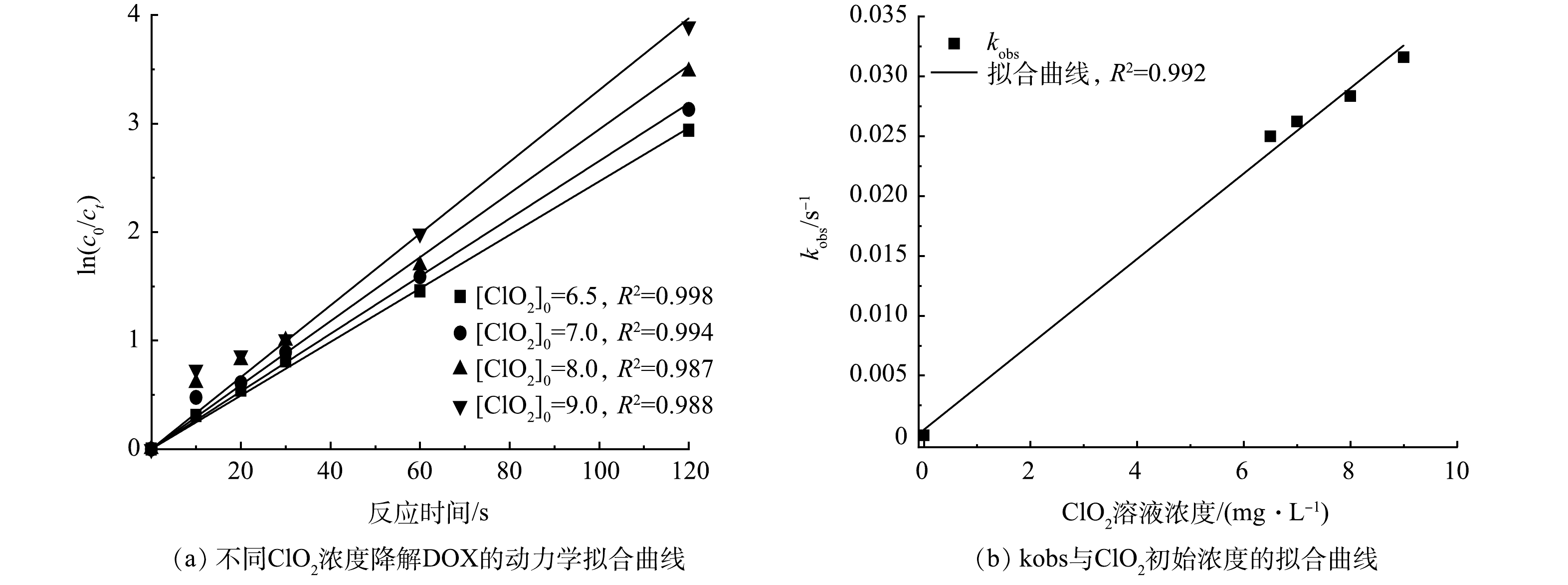
1) ClO2降解DOX反应速率常数及反应级数。不同ClO2浓度下ln(c0/ct)对反应时间t作图,结果如图2(a)所示。由图2(a)可以看出,ln(c0/ct)与时间呈良好的线性关系(R2>0.98),该反应同样符合拟一级动力学模型,因此DOX的反应级数为1。将图2(a)中的每条拟合直线斜率(即kobs)与ClO2浓度进行拟合得到一条直线,如图2(b)所示。可以看出kobs与ClO2浓度呈良好的线性关系(R2=0.992),反应速率随着ClO2浓度的增加而加快,所以ClO2反应级数为1,因此该回归直线的斜率为反应的二级反应速率常数,kapp=2.41×102 M−1·s−1,因此ClO2降解DOX符合二级反应动力学模型。不同ClO2浓度与DOX反应动力学参数如表1所示。
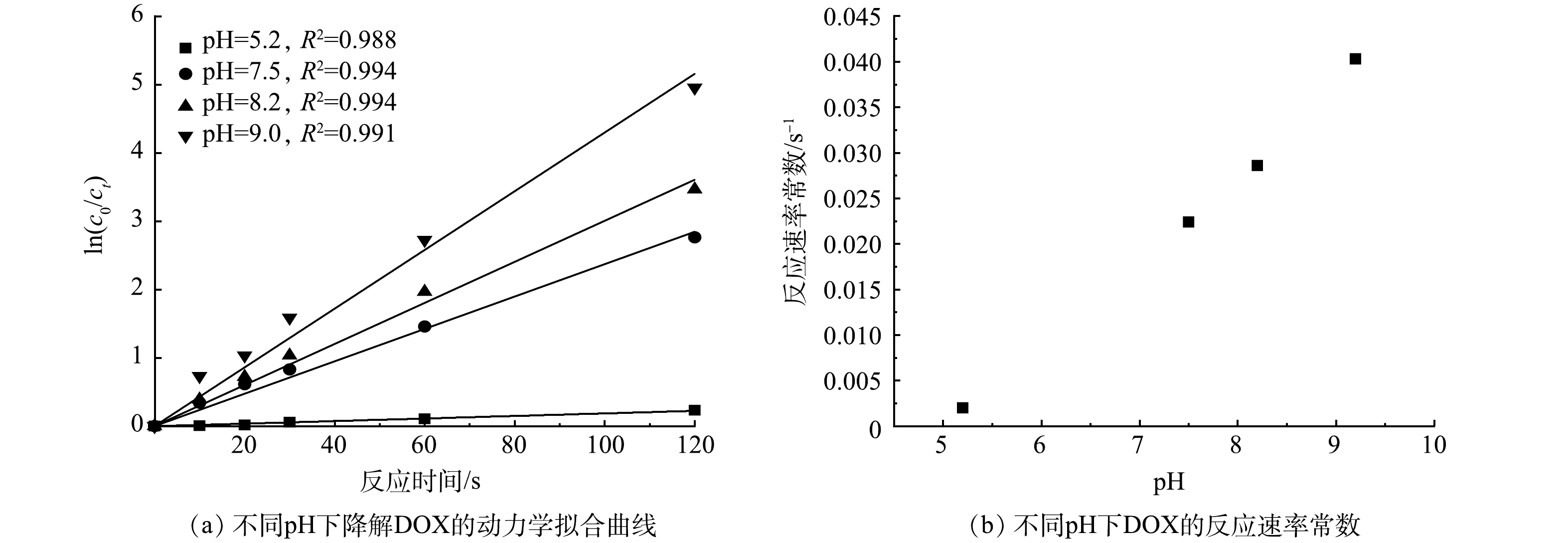
2) pH对DOX的反应速率常数影响。在不同pH下将ln(c0/ct)对反应时间t作图(图3(a));pH与kobs关系如图3(b)所示。由图3(a)和图3(b)可看出,当pH=5.2~9.0时,ClO2对DOX降解速率逐渐升高,反应速率常数由2.00×10−3 s−1上升到4.03×10−2 s−1。表明酸性条件下抑制ClO2对DOX的降解,而碱性条件下能够促进降解。
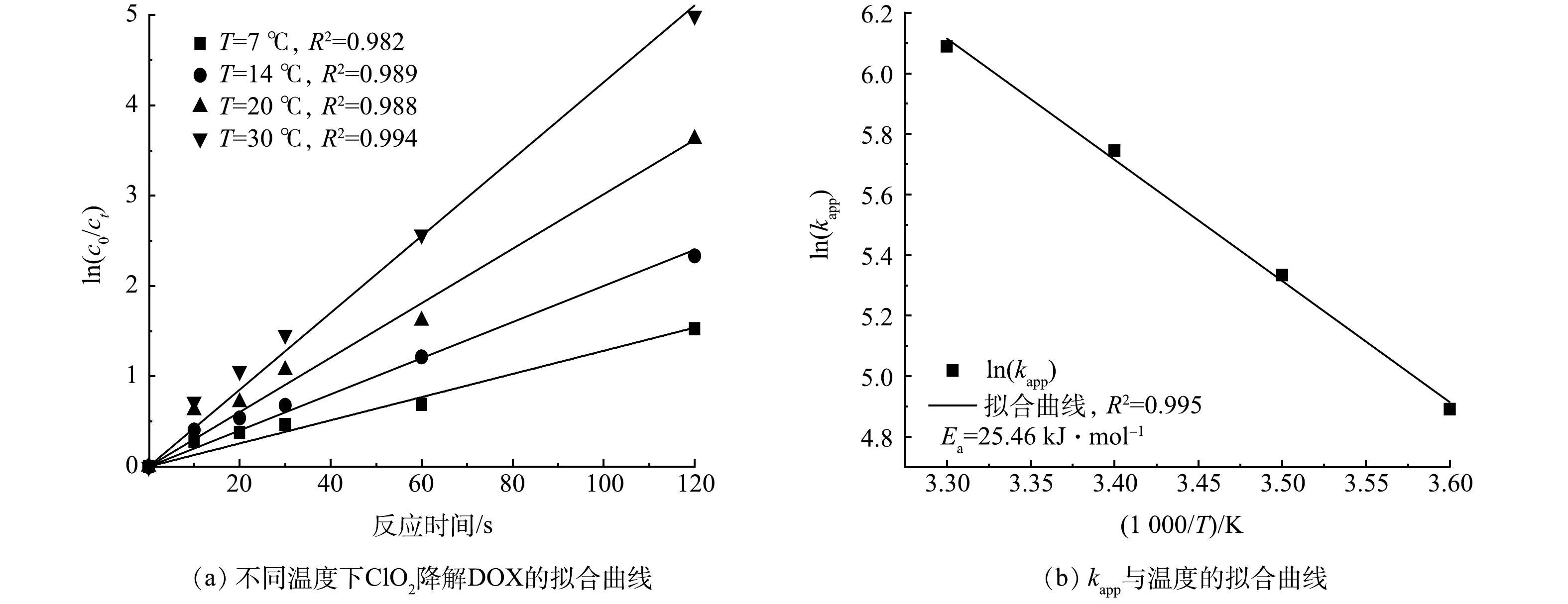
3)温度对DOX的反应速率常数影响。不同温度下ln(c0/ct)与反应时间t关系如图4(a)所示,Ea可以通过kapp与温度拟合得到,拟合结果见图4(b),不同温度下各反应的动力学参数见表2。由图4(a)~(b)可看出:kapp与温度之间有良好的线性关系(R2=0.995);根据拟合曲线斜率可以计算出ClO2与DOX反应活化能为25.46 kJ·mol−1。由表2可以得到,温度每升高10 ℃,kapp会增加1.41倍。因此,当温度升高,DOX的反应速率上升。这是因为温度升高,反应体系中分子平均动能增大,活化分子增多,反应体系中各分子有效碰撞次数增加,使反应速率加快。
-
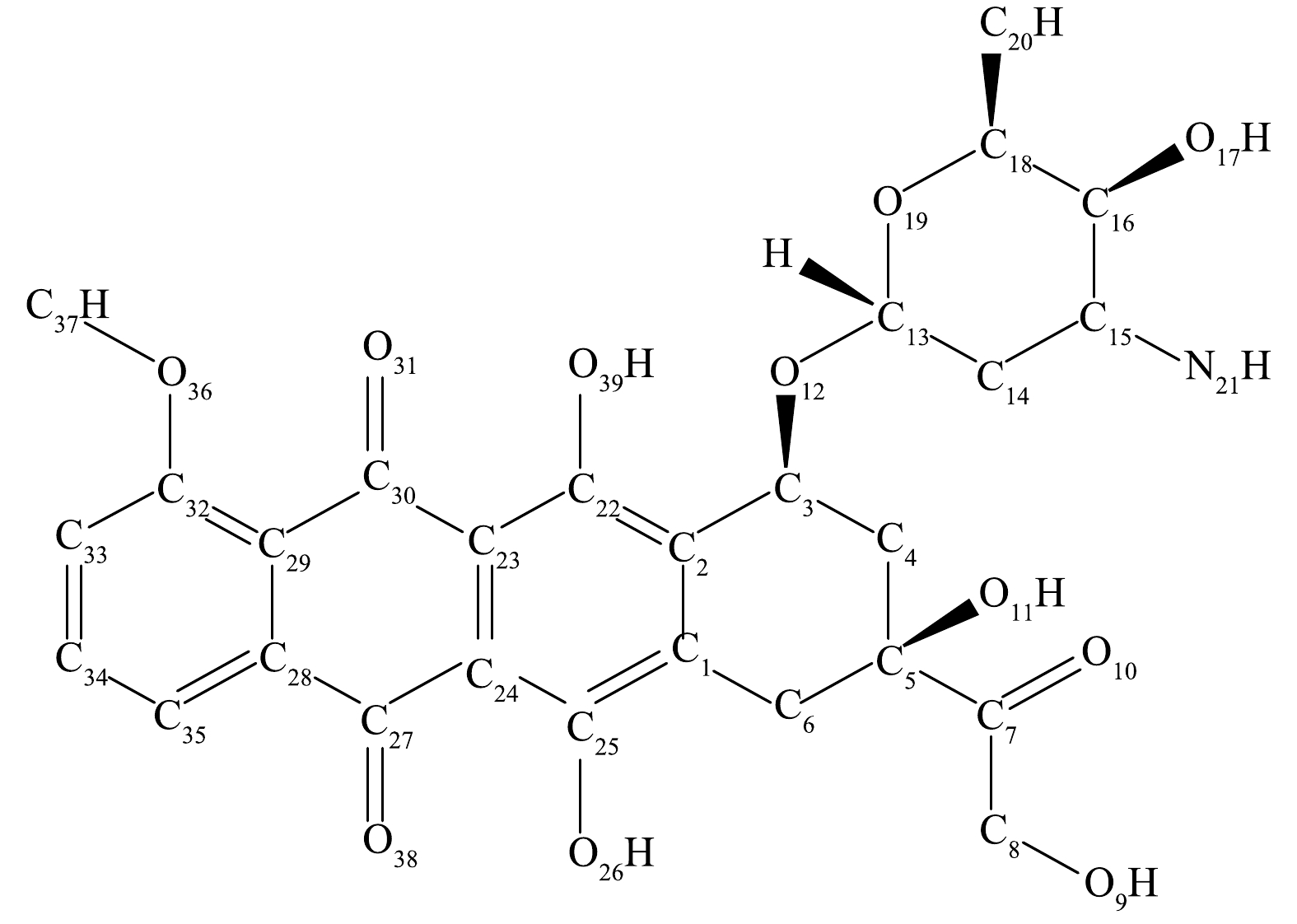
1) DOX分子结构与反应活性位点分析。分子的结构能够反映出分子的反应活性,对DOX进行结构优化后的图形见图5,分子主要键长的信息见表3。从表3可以看出,从整体上看DOX分子上的C—C、C=C、C—O、C=O、C—H、O—H、C—N、N—H的键长平均值分别为1.516 2、1.401 1、1.408 4、1.226 4、1.089 1、0.975 8、1.464 8、1.017 0 Å。与苯环上的C—C单键的键长相比,支链上的C5—C7单键以及含氧六元环上的C—C单键的键长较大。键长顺序为C—C>C—N>C—O>C=O>C—H>N—H>O—H。从上述结果可以看出,DOX分子中支链上和含氧六元环上的C—C单键在降解过程中很容易受到亲核攻击[34],且O—H键相较于其他类型的化学键的键长均小,说明该化学键容易受到亲电攻击。
DOX的静电势和前线分子轨道能量等信息预示着其具有不同的反应特性,但具体的反应活性位点仍不明确。而亲电自由基的反应活性对于有机分子反应途径的研究及为重要。利用福井函数对DOX的亲核反应位点、亲电反应位点及自由基反应位点进行分析。表4列出DOX的亲核攻击(f +)和亲电攻击(f −)。一般情况下,福井函数值越大,说明该原子为主要攻击位点。由表4可以看出,DOX的f −最大值在蒽醌环上的O26、O39原子上,说明O26和O39容易受到亲电攻击。
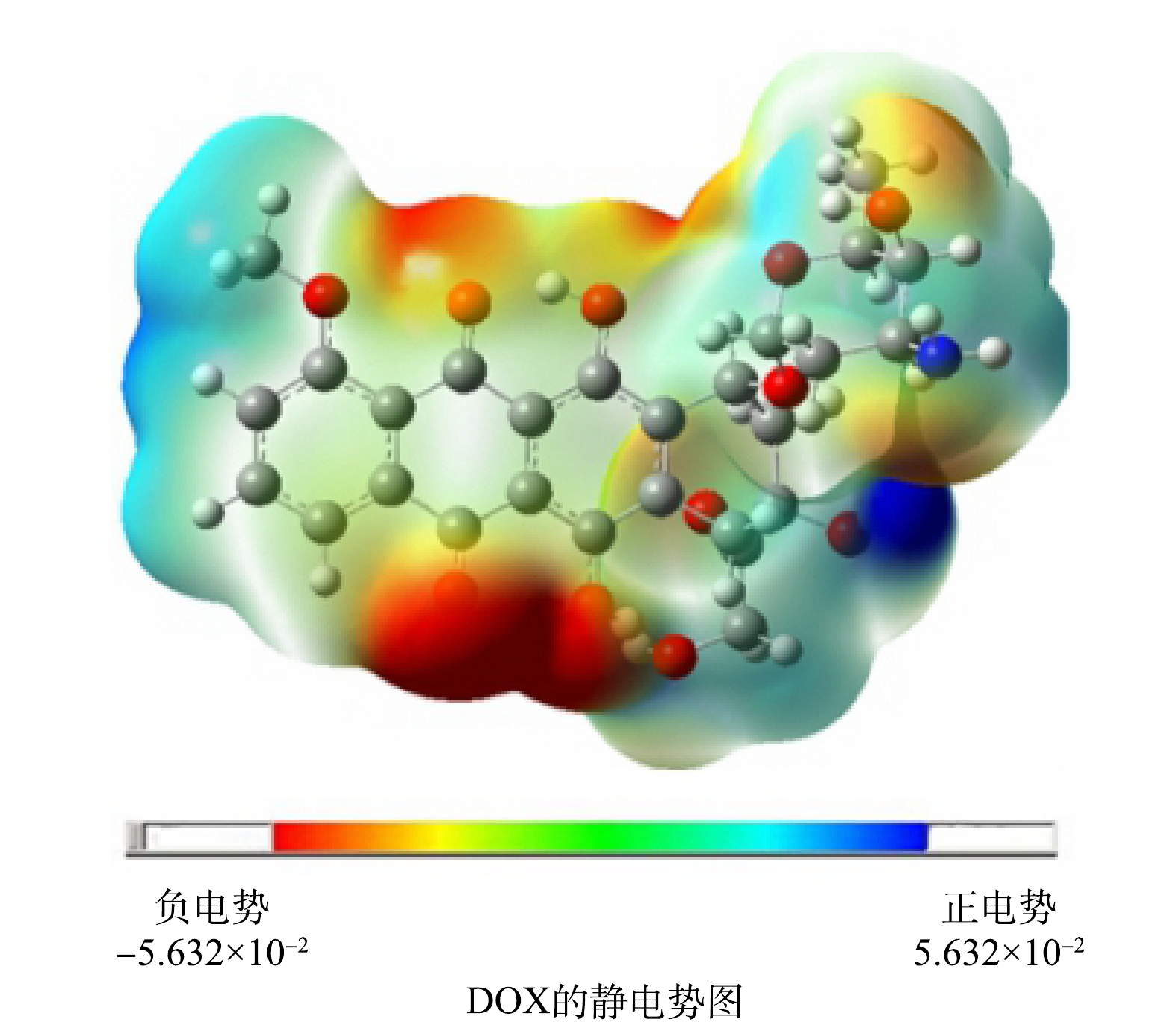
2) NPA(natural population analysis)电荷分布分析。ClO2降解DOX的过程会发生电子的得失,而分子的电荷分布影响其反应特性。DOX分子的静电荷分布,其中C1、C2、C4、C6、C8、C14、C15、C20、C23、C24、C28、C29、C34、C35、C37所带电荷为−0.035、−0.123、−0.404、−0.437、−0.110、−0.426、−0.045、−0.584、−0.213、−0.139、−0.074、−0.172、−0.158、−0.180、−0.199 a.u.,其余的碳原子均带正电,所有的氧原子均带负电,其中O26和O39所带电荷为-0.698和-0.720 a.u.,所有氢原子均带正电,反应过程中C20、O39、O26容易受到亲电攻击。DOX在发生降解的过程中蒽醌环上的羟基取代基中的氧原子以及个别碳原子容易发生亲电攻击。图6为DOX的静电势图,其中蓝色到红色区域表示电子云由稀疏到密集部分。可以看到DOX的电子云密度较大的区域主要集中在氧原子周围,电子云密度较小的区域主要集中在碳原子与氢原子周围。
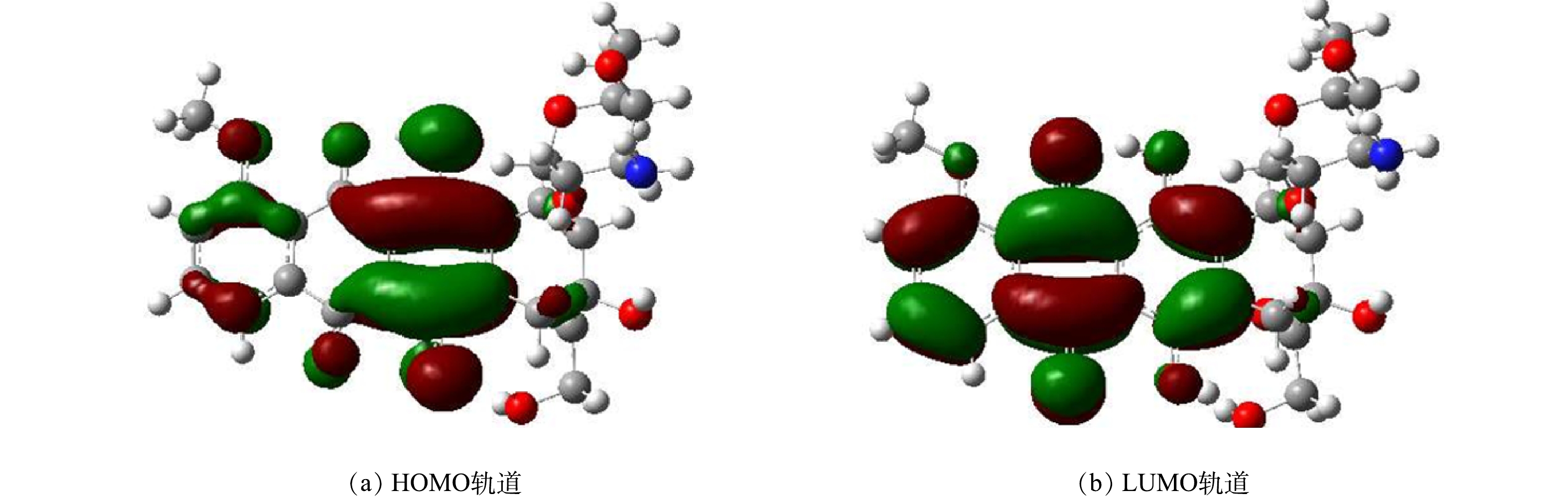
3)前线分子轨道分析。HOMO和LUMO轨道图形能够直观地看到分子容易得失电子的区域。若分子中的某部分被HOMO轨道所覆盖区域较大,说明该区域容易发生失去电子的情况;若分子中的某部分被LUMO轨道所覆盖区域大,说明该区域容易发生得电子的情况。图7显示了DOX前线分子轨道图,其中绿色区域代表正相位、红色区域代表负相位。从图7中可以看到,对于DOX的HOMO轨道主要聚集在二羟基取代苯环上的氧原子与碳原子周围,说明该区域容易受到亲电试剂攻击,其LUMO轨道分布主要集中在蒽醌环上的碳原子周围和苯环上的含氧双键周围,则该区域容易发生亲核试剂攻击。DOX的最高占据分子轨道能量为−5.95 eV,最低未占据分子轨道能量为−2.88 eV,前线轨道能隙为3.069 eV,化学势为4.42 eV,硬度为1.54 eV,亲电指数为6.34 eV,电离势为5.95 eV,电子亲合能为2.88 eV。
综上所述,通过分子结构与反应活性位点分析可知DOX分子中支链上和含氧六元环上的C-C单键相对较长,这使它们在降解过程中更容易受到亲核攻击。O—H键的键长数值较小,表明这个化学键容易受到亲电攻击。福井函数的f +和f −指数表明,DOX的f −最大值在蒽醌环上的O26、O39原子上,这表明这些原子容易受到亲电攻击。在ClO2降解DOX的过程中,分子中电子密度较高的区域,特别是蒽醌环上的羟基和个别碳原子,更容易受到亲电攻击。静电势图进一步确认了氧原子周围的电子云密度较大,表明这些区域在化学反应中可能更活跃。在DOX分子中,HOMO轨道的高电子密度区域,特别是二羟基取代苯环上的氧原子和碳原子,倾向于吸引亲电试剂的攻击。相反,LUMO轨道覆盖的区域,即蒽醌环上的碳原子和苯环上的含氧双键附近,更可能遭遇亲核试剂的攻击。
-
1) ClO2降解DOX的产物分析。不同pH下降解前后的6组样品所含主要物质的质核比列于表5。根据目标化合物的结构和反应原理,共推测出5种降解产物,HPLC-MS扫描后的质荷比分别为:560、576、387、303、148,所对应氧化产物表示为M+16、M+32、M-157、M-241、M-396(M表示DOX母体质荷比,+或-分别表示产物相较于DOX相对分子质量的损失或者增加,数字表示损失或增加的量)。从表5可以看出,ClO2不能将DOX完全矿化,并且该化合物被ClO2完全降解后中间产物仍然存在,需要对降解的中间产物进一步进行分析。此外,各pH范围下的空白和降解后的样品同样都检测到了m/z=158.15的物质,这是由于在降解后加入硫代硫酸钠进行了猝灭,确定该物质是硫代硫酸钠。m/z 544.17在3组不同pH的降解实验中均被检测到,因此推测可能是该反应物自身。ClO2在降解酸性、碱性、中性条件的DOX下,其产物中都出现了M+16、M+32、M-157、M-241四种产物,产物M-396的质谱峰虽然存在,但非常小,该产物可能立刻被矿化成其他小分子产物。且该产物在ZHAO等[35]研究中也同样出现,因此将该种产物考虑进产物分析中。
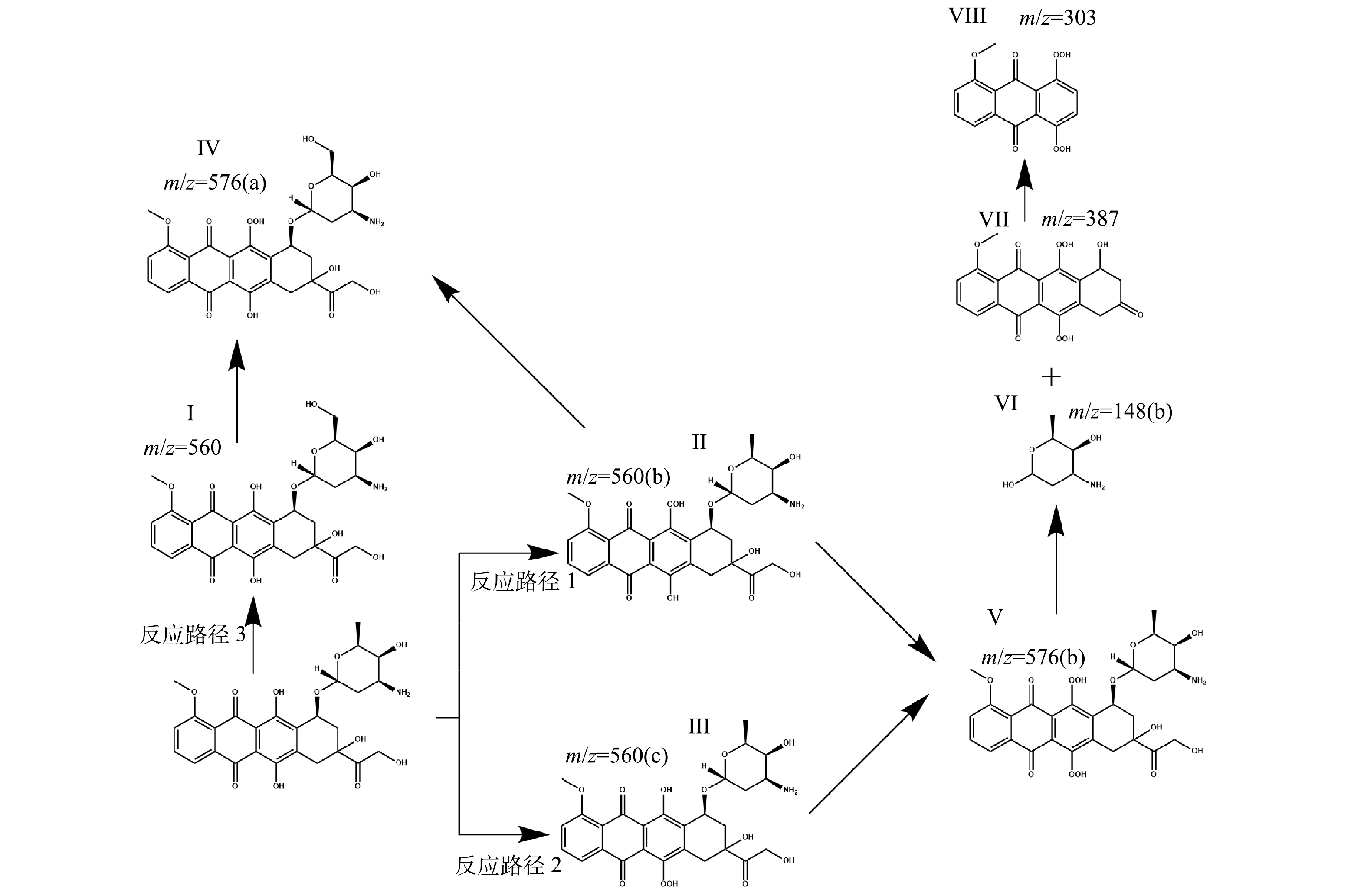
2) ClO2降解DOX的反应途径。HPLC-MS扫描出可能产物结果如图8所示。共推测出8种结构式不同的降解产物,其对应的质荷比分别为560(a)、560(b)、560(c)、576(a)、576(b)、387、303、148,所对应的氧化产物表示为M+16(a)、M+16(b)、M+16(b)、M+32(a)、M+32(b)、M-157、M-241、M-396,其中a、b表示相同的m/z下结构不同的产物。
根据福井函数以及电荷分布计算结果可知DOX分子上的C20、O26、O29容易受到亲电反应攻击。推测的反应路径如图8所示。
反应路径包括以下3个方面:1)反应路径1,含羟基的39号氧原子被ClO2氧化过程产生的自由基攻击后,首先发生自由基的抽氢反应,使氧原子和碳原子处于缺电子状态,氧原子处进一步发生加成反应,得到中间产物Ⅱ;2)反应路径2,含羟基的26号氧原子在ClO2氧化过程产生的自由基攻击后,发生一系列的抽氢和·OH加成反应,得到中间产物Ⅲ,反应中间产物Ⅱ和Ⅲ进一步在ClO2的氧化下生成中间产物Ⅴ,随后12号氧原子与支链上的含氧六元环的13号碳原子发生断裂,与此同时5号碳原子与7号碳原子相连处发生断裂,最终生成产物Ⅵ和Ⅶ;3)反应路径3,C20被ClO2氧化过程产生的自由基攻击后,同样发生自由基的抽氢反应和加成反应得到产物Ⅰ,进一步含羟基的26或39号氧原子与·OH自由基发生反应最终生成产物Ⅳ。产物Ⅶ和Ⅳ通过发生一系列的开环反应生成最终产物Ⅷ。
-
DOX中间产物Ⅰ的logP值为0.77,产物Ⅱ的logP值为0.8,产物Ⅲ的logP值为0.8,产物Ⅳ的logP值为0.3,产物Ⅴ的logP值为−0.16,产物Ⅵ的logP值为−1.37,产物Ⅶ的logP值为0.85,产物Ⅷ的logP值为2.28,DOX的产物的名称与产物分析结果保持一致。从上文可以看出,DOX的logP值均小于5。对于DOX而言,其本身分配系数为1.27,而中间产物Ⅷ的分配系数为2.28,该产物比DOX本身的毒性要大。表明ClO2在DOX的过程中,有毒性更强的产物出现,但部分的中间产物可以继续被降解成毒性较弱的终产物。
-
1) ClO2浓度、DOX的浓度、溶液的pH对去除DOX效果有很大的影响,低浓度ClO2对于在不同温度下DOX降解效果的差异不显著;碱性条件下DOX相较于酸性条件下的去除率及反应速率都快,说明碱性条件下能够加速反应的进行。
2) ClO2对于DOX的降解符合二级反应,反应速率常数为 2.41×10−2 mmol·L−1·s−1;温度越高,DOX的反应速率常数也随之增加。DOX的反应活化能为25.46 kJ·mol−1。
3)根据NPA电荷分布及福井函数综合分析,DOX的主要亲电反应位点分别为O26、O39、C20;通过HPLC-MS检测出的产物结果与量子化学计算所确定的反应位点,推测DOX在被降解过程中经历了抽氢反应、自由基的加成反应。
4)通过计算DOX降解前后的logP值,发现DOX降解过程中产物Ⅷ的logP值大于DOX说明中间产物毒性较强,但部分中间产物可以进一步被ClO2降解为毒性更小的产物。
二氧化氯降解废水中多柔比星的反应动力学与降解机理
Degradation kinetics and mechanism of doxorubicin in wastewater by chlorine dioxide
-
摘要: 近年来,多柔比星等蒽环类抗生素被广泛应用于医疗、畜牧业等,其在水中的半衰期较大,对人类健康和环境产生了较大威胁。二氧化氯(ClO2)因氧化性强且不产生卤代消毒副产物等优点,具有降解抗生素的潜在能力。因此,该研究使用ClO2降解盐酸多柔比星(DOX),探究了影响降解的因素以及反应动力学,此外,利用高相液相色谱-质谱联用分析了降解产物,使用量子化学计算揭示其反应活性位点,通过将实验结果与理论计算结合阐述其降解机理。结果表明,当ClO2质量浓度为0.8 mg·L−1、温度为25 ℃、pH为7.5时,ClO2降解DOX效果最好,降解率为94.07%;ClO2降解DOX符合二级反应动力学模型,反应速率常数为2.41×10−2 mmol·L−1·s−1;反应活化能为Ea=25.46 kJ·mol−1;DOX在碱性条件下比酸性条件下更容易被降解。量子化学计算结果表明,DOX的C—C单键容易受到亲核攻击,O—H键容易受到亲电攻击;O26、O39、C20为亲电反应位点。质谱解析结果发现,DOX被ClO2氧化后发生了自由基的抽氢及加成反应,反应降解产物分别为M+16、M+32、M-157、M-241、M-396,与计算结果基本一致。通过分析DOX降解过程中毒性的变化发现,存在毒性较强的中间产物。Abstract: In recent years, anthracyclines antibiotics including doxorubicin have been widely used in medical treatment and animal husbandry, and their half-life in water is relatively long, which poses a great threat to human health and the environment. Chlorine dioxide (ClO2) has the potential to degrade antibiotics because of its strong oxidation and free of halogenated disinfection byproducts. Therefore, ClO2 was used to degrade Doxorubicin hydrochloride (DOX), and the influencing factors and the reaction kinetics were explored; meanwhile, high performance liquid chromatography-mass spectrometry was used to identify its degradation products; quantum chemical calculations were used to reveal its reactive sites; and the degradation mechanism was illustrated through the combination of experimental results and theoretical calculations. The results showed that the best DOX degradation effect of ClO2 occurred when the concentration of ClO2 was 0.8mg·L−1, the temperature was 25 ℃, and pH was 7.5, and the degradation rate reached 94.07%. DOX degradation by ClO2 conformed to the second-order reaction kinetic model, and the reaction rate constant was 2.41×10−2 mmol·L−1·s−1. The activation energy was 25.46kJ·mol−1. DOX was more easily degraded under alkaline conditions than under acidic conditions.The quantum chemical calculation results showed that the C-C single bond of DOX is vulnerable to nucleophilic attack, and the O-H bond is vulnerable to electrophilic attack. O26, O39 and C20 are electrophilic reaction sites. The results of mass spectrometry showed that free radical hydrogen extraction and addition reactions occurred after DOX was oxidized by ClO2, and the reaction degradation products were M+16, M+32, M-157, M-241, and M-396, respectively, which were basically consistent with the calculated results. It is found that there were more toxic intermediate products by analyzing the changes in toxicity during the degradation of DOX.
-
Key words:
- doxorubicin /
- chlorine dioxide /
- degration kinetics /
- reaction pathway /
- quantum chemical calculation
-
世界卫生组织(world health organization, WHO)称,癌症是全球第二大死亡原因。2020年全球有1 930×104新癌症病例、1 000×104癌症死亡,预计到2032年,每年新增癌症病例将上升到2 200×104,这意味着抗癌类抗生素的消费量将急剧增加[1]。但抗生素使用后不会被生物体完全吸收,其以原药或代谢物的形式通过粪便或者尿液排出体外[2],导致环境中存在大量残留抗生素及其衍生物,并迁移至地表水、地下水并进入饮用水处理及输送系统中[3-4]。在市政污水、污水处理厂、地表水和地下水中,经常可以检测到μg·L−1级的环丙沙星、磺胺类药物、罗红霉素、脱水红霉素等药物[5-7]。抗生素类药物一般都是非特异性的、缺乏选择性,一方面在任何真核生物体中都会引起细胞毒性、基因毒性、诱变、致畸和内分泌干扰作[8-13],改变水环境中的微生物群落,并且导致耐药基因的产生[14-16];另一方面抗生素通过食物链在人体内富集,对人体的肠道疾病产生过敏影响,甚至有些还会产生“三致效应”[17],长期富集抗生素会损害人体的免疫系统,甚至严重的影响各项生理功能[18]。
蒽环类抗生素是一种新型污染物,其代表物柔红霉素、多柔比星、表柔比星等在水环境中的半衰期时间较长,属于难以降解的有机物。目前利用生物降解[19]、吸附[20-21]、光催化氧化[22]、电化学氧化[23-24]等高级氧化技术对该类抗生素进行氧化降解的相关研究较多。FRANQUET等[19]利用序批式反应器(sequencing batch reactor, SBR)对废水中的柔红霉素、多柔比星进行降解实验发现,柔红霉素的降解速率要比多柔比星快很多,反应15 min内,柔红霉素被降解致检测下限,多柔比星仅降解了60%。但生物降解技术在利用微生物处理高浓度抗生素废水的过程时,会对微生物产生毒性作用并且诱导一些致病菌产生耐药性的风险。GHODRATI等[20]使用氧化石墨烯、活性炭和多壁碳纳米管作为吸附材料对柔红霉素进行吸附动力学的比较研究,发现石墨烯具有较短的吸附平衡时间及较高的吸附率,其吸附平衡时间为30 min,能够吸附88%的柔红霉素,而活性炭和多壁碳纳米管材料的吸附平衡时间长达300 min和1 400 min,吸附率仅达到51%和68%。但吸附过程只是将污染物富集,并没有实质性的将污染物进行降解矿化,因此,会存在二次污染的风险。DUMITRU等[22]通过热解草酸铋铁配合物制得BiFeO3,探究其在光催化与单纯的紫外照射对多柔比星的降解差异。结果表明,BiFeO3的光催化在150 min后可去除79%的多柔比星,而单纯紫外照射仅可去除33%。但由于光催化技术对于透光度要求较高,如果水体中的悬浮物较多、色度较高就会影响光催化效果,进而会影响处理效果。
二氧化氯(ClO2)是一种环境友好型的强氧化剂和消毒剂,在水处理工艺中作为氯消毒的替代产品可以有效降解水中有机污染物,去除还原态铁、锰及硫化物等无机污染物,同时不会产生具有三致作用的有机卤代物[25];也可在防疫灭疫、水产畜牧养殖和造纸制浆漂泊等领域中广泛应用。ClO2通过单电子转移的形式与有机物发生氧化还原反应,能够有效降解吡唑酮[26]、氟喹诺酮[27]、磺胺类[28]等药物,因此具有降解抗生素的潜在能力。侯智昊等[29]利用ClO2降解磺胺甲基噁唑和磺胺脒,初始浓度为0.5~2.5 μmol·L−1的磺胺甲基噁唑与初始浓度大于20 μmol·L−1的ClO2反应30 s后,去除率可达到83%以上;而磺胺脒在ClO2初始浓度大于50 μmol·L−1时,反应120 s去除率达到95%;并且酸性条件下会抑制ClO2对磺胺类抗生素的降解,而在碱性条件下反应120 s后几乎都能够完全被降解。
为了充分利用优良消毒剂ClO2的氧化效果,减轻抗生素对环境污染,本研究通过考察ClO2对盐酸多柔比星(DOX)的去除效果、影响因素、反应动力学以及降解机理,可供同类有机污染物的反应参考,也可为进一步确定工程应用参数提供科学依据。对控制环境中的新型抗生素的污染、生物毒性等潜在的环境威胁具有重要的理论意义和应用价值。
1. 材料和方法
1.1 ClO2的制备和DOX来源
采用GB26366-2021《二氧化氯消毒剂卫生要求》A1.4.2的方法制备高纯二氧化氯。二氧化氯母液质量浓度为500 mg·L−1,使用前进行标定。DOX购买于上海阿拉丁生化科技有限公司,色谱纯,纯度为98%。制备DOX标准溶液时,称取0.05 g DOX,用少量超纯水溶解后转至50 mL的容量瓶中,将制得质量浓度为1.0 g·L−1的标准溶液放在4 ℃的冰箱中避光存储。
1.2 ClO2对DOX降解效果及影响因素实验
1) ClO2初始浓度对降解效果的影响实验。反应容器采用体积为100 mL的聚四氟乙烯玻璃瓶,用锡纸包裹住避光。量取60 mL质量浓度5 mg·L−1的DOX于聚四氟乙烯玻璃瓶中,调节pH为7.5±0.1,放在恒温水浴磁力搅拌器中,设定温度为(25±1) ℃。加入质量浓度为0.2、0.4、0.6、0.8、1.0 mg·L−1的ClO2对DOX进行降解。开启磁力搅拌器,控制转速为200 r·min−1,用移液枪分别在0、5、10、20、30 min吸取5 mL的反应溶液于已经盛有20 μL的0.05 mol·L−1的硫代硫酸钠溶液的棕色小瓶中终止反应。
2)温度对降解效果的影响实验。ClO2质量浓度为0.6 mg·L−1,溶液pH控制在7.5±0.1。对于实验过程中低温条件,利用恒温磁力搅拌器进行加热控制;对于高温条件,利用冰块水浴降温。
3) pH对降解效果的影响实验。实验过程基本与上述方法基本相同,ClO2质量浓度为0.6 mg·L−1,用HCl和NaOH对DOX溶液进行调节所需pH条件,同时控制溶液温度为(25±1) ℃。
4)抗生素浓度对降解效果的影响实验。ClO2质量浓度为0.6 mg·L−1,量取60 mL质量浓度为2、5、10、15、20 mg·L−1的DOX于聚四氟乙烯玻璃瓶中,控制pH为7.5±0.1、温度为(25±1) ℃,放在恒温水浴磁力搅拌器中,使用移液枪分别在0、5、10、20、30 min吸取5 mL的反应溶液,用硫代硫酸钠进行淬灭。
1.3 ClO2降解DOX反应动力学实验
1) ClO2降解DOX反应速率常数及反应级数实验。取60 mL质量浓度为5 mg·L−1的DOX浓度于100 mL聚四氟乙烯玻璃瓶中,再加入高浓度的ClO2溶液,使其混合后溶液中ClO2质量浓度大于50 mg·L−1,即超过DOX初始浓度的10倍以上,在水浴中保持反应温度为(25±1) ℃,开启磁力搅拌器,控制转速为200 r·min−1。使用移液枪分别在0、20、40、60、120 s时吸取5 mL反应DOX后的溶液,用硫代硫酸钠进行淬灭。
2) pH对DOX的反应速率常数影响实验。DOX质量浓度为5 mg·L−1,ClO2质量浓度为6.5 mg·L−1,控制反应温度为(25±1) ℃,溶液pH分别为5.2、7.5、8.2、9.0。
3)温度对DOX的反应速率常数影响实验。DOX初始质量浓度为5 mg·L−1,ClO2质量浓度为6.5 mg·L−1条件下,溶液pH为7.5±0.1,控制反应温度为7、14、20、30 ℃。
本文中各参数采用孤立变量法确定,使ClO2浓度大于DOX的10倍以上,可视为ClO2在反应的整个过程中浓度几乎不变,因此ClO2降解DOX的反应动力学方程根据式(1)和式(2)计算。
ν=dcDOXdt=−kobs[DOX]n2 (1) kobs=kapp[ClO2] (2) 式中:
dcDOXdt kobs kapp 1.4 DOX分析方法
本研究利用高效液相色谱(HPLC,LC-10AT)对DOX的标准样品和降解后样品的残留含量进行检测,根据峰面积的进行定量分析,所用色谱柱型号为ZORBAX SB-C18。每次做3组平行实验,取平均值。
检测DOX的色谱条件如下。流动相为甲醇∶ 0.01 mol·L−1磷酸二氢铵(NH4H2PO3)∶乙酸=30∶20∶0.1。色谱条件:检测波长为254 nm,进样量为20 μL,柱温为25 ℃,流速为1.0 mL·min−1,DOX的保留时间为4.5 min。
1.5 降解产物的分析方法
DOX降解产物采用高效液相色谱-质谱联用仪,仪器型号为赛默飞世尔公司静电场轨道阱质谱联用仪(HPLC—MS),色谱柱为Themo Scientific TM Hypersil GOLD C18 Column(50×2.1 mm,1.9 μm)。DOX采用梯度洗脱,流动相A为水,B为乙腈,0~1 min 5% B,1~8 min 5%~70% B,8~9 min 70%~100% B,9~14 min 100% B,14~14.1 min 100%~50% B,14.1~17 min 5% B,流速为0.3 mL·min−1,进样量10 μL,柱温为30 ℃。质谱方法为ESI+正离子模式;气帘气,35 Pa;Gas 1,45 psi;Gas 2,45 psi;温度为500 ℃;离子化压力为5 000 V,去簇电压为70 V;全扫描范围,m/z 150~
1800 ;裂解电压为5 V;CE Spread, 0 V。1.6 量子化学计算
本研究利用Gaussian 16软件的B3LYP/6-31G(d,p)方法对DOX分子进行结构优化,再利用更精密的基组6-311++G(2d,p)进一步分析,选用高级别基组的目的是在研究化学反应的机理,特别是过渡态和反应路径时,高级别的基组可以提供更可靠的能量梯度和几何结构;使用DFT方法,经B3LYP密度泛函的6-311++G(2d,p)基组进行结构优化;再利用Gaussian View以三维形式查看分子轨道,找到分子中能量最高的占据轨道(HOMO)和能量最低的未占据轨道(LUMO)。选用极化连续介质模型,所选溶剂为水进行相关的化学计算。本文所用到的量子化学计算描述符有最高占据分子轨道(HOMO)、最低未占据分子轨道(LUMO)、前线轨道能隙(ΔE)(式(3))、化学势(μ)(式(4))、硬度(η)(式(5))、亲电指数(ω)(式(6)),利用这些参数分析DOX的相关反应特性。
ΔE=|EHOMO−ELUMO| (3) μ=I+A2 (4) η=I−A2 (5) ω=μ22η (6) 式中:ΔE为前线轨道能隙,eV;EHOMO为最高占据分子轨道的能量,eV;ELUMO为最低未占据分子轨道的能量,eV;μ为化学势,eV;η为硬度,eV;ω为亲电指数,eV;I为电离势,eV;A为电子亲和能,eV。
1.7 福井函数
为了探究不同分子中不同位点的反应活性,FUKUI等 [30]引入了福井函数(Fukui)这一理论。分子中每个原子的亲电攻击、亲核攻击、自由基攻击的Fukui函数分别根据式(7)、式(8)和式(9)计算。
f−(r)=qi(N)−qi(N−1) (7) f+(r)=qi(N+1)−qi(N) (8) f0(r)=f−(r)+f+(r)2 (9) 式中:
qi(N)、qi(N−1)、qi(N+1) f+(r) f−(r) f0(r) 1.8 分配系数的计算
本文通过计算每种降解产物的分配系数(logP)来判断产物的脂溶性,进而推断ClO2对DOX降解后的产物潜在的健康风险。logP数值越大,说明该物质具有亲脂性越强,数值越小说明亲水性越强。一般情况下,当logP≤5时,对生物的致死性和慢性毒性随着数值的增大而增大[31]。本文采用中国科学院上海有机化学研究所开发的XLOGP3工具[32],对优化后蒽环类抗生素分子本身、以及被ClO2降解后产物的logP进行计算,通过分析降解前后毒性变化来评估潜在的风险。
2. 结果与讨论
2.1 ClO2对DOX的降解效果及影响因素
1) ClO2初始浓度对降解效果的影响。当温度为(25±1) ℃、pH为7.5±0.1、DOX初始质量浓度为5 mg·L−1时,ClO2初始浓度对降解效果的影响情况如图1(a)所示。由图1(a)可以看出,随着ClO2的浓度增加,DOX的去除率均有上升,当ClO2质量浓度高于0.6 mg·L−1后,DOX去除率上升趋势减缓。这是由于ClO2的氧化能力随其浓度的增加而显著提升,从而有效地攻击和破坏DOX分子中的化学键,但当ClO2质量浓度超过0.6 mg·L−1后,几乎所有的DOX分子均已与ClO2充分反应,导致反应体系趋近于饱和状态,因此,进一步增加ClO2浓度并不会显著提高去除率。此外反应时间在5 min内去除效果显著,5 min后反应几乎达到平衡状态。DOX在接触0.2、0.4、0.6、0.8、1.0 mg·L−1的ClO2 30 min后,降解率分别为35.31%、40.95%、66.97%、93.09%、94.07%,增加ClO2浓度能够有效地去除DOX。
2)温度对降解效果的影响。当pH为7.5±0.1、DOX初始质量浓度为5 mg·L−1、ClO2初始质量浓度为0.6 mg·L−1时,温度对降解效果的影响结果如图1(b)所示。由图1(b)可看出,随着温度的升高,ClO2对DOX的去除率没有显著变化,30 min后去除率分别达到48.32%、50.65%、63.22%、60.45%、60.33%,这表明ClO2去除DOX的能力受温度影响很小。
3) pH对降解效果的影响。当温度为(25±1) ℃,DOX初始质量浓度为5 mg·L−1,ClO2初始质量浓度为0.6 mg·L−1时,pH对降解效果的影响结果如图1(c)所示。由图1(c)可以看出,随着溶液pH的增加ClO2对DOX的降解效果显著增加。DOX溶液在pH为4.8、5.2、7.5、8.5、9.5接触30 min后去除率分别达到54.02%、62.25%、66.18%、64.22%、67.80%。酸性条件下对DOX的降解率要弱于碱性,这是因为ClO2的氧化还原电位与pH呈线性关系,当pH每增加1,其氧化还原电位增加0.062 V[33],因此ClO2氧化能力也随之增加。
4) DOX浓度对降解效果的影响。当温度为(25±1) ℃、pH为7.5±0.1、ClO2初始质量浓度为0.6 mg·L−1时,DOX浓度对降解效果的影响结果如图1(d)所示。由图1(d)可以看出,DOX的去除率随着其初始浓度的增加而明显降低,DOX初始质量浓度为2、5、10、15、20 mg·L−1时,与ClO2反应30 min后去除率分别达到93.41%、78.28%、49.5%、40.16%、28.43%。因为ClO2初始质量浓度较低仅为0.6 mg·L−1,去除率过低有可能是由于ClO2添加量过低,大量DOX未能与ClO2反应而残留导致降解效率低。
2.2 ClO2降解DOX的反应动力学
1) ClO2降解DOX反应速率常数及反应级数。不同ClO2浓度下ln(c0/ct)对反应时间t作图,结果如图2(a)所示。由图2(a)可以看出,ln(c0/ct)与时间呈良好的线性关系(R2>0.98),该反应同样符合拟一级动力学模型,因此DOX的反应级数为1。将图2(a)中的每条拟合直线斜率(即kobs)与ClO2浓度进行拟合得到一条直线,如图2(b)所示。可以看出kobs与ClO2浓度呈良好的线性关系(R2=0.992),反应速率随着ClO2浓度的增加而加快,所以ClO2反应级数为1,因此该回归直线的斜率为反应的二级反应速率常数,kapp=2.41×102 M−1·s−1,因此ClO2降解DOX符合二级反应动力学模型。不同ClO2浓度与DOX反应动力学参数如表1所示。
表 1 不同ClO2浓度下降解DOX动力学参数Table 1. Kinetic parameters of DOX degradation by ClO2 at different concentrations[ClO2]0/(mg·L−1) kobs/s−1 T1/2/s R2 6.5 0.024 98 27.45 0.998 7.0 0.026 22 26.44 0.994 8.0 0.028 34 24.46 0.987 9.0 0.031 59 21.94 0.988 2) pH对DOX的反应速率常数影响。在不同pH下将ln(c0/ct)对反应时间t作图(图3(a));pH与kobs关系如图3(b)所示。由图3(a)和图3(b)可看出,当pH=5.2~9.0时,ClO2对DOX降解速率逐渐升高,反应速率常数由2.00×10−3 s−1上升到4.03×10−2 s−1。表明酸性条件下抑制ClO2对DOX的降解,而碱性条件下能够促进降解。
3)温度对DOX的反应速率常数影响。不同温度下ln(c0/ct)与反应时间t关系如图4(a)所示,Ea可以通过kapp与温度拟合得到,拟合结果见图4(b),不同温度下各反应的动力学参数见表2。由图4(a)~(b)可看出:kapp与温度之间有良好的线性关系(R2=0.995);根据拟合曲线斜率可以计算出ClO2与DOX反应活化能为25.46 kJ·mol−1。由表2可以得到,温度每升高10 ℃,kapp会增加1.41倍。因此,当温度升高,DOX的反应速率上升。这是因为温度升高,反应体系中分子平均动能增大,活化分子增多,反应体系中各分子有效碰撞次数增加,使反应速率加快。
表 2 不同温度下ClO2降解DOX的反应动力学参数Table 2. Kinetic parameters of DOX degradation by ClO2 at different temperatures温度/℃ kobs/s−1 kapp/(mmol·(L·s)−1) R2 7 0.012 82 133.04 0.982 14 0.019 99 207.45 0.989 20 0.030 13 312.68 0.988 30 0.042 53 441.37 0.994 2.3 ClO2降解DOX的机理
1) DOX分子结构与反应活性位点分析。分子的结构能够反映出分子的反应活性,对DOX进行结构优化后的图形见图5,分子主要键长的信息见表3。从表3可以看出,从整体上看DOX分子上的C—C、C=C、C—O、C=O、C—H、O—H、C—N、N—H的键长平均值分别为1.516 2、1.401 1、1.408 4、1.226 4、1.089 1、0.975 8、1.464 8、1.017 0 Å。与苯环上的C—C单键的键长相比,支链上的C5—C7单键以及含氧六元环上的C—C单键的键长较大。键长顺序为C—C>C—N>C—O>C=O>C—H>N—H>O—H。从上述结果可以看出,DOX分子中支链上和含氧六元环上的C—C单键在降解过程中很容易受到亲核攻击[34],且O—H键相较于其他类型的化学键的键长均小,说明该化学键容易受到亲电攻击。
表 3 DOX的键长Table 3. Bond length of DOX化学键 键长 /Å 化学键 键长 /Å 化学键 键长 /Å C1—C2 1.384 4 C7—C8 1.530 3 C15—H52 1.093 16 C2—C3 1.513 2 C5—O11 1.427 68 C16—H53 1.092 45 C3—C4 1.526 73 C8—O9 1.438 1 C18—H55 1.093 86 C4—C5 1.541 98 C25—O26 1.357 34 C20—H56 1.090 61 C5—C6 1.551 78 C22—O39 1.342 57 C20—H57 1.090 88 C1—C25 1.406 806 C32—O36 1.344 38 C20—H58 1.091 67 C22—C23 1.410 19 C37—O36 1.431 35 C35—H64 1.080 07 C23—C24 1.417 93 C3—O12 1.441 54 C24—H63 1.082 75 C24—C25 1.402 01 O12—C13 1.412 31 C33—H62 1.078 81 C23—C30 1.471 68 C13—O19 1.420 48 C37—H66 1.091 54 C29—C30 1.469 62 C18—O19 1.444 57 C37—H67 1.091 51 C28—C29 1.408 09 C16—O17 1.432 25 C37—H65 1.086 36 C27—C28 1.493 56 C30—O31 1.245 67 C15—N21 1.464 81 C24—C27 1.475 73 C27—O38 1.223 91 N21—H59 1.016 56 C29—C32 1.421 08 C7—O10 1.209 52 N21—H60 1.017 5 C32—C33 1.399 35 C3—H40 1.088 06 O9—H41 0.966 93 C33—C34 1.385 47 C4—H41 1.089 86 O11—H48 0.966 04 C34—C35 1.386 5 C4—H42 1.089 7 O17—H54 0.966 76 C28—C35 1.388 76 C6—H44 1.091 73 O39—H68 1.000 57 C13—C14 1.521 01 C6—H43 1.085 42 O26—H61 0.978 63 C14—C15 1.529 72 C8—H45 1.084 75 C1—C6 1.503 36 C15—C16 1.540 17 C8—H46 1.091 07 C16—C18 1.528 21 C13—H49 1.092 06 C18—C20 1.514 04 C14—H51 1.093 32 C5—C7 1.535 75 C14—H50 1.090 1 DOX的静电势和前线分子轨道能量等信息预示着其具有不同的反应特性,但具体的反应活性位点仍不明确。而亲电自由基的反应活性对于有机分子反应途径的研究及为重要。利用福井函数对DOX的亲核反应位点、亲电反应位点及自由基反应位点进行分析。表4列出DOX的亲核攻击(f +)和亲电攻击(f −)。一般情况下,福井函数值越大,说明该原子为主要攻击位点。由表4可以看出,DOX的f −最大值在蒽醌环上的O26、O39原子上,说明O26和O39容易受到亲电攻击。
表 4 DOX中每个原子福井函数值Table 4. Fukui function values per atom for DOX原子 f − f + 原子 f − f + 原子 f − f + 1C 0.024 6 0.043 6 24C 0.034 5 0.018 5 47H 0.003 8 0.002 2 2C 0.024 7 0.041 5 25C 0.048 7 0.025 2 48H 0.005 2 0.007 5 3C 0.002 9 0.005 8 26O 0.066 8 0.022 4 49H 0.002 1 0.005 6 4C 0.004 0.004 1 27C 0.008 7 0.052 4 50H 0.004 3 0.001 1 5C 0.002 6 0.003 28C 0.001 3 0.024 9 51H 0.006 9 0.004 5 6C 0.004 5 0.006 8 29C 0.004 7 0.017 2 52H 0.008 1 0 7C 0.000 2 0.000 3 30C 0.008 4 0.063 6 53H 0.011 7 0.006 7 8C 0.005 1 0.004 5 31O 0.023 5 0.079 5 54H 0.005 9 0.000 1 9O 0.001 5 0.000 2 32C 0.018 0.023 2 55H 0.003 4 0.000 3 10O 0.010 6 0.007 4 33C 0.024 3 0.040 6 56H 0.006 0.003 6 11O 0.014 7 0.014 7 34C 0.025 7 0.049 1 57H 0.005 1 0.000 7 12O 0.006 2 0.007 3 35C 0.025 6 0.025 2 58H 0.009 2 0.007 13C 0.000 3 0.000 9 36O 0.019 1 0.010 8 59H 0.022 5 0.006 4 14C 0.003 3 0.000 3 37C 0.008 8 0.011 2 60H 0.019 9 0.003 9 15C 0.009 4 0.000 8 38O 0.033 3 0.083 5 61H 0.017 5 0.011 6 16C 0.010 4 0.001 6 39O 0.072 4 0.035 3 62H 0.014 8 0.023 2 17O 0.019 5 0.006 8 40H 0.005 8 0.007 8 63H 0.017 1 0.028 18C 0.004 6 0.000 8 41H 0.011 6 0.014 4 64H 0.013 1 0.018 3 19O 0.004 1 0.001 5 42H 0.005 4 0.004 2 65H 0.009 7 0.014 20C 0.005 8 0.002 1 43H 0.007 5 0.008 9 66H 0.009 7 0.011 5 21N 0.033 6 0.003 9 44H 0.009 3 0.013 2 67H 0.010 1 0.011 8 22C 0.042 5 0.022 45H 0.011 8 0.011 1 68H 0.015 3 0.012 23C 0.038 2 0.013 46H 0.005 0.005 2 2) NPA(natural population analysis)电荷分布分析。ClO2降解DOX的过程会发生电子的得失,而分子的电荷分布影响其反应特性。DOX分子的静电荷分布,其中C1、C2、C4、C6、C8、C14、C15、C20、C23、C24、C28、C29、C34、C35、C37所带电荷为−0.035、−0.123、−0.404、−0.437、−0.110、−0.426、−0.045、−0.584、−0.213、−0.139、−0.074、−0.172、−0.158、−0.180、−0.199 a.u.,其余的碳原子均带正电,所有的氧原子均带负电,其中O26和O39所带电荷为-0.698和-0.720 a.u.,所有氢原子均带正电,反应过程中C20、O39、O26容易受到亲电攻击。DOX在发生降解的过程中蒽醌环上的羟基取代基中的氧原子以及个别碳原子容易发生亲电攻击。图6为DOX的静电势图,其中蓝色到红色区域表示电子云由稀疏到密集部分。可以看到DOX的电子云密度较大的区域主要集中在氧原子周围,电子云密度较小的区域主要集中在碳原子与氢原子周围。
3)前线分子轨道分析。HOMO和LUMO轨道图形能够直观地看到分子容易得失电子的区域。若分子中的某部分被HOMO轨道所覆盖区域较大,说明该区域容易发生失去电子的情况;若分子中的某部分被LUMO轨道所覆盖区域大,说明该区域容易发生得电子的情况。图7显示了DOX前线分子轨道图,其中绿色区域代表正相位、红色区域代表负相位。从图7中可以看到,对于DOX的HOMO轨道主要聚集在二羟基取代苯环上的氧原子与碳原子周围,说明该区域容易受到亲电试剂攻击,其LUMO轨道分布主要集中在蒽醌环上的碳原子周围和苯环上的含氧双键周围,则该区域容易发生亲核试剂攻击。DOX的最高占据分子轨道能量为−5.95 eV,最低未占据分子轨道能量为−2.88 eV,前线轨道能隙为3.069 eV,化学势为4.42 eV,硬度为1.54 eV,亲电指数为6.34 eV,电离势为5.95 eV,电子亲合能为2.88 eV。
综上所述,通过分子结构与反应活性位点分析可知DOX分子中支链上和含氧六元环上的C-C单键相对较长,这使它们在降解过程中更容易受到亲核攻击。O—H键的键长数值较小,表明这个化学键容易受到亲电攻击。福井函数的f +和f −指数表明,DOX的f −最大值在蒽醌环上的O26、O39原子上,这表明这些原子容易受到亲电攻击。在ClO2降解DOX的过程中,分子中电子密度较高的区域,特别是蒽醌环上的羟基和个别碳原子,更容易受到亲电攻击。静电势图进一步确认了氧原子周围的电子云密度较大,表明这些区域在化学反应中可能更活跃。在DOX分子中,HOMO轨道的高电子密度区域,特别是二羟基取代苯环上的氧原子和碳原子,倾向于吸引亲电试剂的攻击。相反,LUMO轨道覆盖的区域,即蒽醌环上的碳原子和苯环上的含氧双键附近,更可能遭遇亲核试剂的攻击。
2.4 ClO2降解DOX的降解产物分析及降解途径
1) ClO2降解DOX的产物分析。不同pH下降解前后的6组样品所含主要物质的质核比列于表5。根据目标化合物的结构和反应原理,共推测出5种降解产物,HPLC-MS扫描后的质荷比分别为:560、576、387、303、148,所对应氧化产物表示为M+16、M+32、M-157、M-241、M-396(M表示DOX母体质荷比,+或-分别表示产物相较于DOX相对分子质量的损失或者增加,数字表示损失或增加的量)。从表5可以看出,ClO2不能将DOX完全矿化,并且该化合物被ClO2完全降解后中间产物仍然存在,需要对降解的中间产物进一步进行分析。此外,各pH范围下的空白和降解后的样品同样都检测到了m/z=158.15的物质,这是由于在降解后加入硫代硫酸钠进行了猝灭,确定该物质是硫代硫酸钠。m/z 544.17在3组不同pH的降解实验中均被检测到,因此推测可能是该反应物自身。ClO2在降解酸性、碱性、中性条件的DOX下,其产物中都出现了M+16、M+32、M-157、M-241四种产物,产物M-396的质谱峰虽然存在,但非常小,该产物可能立刻被矿化成其他小分子产物。且该产物在ZHAO等[35]研究中也同样出现,因此将该种产物考虑进产物分析中。
表 5 ClO2降解DOX前后m/z的质谱扫描结果Table 5. The mass spectrometry scan results of m/z before and after DOX degradation by ClO2反应条件 降解前 降解后 未调节pH 544.17、149.02、344.22、470.36、388.25、475.32、518.88、158.15、158.15 474.78、406.79、544.17、303.12、576.16、459.27、503.31、576.17、387.18、158.15、149.02 酸性条件 544.17、425.21、453.34、396.80、405.81、149.02、154.99、149.02、432.28、388.25、432.28、476.31、566.43、588.41、158.15 562.66、412.77、544.17、149.02、388.25、520.33、503.31、547.33、407.79、303.12、509.88、560.17、158.15、576.17、387.18、158.15 碱性条件 544.17、344.23、415.25、476.31、453.34、520.33、564.35、340.25、158.15 560.17、149.02、544.17、303.12、458.80、562.66、548.70、592.15、594.16、476.30、158.15、576.17、560.18、387.18、158.15 2) ClO2降解DOX的反应途径。HPLC-MS扫描出可能产物结果如图8所示。共推测出8种结构式不同的降解产物,其对应的质荷比分别为560(a)、560(b)、560(c)、576(a)、576(b)、387、303、148,所对应的氧化产物表示为M+16(a)、M+16(b)、M+16(b)、M+32(a)、M+32(b)、M-157、M-241、M-396,其中a、b表示相同的m/z下结构不同的产物。
根据福井函数以及电荷分布计算结果可知DOX分子上的C20、O26、O29容易受到亲电反应攻击。推测的反应路径如图8所示。
反应路径包括以下3个方面:1)反应路径1,含羟基的39号氧原子被ClO2氧化过程产生的自由基攻击后,首先发生自由基的抽氢反应,使氧原子和碳原子处于缺电子状态,氧原子处进一步发生加成反应,得到中间产物Ⅱ;2)反应路径2,含羟基的26号氧原子在ClO2氧化过程产生的自由基攻击后,发生一系列的抽氢和·OH加成反应,得到中间产物Ⅲ,反应中间产物Ⅱ和Ⅲ进一步在ClO2的氧化下生成中间产物Ⅴ,随后12号氧原子与支链上的含氧六元环的13号碳原子发生断裂,与此同时5号碳原子与7号碳原子相连处发生断裂,最终生成产物Ⅵ和Ⅶ;3)反应路径3,C20被ClO2氧化过程产生的自由基攻击后,同样发生自由基的抽氢反应和加成反应得到产物Ⅰ,进一步含羟基的26或39号氧原子与·OH自由基发生反应最终生成产物Ⅳ。产物Ⅶ和Ⅳ通过发生一系列的开环反应生成最终产物Ⅷ。
2.5 产物的分配系数
DOX中间产物Ⅰ的logP值为0.77,产物Ⅱ的logP值为0.8,产物Ⅲ的logP值为0.8,产物Ⅳ的logP值为0.3,产物Ⅴ的logP值为−0.16,产物Ⅵ的logP值为−1.37,产物Ⅶ的logP值为0.85,产物Ⅷ的logP值为2.28,DOX的产物的名称与产物分析结果保持一致。从上文可以看出,DOX的logP值均小于5。对于DOX而言,其本身分配系数为1.27,而中间产物Ⅷ的分配系数为2.28,该产物比DOX本身的毒性要大。表明ClO2在DOX的过程中,有毒性更强的产物出现,但部分的中间产物可以继续被降解成毒性较弱的终产物。
3. 结论
1) ClO2浓度、DOX的浓度、溶液的pH对去除DOX效果有很大的影响,低浓度ClO2对于在不同温度下DOX降解效果的差异不显著;碱性条件下DOX相较于酸性条件下的去除率及反应速率都快,说明碱性条件下能够加速反应的进行。
2) ClO2对于DOX的降解符合二级反应,反应速率常数为 2.41×10−2 mmol·L−1·s−1;温度越高,DOX的反应速率常数也随之增加。DOX的反应活化能为25.46 kJ·mol−1。
3)根据NPA电荷分布及福井函数综合分析,DOX的主要亲电反应位点分别为O26、O39、C20;通过HPLC-MS检测出的产物结果与量子化学计算所确定的反应位点,推测DOX在被降解过程中经历了抽氢反应、自由基的加成反应。
4)通过计算DOX降解前后的logP值,发现DOX降解过程中产物Ⅷ的logP值大于DOX说明中间产物毒性较强,但部分中间产物可以进一步被ClO2降解为毒性更小的产物。
-
表 1 不同ClO2浓度下降解DOX动力学参数
Table 1. Kinetic parameters of DOX degradation by ClO2 at different concentrations
[ClO2]0/(mg·L−1) kobs/s−1 T1/2/s R2 6.5 0.024 98 27.45 0.998 7.0 0.026 22 26.44 0.994 8.0 0.028 34 24.46 0.987 9.0 0.031 59 21.94 0.988 表 2 不同温度下ClO2降解DOX的反应动力学参数
Table 2. Kinetic parameters of DOX degradation by ClO2 at different temperatures
温度/℃ kobs/s−1 kapp/(mmol·(L·s)−1) R2 7 0.012 82 133.04 0.982 14 0.019 99 207.45 0.989 20 0.030 13 312.68 0.988 30 0.042 53 441.37 0.994 表 3 DOX的键长
Table 3. Bond length of DOX
化学键 键长 /Å 化学键 键长 /Å 化学键 键长 /Å C1—C2 1.384 4 C7—C8 1.530 3 C15—H52 1.093 16 C2—C3 1.513 2 C5—O11 1.427 68 C16—H53 1.092 45 C3—C4 1.526 73 C8—O9 1.438 1 C18—H55 1.093 86 C4—C5 1.541 98 C25—O26 1.357 34 C20—H56 1.090 61 C5—C6 1.551 78 C22—O39 1.342 57 C20—H57 1.090 88 C1—C25 1.406 806 C32—O36 1.344 38 C20—H58 1.091 67 C22—C23 1.410 19 C37—O36 1.431 35 C35—H64 1.080 07 C23—C24 1.417 93 C3—O12 1.441 54 C24—H63 1.082 75 C24—C25 1.402 01 O12—C13 1.412 31 C33—H62 1.078 81 C23—C30 1.471 68 C13—O19 1.420 48 C37—H66 1.091 54 C29—C30 1.469 62 C18—O19 1.444 57 C37—H67 1.091 51 C28—C29 1.408 09 C16—O17 1.432 25 C37—H65 1.086 36 C27—C28 1.493 56 C30—O31 1.245 67 C15—N21 1.464 81 C24—C27 1.475 73 C27—O38 1.223 91 N21—H59 1.016 56 C29—C32 1.421 08 C7—O10 1.209 52 N21—H60 1.017 5 C32—C33 1.399 35 C3—H40 1.088 06 O9—H41 0.966 93 C33—C34 1.385 47 C4—H41 1.089 86 O11—H48 0.966 04 C34—C35 1.386 5 C4—H42 1.089 7 O17—H54 0.966 76 C28—C35 1.388 76 C6—H44 1.091 73 O39—H68 1.000 57 C13—C14 1.521 01 C6—H43 1.085 42 O26—H61 0.978 63 C14—C15 1.529 72 C8—H45 1.084 75 C1—C6 1.503 36 C15—C16 1.540 17 C8—H46 1.091 07 C16—C18 1.528 21 C13—H49 1.092 06 C18—C20 1.514 04 C14—H51 1.093 32 C5—C7 1.535 75 C14—H50 1.090 1 表 4 DOX中每个原子福井函数值
Table 4. Fukui function values per atom for DOX
原子 f − f + 原子 f − f + 原子 f − f + 1C 0.024 6 0.043 6 24C 0.034 5 0.018 5 47H 0.003 8 0.002 2 2C 0.024 7 0.041 5 25C 0.048 7 0.025 2 48H 0.005 2 0.007 5 3C 0.002 9 0.005 8 26O 0.066 8 0.022 4 49H 0.002 1 0.005 6 4C 0.004 0.004 1 27C 0.008 7 0.052 4 50H 0.004 3 0.001 1 5C 0.002 6 0.003 28C 0.001 3 0.024 9 51H 0.006 9 0.004 5 6C 0.004 5 0.006 8 29C 0.004 7 0.017 2 52H 0.008 1 0 7C 0.000 2 0.000 3 30C 0.008 4 0.063 6 53H 0.011 7 0.006 7 8C 0.005 1 0.004 5 31O 0.023 5 0.079 5 54H 0.005 9 0.000 1 9O 0.001 5 0.000 2 32C 0.018 0.023 2 55H 0.003 4 0.000 3 10O 0.010 6 0.007 4 33C 0.024 3 0.040 6 56H 0.006 0.003 6 11O 0.014 7 0.014 7 34C 0.025 7 0.049 1 57H 0.005 1 0.000 7 12O 0.006 2 0.007 3 35C 0.025 6 0.025 2 58H 0.009 2 0.007 13C 0.000 3 0.000 9 36O 0.019 1 0.010 8 59H 0.022 5 0.006 4 14C 0.003 3 0.000 3 37C 0.008 8 0.011 2 60H 0.019 9 0.003 9 15C 0.009 4 0.000 8 38O 0.033 3 0.083 5 61H 0.017 5 0.011 6 16C 0.010 4 0.001 6 39O 0.072 4 0.035 3 62H 0.014 8 0.023 2 17O 0.019 5 0.006 8 40H 0.005 8 0.007 8 63H 0.017 1 0.028 18C 0.004 6 0.000 8 41H 0.011 6 0.014 4 64H 0.013 1 0.018 3 19O 0.004 1 0.001 5 42H 0.005 4 0.004 2 65H 0.009 7 0.014 20C 0.005 8 0.002 1 43H 0.007 5 0.008 9 66H 0.009 7 0.011 5 21N 0.033 6 0.003 9 44H 0.009 3 0.013 2 67H 0.010 1 0.011 8 22C 0.042 5 0.022 45H 0.011 8 0.011 1 68H 0.015 3 0.012 23C 0.038 2 0.013 46H 0.005 0.005 2 表 5 ClO2降解DOX前后m/z的质谱扫描结果
Table 5. The mass spectrometry scan results of m/z before and after DOX degradation by ClO2
反应条件 降解前 降解后 未调节pH 544.17、149.02、344.22、470.36、388.25、475.32、518.88、158.15、158.15 474.78、406.79、544.17、303.12、576.16、459.27、503.31、576.17、387.18、158.15、149.02 酸性条件 544.17、425.21、453.34、396.80、405.81、149.02、154.99、149.02、432.28、388.25、432.28、476.31、566.43、588.41、158.15 562.66、412.77、544.17、149.02、388.25、520.33、503.31、547.33、407.79、303.12、509.88、560.17、158.15、576.17、387.18、158.15 碱性条件 544.17、344.23、415.25、476.31、453.34、520.33、564.35、340.25、158.15 560.17、149.02、544.17、303.12、458.80、562.66、548.70、592.15、594.16、476.30、158.15、576.17、560.18、387.18、158.15 -
[1] International Agency for Research on Cancer. Latest global cancer data: Cancer burden rises to 19.3 million new cases and 10.0 million cancer deaths in 2020[R]. World Health Organization, 2020. [2] QIN K, ZHAO Q, YU H, et al. A review of bismuth-based photocatalysts for antibiotic degradation: Insight into the photocatalytic degradation performance, pathways and relevant mechanisms[J]. Environmental Research, 2021, 199: 111360. doi: 10.1016/j.envres.2021.111360 [3] KÜMMERER K. Significance of antibiotics in the environment[J]. Journal of Antimicrobial Chemotherapy, 2003, 52(1): 5-7. doi: 10.1093/jac/dkg293 [4] WANG J, ZHUAN R. Degradation of antibiotics by advanced oxidation processes: An overview[J]. Science of The Total Environment, 2020, 701: 135023. doi: 10.1016/j.scitotenv.2019.135023 [5] KOLPIN D W, FURLONG E T, MEYER M T, et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in U. S. streams, 1999−2000: a national reconnaissance[J]. Environmental Science & Technology, 2002, 36(6): 1202-1211. [6] ZUCCATO E, CALAMARI D, NATANGELO M, et al. Presence of therapeutic drugs in the environment[J]. The Lancet, 2000, 355(9217): 1789-1790. doi: 10.1016/S0140-6736(00)02270-4 [7] GOLET E M , ALDER A C, HARTMANN A, et al. Trace determination of fluoroquinolone antibacterial agents in urban wastewater by solid-phase extraction and liquid chromatography with fluorescence detection[J]. Analytical Chemistry, 2001, 73(15): 3632-3638. [8] KÜMMERER K, AL AHMAD A, BERTRAM B, et al. Biodegradability of antineoplastic compounds in screening tests: Influence of glucosidation and of stereochemistry[J]. Chemosphere, 2000, 40(7): 767-773. doi: 10.1016/S0045-6535(99)00451-8 [9] JOHNSON A C, JÜRGENS M D, WILLIAMS R J, et al. Do cytotoxic chemotherapy drugs discharged into rivers pose a risk to the environment and human health? An overview and UK case study[J]. Journal of Hydrology, 2008, 348(1-2): 167-175. doi: 10.1016/j.jhydrol.2007.09.054 [10] LIANG X, WANG L, OU R, et al. Effects of norfloxacin on hepatic genes expression of P450 isoforms (CYP1A and CYP3A), GST and P-glycoprotein (P-gp) in Swordtail fish (Xiphophorus Helleri)[J]. Ecotoxicology, 2015, 24(7-8): 1566-1573. doi: 10.1007/s10646-015-1457-1 [11] YAN Z, YANG Q, JIANG W, et al. Integrated toxic evaluation of sulfamethazine on zebrafish: Including two lifespan stages (embryo-larval and adult) and three exposure periods (exposure, post-exposure and re-exposure)[J]. Chemosphere, 2018, 195: 784-792. doi: 10.1016/j.chemosphere.2017.12.119 [12] ZHANG S, DING J, RAZANAJATOVO R M, et al. Interactive effects of polystyrene microplastics and roxithromycin on bioaccumulation and biochemical status in the freshwater fish red tilapia (Oreochromis niloticus)[J]. Science of The Total Environment, 2019, 648: 1431-1439. doi: 10.1016/j.scitotenv.2018.08.266 [13] RODRIGUES S, ANTUNES S C, CORREIA A T, et al. Oxytetracycline effects in specific biochemical pathways of detoxification, neurotransmission and energy production in oncorhynchus mykiss[J]. Ecotoxicology and Environmental Safety, 2018, 164: 100-108. doi: 10.1016/j.ecoenv.2018.07.124 [14] LUOY, MAO D, RYSZ M, et al. Trends in antibiotic resistance genes occurrence in the haihe river, China[J]. Environmental Science & Technology, 2010, 44(19): 7220-7225. [15] CHATURVEDI P, CHOWDHARY P, SINGH A, et al. Dissemination of antibiotic resistance genes, mobile genetic elements, and efflux genes in anthropogenically impacted riverine environments[J]. Chemosphere, 2021, 273: 129693. doi: 10.1016/j.chemosphere.2021.129693 [16] OLUYEGE J O, DADA A C, ODEYEMI A T. Incidence of multiple antibiotic resistant gram-negative bacteria isolated from surface and underground water sources in south western region of Nigeria[J]. Water Science and Technology, 2009, 59(10): 1929-1936. doi: 10.2166/wst.2009.219 [17] MUKHERJEE S, Mehta D, DHANGAR K, et al. Environmental fate, distribution and state-of-the-art removal of antineoplastic drugs: a comprehensive insight[J]. Chemical Engineering Journal, 2021, 407: 127184. doi: 10.1016/j.cej.2020.127184 [18] 马驿, 孙永学, 陈进军, 等. 兽药残留对生态环境影响的研究进展[J]. 中国兽医科学, 2010, 40(6): 650-654. [19] FRANQUET-GRIELL H, MEDINA A, SANS C, et al. Biological and photochemical degradation of cytostatic drugs under laboratory conditions[J]. Journal of Hazardous Materials, 2017, 323: 319-328. doi: 10.1016/j.jhazmat.2016.06.057 [20] GHODRATI A, SHAHROUZI J R, NEMATI R, et al. Adsorptive removal of daunorubicin from water by graphene oxide, activated carbon, and multiwalled carbon nanotubes: Equilibrium and kinetic studies[J]. Chemical Engineering & Technology, 2022, 45(12): 2203-2210. [21] FU H, LI M, XU Q, et al. Nitrogen doped carbon-distributed and nitrogen-stabilized ultrafine FeM (M = Pd, Pt, Au) nanoclusters for doxorubicin detoxification[J]. Applied Catalysis B: Environmental, 2022, 316: 121646. doi: 10.1016/j.apcatb.2022.121646 [22] DUMITRU R, IANCULESCU A, PĂCURARIU C, et al. BiFeO3-synthesis, characterization and its photocatalytic activity towards doxorubicin degradation from water[J]. Ceramics International, 2019, 45(2): 2789-2802. doi: 10.1016/j.ceramint.2018.07.298 [23] MORENO E K G, GARCIA L F, LOBÓN G S, et al. Ecotoxicological assessment and electrochemical remediation of doxorubicin[J]. Ecotoxicology and Environmental Safety, 2019, 179: 143-150. doi: 10.1016/j.ecoenv.2019.04.050 [24] FERREIRA GARCIA L, GONÇALVES MORENO E K, BARROSO BRITO L, et al. Effective degradation of the antineoplastic doxorubicin by electrochemical oxidation on boron doped diamond[J]. Journal of Electroanalytical Chemistry, 2020, 870: 114252. doi: 10.1016/j.jelechem.2020.114252 [25] 刘宇鹤, 吴明松, 周秀艳, 等. 二氧化氯水消毒副产物的生成与消减研究进展[J]. 中国消毒学杂志, 2019, 36(5): 380-383. doi: 10.11726/j.issn.1001-7658.2019.05.020 [26] JIA X H, FENG L, LIU Y Z, et al. Oxidation of antipyrine by chlorine dioxide: Reaction kinetics and degradation pathway[J]. Chemical Engineering Journal, 2017, 309: 646-654. doi: 10.1016/j.cej.2016.10.062 [27] WANG P, HE Y L, HUANG C H. Oxidation of fluoroquinolone antibiotics and structurally related amines by chlorine dioxide: Reaction kinetics, product and pathway evaluation[J]. Water Research, 2010, 44(20): 5989-5998. doi: 10.1016/j.watres.2010.07.053 [28] SANTOS L H, ARAÚJO A N, FACHINI A, et al. Ecotoxicological aspects related to the presence of pharmaceuticals in the aquatic environment[J]. Journal of Hazardous Materials, 2010, 175(1-3): 45-95. doi: 10.1016/j.jhazmat.2009.10.100 [29] 侯智昊. 二氧化氯降解磺胺类抗生素反应动力学及机理研究[D]. 西安: 西北大学, 2021. [30] FUKUI K, PULLMAN B. Horizons of quantum chemistry: proceedings of the third international congress of quantum chemistry[C]. Held at Kyoto, Japan, 1979. Springer Netherlands. [31] 胡常伟, 李贤均编著. 绿色化学原理和应用 [M]. 北京: 中国石化出版社, 2002. [32] CHENG T, ZHAO Y, LI X, et al. Computation of octanol−water partition coefficients by guiding an additive model with knowledge[J]. Journal of Chemical Information and Modeling, 2007, 47(6): 2140-2148. doi: 10.1021/ci700257y [33] 黄君礼编著. 水消毒剂和处理剂 二氧化氯[M]. 北京: 化学工业出版社, 2010. [34] 丁朋飞. 氯消毒工艺中抗生素磺胺二甲氧嗪降解动力学及机理研究[D]. 常州: 常州大学, 2022. [35] ZHAO C, LI C, CHEN M, et al. Effective removal of antineoplastic doxorubicin by 0D Nb2O5 quantum dots embed 3D porous C-doped g-C3N4: degradation mechanism, pathway and toxicity assessment[J]. Applied Surface Science, 2023, 612: 155861. doi: 10.1016/j.apsusc.2022.155861 -











 下载:
下载: