-
土壤微生物在促进土壤生物地球化学循环和维持土壤质量方面发挥着关键作用,这已经得到了广泛的研究证实[1-2]。这些微生物群落对环境因素表现出敏感性,其中土壤pH值[3-4]、水分[5]和温度[6-7]是影响最大的几个因素。人类的实践活动(如土壤改良)[8-9]也能对土壤微生物群落产生影响。以往的研究表明,在盐碱土壤中施用生物炭可以有效增加土壤的孔隙度、水分保持能力和有机质的质量分数[10],从而为微生物提供更多的生存空间和养分来源。生物炭的吸附能力可以去除土壤中的有害物质,如盐分、重金属和有机污染物等,从而降低土壤有害物质对微生物的胁迫作用,为微生物创造了适宜的生存环境[11]。土壤理化性质的改善往往对土壤微生物生长繁殖具有积极作用[12-13]。这些因素共同促进了微生物丰度和多样性的提高,改善了微生物群落的组成和结构。土壤微生物介导许多关键的生态系统过程,例如有机质周转、养分循环和土壤结构形成[14],所有这些都对植物生长至关重要。然而,生物炭对微生物的影响也取决于其种类和性质。不同的生物炭具有不同的物理和化学性质,如比表面积、官能团数量和表面电荷等,这些性质决定了生物炭对土壤微生物的作用方式和效果。例如,某些生物炭可能更适合为特定的微生物提供生存空间,而其他生物炭则可能更适合作为碳源或能量来源。尽管目前已经了解一些关于土壤微生物群落如何响应环境变化的信息,但关于如何最有效地利用生物炭和其他改良剂来改善盐碱土壤中的微生物群落,仍需进行更多的研究。这将有助于更好地理解并管理盐碱土壤,以实现更可持续的农业生产和环境保护。
改良实验的前期研究结果表明,污泥水热炭及稻壳热解炭的适度添加(1%)在滨海盐渍土改良的应用从养分和植物生长的角度来看均是可行的。其中,酸性的污泥水热炭因其携带的丰富营养元素(如碳、氮、磷、硫等)更适合用于改良盐碱土,能够有效促进植物生长并增强植物对盐碱的耐受性[15]。然而这2种生物炭的施加是否通过提供养分、改善土壤物理性质、促进植物根系生长等方式,来促进微生物的生长和活动,进一步改善盐渍土的质量值得探讨。
本研究旨在确定2种生物炭不同投入量下的细菌群落转化特征,包括:1)确定生物炭的种类和用量对土壤细菌群落特征的影响。2)揭示影响土壤细菌群落的关键因素。3)探讨土壤细菌之间以及土壤细菌与植物的协同进化关系。这将有助于更好地了解2种生物炭在盐渍土改良中的作用和机制,为工程实践提供理论依据。
-
1)滨海盐渍土。滨海盐渍土采自上海市崇明东滩(31°31′39.33″N, 121°56′15.98″E),理化性质如下:pH 9.1±0.1,全盐量(4.51±0.57) g·kg−1,有机质(19.9±1.29) g·kg−1,全氮(0.73±0.07) g·kg−1,全磷(1.05±0.02) g·kg−1,全钾(16.5±1.35) g·kg−1,水解性氮(75.8±9.19) g·kg−1,有效磷(19.7±1.99) g·kg−1,速效钾(590±162) g·kg−1,阳离子交换量(5.35±0.48) cmol·kg−1。
2)生物炭。选取污泥水热炭及稻壳热解炭作为盐渍土改良材料。污泥水热炭是以上海城投污水处理有限公司石洞口污水处理厂的重力浓缩污泥为原料,在水热反应釜中经180 ℃、18.5 MPa加热3 h后,再通过板框压滤脱水至含水量≤20%制得;而稻壳热解炭则是稻壳在反应釜中400 ℃下碳化煅烧2.5 h生成。理化性质如表1。
3)孔雀草(Tagetes patula L.)。试验所用植物材料为地被植物孔雀草。在盐渍土绿化中,孔雀草能显著提升地面覆盖度,减缓土壤蒸发,并有效抑制返盐。相较于乔木和灌木,孔雀草对土壤质量的反应更为迅速和敏感,在改良试验中能够迅速反映出土壤的变化情况。
-
采用室内盆栽试验进行滨海盐渍土改良研究。盆栽试验前将2种生物炭用粉碎机破碎至粉末状,分别与滨海盐渍土以重量比(w/w)0.5%、1.0%、5.0%配置形成6个生物炭试验处理:0.5%污泥水热炭(S1)、1%污泥水热炭(S2)、5%污泥水热炭(S3)、0.5%稻壳热解炭(T1)、1%稻壳热解炭(T2)和5%稻壳热解炭(T3)),以未施加生物炭的崇明东滩滨海盐渍土作为试验对照(CK),每个处理设置4个重复。
-
1)土壤及植物指标测定。栽植3个月后,测定土壤电导率(soil electric conductivity,EC)、水分、容重、pH、全盐量、有机质、全磷、全氮、速效钾及有机碳;测定植物生物量、茎根比(鲜重)、叶绿素质量分数、根系活力、超氧化物歧化酶(superoxide dismutase,SOD)活性、过氧化氢酶(catalase,CAT)活性、丙二醛(malondialdehyde,MDA)含量。测定方法及所获得的数值均已在前期发表的论文中进行报道[15]。
2)微生物指标测定及分析。栽植3个月后,采集种植盆表层10 cm处土壤及根系的混合物,利用E.Z.N.A.® soil DNA kit (Omega Bio-tek,Norcross,GA,U.S.)提取微生物群落总DNA。使用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)对16S rRNA基因V3-V4可变区进行PCR扩增,送上海美吉生物医药科技有限公司利用Illumina公司的Miseq PE300平台进行测序分析。利用PICRUSt2 预测2种生物炭3个施加梯度下促进养分循环和帮助植物抗逆性相关酶的相对丰度变化。包括铁载体合成基因(Siderophore synthesis)、抗氧化酶(Antioxidant enzymes)、Na+/H+逆向转运蛋白(Na+/H+ antiporter)、K+/H+逆向转运蛋白(K+/H+ antiporter)、磷酸酶(Phosphatase)、吲哚-3-乙酸酰胺(IAA)合成基因、Na+转运蛋白(Na+-transport)、胞外多糖合成(Exopolysaccharide production)、色氨酸合成酶(Tryptophan synthase)、3-植酸酶(3-phytase)、内切葡聚糖酶(endoglucanase)、1-氨基环丙烷-1-羧酸脱氨酶(ACCD)及氮、硫循环基因[16-17]。
-
数据图的绘制采用Origin 2018。均值及标准偏差均利用Excel进行计算,数理统计利用SPSS statistics 23 Software,采用单因素方差分析方法。PCoA分析、RDA分析图利用美吉生物云平台(https://cloud.majorbio.com)进行绘制。共线性网络差异分析图利用Gephi 0.10绘制。
-
如图1(a)所示,土壤细菌的优势菌门分别为Firmicutes、Proteobacteria、Actinobacteriota、Acidobacteriota、Chloroflexi、Myxococcota、Cyanobacteria、Bacteroidota、Gemmatimonadota和Methylomirabilota。对照组CK优势菌门相对丰度由大到小排序依次为Firmicutes(21.32%)、Proteobacteria(20.21%)、Actinobacteriota(20.15%)、Acidobacteriota(10.84%)和Chloroflexi(7.42%)。与对照相比,污泥水热炭处理随添加量的上升Firmicutes(21.39%、21.80%、24.65%)、Proteobacteria(20.16%、21.32%、23.83%)呈上升趋势,而Chloroflexi(7.28%、8.01%、6.77%)呈先上升后下降的趋势。稻壳热解炭处理随添加量的上升Firmicutes(18.85%、23.05%、18.65%)、Chloroflexi(6.07%、7.32%、6.61%)呈先上升后下降趋势,Proteobacteria(21.69%、19.91%、23.77%)呈先下降后上升趋势。
如图1(c)所示,门水平其中具有显著性差异的菌门及对应丰度(CK、S1、S2、S3、T1、T2、T3)分别为Actinobacteriota(20.15%、17.65%、18.58%、16.7%、19.7%、16.38%、16.06%)、Myxococcota(4.23%、4.38%、5.00%、3.98%、4.46%、3.57%、2.97%)、Gemmatimonadota(2.63%、2.72%、3.30%、4.23%、2.81%、2.71%、2.00%)、Methylomirabilota(1.41%、1.46%、1.27%、0.59%、1.38%、1.12%、1.00%)、Desulfobacterota(0.39%、1.15%、1.03%、0.97%、0.57%、0.47%、0.29%)、Entotheonellaeota(0.56%、0.52%、0.42%、0.20%、0.49%、0.43%、0.40%)、NB1-j(0.09%、0.18%、0.19%、0.11%、0.16%、0.11%、0.08%)和Spirochaetota(0.01%、0.09%、0.06%、0.10%、0.02%、0.04%、0.01%)。不同添加量污泥水热炭处理及稻壳热解炭处理组Actinobacteriota和Entotheonellaeota相对丰度均低于对照组CK。污泥水热炭处理组Actinobacteriota相对丰度随添加量上升出现先上升后下降趋势,Actinobacteriota具有较强的耐盐性和养分利用能力[17],许多Actinobacteriota门细菌可以降解复杂的化合物,如多糖和酚类化合物[18],这使得它们能够获取营养,在更加贫瘠和恶劣的环境中生存。因此Actinobacteriota丰度下减少表明污泥水热炭的加入改善了土壤条件。Entotheonellaeota相对丰度随添加量上升呈下降趋势。Gemmatimonadota相对丰度随添加量上升显著上升,随着pH和盐度的降低,细菌群落从耐盐异养细菌(如Actinobacteriota)转变为在中性pH值和低盐度环境中生存的细菌(Gemmatimonaidetes)[19]。Methylomirabilota、Desulfobacterota相对丰度随添加量上升呈下降趋势,两者均为厌氧细菌[20],其丰度的减少可归因于生物炭添加后土壤通气性能的提升。改良试验的结果明确显示,2种生物炭显著降低土壤容重(P<0.05)[15],这意味着土壤内部的孔隙度得到了显著增大。孔隙度的增加可以为气体在土壤中的扩散和流通提供了更广阔的通道,优化了土壤的通气性能。Myxococcota、NB1-j和Spirochaetota均与根际土壤的有机质,氮磷钾或硫化物营养元素的循环相关[21-23]。Myxococcota和NB1-j相对丰度随添加量上升呈先上升后下降趋势,S2显著高于其他处理组。Spirochaetota相对丰度随添加量上升呈下降后上升趋势。稻壳热解炭处理组Actinobacteriota、Myxococcota、Gemmatimonadota、Methylomirabilota、Desulfobacterota、Entotheonellaeota相对丰度均随添加量上升呈下降趋势。NB1-j相对丰度随添加量上升呈下降趋势。Spirochaetota相对丰度随添加量上升呈上升后下降趋势。
如图1(b)所示,土壤细菌的优势属分别为Bacillus、Marmoricola、Symbiobacteraceae科未知属、Vicinamibacteraceae科未知属、Gaiella、Tumebacillus。Bacillus(CK、S1、S2、S3、T1、T2、T3)丰度分别为10.76%、9.18%、9.98%、15.11%、9.35%、9.62%、9.59,污泥水热炭0.5%和1%的处理丰度小于对照组CK,但随着添加量的上升呈上升趋势。稻壳热解炭处理要显著低于对照组CK,但不同添加量之间差异不显著;Marmoricola(3.22%、2.81%、3.40%、3.73%、2.40%、2.75%、2.72%)不同处理组之间的变化趋势与Bacillus相似。
如图1(d)所示,土壤细菌群落中具有显著性差异的属分别为Gaiella、Tumebacillus、Gemmatimonas、RB41、Ammoniphilus、Steroidobacter、Fonticella、Ilumatobacter、Skermanella和Catellatospora等。对照组CK相对丰度依次为1.79%、1.27%、0.50%、0.83%、0.41%、0.35%、0.10%、0.37%、0.25%和0.33%。水热炭处理组(S1、S2、S3)Gemmatimonas(0.59%、0.76%、1.01%)和Steroidobacter(0.39%、0.52%、0.77%)相对丰度随添加量上升显著上升。Gemmatimonas和Steroidobacter都是有助于土壤细菌组稳定的关键类群。它们分别具有磷酸盐和次磷酸盐代谢以及氮代谢的功能,能够利用这些化合物作为唯一的氮源或磷源进行生长。维持土壤中氮磷的平衡,从而促进植物的生长和生态系统的稳定[24]。Gaiella(1.88%、1.85%、1.07%)、Ilumatobacter(0.37%、0.34%、0.23%)和Skermanella(0.23%、0.22%、0.16%)相对丰度随添加量上升显著下降,均为嗜盐、嗜碱性菌属[25-26]。有机物分解细菌RB41(0.41%、0.45%、0.16%)、Tumebacillus(0.72%、1.62%、0.90%)[27]和产酸菌Fonticella(0.81%、0.83%、0.44%)[22]相对丰度随添加量上升呈先上升后下降趋势。耐盐植物促生长细菌Ammoniphilus(0.72%、0.60%、0.92%)[28]和Catellatospora(0.27%、0.19%、0.21%)[29]相对丰度随添加量上升呈下降后上升趋势。稻壳热解炭处理组(T1、T2、T3)Tumebacillus(1.85%、1.90%、3.05%)和RB41(0.47%、0.68%、0.88%)相对丰度随添加量上升显著上升。Gaiella(2.05%、1.58%、1.30%)、Ammoniphilus(0.46%、0.29%、0.23%)、Steroidobacter(0.38%、0.35%、0.27%)、Fonticella(0.44%、0.34%、0.31%)、Ilumatobacter(0.44%、0.34%、0.31%)和Skermanella(0.31%、0.31%、0.25%)相对丰度随添加量上升显著下降。Gemmatimonas(0.52%、0.61%、0.36%)和Catellatospora(0.16%、0.18%、0.10%)相对丰度随添加量上升呈先上升后下降趋势。
-
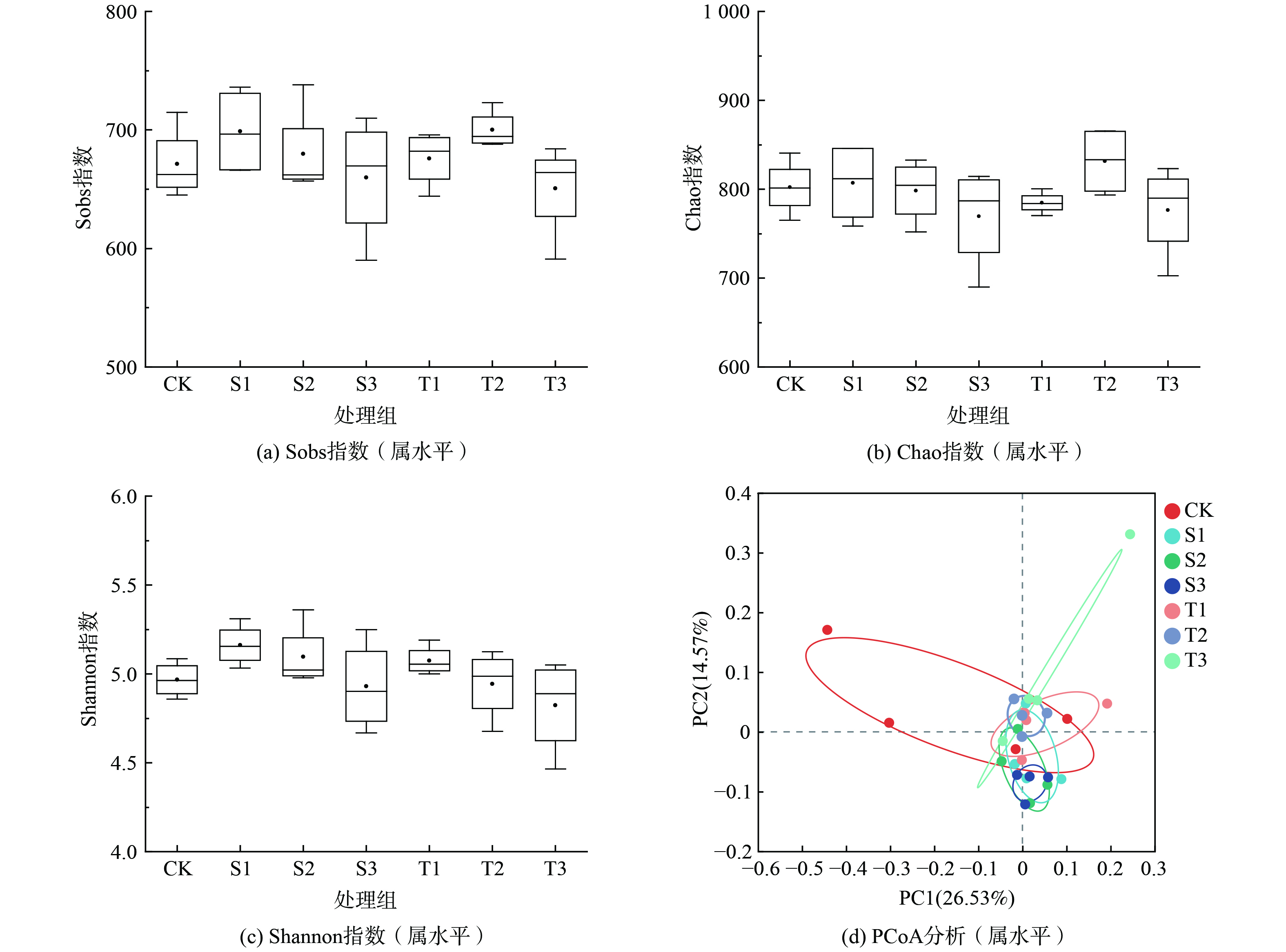
对土壤细菌群落多样性指数进行分析,结果表明(图2(a)~(c)),2组样本检测到的OTU丰富度(Chao指数,P=0.09<0.1)具有较大差异,生态优势度(Sobs指数,P=0.04<0.05)具有显著性差异。Sobs指数污泥水热炭处理组及稻壳热解炭处理组随添加量的增加均呈先上升后下降趋势;Chao指数污泥水热炭添加组随添加量的增加呈下降趋势,稻壳热解炭添加组随添加量的增加呈先上升后下降趋势。然而,2组样本之间群落多样性指数(Shannon指数,P=0.14>0.05)没有显著性差异。说明生物炭改良盐渍土后群落当中物种组成的种类下降,且群落内物种数量分布更均匀。2种生物炭添加组差异不显著,均是1%的添加量具有较高的多样性。
主坐标分析(principal co-ordinates analysis,PCoA)(PERMANOVA,R=0.196 4,P=0.003<0.05)显示(图2(d)),生物炭添加和CK的细菌群落之间存在明显的分离,而水热炭和稻壳热解炭处理的细菌群落之间随着添加量的上升细菌群落之间的分离越明显,说生物炭的种类跟添加量均对土壤细菌群落组成产生影响。
-
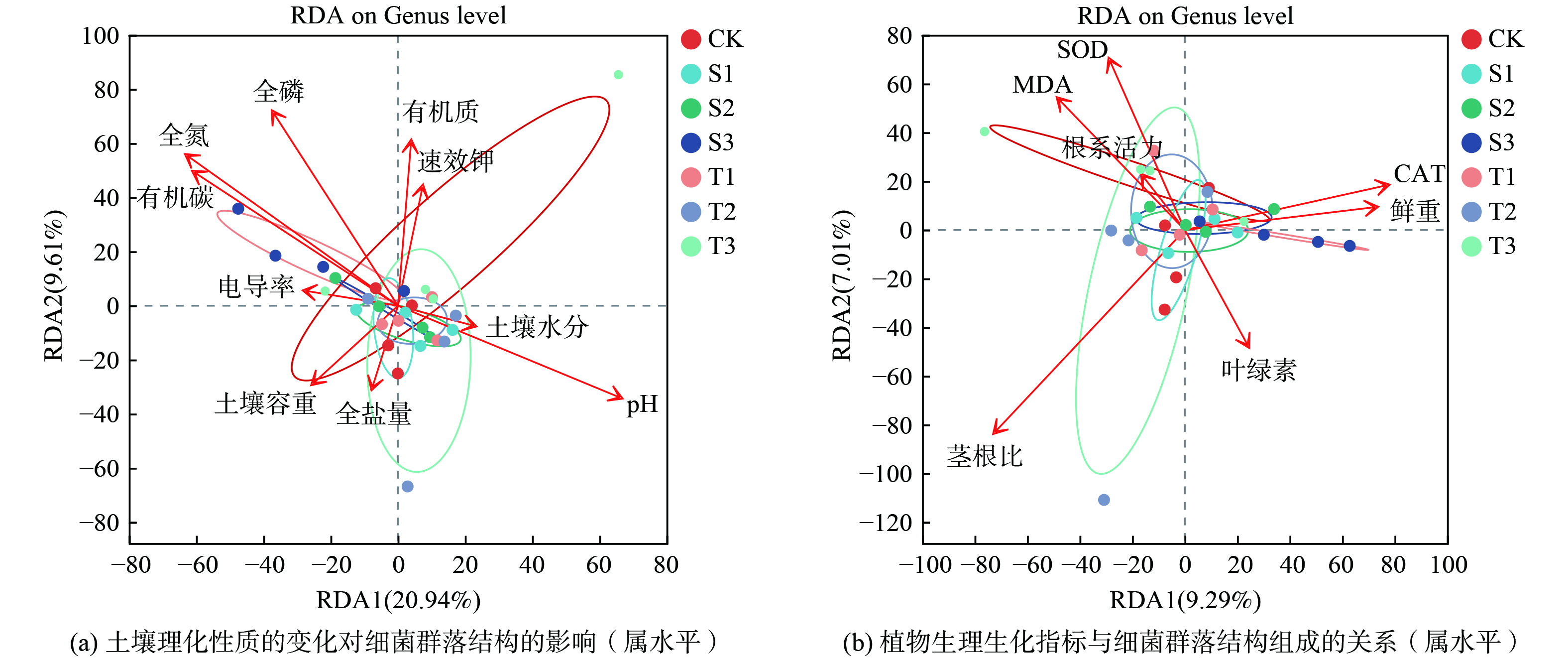
通过vif方差膨胀因子分析,筛选并去除vif>20的环境因子。筛选后的环境因子用于做冗余分析(redundancy analysis,RDA),揭示不同处理土壤样本细菌属水平群落组成与不同环境因子之间的相关性(图3)。结果显示土壤指标全氮、有机碳、pH以及全磷均显著影响土壤细菌群落组成(P<0.05),有机质对土壤细菌群落组成影响较大(P<0.1)。
生物炭作为一种有机肥料,可以直接为微生物提供碳、氮、磷等营养底物,从而刺激微生物的生长和繁殖。这种养分供给方式不仅提升了微生物的活性,还丰富了其多样性。在对比稻壳热解炭与污泥水热炭这2种不同类型的生物炭时,研究发现污泥生物炭的氮磷质量分数明显高于稻壳热解炭,这为其在促进微生物生长方面提供了独特的优势[15]。维持土壤中氮磷平衡的2个关键菌种Gemmatimonas和Steroidobacter的丰度随着添加量的增加而显著上升。这可能是因为滨海盐渍土pH值偏高,磷是限制碱性土壤中植物生长的主要营养元素。因此,提高磷的有效性成为生物炭添加改良土壤的关键[13],而污泥水热炭在这方面表现得更为出色。有研究发现,生物炭的添加促进了土壤微生物对有机碳的矿化作用。这意味着生物炭有助于土壤中有机质的分解和转化,从而提高了土壤的养分有效性和肥力[30]。在本研究中,污泥水热炭处理组的有机物分解细菌RB41、Tumebacillu和Fonticella的丰度也出现上升趋势,然而,当添加量达到5%时,丰度出现下降,这可能是由于污泥水热炭中含有的盐分导致土壤全盐量上升,对土壤微生物过程产生了不利影响。
生物炭也可以通过改善盐渍土的理化性质,如降低土壤容重、优化水分特征、调整pH值、降低盐度、提高养分有效性等,为微生物创造了适宜的生存环境。研究表明,在土壤酶活性中起重要作用的微生物种群在低容重土壤中更为丰富[31]。生物炭丰富的孔隙结构可为微生物提供足够的空间进行繁殖和生长,增加土壤中微生物的丰度和多样性。此外,这些孔隙结构还有助于提高微生物对营养物质的吸收和利用,进一步促进了微生物的生长和繁殖。同时,这些孔隙结构还为土壤微生物提供了一个庇护场所,使它们能够免受土壤动物的捕食[32]。需要注意的是,碱化会对土壤微生物过程产生不利影响,如微生物生物量减少等[33]。在本研究中,尽管稻壳热解炭因高石墨化程度和较大比表面积而具有更强吸附能力[15],但污泥水热炭因其弱酸性特性在降低盐碱土pH值方面表现更优,这显著影响了土壤细菌群落结构及功能,成为两者效果差异的关键所在。
此外,研究发现植物茎根比与土壤细菌群落组成间存在显著相关性(P<0.05)。污泥水热炭不仅通过释放氢离子中和土壤碱性、置换钠离子来改善通透性,还因其富含氮磷而有效促进根系生长[15]。这种生物炭可以通过调控植物根系的发育和根系分泌物的释放,塑造出高效养分循环和具有抗逆性的根际微生物群落。这些微生物群落可以释放渗出物,如可溶性糖和次级代谢物等,作为土壤微生物群落的碳源[34]。施加生物炭后,土壤环境会发生变化,这种变化会影响到土壤中的微生物群落。而微生物群落的变化又会进一步影响土壤养分的分解和转移。这是一个相互影响、相互作用的漫长过程,需要进一步深入探讨土壤细菌群落对污泥水热炭改良盐碱地响应的研究。
-
基于土壤细菌群落属水平的网络分析,本研究深入探究了不同处理组之间潜在的细菌相互作用和差异,结果如图4所示。分析结果显示,不同处理组的细菌网络图存在显著差异(图4(a)~(c))。具体而言,对照处理(CK)的节点和边的数量分别为79和645,所有节点对之间的平均网络距离(平均路径长度)为2.82条边。同时,其平均聚类系数(即节点如何嵌入到其邻域中,因此它们倾向于聚集在一起的程度)为0.83(图4(d))。稻壳热解炭处理组的节点、边、平均路径长度和平均聚类系数分别为151、869、2.68、0.38。而污泥水热炭处理组则表现出更多的网络中心节点和边数,分别为165和1 413,其平均路径长度为2.471,平均聚类系数为0.432(图4(d))。
相较于稻壳热解炭处理组,污泥水热炭处理组具有更高的网络密度和模块化特征,这暗示着其细菌群落稳定性可能更优。在网络分析中,“中心”是一个非常有用的特征,它指的是微生物组中高度相互连接的节点[35]。这些中心被认为是微生物群落中的关键物种,因为它们的移除可能导致微生物组的组成和功能发生巨大变化[36]。因此,这些中心物种在维护微生物群落稳定性和功能方面起着至关重要的作用。添加稻壳热解炭后,盐渍土的核心微生物菌属并未发生显著变化,然而,核心微生物与卫星菌属之间的联系显著增加。这表明稻壳热解炭可能促进了核心微生物与卫星菌属之间的相互作用和协同进化。这种联系的增加可能有助于增强微生物群落的多样性和稳定性,从而更好地适应盐渍环境;而污泥水热炭的添加不仅增强了核心微生物与卫星菌属之间的联系,还显著增加了核心微生物的菌属数量。盐渍土中原本具有最大节点度(degree)的Bacillus在污泥水热炭处理后其节点度有所降低,而Candidatus_Solibacter、Adhaeribacter、Noviherbaspirillum、Massilia、Pedobacter、Sphingoaurantiacus、Bacillus、P3OB-42等菌属的节点度则有所上升。生物炭具有强大的吸附能力,能够结合多种有机分子,其中许多是非极性的,与细胞间通讯所使用的分子结构相似[37]。在土壤中,生物炭能够吸收那些用于细胞间交流和协调决策的可扩散小分子。通过调控微生物细胞间的信号分子交流,如群感效应等机制[31],生物炭能够精准地调节微生物群落的种间关系,促进微生物间的互惠共生,维护土壤生态系统的稳定。这种调控作用不仅有助于提升土壤肥力,还可能促进植物的生长和发育。
-
生物炭对盐渍土中的细菌群落具有显著影响,不仅能提高细菌的丰度和多样性,还能重塑其群落结构,进而改变了细菌群落的功能特性。据ZHENG等[38]的研究,花生壳生物炭显著增强了盐生植物田菁和锦葵根际及非根际土壤中细菌的丰度和多样性,特别是那些具有固碳功能(如Alphaproteobacteria和Cytophagia)、解磷功能(如Pseudomonas和Bacillus)以及能够缓解盐胁迫(如Pseudomonas)的细菌成为优势菌群。这种变化意味着生物炭不仅为盐渍土中的细菌提供了更多的生存空间和机会,还优化了群落的功能结构,使其更加适应盐渍土的环境压力。YAO等[39]的研究也进一步证实了生物炭在盐渍土改良中的积极作用。他们发现,生物炭的添加可以显著提高土壤中的CAT、碱性磷酸酶活性,以及尿素和蔗糖活性,这些都有助于提升植物在盐碱地上的生长和产量。然而,生物炭对土壤酶的影响是复杂多变的,其活性受到生物炭的施用量、类型以及所施用土壤的性质等多重因素的影响[40]。
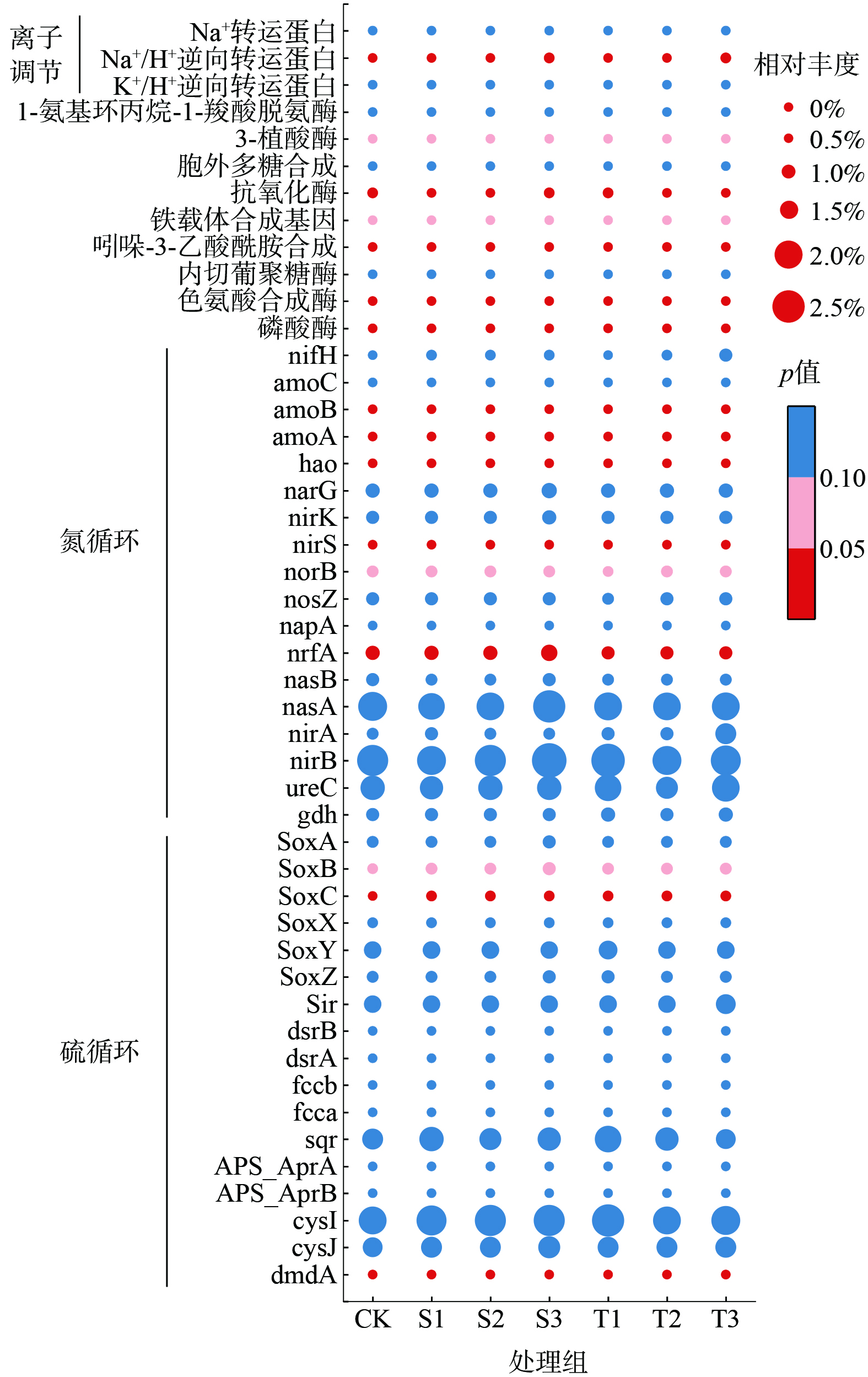
如图5所示,随着生物炭添加量的增加,土壤细菌群落中的相关酶发生了适应性变化,这些酶能够促进养分循环并帮助植物提高抗逆性。与对照组CK相比,2种生物炭添加组中的硫氧化通路相关基因SoxC和SoxB均得到了富集。然而,随着生物炭添加量的增加,这2种基因在2种生物炭处理中的变化趋势却截然不同。污泥水热炭添加组中,由于污泥水热炭有机硫质量分数高达0.23±0.04%[15],远高于稻壳热解炭,使得SoxC和SoxB的丰度均显著增加。而稻壳热解炭(有机硫质量分数未检出)添加组中这2种基因的丰度却呈现出降低的趋势。硫氧化通路的强化使得土壤中能够被植物吸收的有效硫(SO42-形式)[41]含量增加,这不仅有助于改善土壤养分状况,还进一步降低了土壤pH值,从而促进了植物的生长并增强了其抗逆性。此外,污泥水热炭的添加还显著抑制了硫循环中dmdA的累积,并且随着添加量的增加,其丰度呈现显著下降趋势(P<0.05)。然而,稻壳热解炭的添加则促进了dmdA的富集,但同样随着添加量的增加,其丰度也显著下降。由于2种生物炭的添加,土壤容重显著降低,土壤孔隙度则相应增加,这有利于土壤通气性和水分渗透性的改善。这2种生物炭的添加均促进了土壤的硝化过程,但它们在促进硝化作用方面的效果呈现出不同的特点。污泥水热炭因其特殊的制备过程和组成,能够提供更丰富的含氮底物,这为硝化细菌提供了充足的营养来源。随着污泥水热炭添加量的增加,硝化关键基因amoA、amoB和hao的丰度呈现出显著的上升趋势(P<0.05)。硝化作用在污泥水热炭的影响下得到了显著增强,有利于土壤中铵态氮向硝态氮的转化,从而提高土壤中可利用氮的含量。相比之下,稻壳热解炭虽然也在一定程度上促进了土壤的硝化过程,但其效果相对较弱。在硝化强度上,稻壳热解炭添加组虽有轻微提升,但随着添加量的增加,硝化关键基因的丰度却呈现出下降的趋势。在反硝化过程中,关键基因也呈现出相应的变化。具体来说,nirS(P<0.05)和norB(P<0.1)的丰度在污泥水热炭添加组中随着添加量的增加而显著增加。而在稻壳热解炭添加组中,nirS的丰度随着添加量的增加而显著下降,而norB的丰度则呈现出先上升后下降的趋势。此外,对于硝酸盐还原为氨的关键基因nrfA(P<0.05),其丰度在污泥水热炭添加组中随着添加量的增加而显著增加。而在稻壳热解炭添加组中,其丰度与对照组CK相比则略有下降。
在植物生长促进方面,污泥水热炭的添加显著增加了Na+/H+逆向转运蛋白、铁载体合成基因、磷酸酶、抗氧化酶、色氨酸合成酶、3-植酸酶以及吲哚-3-乙酸酰胺的丰度,且这种增加与添加量呈正相关。这显示出污泥水热炭对土壤微生物群落和酶活性的积极影响。相比之下,稻壳热解炭的添加导致这些基因和酶的丰度先降低后上升,但吲哚-3-乙酸酰胺合成基因的丰度则随添加量的增加而下降。许多促进植物生长的根际细菌,具有ACC脱氨酶、IAA生物合成、磷酸酶、铁载体产生、固氮和抗氧化酶,可提高植物的耐盐性[42]。改良后,Na+/H+逆向转运蛋白的增加可以降低微生物Na+的积累,提高微生物的活性。土壤细菌群落通过增加氮硫循环关键基因、铁载体的合成和磷酸酶的分泌来促进植物对硫、氮、磷及铁等营养物质的吸收,从而增强其在盐渍土等不利环境中的适应性和生存能力;通过植物激素吲哚-3-乙酸酰胺及参与生长素生物合成的色氨酸合成酶的分泌刺激植物根系的发育,增加根的数量和长度,从而帮助植物更好地吸收水分和营养物质。这对于在盐渍土等不利环境中生长的植物来说尤为重要,因为发达的根系可以帮助植物更好地适应高盐浓度和低水分含量的环境。
-
1)不同生物炭添加后土壤中细菌在门属水平上的优势菌未发生变化,但优势菌相对丰度在不同处理间存在明显差异,嗜盐碱的菌的丰度降低,有助于维持土壤细菌组稳定的关键类群丰度升高。
2)多样性分析表明,生物炭改良盐渍土后群落当中物种组成的种类下降,且群落内物种数量分布更均匀,2种生物炭均是1%的添加量具有较高的多样性。
3)RDA分析表明,不同生物炭添加处理滨海盐碱土土壤微生物群落结构存在明显差异,土壤细菌群落分布主要受土壤全氮、有机碳、pH、全磷以及植物茎根比的影响。
4)2种生物炭的施加均显著增加土壤细菌群落稳定性,相较于稻壳热解炭处理组,水热炭处理组具有更多的网络中心节点和边数,显示出更高的网络密度,并且网络具有较高的模块化特征。
5)与稻壳热解炭相比,污泥水热炭添加组根际土壤中的微生物群具有更丰富的促进植物生长和缓解盐胁迫的基因。土壤细菌群落通过铁载体的合成、磷酸酶的分泌以及吲哚-3-乙酸酰胺的分泌等机制,这些微生物与植物建立了独特的共生关系,从而提高了植物在盐渍土不利环境中的生存能力和生产潜力。
2种生物炭施用对滨海盐渍土土壤细菌群落结构的影响分析
Analysis of the impact of applying two types of biochar on the soil bacterial community in coastal saline soil
-
摘要: 本研究针对生物炭在改良盐碱土壤中的潜在应用及其对土壤微生物多样性影响的复杂性,采用不同类型生物炭改良滨海盐渍土,探究生物炭对土壤细菌群落结构的调控作用,并解析土壤细菌群落对盐渍土绿化植物的促生机制。通过室内盆栽模拟试验,对比研究不同比例(质量比:0.5%、1%、5%)污泥水热炭和稻壳热解炭施加对土壤细菌群落结构变化的影响,并深入探讨了土壤细菌群落结构变化与土壤质量变化的关系。结果显示:添加生物炭3个月后土壤优势菌门、属均未改变,但在不同处理中的排序及相对丰度变化显著。优势菌属为Bacillu、Marmoricola等,具有显著性差异的属分别为Gaiella、Tumebacillus、Gemmatimonas等,嗜盐碱的菌的丰度降低,有助于维持土壤细菌组稳定的关键类群的丰度升高。多样性分析表明,2种生物炭改良盐渍土后均导致土壤微生物群落中的物种组成种类减少,但物种数量分布更均匀。当生物炭添加量为1%时,土壤微生物群落的多样性较高。冗余分析表明,土壤细菌群落分布主要受土壤全氮、有机碳、pH、全磷以及植物茎根比的影响。与稻壳热解炭相比,污泥水热炭在改良盐渍土方面表现出更为显著的效果,显著增加土壤细菌群落稳定性,其网络密度更高、模块化特征更明显,且具有更丰富的促进植物生长和缓解盐胁迫的基因。土壤细菌群落通过铁载体的合成、磷酸酶的分泌以及吲哚-3-乙酸酰胺的分泌等机制,提高植物在盐渍土不利环境中的生存能力和生产潜力。该研究结果可为生物炭在盐渍土改良中的实际应用提供理论参考。Abstract: In order to investigate the regulatory effects of different types of biochar amendment on bacterial community structure in coastal saline soil, and to analyze how these bacterial communities enhance plant growth, a laboratory pot experiment was conducted. High-throughput sequencing techniques were employed to analyze the alterations in soil bacterial community structure resulting from the addition of different proportions (mass ratio: 0.5%, 1%, 5%) of sludge hydrochar and rice husk biochar. Furthermore, the correlation between the changes in soil bacterial community structure and soil quality was thoroughly explored. The results showed that despite no change in the dominant bacterial phyla and genera in the soil after three months of biochar addition, there were significant variations in their order and relative abundance across different treatments. Bacillus and Marmoricola were among the dominant bacterial genera, while Gaiella, Tumebacillus, Gemmatimonas, etc. exhibited significant differences. The abundance of halophilic bacteria decreased, while the abundance of key groups that help maintain the stability of soil bacterial communities increased. Diversity analysis indicated that both types of biochar reduced the species composition in soil microbial communities following their application to improve saline soil, yet the species distribution became more uniform. When the biochar addition amount was 1%, the diversity of soil microbial community was higher. Redundancy analysis showed that there were significant differences in the microbial community structure of coastal saline soil treated with different biochars. The distribution of soil bacterial communities was primarily influenced by factors such as soil total nitrogen, organic carbon, pH, total phosphorus, and plant stem-root ratio. Compared with rice husk pyrolysis char, sludge hydrochar demonstrated more profound effects in enhancing the quality of saline soil, significantly boosting the stability of the soil bacterial community. This bacterial community exhibited a higher network density, more pronounced modularization characteristics, and a richer repertoire of genes that promote plant growth and alleviate salt stress. By mechanisms such as siderophore production, phosphatase secretion, and indole acetic acid secretion, this bacterial community effectively improved plant survival and production potential in the challenging environment of saline soil. The findings of this study offer valuable theoretical insights for the practical utilization of biochar in ameliorating coastal saline soils.
-
Key words:
- sludge hydrochar /
- rice husk biochar /
- coastal saline-alkali soil /
- bacterial community
-
土壤微生物在促进土壤生物地球化学循环和维持土壤质量方面发挥着关键作用,这已经得到了广泛的研究证实[1-2]。这些微生物群落对环境因素表现出敏感性,其中土壤pH值[3-4]、水分[5]和温度[6-7]是影响最大的几个因素。人类的实践活动(如土壤改良)[8-9]也能对土壤微生物群落产生影响。以往的研究表明,在盐碱土壤中施用生物炭可以有效增加土壤的孔隙度、水分保持能力和有机质的质量分数[10],从而为微生物提供更多的生存空间和养分来源。生物炭的吸附能力可以去除土壤中的有害物质,如盐分、重金属和有机污染物等,从而降低土壤有害物质对微生物的胁迫作用,为微生物创造了适宜的生存环境[11]。土壤理化性质的改善往往对土壤微生物生长繁殖具有积极作用[12-13]。这些因素共同促进了微生物丰度和多样性的提高,改善了微生物群落的组成和结构。土壤微生物介导许多关键的生态系统过程,例如有机质周转、养分循环和土壤结构形成[14],所有这些都对植物生长至关重要。然而,生物炭对微生物的影响也取决于其种类和性质。不同的生物炭具有不同的物理和化学性质,如比表面积、官能团数量和表面电荷等,这些性质决定了生物炭对土壤微生物的作用方式和效果。例如,某些生物炭可能更适合为特定的微生物提供生存空间,而其他生物炭则可能更适合作为碳源或能量来源。尽管目前已经了解一些关于土壤微生物群落如何响应环境变化的信息,但关于如何最有效地利用生物炭和其他改良剂来改善盐碱土壤中的微生物群落,仍需进行更多的研究。这将有助于更好地理解并管理盐碱土壤,以实现更可持续的农业生产和环境保护。
改良实验的前期研究结果表明,污泥水热炭及稻壳热解炭的适度添加(1%)在滨海盐渍土改良的应用从养分和植物生长的角度来看均是可行的。其中,酸性的污泥水热炭因其携带的丰富营养元素(如碳、氮、磷、硫等)更适合用于改良盐碱土,能够有效促进植物生长并增强植物对盐碱的耐受性[15]。然而这2种生物炭的施加是否通过提供养分、改善土壤物理性质、促进植物根系生长等方式,来促进微生物的生长和活动,进一步改善盐渍土的质量值得探讨。
本研究旨在确定2种生物炭不同投入量下的细菌群落转化特征,包括:1)确定生物炭的种类和用量对土壤细菌群落特征的影响。2)揭示影响土壤细菌群落的关键因素。3)探讨土壤细菌之间以及土壤细菌与植物的协同进化关系。这将有助于更好地了解2种生物炭在盐渍土改良中的作用和机制,为工程实践提供理论依据。
1. 材料与方法
1.1 试验材料
1)滨海盐渍土。滨海盐渍土采自上海市崇明东滩(31°31′39.33″N, 121°56′15.98″E),理化性质如下:pH 9.1±0.1,全盐量(4.51±0.57) g·kg−1,有机质(19.9±1.29) g·kg−1,全氮(0.73±0.07) g·kg−1,全磷(1.05±0.02) g·kg−1,全钾(16.5±1.35) g·kg−1,水解性氮(75.8±9.19) g·kg−1,有效磷(19.7±1.99) g·kg−1,速效钾(590±162) g·kg−1,阳离子交换量(5.35±0.48) cmol·kg−1。
2)生物炭。选取污泥水热炭及稻壳热解炭作为盐渍土改良材料。污泥水热炭是以上海城投污水处理有限公司石洞口污水处理厂的重力浓缩污泥为原料,在水热反应釜中经180 ℃、18.5 MPa加热3 h后,再通过板框压滤脱水至含水量≤20%制得;而稻壳热解炭则是稻壳在反应釜中400 ℃下碳化煅烧2.5 h生成。理化性质如表1。
表 1 2种生物炭理化性质Table 1. Characteristics of two types of biochar生物炭种类 pH 全盐量/(g·kg−1) 有机质/(mg·kg−1) 全磷/(g·kg−1) 全氮/(g·kg−1) 全钾/(g·kg−1) 污泥水热炭 6.2±0.1 8.66±0.18 0.43±0.04 38.80±1.10 22.10±14.90 4.98±5.15 稻壳热解炭 8.6±0.1 1.74±0.05 0.40±0.01 0.37±0.02 1.33±0.05 275.00±75.00 3)孔雀草(Tagetes patula L.)。试验所用植物材料为地被植物孔雀草。在盐渍土绿化中,孔雀草能显著提升地面覆盖度,减缓土壤蒸发,并有效抑制返盐。相较于乔木和灌木,孔雀草对土壤质量的反应更为迅速和敏感,在改良试验中能够迅速反映出土壤的变化情况。
1.2 试验方法
采用室内盆栽试验进行滨海盐渍土改良研究。盆栽试验前将2种生物炭用粉碎机破碎至粉末状,分别与滨海盐渍土以重量比(w/w)0.5%、1.0%、5.0%配置形成6个生物炭试验处理:0.5%污泥水热炭(S1)、1%污泥水热炭(S2)、5%污泥水热炭(S3)、0.5%稻壳热解炭(T1)、1%稻壳热解炭(T2)和5%稻壳热解炭(T3)),以未施加生物炭的崇明东滩滨海盐渍土作为试验对照(CK),每个处理设置4个重复。
1.3 分析方法
1)土壤及植物指标测定。栽植3个月后,测定土壤电导率(soil electric conductivity,EC)、水分、容重、pH、全盐量、有机质、全磷、全氮、速效钾及有机碳;测定植物生物量、茎根比(鲜重)、叶绿素质量分数、根系活力、超氧化物歧化酶(superoxide dismutase,SOD)活性、过氧化氢酶(catalase,CAT)活性、丙二醛(malondialdehyde,MDA)含量。测定方法及所获得的数值均已在前期发表的论文中进行报道[15]。
2)微生物指标测定及分析。栽植3个月后,采集种植盆表层10 cm处土壤及根系的混合物,利用E.Z.N.A.® soil DNA kit (Omega Bio-tek,Norcross,GA,U.S.)提取微生物群落总DNA。使用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)对16S rRNA基因V3-V4可变区进行PCR扩增,送上海美吉生物医药科技有限公司利用Illumina公司的Miseq PE300平台进行测序分析。利用PICRUSt2 预测2种生物炭3个施加梯度下促进养分循环和帮助植物抗逆性相关酶的相对丰度变化。包括铁载体合成基因(Siderophore synthesis)、抗氧化酶(Antioxidant enzymes)、Na+/H+逆向转运蛋白(Na+/H+ antiporter)、K+/H+逆向转运蛋白(K+/H+ antiporter)、磷酸酶(Phosphatase)、吲哚-3-乙酸酰胺(IAA)合成基因、Na+转运蛋白(Na+-transport)、胞外多糖合成(Exopolysaccharide production)、色氨酸合成酶(Tryptophan synthase)、3-植酸酶(3-phytase)、内切葡聚糖酶(endoglucanase)、1-氨基环丙烷-1-羧酸脱氨酶(ACCD)及氮、硫循环基因[16-17]。
1.4 绘图及统计学方法
数据图的绘制采用Origin 2018。均值及标准偏差均利用Excel进行计算,数理统计利用SPSS statistics 23 Software,采用单因素方差分析方法。PCoA分析、RDA分析图利用美吉生物云平台(https://cloud.majorbio.com)进行绘制。共线性网络差异分析图利用Gephi 0.10绘制。
2. 结果与讨论
2.1 2种生物炭施加对土壤细菌组成的影响及物种差异分析
如图1(a)所示,土壤细菌的优势菌门分别为Firmicutes、Proteobacteria、Actinobacteriota、Acidobacteriota、Chloroflexi、Myxococcota、Cyanobacteria、Bacteroidota、Gemmatimonadota和Methylomirabilota。对照组CK优势菌门相对丰度由大到小排序依次为Firmicutes(21.32%)、Proteobacteria(20.21%)、Actinobacteriota(20.15%)、Acidobacteriota(10.84%)和Chloroflexi(7.42%)。与对照相比,污泥水热炭处理随添加量的上升Firmicutes(21.39%、21.80%、24.65%)、Proteobacteria(20.16%、21.32%、23.83%)呈上升趋势,而Chloroflexi(7.28%、8.01%、6.77%)呈先上升后下降的趋势。稻壳热解炭处理随添加量的上升Firmicutes(18.85%、23.05%、18.65%)、Chloroflexi(6.07%、7.32%、6.61%)呈先上升后下降趋势,Proteobacteria(21.69%、19.91%、23.77%)呈先下降后上升趋势。
如图1(c)所示,门水平其中具有显著性差异的菌门及对应丰度(CK、S1、S2、S3、T1、T2、T3)分别为Actinobacteriota(20.15%、17.65%、18.58%、16.7%、19.7%、16.38%、16.06%)、Myxococcota(4.23%、4.38%、5.00%、3.98%、4.46%、3.57%、2.97%)、Gemmatimonadota(2.63%、2.72%、3.30%、4.23%、2.81%、2.71%、2.00%)、Methylomirabilota(1.41%、1.46%、1.27%、0.59%、1.38%、1.12%、1.00%)、Desulfobacterota(0.39%、1.15%、1.03%、0.97%、0.57%、0.47%、0.29%)、Entotheonellaeota(0.56%、0.52%、0.42%、0.20%、0.49%、0.43%、0.40%)、NB1-j(0.09%、0.18%、0.19%、0.11%、0.16%、0.11%、0.08%)和Spirochaetota(0.01%、0.09%、0.06%、0.10%、0.02%、0.04%、0.01%)。不同添加量污泥水热炭处理及稻壳热解炭处理组Actinobacteriota和Entotheonellaeota相对丰度均低于对照组CK。污泥水热炭处理组Actinobacteriota相对丰度随添加量上升出现先上升后下降趋势,Actinobacteriota具有较强的耐盐性和养分利用能力[17],许多Actinobacteriota门细菌可以降解复杂的化合物,如多糖和酚类化合物[18],这使得它们能够获取营养,在更加贫瘠和恶劣的环境中生存。因此Actinobacteriota丰度下减少表明污泥水热炭的加入改善了土壤条件。Entotheonellaeota相对丰度随添加量上升呈下降趋势。Gemmatimonadota相对丰度随添加量上升显著上升,随着pH和盐度的降低,细菌群落从耐盐异养细菌(如Actinobacteriota)转变为在中性pH值和低盐度环境中生存的细菌(Gemmatimonaidetes)[19]。Methylomirabilota、Desulfobacterota相对丰度随添加量上升呈下降趋势,两者均为厌氧细菌[20],其丰度的减少可归因于生物炭添加后土壤通气性能的提升。改良试验的结果明确显示,2种生物炭显著降低土壤容重(P<0.05)[15],这意味着土壤内部的孔隙度得到了显著增大。孔隙度的增加可以为气体在土壤中的扩散和流通提供了更广阔的通道,优化了土壤的通气性能。Myxococcota、NB1-j和Spirochaetota均与根际土壤的有机质,氮磷钾或硫化物营养元素的循环相关[21-23]。Myxococcota和NB1-j相对丰度随添加量上升呈先上升后下降趋势,S2显著高于其他处理组。Spirochaetota相对丰度随添加量上升呈下降后上升趋势。稻壳热解炭处理组Actinobacteriota、Myxococcota、Gemmatimonadota、Methylomirabilota、Desulfobacterota、Entotheonellaeota相对丰度均随添加量上升呈下降趋势。NB1-j相对丰度随添加量上升呈下降趋势。Spirochaetota相对丰度随添加量上升呈上升后下降趋势。
如图1(b)所示,土壤细菌的优势属分别为Bacillus、Marmoricola、Symbiobacteraceae科未知属、Vicinamibacteraceae科未知属、Gaiella、Tumebacillus。Bacillus(CK、S1、S2、S3、T1、T2、T3)丰度分别为10.76%、9.18%、9.98%、15.11%、9.35%、9.62%、9.59,污泥水热炭0.5%和1%的处理丰度小于对照组CK,但随着添加量的上升呈上升趋势。稻壳热解炭处理要显著低于对照组CK,但不同添加量之间差异不显著;Marmoricola(3.22%、2.81%、3.40%、3.73%、2.40%、2.75%、2.72%)不同处理组之间的变化趋势与Bacillus相似。
如图1(d)所示,土壤细菌群落中具有显著性差异的属分别为Gaiella、Tumebacillus、Gemmatimonas、RB41、Ammoniphilus、Steroidobacter、Fonticella、Ilumatobacter、Skermanella和Catellatospora等。对照组CK相对丰度依次为1.79%、1.27%、0.50%、0.83%、0.41%、0.35%、0.10%、0.37%、0.25%和0.33%。水热炭处理组(S1、S2、S3)Gemmatimonas(0.59%、0.76%、1.01%)和Steroidobacter(0.39%、0.52%、0.77%)相对丰度随添加量上升显著上升。Gemmatimonas和Steroidobacter都是有助于土壤细菌组稳定的关键类群。它们分别具有磷酸盐和次磷酸盐代谢以及氮代谢的功能,能够利用这些化合物作为唯一的氮源或磷源进行生长。维持土壤中氮磷的平衡,从而促进植物的生长和生态系统的稳定[24]。Gaiella(1.88%、1.85%、1.07%)、Ilumatobacter(0.37%、0.34%、0.23%)和Skermanella(0.23%、0.22%、0.16%)相对丰度随添加量上升显著下降,均为嗜盐、嗜碱性菌属[25-26]。有机物分解细菌RB41(0.41%、0.45%、0.16%)、Tumebacillus(0.72%、1.62%、0.90%)[27]和产酸菌Fonticella(0.81%、0.83%、0.44%)[22]相对丰度随添加量上升呈先上升后下降趋势。耐盐植物促生长细菌Ammoniphilus(0.72%、0.60%、0.92%)[28]和Catellatospora(0.27%、0.19%、0.21%)[29]相对丰度随添加量上升呈下降后上升趋势。稻壳热解炭处理组(T1、T2、T3)Tumebacillus(1.85%、1.90%、3.05%)和RB41(0.47%、0.68%、0.88%)相对丰度随添加量上升显著上升。Gaiella(2.05%、1.58%、1.30%)、Ammoniphilus(0.46%、0.29%、0.23%)、Steroidobacter(0.38%、0.35%、0.27%)、Fonticella(0.44%、0.34%、0.31%)、Ilumatobacter(0.44%、0.34%、0.31%)和Skermanella(0.31%、0.31%、0.25%)相对丰度随添加量上升显著下降。Gemmatimonas(0.52%、0.61%、0.36%)和Catellatospora(0.16%、0.18%、0.10%)相对丰度随添加量上升呈先上升后下降趋势。
2.2 2种生物炭施加对土壤细菌多样性的影响
对土壤细菌群落多样性指数进行分析,结果表明(图2(a)~(c)),2组样本检测到的OTU丰富度(Chao指数,P=0.09<0.1)具有较大差异,生态优势度(Sobs指数,P=0.04<0.05)具有显著性差异。Sobs指数污泥水热炭处理组及稻壳热解炭处理组随添加量的增加均呈先上升后下降趋势;Chao指数污泥水热炭添加组随添加量的增加呈下降趋势,稻壳热解炭添加组随添加量的增加呈先上升后下降趋势。然而,2组样本之间群落多样性指数(Shannon指数,P=0.14>0.05)没有显著性差异。说明生物炭改良盐渍土后群落当中物种组成的种类下降,且群落内物种数量分布更均匀。2种生物炭添加组差异不显著,均是1%的添加量具有较高的多样性。
主坐标分析(principal co-ordinates analysis,PCoA)(PERMANOVA,R=0.196 4,P=0.003<0.05)显示(图2(d)),生物炭添加和CK的细菌群落之间存在明显的分离,而水热炭和稻壳热解炭处理的细菌群落之间随着添加量的上升细菌群落之间的分离越明显,说生物炭的种类跟添加量均对土壤细菌群落组成产生影响。
2.3 2土壤理化性质的变化与细菌群落结构关联分析
通过vif方差膨胀因子分析,筛选并去除vif>20的环境因子。筛选后的环境因子用于做冗余分析(redundancy analysis,RDA),揭示不同处理土壤样本细菌属水平群落组成与不同环境因子之间的相关性(图3)。结果显示土壤指标全氮、有机碳、pH以及全磷均显著影响土壤细菌群落组成(P<0.05),有机质对土壤细菌群落组成影响较大(P<0.1)。
生物炭作为一种有机肥料,可以直接为微生物提供碳、氮、磷等营养底物,从而刺激微生物的生长和繁殖。这种养分供给方式不仅提升了微生物的活性,还丰富了其多样性。在对比稻壳热解炭与污泥水热炭这2种不同类型的生物炭时,研究发现污泥生物炭的氮磷质量分数明显高于稻壳热解炭,这为其在促进微生物生长方面提供了独特的优势[15]。维持土壤中氮磷平衡的2个关键菌种Gemmatimonas和Steroidobacter的丰度随着添加量的增加而显著上升。这可能是因为滨海盐渍土pH值偏高,磷是限制碱性土壤中植物生长的主要营养元素。因此,提高磷的有效性成为生物炭添加改良土壤的关键[13],而污泥水热炭在这方面表现得更为出色。有研究发现,生物炭的添加促进了土壤微生物对有机碳的矿化作用。这意味着生物炭有助于土壤中有机质的分解和转化,从而提高了土壤的养分有效性和肥力[30]。在本研究中,污泥水热炭处理组的有机物分解细菌RB41、Tumebacillu和Fonticella的丰度也出现上升趋势,然而,当添加量达到5%时,丰度出现下降,这可能是由于污泥水热炭中含有的盐分导致土壤全盐量上升,对土壤微生物过程产生了不利影响。
生物炭也可以通过改善盐渍土的理化性质,如降低土壤容重、优化水分特征、调整pH值、降低盐度、提高养分有效性等,为微生物创造了适宜的生存环境。研究表明,在土壤酶活性中起重要作用的微生物种群在低容重土壤中更为丰富[31]。生物炭丰富的孔隙结构可为微生物提供足够的空间进行繁殖和生长,增加土壤中微生物的丰度和多样性。此外,这些孔隙结构还有助于提高微生物对营养物质的吸收和利用,进一步促进了微生物的生长和繁殖。同时,这些孔隙结构还为土壤微生物提供了一个庇护场所,使它们能够免受土壤动物的捕食[32]。需要注意的是,碱化会对土壤微生物过程产生不利影响,如微生物生物量减少等[33]。在本研究中,尽管稻壳热解炭因高石墨化程度和较大比表面积而具有更强吸附能力[15],但污泥水热炭因其弱酸性特性在降低盐碱土pH值方面表现更优,这显著影响了土壤细菌群落结构及功能,成为两者效果差异的关键所在。
此外,研究发现植物茎根比与土壤细菌群落组成间存在显著相关性(P<0.05)。污泥水热炭不仅通过释放氢离子中和土壤碱性、置换钠离子来改善通透性,还因其富含氮磷而有效促进根系生长[15]。这种生物炭可以通过调控植物根系的发育和根系分泌物的释放,塑造出高效养分循环和具有抗逆性的根际微生物群落。这些微生物群落可以释放渗出物,如可溶性糖和次级代谢物等,作为土壤微生物群落的碳源[34]。施加生物炭后,土壤环境会发生变化,这种变化会影响到土壤中的微生物群落。而微生物群落的变化又会进一步影响土壤养分的分解和转移。这是一个相互影响、相互作用的漫长过程,需要进一步深入探讨土壤细菌群落对污泥水热炭改良盐碱地响应的研究。
2.4 土壤细菌共线性网络差异分析
基于土壤细菌群落属水平的网络分析,本研究深入探究了不同处理组之间潜在的细菌相互作用和差异,结果如图4所示。分析结果显示,不同处理组的细菌网络图存在显著差异(图4(a)~(c))。具体而言,对照处理(CK)的节点和边的数量分别为79和645,所有节点对之间的平均网络距离(平均路径长度)为2.82条边。同时,其平均聚类系数(即节点如何嵌入到其邻域中,因此它们倾向于聚集在一起的程度)为0.83(图4(d))。稻壳热解炭处理组的节点、边、平均路径长度和平均聚类系数分别为151、869、2.68、0.38。而污泥水热炭处理组则表现出更多的网络中心节点和边数,分别为165和1 413,其平均路径长度为2.471,平均聚类系数为0.432(图4(d))。
相较于稻壳热解炭处理组,污泥水热炭处理组具有更高的网络密度和模块化特征,这暗示着其细菌群落稳定性可能更优。在网络分析中,“中心”是一个非常有用的特征,它指的是微生物组中高度相互连接的节点[35]。这些中心被认为是微生物群落中的关键物种,因为它们的移除可能导致微生物组的组成和功能发生巨大变化[36]。因此,这些中心物种在维护微生物群落稳定性和功能方面起着至关重要的作用。添加稻壳热解炭后,盐渍土的核心微生物菌属并未发生显著变化,然而,核心微生物与卫星菌属之间的联系显著增加。这表明稻壳热解炭可能促进了核心微生物与卫星菌属之间的相互作用和协同进化。这种联系的增加可能有助于增强微生物群落的多样性和稳定性,从而更好地适应盐渍环境;而污泥水热炭的添加不仅增强了核心微生物与卫星菌属之间的联系,还显著增加了核心微生物的菌属数量。盐渍土中原本具有最大节点度(degree)的Bacillus在污泥水热炭处理后其节点度有所降低,而Candidatus_Solibacter、Adhaeribacter、Noviherbaspirillum、Massilia、Pedobacter、Sphingoaurantiacus、Bacillus、P3OB-42等菌属的节点度则有所上升。生物炭具有强大的吸附能力,能够结合多种有机分子,其中许多是非极性的,与细胞间通讯所使用的分子结构相似[37]。在土壤中,生物炭能够吸收那些用于细胞间交流和协调决策的可扩散小分子。通过调控微生物细胞间的信号分子交流,如群感效应等机制[31],生物炭能够精准地调节微生物群落的种间关系,促进微生物间的互惠共生,维护土壤生态系统的稳定。这种调控作用不仅有助于提升土壤肥力,还可能促进植物的生长和发育。
2.5 土壤细菌PICRUSt2功能预测
生物炭对盐渍土中的细菌群落具有显著影响,不仅能提高细菌的丰度和多样性,还能重塑其群落结构,进而改变了细菌群落的功能特性。据ZHENG等[38]的研究,花生壳生物炭显著增强了盐生植物田菁和锦葵根际及非根际土壤中细菌的丰度和多样性,特别是那些具有固碳功能(如Alphaproteobacteria和Cytophagia)、解磷功能(如Pseudomonas和Bacillus)以及能够缓解盐胁迫(如Pseudomonas)的细菌成为优势菌群。这种变化意味着生物炭不仅为盐渍土中的细菌提供了更多的生存空间和机会,还优化了群落的功能结构,使其更加适应盐渍土的环境压力。YAO等[39]的研究也进一步证实了生物炭在盐渍土改良中的积极作用。他们发现,生物炭的添加可以显著提高土壤中的CAT、碱性磷酸酶活性,以及尿素和蔗糖活性,这些都有助于提升植物在盐碱地上的生长和产量。然而,生物炭对土壤酶的影响是复杂多变的,其活性受到生物炭的施用量、类型以及所施用土壤的性质等多重因素的影响[40]。
如图5所示,随着生物炭添加量的增加,土壤细菌群落中的相关酶发生了适应性变化,这些酶能够促进养分循环并帮助植物提高抗逆性。与对照组CK相比,2种生物炭添加组中的硫氧化通路相关基因SoxC和SoxB均得到了富集。然而,随着生物炭添加量的增加,这2种基因在2种生物炭处理中的变化趋势却截然不同。污泥水热炭添加组中,由于污泥水热炭有机硫质量分数高达0.23±0.04%[15],远高于稻壳热解炭,使得SoxC和SoxB的丰度均显著增加。而稻壳热解炭(有机硫质量分数未检出)添加组中这2种基因的丰度却呈现出降低的趋势。硫氧化通路的强化使得土壤中能够被植物吸收的有效硫(SO42-形式)[41]含量增加,这不仅有助于改善土壤养分状况,还进一步降低了土壤pH值,从而促进了植物的生长并增强了其抗逆性。此外,污泥水热炭的添加还显著抑制了硫循环中dmdA的累积,并且随着添加量的增加,其丰度呈现显著下降趋势(P<0.05)。然而,稻壳热解炭的添加则促进了dmdA的富集,但同样随着添加量的增加,其丰度也显著下降。由于2种生物炭的添加,土壤容重显著降低,土壤孔隙度则相应增加,这有利于土壤通气性和水分渗透性的改善。这2种生物炭的添加均促进了土壤的硝化过程,但它们在促进硝化作用方面的效果呈现出不同的特点。污泥水热炭因其特殊的制备过程和组成,能够提供更丰富的含氮底物,这为硝化细菌提供了充足的营养来源。随着污泥水热炭添加量的增加,硝化关键基因amoA、amoB和hao的丰度呈现出显著的上升趋势(P<0.05)。硝化作用在污泥水热炭的影响下得到了显著增强,有利于土壤中铵态氮向硝态氮的转化,从而提高土壤中可利用氮的含量。相比之下,稻壳热解炭虽然也在一定程度上促进了土壤的硝化过程,但其效果相对较弱。在硝化强度上,稻壳热解炭添加组虽有轻微提升,但随着添加量的增加,硝化关键基因的丰度却呈现出下降的趋势。在反硝化过程中,关键基因也呈现出相应的变化。具体来说,nirS(P<0.05)和norB(P<0.1)的丰度在污泥水热炭添加组中随着添加量的增加而显著增加。而在稻壳热解炭添加组中,nirS的丰度随着添加量的增加而显著下降,而norB的丰度则呈现出先上升后下降的趋势。此外,对于硝酸盐还原为氨的关键基因nrfA(P<0.05),其丰度在污泥水热炭添加组中随着添加量的增加而显著增加。而在稻壳热解炭添加组中,其丰度与对照组CK相比则略有下降。
在植物生长促进方面,污泥水热炭的添加显著增加了Na+/H+逆向转运蛋白、铁载体合成基因、磷酸酶、抗氧化酶、色氨酸合成酶、3-植酸酶以及吲哚-3-乙酸酰胺的丰度,且这种增加与添加量呈正相关。这显示出污泥水热炭对土壤微生物群落和酶活性的积极影响。相比之下,稻壳热解炭的添加导致这些基因和酶的丰度先降低后上升,但吲哚-3-乙酸酰胺合成基因的丰度则随添加量的增加而下降。许多促进植物生长的根际细菌,具有ACC脱氨酶、IAA生物合成、磷酸酶、铁载体产生、固氮和抗氧化酶,可提高植物的耐盐性[42]。改良后,Na+/H+逆向转运蛋白的增加可以降低微生物Na+的积累,提高微生物的活性。土壤细菌群落通过增加氮硫循环关键基因、铁载体的合成和磷酸酶的分泌来促进植物对硫、氮、磷及铁等营养物质的吸收,从而增强其在盐渍土等不利环境中的适应性和生存能力;通过植物激素吲哚-3-乙酸酰胺及参与生长素生物合成的色氨酸合成酶的分泌刺激植物根系的发育,增加根的数量和长度,从而帮助植物更好地吸收水分和营养物质。这对于在盐渍土等不利环境中生长的植物来说尤为重要,因为发达的根系可以帮助植物更好地适应高盐浓度和低水分含量的环境。
3. 结论
1)不同生物炭添加后土壤中细菌在门属水平上的优势菌未发生变化,但优势菌相对丰度在不同处理间存在明显差异,嗜盐碱的菌的丰度降低,有助于维持土壤细菌组稳定的关键类群丰度升高。
2)多样性分析表明,生物炭改良盐渍土后群落当中物种组成的种类下降,且群落内物种数量分布更均匀,2种生物炭均是1%的添加量具有较高的多样性。
3)RDA分析表明,不同生物炭添加处理滨海盐碱土土壤微生物群落结构存在明显差异,土壤细菌群落分布主要受土壤全氮、有机碳、pH、全磷以及植物茎根比的影响。
4)2种生物炭的施加均显著增加土壤细菌群落稳定性,相较于稻壳热解炭处理组,水热炭处理组具有更多的网络中心节点和边数,显示出更高的网络密度,并且网络具有较高的模块化特征。
5)与稻壳热解炭相比,污泥水热炭添加组根际土壤中的微生物群具有更丰富的促进植物生长和缓解盐胁迫的基因。土壤细菌群落通过铁载体的合成、磷酸酶的分泌以及吲哚-3-乙酸酰胺的分泌等机制,这些微生物与植物建立了独特的共生关系,从而提高了植物在盐渍土不利环境中的生存能力和生产潜力。
-
表 1 2种生物炭理化性质
Table 1. Characteristics of two types of biochar
生物炭种类 pH 全盐量/(g·kg−1) 有机质/(mg·kg−1) 全磷/(g·kg−1) 全氮/(g·kg−1) 全钾/(g·kg−1) 污泥水热炭 6.2±0.1 8.66±0.18 0.43±0.04 38.80±1.10 22.10±14.90 4.98±5.15 稻壳热解炭 8.6±0.1 1.74±0.05 0.40±0.01 0.37±0.02 1.33±0.05 275.00±75.00 -
[1] NIELSEN U N, AYRES E, WALL D H, et al. Soil biodiversity and carbon cycling: A review and synthesis of studies examining diversity-function relationships[J]. European Journal of Soil Science, 2011, 62(1): 105-116. doi: 10.1111/j.1365-2389.2010.01314.x [2] GRAHAM E B, WIEDER W R, LEFF J W, et al. Do we need to understand microbial communities to predict ecosystem function? A comparison of statistical models of nitrogen cycling processes[J]. Soil Biology & Biochemistry, 2014, 68: 279-282. [3] VALENTíN-VARGAS A, ROOT R A, NEILSON J W, et al. Environmental factors influencing the structural dynamics of soil microbial communities during assisted phytostabilization of acid-generating mine tailings: a mesocosm experiment[J]. Science of the Total Environment, 2014, 500: 314-324. [4] SUN R B, GUO X S, WANG D Z, et al. Effects of long-term application of chemical and organic fertilizers on the abundance of microbial communities involved in the nitrogen cycle[J]. Applied Soil Ecology, 2015, 95: 171-178. doi: 10.1016/j.apsoil.2015.06.010 [5] EVANS S E, WALLENSTEIN M D. Soil microbial community response to drying and rewetting stress: does historical precipitation regime matter?[J]. Biogeochemistry, 2012, 109(1-3): 101-116. doi: 10.1007/s10533-011-9638-3 [6] LAUBER C L, RAMIREZ K S, AANDERUD Z, et al. Temporal variability in soil microbial communities across land-use types[J]. Isme Journal, 2013, 7(8): 1641-1650. doi: 10.1038/ismej.2013.50 [7] AUFFRET M D, KARHU K, KHACHANE A, et al. The role of microbial community composition in controlling soil respiration responses to temperature[J]. Plos One, 2016, 11(10): e0165448. doi: 10.1371/journal.pone.0165448 [8] ZUBER S M, VILLAMIL M B. Meta-analysis approach to assess effect of tillage on microbial biomass and enzyme activities[J]. Soil Biology & Biochemistry, 2016, 97: 176-187. [9] SUN R B, LI W Y, DONG W X, et al. Tillage changes vertical distribution of soil bacterial and fungal communities[J]. Frontiers in Microbiology, 2018, 9: 699. doi: 10.3389/fmicb.2018.00699 [10] SAIFULLAH, DAHLAWI S, NAEEM A, et al. Biochar application for the remediation of salt-affected soils: challenges and opportunities[J]. Science of the Total Environment, 2018, 625: 320-335. doi: 10.1016/j.scitotenv.2017.12.257 [11] OLIVEIRA F R, PATEL A K, JAISI D P, et al. Environmental application of biochar: current status and perspectives[J]. Bioresource Technology, 2017, 246: 110-122. doi: 10.1016/j.biortech.2017.08.122 [12] LAL R. Restoring soil quality to mitigate soil degradation[J]. Sustainability, 2015, 7(5): 5875-5895. doi: 10.3390/su7055875 [13] ZHANG X, QU J S, LI H, et al. Biochar addition combined with daily fertigation improves overall soil quality and enhances water-fertilizer productivity of cucumber in alkaline soils of a semi-arid region[J]. Geoderma, 2020, 363: 114170. doi: 10.1016/j.geoderma.2019.114170 [14] FIERER N, WOOD S A, DE MESQUITA C P B. How microbes can, and cannot, be used to assess soil health[J]. Soil Biology & Biochemistry, 2021, 153: 108111. [15] 王莹, 曹世伟, 朱义, 等. 2种生物炭施用对滨海盐渍土土壤及植物影响的对比分析[J/OL]. 环境工程学报, 1-11[2024-10-13]. http://kns.cnki.net/kcms/detail/11.5591.X.20240906.1808.012.html. [16] ZHENG Y F, XU Z C, LIU H D, et al. Patterns in the microbial community of salt-tolerant plants and the functional genes associated with salt stress alleviation[J]. Microbiology Spectrum, 2021, 9(2): e00767-21. [17] YANG X X, DAI Z A, YUAN R W, et al. Effects of salinity on assembly characteristics and function of microbial communities in the phyllosphere and rhizosphere of salt-tolerant Avicennia marina mangrove species[J]. Microbiology Spectrum, 2023, 11(2): e03000-22. [18] JIANG H C, HUANG Q Y, DENG S C, et al. Planktonic actinobacterial diversity along a salinity gradient of a river and five lakes on the Tibetan Plateau[J]. Extremophiles, 2010, 14(4): 367-376. doi: 10.1007/s00792-010-0316-5 [19] MACIAS-PEREZ L A, LEVARD C, BARAKAT M, et al. Contrasted microbial community colonization of a bauxite residue deposit marked by a complex geochemical context[J]. Journal of Hazardous Materials, 2022, 424: 127470. doi: 10.1016/j.jhazmat.2021.127470 [20] ROLDAN D M, CARRIZO D, SANCHEZ-GARCIA L, et al. Diversity and effect of increasing temperature on the activity of methanotrophs in sediments of fildes peninsula freshwater lakes, King George Island, Antarctica[J]. Frontiers in Microbiology, 2022, 13: 822552. doi: 10.3389/fmicb.2022.822552 [21] ZHANG Q Q, ZHAO W W, ZHOU Z Z, et al. The application of mixed organic and inorganic fertilizers drives soil nutrient and bacterial community changes in teak plantations[J]. Microorganisms, 2022, 10(5): 958. doi: 10.3390/microorganisms10050958 [22] LIU X J, DU F F, CHEN S Z, et al. Increased diversity of rhizosphere bacterial community confers adaptability to coastal environment for Sapium sebiferum trees[J]. Forests, 2022, 13(5): 667. doi: 10.3390/f13050667 [23] YE Y L, MA K J, FU Y H, et al. The heterogeneity of microbial diversity and its drivers in two types of sediments from tidal flats in Beibu Gulf, China[J]. Frontiers in Marine Science, 2023, 10: 1256393. doi: 10.3389/fmars.2023.1256393 [24] XUN W B, LIU Y P, LI W, et al. Specialized metabolic functions of keystone taxa sustain soil microbiome stability[J]. Microbiome, 2021, 9(1): 35. doi: 10.1186/s40168-020-00985-9 [25] 郭晓雯, 杜思垚, 王芳霞, 等. 长期咸水滴灌对棉田土壤细菌和真菌群落结构的影响[J]. 新疆农业科学, 2022, 59(12): 2909-2923. doi: 10.6048/j.issn.1001-4330.2022.12.006 [26] KALWASINSKA A, FELFOLDI T, SZABO A, et al. Microbial communities associated with the anthropogenic, highly alkaline environment of a saline soda lime, Poland[J]. Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology, 2017, 110(7): 945-962. doi: 10.1007/s10482-017-0866-y [27] ZHU F X, ZHU C Y, DOYLE E, et al. Fate of di (2 ethylhexyl) phthalate in different soils and associated bacterial community changes[J]. Science of the Total Environment, 2018, 637: 460-469. [28] YADAV A N, SAXENA A K. Biodiversity and biotechnological applications of halophilic microbes for sustainable agriculture[J]. Journal of Applied Biology & Biotechnology, 2018, 6(1): 48-55. [29] LIU C, YAMAMURA H, HAYAKAWA M, et al. Plant growth-promoting and antimicrobial chloropyrroles from a rare actinomycete of the genus Catellatospora[J]. Journal of Antibiotics, 2022, 75(12): 655-661. doi: 10.1038/s41429-022-00567-x [30] MANZONI S, PORPORATO A. Soil carbon and nitrogen mineralization: theory and models across scales[J]. Soil Biology & Biochemistry, 2009, 41(7): 1355-1379. [31] LI C H, MA B L, ZHANG T Q. Soil bulk density effects on soil microbial populations and enzyme activities during the growth of maize (Zea mays L. ) planted in large pots under field exposure[J]. Canadian Journal of Soil Science, 2002, 82(2): 147-154. doi: 10.4141/S01-026 [32] 刘强, 袁延飞, 刘一帆, 等. 生物炭对盐渍化土壤改良的研究进展[J]. 地球科学进展, 2022, 37(10): 1005-1024. doi: 10.11867/j.issn.1001-8166.2022.050 [33] YUAN B C, XU X G, LI Z Z, et al. Microbial biomass and activity in alkalized magnesic soils under arid conditions[J]. Soil Biology & Biochemistry, 2007, 39(12): 3004-3013. [34] REINHOLD-HUREK B, BUENGER W, BURBANO C S, et al. Roots shaping their microbiome: global hotspots for microbial activity[J]. Annual Review of Phytopathology, 2015, 532015: 403-424. [35] BANERJEE S, SCHLAEPPI K, VAN DER HEIJDEN M G A. Keystone taxa as drivers of microbiome structure and functioning[J]. Nature Reviews Microbiology, 2018, 16(9): 567-576. doi: 10.1038/s41579-018-0024-1 [36] FAUST K, RAES J. Microbial interactions: from networks to models[J]. Nature Reviews Microbiology, 2012, 10(8): 538-550. doi: 10.1038/nrmicro2832 [37] LEHMANN J, RILLIG M C, THIES J, et al. Biochar effects on soil biota-a review[J]. Soil Biology & Biochemistry, 2011, 43(9): 1812-1836. [38] ZHENG H, WANG X, CHEN L, et al. Enhanced growth of halophyte plants in biochar-amended coastal soil: roles of nutrient availability and rhizosphere microbial modulation[J]. Plant Cell and Environment, 2018, 41(3): 517-532. doi: 10.1111/pce.12944 [39] YAO T X, ZHANG W T, GULAQA A, et al. Effects of peanut shell biochar on soil nutrients, soil enzyme activity, and rice yield in heavily saline-sodic paddy field[J]. Journal of Soil Science and Plant Nutrition, 2021, 21(1): 655-664. doi: 10.1007/s42729-020-00390-z [40] 徐广平, 滕秋梅, 沈育伊, 等. 香蕉茎叶生物炭对香蕉枯萎病防控效果及土壤性状的影响[J]. 生态环境学报, 2020, 29(12): 2373-2384. [41] RANADEV P, ASHWIN R, BAGYARAJ D J, et al. Sulfur oxidizing bacteria in agro ecosystem and its role in plant productivity-a review[J]. Journal of Applied Microbiology, 2023, 134(8): lxad161. doi: 10.1093/jambio/lxad161 [42] QIN Y, DRUZHININA I S, PAN X Y, et al. Microbially mediated plant salt tolerance and microbiome-based solutions for saline agriculture[J]. Biotechnology Advances, 2016, 34(7): 1245-1259. doi: 10.1016/j.biotechadv.2016.08.005 -




 DownLoad:
DownLoad: