-
矿产资源开发与利用一直以来都是世界各国发展的重要基础[1]。随着国家发展以及工业进步,我们对矿产资源的需求也越来越大,矿产资源开采活动也越来越频繁[2]。但矿产资源的开采往往伴随着生态环境破坏,这其中包括植被破坏、表土剥离、重金属污染、尾矿堆存等[3]。
尾矿作为选矿后留下的固体废物其主要矿物成分为碳酸盐类和硅酸盐类,具有颗粒细小多为砂质、有机质极低、重金属毒性高且易扩散、微生物少、植被难以定殖等特点[4-6]。针对上述特点,目前尾矿的生态修复多采用“改良剂-微生物-植物”体系进行尾矿生态修复[7]。这种修复策略对重金属污染防治作用分为重金属稳定固化和植物吸收,通过有机质的引入为植物生长提供养分以及利用其中的官能团对重金属进行螯合等作用,在实现生态覆绿的同时防治重金属污染[8]。而植物能否定殖成功的关键点就在于重金属的毒性作用和有机质、氮、磷、钾等营养元素,因此探究尾矿生态修复过程中养分以及重金属的变化尤为重要。
本研究通过盆栽实验模拟尾矿生态修复过程,旨在诠释有机酸淋洗和菌棒有机质添加的情况下尾矿中养分和重金属的变化情况及作用机理,为尾矿生态修复工程提供依据。
-
实验尾矿选自云南省昆明市东川区铜尾矿,为海相砂岩型铜矿,主要矿物为白云石、石英、方解石、钠长石等[9]。其尾矿为砂质,养分较低,主要重金属为铜、锌、铁、锰。添加的废菌棒(以下简称菌棒)为福建古田县购买的茶树菇、滑子菇、银耳废菌棒堆肥发酵制成。具体理化性质见表1。
选用的有机酸改良剂包括柠檬酸(C6H8O7)、草酸(C2H2O4)、醋酸(C2H4O2)、酒石酸(C4H6O6)、抗坏血酸(C6H8O6),纯度为分析纯,有机酸从上海麦克林生化科技股份有限公司购买。有机酸的官能团能够与重金属结合形成较为稳定的配合物,从而降低重金属的毒性作用[10]。植物选择种植高羊茅,草种从宿迁绿芃种业科技有限公司购买。使用的微生物菌肥为硅酸盐细菌,菌肥从北海亦强生物科技有限公司购得,其活菌数≥1.0×1010 g−1。
-
本研究结合前人实验方法[11],采用盆栽实验进行,尾矿重量为1 kg每盆,然后配制浓度为0.1 mol·L−1的5 种有机酸淋洗剂对尾矿分别进行淋洗,有机酸选取浓度参考吴俭[10]相关研究结果而确定,由于尾矿本身为碱性所以无需进行pH回调,反应放置1 个月后取样用于重金属和养分等分析(以上部分称之为处理前),之后向其中加入菌棒50 g以及将1 g微生物菌肥混匀,同时向每盆中均匀撒入高羊茅种子50 颗,待发芽后拔除多余高羊茅每盆保留25 株,每组设置4 个平行,同时设置对照组。培养3 个月后收集尾矿样品和植物样品进行分析(以上部分称之为处理后),将其实验前后数据进行对比,观察添加菌棒前后的变化。实验组:C(草酸淋洗)、U(醋酸淋洗)、N(柠檬酸淋洗)、J(酒石酸淋洗)、K(抗坏血酸淋洗)。对照组:T1(无有机酸淋洗,无发酵菌棒添加)、T2(无有机酸淋洗)。
-
采用pH计(pHS-3C,上海雷磁科学仪器有限公司)测定尾矿pH,固液比为1∶5。采用电导率仪(DDS-11A,上海雷磁科学仪器有限公司)测定尾矿EC,固液比为1∶5。采用SEM-EDS(Sigma 300,德国ZEISS公司)观察不同有机酸淋洗及菌棒添加后尾矿中元素分布。
养分测定:有机质采用“水合热重铬酸钾氧化-比色法”在559 nm波长处用紫外分光光度计(EVOLUTION 201,安捷伦科技有限公司)测定;碱解氮采用碱解扩散法测定;速效磷采用碳酸氢钠法在700 nm波长处用紫外分光光度计测定;速效钾采用乙酸铵浸提法在火焰原子吸收光度计(TAS-990,北京普析通用仪器有限责任公司)测定。
重金属测定:铜、锌、铁、锰总量采用混合酸溶法在火焰原子吸收光度计上测定;重金属化学形态采用BCR顺序提取法测定;有效态采用DTPA浸提法测定;植物中的重金属采用高氯酸+硝酸消化测定[12]。
-
采用生态风险指数(ecological risk index,ERI),评价重金属环境风险;风险评价编码法(risk assessment code,RAC)以重金属形态为对象评价重金属污染风险;次生相与原生相比值(rations of secondary phase and primary phase,RSP)来评价其污染风险等级。数据处理采用SPSS.26进行单因素方差分析(P<0.05)和邓肯检验(P<0.05),评价各处理组间pH、电导率(electric conductivity,EC)、养分、重金属等的显著性差异。
-
pH作为环境中的关键参数,土壤中无数物质的化学反应都与其有关,并且它直接或间接影响着植物生长发育,过酸和过碱的环境都不适宜植物生长[13-14]。这样的情况也同样适用于生态修复的尾矿基质中,因此,将尾矿基质维持在微酸性至微碱性是生态修复的重要基础。而EC则是代表着尾矿中可溶性盐的浓度,其浓度过高会形成反渗透和离子胁迫,会引起植物损伤和抑制植物生长[15]。有机酸淋洗和菌棒添加情况下尾矿的pH和EC变化情况见表2。
与对照组相比,在未添加菌棒及植物种植前(处理前),有机酸淋洗下尾矿pH均有不同程度的上升,这可能是因为有机酸加速了矿物的溶解释放Na+、K+、Ca2+等离子以及硅酸盐水解释放的OH−有关[13,16],其中C组pH上升最明显。而在添加菌棒和植物种植以后(处理后)pH均有不同程度的降低,与对照组T1相比,在添加了菌棒的情况下pH降低更为显著,降低范围从1.15~2.14不等。这是可能因为微生物介导的有机质分解和植物根系分泌产生的有机酸所致,然而这些有机酸的产生并没有像之前一样引起pH的上升,这可能是因为植物及微生物的引入能够调控自身对Na+、K+、Ca2+等离子的吸收等,使周围环境pH保持在适宜生长的范围内[17]。
EC在处理前组内的变化趋势和原因与pH相似,均是在有机酸淋洗情况下EC值要显著高于对照组,主要是因为有机酸的淋洗溶解矿物释放大量元素所致。处理后与处理前相比,EC降低了79.33~199.55 us·cm−1,说明添加菌棒有机质能够显著降低EC值,这是因为有机质中含有大量的羧基等能够增加土壤胶体吸附Ca2+、K+等盐基离子的能力,从而降低可溶性盐离子[18]。通过以上分析,可以发现菌棒的引入能够大幅度降低尾矿pH和EC值,改变尾矿盐碱度,为植物生长提供良好的基础条件,加快植物定殖。
-
土壤养分作为植物生长的必须物质,当养分不足时,会严重影响植物生长发育。例如,当有机质缺乏时会影响土壤团聚性,使土壤板结等,进而导致植物呼吸作用和养分吸收减弱;当缺氮时,会导致植株矮小、植物细胞壁变薄,容易受病菌感染等;当缺钾时,会降低植物体内酶活性;当缺磷时,会影响植物光合作用、蛋白质合成等正常生命代谢活动[19]。由于菌棒本身含有的氮磷钾远高于尾矿,因此菌棒的添加在一定程度上会使得尾矿中的养分提高,根据实验条件计算可知,理论上有机质增加1.59 g·kg−1,碱解氮、速效磷、速效钾分别增加60.29、7.22、3.47 mg·kg−1。然而,研究结果表明,当向尾矿中添加菌棒后,有机质、碱解氮、速效磷、速效钾均显著高于理论升高值,具体结果见表3。
从表中可以发现,在添加菌棒的情况下(处理后)T2、U、N,有机质均达到绿化种植土壤肥力技术要求,J、C、K虽然略低于绿化种植土壤肥力技术要求,但也远高于未添加菌棒的组别;碱解氮、速效磷、速效钾则是在添加菌棒后所有组别均达到了绿化种植土壤肥力技术要求。其中,有机质N处理组最高,23.32 g·kg−1,U处理组次之,21.18 g·kg−1;碱解氮U处理组最高,114.57 mg·kg−1,C处理组次之,110.10 mg·kg−1;速效磷K处理组最高,12.42 mg·kg−1,N处理组次之,12.23 mg·kg−1;速效钾J处理组最高,161.65 mg·kg−1,U处理组次之,137.03 mg·kg−1;有机质、碱解氮、速效磷的提高一方面是菌棒自身其养分较高,更重要的可能是由于菌棒的添加给微生物提供了生存条件,微生物通过对菌棒的分解转化使得尾矿中养分进一步升高[20]。钾的提高可能是添加的硅酸盐菌所致,由于菌棒的添加为硅酸盐细菌生长繁殖提供充足的碳源,使得硅酸盐菌大量繁殖,硅酸盐细菌又称解钾细菌,能够破坏矿物晶格释放其中的钾元素[21]。而在(处理前)组别中,由于尾矿本身养分低,因此在有机酸淋洗下无明显变化;在(处理后)组别中可以发现向添加菌棒的情况下不同有机酸淋洗组之间养分的变化情况同样不大,说明有机酸淋洗对尾矿养分变化影响较小。综上所述,菌棒的添加能够大幅度改善尾矿养分情况,解决尾矿生态修复过程中由于养分缺乏导致的植物矮小易死亡等问题。
-
重金属作为尾矿的主要特征污染物,一方面会对周边土壤和水环境造成严重污染,一方面也会因为对植物的毒性作用造成尾矿生态修复工程难度增加[22]。重金属主要是在细胞和分子层面对植物产生毒性作用改变植物生理循环,例如使酶失活、破坏细胞膜细胞壁的完整性、蛋白质变性、诱导活性氧的产生以及与植物中某些生物分子结合[23]。
1)重金属化学形态变化。将尾矿中的重金属向更稳定的形态转化,减弱其迁移能力和毒性作用是尾矿生态修策略的1 种。ASEMOLOYE等[24]和CAI等[25]研究发现菌棒可以作为重金属钝化剂,结合和固定土壤中的重金属,能够促进重金属向活性较低的化学形态转化。因此,本研究通过引入有机酸和菌棒,利用其含有丰富的官能团及配位体对重金属进行螯合,以此来探究尾矿中重金属化形态的变化情况,具体结果见图1。
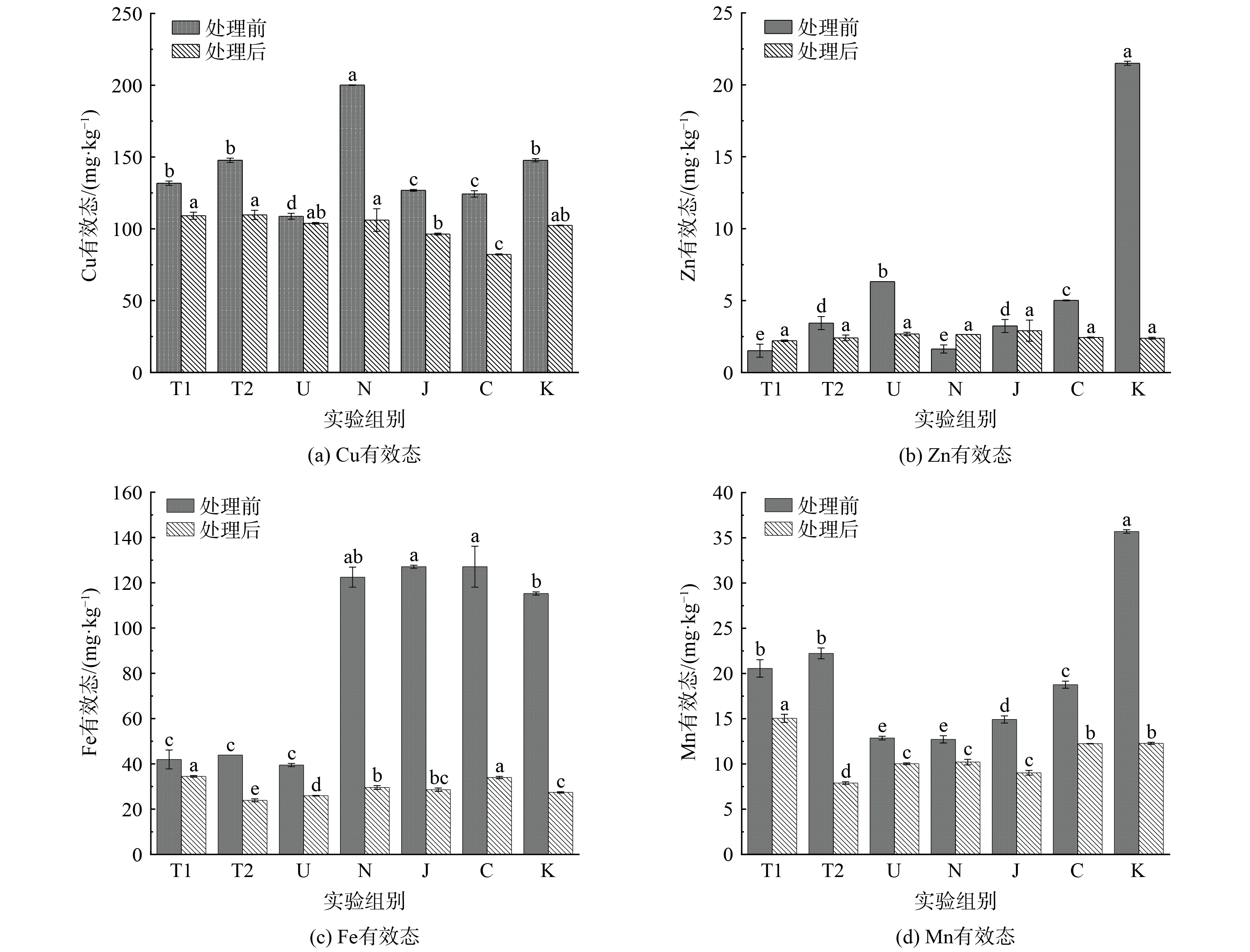
从图中可以发现,在添加菌棒前(处理前),不同有机酸处理均能够降低Cu的弱酸提取态及还原态,可氧化态则是U、J、C、K处理组略微升高,T2和N组略微降低,以及提高其残渣态占比。在弱酸提取态中U处理组效果最好,与T1相比降低了7.3%;还原态中则是K处理组效果最好,与T1相比降低了5.78%;可氧化态中与T1相比J处理组升高最多(4.1%);残渣态中K处理组效果最好,与T1相比升高了12.64%。对Zn的弱酸提取态则是在N、J、C组处理下有所降低,N处理组降低最多(2.73%),U和K两组处理有所升高,K处理组升高最多(12.29%);还原态在5 组有机酸处理下有不同程度降低;而对可氧化态和残渣态的变化不大。总体上说,有机酸处理对Zn的化学形态影响较低。Fe和Mn在有机酸处理下化学形态变化则是不明显。综上所述大部分有机酸处理均能降低重金属的弱酸提取态和可还原态,Cu和Zn受有机酸影响程度要大于Fe和Mn。
当向有机酸处理后的尾矿中添加菌棒(处理后),由于向尾矿中添加的菌棒重量占比远远小于尾矿,因此菌棒添加引起的物理稀释忽略不计。从图中可以发现Cu和Fe的弱酸提取态占比进一步减少,与处理前相比Cu的弱酸提取态占比从41.39%~34.06%降低至22.57%~18.54%;Fe弱酸提取态占比从10.08%~5.78%降低至2.18%~1.72%;Mn弱酸提取态占比从15.70%~13.88%降低至11.95%~10.52%;而对Zn弱酸提取态的影响则是不明显,与处理前相比略微有升高。可还原态Cu和Fe的变化情况与弱酸提取态相似,与处理前相比Cu的可还原态占比整体上从10.66%~4.88%降低至7.44%~6.21%;Fe可还原态占比从12.29%~10.00%降低至8.77%~8.08%;Zn可还原态占比略微有所降低,从7.15%~4.23%降低至5.12%~3.43%;Mn可还原态处理前后变化则是不明显。4 种重金属的可氧化态处理前后变化情况与弱酸提取态和可还原态变化情况有所不同,菌棒添加对4 种重金属的可氧化态均影响较小。Cu可氧化态占比略微有所降低,整体上从23.80%~19.12%降低至20.15%~17.44%;Fe可氧化态占比整体上从2.12%~2.72%升高至2.80%~4.45%;而Zn和Mn的可氧化态整体上则是变化不明显。残渣态占比则是除了Zn略微有所降低外,整体上从77.80%~62.40%降低至75.49%~71.22%,其余3 种重金属均有不同程度升高,Cu残渣态占比整体上从37.08%~28.77%升高至54.62%~50.59%,这也说明了菌棒的添加大幅提高了Cu的残渣态;Fe残渣态占比整体从80.03%~77.04%上升至86.79%~85.11%;Mn残渣态占比整体从84.72%~82.87%上升至87.99%~86.42%。通过对添加菌棒前后重金属各个化学形态对比分析可以知道,除了Zn外,菌棒的添加会降低Cu、Fe、Mn的弱酸提取态及可还原态占比,增加残渣态占比,使其向更稳定低毒的形态转变。
2)重金属有效态和植物吸收变化。重金属有效态作为植物可以吸收利用的形态与植物的生长发育息息相关[26],因此,关注其变化也是在尾矿生态修复工程中十分必要的。有机酸淋洗和菌棒添加对尾矿中Cu、Zn、Fe、Mn有效态的影响情况见图2。
在处理前的组别中,与T1、T2相比大部分有机酸淋洗有助于Cu的有效态减少,但N组除外,这可能是由于柠檬酸的酸化作用所致[27]。而Zn有效态则是在大部分有机酸的淋洗下表现出升高的趋势,其中K组尤为明显,这可能与Zn在尾矿中的存在形式有关,导致有机酸对Zn主要是解吸作用[28]。Fe的有效态在N、J、C、K,4组有机酸酸处理下显著升高,这可能是有机酸诱导的含Fe矿物溶解[29]。Mn的有效态变化情况与Zn相似,均是在K处理组最高。在处理后的组别中,可以发,当菌棒添加后4 种重金属的有效态均要明显低于处理前组别,这可能是因为在植物根系及微生物的作用下,菌棒被逐渐分解形成的腐殖质中含有大量羧酸、羟基、多糖等官能团与重金属络合以及有机物代谢过程的副产物使得铁锰氧化物增加进而加强了对重金属的吸附作用[30-32]。
图3则是表示不同有机酸处理下及菌棒添加后(处理后)植物地上和地下部分植中重金属的质量分数,从图中可以发现,T1与其他组相比:在添加菌棒后植物地上和地下部分中Cu的质量分数显著降低,T2与其他有机酸处理组相比则是变化不明显,这说明有机酸对植物吸收重金属的影响小于菌棒添加的影响;植物对Zn和Mn的吸收则无论是菌棒添加还是有机酸淋洗情况下均变化不明显;对Fe的吸收地下部分在菌棒添加后显著上升,地上部分则是有机酸淋洗的组别吸收较高。图4为尾矿的EDS图谱及Cu、Zn、Fe、Mn的元素分布图,结果表明,在添加菌棒的尾矿中,绝大部分组别的Cu、Zn、Fe、Mn均有不同程度降低,从元素分布图也能看出相较于T1,其他组别4 种元素分布相对较少。EDS图谱结果也表明植物对重金属的吸收情况,并且与上述重金属的化学形态和有效态的变化情况基本符合,也证实了上述中给出的有关重金属变化的结果。
3)重金属环境风险评价。由于各种重金属风险评价方法差异较大,各有优缺点,因此本研究采用RAC、ERI、RSP,3 种评价方法对有机酸和菌棒处理下的重金属进行风险评价,对比各种方法下重金属污染风险等级[33-35]。
RAC法主要是通过重金属中的弱酸提取态在总量中的占比对环境风险进行评级,其公式为式(1)。
式中:RAC为尾矿中重金属风险指数;
CF1 为弱酸可提取态重金属,mg·kg−1;CF2 为可还原态重金属,mg·kg−1;CF3 为可氧化态重金属,mg·kg−1;CF4 为残渣态重金属,mg·kg−1。ERI通常是以重金属活性较高的有效态与重金属总量之比来评价重金属风险等级,其公式为式(2)。
式中:ERI为尾矿中重金属生态风险指数;
Cbs 为有效态重金属,mg·kg−1;Cs 为总重金属,mg·kg−1。RSP是指次生相(除残渣态)重金属形态与原生相(残渣态)重金属比值来评价其污染风险等级,其公式为式(3)。
式中:RSP为尾矿中重金属污染程度;
Msec 为次生相重金属,mg·kg−1;Mprim 为原生相重金属,mg·kg−1。3 种方法评价等级划分标准见表4,Cu、Zn、Fe、Mn风险评价分别见表5、6、7、8。
从表5中可以发现,利用3 种评价方法对尾矿中的Cu污染进行评价时,RAC方法显示在未添加菌棒的处理前组别中Cu污染评价等级均为高风险,但在添加菌棒的处理后组别中Cu污染等级均降为中风险;ERI方法显示虽然在处理前和处理后组别均为中风险,但是在添加菌棒的处理后组相比于处理前组别其ERI值均有显著降低;RSP方法评价Cu污染等级显示在未添加菌棒的处理前组别中为轻度污染和中度污染,而在添加菌棒的处理后组别中均变为无污染。在T1组别中,也就是未添加菌棒情况下种植植物会增加RAC和RSP值,RAC评价中从处理前的41.36%增加至处理后的49.91%;RSP评价中更是从2.53增加至4.15,污染等级从中度变为重度。相比于菌棒添加,有机酸淋洗对Cu污染风险的影响就小的很多,无论是在处理前还是处理后组别中,不同有机酸处理虽然对RAC、ERI、RSP的值有变化但对评价等级几乎没影响。
从表6中可以发现,利用3种方法对Zn污染进行评价时,RAC方法评价在未添加菌棒的处理前组别中为中风险,虽然在添加菌棒的处理后组别中RAC值有所升高,但评价等级仍然为中风险;ERI方法处理前组别为高、中、低风险,处理后组别均降为低风险;对RSP评价无明显影响,处理前后组别均为无污染。而有机酸淋洗除了对处理前组别ERI评价等级有影响外(K组对EIR评价影响最大),对其他方法评价等级均没有显著的影响。
从表7、8中发现,与Cu和Zn不同的是,Fe和Mn虽然3种评价方法的值处理后组别相比于处理前组别均有降低,但其评价等级几乎没变化。同样,在不同有机酸处理下,Fe和Mn的评价值和评价等级也无明显变化。通过对4 种重金属的风险评价分析,可以发现无论是有机酸处理下还是添加菌棒对Cu和Zn的影响要大于Fe和Mn,其次,在Cu和Zn的风险等级评价中可以发现,添加菌棒的作用要大于有机酸淋洗的作用。
-
1)尾矿pH和EC受有机酸处理和菌棒添加的显著影响,菌棒添加下,pH降低了1.15~2.14,EC降低了79.33~199.55 us·cm−1。
2)尾矿中的养份受到菌棒添加的显著影响。在菌棒添加下养分显著增加,基本达到绿化种植土壤肥力技术要求。
3)除Zn外,有机酸淋洗和菌棒添加均能降低其余3 种重金属的弱酸提取态,增加残渣态。重金属形态受菌棒添加的影响要大于有机酸,对Cu的影响最大。
有机酸淋洗和废菌棒添加对铜尾矿盆栽实验中养分和重金属的影响
Effects of organic acid washing and edible fungi residue addition on nutrients and heavy metals in copper tailings potting experiments
-
摘要: 尾矿作为矿山开采后的废弃物,针对其重金属毒性高和养分贫瘠等导致生态修复工程难度增加的问题,采用有机酸淋洗和菌棒添加的方式实现尾矿中重金属稳定和养分提升,以使得其能够满足植物生长。通过选取5 种有机酸按0.1 mol·L−1浓度对尾矿进行淋洗然后再添加菌棒,采用微生物-植物的生态修复方式进行盆栽实验模拟尾矿生态修复过程,研究了有机酸淋洗和菌棒添加对铜尾矿中养分和重金属变化情况及作用机理。结果表明,当有机酸淋洗和菌棒添加时,铜尾矿中有机质提高了12.08~17.37 g·kg−1,碱解氮提高了96.89~114.00 mg·kg−1,速效磷提高了8.68~10.68 mg·kg−1,速效钾提高了44.73~92.96 mg·kg−1,其养分质量分数基本达到绿化种植土壤肥力技术要求;同时,减少了Cu、Zn、Fe、Mn弱酸提取态比例,对Cu的效果最明显,有机酸处理最高可减少7.3%,菌棒添加能减少18.82%~15.55%。本研究结果可为尾矿生态修复过程养分改善及重金属稳定提供理论参考。Abstract: Tailings are the waste after mining, due to its high heavy metal toxicity and poor nutrients, which lead to an increase in the difficulty of ecological restoration projects. The use of organic acid washing and edible fungi residue addition can achieve heavy metal stabilization and nutrient upgrading in tailings, in order to make it meet the needs of plant growth. By selecting five organic acids at a concentration of 0.1 mol∙L−1 for washing tailings and then adding edible fungi residue, using the ecological restoration method of microorganism-plant for potting experiments to simulate the ecological restoration process of tailings, the effects of organic acid washing and edible fungi residue addition on the nutrient and heavy metal changes in copper tailings and their mechanisms were studied. The results showed that when organic acid washing and edible fungi residue were added together, the organic matter in copper tailings increased 12.08~17.37 g∙kg−1, alkaline dissolved nitrogen increased 96.89~114.00 g∙kg−1, quick-acting phosphorus increased 8.68~10.68 g∙kg−1, quick-acting potassium increased 44.73~92.96 g∙kg−1, and its nutrient mass fraction has basically reached the green planting soil fertility technical requirements. At the same time, they reduced the proportion of Cu, Zn, Fe, Mn in weak acid extraction state. The most obvious effect was on Cu. The organic acid treatment can be reduced by up to 7.3%, and the addition of edible fungi residue can reduce the content by 18.82%~15.55%. The results of this study can provide theoretical references for nutrient improvement and heavy metal stabilization during the ecological rehabilitation of tailings.
-
Key words:
- tailings /
- heavy metal /
- organic acid /
- nutrient /
- edible fungi residue
-
阿特拉津(2-Chloro-4-ethylamino-6-isopropylamino-s-triazine,ATZ)是一种通过阻断叶绿体中质体醌结合蛋白和抑制光合作用来防治阔叶和禾草类杂草的选择性除草剂,土壤对其吸附性较低,因此极易向地表水、深层土壤和地下中迁移[1]. 低浓度的阿特拉津显著降低作物的株高、根长、根干重,高浓度的阿特拉津甚至会导致植物死亡[2];阿特拉津影响雄性斑马鱼的神经发育和神经功能[3],已成为一种污染源并对动植物和人类健康造成不可忽视的风险[4-5]. 由于阿特拉津严重的危害及影响,2004年在欧盟被禁止使用,但由于它价格低廉而在世界其他地区被广泛使用,仍是国际上销售的主要除草剂之一.
目前,环境中阿特拉津的去除方法主要有吸附法[6]、光催化法[7]、高级氧化法[8]、植物修复法[9-10]、生物法[11]等,其中基于微生物降解的生物修复法不仅效率高,而且几乎不损害生态环境,并且可将ATZ转化为无毒或低毒的物质.很多研究者已筛选出能将阿特拉津作为唯一氮源或碳源的微生物,如细菌Pseudomonas sp. strain AKN5[12]、Klebsiella sp. FH-1[13]、Citricoccus sp. strain TT3[14]、Arthrobacter sp. 30、Pseudomonas sp. AD39[15]和真菌Pleuroyus ostreatus INCQS 40310[16]等. 这些菌株对阿特拉津具有耐受性并能降解高浓度的阿特拉津,Enterobacter sp.LY-2[17]对浓度为100 mg·kg−1的污染土壤具有修复效果,14 d后阿特拉津浓度降低为9.9 mg·kg−1;产脲节杆菌(Arthrobacter ureafaciens)CS3,培养2 d 可将50 mg·L−1的阿特拉津完全降解[18]. 虽然目前报道的去除阿特拉津的微生物种类较多,但仍然存在停滞期长,降解耗时较长,耐受性差等不足。而且大部分菌株来源于中国北部寒冷地区,东北多为黑土,呈中性或偏碱性、有机质及氮磷含量丰富,而长三角地区雨量充沛、气温较高,土壤通透性差、呈弱酸性、有机质及氮磷含量较低,这些菌株可能不适应长三角的土壤环境,因此有必要寻找适合长三角地区的高效阿特拉津降解微生物资源.
本研究从江苏省5个不同地区的农田土壤中筛选分离能适应长三角地区阿特拉津污染土壤的菌株,研究ATZ初始浓度、温度和pH对菌株繁殖和降解效果的影响,判断菌株的适用环境范围,并采用HPLC-MS测定ATZ的降解产物,推断可能存在的降解转化途径.
1. 材料与方法(Materials and methods)
1.1 主要试剂
阿特拉津(>97%)(C18H14ClN5,分子量214.69,密度为1.2 g·cm−1、沸点为200 ℃、熔点为174 ℃,难溶于水)、甲醇、乙醇、葡萄糖、C6H9Na3O9、C9H11NO、C6H7NO3S、C10H9N等. 无机盐培养基(MSM):Mg2SO4·7H2O 0.1 g·L−1、K2HPO4 1 g·L−1、KH2PO4 1 g·L−1、FeSO4·7H2O 0.025 g·L−1、CaCl2 0.025 g·L−1,适量阿特拉津;富集培养基(LB) :牛肉浸膏5 g·L−1、胰蛋白胨10 g·L−1、NaCl 5 g·L−1,加15 g·L−1琼脂即为固体培养基.
1.2 阿特拉津降解菌的筛选与分离纯化
取江苏省5个长期喷洒阿特拉津的农田表层土壤(0—10 cm)进行降解菌株的驯化. 将土壤样品(5 g)分别加入150 mL MSM培养基中(ATZ浓度为50 mg·L−1),培养条件设置为 30 ℃、150 r·min−1. 驯化7 d后将上清液转至新的MSM培养基中,重复3次适应过程. 最后,将梯度稀释的培养液涂布于LB固体培养基,待菌落长成后,将其进行多次划线分离和纯化,并于无机盐培养基验证降解效果. 最终,筛选出一株能够降解阿特拉津的菌株D2,并采用斜面培养基和甘油保存.
1.3 菌株的鉴定
1.3.1 菌株的形态学观察
将菌株接种于固体培养基,2—3 d后观察长出菌落的形态(形状、色泽、透明程度等);采用扫描电镜(Quanta FEG 250)观察菌株 D2放大50000倍后的表面形态.
1.3.2 生理生化试验
革兰氏染色试验、水解产酸、柠檬酸盐利用、V-P、过氧化氢酶等指标,具体测定方法依据《污染控制微生物实验》[19],并参照《常见细菌系统鉴定手册》[20]与类似细菌进行比较.
1.3.3 16S rDNA基因序列分析
将菌株在固体培养基中划线分离,待菌落长成后进行16S rDNA基因鉴定,由上海天霖生物科技有限公司完成. 将D2的 16Sr DNA 基因序列在BLAST系统中与基因库进行比对分析,并使用MEGA 7.0软件绘制系统发育树.
1.4 菌株生长量的测定及生长模型拟合
采用紫外可见分光光度计(INESA-N4)测定菌株生长不同时间段的OD600以推测菌株的生长情况,以原始溶液为空白对照绘制D2的生长曲线,并用 SGompertz模型[21](式(1))和Slogistic模型[22](式(3))拟合D2的生长曲线,并得到菌株最大比生长速率(μ1、μ2):
lgNt1=lgN0+a1×e−e−k1(X−Xc) (1) μ1=a1×k1e (2) 式中,t为时间(h),Nt1为时间t时菌株的数量,N0为初始菌株数量,Xc为达到最大升值速率的时间(h),μ1为菌株的最大比生长速率(h−1),a1为菌株最大生长量.
Nt2=a21+e−k2(X−X0) (3) μ2=a2×k24 (4) 式中,t为时间(h),Nt2为时间t时菌株的数量,X0为达到最大升值速率的时间(h),μ2为菌株的最大比生长速率(h−1),a2为菌株最大生长量.
1.5 菌株D2最佳降解条件的研究
为了探究环境因素对菌株降解阿特拉津的影响,将菌悬液按照体积比为2%的量接种到含阿特拉津的MSM培养基中,研究不同初始浓度(10、20、50、100、150、200 mg·L−1)、不同pH(5.0、7.0、9.0)、不同温度(10、20、30、40 ℃)下菌株对阿特拉津的降解情况,以转速 150 r·min−1 避光培养,溶液经0.22 μm滤膜后测定阿特拉津的浓度.
1.6 阿特拉津及其降解产物的测定
阿特拉津的浓度采用岛津高效液相色谱仪(LC-20AT,Japan)测定. 检测条件:流动相为V(甲醇):V(水)=60:40,流速为1.0 mL·min−1,波长为220 nm. 降解产物定性分析采用带有高效液相色谱仪UltiMate 3000(Thermo Fisher Scientific,USA)和高分辨质谱仪5600 QTOF(AB SCIEX,Framingham,USA)的超高压液相质谱仪HPLC-MS,色谱柱(ACQUITY UPLC HSS T3 1.8 μm ,2.1 mm×100 mm),以水(含有2 mmol·L−1乙酸铵)和乙腈进行梯度洗脱. 条件:轰击能量,30 eV;雾化气压(GS1):60 Psi,辅助气压,60 Psi;气帘气压,35 Psi;温度,650 ℃;喷雾电压,5000 V(正离子模式)或−4000 V(负离子模式).
2. 结果与讨论(Results and discussion)
2.1 阿特拉津高效降解菌株的分离与鉴定
采用以阿特拉津(50 mg·L−1)为碳源和氮源的无机盐培养基对5个种植玉米的农田土壤经过驯化、分离,筛选出8株生长良好且菌落形态不同的菌株,最终选择一株降解效能最好的菌株,将其命名为D2.
菌株D2的菌落形态观察如图1(a),菌落较小,边缘整齐,浅黄色;革兰氏染色结果表明,D2为革兰氏阳性菌 (图1b ). 扫描电镜(×5000)下观察的菌株形态如图1(c)所示,D2呈杆状. 生理生化试验结果显示(表1),硝酸盐还原及过氧化氢酶试验均呈阳性,其余结果均为阴性.
表 1 菌株D2的生理生化特性Table 1. Physiological characteristic of strain D2特征 Characteristic 结果 Results 革兰氏染色 + 淀粉水解 − 吲哚 − 甲基红 − V-P产生 − 柠檬酸盐利用 − 硝酸盐还原 + 过氧化氢酶 + 注:“+”为阳性;“−”为阴性. Note:“+” means positive and “−” means negative. 将PCR扩增后得到的基因片段进行测序,测序结果在 NCBI 上经 BLAST 分析目标序列与同源序列,并绘制系统发育树(图2),对比发现ATZ降解菌株D2与土壤芽孢杆菌(Solibacillus)的核苷酸序列相似率高达99.58%,因此菌株D2经鉴定为土壤芽孢杆菌.
2.2 菌株D2的生长曲线及模型拟合
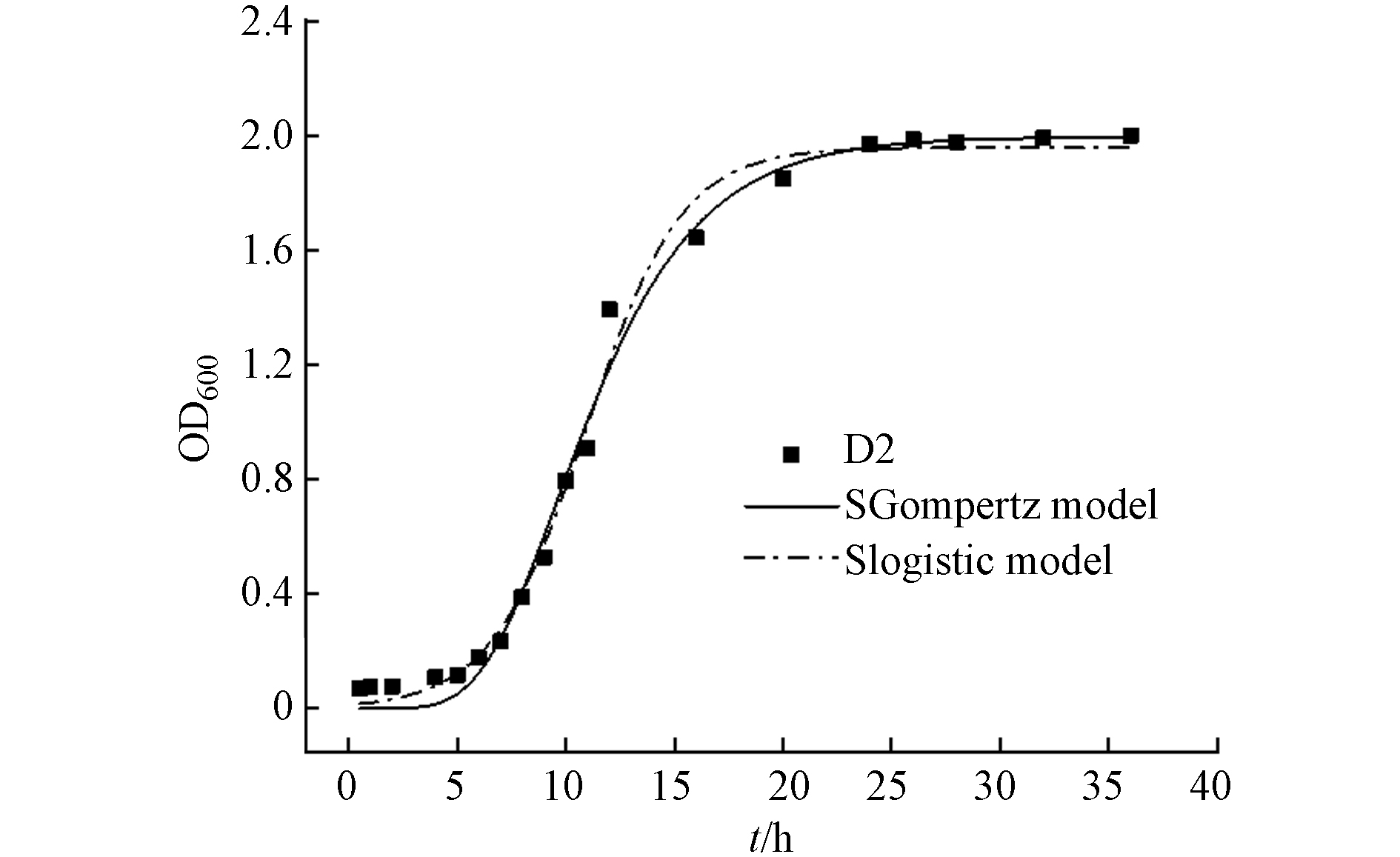
菌株D2的生长曲线见图3. 在LB培养基中,D2经过5 h的适应期后进入菌株代谢旺盛的对数期;12 h后OD600达到1.0,此时的菌株增长速率最快;24 h后达到生长繁殖的峰值,此后OD600不再增长,菌株数量相对趋于稳定.
采用SGompertz模型[23]和Slogistic模型拟合菌株的生长曲线(表2,图3). 结果显示,两种模型均可较好地拟合D2的生长曲线,拟合度(R2)分别为0.991和0.992,在第10 h左右D2到达最大比生长速率,随后比生长速率逐渐降低.
表 2 菌株生长曲线的SGompertz模型和Slogistic模型拟合参数对比Table 2. Comparative list of bacteria growth due to SGompertz and Slogistic model名称 Name SGompertz model Slogistic model R2 a1 K1 XC/h μ1/h−1 R2 a2 K2 X0/h μ2/h−1 D2 0.991 1.995 0.279 9.647 0.214 0.992 1.958 0.454 10.950 0.222 2.3 菌株D2对阿特拉津的降解特性研究
2.3.1 初始浓度对菌株降解阿特拉津的影响
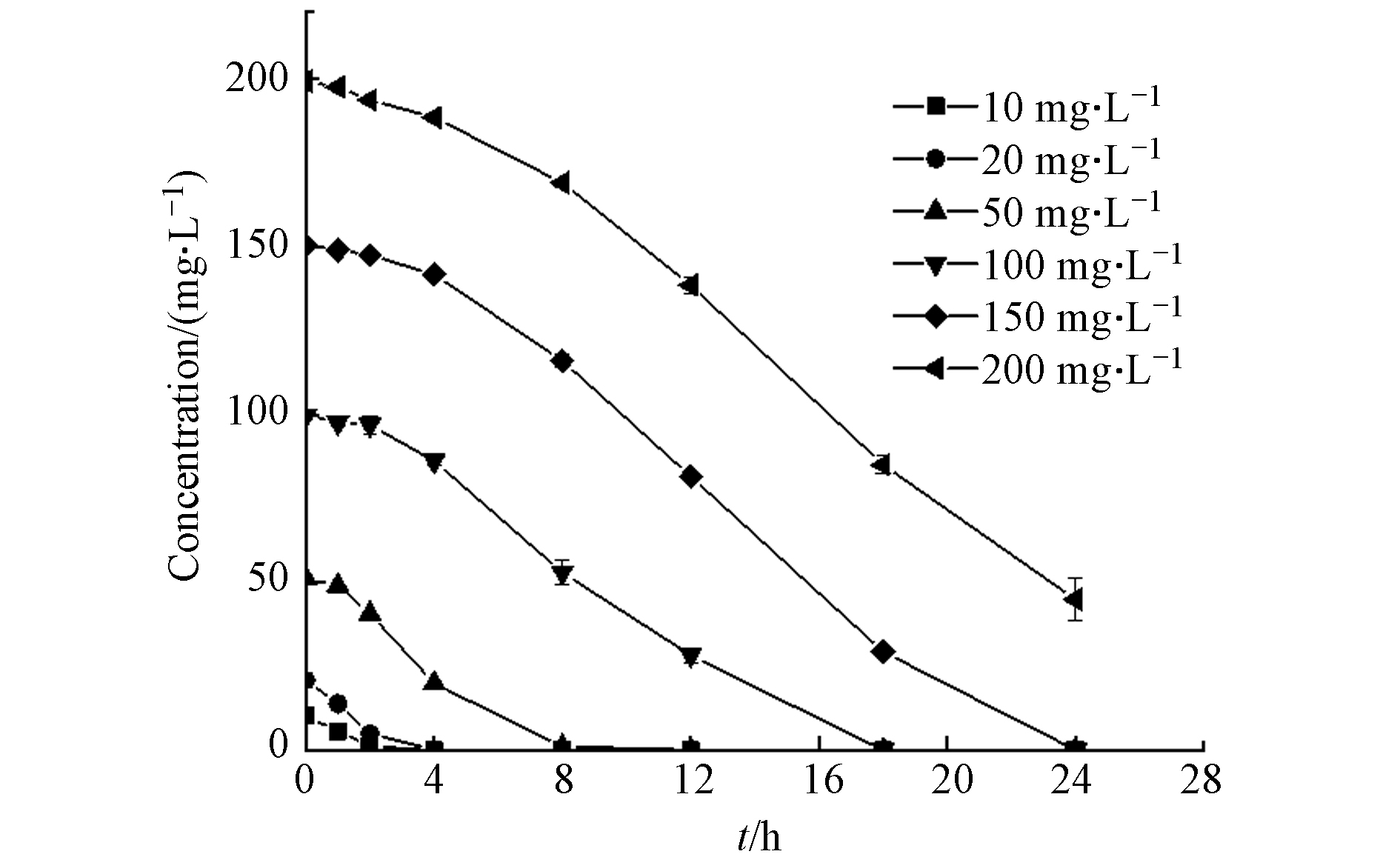
污染物浓度对菌株的影响是评价菌株生长及降解能力的标准之一[24],D2在不同初始浓度下对ATZ的降解效果如图4所示. 当浓度为200 mg·L−1时,D2对ATZ仍具有较高的去除能力,24 h的降解率为77.43%;初始浓度越低,D2的去除效率越高,将初始浓度为150、100、50、20、10 mg·L−1的ATZ完全降解分别需要24、18、8、4、3 h.长三角洲地区农田土壤中ATZ浓度的平均值为5.7 ng·L−1,检出率高达57.7%[25],菌株D2对ATZ的耐受性远高于环境中的平均浓度,因此它是一株在实际污染环境中具有应用价值的降解菌株.
2.3.2 温度和pH对菌株降解阿特拉津的影响
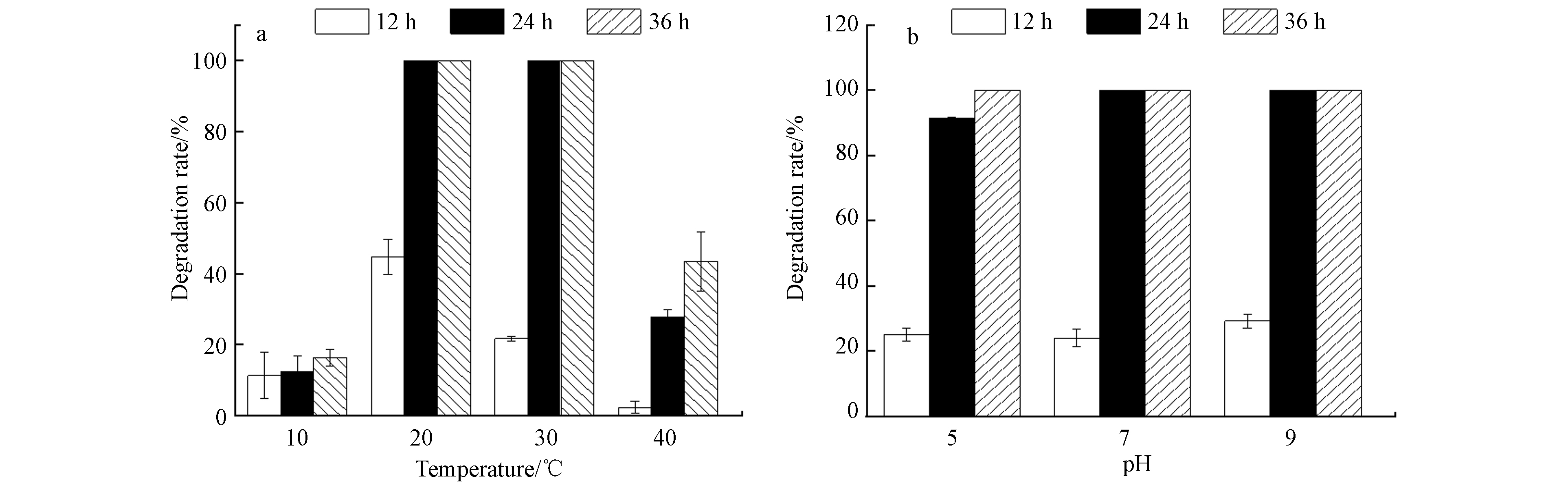
温度和pH会通过影响细菌的生长而影响其降解能力[26-28],不同温度(10、20、30、40 ℃)条件下,D2对初始浓度为100 mg·L−1 ATZ的降解情况见图5a. 当温度为20—30 ℃时,D2在24 h内将ATZ完全降解;但在10 ℃和40 ℃下培养36 h时,D2对ATZ的降解率仅为16.33%和43.48%,说明低温和高温都会抑制菌株的代谢作用,这与菌株的酶活性密切相关[29]. 另外,培养基的酸碱度也会影响细菌酶的合成和催化活性[9],细菌表面的电荷分布随着pH的改变而改变 [26]. 不同pH条件下,D2对初始浓度为100 mg·L−1(培养温度为30 ℃)ATZ的降解率如图5b所示. 当pH为5.0、7.0和9.0 时,经过24 h,D2对ATZ的降解率分别为到91.42%、100%、100%. 据以往研究报道,pH为5.0和9.0时,阿特拉津降解菌(Enterobacter sp.)的降解率低于70%[27],菌株L-6 [28] 仅能适应碱性环境,当pH=6时,降解率为45.6%,因此菌株D2对pH具有较高的适应性.
2.3.3 菌株D2的降解及生长动力学研究
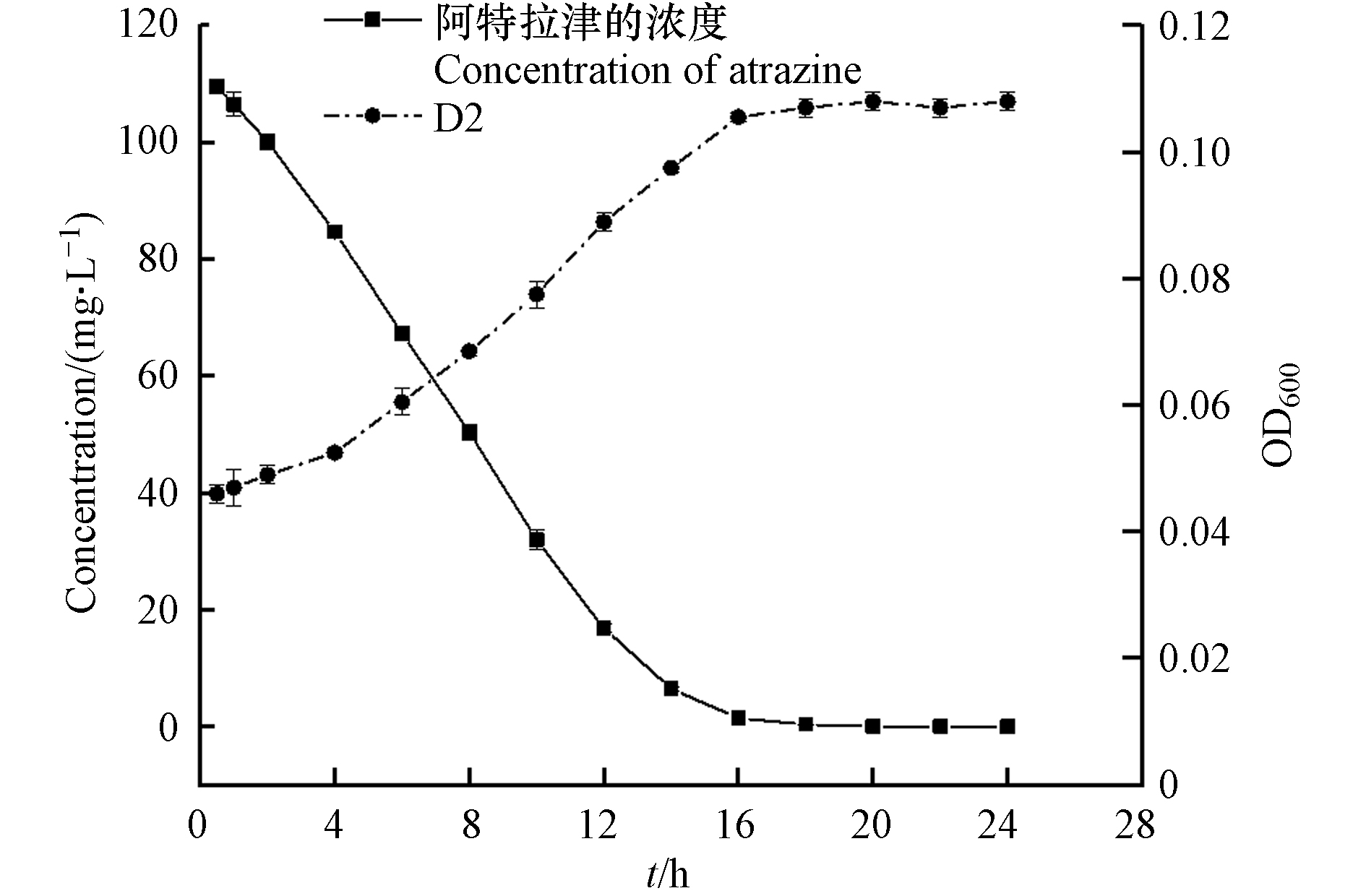
在最佳降解条件下(2%的菌悬液接种量、温度为20 ℃、pH为9.0),将菌株D2接种至初始浓度为100 mg·L−1的ATZ无机盐培养基中,生长及降解动态曲线如图6所示. 菌株D2的生长与ATZ浓度呈较强的负相关(表3,r=−0.983,P<0.01),随着菌株的生长,阿特拉津的浓度急剧降低. 培养初期D2存在短暂的适应期,OD600从0.046增至0.052;培养4 h后进入对数生长期,OD600达到0.097,此时随着菌株的大量生长ATZ被快速降解;在培养14 h以后菌株进入静止期,此时菌株数量达到最大值,其OD600为0.107,ATZ浓度降为6.41 mg·L−1,降解率达到94.33%,在18 h时ATZ被完全去除. 实验结果表明,阿特拉津浓度的降低与D2的数量密切相关,证明菌株D2具有阿特拉津去除能力.
表 3 浓度与OD600的相关性分析Table 3. Correlation analysis between concentration and OD600平均值 Average value 标准差 Standard deviation 浓度 Concentration OD600 浓度 41.093 44.110 1 OD600 0.080 0.026 −0.983** 1 注:* P<0.05,** P<0.01. 2.4 阿特拉津降解产物与降解途径研究
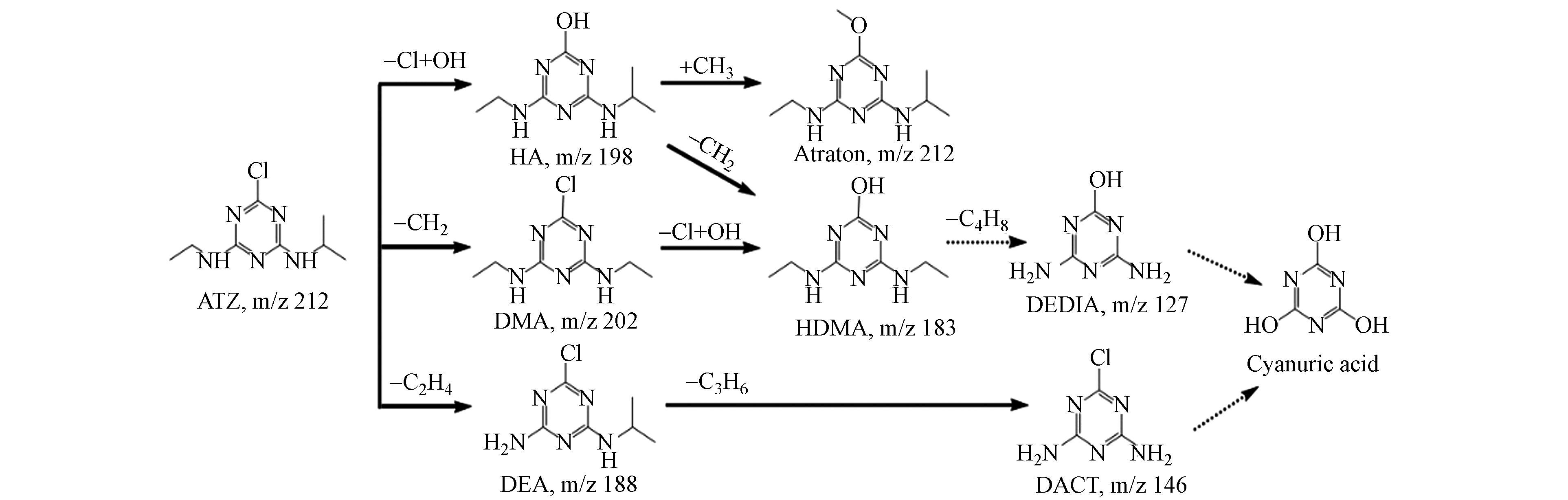
菌株D2于含ATZ的无机盐培养基进行培养,取12 h时的样品进行分析,采用高效液相色谱-质谱联用仪(HPLC-MS)测定其降解产物,共检测出6种可能的代谢物(图7 b—g),质荷比(m/z)分别为146.00、184.12、198.13、202.08、212.15、188.07,与已知标准化合物和报道的阿特拉津代谢物的比较,这6种代谢物分别被确定为脱乙基脱异丙基阿特拉津(DACT)、羟基西玛津(HDMA)、羟基阿特拉津(HA)、西玛津(DMA)、阿特拉通(Atraton)和脱乙基阿特拉津(DEA).
根据产物的结构组成和报道过的阿特拉津降解途径提出菌株D2降解阿特拉津的可能途径,结果如图8所示.
途径Ⅰ:首先羟基取代氯,形成脱氯羟基化的阿特拉津(HA),然后甲基取代HA的氢生成阿特拉通(Atraton),HA也可能通过脱甲基化反应转化为羟基西玛津(HDMA).途径Ⅱ:阿特拉津的异丙基脱甲基化生成西玛津(DMA),然后DMA的氯被一个羟基取代,转化为羟基西玛津(HDMA).途径Ⅲ:阿特拉津经N-脱烷基反应转化为脱乙基阿特拉津(DEA),随后DEA异丙基化为脱乙基脱异丙基阿特拉津(DACT). Liu等[30]在研究土壤中阿特拉津的降解途径时得到了相似的结果,阿特拉津可通过光解、水解及微生物降解转化为羟基阿特拉津、阿特拉通、扑灭津、脱乙基阿特拉津、羟基西玛津、西玛津、去乙基异丙基化阿特拉津等. 而Zhang 等[31]和郭火生等[32]还发现羟基阿特拉津可以被进一步水解为三聚氰酸.通过以上总结推测,阿特拉津的降解中间产物还会通过脱甲基化、脱烷基化和水解等产生三聚氰胺二酰胺(DEDIA)、去乙基异丙基化阿特拉津(DACT)和三聚氰酸等副产物.
2.5 菌株D2的降解能力
将本研究中的D2与已报道过具有阿特拉津降解能力的菌株进行对比,结果汇总如表4所示. 目前已经筛选出很多能以阿特拉津为唯一碳源或氮源生长的菌株,并适用于阿特拉津浓度范围为8—100 mg·L−1的废水,但本研究中的新菌株D2具有更优异的降解性能. 已研究的菌株Acinetobacter lwoffii DNS32 [32]在 20 ℃和 35 ℃时,对阿特拉津的降解率约为 30%—35%,最佳生长pH为7—8,在酸性及pH高于8的条件下,菌株的生长及降解能力受到抑制;菌株C2[33]在20 ℃、30 ℃、40 ℃下培养5 d后,降解率分别为86.7%、97.6%和21.9%;菌株SB5[34]生长的温度范围是25—37 ℃,在pH=8的条件下完全降解ATZ需36 h. 本研究分离出的菌株D2在20 —30 ℃、pH为5.0 — 9.0的范围内,18 h以内即可将100 mg·L−1的阿特拉津完全降解,远远快于培养时间为24 —264 h的其他菌株,且具有更强的pH和温度的适应性,在40 ℃的高温下仍具有一定的活性,降解率高于40%,在10 ℃的条件下,D2对ATZ的降解率仍有近20%. 另外,已报道的菌株大部分来源于北部寒冷地区,而菌株D2来源于江苏省农田土壤,更能适应夏季高温、有机质及氮磷含量低、弱酸性的土壤环境,可成为长三角地区阿特拉津污染土壤和废水修复的微生物资源.
表 4 已报道菌株对阿特拉津的降解效果的比较Table 4. Comparison of atrazine degradation by strains has been reported菌种 Strains 浓度/(mg·L−1)Concentation 温度/℃Temperature pH 地区Region 降解率/% Degradation 时间/h Time 文献来源Literature sources Klebsiella sp. FH1 50 25 9 吉林 81.5% 264 [13] LY-2 100 25 — 35 6 — 9 哈尔滨 98.7% 48 [17] CS3 50 30 7 河北 100% 48 [18] Arthrobacter sp. ZXY-2 50 30 — 35 8 — 9 哈尔滨 100% 6 [35] Arthrobacter sp. DNS10 100 30 7.5 哈尔滨 99.41% 24 [36] Paenarthrobacter sp. W11 100 30 7 吉林 97.1% 60 [37] Paenarthrobacter sp. W24 100 30 7 吉林 94.2% 72 [38] Arthrobacter sp. C2 100 30 7 — 9 吉林 100% 72 [33] Pseudomonas sp. 20 30 / 巴西 99% 24 [39] Achromobacter sp. 20 30 / 巴西 39% 48 [39] Pencillium sp. yz11-22N2 8 28 7 / 91.2% 120 [40] D2 100 20 — 30 5 — 9 江苏 100% 18 本研究 3. 结论(Conclusions)
(1)从江苏省5个不同区域的农田土壤中筛选出一株以阿特拉津为唯一碳源和氮源生长的菌株D2,属于土壤芽孢杆菌(Solibacillus),该菌株能适应长三角地区环境,并有效降解水体和土壤中的阿特拉津.
(2)在pH 5.0—9.0、温度20—30 ℃的条件下,菌株具有良好的降解能力. 最适条件下,D2能在18 h内将100 mg·L−1的ATZ完全降解,具有较高的耐受性及降解效率.
(3)D2主要通过脱氯羟基化、加氢脱烷基化、甲基化、脱烷基化和水解等将ATZ转化为羟基阿特拉津(HA)、阿特拉通(Atraton)、脱乙基阿特拉津(DEA)、西玛津(DMA)、羟基西玛津(HDMA)和脱乙基脱异丙基阿特拉津(DACT).
-
表 1 铜尾矿和菌棒基本理化性质
Table 1. Basic physicochemical properties of copper tailings and edible fungi residue
供试材料 pH 电导率/(us·cm−1) 有机质/(g·kg−1) 碱解氮/(mg·kg−1) 速效磷/(mg·kg−1) 速效钾/(mg·kg−1) 铜/(mg·kg−1) 锌/(mg·kg−1) 铁/(mg·kg−1) 锰/(mg·kg−1) 铜尾矿 9.43 139.00 5.27 0.57 0.35 55.64 531.70 38.00 1 415.00 3 506.00 菌棒 7.11 — 38.83 1 266.80 152.13 128.75 — — — — 表 2 不同有机酸淋洗下及菌棒添加前后尾矿pH和EC值
Table 2. pH and EC values of copper tailings treated with different organic acids washing and edible fungi residue before and after addition
组别 pH EC/(us·cm−1) 处理前 处理后 处理前 处理后 T1 8.38±0.233d 7.61±0.028c 189.00±18.384c 115.95±8.980b T2 8.80±0.007c 7.65±0.007c 165.85±11.101c 86.52±5.550cd U 9.80±0.084ab 7.71±0.084bc 289.00±89.095ab 99.00±3.111bc N 9.91±0.049ab 7.77±0.042b 297.50±6.363ab 99.05±2.050bc J 9.79±0.091ab 7.78±0.028b 382.50±7.778a 182.95±8.555a C 10.01±0.007a 7.94±0.035a 301.50±36.062ab 106.95±5.020b K 9.71±0.000b 7.89±0.056a 286.00±5.656b 89.30±8.909cd 注:同列数据后不同小写字母表示差异显著(P<0.05)。 表 3 不同有机酸淋洗下及菌棒添加前后尾矿养分值
Table 3. Nutrient contents of copper tailings treated with different organic acids washing and edible fungi residue before and after addition
组别或标准 有机质/(g·kg−1) 碱解氮/(mg·kg−1) 速效磷/(mg·kg−1) 速效钾/(mg·kg−1) 处理前 处理后 处理前 处理后 处理前 处理后 处理前 处理后 T1 5.28±0.21bc 7.99±0.38b 0.49±0.05d 11.57±1.87d 1.39±0.12bc 3.15±0.47c 66.62±1.78bc 70.49±2.81e T2 6.11±0.20a 20.08±1.39a 3.24±0.12a 105.06±6.79bc 2.67±0.16a 11.94±0.73a 63.39±3.31c 115.72±5.55d U 5.48±0.46abc 21.18±3.58a 0.57±0.17cd 114.57±3.13a 2.50±0.27a 11.96±0.37a 65.81±1.67bc 137.03±7.53bc N 5.95±2.30ab 23.32±4.90a 0.14±0.03e 97.04±2.00c 1.37±0.07bc 12.23±0.62a 72.25±3.09a 121.20±5.04cd J 5.45±0.27abc 17.53±1.42a 2.15±0.17b 99.90±1.91c 1.55±0.33bc 11.82±0.82a 68.69±1.88ab 161.65±6.59a C 5.17±0.23c 18.63±2.12a 0.84±0.04c 110.10±2.06ab 1.13±0.11c 9.81±0.58b 68.73±1.88ab 113.46±5.35d K 5.12±0.03c 18.70±1.37a 2.01±0.12b 102.69±2.05bc 1.67±0.10b 12.42±0.76a 68.35±3.57ab 145.17±8.56b 绿化种植土壤肥力技术要求 20~80 40~200 5~60 60~300 注:同列数据后不同小写字母表示差异显著(P<0.05)。 表 4 RAC、ERI、RSP法评价标准
Table 4. Evaluation criteria of RAC, ERI and RSP methods
等级 RAC ERI RSP RAC值 划分标准 ERI值 划分标准 RSP值 划分标准 1 RAC<1% 无风险 ERI<1% 无风险 RSP≤1 无污染 2 1%≤RAC<10% 低风险 1%≤ERI<10% 低风险 1<ERI≤2 轻度污染 3 10%≤RAC<30% 中风险 10%≤ERI<30% 中风险 2<ERI≤3 中度污染 4 30%≤RAC<50% 高风险 30%≤ERI<50% 高风险 ERI>3 重度污染 5 RAC≥50% 极高风险 ERI≥50% 极高风险 — — 表 5 不同有机酸淋洗及菌棒添加后尾矿中Cu的RAC、ERI、RSP法等级风险评价
Table 5. RAC, ERI and RSP grade risk assessment of Cu in tailings treated with different organic acids washing and after edible fungi residue was added
组别 RAC值 RAC评价等级 ERI值 ERI评价等级 RSP值 RSP评价等级 处理前 处理后 处理前 处理后 处理前 处理后 处理前 处理后 处理前 处理后 处理前 处理后 T1 41.36%±1.12%a 49.91%±0.53%a 高风险 高风险 26.91%±0.73%c 20.53%±0.23%a 中风险 中风险 2.53±0.67a 4.15±0.96a 中度污染 重度污染 T2 38.24%±0.44%bc 22.57%±0.97%b 高风险 中风险 29.12%±0.04%b 22.81%±1.04%a 中风险 中风险 2.10±0.10ab 0.93±0.22b 中度污染 无污染 U 34.06%±0.49%d 18.53%±0.27%b 高风险 中风险 21.59%±0.60%d 21.17%±0.00%a 中风险 中风险 1.73±0.01b 0.83±0.03b 轻度污染 无污染 N 40.15%±2.15%ab 20.05%±4.88%b 高风险 中风险 39.30%±1.14%a 21.43%±6.80%a 中风险 中风险 2.02±0.28ab 0.87±0.26b 中度污染 无污染 J 38.36%±1.11%bc 22.60%±0.39%b 高风险 中风险 26.07%±1.54%c 20.69%±0.17%a 中风险 中风险 2.30±0.05ab 0.97±0.05b 中度污染 无污染 C 37.20%±0.72%c 22.93%±0.96%b 高风险 中风险 25.12%±0.55%c 17.95%±0.78%a 中风险 中风险 2.21±0.20ab 0.92±0.00b 中度污染 无污染 K 37.34%±0.69%c 19.93%±0.40%b 高风险 中风险 29.69%±0.46%b 22.58%±0.09%a 中风险 中风险 1.78±0.10b 0.88±0.08b 轻度污染 无污染 注:同列数据后不同小写字母表示差异显著(P<0.05)。 表 6 不同有机酸淋洗及菌棒添加后尾矿中Zn的RAC、EIR、RSP法等级风险评价
Table 6. RAC, ERI and RSP grade risk assessment of Zn in tailings treated with different organic acids washing and after edible fungi residue was added
组别 RAC值 RAC评价等级 EIR值 EIR评价等级 RSP值 RSP评价等级 处理前 处理后 处理前 处理后 处理前 处理后 处理前 处理后 处理前 处理后 处理前 处理后 T1 13.79%±4.79%b 12.79%±1.97%b 中风险 中风险 4.15%±1.31%e 6.93%±0.22%a 低风险 低风险 0.38±0.11b 0.30±0.02b 无污染 无污染 T2 12.22%±1.95%b 14.47%±0.58%ab 中风险 中风险 9.77%±1.49%cd 7.44%±1.00%a 低风险 低风险 0.37±0.04b 0.35±0.01ab 无污染 无污染 U 14.66%±0.94%b 15.85%±2.42%ab 中风险 中风险 17.42%±1.11%b 8.79%±0.05%a 中风险 低风险 0.35±0.04b 0.38±0.05ab 无污染 无污染 N 10.97%±1.90%b 14.95%±0.28%ab 中风险 中风险 4.50%±1.12%e 8.85%±0.08%a 低风险 低风险 0.28±0.02b 0.35±0.02ab 无污染 无污染 J 11.52%±0.61%b 13.66%±0.66%ab 中风险 中风险 9.17%±2.01%d 8.41%±2.33%a 低风险 低风险 0.29±0.03b 0.32±0.02b 无污染 无污染 C 11.48%±0.78%b 16.46%±0.57%a 中风险 中风险 12.67%±0.83%c 7.83%±0.18%a 中风险 低风险 0.29±0.04b 0.40±0.00a 无污染 无污染 K 26.08%±0.28%a 14.61%±1.68%ab 中风险 中风险 49.94%±0.57%a 7.01%±0.54%a 高风险 低风险 0.60±0.02a 0.33±0.03ab 无污染 无污染 注:同列数据后不同小写字母表示差异显著(P<0.05)。 表 7 不同有机酸淋洗及菌棒添加后尾矿中Fe的RAC、EIR、RSP法等级风险评价
Table 7. RAC, ERI and RSP grade risk assessment of Fe in tailings treated with different organic acids washing and after edible fungi residue was added
组别 RAC值 RAC评价等级 EIR值 EIR评价等级 RSP值 RSP评价等级 处理前 处理后 处理前 处理后 处理前 处理后 处理前 处理后 处理前 处理后 处理前 处理后 T1 6.24%±0.15%c 17.61%±1.73%a 低风险 中风险 0.30%±0.03%b 0.25%±0.00%a 无风险 无风险 0.25±0.00b 0.46±0.04a 无污染 无污染 T2 5.59%±0.26%c 1.72%±0.31%b 低风险 低风险 0.31%±0.01%b 0.17%±0.00%c 无风险 无风险 0.25±0.01b 0.15±0.00b 无污染 无污染 U 6.59%±0.09%c 1.76%±0.02%b 低风险 低风险 0.28%±0.00%b 0.18%±0.00%bc 无风险 无风险 0.24±0.00b 0.16±0.00b 无污染 无污染 N 8.07%±1.18%b 1.88%±0.21%b 低风险 低风险 0.90%±0.02%a 0.21%±0.01%b 无风险 无风险 0.26±0.02ab 0.16±0.00b 无污染 无污染 J 9.47%±0.11%a 1.77%±0.06%b 低风险 低风险 0.94%±0.02%a 0.20%±0.01%b 无风险 无风险 0.28±0.01ab 0.16±0.01b 无污染 无污染 C 5.78%±0.13%c 1.98%±0.14%b 低风险 低风险 0.94%±0.07%a 0.24%±0.00%a 无风险 无风险 0.26±0.00ab 0.17±0.00b 无污染 无污染 K 10.08%±0.42%a 2.18%±1.68%b 中风险 低风险 0.87%±0.02%a 0.19%±0.00%bc 无风险 无风险 0.29±0.01a 0.17±0.00b 无污染 无污染 注:同列数据后不同小写字母表示差异显著(P<0.05)。 表 8 不同有机酸淋洗及菌棒添加后尾矿中Mn的RAC、EIR、RSP法等级风险评价
Table 8. RAC, ERI and RSP grade risk assessment of Mn in tailings treated with different organic acids washing and after edible fungi residue was added
组别 RAC值 RAC评价等级 EIR值 EIR评价等级 RSP值 RSP评价等级 处理前 处理后 处理前 处理后 处理前 处理后 处理前 处理后 处理前 处理后 处理前 处理后 T1 14.92%±0.38%ab 16.10%±0.10%a 中风险 中风险 0.58%±0.03%c 0.46%±0.02%a 无风险 无风险 0.19±0.00ab 0.22±0.00a 无污染 无污染 T2 14.97%±0.34%ab 11.64%±0.63%bc 中风险 中风险 0.63%±0.02%b 0.24%±0.00%e 无风险 无风险 0.19±0.01ab 0.15±0.00bc 无污染 无污染 U 13.88%±0.06%b 11.08%±0.03%cd 中风险 中风险 0.37%±0.00%e 0.30%±0.00%cd 无风险 无风险 0.18±0.00b 0.14±0.00bcd 无污染 无污染 N 14.82%±1.13%ab 11.09%±0.46%cd 中风险 中风险 0.36%±0.00%e 0.31%±0.00%c 无风险 无风险 0.19±0.01ab 0.14±0.00bcd 无污染 无污染 J 15.03%±0.11%ab 11.00%±0.31%cd 中风险 中风险 0.44%±0.00%d 0.27%±0.01%d 无风险 无风险 0.19±0.00ab 0.14±0.00cd 无污染 无污染 C 15.70%±0.15%a 11.95%±0.23%b 中风险 中风险 0.55%±0.01%c 0.38%±0.00%b 无风险 无风险 0.20±0.00a 0.15±0.00b 无污染 无污染 K 14.56%±0.44%ab 10.52%±0.01%d 中风险 中风险 1.03%±0.00%a 0.36%±0.01%b 低风险 无风险 0.18±0.00ab 0.13±0.00d 无污染 无污染 注:同列数据后不同小写字母表示差异显著(P<0.05)。 -
[1] 翟明国, 胡波. 矿产资源国家安全、国际争夺与国家战略之思考[J]. 地球科学与环境学报, 2021, 43(1): 1-11. [2] 张照志, 潘昭帅, 李厚民, 等. 中国矿产资源国情调查评价历史回顾及对推动国民经济发展的作用[J]. 地质与勘探, 2023, 59(1): 188-210. doi: 10.12134/j.dzykt.2023.01.016 [3] ZHANG J W, ZHANG J L, DENG Y R, et al. Quantitative evaluation of ecological and environmental impacts caused by future mining[J]. Ore Geology Reviews, 2023, 162: 105672. doi: 10.1016/j.oregeorev.2023.105672 [4] GITARI W M, THOBAKGALE R, AKINYEMI S A. Mobility and attenuation dynamics of potentially toxic chemical species at an abandoned copper mine tailings dump[J]. Minerals, 2018, 8(2): 64. doi: 10.3390/min8020064 [5] 潘峰岗. 浅谈铜矿开采中常见的选矿工艺及其发展趋势[J]. 中国金属通报, 2019(5): 39-40. doi: 10.3969/j.issn.1672-1667.2019.05.026 [6] SHI Y F, ZANG Y F, YANG H H, et al. Biochar enhanced phytostabilization of heavy metal contaminated mine tailings: A review[J]. Frontiers in Environmental Science, 2022, 10: 13. [7] 安如意, 王辉, 李晟洲, 等. “双碳”背景下铁尾矿库生态修复技术方向与策略[J]. 有色金属(矿山部分), 2022, 74(6): 82-91. [8] 吴子剑, 陈明利, 付新喜, 等. 锰尾矿区有机菌肥-速生树种的生态修复效应[J]. 中国环境科学, 2019, 39(12): 5219-5227. [9] 曾瑞垠, 祝新友, 张雄, 等. 海相砂岩型铜矿研究进展及若干问题—以中非加丹加铜矿和云南东川铜矿对比研究为例[J]. 地质通报, 2020, 39(10): 1608-1624. doi: 10.12097/j.issn.1671-2552.2020.10.012 [10] 吴俭. 酒石酸等5种有机酸对镉锌、镉镍污染土壤清洗效果与影响因素研究[D]. 广州: 华南理工大学, 2015. [11] 林益超. 高海拔铜矿区尾矿土壤化及生态修复先锋植物筛选研究[D]. 昆明: 昆明理工大学, 2023. [12] 吴少杰, 黑笑涵. 测定植物样品重金属含量的火焰原子吸收法[J]. 实验科学与技术, 2009, 7(4): 25-26+125. [13] MSIMBIRA L A, SMITH D L. The roles of plant growth promoting microbes in enhancing plant tolerance to acidity and alkalinity stresses[J]. Frontiers in Sustainable Food Systems, 2020, 4: 106. doi: 10.3389/fsufs.2020.00106 [14] PENN C J, CAMBERATO J J. A critical review on soil chemical processes that control how soil pH affects phosphorus availability to plants[J]. Agriculture-Basel, 2019, 9(6): 120. doi: 10.3390/agriculture9060120 [15] HUANG L H, LIU X, WANG Z C, et al. Interactive effects of pH, EC and nitrogen on yields and nutrient absorption of rice (Oryza sativa L. )[J]. Agricultural Water Management, 2017, 194: 48-57. doi: 10.1016/j.agwat.2017.08.012 [16] LAWRENCE C, HARDEN J, MAHER K. Modeling the influence of organic acids on soil weathering[J]. Geochimica Et Cosmochimica Acta, 2014, 139: 487-507. doi: 10.1016/j.gca.2014.05.003 [17] TSAI H H, SCHMIDT W. The enigma of environmental pH sensing in plants[J]. Nature Plants, 2021, 7(2): 106-115. doi: 10.1038/s41477-020-00831-8 [18] 肖扬, 黄立华, 杨易, 等. 长期不同培肥对苏打盐碱地稻田土壤盐碱指标和养分含量的影响[J]. 农业资源与环境学报, 2023, 40(1): 126-134. [19] 李思邈, 庞佳音, 方香玲. 氮磷钾营养影响植物根部病害的研究进展[J]. 植物生理学报, 2023, 59(11): 2011-2017. [20] KONG X S, JIA Y Y, SONG F Q, et al. Insight into litter decomposition driven by nutrient demands of symbiosis system through the hypha bridge of arbuscular mycorrhizal fungi[J]. Environmental Science and Pollution Research, 2018, 25(6): 5369-5378. doi: 10.1007/s11356-017-0877-2 [21] 王伟, 李佳, 刘金淑, 等. 硅酸盐细菌菌株的分离及其解钾解硅活性初探[J]. 安徽农业科学, 2009, 37(17): 7889-7891. doi: 10.3969/j.issn.0517-6611.2009.17.033 [22] LI S, WU J L, HUO Y L, et al. Profiling multiple heavy metal contamination and bacterial communities surrounding an iron tailing pond in northwest China[J]. Science of the Total Environment, 2021, 752: 141827. doi: 10.1016/j.scitotenv.2020.141827 [23] YAASHIKAA P R, KUMAR P S, JEEVANANTHAM S, et al. A review on bioremediation approach for heavy metal detoxification and accumulation in plants[J]. Environmental Pollution, 2022, 301: 119035. doi: 10.1016/j.envpol.2022.119035 [24] ASEMOLOYE M D, CHKWUKA K S, JONATHAN S G. Spent mushroom compost enhances plant response and phytoremediation of heavy metal polluted soil[J]. Journal of Plant Nutrition and Soil Science, 2020, 183(4): 492-499. doi: 10.1002/jpln.202000044 [25] CAI B, CHEN Y H, DU L, et al. Spent mushroom compost and calcium carbonate modification enhances phytoremediation potential of Macleaya cordata to lead-zinc mine tailings[J]. Journal of Environmental Management, 2021, 294: 113029. doi: 10.1016/j.jenvman.2021.113029 [26] 胡丰青, 颜蒙蒙, 王济, 等. 土壤重金属有效态和生物碳关系研究进展及展望[J]. 贵州师范大学学报(自然科学版), 2016, 34(4): 116-120. [27] 陶荣浩. 有机酸和氯化钙强化玉米修复镉铅污染农田效果研究[D]. 合肥: 安徽农业大学, 2023. [28] CHEN J R, SHAFI M, WANG Y, et al. Organic acid compounds in root exudation of moso bamboo (Phyllostachys pubescens) and its bioactivity as affected by heavy metals[J]. Environmental Science and Pollution Research, 2016, 23(20): 20977-20984. [29] DONG X, DAI M, YANG T, et al. Mechanism of interaction between ascorbic acid and soil iron-containing minerals for peroxydisulfate activation and organophosphorus flame retardant degradation[J]. Environmental research, 2023, 244: 117883. [30] WU S H, TURSENJAN D, SUN Y B. Impact of compost methods on humification and heavy metal passivation during chicken manure composting[J]. Journal of Environmental Management, 2023, 325: 116573. doi: 10.1016/j.jenvman.2022.116573 [31] 刘凡, 谭文峰, 刘桂秋, 等. 几种土壤中铁锰结核的重金属离子吸附与锰矿物类型[J]. 土壤学报, 2002(5): 699-706. doi: 10.3321/j.issn:0564-3929.2002.05.012 [32] GASPARATOS D. Sequestration of heavy metals from soil with Fe-Mn concretions and nodules[J]. Environmental Chemistry Letters, 2013, 11(1): 1-9. doi: 10.1007/s10311-012-0386-y [33] 许梦雅, 张超, 单保庆, 等. 白洋淀不同类型水体表层沉积物重金属的赋存形态及风险[J]. 环境科学, 2022, 43(9): 4532-4542. [34] 张维, 傅开彬, 王磊, 等. 四川某铜矿选冶渣综合理化特性及环境污染特性评价[J]. 环境化学, 2023, 43(2): 1-12. [35] 李中兴, 任珺, 周怡蕾, 等. 酸改性凹凸棒石对土壤Cu-Zn的钝化修复[J]. 环境工程学报, 2022, 16(10): 3381-3391. doi: 10.12030/j.cjee.202201017 期刊类型引用(2)
1. 毛舜羽,王荣华,王慧,覃岚倩,许丹丹,丁彦礼,白少元. 人工湿地结构对农业面源污染中阿特拉津净化性能的影响. 环境工程学报. 2024(12): 3507-3516 .  百度学术
百度学术
2. 白馨雨,谭欣,王凯,刘思琪,董鑫,孙冬梅. 微生物修复阿特拉津污染的研究进展. 现代农业科技. 2023(17): 149-154 .  百度学术
百度学术
其他类型引用(3)
-






 下载:
下载: