-
早在20世纪,硝酸盐污染就已成为国际上普遍关注的问题,硝酸盐污染主要来源于大气沉降、土壤中化肥农药的大量使用、生产生活中排放的污水及生物的代谢废物等,其特点主要有稳定性高、溶解性高和易迁移[1]。特别是对于以地下水为主要饮用水源的国家和地区来说,该问题还突出表现为对人体健康的潜在威胁,根据国际流行病学研究,饮用水中高水平的硝酸盐除了具有婴幼儿高铁血红蛋白症的急性风险,还可能会增加人体内致癌化学物质的形成。新西兰的一项关于饮用水中硝酸盐污染程度的研究认为,3.26%的结直肠癌可归因于硝酸盐,导致了100例确诊病例和41例死亡病例[2]。为此,世界卫生组织(WHO)以及各国均制定了水中硝酸盐(以N计,下同)的浓度标准,如欧盟规定了饮用水中硝酸盐的质量浓度应少于11.3 mg·L−1,WHO、美国、日本、加拿大规定了硝酸盐的最高限值为10 mg·L−1,我国最新修订的《生活饮用水卫生标准》(GB 5749-2022) 中也规定了饮用水中硝酸盐的限值为10 mg·L−1。
当前,我国北方的地下水中硝酸盐超标情况不容乐观。一项关于北京市潮白河中上游地区地下水中硝酸盐含量的研究[3]表明,267个水样中硝酸盐氮超标率达到28.84%,平均质量浓度为15.89 mg·L−1,最高值为65.5 mg·L−1。有学者对青岛市农区地下水的检测发现约28.57%的地下水样品严重超标,85.71%超过了WHO规定的标准[4]。内蒙古的一项研究[5]表明,该研究区地下水中硝酸盐质量浓度在0.8~109.57 mg·L−1,平均为23.57 mg·L−1,且该地区地下水的非致癌性慢性毒性影响中约有10%的儿童超出其能够接受的健康风险。
目前去除水中的硝酸盐的方法包括物理法如离子交换法[6]、反渗透法[7]、生物反硝化[8]和化学法[9]。近年来,高级还原技术表现出了良好的发展潜力和应用前景,其原理是通过催化剂或紫外光等活化手段,使得还原剂产生具有强还原能力的自由基,能够将水中具有氧化性的污染物还原去除。目前已有多种可以去除硝酸盐的高级还原体系被提出,如产生水合电子(eaq−)的UV/亚硫酸盐体系[10]、产生二氧化碳自由基(·CO2−)的UV/甲酸体系[11-13]和UV/过氧化氢/甲酸盐体系[11]等。
·CO2−是一种强还原性物质,氧化还原电位为E0=-1.9 V[14],其来源大多为含有羧基基团的简单有机物或有机盐,通过加热或紫外照射等方式活化产生。常见的产生方法是将氧化剂过硫酸盐与甲酸耦合[15],但该方法会引入硫元素,存在二次污染的风险,因此,在选择·CO2−的活化底物时应考虑其清洁性和安全性,同时有广泛的获取途径。
乙酸钠作为一种含有羧基基团的小分子有机酸盐,无毒无害,价格低廉,是污水处理厂最常用的碳源之一。为此,本研究提出一种利用乙酸钠作为产生·CO2−的前体物,在紫外光的照射下还原水中硝态氮的方法,考察了乙酸钠投加浓度、初始pH、Cl−浓度、SO42−浓度、HCO3−浓度、溶解性有机物浓度、光照强度对该体系还原效能的影响,并通过ESR对反应中所产生的自由基种类进行了鉴定,且进一步推测反应机理,以期为水体中硝酸盐高效快速去除提供一种方法参考。
-
硝酸钾(KNO3,分析纯,99%,国药集团化学试剂有限公司)、乙酸钠(CH3COONa,分析纯,99%,国药集团化学试剂有限公司)、5,5-二甲基-1-吡咯啉-N-氧化物(C6H11NO,DMPO,97%,上海阿拉丁生化科技股份有限公司),甲基紫精(C12H14Cl2N2·xH2O,99%,上海阿拉丁生化科技股份有限公司),碳酸氢钠(NaHCO3)、氯化钠(NaCl)、氢氧化钠(NaOH)等试剂均为分析纯,实验用水为去离子水(舒活泉,YK-RO-B-15L)。
-
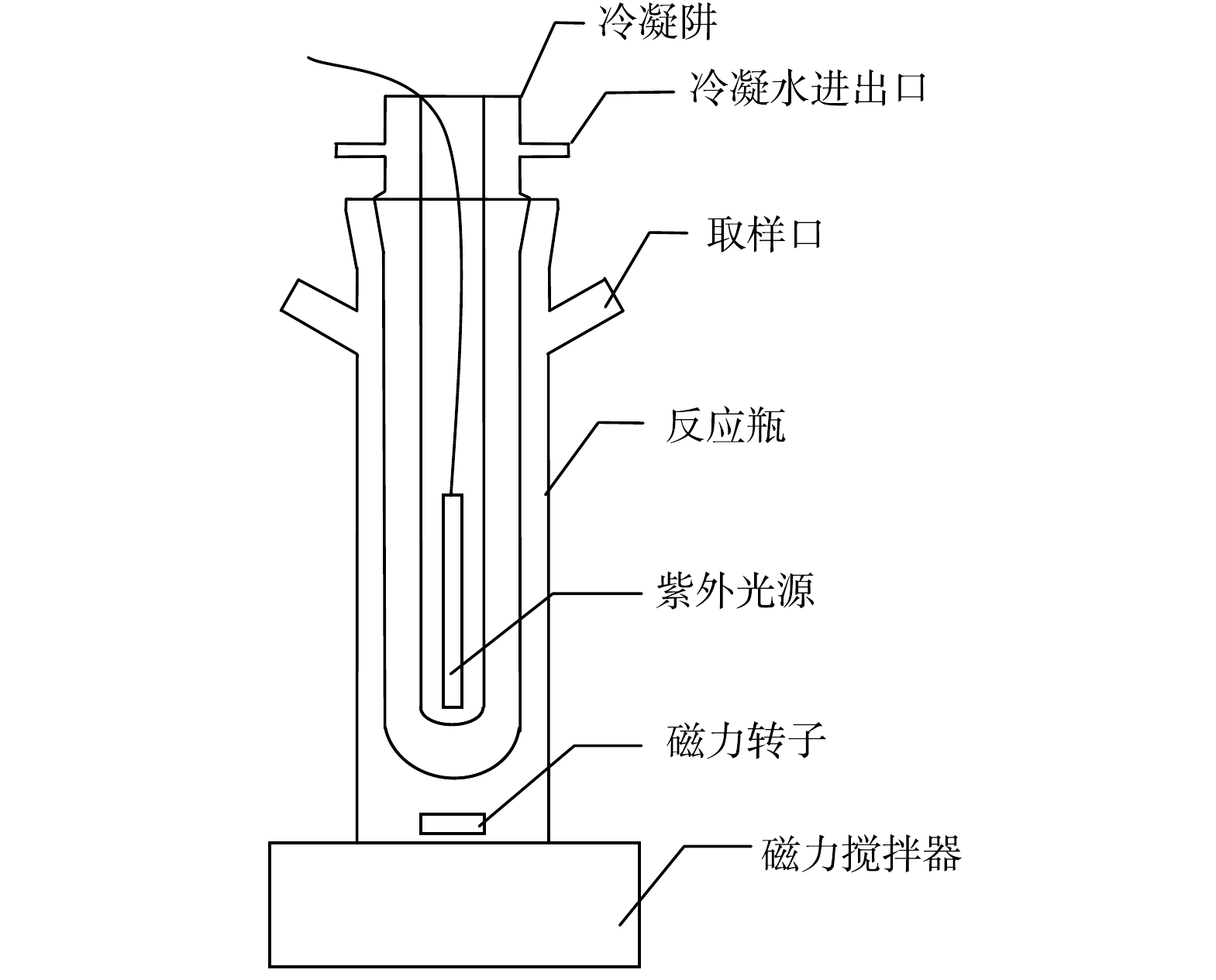
实验装置采用定制的内照式高纯石英反应器(V=250 mL),由主辐射波长为365 nm的紫外光源(上海季光特种照明电器厂,GGZ125、GGZ175)、冷凝阱、反应瓶组成,整个反应装置如图1所示。反应瓶中放置冷凝阱,冷凝水在冷凝阱中循环流动。紫外光源置于冷凝阱中心,在实验开始前需预热15 min以保证能量能够稳定输出。
采用硝酸钾和去离子水配制为质量浓度为16 mg·L−1的NO3−溶液(以N计),与一定量乙酸钠溶液均匀混合,根据实验需要加入一定量磷酸或氢氧化钠调节溶液的pH,并用pH计(上海雷磁,PHS-3G)测定,将混合液转移到石英反应器中,开启磁力搅拌器(上海梅颖浦仪器仪表制造有限公司,H01-1A),调节转速为300 r·min−1,并打开冷凝水开关,使混合液在紫外光照射下进行反应。光照总时间120 min,每隔20 min取样一次。所有实验均为3次重复实验。
-
NO3−-N,NO2−-N,NH4+-N,TN质量浓度的测定采用多参数水质测定仪 (北京连华永兴科技发展有限公司,LH-3BA(V12)),所依据的测定方法分别是《水质 硝酸盐氮的测定 变色酸分光光度法》(F-HZ-HJ-DQ-123)、《水质 亚硝酸盐氮的测定 分光光度法》(GB 7493-87)、《水质 氨氮的测定 纳氏试剂分光光度法》(HJ 535-2009)、《水质 总氮的测定 碱性过硫酸钾消解紫外分光光度法》(HJ 636-2012)。
由于本反应体系中不存在有机氮,TN以3种无机氮的质量浓度之和表达,计算方法如式(1)所示。
式中:c(TN)为反应时间为t时总氮的质量浓度,mg·L−1;c(NO3−)为反应时间为t时硝态氮的质量浓度,mg·L−1;c(NO2−)为反应时间为t时亚硝态氮的质量浓度,mg·L−1;c(NH4+)为反应时间为t时氨氮的质量浓度,mg·L−1。
本研究通过反应体系的NO3−还原去除率和TN去除率共同表达反应体系的效能。NO3−去除率(R)和TN去除率(RTN)的计算式如式(2)和式(3)所示。
式中:c0(NO3−)为硝态氮的初始质量浓度,mg·L−1;c0(TN)为总氮的初始质量浓度,mg·L−1。
采用Bruker ESR 5000电子顺磁共振波谱仪对自由基进行原位检测,以DMPO为自由基捕获剂,使用毛细管吸取一定量的反应溶液与DMPO混合,放入ESR的检测腔内,使用紫外光灯进行原位照射,调节ESR工作参数以获得本次反应的ESR图谱,ESR的工作参数为扫描范围330~340 mT、扫场时间60 s、调制振幅0.1 mT、调制频率100 kHz、微波功率10 mW。通过与不同自由基的标准图谱进行对照从而确定参与反应的自由基类型。
-
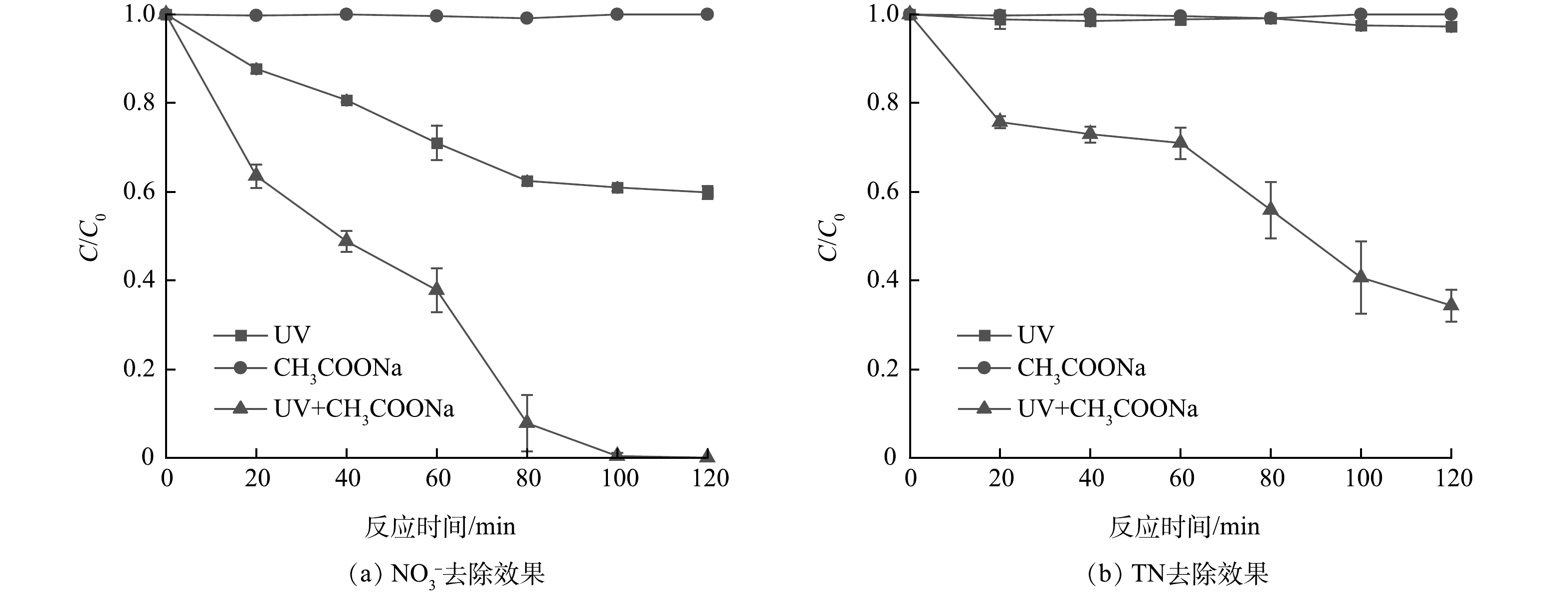
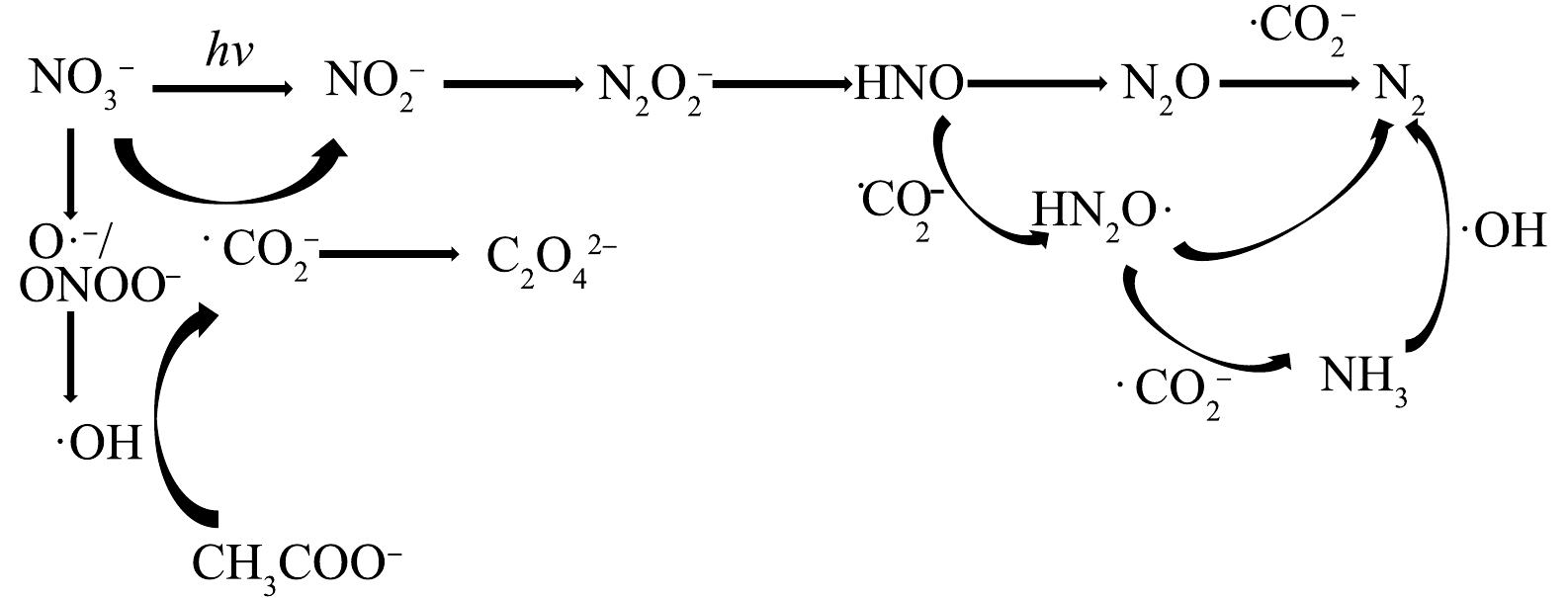
前人研究中选择的NO3−初始质量浓度与实际相比通常较高[11,13,16],本研究依据北京市潮白河中上游地区地下水中硝酸盐平均污染水平[3],取NO3−初始质量浓度为16 mg·L−1。其他实验条件设置为,乙酸钠初始浓度为5 mmol·L−1,紫外光光源采用主波长为365 nm、功率为125 W的高压汞灯,反应时间为120 min。对比了单独UV、单独乙酸钠、UV/乙酸钠体系对NO3−的还原效果及对TN的去除效果,如图2所示。结果表明,单独UV体系可以去除约40%的NO3−,TN去除率可以忽略不计,可见NO3−部分转化为其他无机氮,几乎没有含氮气体生成。相关研究[17]表明,在紫外光波长大于280 nm时NO3−会在紫外照射下产生不稳定的激发态,进而转化为NO2− (式(4)~(5))。NO3−和TN在单独乙酸钠体系中均没有去除效果,而在UV/乙酸钠体系中降解效能得到了显著提升,在100 min内可以将16 mg·L−1的NO3−全部去除,在120 min反应结束时,TN去除率达到67.77%,说明UV/乙酸钠体系具备有效去除水中硝态氮的能力。以往研究[17]表明,该类体系产生·CO2−通常是关键,而含羧基基团的有机物是产生·CO2−的物质基础。乙酸钠中同样具备羧基结构,因此,可推断UV/乙酸钠体系具有较强还原能力的原因可能是其中产生了·CO2−。
-
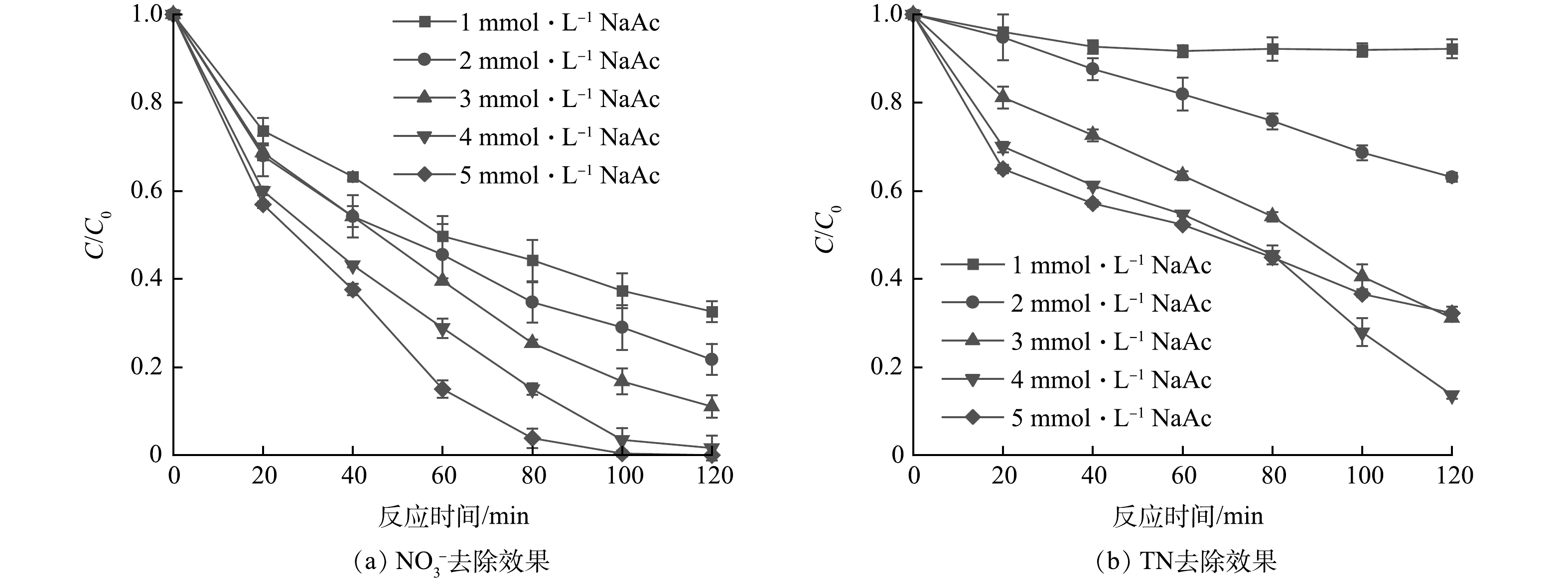
受制于反应器的类型和反应条件,各反应物的比例往往高于理论值,而存在一个最佳的比例或范围。参考前人研究中的最佳药品投加比例[11,12,16],针对初始质量浓度为16 mg·L−1的NO3−,选取乙酸钠初始浓度梯度为1、2、3、4、5 mmol·L−1,结果如图3所示。当乙酸钠浓度由1 mmol·L−1上升到5 mmol·L−1时,NO3−的去除率逐步上升,反应120 min时NO3−的去除率由67.4%上升至100%,这说明随着乙酸钠浓度的提高,·CO2−的生成量增多,反应体系的还原能力也相应提高。然而TN去除率呈先上升后下降的趋势,在乙酸钠投加量为4 mmol·L−1时,TN去除率最高达到86.4%。CHEN等[13]通过实验及模型计算等手段量化了基于·CO2−的脱氮过程,NO3−在紫外光照射和甲酸盐存在的条件下分解为多种含氮中间体,最终还原产物为气体如N2O、N2(式(6)~(14))。
许贻乔等[18]在紫外/甲酸盐体系的研究中发现若体系中还原能力过剩,可能无法将反应控制在转化为气体的步骤,而是进一步还原为NH4+残留在溶液中,从而导致TN的去除效果不理想(式(13),式(15)~(18)),同时,也可能发生·CO2−重组,造成自由基的淬灭(式(19))。因此,控制反应体系的还原能力对NO3−和TN的高效去除至关重要,这也解释了本实验中4 mmol·L−1乙酸钠投加量的TN去除率高于5 mmol·L−1乙酸钠投加量的原因。本实验中,虽然当乙酸钠的投加量为4 和5 mmol·L−1时,NO3−的去除率均可达到98.39%以上,但考虑到TN去除率,选择4 mmol·L−1作为乙酸钠的最佳投加量进行后续实验。
-
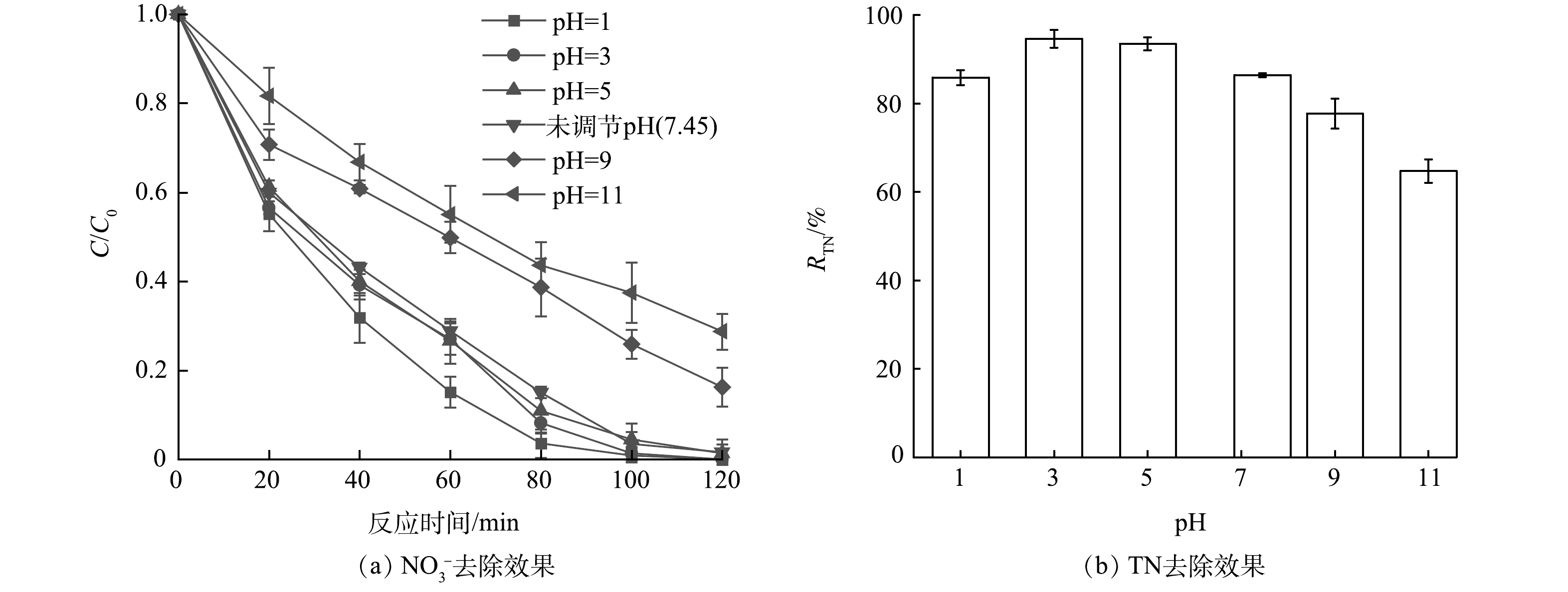
1)初始pH影响。配制NO3−初始质量浓度为16 mg·L−1和乙酸钠初始浓度为4 mmol·L−1的混合液,测定未调节溶液的pH约为7.45,采用磷酸溶液和氢氧化钠溶液调节混合液的初始pH,使其分别为pH=1.0、3.0、5.0、9.0、11.0,在紫外照射120 min后考察NO3−和TN去除率的变化,结果如图4所示。不调节初始pH(pH约为7.45)时NO3−的去除率即可达到98.39%,说明UV/乙酸钠体系的反应条件温和;该还原体系在酸性条件下不受影响,但在碱性环境下不利于NO3−的还原进程,这可能是由于将NO3−转化为其他含氮化合物需要消耗一定量的H+(式(20)~(21))。
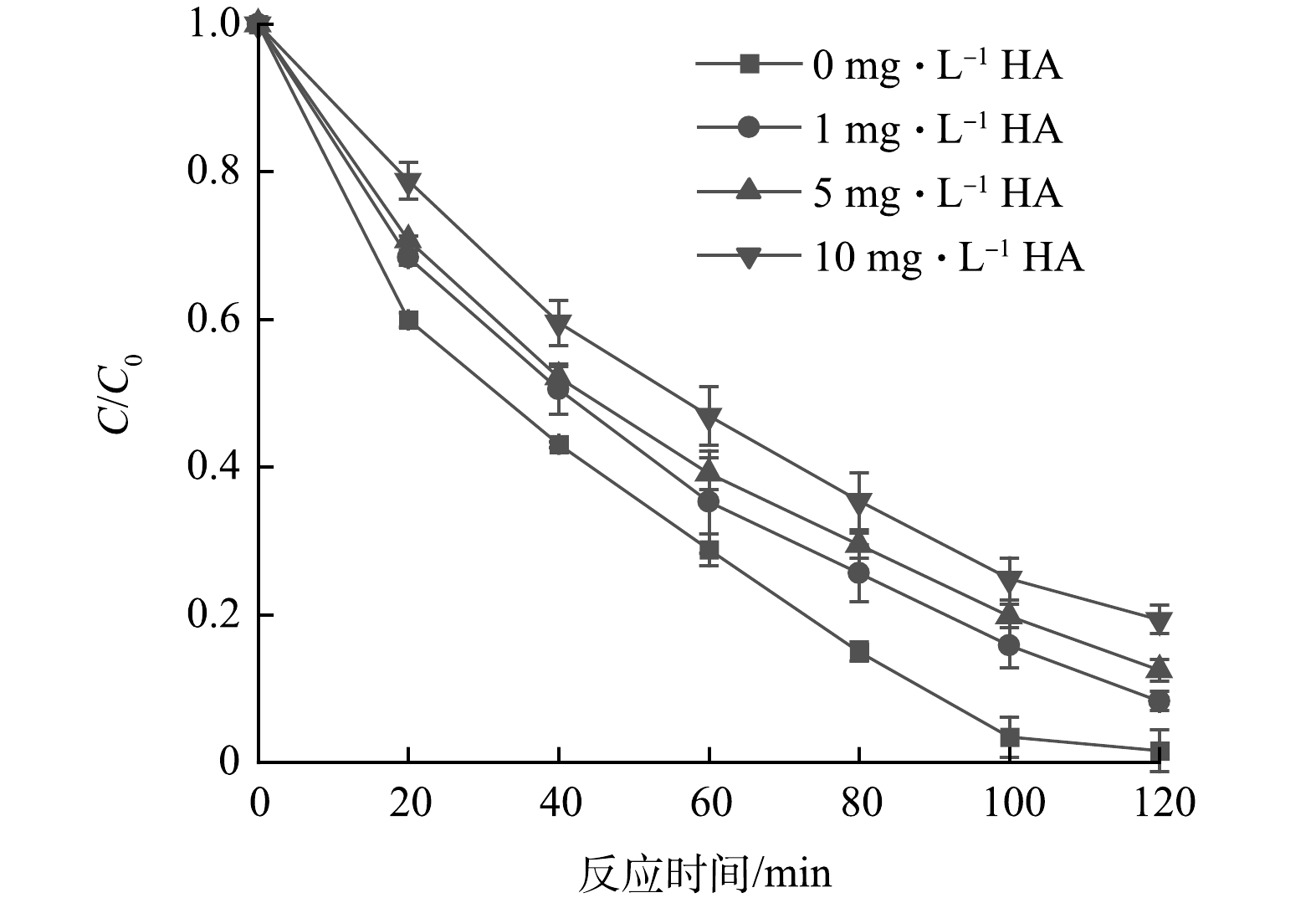
2)溶解性有机物的影响。溶解性有机物(dissolved organic matter, DOM) 是各种天然水体中有机质最重要的赋存形式,其中,腐殖酸(humic acid, HA)是水体中DOM的重要组成部分。选取HA作为DOM的代表物,根据ZHENG等[19]于北京密怀顺潮白河流域分别采集的再生水回补区及南水北调水回补区的地表水和地下水中DOM质量浓度范围,设置质量浓度梯度为1、5、10 mg·L−1,考察其对UV/乙酸钠体系对NO3−还原效果的影响,结果如图5所示。HA的加入会影响反应体系的还原能力,且HA的质量浓度越高,抑制效果越明显。究其原因,一方面可能由于HA本身具有一定的氧化性,可以起到清除还原性自由基的作用[20],在紫外光的照射下,DOM可产生活性氧(ROS),包括具有强氧化性的单线氧(1O2)、羟基自由基(·OH)、过氧化氢(H2O2)等活性物质[21],导致体系中的还原能力不足;另一方面可能是由于HA所带来的光屏蔽效应,不利于紫外光在溶液中的传播。
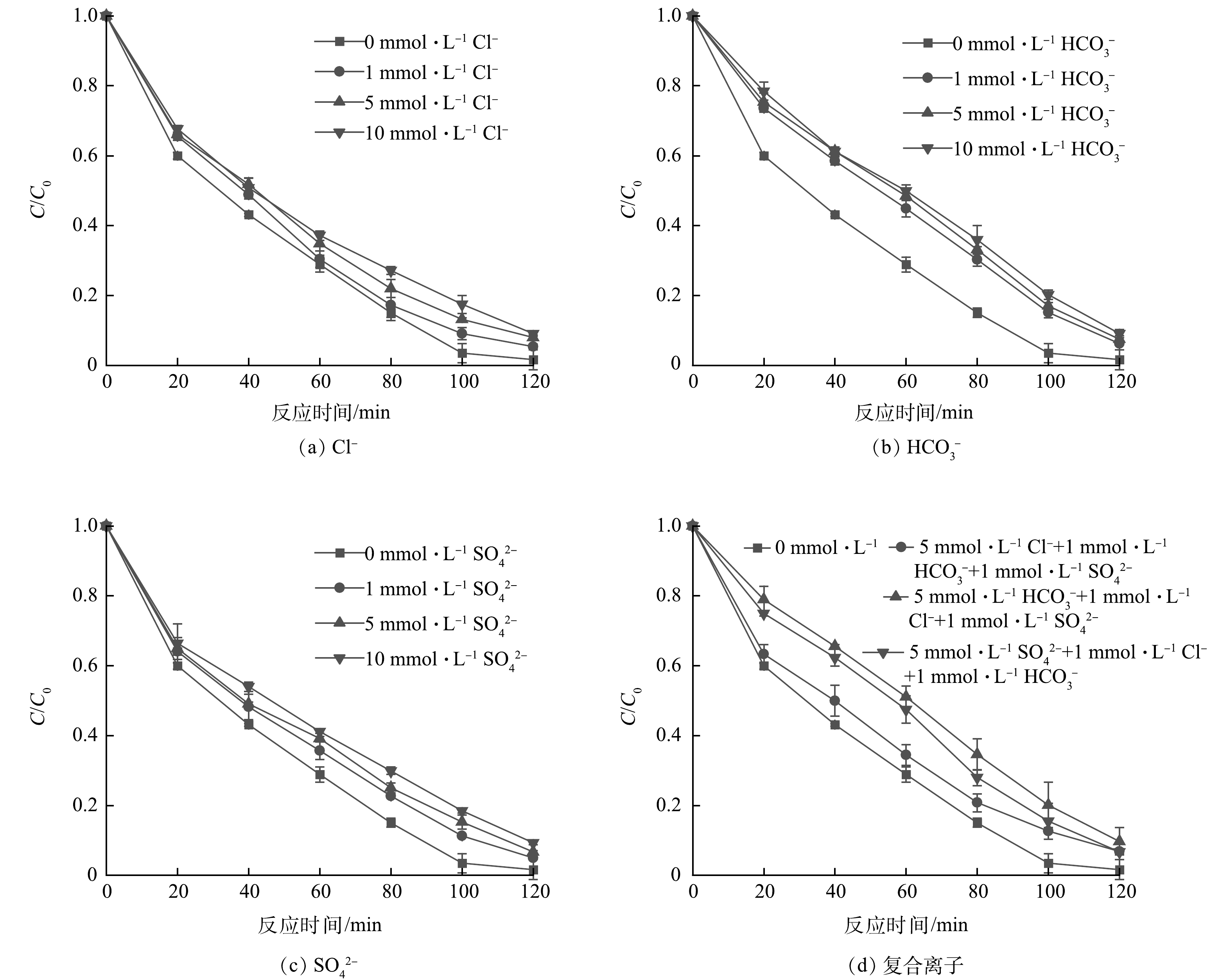
3)水中常见无机离子的影响。天然水体中通常存在Cl−、HCO3−、SO42−等无机离子,有相关研究对潮白河周边水体特征进行了考察,发现不同种类水体的离子变异系数较大[22],因此,分别设置1、5、10 mmol·L−1的浓度梯度,考察这些离子对UV/乙酸钠还原体系去除硝态氮的影响。
天然淡水中氯离子含量较低,其来源主要为水源流经含氯化物的地层时所带入,或受到生活污水、工业废水等的污染。不同浓度的氯离子对UV/乙酸钠体系的影响如图6(a)所示。结果表明,加入Cl−对反应中NO3−的还原效果起到一定的抑制作用,推测其原因可能为Cl−在紫外光照射下会生成含氯的氧化性物质[15,23]。
大部分地区地下水源水和地表水源水离子组成比例相近,HCO3−为主要的阴离子之一,维持水体pH稳定具有重要的意义。天然水的pH一般为6.5~8.5,水体中的碳酸化合物主要以碳酸氢盐的形式存在[24] 。在UV/乙酸钠体系中,碳酸氢根离子对NO3−的还原的影响实验结果如图6(b)所示。结果表明,HCO3−的投加对NO3−的还原速率起到一定减缓作用,这是由于加入HCO3−能够使得反应体系中的pH升高,而上述实验表明UV/乙酸钠体系在偏碱性的环境中还原能力不如在酸性环境中理想。另外,也有研究[25]表明,HCO3−能够消耗·CO2−,既能够与NO3−竞争·CO2−,又会生成氧化性的碳酸根自由基(·CO3−)(式(22)、(23))。
水中硫酸盐主要来源于矿物地层及有机质,含水硫酸钙为水中硫酸盐的主要成分。向UV/乙酸钠体系中加入不同浓度的硫酸根离子对NO3−的还原效果如图6(c)所示。SO42−的加入一定程度上抑制了对反应体系的还原能力,在SO42−浓度由1 mmol·L−1上升到10 mmol·L−1时,NO3−的降解率由95.1%降至90.67%。这是由于SO42−在紫外辐射下能够发生式(24)的反应,转化为强氧化性的硫酸根自由基(SO4·−)[26],因此影响了反应体系的对NO3−的还原。
由于地质、地貌、气候和水文等自然条件上的差异,导致了不同水体的化学性质的多种多样性。各水体组成成分复杂,多种离子及化合物广泛存在,图6(d)为探究不同浓度的氯离子、碳酸氢根离子及硫酸根离子共存对NO3−的还原的影响。水中共存的复合离子同样抑制了NO3−的还原,其中以氯离子为主的复合离子体系对于UV/乙酸钠体系的还原效果影响相对较小,而以碳酸氢根离子为主的复合离子体系抑制作用最明显,反应120 min时NO3−的还原率降低到90.28%。
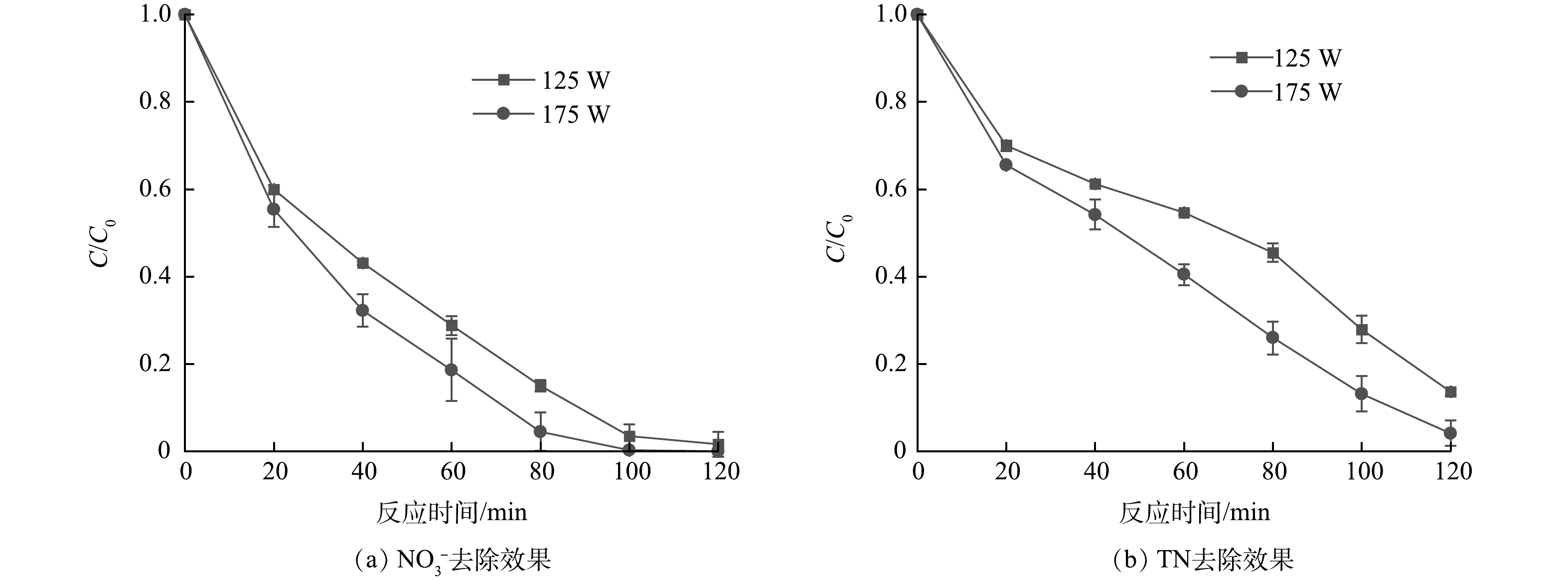
4)光源强度的影响。为考察不同的光照强度对UV/乙酸钠体系还原NO3−效果的影响,使用125 W和175 W高压汞灯为光源,结果如图7所示。随着紫外光源功率的上升,NO3−去除速率逐渐加快,当功率为175 W时,100 min即可去除所有的NO3−,同时TN去除率也提高到了87.6%。这是因为紫外光强度增大,单位时间内产生的·CO2−数量上升,从而可缩短NO3−还原反应的时间。
-
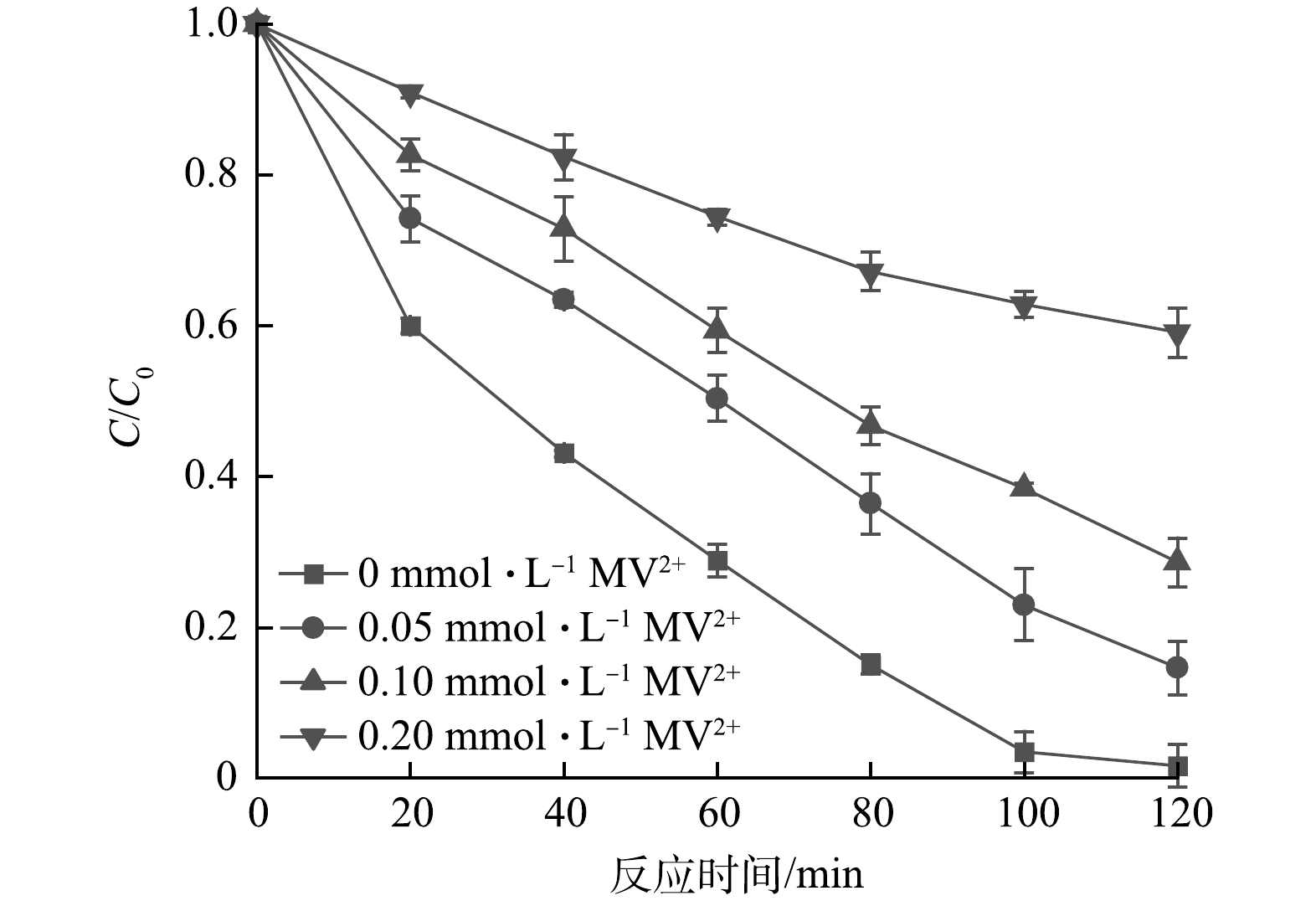
1)自由基淬灭实验。自由基淬灭剂能够与特定自由基发生反应,从而减少反应体系中该自由基的数量,因此,常被用来确定反应中起主要作用的自由基种类,选取甲基紫精(MV2+)作为·CO2−的淬灭剂[27](式(25))。通过与空白实验组对比,考察·CO2−在反应体系内的作用。投加不同浓度的MV2+后,反应体系对于NO3−的去除效果得到不同程度的抑制。 由图8可见,MV2+的投加量与反应体系的还原效能呈负相关,当MV2+的投加量从0 mmol·L−1增加到0.2 mmol·L−1时,NO3−的去除率由98.4%降低至40.9%。因此,在UV/乙酸钠体系中,·CO2−为主要的还原性物质。
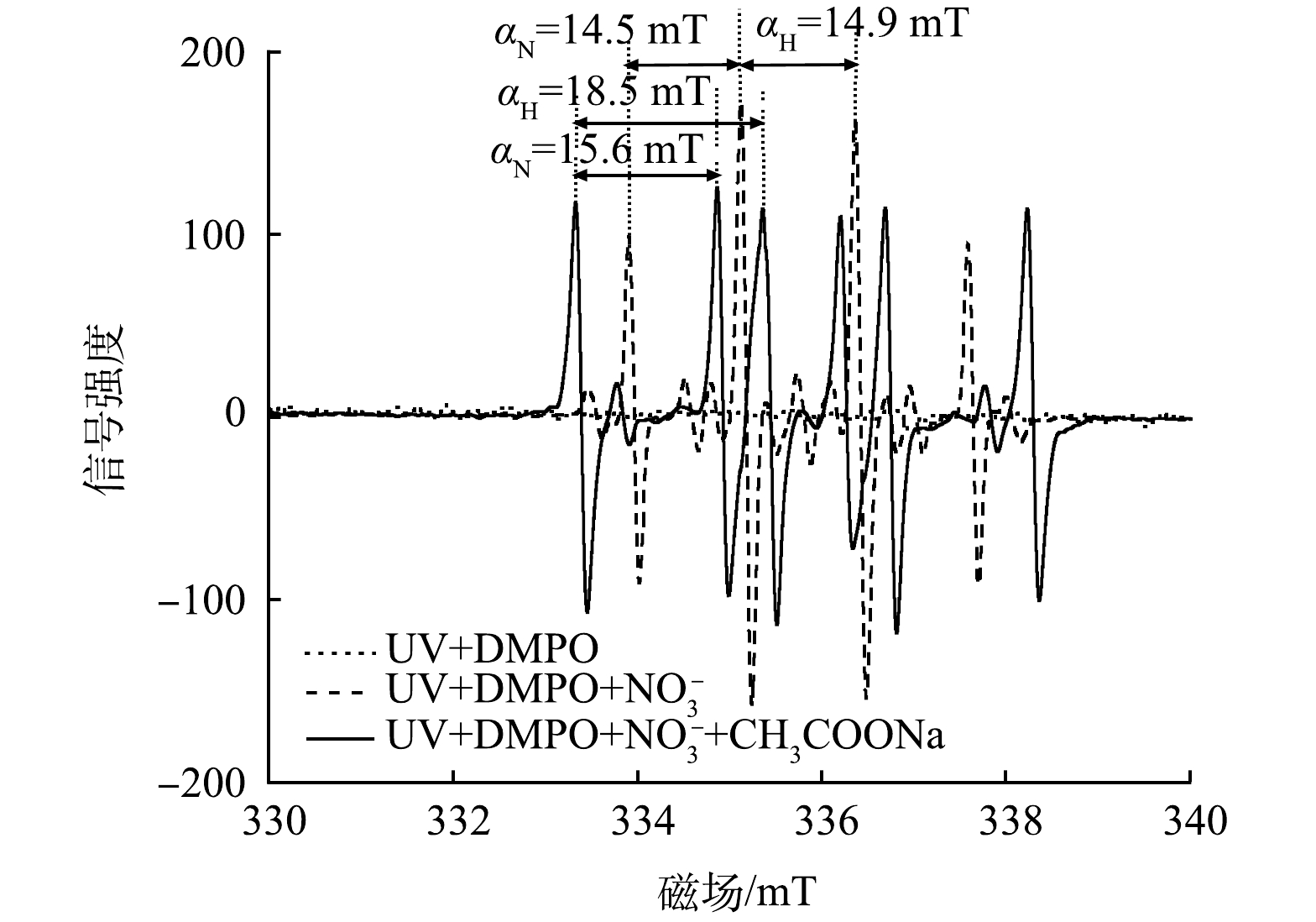
2) ESR自由基测定实验。进一步采用电子顺磁共振波谱仪检测UV/乙酸钠体系所产生的自由基种类,使用DMPO作为自由基捕获剂,可与一些特定自由基发生反应,生成较稳定的化合物,空白实验设为仅有捕获剂存在的情况。由图9可知,使用紫外光单独照射NO3−溶液,ESR谱图显示出了典型的DMPO-·OH加合物的4个特征峰(强度比为1∶2∶2∶1),超精细耦合常数αN=14.5 mT,αH=14.9 mT [28],说明体系中产生了·OH,这可能是由于NO3−在紫外光照条件下自身可以发生光解[13](式(26)~( 30))。
由图9可以确定在上述溶液中加入乙酸钠后有·CO2−的生成,在该谱图中观察到6个等峰信号,超精细耦合常数αN=15.6 mT,αH=18.5 mT,其光谱特征与DMPO-·CO2−加合物的光谱特征一致[29],由于·CO2−是由乙酸钠中的羧基基团转化而来,而单独乙酸钠受紫外光照射还原能力较弱,即除紫外光的能量输入以外,·OH与羧基的反应也起到至关重要的作用,因此,推测在UV/乙酸钠体系中可能存在如式(31)所示的反应。这一推论在甲酸/甲酸盐的相关体系中也有类似报道[11,13,16]。
3)反应产物分析。为进一步探究反应机理,在NO3−初始质量浓度为16 mg·L−1,乙酸钠初始浓度为4 mmol·L−1的反应条件下,测定NO3−-N、NO2−-N、NH4+-N和TN的质量浓度随反应时间的变化情况,测定结果如图10所示。由图10可知,溶液中NO3−和TN质量浓度随反应的进行持续下降,但NO2−和NH4+的质量浓度呈现先上升后下降的趋势。结合氮元素的价态变化及上文自由基的鉴定结果,可以推测出如下反应过程,首先NO3−可直接光解为一系列不稳定的含氮的中间体,最终转化为NO2−,并且 NO3−在紫外光作用下能够产生·OH,主要作用于乙酸钠的羧基基团,从而产生还原性自由基·CO2−,其可用来还原NO3−和NO2−,·CO2−也能够发生重组。NO2−可被·CO2−进一步还原为气体(N2)或NH4+,同时在反应过程中·OH能够将部分NH4+氧化为含氮气体(式(32)~(33))。根据上述实验结果及式(32)~(33),可以推断出UV/乙酸钠体系去除NO3−的可能反应路径(图11)。
-
1)当NO3−初始质量浓度为16 mg·L−1,乙酸钠初始投加量为4 mmol·L−1时,在功率为125 W、主波长为365 nm的紫外光下照射120 min后,NO3−和TN的去除率分别可达到98.4%和86.4%。酸性环境有利于提升UV/乙酸钠反应体系的还原能力,而溶解性有机物和水中常见的无机离子会削弱此体系的还原效能。
2)自由基淬灭实验及ESR鉴定实验结果表明体系中产生了还原性自由基,即·CO2−,其对体系的还原效能起着关键作用。
3) UV/乙酸钠高级还原体系反应条件温和,操作灵活简单,可为高效去除地下水中硝酸盐提供一种新方法。本反应尽管反应速率较快,但由于乙酸钠添加比例高于生物脱氮的比例,需要进一步改进反应器类型,促进反应条件的充分达成,以不断接近或超越生物脱氮的比例。
紫外光/乙酸钠体系去除水体中硝态氮
Nitrate reduction by UV/ sodium acetate system
-
摘要: 通过构建紫外光(UV)/乙酸钠高级还原体系(ARP),产生强还原性的二氧化碳自由基(·CO2−),从而将水中硝酸盐(NO3−)转化为气体溢出。采用电子自旋共振波谱仪(ESR)对反应体系中·CO2−进行了鉴定,并考察了乙酸钠初始投加量、初始pH、水中常见的离子及溶解性有机物对反应体系还原效能的影响。结果表明:在硝酸盐的初始质量浓度(以N计)为16 mg·L−1,乙酸钠投加量为4 mmol·L−1,反应溶液的pH为7.45,采用125 W、365 nm的高压汞灯作为光源时,紫外光/乙酸钠体系对水中硝酸盐和总氮(TN)的去除率分别为98.4%和86.4%。水体的酸性条件和紫外灯高功率有利于提高反应效能,而水中常见的阴离子如氯离子(Cl−)、硫酸根离子(SO42−)、碳酸氢根离子(HCO3−)及溶解性有机物如腐殖酸(HA)会对NO3−的去除效率也有一定影响。Abstract: The ultraviolet light (UV)/sodium acetate advanced reduction process (ARP) system was constructed to produce the carbon dioxide anion radical (·CO2−) with a strong reducing power, which could converted nitrate in water into gas overflow. The production of ·CO2− in the reaction system was confirmed by electron spin resonance (ESR), and the effects of the initial dosage of sodium acetate, initial pH, common ions and dissolved organic matter on the efficiency of reaction were investigated. The results showed that when the initial concentration of nitrate was 16 mg·L−1 and the dosage of sodium acetate was 4 mmol·L−1, the pH of the reaction solution was 7.45, and a 125 W, 365 nm high-pressure mercury lamp was used as the light source, the degradation rates of nitrate and total nitrogen (TN) in the UV/sodium acetate system reached 98.4% and 86.4%, respectively. Acidic conditions and high power of UV lamp were conducive to improving reaction efficiency. Common anions in water such as chloride ion, sulfate ion, bicarbonate ion and dissolved organic matter such as humic acid (HA) had a certain impact on the removal efficiency of nitrate.
-

-
-
[1] ZHANG Q, SUN J, LIU J, et al. Driving mechanism and sources of groundwater nitrate contamination in the rapidly urbanized region of south China[J]. Journal of Contaminant Hydrology, 2015, 182: 221-230. doi: 10.1016/j.jconhyd.2015.09.009 [2] CHAMBERS T, DOUWES J, MANNETJE A, et al. Nitrate in drinking water and cancer risk: The biological mechanism, epidemiological evidence and future research[J]. Australian and New Zealand Journal of Public Health, 2022, 46(2): 105-108. doi: 10.1111/1753-6405.13222 [3] 张洁, 杨庆, 肖寒, 等. 北京典型地区地下水硝酸盐氮污染特征解析[J]. 北京水务, 2022, 47(3): 25-30. [4] 寇馨月, 丁军军, 李玉中, 等. 青岛市农区地下水硝态氮污染来源解析[J]. 环境科学, 2021, 42(7): 3232-3241. [5] FENG W, WANG C, LEI X, et al. Distribution of nitrate content in groundwater and evaluation of potential health risks: A case study of rural areas in Northern China[J]. International Journal of Environmental Research and Public Health, Multidisciplinary Digital Publishing Institute, 2020, 17(24): 9390. [6] 黄俊亮, 刘成, 王胜涛, 等. 离子交换工艺对地表水中硝酸盐的去除效能及应用模式[J]. 给水排水, 2021, 57(11): 12-18. [7] 李洁. 超滤反渗透组合工艺在水厂硝酸盐深度处理中的工程应用[J]. 净水技术, 2021, 40(10): 155-159. [8] 彭彤. 电解强化生物反硝化固定床去除地下水中硝酸盐的研究[D]. 北京: 中国地质大学(北京), 2016. [9] 赵爽, 汪晓军, 杨永愿. 化学法处理低浓度硝酸盐氮废水的试验研究[J]. 工业水处理, 2018, 38(1): 79-82. [10] TAN L, MAO R, SU P, et al. Efficient photochemical denitrification by UV/sulfite system: Mechanism and applications[J]. Journal of Hazardous Materials, 2021, 418: 126448. doi: 10.1016/j.jhazmat.2021.126448 [11] 许贻乔, 吴磊, 郑天怡. 基于紫外光活化甲酸产生二氧化碳自由基的硝态氮还原分析(英文)[J]. Journal of Southeast University(English Edition), 2022, 38(1): 77-84. [12] 郑天怡. 紫外光诱导甲酸还原水体中硝态氮的研究[D]. 南京: 东南大学, 2020. [13] CHEN G, HANUKOVICH S, CHEBEIR M, et al. Nitrate removal via a formate radical-unduced photochemical process[J]. Environmental Science & Technology, American Chemical Society, 2019, 53(1): 316-324. [14] MONTESINOS V N, QUICI N, DESTAILLATS H, et al. Nitric oxide emission during the reductive heterogeneous photocatalysis of aqueous nitrate with TiO2[J]. RSC Advances, 2015, 5(104): 85319-85322. doi: 10.1039/C5RA17914A [15] 秦宝雨, 唐海, 严律, 等. 紫外活化过硫酸盐/甲酸体系还原水中Cr(Ⅵ)机理及影响因素[J]. 环境工程学报, 2019, 13(9): 2121-2129. [16] CHEN J, LIU J, ZHOU J, et al. Reductive removal of nitrate by carbon dioxide radical with high product selectivity to form N2 in a UV/H2O2/HCOOH system[J]. Journal of Water Process Engineering, 2020, 33: 101097. doi: 10.1016/j.jwpe.2019.101097 [17] TUGAOEN H O, GARCIA-SEGURA S, HRISTOVSKI K, et al. Challenges in photocatalytic reduction of nitrate as a water treatment technology[J]. Science of the Total Environment, 2017, 599-600: 1524-1551. doi: 10.1016/j.scitotenv.2017.04.238 [18] 许贻乔. 紫外活化甲酸盐还原地下水硝态氮的应用研究[D]. 南京: 东南大学, 2022. [19] ZENG X, ZHENG Y, CHEN X, et al. Molecular responses of dissolved organic matter to anthropogenic groundwater recharge: Characteristics, transformations, and sensitive molecules[J]. Environmental Science & Technology, American Chemical Society, 2023, 57(20): 7789–7799. [20] HABIBUL N, CHEN W. Structural response of humic acid upon binding with lead: A spectroscopic insight[J]. Science of the Total Environment, 2018, 643: 479-485. doi: 10.1016/j.scitotenv.2018.06.229 [21] 骆媛媛. 渭河流域DOM的光谱学特性及与聚苯乙烯微塑料的交互作用[D]. 杨凌: 西北农林科技大学, 2021. [22] 姜瑞雪, 韩冬梅, 宋献方, 等. 再生水补给河道周边水体特征——以北京潮白河顺义段为例[J]. 资源科学, 2020, 42(12): 2419-2433. doi: 10.18402/resci.2020.12.13 [23] 付伟. 基于紫外活化甲酸技术去除四氯化碳的研究[D]. 北京: 中国地质大学(北京), 2020. [24] 刘成, 徐文蕙, 周卫东, 等. 饮用水中碳酸氢根的意义和控制目标探讨[J]. 净水技术, 2023, 42(8): 1-9. [25] JIANG W, TANG P, LU S, et al. Comparative studies of H2O2/Fe(II)/formic acid, sodium percarbonate/Fe(II)/formic acid and calcium peroxide/Fe(II)/formic acid processes for degradation performance of carbon tetrachloride[J]. Chemical Engineering Journal, 2018, 344: 453-461. doi: 10.1016/j.cej.2018.03.092 [26] 代朝猛, 刘仟, 段艳平, 等. 活化过一硫酸盐技术降解环境有机污染物的研究进展[J]. 环境科学研究, 2022, 35(1): 141-149. [27] DAS T N, GHANTY T K, PAL H. Reactions of methyl viologen dication (MV2+) with H atoms in aqueous solution: Mechanism derived from pulse radiolysis measurements and ab initio MO calculations[J]. Journal of Physical Chemistry A, American Chemical Society, 2003, 107(31): 5998-6006. [28] LI J, MA S, REN K, et al. Studies on the preparation of fly ash-derived Fe-SSZ-13 catalysts and their performance in the catalytic oxidation of NO by H2O2[J]. Molecular Catalysis, 2023, 537: 112920. doi: 10.1016/j.mcat.2023.112920 [29] YANG Q, LIANG X, FU W, et al. Nitrate enhanced the carbon tetrachloride degradation in the UV/HCOOH reductive system[J]. Journal of Environmental Chemical Engineering, 2023, 11(5): 110578. doi: 10.1016/j.jece.2023.110578 -



 下载:
下载: