-
随着我国经济的快速发展和生活水平的不断提高,餐厨垃圾的产量逐年增加。据统计,全球每年产生约1.3×108 t餐厨垃圾,而在中国餐厨垃圾的产量已占城市生活垃圾总量的50%以上,资源回收潜力巨大[1]。另一方面,剩余污泥产量逐年增加和处理效率低下也是亟需解决的问题[2]。厌氧消化是餐厨垃圾和剩余污泥的主要处理方式,同时厌氧工艺会产生大量高浓度有机废水-沼液[3]。消化沼液占厌氧消化产物总量的80%~90%,其具有产量大、营养物质丰富等优点,有极高的经济和环境价值[4]。沼液中含有大量溶解性有机物(dissolved organic matter,DOM),包括不同种类的有机化合物,如碳水化合物、蛋白质和有机酸等[5]。处理不当会通过地表径流排放或地下水渗透污染水体,进而威胁环境和生态系统[6]。DOM的组成和结构特征对于研究厌氧消化过程中许多成分的转化和归宿有重要作用。
DOM是指存在于各类水体中可以通过0.45 μm滤膜的有机质混合体[7],常用的表征技术有紫外可见吸收光谱法[8]、三维荧光光谱法[9]、核磁共振法[10]和傅里叶变换离子回旋共振质谱[11]等,其中三维荧光光谱法具有灵敏度高、无需化学试剂、对样品无破坏等特点[12-13],广泛应用于河流、湖泊、地下水等水体的检测及水质评价等方面研究[14-16]。三维荧光技术已经成功地应用于环境水体中DOM的识别和解析,但是很少用于沼液检测。三维荧光光谱结合数据分析方法如荧光区域积分法(fluorescence regional integration,FRI)、平行因子分析法(parallel factor analysis,PARAFAC)能够实现DOM有机组分的分离和定量。FRI方法可用于对三维荧光光谱重叠对象光谱识别和相对定量表征[17-18]。PARAFAC方法可以实现三维荧光光谱重叠荧光峰的解析,准确识别出荧光峰的个数、位置及最大荧光强度[19]。结合区域积分法与平行因子法,将一定程度上揭示沼液中DOM的类别并显示其变化趋势。
本研究针对沼液处理采用三维荧光光谱技术为表征手段,对加入不同来源物质的餐厨垃圾厌氧消化过程中消化沼液内的DOM进行检测和分析,结合FRI法和PARAFAC法,提取有效的荧光光谱特征,考察沼液中DOM的含量变化并进行综合评估,将为该领域的研究人员深入了解餐厨垃圾厌氧消化过程中DOM的全过程变化提供有用的参考。
-
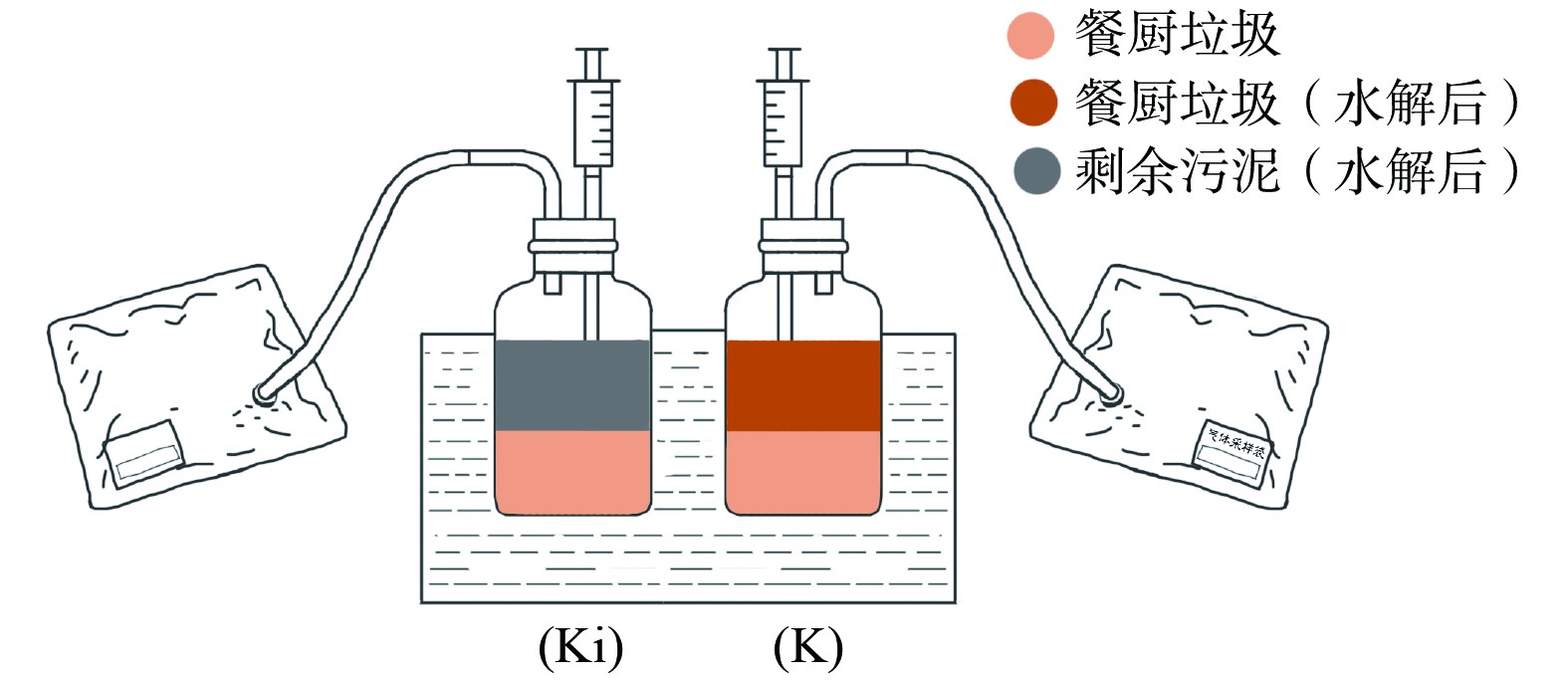
实验装置主要由消化容器、温控装置、采样装置及集气装置组成如图1所示。其中选用500 mL广口瓶作为消化容器,恒温水浴锅(SYG-A2-4,天津市泰斯特仪器有限公司)作为温控装置、500 mL气体采样袋作为集气装置、10 mL注射器作为采样装置。研究采集的外源性物质(剩余污泥)来自于北京某污水处理厂MBR池出口,自身源物质(餐厨垃圾)来自本学校学生食堂泔水桶。样品均经前处理后通过2 mm滤网去除大颗粒杂质,其中污泥样品经过沉淀浓缩处理,餐厨样品去除大骨头后等杂物后破碎处理。各取部分样品在压力蒸汽灭菌器(YXQ-LS,上海博讯医疗生物仪器股份有限公司)中热水解30 min(表压0.11 MPa,121 ℃)。消化底物为200 mL餐厨垃圾,以1:1的体积比加入水解后的外源性物质构成厌氧消化Ki组,以相同比例加入水解后的自身源物质构成厌氧消化K组。样品放入消化容器中进行厌氧消化实验,消化容器置于恒温水浴锅进行厌氧消化,实验设置2组平行样,每组测样两次,温度控制为(35±1) ℃。厌氧消化共计33 d,每隔3 d用排水法测量集气袋的总气量(Gas),用注射器吸取沼液并分装置于-20 ℃冰箱保存。
-
本实验所测理化指标以1∶50的比例稀释后测定。乙酸(C2H4O2)测定采用国家标准《环境空气 降水中有机酸(乙酸、甲酸和草酸)的测定 离子色谱法)》(HJ 1004—2018)。COD测定采用国家标准《水质 化学需氧量的测定 重铬酸盐法》(HJ 828—2017)。pH值测定采用国家标准《水质 pH值的测定 玻璃电极法》(GB 6920—1986)。总氮(TN)测定采用国家标准《水质 总氮的测定 碱性过硫酸钾消解紫外分光光度法》(HJ 636—2012)。
-
采用荧光光谱仪(Cary Eclipse,美国安捷伦科技有限公司)测试沼液的三维荧光特征光谱。将沼液以1∶200的比例稀释经0.45 μm滤膜过滤后置于石英比色皿中测试。测试其三维荧光光谱,波长范围选择激发波长(Ex)为200~450 nm,步长为5 nm;发射波长(Em)为250~550 nm,步长为5 nm,狭缝宽度为5 nm,扫描速度2 400 nm·min−1。
1)FRI法。FRI法由CHEN等[20]提出,将激发、发射波长所形成的二维荧光区域分成了5个部分,代表5种不同类型的有机物,如表1所示。用Origin 2023软件计算出特定荧光区域的积分体积,即具有相似性质有机物的累积荧光强度,然后对体积积分进行标准化得到特定荧光区域积分标准体积。
2)PARAFAC法。PARAFAC法是由STEDMON等[21]在主成分分析的基础上对三维荧光光谱峰分离提出平行因子法,由MURPHY等[22]对平行因子算法进行优化改进,并建立在线组分共享对比和基于Matlab软件平台下drEEM三维荧光平行因子工具箱。在MATLAB R2019a软件中使用drEEM-0.6.5工具箱[23]对激发发射矩阵数据进行建模,去除瑞利散射和拉曼散射的干扰后,将模型限制为非负值,使用残差分析和拆半分析对组分数量进行检验,最终确定合适的组分数量[24]。
-
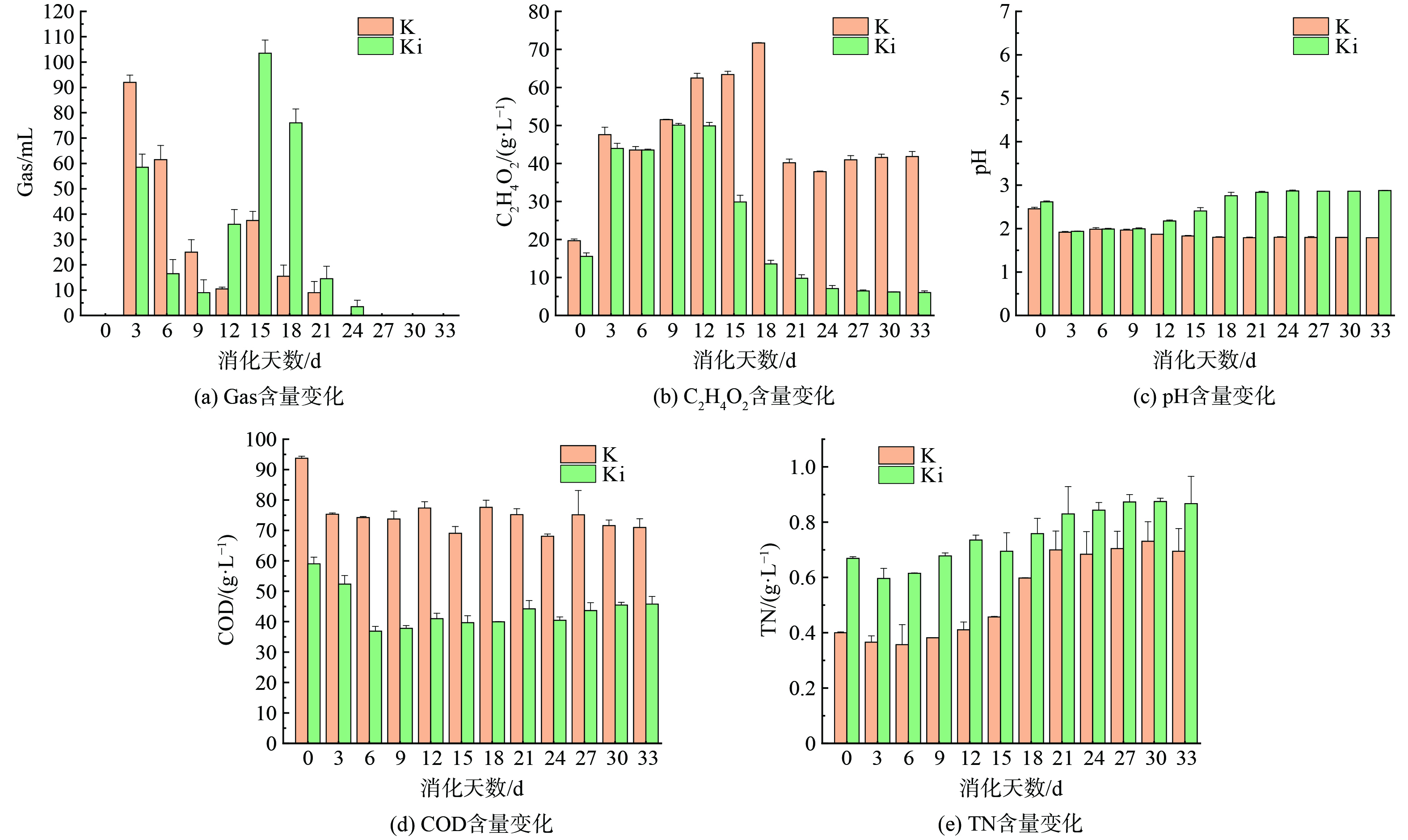
厌氧消化过程中所测得的理化指标变化如图2所示。Gas最大产量K组在第3 d达到最大气量92 mL,Ki组在第15 d达到最大气量103.5 mL。C2H4O2含量随着厌氧消化进程呈现先升高后逐渐降低趋势,其中K组最大含量71.69 g·L−1出现在第18 d,Ki组最大含量50.08 g·L−1出现在第9 d。K组和Ki组厌氧环境均呈现酸性,K组的酸性更强。K组的COD含量显著高于Ki组,K组平均为75.18 g·L−1,Ki组平均为43.86 g·L−1。TN含量K组最大为0.70 g·L−1,Ki组最大为0.88 g·L−1,TN量和Gas量呈负相关。
-
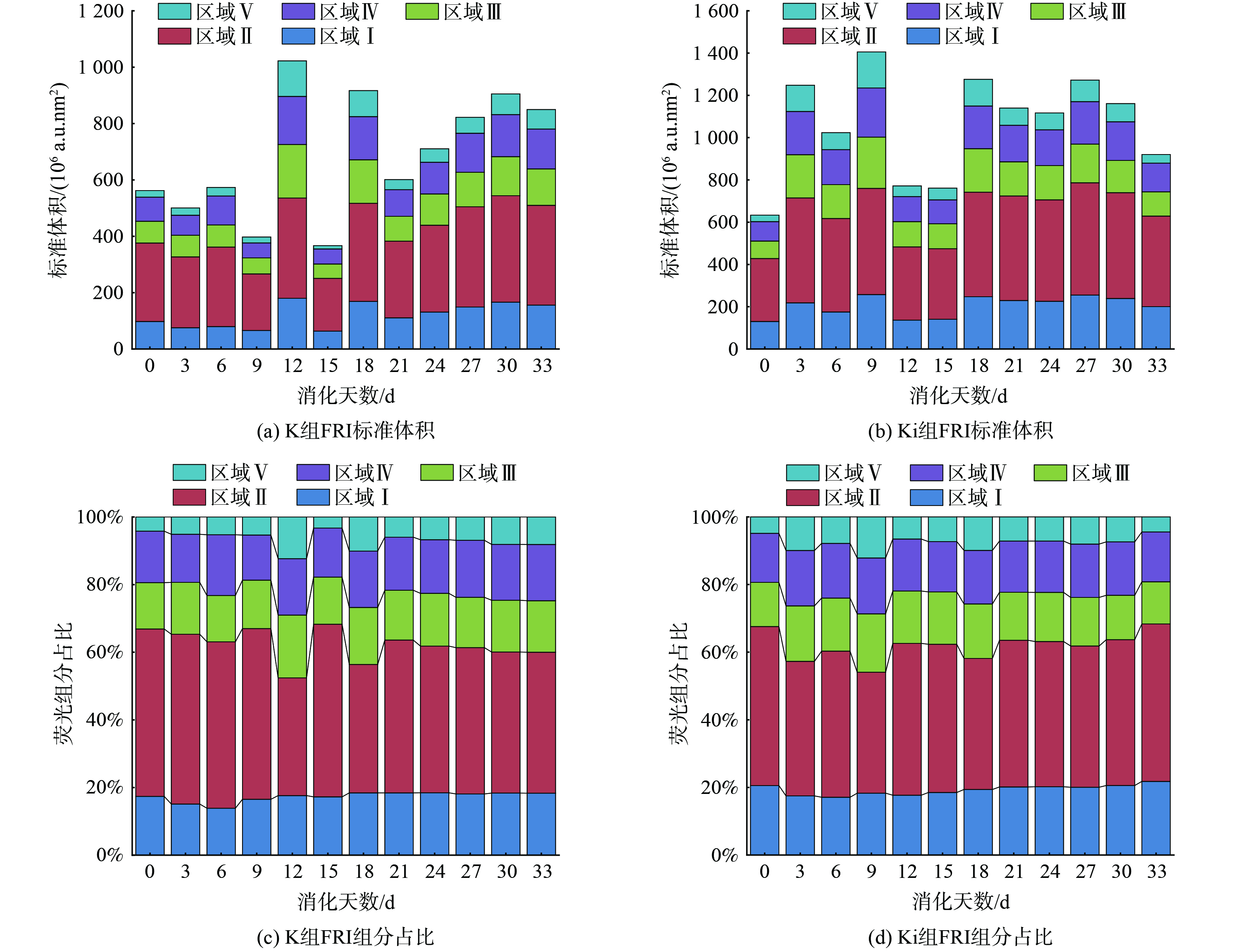
根据FRI计算方法得到5个区域的积分标准体积,沼液中各采样点FRI组分的全过程变化如图3所示。从图3(a)各采样点标准体积来看,K组在第12、18 d总标准体积积分显著上升,其中第12 d上升至1 022.3×106 a.u.nm2,第18 d上升至916.9×106 a.u.nm2;Ki组在第3、9 d总标准体积积分显著上升,其中第3 d上升至1 247.9×106 a.u.nm2,第9 d上升至1 405.6×106 a.u.nm2。推测由于厌氧水解作用先使DOM溶出增大,厌氧细菌利用后造成物质下降。随着厌氧过程增加,厌氧活性物质减小,DOM利用速率减慢。对比K组和Ki组发现,加入外源性物质的厌氧消化标准体积显著高于自身源物质,因此,加入外源性物质能够促进厌氧消化DOM的产生。
从图3(b)各采样点组分的相对丰度来看,有机物的含量在各区域所占比例变化不大,样品中区域Ⅱ所代表的芳香类蛋白物质Ⅱ的含量较大,其中K组占比在35%~51%,Ki组占比在36%~47%。根据岳龙飞等[14]的研究推断出两组样品中在消化周期内微生物活性均较弱。
-
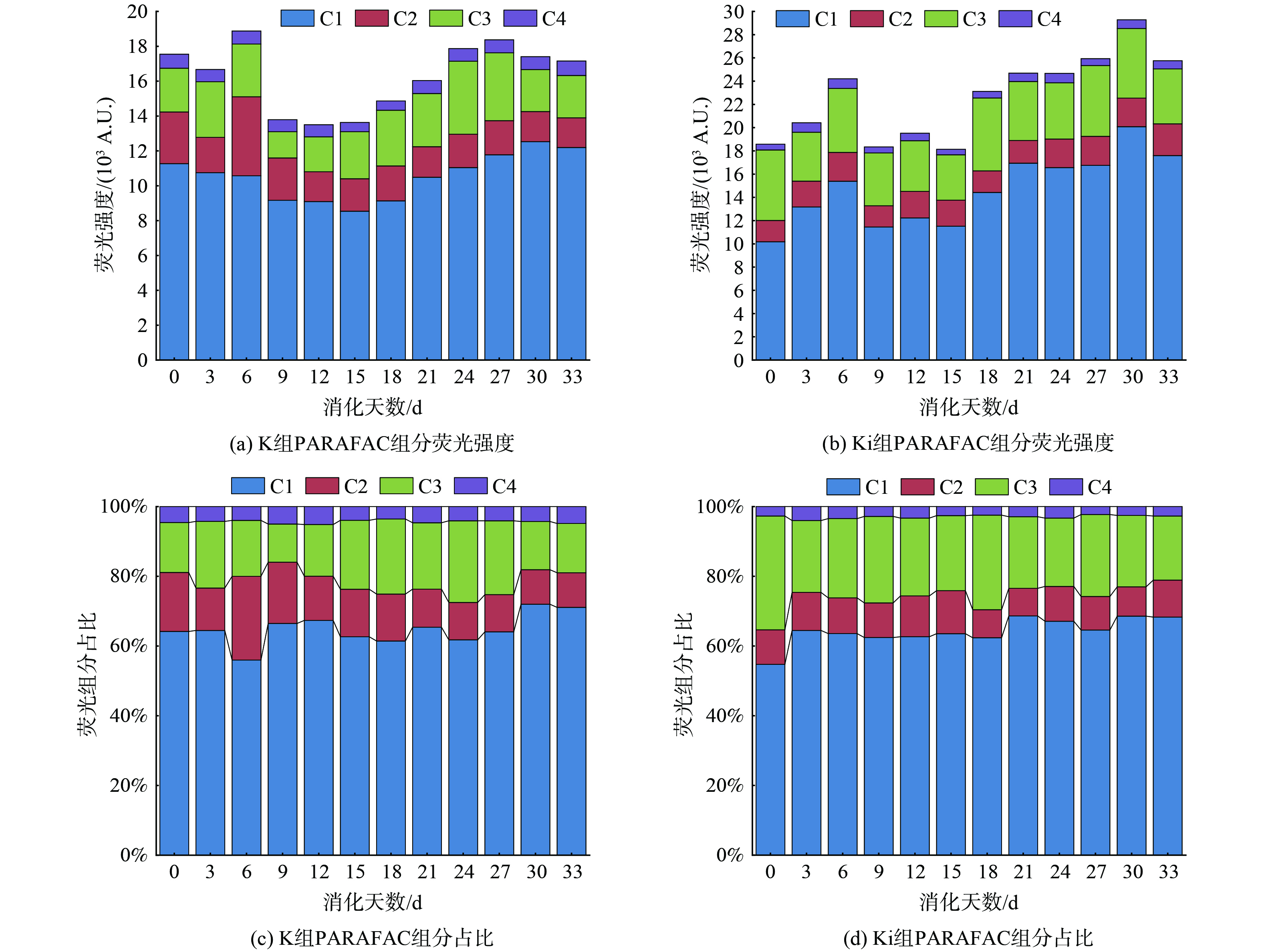
基于PARAFAC模型对厌氧消化全过程中消化沼液的荧光数据进行分析,确定最佳因子数为4个。消化沼液DOM中四组分荧光组分与对应载荷示意图如图4所示。厌氧消化的各个阶段,其DOM组分可能相近,但组分强度会发生变化[25]。表2中列举了4组分对应的大分子组分的对比结果。根据以往对荧光组分的研究,推断C1和C3组分为芳香类氨基酸,其中C1为类色氨酸,C3为类酪氨酸,这类组分反映的是生物降解来源形成的荧光峰值,会受到生活污水和工业废水等外源输入的微生物影响[26]。C2和C4组分为类腐殖质物质,其中C2为类富里酸,C4为陆源类腐殖质,这类组分反映的是河流输入及其携带的土壤溶解至水中的腐殖质,另外还包括水体内部浮游动植物及微生物经过细菌分解的残体[27]。
平行因子解析各采样点的荧光强度如图5(a)所示。K组的总荧光强度在第6 d达到最大值18.9×103 A.U.,第12 d下降到13.5×103 A.U.后在第27 d上升到18.4×103 A.U.;Ki组的总荧光强度在第6 d达到24.2×103 A.U.,第15 d下降到18.1×103 A.U.后在第30 d上升到29.2×103 A.U.。从图5(b)各采样点组分的相对丰度来看,有机物的含量在各区域所占比例变化不大。C1所代表的类色氨酸最多,K组占比为55%~72%,Ki组占比为54%~69%,其次为C3代表的类酪氨酸,K组占比为11%~23%,Ki组占比为18%~33%。对比K组和Ki组发现,加入外源性物质的厌氧消化总荧光强度显著高于自身源物质,且芳香类氨基酸为主要溶解性有机质。因此,加入外源性物质的厌氧消化能够促进DOM的产生。
-
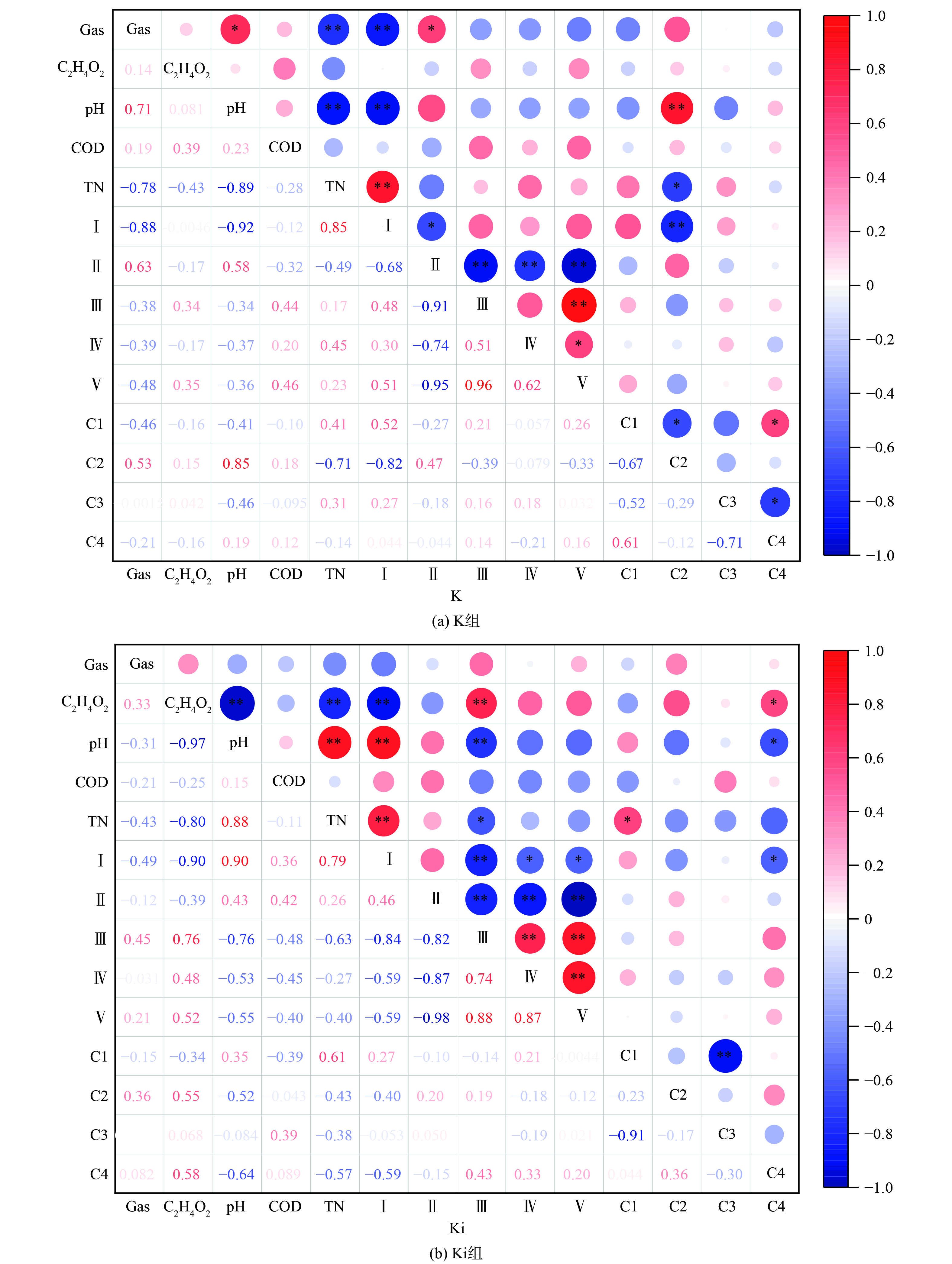
为明确各组DOM的特征差异,对DOM组分及理化参数进行Pearson相关性分析如图6所示。分析结果表明,在K组中C2组分的百分含量与TN、pH、区域Ⅰ的百分含量呈现显著相关关系,区域Ⅰ还与Gas、pH和TN含量呈现显著相关关系,并且区域Ⅱ与Gas呈显著相关关系。在Ki组中,C4组分的百分含量与C2H4O2、pH和区域Ⅰ含量呈现显著相关关系,区域Ⅰ还与C2H4O2、TN、pH呈现显著相关关系。FRI分析出区域Ⅰ的百分含量与TN和pH在2组样品中均呈现显著相关关系,其中与TN均呈正相关关系,而PARAFAC分析中没有共同的显著相关关系出现。分析结果表明,用沼液中DOM的荧光指数变化情况可以反映TN含量和C2H4O2含量等,可以作为沼液监测的一种快速高效的方法。
-
1)热水解后的剩余污泥加入餐厨垃圾厌氧消化体系相比热水解后餐厨垃圾的加入,达到最大产乙酸量的消化时间可缩短一半。
2)FRI与PARAFAC分析可揭示消化沼液中DOM的组分及其含量动态变化,结果表明加入热水解后的剩余污泥能促进厌氧消化DOM的产生。
3)TN含量与FRI分析出的芳香类蛋白质Ⅰ有显著正相关关系,可以利用三维荧光光谱技术结合FRI有效地表征沼液中TN的变化。
外源性物质对消化沼液中DOM光谱特征的影响
Effects of exogenous substances on the spectral characteristics of DOM in digested biogas slurry
-
摘要: 餐厨垃圾厌氧消化产酸是其资源化、能源化利用的重要途径,但消化过程中产生的沼液成为限制技术发展的关键因素,沼液处理成为亟需解决的问题,需要明确其组分才能更好实现沼液产品的增值化。通过添加外源性物质与自身源物质对比,采用三维荧光光谱结合区域积分和平行因子技术,探究餐厨垃圾消化沼液中溶解性有机物(DOM)的荧光组分和荧光强度差异与餐厨垃圾厌氧消化产酸性能。研究结果表明,加入外源性物质的餐厨垃圾厌氧消化能够缩短乙酸产出时间,总氮含量与区域积分法分析出的芳香类蛋白质Ⅰ有显著正相关关系,区域积分分析与平行因子分析能够揭示沼液中溶解性有机物的类别并显示各组分的变化,加入外源性物质能够促进餐厨垃圾厌氧消化DOM的产生。本研究结果可为沼液产品增值化的应用提供理论参考。Abstract: Anaerobic digestion of kitchen waste for acidogenesis is one of the most promising technologies for recycling resources and recovering energy for better sustainable development, however, high yields of digestate constrains the development of this technology, rendering proper treatment of digestate a stranglehold problem, which is fundamentally dependent upon fast and accurate determination of compositions and corresponding abundances in digestates. This study used three-dimensional fluorescence spectroscopy combined with fluorescence region integration (FRI) and parallel factor (PARAFAC) methods to investigate different effects of exogenous and self-derived substances on fluorescence components and intensities of dissolved organic matter (DOM) in digestate as well as acid production performance along kitchen waste digestion. The results indicated that adding exogenous substances to kitchen waste digestion could accelerate production of acetic acid and DOMs in the digestate. Total nitrogen in digestate was significantly and positively correlated with the FRI-revealed aromatic protein I. Both FRI and PARAFAC could accurately reveal the DOMs’ categories in digestate and indicate the dynamic variations of each component. The results could provide a theoretical reference for enhancing kitchen waste anaerobic digestion and value-added digestate recycling utilization.
-
塑料给人们带来很多方便的同时,也给人们带来了困扰。由于产量大,耐受性强,回收率低等原因,塑料在环境中不断积累,在赤道、极地、峰顶和海底都能找到不同种类的塑料残体。在这些塑料残体中,尺寸小于5 mm的塑料被定义为微塑料,由于其特有的理化性质和毒性效应而受到广泛关注[1-3]。目前,微塑料包括初级微塑料和次级微塑料。顾名思义,初级微塑料就是尺寸小于5 mm塑料颗粒的直接应用和排放,例如洗面奶中去角质的颗粒物主要成分就是微塑料[4];次级微塑料来源于大尺寸塑料残体的光解、热解、水解以及生物降解等[5-8]。
微塑料一旦被摄取,会引起摄食活性,存活率和繁殖率的降低等毒性效应,并常伴有炎症反应[9-11]。此外,微塑料还可以随循环系统在生物体内迁移,进入不同的组织和器官,从而在生物体内富集[2]。常常除了自身的毒性,微塑料可以通过吸附作用作为有机和无机污染物传输载体,如多氯联苯、多环芳烃、多溴联苯醚和有机氯农药等[12-16]。Bakir等模拟了肠道系统内污染物的吸附/解吸行为,发现在模拟肠道内污染物从微塑料上的解吸速率是海水中的30倍[17]。一旦被摄取,就像“特洛伊木马”一样将所携带污染物快速解吸,从而提高污染物的毒性和生物可利用性,进一步增加了微塑料的潜在风险。除了不断吸附外源污染物之外,塑料本身会根据特定的用途引入不同的化学添加剂,这些添加剂会随着塑料的老化渗滤到环境中,引起雌激素效应和内分泌干扰效应[16]。
光化学降解是塑料在环境中老化和降解的主要途径。暴露于空气中,经太阳光或紫外光照射,微塑料可以生成含氧基团,如羰基和羟基。未经老化的微塑料往往对疏水性有机物具有很好的吸附性能,随着老化程度的加深,含氧官能团的增加,对亲水性有机污染物的吸附显著增加。Liu等研究了老化前后聚氯乙烯微塑料对抗生素环丙沙星的吸附,发现老化后PVC微塑料结构中的含氧官能团可以与环丙沙星分子之间形成氢键作用,使得环丙沙星的吸附量显著提高[18]。因此,光解老化可以显著改变微塑料的环境行为,从而产生新的环境效应。然而,目前有关微塑料环境转化的研究还很有限。因此,有关不同性质微塑料光解老化过程亟待研究。
本研究以常用塑料制品为研究对象,经机械破碎得到相应的微塑料,于空气中进行太阳光照暴露,研究它们的红外光谱变化情况,并与标准谱图对比,确定塑料种类,以及自然光解老化对塑料结构的影响,从而为分析其潜在的环境行为提供理论指导。
1. 材料和方法(Materials and methods)
1.1 微塑料制备
收集生活与实验室中常见的塑料制品(如图1),包括塑料袋、饮料瓶、外卖盒、离心管、枪头和注射器(注射器筒与注射器推杆)。将各种塑料制品经液氮冷冻处理后用研磨粉碎机(A11 basic Analytical mil,IKA,Germany)机械破碎,得到相应的粉末状微塑料样品,装瓶待用。
1.2 光照暴露实验
将制备好的微塑料进行太阳光光照暴露,暴露地点为江苏省南京市栖霞区南京大学仙林校区环境学院(北纬N32°07′10.16″,东经E118°56′52.71″),样品倾斜角度为30°,以便于更充分接触光照。暴露时间为2019年1月1日—2019年12月31日,共计365 d,天气信息见网址http://www.tianqihoubao.com/lishi/nanjing/month/201901.html。分别使用光强仪(CEL-NP2000-10, Ceaulight Inc., Beijing, China)和温度计测定了9:00、12:00和15:00光照强度和温度。光照强度(365 nm)为0.1—2.8 mW·cm−2(平均(1.2±0.6) mW cm−2),温度为−3—38 ℃(平均(22±9) ℃)。
1.3 微塑料表征
本研究采用衰减全反射-傅里叶变换红外光谱(ATR-FTIR)(Tensor 27,Bruker,Germany)分析光照前后微塑料的种类以及红外光谱变化情况,分辨率为4 cm−1,扫描次数为32,采集范围600—4000 cm−1。为分析微塑料在光照前后表面形貌变化,场发射扫描电子显微镜(SEM,FEG Quanta 250,FEI Co.,Netherland)被用来采集微塑料的SEM图片,操作电压为10 kV。Brunauer-Emmett-Teller(BET)分析仪(Micrometrics ASAP2020)和测角仪(Rame-Hart 250, Succasumna, NJ, USA)分别用于测定微塑料老化前后的BET比表面积和接触角。
2. 结果和讨论(Results and discussion)
2.1 塑料样品种类分析
测量7种常见塑料样品的红外光谱图,并与红外光谱仪自带数据库中的标准红外谱结果以及文献进行匹配和比较,分析其主要成分。红外结果表明,塑料袋和注射器推杆属于PE塑料,外卖盒、离心管、枪头和注射器筒属于PP塑料,饮料瓶属于PET塑料。
2.2 微塑料红外光谱分析
2.2.1 PE类常见塑料
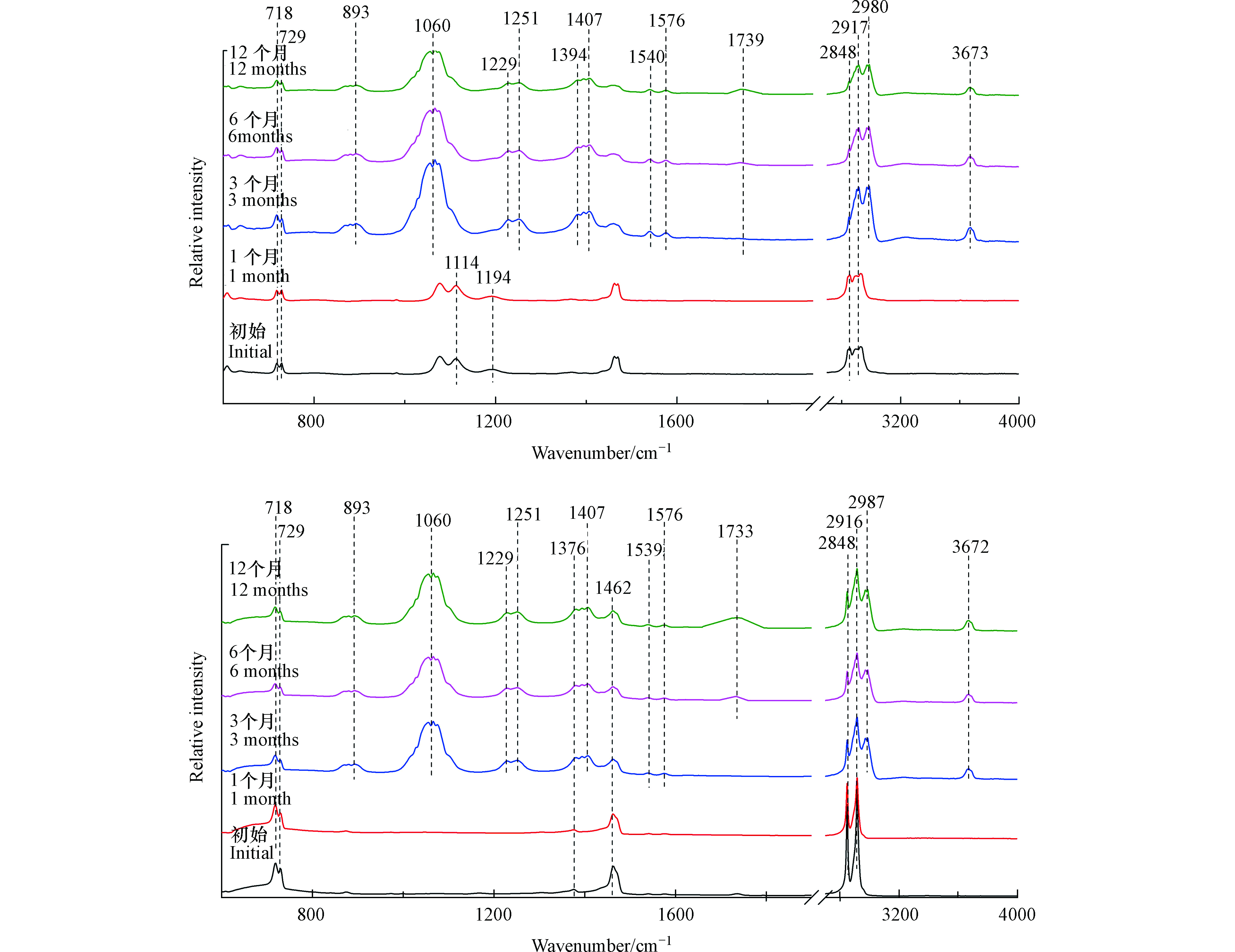
如图2(a)所示,塑料袋样品在光照1个月后,其红外光谱图没有发生显著变化。
然而,在光照3个月后,出现了新的红外吸收峰。3673 cm−1处的红外吸收峰表示O—H伸缩振动,2987 cm−1与2972 cm−1处的红外吸收峰表示甲基C—H伸缩振动,1576 cm−1与1540 cm−1处的红外吸收峰对应芳烃的C=C伸缩振动,1407 cm−1处的红外吸收峰表示O—H弯曲振动,893、1056、1066、1229、1251 cm−1处的红外吸收峰表示C—O伸缩振动[19]。所以塑料袋在光照3个月后可能生成了羟基与苯环。此外,光照3个月后,1194 cm−1与1114 cm−1处的红外吸收峰逐渐减弱,这两个峰代表醚键C—O—C的伸缩振动[20],这说明在光照导致塑料袋微塑料表面醚键的断裂。如图2(b)所示,注射器推杆微塑料三阶段变化与塑料袋微塑料相似。由于添加剂成分的不同,未检测到醚键C—O—C红外特征吸收峰。
2.2.2 PP类常见塑料
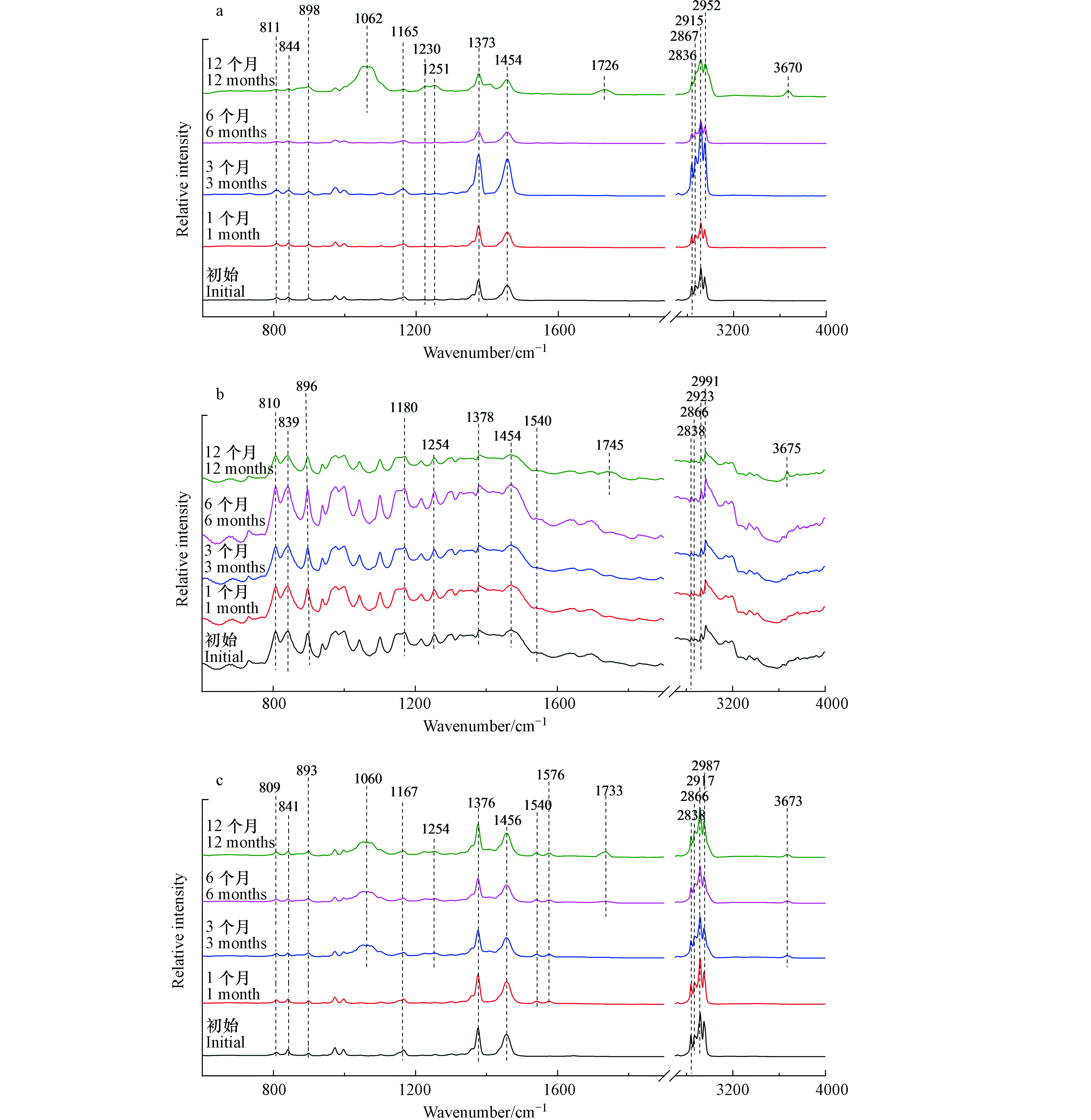
外卖盒红外光谱如图3(a)所示,暴露前6个月,外卖盒的红外光谱没有发现显著变化。然而,在光照12个月后,出现一些新的红外吸收峰。1062 cm−1和1251 cm−1处的红外吸收峰表示C—O伸缩振动[19]。1726 cm−1和3670 cm−1处的红外吸收峰分别表示光老化过程中产生的碳基(—C=O)和羟基(O—H)的伸缩振动[21]。对于注射器筒来说,光照12个月后,其红外光谱出现的—C=O(1745 cm−1)和O—H(3675 cm−1)红外特征峰是其光老化过程中的主要变化(图3(b))。
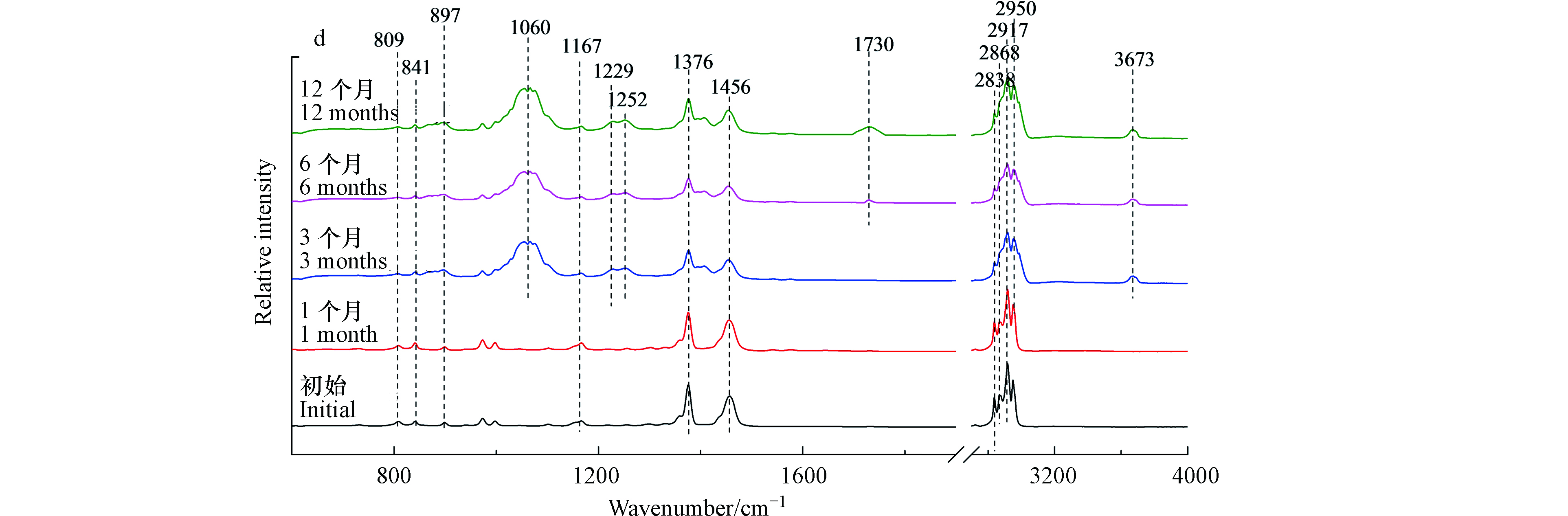
图3(c)与图3(d)分别为枪头与离心管的红外光谱。光照3个月后,红外光谱发生显著变化。在1060、1254、1540/1576 cm−1出现新的吸收峰,分别对应C—O伸缩振动和芳烃的C=C伸缩振动[19]。当光照6个月以后,在1733 cm−1和3673 cm−1出现新的吸收峰,分别对应—C=O伸缩振动和O—H的伸缩振动[21]。离心管微塑料也有类似的结果,光照3个月后出现C—O和芳烃的C=C结构,6个月后出现羰基和羟基官能团。
2.2.3 PET类常见塑料
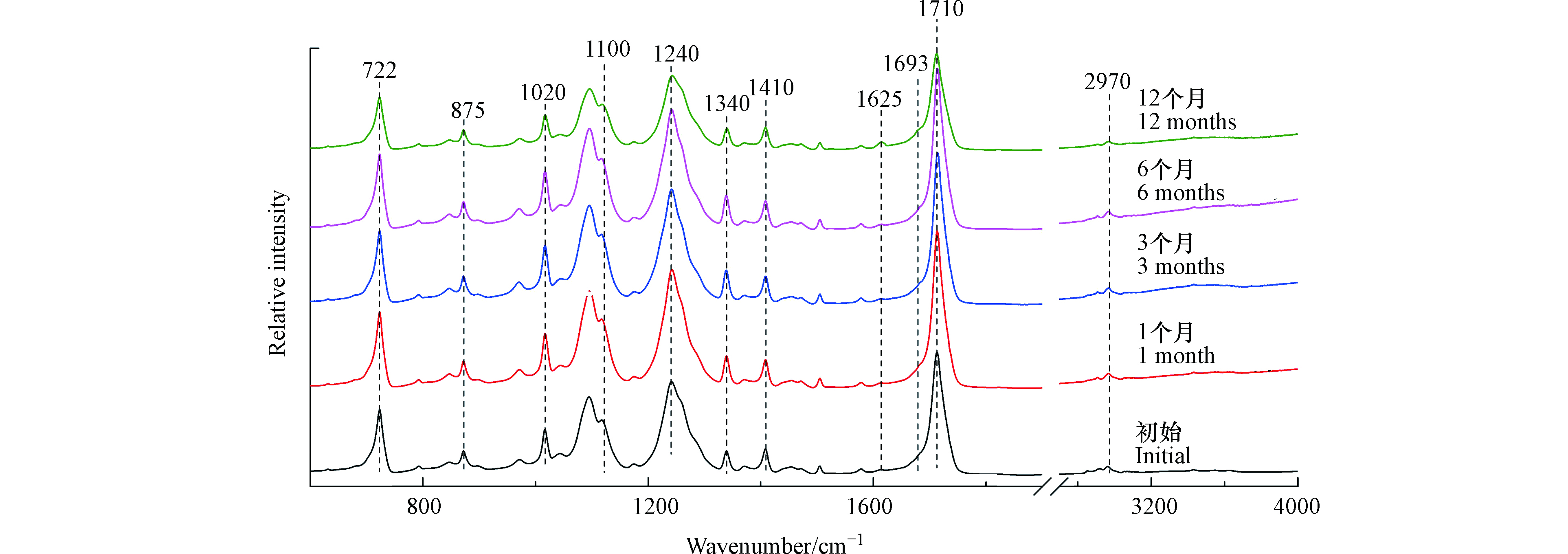
如图4所示,1100、1240、1710、2970 cm−1分别代表PET结构中亚甲基伸缩振动、酯基伸缩振动、羰基伸缩振动和C—H伸缩振动[22]。饮料瓶在光照12个月后,其红外光谱图没有出现新的红外吸收峰,但是在1625 cm−1和1693 cm−1处的红外吸收峰显著增强,这两个红外吸收峰分别代表脂肪链上C=C的伸缩振动和羧基的伸缩振动[22]。因此,PET微塑料在光照12个月后,会产生C=C双键和羧基。
2.3 微塑料老化前后表面形貌和性质分析
测定了SEM照片来表征微塑料自然光解老化前后的表面形貌,如图5所示。塑料袋和注射器推杆微塑料在自然光照处理后,表面出现明显的龟裂。然后对于其他类型的微塑料,在光照12个月之后,微塑料的表面形貌没有发生显著变化。因此,PE材质的微塑料更容易发生光解老化,进而发生破碎分解现象,这与红外光谱的结果一致。此外,分别测定了微塑料老化前后的BET比表面积和接触角。如图6所示,自然光解后,微塑料的水滴接触角显著降低,表明微塑料在光照老化之后亲水性增强。自然光解老化后,微塑料BET比表面积增加,尤其塑料袋和注射器推杆微塑料(表1),这是由于光照后微塑料表面龟裂,微孔增加,这与微塑料的SEM结果一致。
 图 5 微塑料老化前后的扫描电镜图。Figure 5. SEM images of microplastics before and after aging treatment.(a)-(g)分别代表塑料袋、饮料瓶、外卖盒、离心管、枪头、注射器筒和注射器推杆。(a)-(g) represent the SEM images of microplastics derived from plastic bag, drink bottle, take-out box, centrifuge tube, tip, syringe barrel and injector handspike, respectively.
图 5 微塑料老化前后的扫描电镜图。Figure 5. SEM images of microplastics before and after aging treatment.(a)-(g)分别代表塑料袋、饮料瓶、外卖盒、离心管、枪头、注射器筒和注射器推杆。(a)-(g) represent the SEM images of microplastics derived from plastic bag, drink bottle, take-out box, centrifuge tube, tip, syringe barrel and injector handspike, respectively. 图 6 微塑料老化前后的水接触角数码图片。Figure 6. Digital droplet images of microplastics before and after aging treatment.(a)-(g)分别代表塑料袋、饮料瓶、外卖盒、离心管、枪头、注射器筒和注射器推杆。(a)-(g) represent the digital images of microplastics derived from plastic bag, drink bottle, take-out box, centrifuge tube, tip, syringe barrel and injector handspike, respectively.表 1 微塑料老化前后的比表面积。Table 1. BET specific surface areas of microplastics before and after aging treatment.
图 6 微塑料老化前后的水接触角数码图片。Figure 6. Digital droplet images of microplastics before and after aging treatment.(a)-(g)分别代表塑料袋、饮料瓶、外卖盒、离心管、枪头、注射器筒和注射器推杆。(a)-(g) represent the digital images of microplastics derived from plastic bag, drink bottle, take-out box, centrifuge tube, tip, syringe barrel and injector handspike, respectively.表 1 微塑料老化前后的比表面积。Table 1. BET specific surface areas of microplastics before and after aging treatment.BET比表面积/(m2 g−1) 光照前Before photo-irradiation 光照后After photo-irradiation 塑料袋Plastic bag 0.12 0.23 饮料瓶drink bottle 0.15 0.17 外卖盒Take-out box 0.23 0.26 离心管Centrifuge tube 0.31 0.33 枪头Tip 0.54 0.55 注射器筒Syringe barrel 0.32 0.34 注射器推杆Injector handspike 0.27 0.37 3. 结论(Conclusion)
通过测定7种生活与实验室常见塑料产品不同光照时间的红外光谱和表面形貌性质,得到以下结论:(1)PE类微塑料在光照暴露3个月后,有对应羟基、甲基与苯环C=C伸缩振动的红外吸收峰出现,同时对应醚键的红外吸收峰消失。所以PE类微塑料在自然光照条件下不稳定,结构极易产生变化;(2)PP类微塑料外卖盒和注射器筒的稳定性要强于枪头和离心管;(3)PET类微塑料在光照6个月没有显著变化,在光照12个月后会产生C=C双键和羧基;(4)除PET以外,微塑料在自然光照12个月以后,都会产生羰基和羟基等亲水性官能团,接触角减小,亲水性增强;(5)微塑料光解老化后,表面出现龟裂,并伴随比表面积的增加。微塑料的自然老化将会对其理化性质和环境行为产生影响。
-
表 1 5个荧光积分区域
Table 1. Five fluorescence integrated regions
区域 所代表有机物类型 Ex/nm Em/nm Ⅰ 芳香蛋白类物质Ⅰ 220~250 280~330 Ⅱ 芳香蛋白类物质Ⅱ 220~250 330~380 Ⅲ 富里酸类物质 220~250 380~540 Ⅳ 溶解性微生物代谢产物 250~280 280~380 Ⅴ 腐殖酸类物质 250~440 380~540 表 2 4组分对应的大分子物质
Table 2. Corresponding macromolecular substances to the four components of PARAFAC
-
[1] DING Y, ZHAO J, LIU J W, et al. A review of China’s municipal solid waste (MSW) and comparison with international regions: Management and technologies in treatment and resource utilization[J]. Journal of Cleaner Production, 2021, 293: 126144. doi: 10.1016/j.jclepro.2021.126144 [2] 宋壮壮, 张智, 孔赟, 等. 剩余污泥和餐厨垃圾协同厌氧消化处理研究[J]. 给水排水, 2023, 59(5): 37-43. [3] 段娜, 刘倩如, 郑鑫, 等. 沼液酸化贮存技术研究进展[J]. 中国农业大学学报, 2023, 28(11): 208-218. doi: 10.11841/j.issn.1007-4333.2023.11.18 [4] FULDAUER L I, PARKER B M, YAMAN R, et al. Managing anaerobic digestate from food waste in the urban environment: Evaluating the feasibility from an interdisciplinary perspective[J]. Journal of Cleaner Production, 2018, 185: 929-940. doi: 10.1016/j.jclepro.2018.03.045 [5] ZHANG Y, ZHANG P, GUO J, et al. Spectroscopic analysis and biodegradation potential study of dissolved organic matters in sewage sludge treated with high-pressure homogenization[J]. Bioresource Technology, 2013, 135: 616-621. doi: 10.1016/j.biortech.2012.09.034 [6] DU H, GAO W, LI J, et al. Effects of digested biogas slurry application mixed with irrigation water on nitrate leaching during wheat-maize rotation in the North China Plain[J]. Agricultural Water Management, 2019, 213: 882-893. doi: 10.1016/j.agwat.2018.12.012 [7] 杨臣强, 杨瑞, 于玉洁, 等. 基于三维荧光光谱-平行因子分析及紫外-可见吸收光谱对制药污水不同处理工艺单元溶解性有机物特征分析[J]. 环境工程学报, 2023, 17(10): 3444-3453. doi: 10.12030/j.cjee.202308107 [8] ARTINGER R, BUCKAU G, GEYER S, et al. Characterization of groundwater humic substances: Influence of sedimentary organic carbon[J]. Applied Geochemistry, 2000, 15(1): 97-116. doi: 10.1016/S0883-2927(99)00021-9 [9] PAULA G. COBLE. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy[J]. Marine Chemistry, 1996, 51(4): 325-346. doi: 10.1016/0304-4203(95)00062-3 [10] 要世瑾, 杜光源, 牟红梅, 等. 核磁共振技术在土壤-植物-大气连续体研究中的应用[J]. 应用生态学报, 2016, 27(1): 315-326. [11] 刘晗青, 郭寅龙. 傅立叶变换-离子回旋共振质谱法在蛋白质分析中的应用[J]. 质谱学报, 2003, 24(2): 363-369. doi: 10.3969/j.issn.1004-2997.2003.02.010 [12] 罗月萱, 吕泽兰, 晏彩霞, 等. 袁河流域沉积物中溶解性有机质的光谱特征[J]. 环境科学, 2024, 45(8): 4553-4564. [13] 敖静, 王涛, 常瑞英. 三维荧光光谱法在土壤溶解性有机质组分解析中的应用[J]. 土壤通报, 2022, 53(3): 738-746. [14] 岳龙飞, 李洪波, 梁淑轩, 等. 白洋淀入淀河流溶解有机物沿程变化特征及来源解析[J]. 环境工程技术学报, 2023, 13(3): 1050-1060. doi: 10.12153/j.issn.1674-991X.20220425 [15] 隋志男, 郅二铨, 姚杰, 等. 三维荧光光谱区域积分法解析辽河七星湿地水体DOM组成及来源[J]. 环境工程技术学报, 2015, 5(2): 114-120. [16] 高连敬, 杜尔登, 崔旭峰, 等. 三维荧光结合荧光区域积分法评估净水厂有机物去除效果[J]. 给水排水, 2012, 48(10): 51-56. [17] 姜新佩, 姚杰, 张欢. 三维荧光区域积分法评估不同植物对溶解性有机物去除效果[J]. 科学技术与工程, 2015, 15(7): 276-279. doi: 10.3969/j.issn.1671-1815.2015.07.053 [18] 申钊颖, 弓晓峰, 江良, 等. 利用荧光区域积分法解析鄱阳湖DOM组成及来源[J]. 环境科学与技术, 2019, 42(5): 196-203. [19] 万鹏亮, 刘玉玲, 朱妮平, 等. A2O工艺处理城市污水过程中DOM组分变化分析[J]. 西安建筑科技大学学报(自然科学版), 2021, 53(5): 765-772. [20] CHEN W, WESTERHOFF P, LEENHEER J A, et al. Fluorescence excitation−emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 2003, 37(24): 5701-5710. [21] STEDMON C A, BRO R. Characterizing dissolved organic matter fluorescence with parallel factor analysis: a tutorial: Fluorescence-PARAFAC analysis of DOM[J]. Limnology and Oceanography: Methods, 2008, 6(11): 572-579. doi: 10.4319/lom.2008.6.572 [22] MURPHE K R, STEDMON C A, GRAEBER D, et al. Fluorescence spectroscopy and multi-way techniques. PARAFAC[J]. Analytical Methods, 2013, 5(23): 6557. doi: 10.1039/c3ay41160e [23] CHE J G, LIN W F, YE J, et al. Insights into compositional changes of dissolved organic matter during a full-scale vermicomposting of cow dung by combined spectroscopic and electrochemical techniques[J]. Bioresource Technology, 2020, 301: 122757. [24] HUGUET A, VACHER L, RELEXANS S, et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 2009, 40(6): 706-719. doi: 10.1016/j.orggeochem.2009.03.002 [25] ZHANG R, XIAN R, WANG F, et al. Direct discharge of sewage to natural water through illicitly connected urban stormwater systems: An overlooked source of dissolved organic matter[J]. Science of the Total Environment, 2023, 890: 164248. doi: 10.1016/j.scitotenv.2023.164248 [26] 江俊武, 李帅东, 沈胤胤, 等. 夏季太湖CDOM光学特性空间差异及其来源解析[J]. 环境科学研究, 2017, 30(7): 1020-1030. [27] 倪茂飞, 刘睿, 王志康, 等. 典型喀斯特河流汛期溶解性有机质空间变化及其光学参数的耦合关系[J]. 生态学报, 2022, 42(7): 2822-2833. [28] 许明, 刘伟京, 白永刚, 等. 太湖蓝藻水华期可溶有机物的生物降解[J]. 中国环境科学, 2018, 38(9): 3494-3501. doi: 10.3969/j.issn.1000-6923.2018.09.036 [29] YANG B, GAO X, ZHAO J, et al. The impacts of intensive scallop farming on dissolved organic matter in the coastal waters adjacent to the Yangma Island, North Yellow Sea[J]. Science of the Total Environment, 2022, 807: 150989. doi: 10.1016/j.scitotenv.2021.150989 [30] QI L, XIE H, GAGNE J P, et al. Photoreactivities of two distinct dissolved organic matter pools in groundwater of a subarctic island[J]. Marine Chemistry, 2018, 202: 97-120. doi: 10.1016/j.marchem.2018.03.003 [31] FU P, WU F, LIU C, et al. Fluorescence characterization of dissolved organic matter in an urban river and its complexation with Hg(II)[J]. Applied Geochemistry, 2007, 22(8): 1668-1679. doi: 10.1016/j.apgeochem.2007.03.041 [32] 刘兆冰, 梁文健, 秦礼萍, 等. 渤海和北黄海有色溶解有机物(CDOM)的分布特征和季节变化[J]. 环境科学, 2019, 40(3): 1198-1208. [33] 蔡文良, 许晓毅, 杜娴, 等. 嘉陵江重庆段DOM三维荧光光谱的平行因子分析[J]. 环境科学研究, 2012, 25(3): 276-281. [34] 黄凯文, 马珍, 苫君月, 等. 喀斯特山区土壤溶解性有机质光谱特征及来源解析[J]. 环境工程, 2023, 41(5): 115-124. [35] 王筱, 晏彩霞, 聂明华, 等. 紫外老化微塑料衍生DOM理化特性及其与磺胺嘧啶、铜的络合机制[J]. 环境科学, 2023, 44(11): 6159-6171. [36] 程远月, 郭卫东. 厦门湾有色溶解有机物光漂白的三维荧光光谱研究[J]. 光谱学与光谱分析, 2009, 29(4): 990-993. doi: 10.3964/j.issn.1000-0593(2009)04-0990-04 [37] LIAO Z, WANG Y, XIE K, et al. Photochemistry of dissolved organic matter in water from the Pearl River (China): Seasonal patterns and predictive modelling[J]. Water Research, 2022, 208: 117875. doi: 10.1016/j.watres.2021.117875 [38] 申慧彦, 曹承泽, 王嘉富, 等. 典型可溶性有机质组分与土霉素荧光猝灭研究[J]. 环境科学与技术, 2023, 46(5): 201-207. [39] 申慧彦, 徐华健, 王嘉富, 等. 湖滨带土壤长期淹水释放DOM与抗生素的猝灭作用[J]. 环境科学学报, 2024, 44(1): 366-376. -





 下载:
下载: