-
随着经济的快速发展,城乡一体化的速度不断加快,导致城镇河湖水体中无机和有机污染物的输入量前所未有[1]。然而,随着城市排水系统和污水处理设施的升级改造,地表水水质得到了一定改善,但微污染水体仍普遍存在。污染江河水源表现为氨氮、总磷、色度、有机物等指标超出饮用水源卫生标准[2],或导致湖泊、水库水体的富营养化,造成水质恶化。水体富营养化因其对生态环境和人类健康的负面影响而引起了关注,例如藻类和其他浮游生物的快速繁殖、水质恶化、鱼类和其他生物的死亡以及饮用水污染[3-4]。但水体的自净能力是有限的,水体的污染物总量超过某限度时将会造成水体污染,需要借助修复技术实现污染水体的净化。近年来,已开发各种水体修复技术如曝气[5]、引水[6]、化学絮凝[7]、化学杀藻剂添加[8],用于修复各种污染类型的水体。然而,物理化学方法虽然能在一定程度上缓解水体污染,但在实际应用中表现出局限性。例如,曝气和引水的成本很高,还需要较大工程量[9]。添加化学药剂对污染河流的处理效果明显,但化学试剂带来的二次污染也是不可避免的[10]。为了不造成河湖水体进一步恶化,并改善区域环境,迫切需要具有成本效益的技术。与传统工程技术相比,植物修复技术因其高效和生态友好的特性得到了广泛的研究[11-12]。
植物修复是指利用植物从环境中去除和积累污染物[13],包括利用植物来减轻、转移、稳定或降解土壤、沉积物和水中的污染物。根据近期对特定植物的研究,在污水处理设施末端过滤出的污染物,可通过植物进行净化和去除[14]。水生植物可以通过富集和自身生长的生物量累积作用,以及与微生物的协同修复,有效净化水体[15]。沉水植物植株整体生活在水中,各器官直接吸收养分[16];漂浮水生植物在光竞争中具有明显优势,通过迅速繁殖,其茎和根吸收营养[17]。此外,挺水植物根系发育良好,能有效吸收养分,同时为微生物提供良好的生长环境[18]。植物修复技术在水处理中研究包括水体中金属[19]、除草剂修复[20]等。不同的植物种类,如水葫芦 (Eichhornia crassipes) 、浮萍 (Lemna minor) 、水莴苣 (Pistia stratiotes) 、香根草 (Chrysopogon zizanioides) 和芦苇 (Phragmites australis) ,已用于污染河水的修复[21-22]。其中,水葫芦可以改善水质,减少总溶解性固体 (26%) 和磷酸盐 (33%) [23]。对比不同水生植物净化水质除机理方面,水葫芦、水莴苣、狐尾藻3种水生植物对氮和磷的去除主要依赖于植物吸附,水葫芦和水莴苣对氮的去除也与微生物硝化/反硝化密切相关[13]。以往研究多集中在水生植物对水体氮、磷的去除上,但关于不同挺水植物对水质净化效能及影响因素的研究相对较少[24],这在微污染水体植物修复中至关重要。
水生植物生长受温度等环境因素影响,不同物种生长及水质净化的最佳温度不同[2]。当水温高于或低于最适温度时,会影响水生植物对养分尤其是氮、磷的吸收能力,影响其生长和水净化能力[25]。然而,很少有关于水生植物在不同温度下从微污染水体中去除污染物的研究,并探讨挺水植物净水效能及环境因子影响机制[26]。本研究旨在评价不同挺水植物对污染物去除效果,确定不同挺水植物配置模式,探讨不同温度下挺水植物系统对污染物去除效率。本研究结果可为挺水植物水质净化和微污染水体生态修复提供理论基础。
-
试验采取水箱、泡沫浮岛和挺水植物组成的试验装置。试验用塑料水箱 (54 cm×36 cm×60 cm,体积约为120 L) ,试验塑料水箱内水深30 cm;泡沫浮岛放置在每个水箱中央,浮岛采用可降解的聚苯乙烯泡沫 (40 cm×30 cm×2 cm) ,泡沫浮岛上设置6个植物种植孔,间距为10 cm,每个定植孔直径为3 cm,并用泡沫固定种植1株植物;试验植物购买于白洋淀水生植物园,选取长势一致的香蒲 (Typha orientalis) 、鸢尾 (Iris tectorum) 、美人蕉 (Canna indica) 、千屈菜 (Lythrum salicaria) 、慈姑 (Sagittaria trifolia) ,确保每株植物根茎叶齐全,生长良好。试验用水为模拟微污染水体,其中COD为31~46 mg·L−1,TN浓度为2.2~5.2 mg·L−1,TP浓度为0.28~0.42 mg·L−1,NH4+-N浓度为1.1~4.0 mg·L−1。试验开始前,每个塑料水箱中加入试验用水至设计好的水位深度30 cm,从每个水箱取50 mL试验用水测定水质指标。
挺水植物复合人工浮岛装置,包括水箱 (70 cm×50 cm×58 cm,体积约200 L) 、人工浮岛 (包括浮岛框架、火山石和植物3部分) 。浮岛框架中设置直径16 cm花盆2个,深度为8 cm,浮岛框架中填料为火山岩,粒径5~10 mm。
-
挺水植物水质净化试验包括单一植物净化水质试验组和组合植物试验组,试验于2022年夏季7—9月进行,水温在22~28 ℃之间 (平均水温24.7 ℃) 。单一植物试验分别为香蒲、鸢尾、美人蕉、千屈菜、慈姑,每个植物组设置3个重复,植物固定于泡沫浮岛上,并设置只有泡沫浮岛没有植物的水箱作为空白对照组。试验周期为31 d,每2~3 d取一次水样,测定水中pH、溶解氧、COD、氨氮、总磷、总氮等指标,每天取样后补充蒸馏水以保持水体积恒定。水质指标溶解氧和pH进行现场测定,总氮、总磷、氨氮、COD指标进行实验室分析测定。植物生长指标,在试验开始和结束时测定植物高度和根长,试验结束时用称重法测定植物生物量。
组合植物试验,选取美人蕉、千屈菜分别与鸢尾、香蒲进行1∶1组合进行水质净化效果研究,试验过程和水样水质指标测定同单一植物水质净化试验。
基于单一植物和组合植物水质净化试验,选择美人蕉作为典型挺水植物复合人工浮岛试验植物。浮岛置于200 L试验装置中。利用植物浮岛系统研究不同温度条件下污染物去除效率,控制其他条件不变的情况下,温度为20~25 ℃和5~10 ℃下各运行14 d,在温度为20~25 ℃下,模拟微污染水体水质,其中COD为40~46 mg·L−1,TN浓度为4.1~5.1 mg·L−1,TP浓度为0.30~0.40 mg·L−1,NH4+-N浓度为0.90~1.20 mg·L−1;在温度为5~10 ℃下,进水COD为33~40 mg·L−1、TN浓度为3.5~4.5 mg·L−1、TP浓度为0.08~0.18 mg·L−1、NH4+-N浓度为0.60~0.92 mg·L−1。
-
测定的主要指标包括溶解氧、pH、NH4+-N、TN、TP、COD。溶解氧采用便携式溶氧仪 (上海雷磁,JPBJ-608) ,pH采用便携式多参数水质测定仪测定 (上海雷磁,PHBJ- 260F) ,COD采用常温消解快速测定法、TN采用过硫酸钾氧化紫外分光光度法、NH4+-N采用纳氏试剂分光光度法、TP采用过硫酸钾消解分光光度法 (连华水质多参数测定仪 LH-3BA) 。
挺水植物复合人工浮岛微生物分析采用高通量测序法,微生物多样性16S rRNA基因测序主要包括核酸提取、PCR扩增、建库以及测序分析4个过程,采集典型挺水植物系统在常温、低温环境下复合浮岛植物根际填料样品,每个温度下采集3个重复样品,分别保存在无菌聚乙烯自封袋中,样品保存在-20 ℃进行DNA提取微生物,探究复合浮岛植物根际填料样本的微生物群落结构以及微生物与环境相关性等信息。高通量测序由Illumina Miseq pE300测序系统实现,微生物高通量测序工作委托上海美吉生物医药科技有限公司进行。所有样品序列进行OTU划分、多样性分析。
-
检测数据经Excel软件处理后,采用SPSS Statistics、OriginPro 2018对数据进行方差分析、多重比较、相关性分析等。采用生态数据处理软件 (CANOCO) 对微生物样品97%相似性的样品OTU数据与环境因子进行冗余分析。
-
1) 挺水植物生长指标变化
单一植物水质净化试验初始状态和试验结束阶段,测定单一植物组5种植物生物量和根长,如表1所示,美人蕉在实验结束后植株生物量 (鲜重) 增长率为38.03%±5.20%,显著高于其他4种植物 (p<0.05) 。千屈菜在实验结束后植株生物量 (干重) 增长率最大,为39.94%±10.16%。试验过程中慈姑生物量增加相对较少,说明在实验过程中需进行较长时间水体训化和逐渐适应试验环境。鸢尾、香蒲在试验过程中生物量增加无显著差异。
对比植物根长变化,各组植株根系都呈现增长趋势,美人蕉组根长增长率显著高于其他植物组 (p<0.05),增长了259.86%±72.30%;慈姑组根系增长率较低,仅为14.80%±4.20%,主要是部分慈姑受病虫害影响生长状况较差。通过植物植株和根系生长数据分析,表明美人蕉和千屈菜对水环境的适应性较强。
2) 挺水植物对水体溶解氧和pH的影响
单一挺水植物组水体溶解氧变化如图1所示,试验过程中空白对照组中溶解氧在温度、气压变化影响下,空白对照组溶解氧有先降低后增高的波动,基本稳定在为2.18~3.72 mg·L−1范围内。挺水植物组的溶解氧在初始阶段呈现先下降后升高的趋势,多重比较结果显示植物组溶解氧浓度显著低于空白对照组 (p<0.05) 主要是因为在试验初期植物根系呼吸作用显著,消耗了水中溶解氧;其中鸢尾组溶解氧下降趋势最为明显,显著低于其他植物组,溶解氧平均值由3.21 mg·L−1降低到0.5 mg·L−1,主要是试验初期部分根系死亡,有机物释放及微生物分解消耗了溶解氧;随着实验后期鸢尾植株适应水体环境,逐渐发挥净化水质功能,水中溶解氧浓度逐渐回升。千屈菜组水体溶解氧含量相对稳定,且在试验后期较好的改善了氧气条件。
图2为试验过程中水体pH变化,初始阶段空白对照组与植物组pH在7.4~7.9左右;随着试验的进行,空白对照组pH呈上升趋势,最终pH平均值为8.6。由于空白对照组无水生植物吸收水体中营养物质,导致藻类滋生,藻类光合作用消耗水体中CO2,使水体pH偏高;另一方面,水体中的pH会影响藻类的光合作用,进而影响水中藻密度变化[27]。挺水植物系统中pH虽然也呈现上升趋势,但总体pH小于空白对照组且相对稳定,其原因主要是植物的呼吸作用会增加水中CO2浓度,pH随之降低,另外,植物根部会分泌有机酸和H+,也在一定程度上使pH保持相对稳定。
3) 挺水植物对COD的去除效果
不同挺水植物组对水体COD去除效果如图3所示,挺水植物组对COD处理效果与空白对照组相比差异不显著,各组水体COD均呈现下降趋势,试验结束时水体COD在21.8~30.07 mg·L−1。由于试验用水取自湿地,水中含有一定量悬浮态的有机物质,随着装置稳定,水体中悬浮态COD在下沉降至装置底部,COD水平随之降低。同时,植物根系对水中颗粒物有一定的吸附效果,挺水植物组水体COD较空白对照组略低。其中,鸢尾组在试验初期出现烂根现象,导致部分有机物释放到水体中,鸢尾组水体COD水平与空白对照组最为接近。研究表明,植物本身对有机污染物没有吸收作用,试验后期,COD的下降,主要靠水体中微生物对COD的降解作用[28]。
4) 挺水植物对氨氮的去除效果
挺水植物对氨氮的去除效果如图3所示,所有植物组在初始第2~6 d水体氨氮均呈现迅速下降,随后植物组氨氮下降趋势与空白对照组表现出差异,植物组氨氮继续保持较快的下降速度,在试验第15 d后趋于稳定,直至下降到一个极低水平;空白对照组氨氮下降速度相对较慢,在第12 d水体氨氮又出现加速下降情况,到第25 d各组氨氮浓度达到完全去除的水平。植物组对氨氮的去除效果更为显著,空白对照组在试验结束时氨氮也下降到了很低水平,这主要是因为氨氮在水体中去除包括挥发、植物吸收和硝化等过程,在试验初始阶段,在水体有氧环境下,硝化细菌作用下将水体中氨氮转化为硝态氮,所有植物组水体氨氮呈下降趋势,而植物组由于植物的吸收同化作用,较空白对照组氨氮下降速度更快[18]。总体上各植物组氨氮的去除率在95%以上,挺水植物可加速氨氮的去除。
5) 挺水植物对总氮的去除效果
挺水植物系统对水体TN的去除如图3所示,试验初始5 d,由于水中氨氮的挥发和含氮有机颗粒沉降等作用,各组TN浓度均呈现较快的下降。除慈姑外的挺水植物组,TN水平呈持续下降并逐渐趋于稳定。空白对照组在试验第17 d之后呈现波动,TN浓度先上升再下降,植物对氮元素的吸收作用成为TN去除的主要因素。表2为各植物组水体中总氮的去除率计算结果,鸢尾、香蒲组对TN的去除效果分别50.23%~62.77%、49.76%~59.78%,其次为美人蕉和千屈菜对TN的去除率接近,分别为43.66%~48.53%、37.21%~42.08%;慈姑组由于植物死亡,植物凋落物进入水体分解并释放氮元素,对TN的去除效果呈现负值,TN浓度呈增加现象。鸢尾组由于植株死亡现象,根据溶解氧等指标,试验中期水体溶解氧水平较低,在反硝化细菌的作用下发生反硝化,在一定程度上导致TN含量下降[13,29],因此,鸢尾组TN去除有植物吸收和反硝化共同作用影响。
6) 挺水植物对总磷的去除效果
挺水植物对总磷的去除作用如图3所示,所有植物组在初始阶段总磷含量呈快速下降趋势,其原因可能是水体中磷酸盐在水中悬浮颗粒上吸附和沉淀,随着试验进行,挺水植物逐渐适应水体环境,并加快生长,植物根系吸收水中磷酸盐,用于光合作用、自身物质代谢与能量维持[30]。不同植物组对水体总磷的去除率存在差异,如表2所示,美人蕉和千屈菜组水体总磷含量呈现持续下降趋势,对总磷的去除率最高,为72.45%~80.77%,60.56%~77.15%;香蒲对总磷的去除率低于空白对照组,去除率为18.27%~37.42%。
鸢尾和慈姑组对总磷的去除率均为负值,其中鸢尾组为-50.23%~-37.52%,结合溶解氧变化情况,鸢尾在试验过程中部分植株死亡向水体中释放营养盐,水体中总磷含量不降反增;同时,慈姑组植物死亡导致总磷去除率为-45.50%~-36.22%,死亡的植物组织进入水体也造成含磷营养盐释放。两者区别在于,慈姑主要是病虫害影响导致叶片部分受损,植物叶片进入水体造成氮磷营养盐的释放,但根系泌氧未受到显著影响,水体溶解氧含量未见明显降低;鸢尾组是由于部分植株根系死亡,根系部分首先发生腐烂分解释放氮磷营养物质,同时导致水中溶解氧含量明显下降。
-
根据单一挺水植物水质净化结果,其中美人蕉和千屈菜对水体具有较好的改善效果,而鸢尾和香蒲部分植株在试验初期出现了死亡情况,但在试验后期植物表现出较强的适应性,综合单一植物试验结果,将美人蕉和千屈菜作为主要水质净化植物,分别与鸢尾和香蒲进行组合试验,配置比例为1∶1,对组合植物组对水体净化效果和主要水质指标进行分析,结果如图4。组合植物对COD的去除效果与空白对照组无显著差异,去除率为44.27%~68.43%。这与单一植物试验结果相同,主要是由于植物自身生长过程不能直接吸收或降解COD,主要靠水中微生物对水中有机物进行分解。
试验初期,各组氮磷含量下降较快,主要是植物对于氮磷营养的吸收同化作用,因此在试验初始阶段,植物体对氮磷营养盐的需求较大,使水体中氮磷水平快速下降,随着植物体所需营养与环境中氮磷水平达到平衡后,对水体中氮磷营养盐的吸收速度也趋于下降。对比不同植物组合结果,美人蕉和鸢尾、千屈菜与鸢尾组合对污染物的去除效果优于美人蕉和香蒲、千屈菜和香蒲组合,其中鸢尾的组合总磷水平明显低于香蒲组合,和单一试验结论一致,即鸢尾比香蒲去除水中氮磷效果更好。通过单一植物和组合植物对水质改善结果分析,挺水植物改善水质能力受植物类型、生长阶段、生物量、根系活力及环境适应能力等综合因素影响[31-32]。
-
1) 温度对挺水植物复合浮岛净水效能影响
通过单一植物和组合植物水质净化效果对比,美人蕉对试验水环境适应能力最佳,且表现出较好的污染物净化效果,作为典型挺水植物进行复合浮岛净水效能研究,分析复合系统运行期间温度对水质净化影响。植物复合浮岛系统对COD的去除效果如图5所示,当环境温度为20~25 ℃,进水COD为42.56 mg·L−1,出水COD平均浓度为10.62 mg·L−1,COD的去除率平均值为75%;温度降低到5~10 ℃,系统进水COD为48.02 mg·L−1,出水COD平均值为14.27 mg·L−1,COD平均去除率为70%。在低温环境下,挺水植物系统对COD的去除率略低于常温环境,但总体上温度变化对于COD的去除影响不显著,由于适宜温度可促进植物生长和微生物活性,其中,植物根系发展可提高输氧能力,植物生物活性提高、微生物数量增加在一定程度上促进了有机物分解,常温环境COD去除效果略高于低温环境。
在不同环境温度下植物系统对NH4+-N的去除效果如图5所示,常温20~25 ℃条件下,系统出水NH4+-N平均浓度为0.12 mg·L−1,达地表Ⅱ类水标准,系统对NH4+-N的去除率平均值为85%以上;温度5~10 ℃条件下,出水NH4+-N平均浓度为0.20 mg·L−1,去除率为74%左右。随着温度降低,系统对NH4+-N的去除效果略差于常温环境,波动性大,但NH4+-N的出水浓度均可达Ⅱ类水的标准。系统在两个温度情况下NH4+-N去除效果都非常好,这主要是因为植物根系漂浮于水体之中,具有较高的亲和力,吸收速率较高,此外,挺水植物浮岛装置中火山石具有一定吸附作用,这也是人工浮岛对NH4+-N的去除率较高的原因之一。
不同温度条件下挺水植物系统对TN、TP的去除情况如图5所示,环境温度20~25 ℃条件下,系统进水TN平均浓度为4.8 mg·L−1,试验期间进水水质总氮处于V类~劣Ⅴ类水平,且波动相对较大,系统出水TN平均浓度为1.31 mg·L−1,出水较为稳定,达地表Ⅳ类水标准,系统对TN的去除率为73%~77%。环境温度为5~10 ℃,系统进水TN平均浓度为3.9 mg·L−1,出水TN平均浓度为1.8 mg·L−1,达地表Ⅴ类水标准,去除率为68%~72%。常温20~25 ℃条件下,整体实验期间进水水质TP指标均处于劣Ⅴ类水质,系统出水较为稳定,可达地表Ⅳ类水的标准,复合浮岛系统对TP的去除率平均值为78.78%;温度5~10 ℃时,进水水质指标属于Ⅳ类水和Ⅴ类水,出水也较为稳定,出水TP指标均优于地表Ⅳ类水质,系统TP平均去除率为66%。从去除率可以看出,在低温环境下,系统对TP的去除率低于常温环境下,这主要是由于人工浮岛对TP的去除不仅靠植物的吸收作用,还包括微生物的降解以及填料的吸附作用。
2) 不同温度下挺水植物复合浮岛微生物群落特征
常温环境与低温环境复合浮岛植物根际填料样品的微生物高通量测序结果,对OTU水平上微生物群落多样性进行分析。Chao指数和Ace指数代表群落丰富度,由表3可知,常温环境下样品从Sobs检测出的OTU数目为1 576,Ace和Chao的数目均在1 600以上,说明常温样品中微生物丰富度高于低温样品 (Ace和Chao的数目分别为1 076、1 061) 。Shannon指数和Simpson指数表示微生物群落多样性,在常温环境下,Shannon值为5.858,高于低温样品中群落多样性;Simpson值在常温下较低,也说明样品在常温环境下的群落多样性高于低温环境。
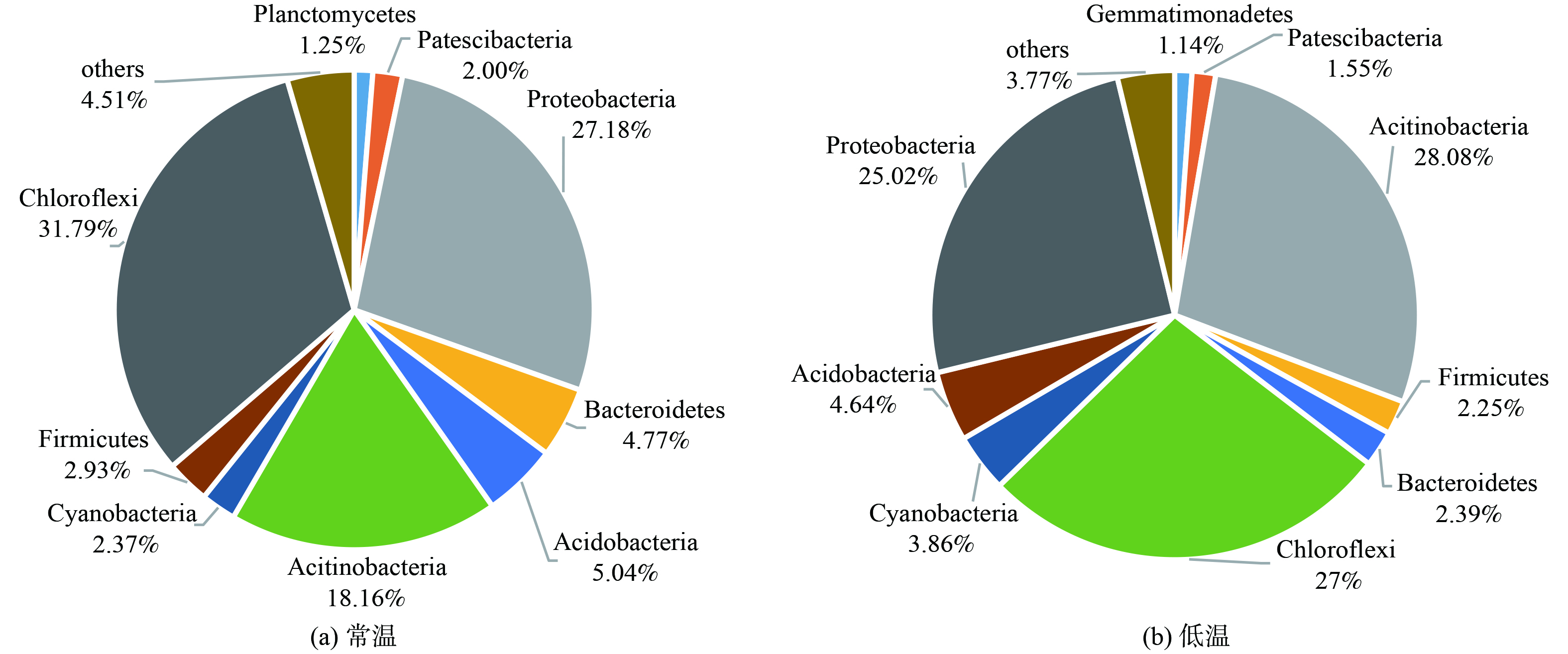
图6为常温环境和低温环境样品微生物群落们水平组成,2种温度条件下样品共有菌门有14个。常温环境样品中,变形菌门 (Proteobacteria) 为优势菌门,在低温环境中,优势菌门为绿弯菌门 (Chloroflexi) 。从图中可以看出微生物在低温和常温共有的门类几乎没有差异,两种环境下的主要菌门均为变形菌门 (Proteobacteria) 、绿弯菌门 (Chloroflexi) 、放线菌门 (Actinobacteria) 这三类,但是不同温度生长在两个水体的特有种细菌群落有显著差别。其中,浮霉菌门 (Planctomycetes) 、疣微菌门 (Verrucomicrobia) 、衣原体门 (Chlamydiae) 为常温环境下独有的微生物,己科河菌门 (Rokubacteria) 为低温时独有微生物。
通过冗余分析 (图7) ,与水体COD、氨氮、TN、TP去除效能关系密切的细菌群落包括浮霉菌门、拟杆菌门 (Bacteroides) 、芽单胞菌门 (Gemmatimonadetes) 等。浮霉菌门、拟杆菌门 (Bacteroides) 、绿弯菌门与污染物去除率呈正相关。有研究表明,拟杆菌门广泛存在于淡水水体中的优势菌,其丰度和富营养化可能有潜在的关系,拟杆菌门对微污染水体含有硝酸盐、氨等污染物具有一定降解作用[33]。芽单胞菌门、蓝藻菌门 (Cyanobacteria) 与污染物去除率呈负相关,蓝藻菌具有固氮能力,对水体N循环起着重要作用[34]。分解有机物的放线菌门与主要污染物去除率也呈负相关。
-
通过对比不同挺水植物净水效果,在单一植物试验中,美人蕉、千屈菜生长良好,植株生物量和根长有明显增长,挺水植物组的溶解氧在初始阶段呈现下降趋势,这主要是植物根系呼吸作用会吸收水体中游离态氧,到试验后期溶解氧浓度有所回升,是由于植物在对污水环境逐渐适应后,植物茎叶组织光合作用产生的氧气通过通气组织输送至植物根系[35],同时,根系具有泌氧作用向水体中释放氧分子,增加水体溶解氧浓度。挺水植物植物对COD没有明显去除效果,对总氮去除效果最好的植物是美人蕉、千屈菜,平均去除率为60.21%、57.83%,对总磷去除效果最好的植物依次是千屈菜、美人蕉、香蒲,平均去除率为73.21%、66.28%、24.57%。实验初期鸢尾对污染水体的不适应造成植株死亡,根部腐烂导致体系呈缺氧状态,体系中发生反硝化使总氮去除效果较好,慈姑抗病虫害能力较弱。组合植物浮床试验中,鸢尾与美人蕉、千屈菜的组合对污染水体的净化效果要明显优于小香蒲与美人蕉、千屈菜的组合,与单一植物浮床试验相比,进行组合植物浮床试验时各组植物都生长良好。综合植物净水效果研究,美人蕉、千屈菜和鸢尾可作为微污染水体的生态修复材料。
研究挺水植物在不同温度下的生长和净水效能,可为水体修复中植物选择提供更有针对性的科学依据。温度是影响植物修复措施处理效果的关键因素,挺水植物生长、生理状况均受到环境温度的影响,水体环境温度过高,将影响植物酶活性、同化能力等,而低温又会影响植物体代谢、根系活性和生物量积累等过程,同时影响水体和植物根际微生物活动。在常温条件下,进水总体均为Ⅴ类~劣Ⅴ类水质条件下,系统出水较为稳定,均可达地表Ⅳ类水质标准,其中氨氮的去除率均在80%以上,污染物去除效果较好;低温条件下,进水浓度与常温环境相差不大,系统对污染物的去除效果明显的下降,TN的出水浓度无法满足入湖库Ⅳ类水的标准,主要是由于温度较低,反硝化菌活性不高导致。在低温环境下,植物系统对TN的去除效果明显的下降,且波动性大,主要原因是在不同温度下植物生长速度有所差异[36],植物吸收是TN去除的主要方式之一,植物在适宜生长温度条件下,植物生长旺盛,植株生物量累积,对养分元素需求量较大。同时,不同温度下植物根际微生物活性存在差异,不同硝化细菌有着不同最适温度,20~25 ℃是大多数硝化菌生长的最适温度,在这一温度微生物活性高,生物脱氮效果好。另外,水体及植物表面附生的硝化细菌,依靠根系泌氧营造的条件进行硝化脱氮,根据接近根系距离的差异,形成了好氧-缺氧-厌氧的微环境[37]。随温度降低,植物根系泌氧能力下降,根系区微环境被破坏,TN去除率下降。复合浮岛系统前期除磷效率较高,说明填料的吸收作用是人工浮岛除磷的主要途径。虽然低温条件下的进水浓度较低,为0.10 mg·L−1左右,高于Ⅳ类水,但各组的出水都没能降到Ⅱ类水,说明植物的生长情况和温度都是影响TP去除的主要因素。
挺水植物复合浮岛系统的优势菌门研究表明,变形菌门是细菌群落中最大的菌门,变形菌门细菌其细胞外膜主要由脂多糖组成,变形门菌具有固氮功能[35]。放线菌门自身可以吸收营养物质,对水体的净化有一定贡献。低温和常温两种条件下,浮岛系统中绿弯菌门均占较大比例,绿弯菌门包括丝状细菌属,在污水处理相关研究中,丝状细菌属在有机物分解及碳循环中具有潜在作用[38]。厚壁菌门和拟杆菌门是两种环境温度下都存在的细菌,厚壁菌门是废水厌氧处理系统中有重要作用的一类微生物,拟杆菌门在产酸阶段有着重要的作用。常温环境下特有的浮霉菌门中一些厌氧氨氧化菌,能在厌氧条件下利用亚硝酸盐氧化铵离子生成氮气,是氮素循环的功能菌。在门分类水平中的微生物菌群结构为系统去除污染物提供了较为稳定的微生物环境,同时也客观的反映出了微生物的菌群结构变化与污染物的降解去除是相关联的[39]。已知放线菌可以分解许多有机物,如芳香化合物等毒性较强的有机化合物,在污水及有机固体废物的生物处理中有积极的作用,放线菌门丰度与污染物去除率呈负相关,也说明放线菌参与了微水体中污染物降解,随放线菌丰度增加而呈现有机物去除效能增加的趋势[40]。在细菌门水平分析的基础上,进一步分析不同温度环境下菌属组成,通过探讨细菌属水平下多样性及优势菌属,为微污染水体水质净化提供依据。
-
水生植物由于其生长特性、配置模式的差异对水体污染物净化效能和水生态景观具有重要影响。通过对5种挺水植物和典型植物浮岛开展水质净化功能研究,比选了单一植物和不同植物组合模式对水体污染物去除效能,提出鸢尾与美人蕉、千屈菜的组合的配置模式优化策略。构建的美人蕉复合人工浮岛系统在常温条件下对污染物去除率较为稳定,初步探究系统中常温环境和低温时特有的微生物菌门,后续还需对植物复合浮岛强化去除污染物、新兴污染物去除机理进行深入的研究,进一步分析系统运行污染负荷、水力停留时间等参数对水质净化效能的影响,从微生物群落结构、功能菌属等特征进行研究,为植物-微生物协同修复水生态环境提供参考建议。
挺水植物浮岛水质净化模拟
Simulation study on water purification of emergent plant floating island
-
摘要: 针对地表水生态系统环境治理与生态保护的实际需求,植物修复技术作为成本较低和适用范围较广的生态修复技术,水生植物类型及配置模式对水质净化功能需系统探讨。为解决微污染水体人工湿地水质净化问题,以美人蕉、千屈菜、香蒲、鸢尾和慈姑5种挺水植物及不同配置模式开展水质净化功能研究,筛选水质净化优势植物基础上探讨不同温度下污染物去除效果。结果表明:水生植物在30 d试验周期内对氨氮 (NH4+-N) 的去除率均大于95%;对总氮 (TN) 和总磷 (TP) 的去除率最高的为美人蕉和千屈菜,其中对TN去除率为60.2%、57.8%,对TP去除率最高为66.3%和73.2%;慈姑因植株枯萎掉落下来进入水体,导致植物向水体释放氮磷,释放率分别为18.7%和43.0%;鸢尾组出现根部腐烂状态,并出现反硝化和TP释放。组合植物试验中,鸢尾与美人蕉、千屈菜的组合对污染水体的净化效果要明显优于香蒲与美人蕉、千屈菜组合,适合运用到湿地等生态修复措施治理微污染水中。水质净化优势植物美人蕉在不同环境温度下净水效能研究表明,低温 (5~10 ℃) 条件下TN平均去除率显著降低,对COD的降解速率影响较小,环境温度20~25 ℃条件下美人蕉对微污染水体COD、NH4+-N、TN和TP的去除效率显著高于低温环境;常温环境下复合浮岛植物根际填料样品的细菌群落多样性高于低温环境,常温环境样品中变形菌门 (Proteobacteria) 为优势菌门,低温环境中优势菌门为绿弯菌门 (Chloroflexi) 。Abstract: According to the actual needs of environmental treatment and ecological protection of surface water ecosystem, phytoremediation technology, as an ecological remediation technology with low cost and wide application range, needs to be systematically discussed for water purification function of aquatic plant types and allocation modes. In this paper, aiming at the water purification problem of constructed wetland in micro-polluted water, five emergent plants, Typha orientalis, Iris tectorum, Canna indica, Lythrum salicaria, Sagittaria trifolia, and their different configuration modes were used to study the water purification function. On the basis of screening the dominant plants for water purification, the pollutant removal efficiency at different temperatures was discussed. The results revealed that the removal rate of ammonia nitrogen (NH4+-N) by aquatic plants in 30 days was more than 95%. Canna and Lythrum groups had the highest removal rates of of total nitrogen (TN) and total phosphorus (TP), and the removal rates of TN were 60.2% and 57.8%, and the removal rates of TP were 66.3% and 73.2%. Sagittaria arrowhead felled into the water body due to withering of plants, which led to the release of nitrogen and phosphorus into the water body, with the release rates of 18.7% and 43.0%, respectively. Root decay, denitrification and total phosphorus release appeared in Iris group. In the combined plant experiment, the combination of Iris, Canna and Lythrum showed better purification effect on polluted water than the combination of Typha, Canna and Lythrum, which was suitable for wetland and other ecological restoration measures to control micro-polluted water. The study on water purification efficiency of Canna, a dominant plant for water purification, at different environmental temperatures showed that the average TN and COD removal rate decreased significantly at low temperature (5~10 ℃). Moreover, the removal efficiency of COD, NH4+-N, TN and TP in micro-polluted water at 20~25 ℃ was significantly higher than that in low temperature environment. The diversity of bacterial community in rhizosphere fillers of composite floating island plants in normal temperature environment was higher than that in low temperature environment. Proteobacteria was the dominant bacterium in normal temperature environment, while Chloroflexi was the dominant bacterium in low temperature environment.
-
Key words:
- slightly polluted water /
- emergent plant /
- water purification /
- low temperature
-

-
表 1 挺水植物水质净化试验中生物量和根长变化
Table 1. Changes of biomass and root length of emergent plants in water purification experiment
测量项目 检测指标 鸢尾 美人蕉 香蒲 千屈菜 慈姑 生物量 初始鲜重/g 33.65±1.26 48.64±6.78 36.12±4.06 21.91±1.80 29.62±2.16 结束鲜重/g 38.35±3.56 67.12±9.74 40.71±7.18 26.51±2.91 29.02±4.11 鲜重增长率 13.91%±3.48% b 38.03%±5.20% a 12.21%±7.23% b 21.07%±3.30% b 5.13%±8.89% b 初始干重/g 21.45±2.20 29.26±4.15 21.28±4.92 10.86±1.28 11.78±2.97 结束干重/g 25.58±2.83 35.72±6.24 25.08±5.72 15.14±0.97 13.18±1.68 干重增长率 19.25±5.50% ab 21.87±9.95% ab 17.92±1.83% ab 39.94±10.16% a 11.86±10.58% b 根长 初始/cm 14.17±1.51 7.15±0.77 18.86±42.21 9.33±1.21 20.94±2.21 结束/cm 20.94±1.56 25.57±4.59 25.42±4.66 18.79±4.21 23.99±2.87 增长率 46.72%±22.00% b 259.86%±72.30% a 34.68%±4.20% b 104.46%±36.77% b 14.80%±4.20% b 注:表中数值为各指标平均值±标准差,不同小写字母为不同处理同一项指标差异显著 (p<0.05) 。 表 2 挺水植物系统对水体总氮和总磷的去除率
Table 2. Removal rate of total nitrogen and phosphorus by emergent plants
% 测量项目 鸢尾 美人蕉 香蒲 千屈菜 慈姑 总氮去除率 62.77~50.23 43.66~48.53 49.76~59.78 37.21~42.08 −19.21~−12.55 总磷去除率 −50.23~−37.52 72.45~80.77 18.27~37.42 60.56~77.15 −45.50~−36.22 表 3 微生物多样性指数统计
Table 3. Statistics of microbial diversity index
样品种类 Ace Chao Coverage Shannon Simpson Sobs 常温20~25 ℃ 1 663 1 660 0.9949 5.858 0.015 1 576 低温5~10 ℃ 1 076 1 061 0.9943 4.623 0.066 968 -
[1] 柏义生, 周国宏, 于鲁冀, 等. 河道水体原位生态净化现场试验[J]. 环境工程, 2019, 37(6): 42-45+116. [2] 李跃平, 刘玉香. 我国微污染水源地污染现状及其处理技术研究进展[J]. 现代化工, 2021, 41(10): 42-46. [3] WURTSBAUGH W A, PAERL H W, DODDS W K. Nutrients, eutrophication and harmful algal blooms along the freshwater to marine continuum[J]. Wiley Interdisciplinary Reviews:Water, 2019, 6(5): e1373. doi: 10.1002/wat2.1373 [4] MAURE E R, TERAUCHI G, I SHIZAKA J, et al. Globally consistent assessment of coastal eutrophication[J]. Nature Communication, 2021, 12(1): 6142. doi: 10.1038/s41467-021-26391-9 [5] 罗伟, 田秋宜. 轻质滤料曝气生物滤池在珠江微污染原水处理中的应用[J]. 城镇供水, 2019, 210(5): 26-30. [6] 丁欢欢. 福州西湖左海湖泊群水流水质改善与引水优化研究[D]. 福州: 福州大学, 2013. [7] 朱小冬, 贠延滨, 马青青, 等. 化学絮凝法和微电解法预处理酯化废水研究[J]. 环境工程, 2016, 34(S1): 373-377. [8] 和丽萍. 利用化学杀藻剂控制滇池蓝藻水华研究[J]. 云南环境科学, 2001(2): 43-44. [9] WANG L K, IVANOV V, TAY J H. , et al. Environmental Biotechnology[M]. Springer Science & Business Media, 2010. [10] RAHMAN M A, HASEGAWA H. Aquatic arsenic: phytoremediation using floating macrophytes[J]. Chemosphere, 2021, 83: 633-646. [11] OJOAWO S O, UDAYAKUMAR G, NAIK P. Phytoremediation of phosphorus and nitrogen with canna x generalis reeds in domestic wastewater through NMAMIT constructed wetland[J]. International Conference on Water Resources, Coastal and Ocean Engineering. Elsevier, 2015, 4: 349-356. [12] GARFI M, FLORES L, FERRER I. Life cycle assessment of wastewater treatment systems for small communities: activated sludge, constructed wetlands and high rate algal ponds[J]. Journal of Cleaner Production, 2017, 161: 211-219. doi: 10.1016/j.jclepro.2017.05.116 [13] LU B, XU Z S, LI J G, et al. Removal of water nutrients by different aquatic plant species: an alternative way to remediate polluted rural rivers[J]. Ecological Engineering, 2018, 110: 18-26. doi: 10.1016/j.ecoleng.2017.09.016 [14] 胡傲, 李宇辉, 杨予静, 等. 不同生长型沉水植物配置对生物量积累和水质净化效果的影响[J]. 湖泊科学, 2022, 34(5): 1484-1492. [15] SUDIARTO S I A, RENGGAMAN A, CHOI H L. Floating aquatic plants for total nitrogen and phosphorus removal from treated swine wastewater and their biomass characteristics[J]. Journal of Environmental Management, 2019, 231: 763-769. doi: 10.1016/j.jenvman.2018.10.070 [16] XU J L, LIU J, HU J, et al. Nitrogen and phosphorus removal in simulated wastewater by two aquatic plants[J]. Environmental Science and Pollution Research, 2021, 28(44): 63237-63249. doi: 10.1007/s11356-021-15206-5 [17] 刘童. 挺水植物浮岛净化太湖流域养殖尾水研究[D]. 徐州: 中国矿业大学, 2021. [18] SU F, LI Z, LI Y, et al. Removal of total nitrogen and phosphorus using single or combinations of aquatic plants[J]. International Journal of Environmental Research and Public Health, 2019, 16(23): 4663. doi: 10.3390/ijerph16234663 [19] SANTOS F S D, MAGALHAES M O L, MAZUR N. Chemical amendment and phytostabilization of an industrial residue contaminated with Zn and Cd[J]. Scientia Agricola, 2007, 64: 506-512. doi: 10.1590/S0103-90162007000500008 [20] KNAUER K, MOHR S, FEILER U. Comparing growth development of Myriophyllum spp. in laboratory and field experiments for ecotoxicological testing[J]. Environmental Science and Pollution Research, 2008, 15: 322-331. doi: 10.1007/s11356-008-0008-1 [21] VALIPOUR A, RAMAN V K, GHOLE V S. Phytoremediation of domestic wastewater using Eichhornia crassipes[J]. Indian Journal of Environmental Health, 2011, 53: 183-190. [22] WANG Z, ZHANG Z, ZHANG J, et al. Large-scale utilization of water hyacinth for nutrient removal in lake Dianchi in China: the effects on the water quality, macrozoobenthos and zooplankton[J]. Chemosphere, 2012, 89: 1255-1261. doi: 10.1016/j.chemosphere.2012.08.001 [23] MOYO P, CHAPUNGU L, MUDZENGI B. Effectiveness of water Hyacinth (Eichhornia crassipes) in remediating polluted water: the case of Shagashe river in Masvingo, Zimbabwe[J]. Advances in Applied Science Research, 2013, 4: 55-62. [24] 宋涛, 王玉杰, 罗雪梅, 等. 不同挺水植物对模拟污水中C、N净化效果研究[J]. 四川环境, 2022, 41(5): 12-16. [25] ZHANG P, KURAMAE A, VAN LEEUWEN C H A, et al. Interactive effects of rising temperature and nutrient enrichment on aquatic plant growth, stoichiometry, and palatability[J]. Frontiers in Plant Science, 2020, 11: 58. doi: 10.3389/fpls.2020.00058 [26] CUI J, WANG W, LI J, et al. Removal effects of Myriophyllum aquaticum on combined pollutants of nutrients and heavy metals in simulated swine wastewater in summer[J]. Ecotoxicology and Environmental Safety, 2021, 213: 112032. doi: 10.1016/j.ecoenv.2021.112032 [27] 葛光环, 王秋利, 寇坤, 等. 陕西瀛湖水中高pH值原因分析及防控对策研究[J]. 环境科学与管理, 2022, 47(10): 89-93. [28] 赵家楠. 微生物驱动的水生植物凋落物分解过程及机制[D]. 保定: 河北大学, 2022. [29] 汤鹏. 不同水生植物配置对微污染水体的净化效果及相关机理研究[D]. 郑州大学, 2021. [30] LI J F, WANG Y H, CUI J W, et al. Removal effects of aquatic plants on high-concentration phosphorus in wastewater during summer[J]. Journal of Environmental Management, 2022, 324: 116434. doi: 10.1016/j.jenvman.2022.116434 [31] 李燕彬. 城市小微湿地景观植物配置技术初探——以北京市北辰中心花园小微湿地为例[J]. 现代园艺, 2021, 44(15): 26-31. [32] HU M H, YUAN J H, YANG X E, et al. Effects of temperature on purification of eutrophic water by floating eco-island system[J]. Acta Ecologica Sin, 2010, 30(6): 310-318. doi: 10.1016/j.chnaes.2010.06.009 [33] 林海, 蔡怡清, 李冰, 等. 北京市妫水河底泥微生物群落结构特征[J]. 生态学报, 2019, 39(20): 7592-7601. [34] GAO Y, WANG C C, ZHANG W G, et al. Vertical and horizontal assemblage patterns of bacterial communities in a eutrophic river receiving domestic wastewater in southeast China[J]. Environmental Pollution, 2017, 230: 469-478. doi: 10.1016/j.envpol.2017.06.081 [35] 许巧玲, 汪丽, 张凤, 等. 8种水生植物对高污染负荷水体除污能力的筛选[J]. 园艺与种苗, 2021(12): 49-52. [36] 杨海清, 李秀艳, 赵丹. 植物-水生动物-填料生态反应器构建和作用机理[J]. 环境工程学报, 2008, 2(6): 852-857. [37] SU Z G, DAI, T J, TANG Y S, et al. Sediment bacterial community structures and their predicted functions implied the impacts from natural processes and anthropogenic activities in coastal area[J]. Marine Pollution Bulletin, 2018, 131(6): 481-495. [38] ZHENG J F, CHEN J H, PAN G X, et al. Biochar decreased microbial metabolic quotient and shifted community composition four years after a single incorporation in a slightly acid rice paddy from southwest China[J]. Science of the Total Environment, 2016, 571(15): 206-217. [39] 徐震. 生物栅对景观水体的处理效果及微生物多样性研究[D]. 合肥: 安徽建筑大学, 2019. [40] 刘幸春, 王洪杰, 王亚利, 等. 府河水体及沉积物细菌群落结构分布特征及其影响因素[J]. 生态毒理学报, 2021, 16(5): 120-135. -




 下载:
下载: