-
进口废塑料在缓解原材料压力的同时,给我国生态环境和人们生命健康带来很大威胁。为了应对这一问题,我国于2017年颁布了《禁止洋垃圾入境推进固体废物进口管理制度改革实施方案》,从而使我国从最大废塑料进口国变为最大再生塑料颗粒进口国[1-2]。塑料生产过程中,Cr、Cd、Hg、Pb、Mn和Cu等重金属随稳定剂或无机颜料等添加剂进入产品,从而对使用者的健康构成潜在威胁[3-9]。尽管废塑料鉴别技术不断更新并且我国加大了对废塑料进口的限制力度[10-13],但我国海关仍多次在进口再生塑料颗粒中发现夹杂废塑料的情况[14-15],这意味着废塑料潜在风险并未完全消除。有文献曾报道国内一次性塑料食品容器中多种金属对人体存在不可忽略的健康风险,其中可能就存在违规生产的再生塑料食品接触产品[16-18]。此外,一些欧美国家目前已允许再生塑料颗粒用于制造食品接触产品,并有可能使再生塑料以产品形式直接进入中国人民的日常生活[19-21]。掺加再生塑料颗粒的食品接触产品在日常生活中可能无法完全避免,因此研究进口再生塑料颗粒中重金属在不同食物液中的浸出特性、并评估长期暴露可能带来的健康风险对其后续加工与利用具有重要意义。
再生塑料颗粒用于制造食品接触产品的人体健康风险评估在我国暂无成型评估框架,但在欧美等国家或地区相对较成熟,其中美国食品局 (US FDA) 提出的评估框架已得到广泛应用[22-24]。HUANG等 [25]引入FDA框架,采用传统危害商(HQ)和危害指数(HI)对再生塑料分类工厂内工人的健康风险进行评估,提出Cr和As在皮肤暴露下致癌风险分别超过EPA建议的不可接受水平38和2倍,存在严重致癌风险。张杰聪等[26]采用类似的评估方法,对婴幼儿经口摄入再生与非再生塑料儿童玩具中重金属的健康风险进行评估,发现再生PP玩具中多种重金属对婴儿的危害指数均高于非再生PP玩具。美国卫生与公众服务部有毒物质和疾病登记署(ATSDR)发布的《联合毒性行为评估指导手册》提出TTD法,考虑到多种重金属的联合毒性[27]。ZOU等[28]引入TTD修正的HI评估中药中重金属的潜在健康风险,发现传统评价方法下健康风险处于可接受水平,而TTD修饰后的HI显示多个靶器官存在不可接受的健康风险。上述研究主要采用传统HQ和 HI评估重金属的人体健康风险,然而实际情况下可能存在多种污染物混合暴露和相互作用,导致在一定程度上可能低估或者高估其健康风险[29-32]。为更准确地评估混合污染物暴露下的健康风险,故采用TTD修饰的HI方法进行风险评估。
基于此,本研究通过检测5种典型进口再生塑料颗粒中重金属在食物模拟液中的浸出浓度,采用传统HI和TTD法估算其经口摄入的健康风险水平,以期为进口再生塑料颗粒风险管理与利用提供一定科学依据。
-
进口再生塑料颗粒样本均取自成都某检测机构,包括聚丙烯(PP)颗粒 (黑、灰、绿和白色) 、聚乙烯(PE)颗粒 (黑、灰和棕色) 、聚苯乙烯(PS)颗粒 (黑、白、绿、茶、黄和褐色) 、聚对苯二甲酸乙二醇酯(PET)颗粒 (黑、绿、灰、黄、蓝、棕色和透明) 和丙烯晴-丁二烯-苯乙烯共聚物(ABS)颗粒 (黑、白、灰和黄色) 5类。将所有颗粒采用超声波清洗器清洗5 min。目测其均为圆柱状、无杂质、无油污、无明显色差,直径2.0~2.5 mm,高2.5~3.0 mm。
-
暴露场景设置:根据相关规范及相关文献[33-35],选取3.00%和50.00%乙酸溶液分别模拟2种浓度的酸性食物,10.00%乙醇溶液模拟含酒精食物,95.00%乙醇溶液模拟脂肪类食物;选取3个温度25、40和70 ℃分别模拟室温、常见加热和模拟加热温度。依据标准[36]要求,将每种场景模拟液体积设置为6.00 mL,预热至指定温度后需加入10个进口再生塑料颗粒,浸泡10 d。
重金属浓度检测:根据《固体废物 金属元素的测定 电感耦合等离子体质谱法》 (HJ766—2015) [37]处理样品并测定Cd、Cr、Pb、Mn、Cu含量,采用ICP-MS测定;根据《固体废物 汞、砷、硒、铋、锑的测定 微波消解/原子荧光法》 (HJ702—2014) [38]处理样品并测定Hg含量,采用原子荧光光谱分析测定。
-
1) 暴露量计算模型。根据EPA发布的人体健康评估手册[39],在本模型中,污染物质主要暴露途径是通过饮食摄入,暴露介质主要是食物模拟液。将相关参数和模拟液中污染物浓度代入式(1)可得各重金属日均暴露量。
式中:LADD、ADD分别为致癌物质日均暴露量和非致癌物质日均暴露量,mg·(kg·d)−1;C为模拟液中污染物的浸出浓度,mg·L−1,由1.2测得;IR为日均饮食摄入量,取1 L·d−1[40];EF为暴露频率,取365 d·a−1;ED为暴露年限,致癌物质70 a,非致癌物质30 a[40];BW为体重,取值60.60 kg[41];AT为平均作用时间,致癌物质取值25 550 d,非致癌物质取值10 950 d [42]。
2) 风险表征计算模型。根据ATSDR的风险计算公式[27],由式(2)、(3)可得致癌风险指数,根据式(4)、(5)可得传统非致癌风险指数,根据式(7)、(8)可得TTD修正后的非致癌风险指数。式(6)为California成人血铅模型[43]。
式中:
Rci 为第i种致癌污染物的致癌风险,无量纲;LADDi 为第i种致癌污染物的日均暴露量,mg·(kg·d)−1;Qi为致癌强度系数,mg·(kg·d)−1;SF为致癌斜率因子,mg·(kg·d)−1;RC为总致癌风险指数,无量纲。式中:HQi为第i种非致癌污染物的非致癌危害商,无量纲;
ADDi 为第i种致癌污染物的日均暴露量,mg·(kg·d)−1;MRL为非致癌最低风险水平,mg·(kg·d)−1;HI为总非致癌风险指数,无量纲。式中:ΔPbB表示血铅浓度增加量,ug·dL−1;1 000为单位换算;SF0为摄入斜率因子,(ug·dL−1) per ( ug·d−1),取值0.04;HQiendpoint为第i种非致癌污染物对靶器官的非致癌危害商,无量纲;TTDiendpoint为污染物i对靶器官的毒性剂量,mg·kg−1·d−1;HIendpoint为靶器官总非致癌风险指数,无量纲。
-
图1显示了5种进口再生塑料颗粒在不同温度和不同食物模拟液中的重金属浸出浓度检测结果。对比我国现行《生活饮用水卫生标准》 (GB5749—2022) [44]限值可知,ABS塑料颗粒中Cr在温度40 ℃+3%乙酸下浸出除外,在所有模拟食物场景下,这些塑料颗粒中Cr和Hg浸出浓度都超出限值,分别超标1.25~38.27和0.47~1 243.04倍,平均超标倍数分别为16.21和1 120.00倍,存在严重安全隐患。主要在2类酸性食物模拟液中,发现Cd、Pb和Mn浸出浓度超标,且主要来源于ABS、PE和PET这3类塑料颗粒。特别是ABS塑料颗粒,在温度40 ℃+3%乙酸和温度70 ℃+50%乙酸的浸出条件下,Pb浸出浓度分别超标高达50.06和41.90倍,存在严重安全隐患。然而,在所有模拟食物场景下,Cu浸出浓度均未超标,不存在安全隐患。
经分析发现,在同种模拟液中,温度越高这5种重金属浸出浓度普遍越高。塑料中重金属在模拟液中的浸出与扩散依赖分子热运动,当实验温度升高,模拟液对塑料颗粒的溶胀作用更明显,使得塑料分子间距更大,从而重金属更易扩散到溶剂中,同时分子热运动也更加剧烈,因此高温下重金属浸出浓度更高[45-47]。这与彭湘莲等[48]对纸塑包装容器中和CHENG等[49]对回收塑料瓶中重金属浸出结果相似。此外,还发现在酸性食物模拟液中,这些进口再生塑料颗粒中6种重金属的浸出浓度普遍高于含酒精和脂肪类食物模拟环境,且酸性越大浸出浓度越大,这说明浸出液pH越低越有利于塑料颗粒中重金属的浸出。这与TUDI等[50]研究不同浸出溶液下,农用聚乙烯塑料制品中重金属的浸出浓度的研究结果相似。值得注意的是,在25和40 ℃模拟食物温度下,存在ABS中重金属在10%乙醇溶液中浸出浓度最高的情况;在70 ℃模拟食物温度下,则存在乙醇溶液中重金属浸出浓度高于3%乙酸溶液的情况。这是因为在此温度下,部分塑料在乙醇溶液中溶胀作用更明显,导致分子间距增大使重金属更易溶出。然而,SHAMIMA等[51]对食品接触塑料包装中重金属在不同溶剂中的浸出浓度的研究结果与此相反,在15%乙醇溶液中的浸出浓度普遍高于3%乙酸溶液,只有少部分情况下3%乙酸溶液中浸出浓度高于15%乙醇,这说明乙醇溶液对塑料颗粒中重金属浸出存在一个最佳浓度。然而,当温度升高到70 ℃时,塑料加速老化,导致塑料颗粒中的孔隙增多、与各种添加剂的附着力下降低,此时溶解度又重新变为造成重金属浸出浓度差异的主导因素,因此ABS中6种重金属浸出浓度最高的场景又重新变成50%乙酸,这与MAO等[52]研究再生电子塑料产品中重金属浸出的研究结果相似。
-
根据世界卫生组织国际癌症研究机构发布的致癌物清单,具有致癌风险的重金属是Cd和Cr,不具有致癌风险的是Pb、Hg、Mn和Cu,因此本研究只考虑Cd和Cr的致癌影响。首先根据公式(1)计算各污染物每日经口摄入量,然后参考相关文献得Cr 、Cd的经口摄入致癌强度系数分别为0.5、6.1 mg·(kg·d)−1[53, 54],并将其带入公式(2)可得致癌风险,计算结果如图2和图3所示。根据US EPA的规定,当致癌风险指数小于10−6时,不存在致癌风险;在10−6~10−4范围内,可能存在致癌风险;而大于10−4时,存在较高致癌风险。在所有模拟食物场景下,5种进口再生塑料颗粒中Cr和Cd致癌风险商都超过安全阈值,2者分别超标200.22~1 6201.04倍和14.66~2 149.29倍,然而,总致癌风险指数超出可能致癌水平上限8.09~165.10倍。由此可见这些塑料颗粒中重金属通过饮食途径摄入时存在较高致癌风险,而Cr非致癌风险更严重。在所有模拟场景下,ABS颗粒中Cd致癌风险商明显高于其它种类塑料颗粒;而在酸性食物模拟液中,PET颗粒中Cr致癌风险商明显高于其它塑料颗粒。此外,在加热和乙酸场景下,这2种重金属的致癌风险普遍更高。上述结果与其浸出规律大体一致,说明重金属浸出直接造成人体致癌风险。
-
1) 常规非致癌危害指数。根据ATSDR于2023年发布的最新版最低风险水平(MRLs),只有Cd和Cr具有口服慢性最低风险水平,其值分别为0.000 1和0.000 9 mg·(kg·d)−1[55]。至于Mn、Cu、Pb和Hg,他们的MRL参考文献取值分别为0.070 0、0.140 0、0.003 5、0.002 0 mg·(kg·d)−1[56-58]。将上述参考值和相关参数代入公式(4)、(5)可以估算其传统非致癌风险指数,结果见图4。
根据US EPA规定,非致癌风险安全限值为1。在所有模拟食物场景下,5种进口再生塑料中Cr非致癌危害商普遍超过安全限值,超标倍数为0.45~36.00倍。在酸性食物模拟场景下,ABS中Cd和Pb非致癌商超过安全阈值。在酸性和含酒精食物模拟场景下,PET中Hg的非致癌危害均超过安全阈值,这些场景都存在不可接受非致癌风险。在所有模拟食物场景下,5种进口再生塑料中Mn和Cu非致癌危害均低于安全阈值,因此不存在非致癌风险。然而,在所有模拟食物场景下,PET、PE、ABS、PS和PP中6种重金属的总非致癌风险指数分别超过安全阈值11.31~35.79、13.73~23.30、3.11~23.89、9.52~18.50和1.24~19.63倍。因此总体呈现严重非致癌风险,且Cr非致癌风险普遍是Cd的10倍左右,是Mn、Cu、Pb和Hg的100倍左右。PET、PE、PS和PP中6种重金属在各食物模拟液中总非致癌风险呈现50%乙酸>3%乙酸>10%乙醇>95%乙醇的规律。且同种模拟液中,70 ℃高温模拟食物场景下的总非致癌风险指数均高于25 ℃和40 ℃的模拟食物温度。上述结果与重金属浸出浓度一致,表明食物模拟液中重金属浓度直接影响人体非致癌风险。尽管上述方法也能对污染物起到快速筛选的作用,但实际多种污染物混合暴露时存在毒性重叠靶点,因此在以下研究的风险评估中引入靶器官毒性剂量对人体非致癌风险进行修正。
2) 基于靶器官毒性剂量的非致癌危害指数。重金属对各靶器官的毒性剂量详见表1。其中,Pb的靶器官毒性剂量以血铅浓度 (ug·dL−1) 为单位,需先用公式(6)将Pb通过饮食摄入的日均暴露量换算成血铅浓度,再根据公式(7)、(8)得到靶器官非致癌风险指数,结果见图5。在所有模拟食物场景下,PET、PE、ABS、PP和PS进口再生塑料颗粒中6种重金属的总非致癌风险指数分别超过安全阈值17.55~54.43、21.38~43.58、8.34~40.59、2.70~32.65和14.73~28.36倍,与修正前相比,考虑靶器官毒性剂量修正后的总非致癌风险指数增加了0.38~1.46倍,这表明常规方法明显低估了进口再生塑料颗粒的非致癌风险。
不同食物模拟场景下,对各靶器官的非致癌风险指数见图6。在所有模拟场景下,5种进口再生塑料颗粒中6种重金属对肠胃道、血液、肾脏和神经系统的非致癌风险指数呈下降趋势,且普遍高于安全阈值2倍以上,存在非致癌风险。其中,对肠胃道的非致癌风险远高于其他3种靶器官。这可能是因为Cr在摄入后首先刺激肠胃道,且只有少量重金属能够被肠胃道吸收并随体液循环到其他靶器官。此外,肾脏对重金属也具有一定消除作用。在所有模拟食物场景下,5种进口再生塑料颗粒中6种重金属对睾丸、心血管和肝脏的非致癌风险指数呈下降趋势,且普遍低于安全阈值。其中,对肝脏的非致癌风险远低于其他2种靶器官,可能因为该靶器官对各重金属赋存量少且肝脏能通过胆汁排泄而消除一部分污染物。然而,在温度为40 ℃的3%乙酸和温度为70 ℃的50%乙酸中,ABS中重金属对心血管的非致癌危害超过安全阈值1倍左右,存在非致癌风险。可能是因为此模拟食物场景下,Pb的溶解度增大,而心血管的靶器官非致癌危害主要来自Pb和Cd。
-
1) 根据我国现行饮用水安全标准,在酸性食物模拟液和加热条件下,5种进口再生塑料颗粒中Cr、Hg、Cd、Mn和Pb浸出浓度超标更严重。结合重金属浸出影响因素,高温和酸性环境有利于重金属浸出,从而对人体健康构成更大的风险。
2) 5种进口再生塑料颗粒中Cr和Cd通过饮食途径摄入的致癌风险商都超过安全阈值,总致癌风险指数超过可能致癌最高限制,表明存在较高致癌风险。并且这些塑料颗粒在50%乙酸模拟酸性食物溶液中致癌风险最严重,分别平均是3%乙酸、10%乙醇和95%乙醇的1.26、1.40和1.77倍。
3) 5种进口再生塑料颗粒中靶器官毒性剂量修正的非致癌风险指数平均是传统HI法的1.55倍,且都超过安全阈值,表明存在非致癌风险。对各靶器官平均非致癌风险排序为肠胃道>血液>肾脏>神经系统>睾丸>心血管>肝脏。此外,Cr的致癌危害与非致癌危害均普遍是其他几种重金属的10倍以上,Cr的健康风险需着重关注。
4) 建议管理部门加大对相关生产企业原材料的检查力度,杜绝已禁止的再生塑料颗粒进入食品接触产品制造行业。建议加大对塑料产品流通领域的抽查力度,未来需重点关注平价塑料制品尤其是食品接触产品,对其中重金属和其他添加物含量进行检测,对不同食物和温度接触下塑料产品中污染物浸出导致的人体健康风险进行更细致的评估。
进口再生塑料颗粒重金属浸出特征及健康风险评价
Heavy metals leaching characteristics and health risk assessment of imported recycled plastic particles
-
摘要: 为了评价进口再生塑料颗粒中主要重金属经口摄入的潜在健康风险,选取了5类典型进口再生塑料颗粒,基于美国环保署(US EPA)人体健康风险评估框架,通过检测其在食物模拟液中Hg、Pb、Cr、Cd、Mn和Cu的浸出浓度,对其饮食摄入途径下的致癌/非致癌风险进行量化评价,并采用靶器官毒性剂量(TTD)法对非致癌风险指数进行修正。结果表明,参照我国饮用水标准,Hg、Pb、Cr、Cd和Mn浸出浓度超标倍数分别高达1 243.04、50.06、38.27、3.27和2.96倍,而Cu未超标,总体上存在严重健康风险。致癌风险结果显示,在所有模拟场景下,5种进口再生塑料颗粒中重金属致癌风险指数平均超过可能致癌水平上限70.28倍。非致癌风险结果显示,在所有模拟场景下,5种进口再生塑料颗粒中重金属传统非致癌风险指数和靶器官毒性剂量修正的非致癌风险指数分别平均超过最高上限15.26倍和23.71倍,其中肠胃道、血液、肾脏和神经系统存在不可接受非致癌风险,睾丸、心血管和肝脏不存在非致癌风险。这表明进口再生塑料颗粒所带来潜在健康风险仍需持续关注。Abstract: To assess the potential health risks of major heavy metals from orally ingested imported recycled plastic particles, five typical imported pellets of recycled plastic were selected. Based on the US Environmental Protection Agency (US EPA) human health risk assessment framework, the leaching concentrations of Hg, Pb, Cr, Cd, Mn, and Cu in food simulant liquids were measured to quantitatively evaluate the carcinogenic/non-carcinogenic risks under dietary exposure pathways. The Target Organ Toxicity Dose (TTD) method was used to adjust the non-carcinogenic risk index. The results showed that compared to the drinking water standards in China, the exceedance multiples of leaching concentrations for Hg, Pb, Cr, Cd, and Mn were as high as 1 243.04、50.06、 38.27、 3.27 and 2.96 times, respectively, while Cu was within the limits. Overall, there were significant health risks. The carcinogenic risk results indicated that the average carcinogenic risk indices of heavy metals in the five imported pellets of recycled plastic exceeded the highest upper limit by 70.28 times in all simulation scenarios. The non-carcinogenic risk results showed that the average traditional non-carcinogenic risk indices and TTD non-carcinogenic risk indices in all simulation scenarios exceeded the highest upper limit by 15.26 and 23.71 times, respectively. Unacceptable non-carcinogenic risks were observed in the gastrointestinal tract, blood, kidneys, and nervous system, while no non-carcinogenic risks were found in the testes, cardiovascular system, and liver. This indicates that continuous attention should be paid to the potential health risks posed by imported recycled plastic particles.
-
重金属元素不易溶于水,治理困难,污染危害大,从而对人类的健康状况产生了非常不利的影响[1]。目前,对重金属污染土壤的修复技术主要以物理化学法为主,以电动法、微生物法和联合修复为辅[2]。电动法是在电场的作用下,以电透渗或电迁移的方式向电极运输土壤中的重金属离子(如Pb、Cd、Cr、Zn等),再集中收集处理。ALLIOUX等[3]开发了一种新的装置,从液体中脱盐并回收珍贵金属离子,如铜、锌、镍、银和锌/铜离子混合物,然后通过简单的电氧化工艺,使金属沉积后得以回收。有研究[4]发现,脱除某些元素(如Hg)或导电性不良的矿物(如某些硫化物)时,添加适当的化学药品,在约3个月内,通过与植物技术的联用,脱除了60%的Hg。微生物对于土壤改善和污染治理也具有优良的效果,主要通过对污染物的吸附作用、污染物形态的形态转换以及污染物之间的电子转移,达到脱除重金属的目的[5]。在众多微生物中,嗜酸性氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans, A.f)是一种具有极强耐受性的好氧菌,长期生活在高浓度重金属环境中的A.f菌能形成一定的耐性和抗性[6],驯化后对重金属具有良好的脱除效果。
把微生物和电化学技术联合起来,已成为当今的研究热点,有利于提高生物修复的修复效率。虽然GILADI等[7]发现,微弱的电场作用可以抑制金黄色葡萄球菌(Staphylococcus aureus, S.aureus)的生长。但也有研究[8]表明,通过施加10~100 mA直流微弱电流能够刺激大肠杆菌(Escherichia coli)的生长和活动,这表明施加微弱的直流电可以加速微生物的生长。MAILLACHERUVU等[9]发现,在0.46 V·cm−1的电场强度下,有利于好氧微生物的培育,有利于增加微生物活性。
本研究针对实际电子废物拆解场地的重金属污染土壤,通过施加不同强度的微弱直流电,研究弱电场条件下嗜酸氧化亚铁硫杆菌对污染土壤中重金属脱除的影响。在保证对土壤扰动小、不易造成二次污染和低成本等优点的前提下,有效解决微生物修复土壤耗时长、效率低的缺陷。研究结果不仅可以提高污染土壤的重金属脱除效率,也为电化学与微生物联合修复土壤的实际应用提供了参考。
1. 材料与方法
1.1 供试材料
本实验使用的土壤样品按《土壤环境监测技术规范》中的相关要求[10],在浙江省温岭某电子废弃物拆解场地附近多点混合取样,采集0~20 cm表层土壤混合样品。土样经剔除植物根系、石砾后过100目筛,密封保存备用。采用HNO3-HF-HCl消解体系[11]对制备土样进行微波消解。
完全消解后,测定得到供试土壤的基本特征:pH为8.1,含水率为4.3%,有机质含量为6.7%,Zn、Cu、Ni、Cd、Cr的质量分数分别为(18 000 ±100.5)、(3 973 ±36.4)、(368 ±22.7)、(41 ±1.3)、(502±31.6) mg·kg−1。
供试菌种从德兴铜矿区土壤样品中筛选并分离得到,后经过实验室多次驯化富集[12]。
9K培养基配方:硫酸铵((NH4)2SO4)3 g·L−1、磷酸氢二钾(K2HPO4)0.5 g·L−1、氯化钾(KCl)0.1 g·L−1、七水硫酸镁(MgSO4·7H2O)0.5 g·L−1、硝酸钙(Ca(NO3)2)0.01 g·L−1、七水硫酸亚铁(FeSO4·7H2O)44 g·L−1。用浓硫酸(H2SO4, 40%)稀释过后的溶液调pH至2.0。
实验仪器包括:高纯度石墨电极(C, 99.9%,上海碳素厂);精密电子天平(AL204,瑞士MEMETTLER TOLEDO公司);移液枪(BIOHIT,赛默飞世尔科技中国有限公司);pH/电位计(STARTER3100,上海奥豪斯仪器有限公司);恒温振荡培养箱(ZHWY-2112B,上海智城分析仪器有限责任公司);微波消解仪(ANTON PAAR);电感耦合等离子体光谱仪(ICAP-7200,赛默飞世尔科技中国有限公司);紫外可见光分光光度计(TU-1810D,北京普析通用仪器有些责任公司)。
1.2 实验方法与分析方法
称取1 g制备土样,加入至盛有50 mL 9K培养基的150 mL的特制封闭电解容器中。初始pH为2,再向9K培养基接入体积分数10%的A.f菌,将2根直径6 mm石墨电极插入后将容器封闭,保证在通气的条件下尽可能地减少液体的损失,电极间距离为5 cm。将装置放于温度30 ℃、转速100 r·min−1的恒温水浴摇床中,连接直流稳压电源进行培养。设置3个电流强度处理,分别是20、60和100 mA,每个处理外加1个不加电场的空白对照组(CK1)和1个不接菌种的空白对照组(CK2),每个处理重复3次。周期为5 d。
在第0、1、2、3和5 天采集石墨电极以及培养基的样品。用5%HNO3消解石墨电极表面的电沉积并定容于50 mL容量瓶内。在培养基样品与电沉积消解后,样品按1∶20与1∶100比例用5%HNO3稀释,供分析目标重金属含量用。
对采集的土壤样品利用紫外可见光分光光度计测定有机质质量比[13];利用pH计、氧化还原电位仪对试验过程中的pH、Eh进行测定;用ICP-OES分析稀释后的液态样品中重金属Zn、Cu、Ni、Cd、Cr的浓度。
2. 结果与讨论
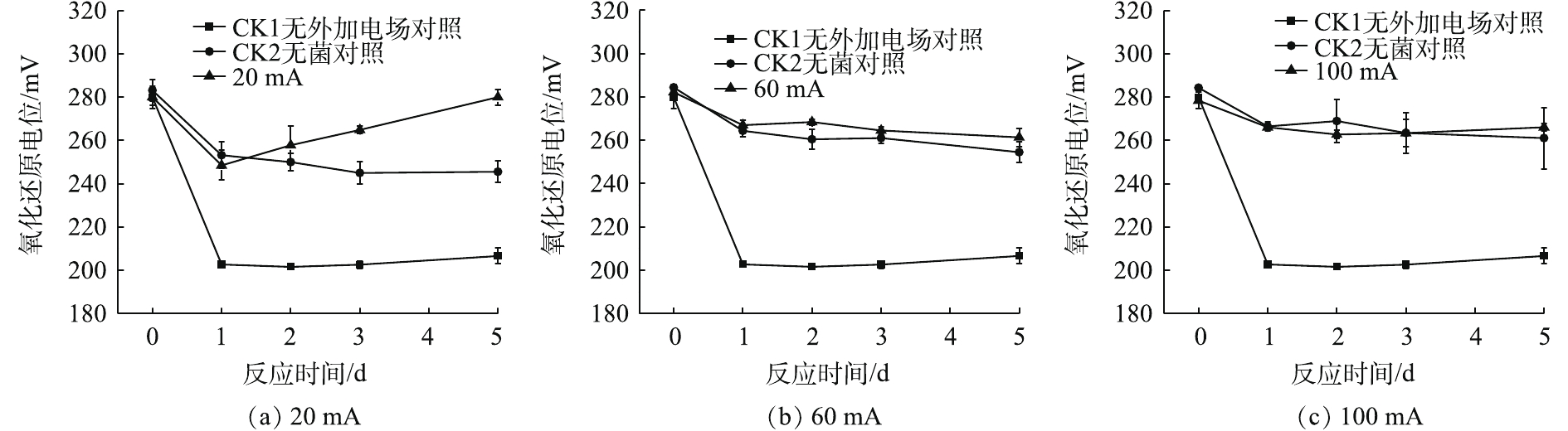
2.1 A.f菌在不同电流强度下pH的变化
如图1(a)所示,与2组对照相比,20 mA实验组菌液的pH随时间的变化呈现小幅度上升,随后下降并趋于稳定。在0~1 d上升趋势明显;在1~2 d呈下降趋势;在3~5 d变化不明显,且pH稳定在2.1。加菌无电场对照组(CK1)在0~1 d上升,其pH在1~5 d维持在3.5左右;加电场无菌对照组(CK2)在第5天的pH保持在2.6左右,变化趋势略同于CK1对照组。
由图1(b)和图1(c)可以看出,施加60 mA与施加100 mA电流强度的实验组pH在第1 天后变化不明显,5 d后,pH稳定在2.3。与CK2对照相比,施加60 mA与施加100 mA的实验组随时间变化不明显,变化曲线大致相同。综上所述,在电场的作用下,对于电子废物拆解场地的重金属污染土壤来说,施加60 mA与100 mA的微弱电流后,5 d后的pH为2.3。
当A.f菌用于生物淋滤系统时,系统中pH的下降是嗜酸微生物大量繁殖的标志[14]。在厌氧条件下,A.f菌可以氧化元素硫并还原三价铁,出现了细胞的增殖[15],同时产生H+,降低pH,反应过程见式(1)。
S+6Fe3++4H2O→HSO−4+6Fe2++7H+ (1) 土壤的缓冲作用会让pH在第1 天有一定程度的上升。当系统施加微弱直流电后,菌液中仍存在微弱的电化学作用,阳极得到电子,导致H2的产生,从而使H+浓度略微下降。当菌液中发生电解水反应时,阳极所产生的H+形成了一个向阴极移动的酸区;阴极产生的OH−形成一个向阳极移动的碱区。当酸区的移动速度大于碱区时,使原本酸性菌液的pH呈现下降趋势[16],所以pH在第1天后下降。因此,在20 mA直流稳压电场的作用下,微电场可为A.f菌创造更加适宜的生存环境。
2.2 A.f菌在不同电流强度下氧化还原电位(Eh)的变化
如图2所示,在9种处理中,5 d后,施加20 mA的微弱电流的实验组氧化还原电位(Eh)最高,呈上升趋势,与2组对照相比,变化各不相同。由图2(a)可以看出,20 mA实验组在1 d后的ORP下降到245 mV;在5 d后,Eh达到280 mV。CK1对照组的上升趋势不明显,5 d后的Eh维持在200 mV;CK2对照组在1~3 d呈现下降趋势,并在3~5 d稳定在250 mV。
由图2(b)与图2(c)可知,在60 mA与100 mA电流强度的条件下,实验组与相应的CK2对照组的Eh变化规律大致相同。在电化学反应的作用下,5 d后的Eh达到260~270 mV,高于20 mA电流强度条件下的CK2对照组。综合来看,20 mA实验组的Eh更高,变化更明显。这说明在微电场的作用下,整个体系的氧化还原能力更强。
对A.f菌施加20 mA的微电场,Eh明显升高。在生物电化学反应中,氧还原反应是生物呼吸等生命过程中最重要的反应,也是能源转换系统的重要反应[17]。从图2(a)中可以看出,20 mA实验组的Eh明显上升,这是微生物和电化学共同作用的结果,外加适宜强度的直流电不仅可以促进细菌生长,加速菌体生长代谢的过程,还能增加细胞膜的通透性[18]。在生物淋滤系统中,Eh也是反映菌种生物活性的标志之一[14],同时体现了体系中金属离子氧化还原能力的强弱,Eh的上升有利于污染土壤中重金属的脱除。综上所述,对A.f菌施加20 mA的微电场,不仅增强了A.f菌的活性,也利于在石墨电极上还原金属离子。
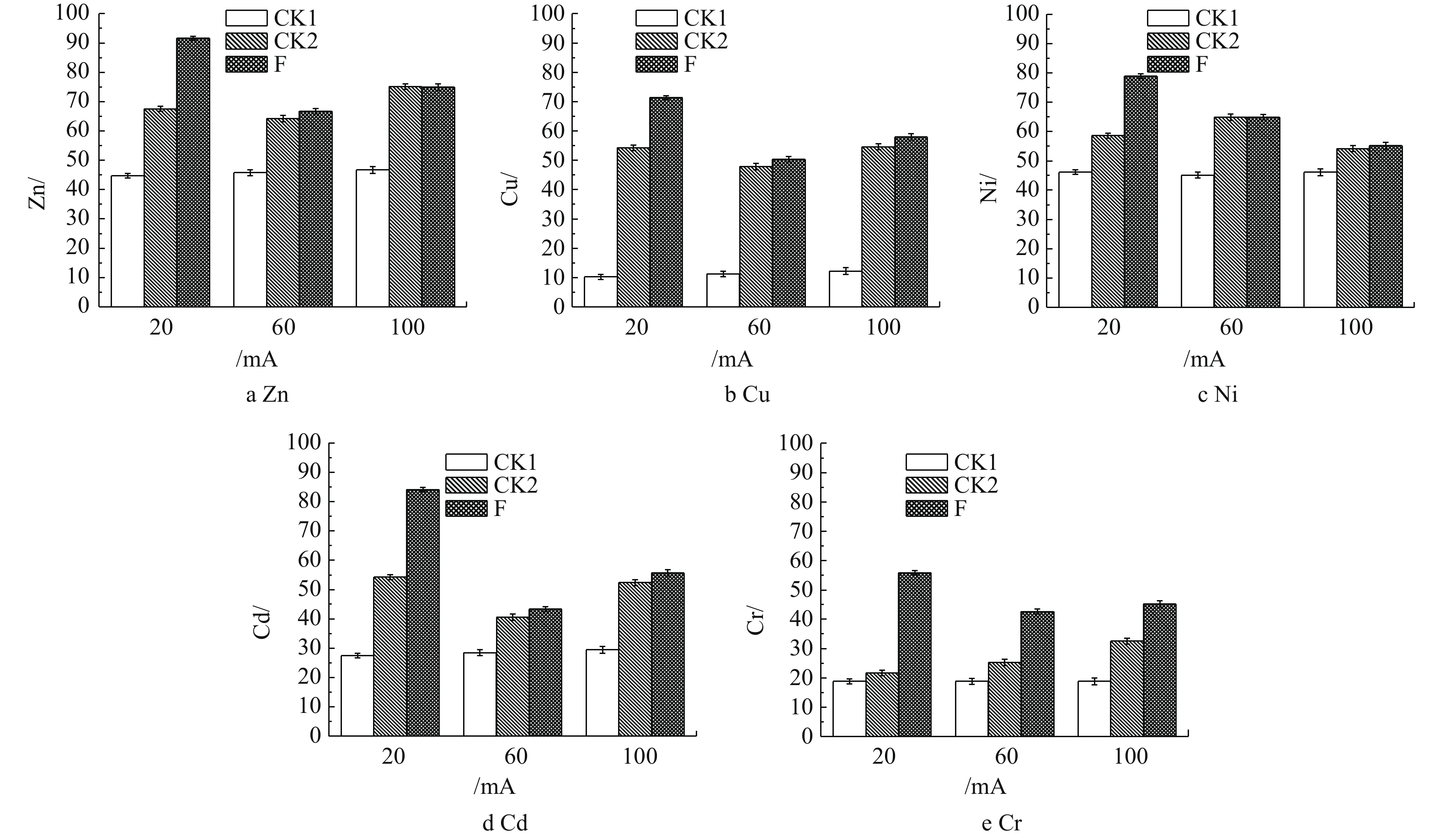
2.3 不同电流强度对重金属脱除率的影响
由图3可知,在电流强度为60 mA和100 mA时,在相应电流强度下,CK2对照组相比于F实验组对土壤中Zn、Cu、Ni、Cd和Cr脱除率的提升不明显。这说明在电流强度为60 mA与100 mA的条件下,整个体系的反应以电场作用为主导,且这样的电流强度对A.f菌淋洗土壤中的重金属存在消极的影响。这是由于实验所选用的嗜酸细菌(A.f),对于直流微弱电流的耐受性达到了极限,从而抑制了嗜酸细菌的氧化还原反应。在电流强度为100 mA时,对Zn、Cu、Cd、Cr的脱除率提升不明显。这说明当体系内的电场作用成为主导时,微弱直流电的小幅度提升不能提高重金属的脱除效率。根据电化学作用的机理,当体系的电流强度越大时,重金属离子迁移的速率越快。以上情况说明,施加不同强度的微弱直流电,对污染土壤中的重金属确实存在影响,但是具体影响还有待实验探究。而在20 mA条件下F实验组,明显提高了污染土壤中重金属的脱除率。土壤中Zn、Cu、Ni、Cd和Cr的脱除率较CK2对照组分别提高74%~91%、58%~72%、62%~78%、57%~85%和46%~56%。在20 mA的微电场条件下,相较CK1对照组,A.f菌对目标重金属的脱除率提高得更多,其中脱除Cu的提升效果最为明显,由10%提高至72%。可见,在电场的作用下,A.f菌对于污染土壤中重金属的脱除效果具有十分积极的影响。在20 mA的电场作用下,A.f菌可以提高脱除土壤中的重金属的效果。
由图3(a)可以看出,Zn的脱除率达到最高。对于重金属Zn来说,20 mA条件下的F实验组与CK2对照组相比,对Zn的脱除率高出16%,这是由于对A.f菌施加微电场的引起的。相比于20 mA条件下的CK1对照组对Zn的脱除率提升不高的原因是,在实验前,土壤中的Zn离子大部分是以离子态的形式存在的[19]。在培养基初始pH为2的条件下,浸出液中已有大量离子态的Zn,这些Zn离子再通过电场作用迁移至装置的阴极。
由图3(b)可知,施加20 mA的电场使A.f菌对Cu的脱除率高出CK2对照组14%,是因为在电场作用下,微生物淋滤的Fe2+出现了定向迁移,导致微生物在实验后期的养分不足,从而使Cu的硫化物结合态被A.f菌氧化进入的溶液速度减缓[20]。电流强度与反应时间也会对Cu离子的脱除效果产生影响,在不抑制A.f菌生长活动的前提下,增加反应时间,该体系对Cu脱除效果的提升仍然会十分明显[21]。
图3(c)表明,相较于20 mA条件下的F实验组和其他电流条件下的CK2对照组,Ni离子的脱除率可高出15%。这是由于在电场的作用下,Ni2+容易与OH−形成沉淀Ni(OH)2,pH对Ni离子的影响非常大[22]。在本体系中,酸性环境下非常利于Ni离子迁移到阴极上,所以电场的作用会较为明显,从而导致在20 mA条件下F实验组的脱除率提升并不明显。但是,较低的pH会对阳极产生不利影响,从而破坏体系的稳定性。
对于重金属Cd来说(图3(d)),经过驯化的A.f菌对Cd具有一定的耐受性,20 mA的电流条件下F实验组对Cd的脱除率高出CK2对照组28%。因为Cd离子在电场作用下的活动性有限,处于电场内不同位置Cd离子,其运动速率与该位置到阳极的距离成反比[23]。而F实验组在A.f菌的作用下,使更多的Cd成为离子态,让Cd离子向阴极运动,从而被脱除。
由图3(e)可以看出,20 mA条件下的F实验组对重金属Cr的脱除率仅高出其他电流条件下的F实验组10%。这是由于Cr在土壤中会以Cr3+、Cr6+的形式存在,而大部分Cr3+会形成Cr(OH)3沉淀。这些沉淀在电场作用下难以迁移,而土壤中Cr6+会以含氧阴离子的形式存在,在电场的作用下向阳极区域迁移[24]。A.f菌也仅仅是将硫化物结合态的Cr离子代谢进浸出液,同时硫化物结合态的Cr含量有限,导致本次实验中的脱除效果均不好。研究结果表明,在20 mA的微电场作用下,A.f菌可以更高效地脱除电子废弃物拆解场地土壤中重金属。在第5天时,20 mA条件下对土壤中重金属Zn、Cu、Ni、Cd、Cr的脱除效果最佳,脱除率分别达到91%、72%、78%、85%、56%。
3. 结论
1)在不同强度的微弱直流电场作用下,A.f菌脱除电子废物拆解场地污染土壤中重金属的研究结果表明:在20 mA直流稳压电场的作用下,可以为A.f菌创造更加适宜生存环境,可以提高整个体系的氧化还原能力。
2)在20 mA直流稳压电场的作用下,A.f菌对Cu脱除率的提升效果最为明显。当电流强度为60 mA以上时,对于A.f菌淋洗土壤中的重金属存在消极的影响。
3)当20 mA直流稳压电场作用于A.f菌时,可以高效脱除电子废物拆解场地的土壤重金属Zn、Cu、Ni、Cd、Cr,5 d后,其去除率分别达到91%、72%、78%、85%、56%。与仅施加电场或接菌的条件相比,脱除率提高18%以上,脱除后的土壤重金属含量低于建设用地土壤质量标准(GB 36600-2018)。因此,在20 mA微电场条件下,A.f菌生物淋洗作用,有利于高效脱除电子废弃物拆解场地土壤中高浓度重金属。
-
靶器官 Cr/(mg·kg−1·d−1) Cd/(mg·kg−1·d−1) Mn/(mg·kg−1·d−1) Cu/(mg·kg−1·d−1) Pb/(ug·dL−1) Hg/(mg·kg−1·d−1) 胃肠道 0.000 9 — — — — — 神经系统 0.010 0 0.000 2 0.070 0 — 10.000 0 — 肾脏 0.010 0 0.000 2 — — 34.000 0 0.002 0 血液 0.003 0 0.000 8 — — 10.000 0 — 睾丸 0.050 0 0.003 0 — — 40.000 0 — 心血管 — 0.005 0 — — 10.000 0 — 肝脏 — — — 0.140 0 — — -
[1] NIKIEMA J, ASIEDU Z. A review of the cost and effectiveness of solutions to address plastic pollution[J]. Environmental Science and Pollution Research, 2022, 29(17): 24547-24573. doi: 10.1007/s11356-021-18038-5 [2] JNR A K L, GALPIN R, MANJULA S, et al. Reuse of waste plastics in developing countries: properties of waste plastic-sand composites[J]. Waste and Biomass Valorization, 2022, 13(9): 3821-3834. doi: 10.1007/s12649-022-01708-x [3] HAHLADAKIS J N, VELIS C A, WEBER R, et al. An overview of chemical additives present in plastics: Migration, release, fate and environmental impact during their use, disposal and recycling[J]. Journal of Hazardous Materials, 2018, 344: 179-199. doi: 10.1016/j.jhazmat.2017.10.014 [4] THOMPSON C M, AARDEMA M J, HEINTZ M M, et al. A review of mammalian in vivo genotoxicity of hexavalent chromium: implications for oral carcinogenicity risk assessment[J]. Critical Reviews in Toxicology, 2021, 51(10): 820-849. doi: 10.1080/10408444.2021.2000934 [5] GODT J, SCHEIDIG F, GROSSE-SIESTRUP C, et al. The toxicity of cadmium and resulting hazards for human health[J]. Journal of Occupational Medicine and Toxicology, 2006, 1(1): 1-6. doi: 10.1186/1745-6673-1-1 [6] BHARDWAJ V, NURCHI V M, SAHOO S K. Mercury toxicity and detection using chromo-fluorogenic chemosensors[J]. Pharmaceuticals, 2021, 14(2): 123. doi: 10.3390/ph14020123 [7] KUMAR A, KUMAR A, M M S C P, et al. Lead toxicity: health hazards, influence on food chain, and sustainable remediation approaches[J]. International Journal of Environmental Research and Public Health, 2020, 17(7): 1-33. [8] CHARKIEWICZ A E, BACKSTRAND J R. Lead toxicity and pollution in Poland[J]. International Journal of Environmental Research and Public Health, 2020, 17(7): 2179. doi: 10.3390/ijerph17072179 [9] ZORODDU M A, AASETH J, CRISPONI G, et al. The essential metals for humans: a brief overview[J]. Journal of Inorganic Biochemistry, 2019, 195: 120-129. doi: 10.1016/j.jinorgbio.2019.03.013 [10] WANG P S, MA H, XI X H, et al. Plastic spectral interference in the biological characterization by Raman or SERS spectroscopy[J]. Journal of Raman Spectroscopy, 2023, 54(6): 573-579. doi: 10.1002/jrs.6517 [11] NGUYEN V T, LINH T T T, VO T K, et al. Analytical techniques for determination of heavy metal migration from different types of locally made plastic food packaging materials using ICP-MS[J]. Food Science & Nutrition, 2023, 11(7): 4030-4037. [12] STANGENBERG F, ÅGREN S, KARLSSON S. Quality assessments of recycled plastics by spectroscopy and chromatography[J]. Chromatographia, 2004, 59(1): 101-106. [13] 章楚加, 仲新建. 关于走私废物罪罚金刑数额裁量之思考[N]. 人民法院报, 2014-08-06. [14] 保持高压态势 拒“洋垃圾”于国门之外——海关总署南京海关缉私局打击“洋垃圾”走私专项行动组[J]. 中国生态文明, 2019(3): 19-20. [15] 沪海关清退“洋垃圾”创新高[J]. 绿色包装, 2019(6): 12. [16] ZENG X, LIU D, WU Y, et al. Heavy metal risk of disposable food containers on human health[J]. Ecotoxicology and Environmental Safety, 2023, 255: 114797. doi: 10.1016/j.ecoenv.2023.114797 [17] TANG Z, LIU M, YI L, et al. Source apportionment and health risk assessment of heavy metals in eastern Guangdong municipal solid waste[J]. Applied Sciences-Basel, 2019, 9(22): 4755. doi: 10.3390/app9224755 [18] JIN Q, GAO H, YUE B, et al. Heavy metal content of rural living solid waste and related source and distribution analysis[J]. Huanjing Kexue, 2018, 39(9): 4385-4392. [19] SILANO V, BAVIERA J M B, BOLOGNESI C, et al. Safety assessment of the process 'RecyPET Hungaria', based on RecyPET Hungaria technology, used to recycle post-consumer PET into food contact materials[J]. Efsa Journal, 2018, 16(11): e05481. [20] STEIMEL K G, HWANG R, DINH D, et al. Evaluation of chemicals leached from PET and recycled PET containers into beverages[J]. Reviews on Environmental Health, 2022.https://doi.org/10.1515/reveh-2022-0183. [21] DEDIEU I, AOUF C, GAUCEL S, et al. Recycled poly(hydroxybutyrate-co-valerate) as food packaging: effect of multiple melt processing on packaging performance and food contact suitability[J]. Journal of Polymers and the Environment, 2023, 31(3): 1019-1028. doi: 10.1007/s10924-022-02600-4 [22] U. S. Environmental Protection Agency. Office of Food Additive Safety. Use of Recycled Plastics in Food Packaging (Chemistry Considerations): Guidance for Industry[EB/OL]. [2023-06-07].https://www.fda.gov/media/150792/download. pdf, 2021. [23] EFSA PANEL ON FOOD CONTACT MATERIALS, ENZYMES, FLAVOURINGS AND PROCESSING AIDS. Scientific Opinion on the criteria to be used for safety evaluation of a mechanical recycling process to produce recycled PET intended to be used for manufacture of materials and articles in contact with food[J]. EFSA Journal, 2011, 9(7): 2184. [24] YE B L. Research on plastic waste treatment [C]//2020 International Conference of Recent Trends in Environmental Sustainability and Green Technologies. Ottawa Canada, 2020: 8. [25] HUANG G Z, XIE J Y, LI T, et al. Worker health risk of heavy metals in pellets of recycled plastic: a skin exposure model[J]. Int Arch Occup Environ Health, 2021, 94(7): 1581-1589. doi: 10.1007/s00420-021-01727-6 [26] 张杰聪, 温云铎, 吴晓丹, 等. 儿童玩具中重金属污染及健康风险评价[J]. 生态毒理学报, 2022, 17(4): 345-353. [27] U. S. Department of Health and Human Services Public Health Service, Agency for Toxic Substances and Disease Registry Division of Toxicology. Guidance manual for the assessment of joint toxic action of chemical mixtures[EB/OL]. [2023-06-07].https://stacks.cdc.gov/view/cdc/6935, 2004. [28] ZUO T T, JIN H Y, CHEN A Z, et al. Novel integrated tiered cumulative risk assessment of heavy metals in food homologous traditional chinese medicine based on a real-life-exposure scenario[J]. Frontiers in Pharmacology, 2022, 13: 908986. doi: 10.3389/fphar.2022.908986 [29] WANG Y F, TANG Y Q, LI Z, et al. Joint toxicity of a multi-heavy metal mixture and chemoprevention in sprague dawley rats[J]. International Journal of Environmental Research and Public Health, 2020, 17(4): 1451. doi: 10.3390/ijerph17041451 [30] WU X Y, COBBINA S J, MAO G H, et al. A review of toxicity and mechanisms of individual and mixtures of heavy metals in the environment[J]. Environmental Science and Pollution Research, 2016, 23: 8244-8259. doi: 10.1007/s11356-016-6333-x [31] SUN H W, MA D J, CHAO C Y, et al. Lead distribution in blood and organs of mice exposed to lead by vein injection[J]. Environmental Technology, 2009, 30(10): 1051-1057. doi: 10.1080/09593330903055643 [32] DUMKOVA J, VRLIKOVA L, VECERA Z, et al. Inhaled cadmium oxide nanoparticles: their in vivo fate and effect on target organs[J]. International Journal of Molecular Sciences, 2016, 17(6): 874. doi: 10.3390/ijms17060874 [33] Commission of European Union. Directive 82/711/EEC, Laying Down the Basic Rules Nec-essary for Testing Migration of the Constituents of Plastic Materials and Articles Intended to Come into Contact with Foodstuffs[S].https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=celex%3A31982L0711, 1982. [34] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品接触及制品迁移试验通则: GB 31604.1—2015[S]. 北京: 中国标准出版社, 2016. [35] 李宁, 肖海清, 王宏伟, 等. 不同塑料餐具中典型毒害物质的暴露评估[J]. 现代食品科技, 2022, 38(9): 321-332. [36] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品接触材料及制品迁移试验预处理方法通则: GB 5009.156—2016[S]. 北京: 中国质检出版社, 2017. [37] 中华人民共和国环境保护部. 固体废物 金属元素的测定 电感耦合等离子体质谱法: HJ766—2015[S]. 北京: 中国环境科学出版社, 2015. [38] 中华人民共和国环境保护部. 固体废物 汞、砷、硒、铋、锑的测定 微波消解/原子荧光法: HJ702—2014[S]. 北京: 中国环境科学出版社, 2014. [39] U. S. Environmental Protection Agency. Risk assessment guidance for superfund (RAGS), vol-ume I: human health evaluation manual [EB/OL]. [2023-06-07].https://www.epa.gov/sites/default/files/2015-11/documents/OSWERdirective9285.6-03.pdf, 2004. [40] 李千婷, 海热提, 林爱军, 等. 再生塑料袋包装食品对人体的健康风险评价[J]. 环境科学与技术, 2010, 33(11): 181-185. [41] 段小丽. 中国人群暴露参数手册[M]. 北京: 中国环境出版社, 2013. [42] SHI H H, ZENG M, PENG H X, et al. Health risk assessment of heavy metals in groundwater of hainan island using the monte carlo simulation coupled with the APCS/MLR model[J]. International Journal of Environmental Research and Public Health, 2022, 19(13): 7827. doi: 10.3390/ijerph19137827 [43] U. S. Environmental Protection Agency. Review of Adult Lead Models Evaluation of Models for Assessing Human Health Risks Associated with Lead Exposures at Non-Residential Areas of Superfund and Other Hazardous Waste Sites[EB/OL]. [2023-06-07].https://semspub.epa.gov/work/HQ/174560.pdf, 2001. [44] 中华人民共和国国家市场监督管理总局, 国家标准化管理委员会. 生活饮用水卫生标准: GB5749—2022[S]. 北京: 中国标准出版社, 2022. [45] 杜斌, 杨睿, 谢续明. 聚对苯二甲酸乙二醇酯水热老化过程中的物理和化学变化[J]. 塑料, 2011, 40(5): 24-27. [46] 麻一明, 吴剑波, 陈宁, 等. 再生ABS材料的热氧老化性能研究[J]. 塑料工业, 2023, 51(4): 117-122. doi: 10.3969/j.issn.1005-5770.2023.04.018 [47] RANJAN V P, JOSEPH A, GOEL S. Microplastics and other harmful substances released from disposable paper cups into hot water[J]. Journal of Hazardous Materials, 2020, 404(Part B): 124118. [48] 彭湘莲, 李忠海, 王利兵, 等. 4种纸塑包装容器中重金属镉的迁移规律研究[J]. 中国食品学报, 2012, 12(9): 73-77. [49] CHENG X, SHI H, ADAMS C D, et al. Assessment of metal contaminations leaching out from recycling plastic bottles upon treatments[J]. Environmental Science and Pollution Research, 2010, 17: 1323-1330. doi: 10.1007/s11356-010-0312-4 [50] TUDI M, YANG L S, YU J P, et al. Leaching Characteristics and potential risk of heavy metals from drip irrigation pipes and mulch substrate in agricultural ecosystems[J]. Science of the Total Environment, 2023, 882: 163573. doi: 10.1016/j.scitotenv.2023.163573 [51] SHAMIMA AKTHER E, MUHAMMAD SAIFUL I, JAHID HASAN S, et al. Assessment of heavy metals migrated from food contact plastic packaging: Bangladesh perspective[J]. Heliyon, 2023, 9(9): e19667. doi: 10.1016/j.heliyon.2023.e19667 [52] MAO S H, GU W H, BAI J F, et al. Migration characteristics of heavy metals during simulated use of secondary products made from recycled e-waste plastic[J]. Journal of Environmental Management, 2020, 266: 110577. doi: 10.1016/j.jenvman.2020.110577 [53] 王世玉, 吴文勇, 刘菲, 等. 典型污灌区土壤与作物中重金属健康风险评估[J]. 中国环境科学, 2018, 38(4): 1550-1560. [54] 杨琰琥, 方先斌, 张晓晴, 等. 程潮矿区周边土壤重金属污染风险评价和健康风险评估[J]. 有色金属(冶炼部分), 2023(1): 65-74,87. [55] U. S. Agency for Toxic Substances and Disease Registry. Minimal Risk Levels (MRLs) for Hazardous Substances[EB/OL]. [2023-06-07]. https://wwwn.cdc.gov/TSP/MRLS/mrlsListing.aspx, 2023. [56] U. S. Agency for Toxic Substances and Disease Registry. Interaction Profile for Toxic Substances: Arsenic, Cadmium, Chromium, Lead[EB/OL]. [2023-06-07]. https://www.atsdr.cdc.gov/interactionprofiles/ip04.html, 2004. [57] U. S. Agency for Toxic Substances and Disease Registry. Interaction Profile for Toxic Substances: Lead, Manganese, Zinc, and Copper[EB/OL]. [2023-06-07]. https://www.atsdr.cdc.gov/interactionprofiles/ip06.html, 2004. [58] U. S. Agency for Toxic Substances and Disease Registry. Interaction Profile for Toxic Substances: Chlorpyifos, Lead, Mercury, and Methylmercury[EB/OL]. [2023-06-07]. https://www.atsdr.cdc.gov/interactionprofiles/ip011.html, 2006. 期刊类型引用(4)
1. 王鑫,印霞棐,梁国斌. 聚磷菌培养及其在降解酸性废水中的研究. 广东化工. 2025(02): 43-44+54 .  百度学术
百度学术
2. 贾瑞雪,顾卫华,赵静,白建峰. 典型固体废物中冶金微生物及其浸出机理研究进展. 生物工程学报. 2023(03): 1040-1055 .  百度学术
百度学术
3. 金芮合,刘敏,何尔凯,李晔,黄晔,杨静,刘欣然. 场地土壤污染物归趋、风险评估和修复治理研究进展. 土壤通报. 2022(02): 492-501 .  百度学术
百度学术
4. 陈龙,李启婷,钱坤鹏. 重金属铬污染土壤的修复技术研究进展. 应用化工. 2022(10): 3058-3062 .  百度学术
百度学术
其他类型引用(5)
-






 下载:
下载: