-
镉 (Cd) 是人体非必需的有剧毒的重金属元素[1-2],极易在小麦等农作物中富集,并通过食物链对人体健康产生威胁[3-5]。近年来河南[6]、甘肃[7]和陕西[8]等地均相继出现不同程度的小麦Cd含量超标现象。SONG等[9]指出小麦对我国北方人群Cd摄入量的贡献高达29.8%。土壤-小麦系统Cd污染风险识别与评估是小麦Cd污染防治策略制定的前提和重要参考。
近年来国内外研究人员对土壤-小麦污染风险进行了大量研究,多集中于应用不同评价指标对Cd污染土壤和小麦进行污染等级划分与定性评估[5,10-11]。其中,MULLER开发的地积累指数法被广泛用于土壤及河道沉积物Cd污染风险研究[12]。HAKANSON提出的潜在生态风险指数综合考虑了Cd毒性效应和相对贡献度等参数,在农田土壤Cd累积研究中应用较多[13]。ZHUANG等[14]应用地积累指数法对我国主要小麦产区土壤Cd生态风险进行了量化评估。李艳玲等[15]应用潜在生态指数对济源市平原区小麦田Cd污染特征进行了评估分析。美国环保署开发的健康风险评估模型建立了Cd暴露途径与人体Cd摄入量的定量关系,被广泛用于评估污染小麦摄入风险评估的研究中[8,16]。然而土壤Cd累积周期长,影响因素繁杂,不同区域农田土壤Cd空间异质性显著[1,11,17-18]。贵州土壤Cd背景值 (0.66 mg·kg−1) 约为内蒙古土壤Cd背景值 (0.05 mg·kg−1) 的13.2倍[17]。上述评价模型多使用固定评价因子和参考标准,难以对区域农田Cd污染风险进行量化分析[19-20]。同时,我国幅员辽阔,不同地区农田土壤理化性质、社会经济水平和人群生活习惯与国外研究差别较大,固定参数的直接应用使评价结果存在较大偏差[21-22],难以充分反映区域土壤-小麦系统Cd污染风险变化趋势。
基于以上问题,本研究以河南省某地为研究对象,基于部分区域大面积调查和不确定性理论,将Monte-Carlo随机模拟方法引入到区域农田Cd污染风险综合评估中,获取该地区土壤和小麦Cd污染风险概率分布情况,探讨有效可行的污染防控目标,以期为区域小麦Cd污染风险管理提供理论指导。
-
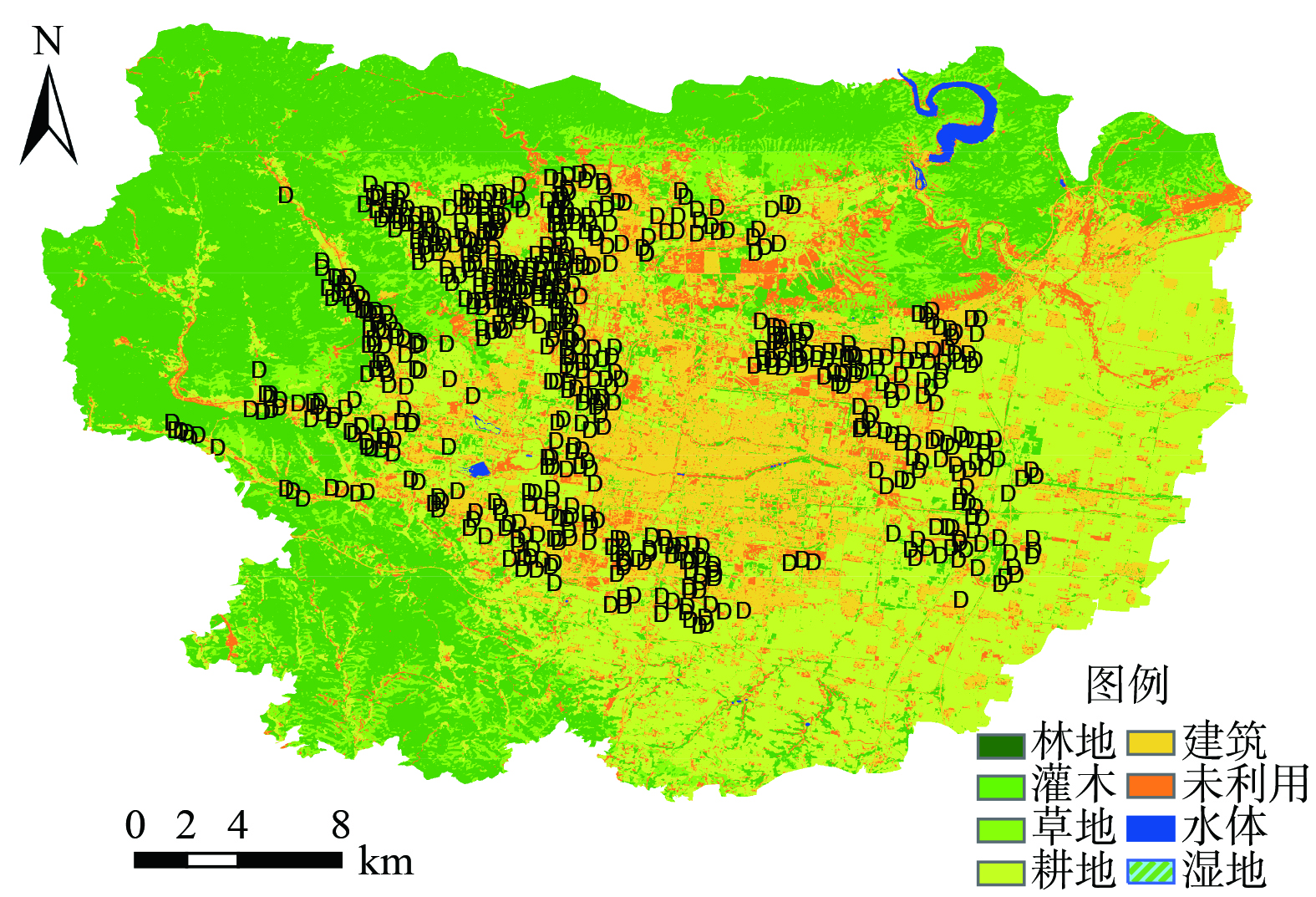
研究区位于河南省某地,年平均温度为15.5 ℃,年平均降水量为546.6~686.2 mm[2],研究区概况如图1所示。区域调查共布设635个采样点位,样点具体分布见图1。另外,10个土壤背景样品采集自研究区远离工矿企业和人类活动干扰的山区[6]。每个采样点应用五点混合采样法采集耕作层土壤 (0~20 cm) 样品1.0 kg左右,同时采集5~10株对应小麦样品,样品标记后带回实验室进行处理分析。
-
土壤样品经风干、研磨和过筛后置于自封袋密封备用。小麦样品经去泥、洗净分出籽粒后再用去离子水冲洗2~3遍,晾干后置于烘干箱中105 ℃杀青30 min,60 ℃烘干至恒重,脱壳后研磨粉碎,置于自封袋密封备用。土壤pH使用电极法测定,土水比为1∶2.5。土壤有机质 (SOM,乙二胺四乙酸—乙酸铵溶液浸提法) 和阳离子交换量 (CEC,盐酸浸提法) 具体测定方法方法参见文献[23]。应用四酸法HCl-HNO3-HF-HCIO4消解土壤样品,应用HNO3-HClO4消解小麦样品[6,24]。使用ICP-MS (7500A,Agilent,USA) 测定样品Cd含量,测定过程中应用国家标准物质 (GBW 07427华北平原土壤;GBW 10046河南小麦) 进行质量控制,回收率在91.8%~108.7%之间。
-
小麦Cd富集系数 (BCF) 常被用来分析土壤-小麦系统Cd富集特征,并可在一定程度上消除区域环境因子影响差异[13,21]。其计算公式见式(1)。
式中:BCF表示小麦籽粒Cd富集因子;WCd表示小麦籽粒Cd含量,mg·kg−1;SCd表示土壤Cd含量,mg·kg−1。
Moran’s I指数多用于空间自相关分析,可有效衡量同一区域内观测值间的依存效应[25],具体计算公式见式(2)~式(3)。
式中:n表示空间对象数量;wij表示空间对象i和空间对象j的空间权重矩阵,如果i和j是相邻的,则权重为1,否则为0;xi和xj代表在空间对象i和空间对象j的属性值 (i,j=1,2,3……n) ;
ˉx 表示空间对象的平均值;S2表示空间对象的方差。Moran’s I指数取值范围在−1到1之间,数值介于−1到0之间表示负相关,为0表示不相关,数值介于0到1之间表示正相关,绝对值越大相关性越强。地积累指数 (Igeo) 考虑了自然地质条件下土壤Cd背景值的影响,是区分和快速判断人类活动影响程度的重要参数[12,14],具体计算公式见式(4)。
式中:SCd表示土壤Cd含量 (mg·kg−1) ,Bn表示土壤Cd背景值,本研究采用研究区土壤Cd背景值 ((0.324±0.105) mg·kg−1) [6]。地积累指数评价结果划分为7个等级,具体等级见表1。
潜在生态风险指数 (Er) 考虑了土壤Cd毒理效应和环境生态效应对生态环境造成的影响[13,15],其具体计算公式见式(5)。
式中:Tr表示Cd生物毒性系数 (Tr-Cd=30) ,SCd表示土壤Cd含量 (mg·kg−1) ,Bn表示土壤Cd背景值,本研究采用研究区土壤Cd背景值 (0.324±0.105 mg·kg−1) [6]。潜在生态风险指数评价结果分为5个等级,具体分级情况见表1。
健康风险评估模型建立了暴露途径与人体健康风险的定量关系[6,16],计算公式见式(6)。
式中:ADD-WCd为区域成人经摄食小麦摄入的Cd日均暴露剂量,mg·kg−1·d−1;WCd为小麦Cd含量,mg·kg−1;IR为研究区成人日均小麦食用量,g·d−1;f为河南省居民食用自产小麦的比例,%;BW为研究区成人平均体重,kg。
耦合公式(1)和(6),人体健康评估模型可进一步用来表征土壤-小麦系统Cd富集量与人体健康风险的量化关系,其计算公式见式(7)。
暴露参数对健康风险评价的结果具有关键性影响[9,21]。本研究中,成人日均小麦食用量 (IR) 和平均体重 (BW) 来自于区域人群健康调查,分别设定为 (307.6±98.8) g·d−1的对数正态分布变量和 (58.6±5.6) kg的正态分布变量[6]。河南省居民食用自产小麦的比例 (f) 参考中国人群暴露参数手册河南部分设定为80.2%[26]。蒙特卡洛 (Monte-Carlo) 模拟是一种基于概率抽样的数理统计方法[19],通过对观测样本已知分布内的随机抽样,获取目标变量的概率分布[20,22]。本研究应用monte carlo模拟方法来降低土壤-小麦系统Cd污染综合风险评估结果的不确定性。
-
应用SPSS 25.0进行农田Cd富集特征统计分析,应用ArcGIS 10.8和Origin 2021进行空间分析和制图,应用Matlab R2021a进行Monte-Carlo随机模拟,设定随机模拟的迭代次数为10000次。
-
研究区土壤-小麦系统Cd富集特征统计结果如表2所示。区域土壤pH在5.44~8.60之间,平均值为8.05,其中94.7%土壤采样点pH均为碱性。耕作层土壤Cd平均含量为1.45 mg·kg−1,为农用地土壤风险筛选值 (0.6 mg·kg−1,《土壤环境质量农用地土壤污染风险管控标准 (试行) 》GB 15618-2018) [27]的2.42倍,约92.8%的土壤样点超过农用地土壤风险筛选值。土壤Cd变幅高达3.78 mg·kg−1,属强变异水平。以上结果说明区域土壤Cd污染形势严峻且受人为活动影响较为剧烈。
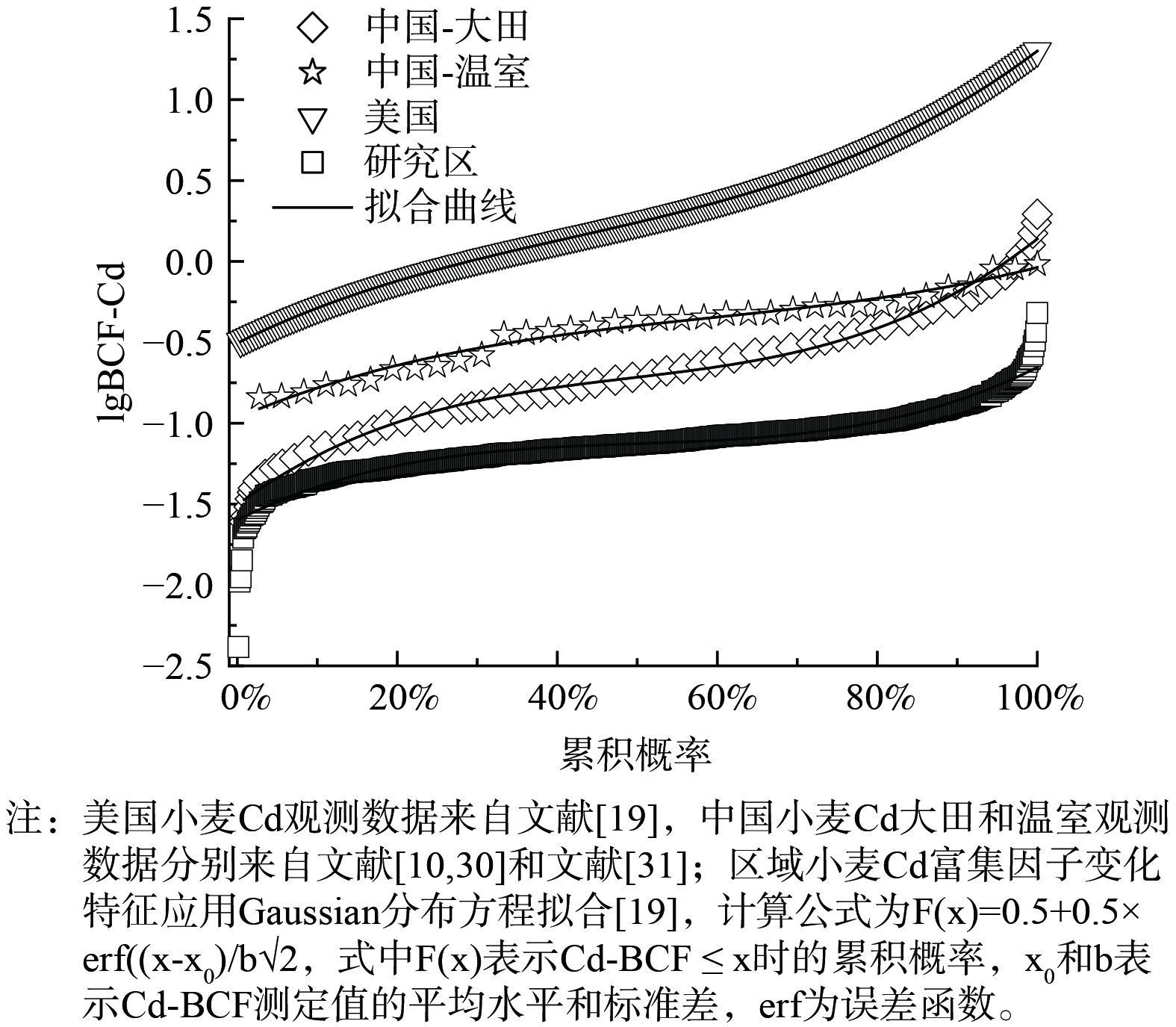
研究区小麦籽粒Cd平均含量为0.18 mg·kg−1,为《食品安全国家标准食品中污染物限量》GB 2762-2022 (0.1 mg·kg−1) 1.84倍[28],显著高于我国河北 (0.05 mg·kg−1) [29]和陕西 (0.02 mg·kg−1) 等[8]小麦产区的小麦籽粒Cd含量,略低于甘肃地区 (0.23 mg·kg−1) [7]小麦籽粒Cd含量。区域小麦籽粒样品超标率高达84.0%,可见区域小麦富Cd现象广泛存在且较为严重。小麦Cd富集系数 (BCF) 可以量化Cd在土壤-小麦的转移过程,表征小麦吸收积累Cd的能力[24,29]。研究区BCF范围为0.02~3.24,平均值为0.16。Gaussian分布方程[19]拟合结果显示区域小麦BCF服从对数正态分布 (图2) ,拟合结果显著 (p<0.001) 。进一步对中国和美国小麦Cd-BCF拟合发现研究区小麦Cd-BCF显著低于美国小麦Cd-BCF (美国小麦Cd-BCF平均值为3.98±5.29,中值为1.96,图2) [19]。另外,中国小麦Cd-BCF大田观测结果 (小麦Cd-BCF平均值为0.28±0.35,中值为0.19) [10,29]和温室观测结果 (小麦Cd-BCF平均值为0.43±0.22,中值为0.44) [30]与区域小麦Cd-BCF累积分布较为相似,可见研究区小麦Cd富集特征具备一定的典型性。
-
研究区土壤-小麦Cd含量空间自相关分析结果如图3所示。区域土壤-小麦Cd含量Moran’s I指数在0~20 km内均为正值,p值均<0.05,Z值均>2,超过20 km后p值>0.05,说明在该范围内 (0~20 km) 区域土壤-小麦Cd含量存在显著空间自相关关系[25]。土壤Cd含量Moran’s I指数在0~10 km范围内变化较大,整体上呈现先显著下降,再轻微上升,再持续下降的趋势。小麦Cd含量Moran's I指数在0~10 km内下降幅度较大,之后趋于平缓。由此可知区域土壤-小麦系统Cd分布特征存在较强的空间聚集性,这种现象可能是由于当地的工矿企业作业和交通运输活动的干扰所致[6]。整体来看,区域土壤-小麦系统Cd含量Moran’s I指数在0~20 km内均表现出随距离增加而逐渐降低的趋势,这表明可以进一步进行空间插值分析。
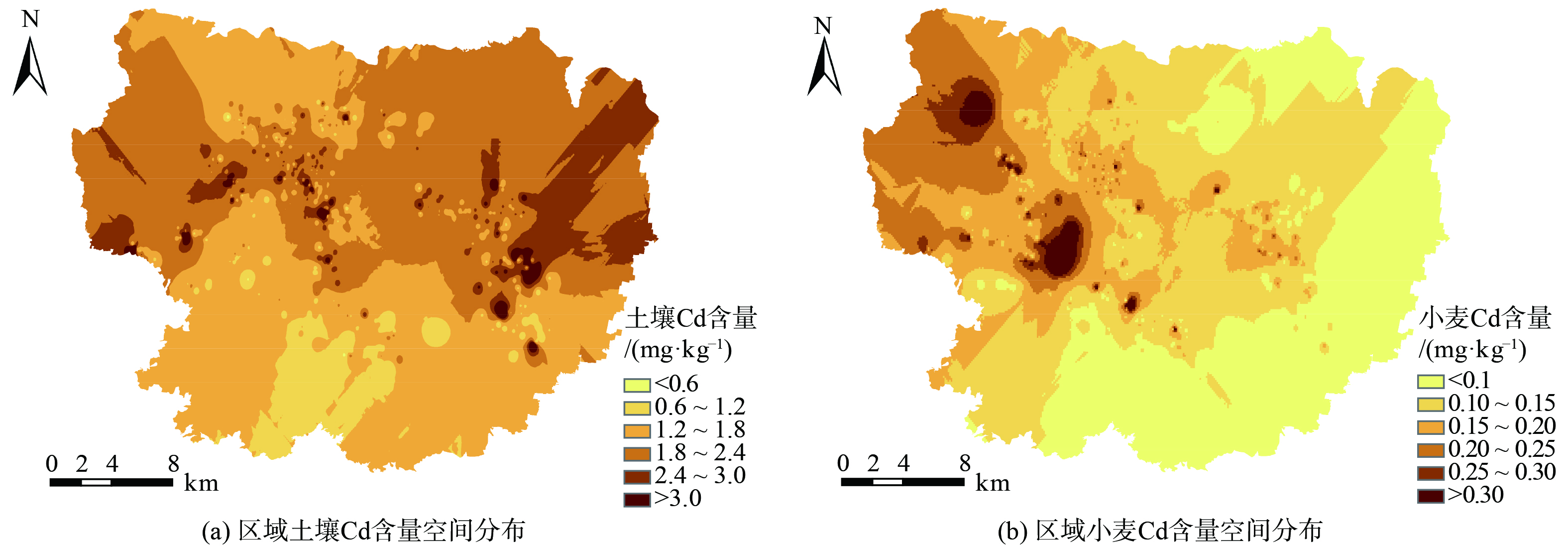
采用反距离加权法对研究区土壤-小麦Cd含量进行空间插值,空间分布如图4所示。由图4(a)可知,土壤Cd含量整体由西北向东南逐渐降低。土壤Cd高值区 (土壤Cd>1.8 mg·kg−1) 主要分布在研究区西北部和中东部区域。LI等[6]对研究区麦田土壤Cd污染进行溯源分析,指出区域西北部靠近铅锌冶炼厂区,中东部靠近人口密集区,频繁的人类活动容易造成土壤Cd累积。同时,区域土壤Cd含量高值区靠近当地主要河流上游,存在通过河流进行Cd迁移的风险。由图4(b)可知,研究区西北部和中部出现小麦Cd富集现象。空间尺度上,区域土壤和小麦Cd含量在研究区西北部表现出一定的相关性,均出现了较高水平的Cd富集现象。但研究区中东部区域存在一定空间差异,出现土壤Cd含量较高而小麦Cd含量较低现象。由以上结果可知区域工矿企业活动对于小麦Cd富集趋势影响显著,针对该地区的污染风险评估是确保研究区耕地安全利用的关键。
-
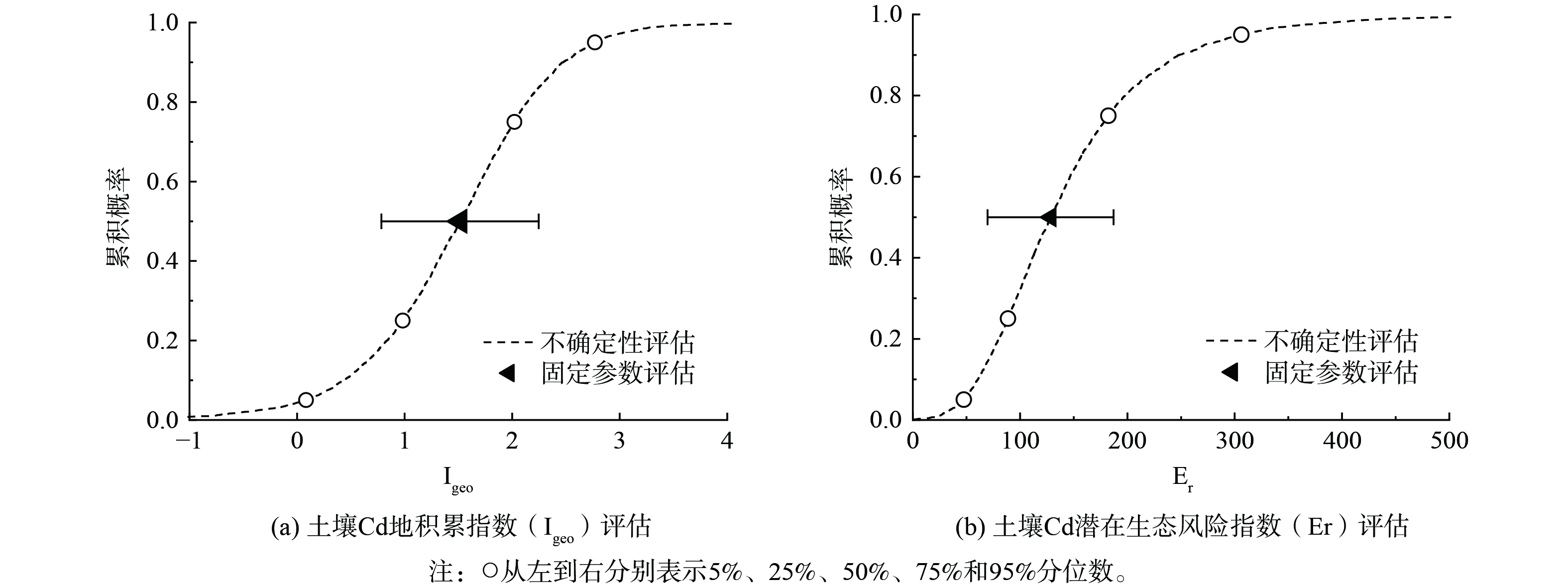
应用地积累指数 (Igeo) 和潜在生态风险指数 (Er) 开展基于固定参数的区域土壤Cd污染风险评估,评价结果见图5。由图5(a)可知,区域土壤Cd地积累指数平均值为1.42±0.73,隶属于轻中度污染等级 (表1) 。由图5(b)可知,区域土壤Cd潜在生态风险指数平均值为134±58.7,属中高等污染水平 (表1) 。考虑到区域土壤Cd含量的强空间异质性水平,进一步开展基于不确定性理论的区域土壤Cd污染风险评估 (图5) 。由图5(a)可知,区域土壤Cd地积累指数主要集中在1.01~1.89之间 (25%~75%分布) ,所调查样点隶属于无污染、轻度、轻中度、中度、中重度污染等级的比例分别为4.4%、21.5%、48.1%、23.2%和2.5%。由图5(b)可知,区域土壤Cd潜在生态风险指数主要集中在90.9~167之间 (25%~75%分布) ,所调查样点隶属于低污染、中等、中高等、高等和极高等污染等级的比例分别为3.2%、1.7%、4.7%、29.2%和4.3%。可见区域土壤Cd生态风险普遍处在高位,需对耕地上风向和河流上游的工矿企业排污进行治理 (图4) ,并避免出现新的污染源以加重区域土壤Cd累积趋势。
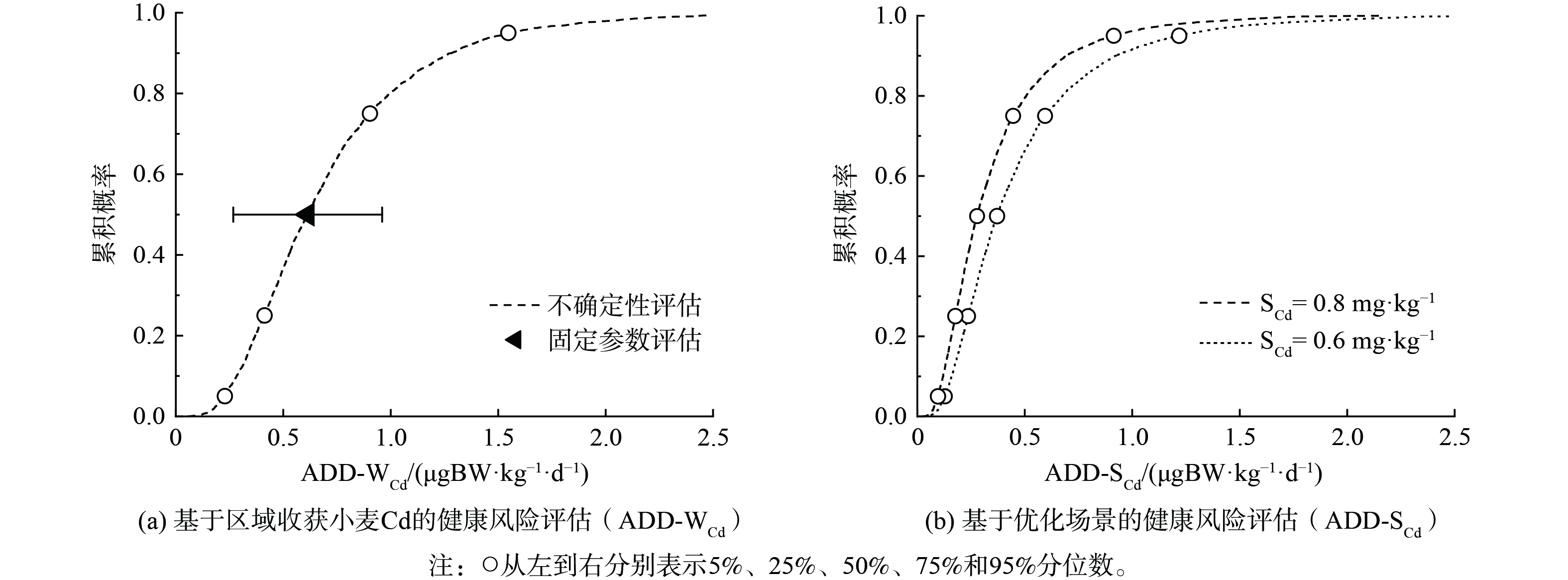
基于固定参数的小麦籽粒Cd人体健康风险评估结果如图6所示。结果显示,研究区成人Cd日均摄入量 (ADD) 为0.71±0.35μg BW·kg−1 d−1,略低于世界卫生组织 (WHO) 推荐的成人Cd摄入量安全值 (0.83 μg BW·kg−1·d−1) [31]。SONG等[9]对我国成人Cd摄入量的研究指出饮食结构的不同、小麦Cd含量差异等因素会促进健康风险评估结果的变异。简单的标准对比难以充分反映区域人群Cd摄入风险变化趋势。进一步开展基于不确定性理论的区域人群Cd摄入风险评估 (图6) 。由图6(a)可知区域人群经食用小麦Cd平均摄入量 (ADD) 主要集中在0.41~0.90 μg BW·kg−1·d−1之间 (25%~75%分布) ,近31.6%的区域人群Cd摄入量超过WHO推荐的安全值 (0.83 μg BW·kg−1·d−1) 。在小麦Cd含量较高的研究区西北部,该风险概率显著上升至79.3%,该区域ADD均值为1.12 μg BW·kg−1·d−1,为研究区人群经食用小麦摄入Cd量的1.58倍。考虑到研究区部分乡镇食用自产小麦比例接近100%,因此造成的危害也较大,在风险管理时应给予足够重视。
-
国务院于2016年印发了《土壤污染防治行动计划》 (简称“土十条”) ,提出我国受污染耕地安全利用率到2030年要达到95%左右[4]。近年来,当地政府积极落实“土十条”各项指标,采取了诸如关闭重污染企业、优化产业格局、减少秸秆还田等手段以降低区域土壤Cd累积趋势,但是不同措施应用下区域人群Cd摄入风险仍不明确。基于不确定性理论应用所构建的人体健康风险评估模型 (公式7) 开展多场景评估,评价结果如图6(b)所示。由图6(b)可知,当区域小麦土壤Cd含量下降到0.80 mg·kg−1 (区域土壤Cd含量25%分布) 时,区域人群Cd摄入量由0.71 μg BW·kg−1·d−1显著下降至0.37 μg BW·kg−1·d−1,超过WHO推荐安全值 (0.83 μg BW·kg−1·d−1) [31]的风险概率由31.6%显著下降至14.1%。ÅKESSON和CHANEY[3]指出人体经饮食摄入Cd含量造成的危害随着Zn摄入量的增加而减小。增加牛奶、鸡蛋等高Zn食物在区域人群日常饮食中的比例[3,9]可进一步降低区域人群Cd摄入风险。
土壤酸化是影响Cd在土壤-小麦系统中富集的主要因子[5-6]。在本研究中,有9.61%的土壤pH<7.5,最小值 (pH=5.44,表2) 低于酸化土壤阈值 (pH=5.5,GB 15618-2018) [27]。为保证区域95%农田的安全利用,研究区土壤Cd含量应控制在0.6 mg·kg−1以下 (《土壤环境质量农用地土壤污染风险管控标准 (试行) 》GB 15618-2018) [27]。该场景下区域人群Cd摄入量为0.28 μg BW·kg−1·d−1,超标风险概率可进一步下降至7.3%。在这些土壤酸化区域增施石灰、生物炭等土壤调理剂可有效控制小麦Cd富集[24,32-33],提升小麦质量水平并降低人群Cd摄入风险。众多研究指出土壤-小麦系统Cd累积量还受到距工业区、矿区和城镇区的距离,不同种类肥料的投入及气候条件等多种因素影响[5,34-35]。充分考虑这些因素的影响,基于不确定性分析原理评估区域Cd污染风险水平及相应概率,使评价过程更加稳健可靠,该方法与空间分析的联合使用更有助于风险决策的科学性和合理性。
-
将Monte-Carlo随机模拟方法引入到地积累指数、潜在风险因子指数和健康风险评价研究中,综合评估区域土壤-小麦系统Cd污染风险。案例分析说明研究区土壤-小麦系统Cd含量空间异质性强,污染风险较高,以区域西北部Cd富集现象最为显著。研究区成人通过食用当地小麦存在一定的健康风险,需引起当地政府足够重视,并根据不同地区概况采取适当防范措施以减少Cd污染危害,保障区域小麦的安全和高质生产。基于不确定性理论开展模拟分析,结果可同步展示不同场景下区域土壤Cd生态风险和小麦Cd健康风险的风险水平及其相应概率,为当地Cd污染防治提供决策支撑,对其他用地类型的重金属污染防治也有一定借鉴作用。
区域农田镉含量空间变异与综合风险的不确定性评估
Spatial variation of cadmium concentration in regional wheat fields and uncertainty-enabled comprehensive risk assessment
-
摘要: 我国小麦镉 (Cd) 污染格局多样,从不确定性角度评估区域小麦田Cd累积风险有助于提升污染防治决策的准确性。本研究基于不确定性理论,将蒙特卡洛 (Monte-Carlo) 随机模拟方法引入到区域土壤-小麦系统Cd污染综合风险评估中,结合多元统计和空间分析开展实例研究。结果表明河南省某小麦主产区92.8%的土壤样品Cd含量超过农田土壤风险筛选值 (0.6 mg·kg−1) ,84.0%的小麦籽粒样品Cd含量超过国家食品安全限量标准 (0.1 mg·kg−1) 。区域土壤-小麦系统Cd累积水平整体上呈现西北高东南低的空间分布格局。区域Cd生态风险以中度污染为主。区域人群Cd摄入量超过WHO推荐安全值的风险概率为31.6%,控制土壤Cd累积趋势可将该超标风险下降至7.3%。不确定性模拟、空间分析和场景分析的综合应用可准确识别农田Cd污染风险等级和相应概率,为区域Cd污染防治提供决策建议。Abstract: China faces great challenges in protecting its wheat soil from spatial heterogeneity of cadmium (Cd) accumulation. The uncertainty analysis helps improve the accuracy in the risk assessment for Cd in soil-wheat system. Based on the stochastic theory, the Monte-Carlo simulation approach was introduced in the ecological risk assessment and health risk assessment. Together with the multi-statistical technique and spatial analysis, proposed models were used for risk analysis in a certain area of Henan Province. Results showed that about 92.8% of the soil samples had Cd exceeding the national soil threshold value (0.6 mg·kg−1), and 84.0% of the wheat samples had Cd concentrations exceeding the national foodstuff threshold value (0.1 mg·kg−1). The concentration of Cd in the soils in the spatial distribution decreased from northwest to southeast, and the ecological risk of regional Cd is mainly moderate pollution. The ecological risk of Cd in the investigated wheat fields fall into the moderate contamination level. About 31.6% of the adult populations consumed wheat cropping in affected areas risk a daily Cd intake above the WHO limit. This risk was significantly decreased to 7.3%, when the accumulation trend of Cd has been controlled. The integrated application of uncertainty simulation, spatial analysis, and scenario analysis can accurately identify the risk levels and probability of Cd contamination from regional agricultural field, provide decision-making recommendations for the prevention and control of local Cd contamination.
-
Key words:
- spatial heterogeneity /
- Monte Carlo simulation /
- ecological risk /
- health risk /
- cadmium
-
镉 (Cd) 是人体非必需的有剧毒的重金属元素[1-2],极易在小麦等农作物中富集,并通过食物链对人体健康产生威胁[3-5]。近年来河南[6]、甘肃[7]和陕西[8]等地均相继出现不同程度的小麦Cd含量超标现象。SONG等[9]指出小麦对我国北方人群Cd摄入量的贡献高达29.8%。土壤-小麦系统Cd污染风险识别与评估是小麦Cd污染防治策略制定的前提和重要参考。
近年来国内外研究人员对土壤-小麦污染风险进行了大量研究,多集中于应用不同评价指标对Cd污染土壤和小麦进行污染等级划分与定性评估[5,10-11]。其中,MULLER开发的地积累指数法被广泛用于土壤及河道沉积物Cd污染风险研究[12]。HAKANSON提出的潜在生态风险指数综合考虑了Cd毒性效应和相对贡献度等参数,在农田土壤Cd累积研究中应用较多[13]。ZHUANG等[14]应用地积累指数法对我国主要小麦产区土壤Cd生态风险进行了量化评估。李艳玲等[15]应用潜在生态指数对济源市平原区小麦田Cd污染特征进行了评估分析。美国环保署开发的健康风险评估模型建立了Cd暴露途径与人体Cd摄入量的定量关系,被广泛用于评估污染小麦摄入风险评估的研究中[8,16]。然而土壤Cd累积周期长,影响因素繁杂,不同区域农田土壤Cd空间异质性显著[1,11,17-18]。贵州土壤Cd背景值 (0.66 mg·kg−1) 约为内蒙古土壤Cd背景值 (0.05 mg·kg−1) 的13.2倍[17]。上述评价模型多使用固定评价因子和参考标准,难以对区域农田Cd污染风险进行量化分析[19-20]。同时,我国幅员辽阔,不同地区农田土壤理化性质、社会经济水平和人群生活习惯与国外研究差别较大,固定参数的直接应用使评价结果存在较大偏差[21-22],难以充分反映区域土壤-小麦系统Cd污染风险变化趋势。
基于以上问题,本研究以河南省某地为研究对象,基于部分区域大面积调查和不确定性理论,将Monte-Carlo随机模拟方法引入到区域农田Cd污染风险综合评估中,获取该地区土壤和小麦Cd污染风险概率分布情况,探讨有效可行的污染防控目标,以期为区域小麦Cd污染风险管理提供理论指导。
1. 材料与方法
1.1 研究区概况和样点采集
研究区位于河南省某地,年平均温度为15.5 ℃,年平均降水量为546.6~686.2 mm[2],研究区概况如图1所示。区域调查共布设635个采样点位,样点具体分布见图1。另外,10个土壤背景样品采集自研究区远离工矿企业和人类活动干扰的山区[6]。每个采样点应用五点混合采样法采集耕作层土壤 (0~20 cm) 样品1.0 kg左右,同时采集5~10株对应小麦样品,样品标记后带回实验室进行处理分析。
1.2 实验室分析
土壤样品经风干、研磨和过筛后置于自封袋密封备用。小麦样品经去泥、洗净分出籽粒后再用去离子水冲洗2~3遍,晾干后置于烘干箱中105 ℃杀青30 min,60 ℃烘干至恒重,脱壳后研磨粉碎,置于自封袋密封备用。土壤pH使用电极法测定,土水比为1∶2.5。土壤有机质 (SOM,乙二胺四乙酸—乙酸铵溶液浸提法) 和阳离子交换量 (CEC,盐酸浸提法) 具体测定方法方法参见文献[23]。应用四酸法HCl-HNO3-HF-HCIO4消解土壤样品,应用HNO3-HClO4消解小麦样品[6,24]。使用ICP-MS (7500A,Agilent,USA) 测定样品Cd含量,测定过程中应用国家标准物质 (GBW 07427华北平原土壤;GBW 10046河南小麦) 进行质量控制,回收率在91.8%~108.7%之间。
1.3 数据处理
小麦Cd富集系数 (BCF) 常被用来分析土壤-小麦系统Cd富集特征,并可在一定程度上消除区域环境因子影响差异[13,21]。其计算公式见式(1)。
BCF=WCd/SCd (1) 式中:BCF表示小麦籽粒Cd富集因子;WCd表示小麦籽粒Cd含量,mg·kg−1;SCd表示土壤Cd含量,mg·kg−1。
Moran’s I指数多用于空间自相关分析,可有效衡量同一区域内观测值间的依存效应[25],具体计算公式见式(2)~式(3)。
Moran’sI=∑ni∑nj≠iwij(xi−ˉx)(xj−ˉx)/∑ni∑nj≠iwij(xi−ˉx)(xj−ˉx)(S2×∑ni∑nj≠iwij)(S2×∑ni∑nj≠iwij) (2) S2=(1/n)×∑ni(xi−ˉx)2 (3) 式中:n表示空间对象数量;wij表示空间对象i和空间对象j的空间权重矩阵,如果i和j是相邻的,则权重为1,否则为0;xi和xj代表在空间对象i和空间对象j的属性值 (i,j=1,2,3……n) ;
ˉx 地积累指数 (Igeo) 考虑了自然地质条件下土壤Cd背景值的影响,是区分和快速判断人类活动影响程度的重要参数[12,14],具体计算公式见式(4)。
Igeo=log2[SCd/(1.5×Bn)] (4) 式中:SCd表示土壤Cd含量 (mg·kg−1) ,Bn表示土壤Cd背景值,本研究采用研究区土壤Cd背景值 ((0.324±0.105) mg·kg−1) [6]。地积累指数评价结果划分为7个等级,具体等级见表1。
表 1 土壤风险指数分级Table 1. Grade of of soil risk index分级 0 1 2 3 4 5 6 Igeo值 <0 0~1 1~2 2~3 3~4 4~5 >5 污染程度 无 轻度 轻~中 中度 中~重 重度 极严重 Er值 — <40 40~80 80~160 160~320 >320 — 生态风险 — 低 中等 中~高 高 极高 — 潜在生态风险指数 (Er) 考虑了土壤Cd毒理效应和环境生态效应对生态环境造成的影响[13,15],其具体计算公式见式(5)。
Er=Tr×SCd/Bn (5) 式中:Tr表示Cd生物毒性系数 (Tr-Cd=30) ,SCd表示土壤Cd含量 (mg·kg−1) ,Bn表示土壤Cd背景值,本研究采用研究区土壤Cd背景值 (0.324±0.105 mg·kg−1) [6]。潜在生态风险指数评价结果分为5个等级,具体分级情况见表1。
健康风险评估模型建立了暴露途径与人体健康风险的定量关系[6,16],计算公式见式(6)。
ADD−WCd=(WCd×IR×f)/BW (6) 式中:ADD-WCd为区域成人经摄食小麦摄入的Cd日均暴露剂量,mg·kg−1·d−1;WCd为小麦Cd含量,mg·kg−1;IR为研究区成人日均小麦食用量,g·d−1;f为河南省居民食用自产小麦的比例,%;BW为研究区成人平均体重,kg。
耦合公式(1)和(6),人体健康评估模型可进一步用来表征土壤-小麦系统Cd富集量与人体健康风险的量化关系,其计算公式见式(7)。
ADD−SCd=(SCd×BCF×IR×f)/BW (7) 暴露参数对健康风险评价的结果具有关键性影响[9,21]。本研究中,成人日均小麦食用量 (IR) 和平均体重 (BW) 来自于区域人群健康调查,分别设定为 (307.6±98.8) g·d−1的对数正态分布变量和 (58.6±5.6) kg的正态分布变量[6]。河南省居民食用自产小麦的比例 (f) 参考中国人群暴露参数手册河南部分设定为80.2%[26]。蒙特卡洛 (Monte-Carlo) 模拟是一种基于概率抽样的数理统计方法[19],通过对观测样本已知分布内的随机抽样,获取目标变量的概率分布[20,22]。本研究应用monte carlo模拟方法来降低土壤-小麦系统Cd污染综合风险评估结果的不确定性。
1.4 数据分析
应用SPSS 25.0进行农田Cd富集特征统计分析,应用ArcGIS 10.8和Origin 2021进行空间分析和制图,应用Matlab R2021a进行Monte-Carlo随机模拟,设定随机模拟的迭代次数为10000次。
2. 结果与讨论
2.1 土壤-小麦系统Cd富集特征分析
研究区土壤-小麦系统Cd富集特征统计结果如表2所示。区域土壤pH在5.44~8.60之间,平均值为8.05,其中94.7%土壤采样点pH均为碱性。耕作层土壤Cd平均含量为1.45 mg·kg−1,为农用地土壤风险筛选值 (0.6 mg·kg−1,《土壤环境质量农用地土壤污染风险管控标准 (试行) 》GB 15618-2018) [27]的2.42倍,约92.8%的土壤样点超过农用地土壤风险筛选值。土壤Cd变幅高达3.78 mg·kg−1,属强变异水平。以上结果说明区域土壤Cd污染形势严峻且受人为活动影响较为剧烈。
表 2 区域土壤基本性质及土壤-小麦Cd含量特征Table 2. Descriptive statistics of soil properties and Cd concentration in the soil-wheat system being investigated检测参数 最小值 最大值 平均值 中值 标准差 土壤pH 5.44 8.60 8.05 8.23 0.56 土壤有机质/(g·kg−1) 10.90 72.90 23.80 21.80 8.82 黏粒/% 16.50 47.30 28.50 28.00 5.54 阳离子交换量 10.60 27.50 18.20 17.8 3.35 土壤Cd/(mg·kg−1) 0.11 3.89 1.45 1.40 0.63 小麦Cd/(mg·kg−1) 0.04 0.51 0.18 0.17 0.09 小麦Cd-BCF 0.022 3.24 0.16 0.12 0.18 研究区小麦籽粒Cd平均含量为0.18 mg·kg−1,为《食品安全国家标准食品中污染物限量》GB 2762-2022 (0.1 mg·kg−1) 1.84倍[28],显著高于我国河北 (0.05 mg·kg−1) [29]和陕西 (0.02 mg·kg−1) 等[8]小麦产区的小麦籽粒Cd含量,略低于甘肃地区 (0.23 mg·kg−1) [7]小麦籽粒Cd含量。区域小麦籽粒样品超标率高达84.0%,可见区域小麦富Cd现象广泛存在且较为严重。小麦Cd富集系数 (BCF) 可以量化Cd在土壤-小麦的转移过程,表征小麦吸收积累Cd的能力[24,29]。研究区BCF范围为0.02~3.24,平均值为0.16。Gaussian分布方程[19]拟合结果显示区域小麦BCF服从对数正态分布 (图2) ,拟合结果显著 (p<0.001) 。进一步对中国和美国小麦Cd-BCF拟合发现研究区小麦Cd-BCF显著低于美国小麦Cd-BCF (美国小麦Cd-BCF平均值为3.98±5.29,中值为1.96,图2) [19]。另外,中国小麦Cd-BCF大田观测结果 (小麦Cd-BCF平均值为0.28±0.35,中值为0.19) [10,29]和温室观测结果 (小麦Cd-BCF平均值为0.43±0.22,中值为0.44) [30]与区域小麦Cd-BCF累积分布较为相似,可见研究区小麦Cd富集特征具备一定的典型性。
2.2 空间异质特征分析
研究区土壤-小麦Cd含量空间自相关分析结果如图3所示。区域土壤-小麦Cd含量Moran’s I指数在0~20 km内均为正值,p值均<0.05,Z值均>2,超过20 km后p值>0.05,说明在该范围内 (0~20 km) 区域土壤-小麦Cd含量存在显著空间自相关关系[25]。土壤Cd含量Moran’s I指数在0~10 km范围内变化较大,整体上呈现先显著下降,再轻微上升,再持续下降的趋势。小麦Cd含量Moran's I指数在0~10 km内下降幅度较大,之后趋于平缓。由此可知区域土壤-小麦系统Cd分布特征存在较强的空间聚集性,这种现象可能是由于当地的工矿企业作业和交通运输活动的干扰所致[6]。整体来看,区域土壤-小麦系统Cd含量Moran’s I指数在0~20 km内均表现出随距离增加而逐渐降低的趋势,这表明可以进一步进行空间插值分析。
采用反距离加权法对研究区土壤-小麦Cd含量进行空间插值,空间分布如图4所示。由图4(a)可知,土壤Cd含量整体由西北向东南逐渐降低。土壤Cd高值区 (土壤Cd>1.8 mg·kg−1) 主要分布在研究区西北部和中东部区域。LI等[6]对研究区麦田土壤Cd污染进行溯源分析,指出区域西北部靠近铅锌冶炼厂区,中东部靠近人口密集区,频繁的人类活动容易造成土壤Cd累积。同时,区域土壤Cd含量高值区靠近当地主要河流上游,存在通过河流进行Cd迁移的风险。由图4(b)可知,研究区西北部和中部出现小麦Cd富集现象。空间尺度上,区域土壤和小麦Cd含量在研究区西北部表现出一定的相关性,均出现了较高水平的Cd富集现象。但研究区中东部区域存在一定空间差异,出现土壤Cd含量较高而小麦Cd含量较低现象。由以上结果可知区域工矿企业活动对于小麦Cd富集趋势影响显著,针对该地区的污染风险评估是确保研究区耕地安全利用的关键。
2.3 综合风险评估
应用地积累指数 (Igeo) 和潜在生态风险指数 (Er) 开展基于固定参数的区域土壤Cd污染风险评估,评价结果见图5。由图5(a)可知,区域土壤Cd地积累指数平均值为1.42±0.73,隶属于轻中度污染等级 (表1) 。由图5(b)可知,区域土壤Cd潜在生态风险指数平均值为134±58.7,属中高等污染水平 (表1) 。考虑到区域土壤Cd含量的强空间异质性水平,进一步开展基于不确定性理论的区域土壤Cd污染风险评估 (图5) 。由图5(a)可知,区域土壤Cd地积累指数主要集中在1.01~1.89之间 (25%~75%分布) ,所调查样点隶属于无污染、轻度、轻中度、中度、中重度污染等级的比例分别为4.4%、21.5%、48.1%、23.2%和2.5%。由图5(b)可知,区域土壤Cd潜在生态风险指数主要集中在90.9~167之间 (25%~75%分布) ,所调查样点隶属于低污染、中等、中高等、高等和极高等污染等级的比例分别为3.2%、1.7%、4.7%、29.2%和4.3%。可见区域土壤Cd生态风险普遍处在高位,需对耕地上风向和河流上游的工矿企业排污进行治理 (图4) ,并避免出现新的污染源以加重区域土壤Cd累积趋势。
基于固定参数的小麦籽粒Cd人体健康风险评估结果如图6所示。结果显示,研究区成人Cd日均摄入量 (ADD) 为0.71±0.35μg BW·kg−1 d−1,略低于世界卫生组织 (WHO) 推荐的成人Cd摄入量安全值 (0.83 μg BW·kg−1·d−1) [31]。SONG等[9]对我国成人Cd摄入量的研究指出饮食结构的不同、小麦Cd含量差异等因素会促进健康风险评估结果的变异。简单的标准对比难以充分反映区域人群Cd摄入风险变化趋势。进一步开展基于不确定性理论的区域人群Cd摄入风险评估 (图6) 。由图6(a)可知区域人群经食用小麦Cd平均摄入量 (ADD) 主要集中在0.41~0.90 μg BW·kg−1·d−1之间 (25%~75%分布) ,近31.6%的区域人群Cd摄入量超过WHO推荐的安全值 (0.83 μg BW·kg−1·d−1) 。在小麦Cd含量较高的研究区西北部,该风险概率显著上升至79.3%,该区域ADD均值为1.12 μg BW·kg−1·d−1,为研究区人群经食用小麦摄入Cd量的1.58倍。考虑到研究区部分乡镇食用自产小麦比例接近100%,因此造成的危害也较大,在风险管理时应给予足够重视。
2.4 不同场景评估
国务院于2016年印发了《土壤污染防治行动计划》 (简称“土十条”) ,提出我国受污染耕地安全利用率到2030年要达到95%左右[4]。近年来,当地政府积极落实“土十条”各项指标,采取了诸如关闭重污染企业、优化产业格局、减少秸秆还田等手段以降低区域土壤Cd累积趋势,但是不同措施应用下区域人群Cd摄入风险仍不明确。基于不确定性理论应用所构建的人体健康风险评估模型 (公式7) 开展多场景评估,评价结果如图6(b)所示。由图6(b)可知,当区域小麦土壤Cd含量下降到0.80 mg·kg−1 (区域土壤Cd含量25%分布) 时,区域人群Cd摄入量由0.71 μg BW·kg−1·d−1显著下降至0.37 μg BW·kg−1·d−1,超过WHO推荐安全值 (0.83 μg BW·kg−1·d−1) [31]的风险概率由31.6%显著下降至14.1%。ÅKESSON和CHANEY[3]指出人体经饮食摄入Cd含量造成的危害随着Zn摄入量的增加而减小。增加牛奶、鸡蛋等高Zn食物在区域人群日常饮食中的比例[3,9]可进一步降低区域人群Cd摄入风险。
土壤酸化是影响Cd在土壤-小麦系统中富集的主要因子[5-6]。在本研究中,有9.61%的土壤pH<7.5,最小值 (pH=5.44,表2) 低于酸化土壤阈值 (pH=5.5,GB 15618-2018) [27]。为保证区域95%农田的安全利用,研究区土壤Cd含量应控制在0.6 mg·kg−1以下 (《土壤环境质量农用地土壤污染风险管控标准 (试行) 》GB 15618-2018) [27]。该场景下区域人群Cd摄入量为0.28 μg BW·kg−1·d−1,超标风险概率可进一步下降至7.3%。在这些土壤酸化区域增施石灰、生物炭等土壤调理剂可有效控制小麦Cd富集[24,32-33],提升小麦质量水平并降低人群Cd摄入风险。众多研究指出土壤-小麦系统Cd累积量还受到距工业区、矿区和城镇区的距离,不同种类肥料的投入及气候条件等多种因素影响[5,34-35]。充分考虑这些因素的影响,基于不确定性分析原理评估区域Cd污染风险水平及相应概率,使评价过程更加稳健可靠,该方法与空间分析的联合使用更有助于风险决策的科学性和合理性。
3. 结论
将Monte-Carlo随机模拟方法引入到地积累指数、潜在风险因子指数和健康风险评价研究中,综合评估区域土壤-小麦系统Cd污染风险。案例分析说明研究区土壤-小麦系统Cd含量空间异质性强,污染风险较高,以区域西北部Cd富集现象最为显著。研究区成人通过食用当地小麦存在一定的健康风险,需引起当地政府足够重视,并根据不同地区概况采取适当防范措施以减少Cd污染危害,保障区域小麦的安全和高质生产。基于不确定性理论开展模拟分析,结果可同步展示不同场景下区域土壤Cd生态风险和小麦Cd健康风险的风险水平及其相应概率,为当地Cd污染防治提供决策支撑,对其他用地类型的重金属污染防治也有一定借鉴作用。
-
表 1 土壤风险指数分级
Table 1. Grade of of soil risk index
分级 0 1 2 3 4 5 6 Igeo值 <0 0~1 1~2 2~3 3~4 4~5 >5 污染程度 无 轻度 轻~中 中度 中~重 重度 极严重 Er值 — <40 40~80 80~160 160~320 >320 — 生态风险 — 低 中等 中~高 高 极高 — 表 2 区域土壤基本性质及土壤-小麦Cd含量特征
Table 2. Descriptive statistics of soil properties and Cd concentration in the soil-wheat system being investigated
检测参数 最小值 最大值 平均值 中值 标准差 土壤pH 5.44 8.60 8.05 8.23 0.56 土壤有机质/(g·kg−1) 10.90 72.90 23.80 21.80 8.82 黏粒/% 16.50 47.30 28.50 28.00 5.54 阳离子交换量 10.60 27.50 18.20 17.8 3.35 土壤Cd/(mg·kg−1) 0.11 3.89 1.45 1.40 0.63 小麦Cd/(mg·kg−1) 0.04 0.51 0.18 0.17 0.09 小麦Cd-BCF 0.022 3.24 0.16 0.12 0.18 -
[1] ZHAO F J, MA Y, ZHU Y G, et al. Soil contamination in China: Current status and mitigation strategies[J]. Environmental Science & Technology, 2015, 49(2): 750-759. [2] XING W, ZHAO Q, SCHECKEL K G, et al. Inhalation bioaccessibility of Cd, Cu, Pb and Zn and speciation of Pb in particulate matter fractions from areas with different pollution characteristics in Henan Province, China[J]. Ecotoxicology and Environmental Safety, 2019, 175: 192-200. doi: 10.1016/j.ecoenv.2019.03.062 [3] ÅKESSON A, CHANEY R. Cadmium exposure in the environment: Dietary exposure, bioavailability and renal effects[J]. Encyclopedia of Environmental Health, 2019, 1: 465-473. [4] 胡文友, 陶婷婷, 田康, 等. 中国农田土壤环境质量管理现状与展望[J]. 土壤学报, 2021, 58(5): 1094-1109. doi: 10.11766/trxb202009220533 [5] RIZWAN M, ALI S, ABBAS T, et al. Cadmium minimization in wheat: A critical review[J]. Ecotoxicology and Environmental Safety, 2016, 130: 43-53. doi: 10.1016/j.ecoenv.2016.04.001 [6] LI Y L, CHEN W P, YANG Y, et al. Quantifying source-specific intake risks of wheat cadmium by associating source contributions of soil cadmium with human health risk[J]. Ecotoxicology and Environmental Safety, 2021, 228: 112982. doi: 10.1016/j.ecoenv.2021.112982 [7] NAN Z, ZHAO C, LI J, et al. Relations between soil properties and selected heavy metal concentrations in spring wheat (Triticum aestivum L. ) grown in contaminated Soils[J]. Water, Air, and Soil Pollution, 2002, 133(1): 205-213. [8] LEI L M, LIANG D L, YU D S, et al. Human health risk assessment of heavy metals in the irrigated area of Jinghui, Shaanxi, China, in terms of wheat flour consumption[J]. Environmental Monitoring and Assessment, 2015, 187: 647. doi: 10.1007/s10661-015-4884-9 [9] SONG Y, WANG Y, MAO W, et al. Dietary cadmium exposure assessment among the Chinese population[J]. Plos One, 2017, 12: 0177978. [10] WANG Z W, NAN Z R, WANG S L, Accumulation and distribution of cadmium and lead in wheat (Triticum aestivum L. ) grown in contaminated soils from the oasis, north-west China[J]. Journal of the Science of Food and Agriculture, 2011, 91(2): 377-384. doi: 10.1002/jsfa.4196 [11] 李岩, 师华定, 刘孝阳, 等. 耒水流域土壤重金属污染的时空变异对比[J]. 环境工程学报, 2020, 14(3): 842-852. doi: 10.12030/j.cjee.201905097 [12] MULLER G. Index of geoaccumulation in sediments of the Rhine river[J]. Geojournal, 1969, 2(3): 109-118. [13] HAKANSON L. An ecological risk index for aquatic pollution control-a sedimentological approach[J]. Water Research, 1980, 14(8): 975-1001. doi: 10.1016/0043-1354(80)90143-8 [14] ZHUANG Z, WANG Q, HUANG S, et al. Source-specific risk assessment for cadmium in wheat and maize: Towards an enrichment model for China[J]. Journal of Environmental Sciences, 2023, 125(3): 723-734. [15] 李艳玲, 陈卫平, 杨阳, 等. 济源市平原区农田重金属污染特征及综合风险评估[J]. 环境科学学报, 2020, 40(6): 2229-2236. doi: 10.13671/j.hjkxxb.2020.0020 [16] USEPA, Risk assessment guidance for superfund, Volume I: Human health evaluation manual part A [M]. Environmental Protection Agency, Washington, D. C. 1989. [17] 国家环境保护局, 中国环境监测总站. 中国土壤元素背景值[M]. 北京: 中国环境科学出版社, 1990. [18] 陈卫平, 杨阳, 谢天, 等. 中国农田土壤重金属污染防治挑战与对策[J]. 土壤学报, 2018, 55(2): 261-272. [19] CHEN W P, LI L Q, CHANG A C, et al. Characterizing the solid-solution partitioning coefficient and plant uptake factor of As, Cd, and Pb in California croplands[J]. Agriculture Ecosystems & Environment, 2009, 129(1-3): 212-220. [20] YANG Y, LI Y L, DAI Y T, et al. Historical and future trends of cadmium in rice soils deduced from long-term regional investigation and probabilistic modeling[J]. Journal of Hazardous Materials, 2021, 415: 125746. doi: 10.1016/j.jhazmat.2021.125746 [21] SWARTJES F A, VERSLUIJS K W, OTTE P F. A tiered approach for the human health risk assessment for consumption of vegetables from with cadmium-contaminated land in urban areas[J]. Environmental Research, 2013, 126: 223-231. doi: 10.1016/j.envres.2013.08.010 [22] PENG C, WANG, M E, CHEN W P. Modelling cadmium contamination in paddy soils under long-term remediation measures: model development and stochastic simulations[J]. Environmental Pollution, 2016, 216: 146-155. doi: 10.1016/j.envpol.2016.05.038 [23] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. [24] 王天齐, 李艳玲, 杨阳, 等. 碱性土壤锌镉比对小麦籽粒镉积累的影响[J]. 环境科学学报, 2021, 41(12): 5143-5149. doi: 10.13671/j.hjkxxb.2021.0209 [25] 张扣扣, 贺婧, 钟艳霞, 等. 基于GIS对宁夏某铜银矿区周边土壤重金属来源解析[J]. 环境科学, 2022, 43(11): 5192-5204. doi: 10.13227/j.hjkx.202201113 [26] 环境保护部. 中国人群暴露参数手册(成人卷)[M]. 北京: 中国环境出版社, 2013: 256. [27] 土壤环境质量农用地土壤污染风险管控标准(试行): GB 15618-2018 [S]. 2018. [28] 国家卫生部, 国家标准化管理委员会. 食品中污染物限量: GB 2762-2005[S]. 2005. [29] 张红振, 骆永明, 章海波, 等. 水稻、小麦籽粒砷、镉、铅富集系数分布特征及规律[J]. 环境科学, 2010, 31(2): 488-495. doi: 10.13227/j.hjkx.2010.02.042 [30] LIU K, LV J L, HE W X, et al. Major factors influencing cadmium uptake from the soil into wheat plants[J]. Ecotoxicology and Environmental Safety, 2015, 113: 207-213. doi: 10.1016/j.ecoenv.2014.12.005 [31] JECFA (Joint FAO/WHO Expert Committee on Food Additives), Joint FAO/WHO Expert Committee on Food Additives Seventy-third Meeting [M]. World Health Organization, Geneva. 2010. [32] 周睿, 魏建宏, 罗琳, 等. 赤泥添加对石灰性土壤中Pb、Cd形态分布及小麦根系的影响[J]. 环境工程学报, 2017, 11(4): 2560-2567. doi: 10.12030/j.cjee.201606191 [33] 曹阳, 李撑娟, 王辉, 等. 施加钝化剂及叶面肥对大田小麦-玉米轮作Cd吸收转运的影响[J]. 农业环境科学学报, 2023, 42(2): 319-326. doi: 10.11654/jaes.2022-0730 [34] GRÜTER R, MEISTER A, SCHULIN R, et al. Green manure effects on zinc and cadmium accumulation in wheat grains (Triticum aestivum L. ) on high and low zinc soils[J]. Plant and Soil, 2017, 422: 437-453. [35] GRÜTER R, COSTEROUSSE B, MAYER J, et al. Long-term organic matter application reduces cadmium but not zinc concentrations in wheat[J]. Science of the Total Environment, 2019, 669: 608-620. doi: 10.1016/j.scitotenv.2019.03.112 -




 下载:
下载: