-
义乌市是世界最大的小商品集散中心,经济高速发达且人口密集[1]。城市化的高速发展不可避免地造成了环境污染,义乌市内的水体污染严重。义乌市年平均水资源总量为8.25×109 m3,但人均水资源量却不到700 m3,远低于全国平均水平,因此水资源短缺已严重制约义乌经济社会的可持续发展[2-4]。分质供水能够开发非常规水资源,优化水资源配置,满足城市用水端和水质多样化的需求,是实现水资源可持续发展的有效措施[5-6]。当从市外调水困难时,分质供水是解决义乌市水资源与水环境问题的有效方案。
义乌市将被污染的义乌江江水和生活污水厂尾水分别作为城市杂用水和工业用水的水源。然而,产出的低品质水不能维持管网生物稳定性,造成水体出现黄色絮状物,用水企业膜污染加重等问题,这可能是水源水质差和处理工艺效能不足等因素的结果。江水和污水厂尾水的水质易受自然因素与人为因素的影响[7-9],这可能会导致后续混凝沉淀、介质过滤和消毒等工艺的处理效能下降[10-11]。义乌市分质供水采用传统工艺(混凝沉淀、过滤、消毒)处理义乌江水,双膜(超滤-反渗透)工艺处理污水厂尾水。双膜法的水质净化效果优良,出水较稳定,但传统工艺在处理水质多变的受污染江水的过程中是否能保障水质稳定性还有待商榷。传统工艺中只有混凝沉淀能去除一部分有机质[12-13],剩余的生物可利用性有机质可能会促进管网异养菌大量繁殖,导致管网末端水质恶化。此外,混凝沉淀还极易受到其他因素的影响,例如,低温会影响Al离子的水解和絮体的形成从而降低混凝效果[14],降雨带来的浊度激增也会影响混凝的效果[15]。为解决水质不稳定的问题,调研分质供水系统中水质的变化特征,以及探究处理工艺对溶解性有机质(dissolved organic matter,DOM )的去除效果十分重要。
本研究选取义乌市分质供水系统中的A水厂、B水厂、C水厂3个水厂为研究对象,使用基本水质分析方法和光谱学技术探究了水处理过程中原水水质参数和DOM组成的变化,并使用高分辨率质谱(fourier transform ion cyclotron resonance mass,FT-ICR MS)深入分析了混凝过程中的DOM分子变化情况,为优化水处理工艺和保障水质安全提供理论参考。
-
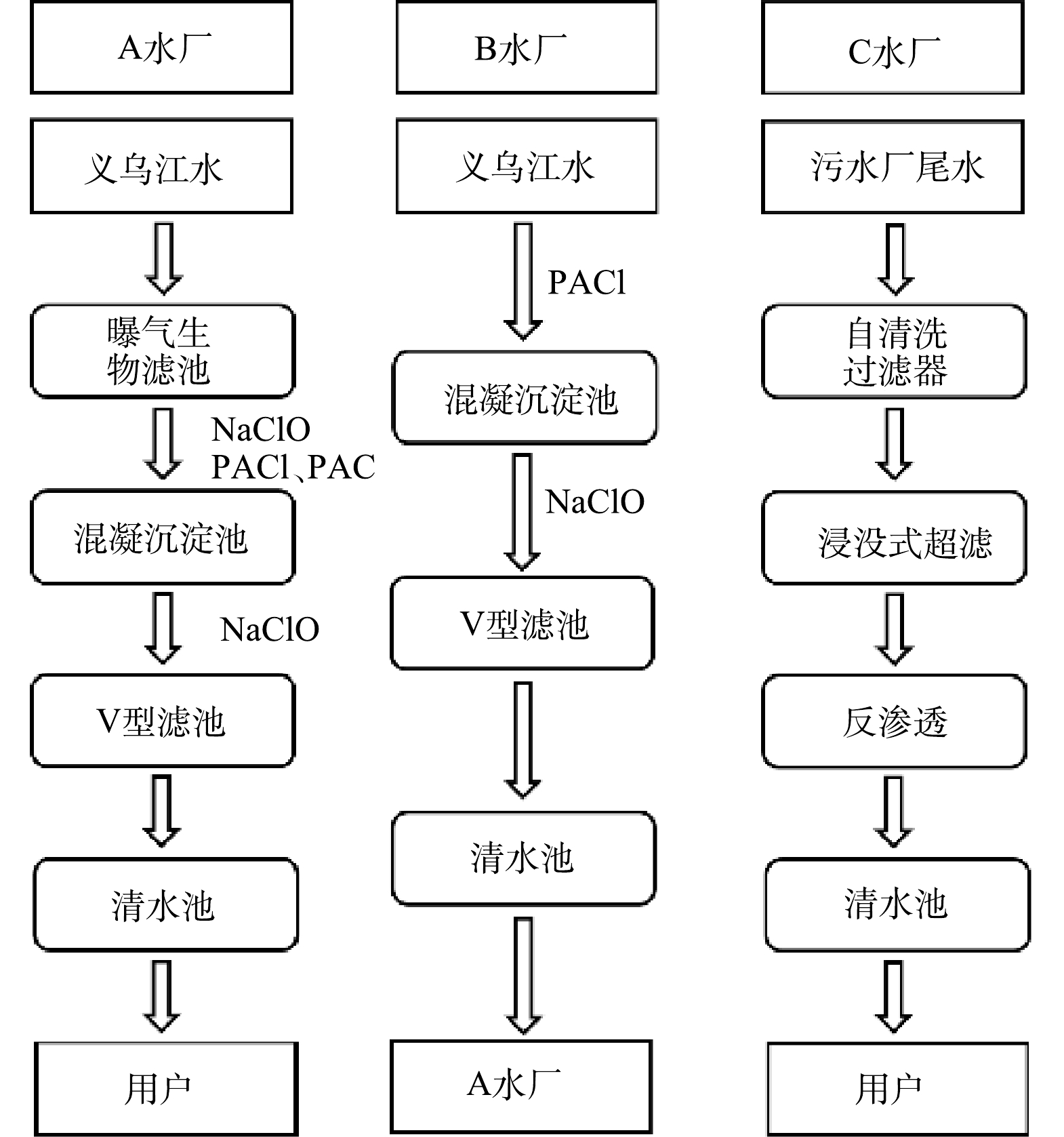
于2021年11月—2022年9月,在A、B、C 3个水厂中分季度取样,水厂各工艺段均设有采样点,处理工艺及采样点如图1所示。2022年之前,A和B水厂以义乌江江水为水源进行生产,采用传统工艺,使用聚合氯化铝(PACl,12.5 mg·L−1)进行混凝。采集A、B水厂的原水、沉淀池出水、滤池出水及出厂水。由于A、B水厂出水到达用户端时出现水质不稳定的问题,A水厂在2022年3月优化工艺,原水先经过曝气生物滤池(BAF)处理,加一定量NaClO后再进行混凝沉淀(PACl,7 mg·L−1),并加入粉末活性炭(PAC,25 mg·L−1)做助凝剂。C水厂使用污水处理厂尾水为原水,采用双膜处理工艺,采集原水、超滤出水、反渗透出水和水厂出水。使用2021年11月采取的B水厂原水与沉后水进行FT-ICR-MS分析。
-
水样的基础理化参数(pH、总溶解性固体(TDS)、电导率、浊度等)采用便携式水质仪(YSI ProDSS, USA)测定(使用前已校正)。氨氮、总氮、总磷分别采用《水质 氨氮的测定 纳氏试剂分光光度法》(HJ 535-2009)、《水质 总氮的测定 碱性过硫酸钾消解紫外分光光度法》(HJ 636-2012)及《水质 总磷的测定 钼酸铵分光光度法》(GB 11893-89)测定。水样过0.45 μm醋酸纤维脂滤膜后,使用岛津TOC-L总有机碳分析仪测定水样的总溶解性有机碳(DOC)。
-
1)紫外吸收光谱分析。采用北京普析公司的TU-1810PC紫外分光光度计测定DOM在200~600 nm内的吸光度,扫描间隔为1 nm。分别计算a(355)(355 nm处的吸收系数)、SUV254(254 nm处吸收系数a与DOC浓度的比值)、SUV260(260 nm处吸收系数a与DOC浓度的比值)、E2/E3(250 nm和365 nm处吸光度之比)。吸收系数根据式(1)和式(2)[16]进行计算。
式中:a(λ)为波长λ下的吸收系数,m−1;a'(λ)为波长λ下的未校正吸收系数,m−1;λ为波长,nm;D(λ)为波长λ下的吸光度;L为光程路径,cm。
2)三维荧光光谱分析。DOM的三维荧光光谱分析是在上海天美FL970 Plus型荧光光谱分析仪上进行的。仪器激发光源为150 W氙弧灯,PMT电压700 V,狭缝宽度为2.5 nm,扫描速度设为12 000 nm·min−1,间隔为5.0 nm。样品扫描波长范围为:激发波长Ex为200~400 nm,发射波长Em为220~550 nm,使用1 cm石英比色皿,响应时间为自动。扫描光谱进行仪器自动校正,以纯水作为空白。
使用Matlab (2022b)中的drEEM0.6、DomFluor工具箱进行PARAFAC分析,其基本原理是将一个三维矩阵分解为因子数为N的三线性组份矩阵和对应的残差项[17],再基于最小二乘法使残差项最小,其数学表达式如式(3)所示。
式中:Xi,j,k是第i个样品的第j个发射波长和第k个激发波长处的荧光强度;ai,f是第i个样品中f组分所占的浓度比例;bi,f和ck,f分别代表第f个组分在第j个发射波长和第k个激发波长上的估算数值;F为组分数目;ei,j,k为模型残差,代表模型未计算的变异性。
扣除空白并去除瑞利散射和拉曼散射,然后建立平行因子分解 (parallel factors,PARAFAC) 模型,利用残差分析和拆半分析验证模型有效性并确定荧光组分个数,输出荧光组分图[18]。随后计算水厂各工艺段样品DOM的荧光指数(fluorescence index,FI)、自生源指数(autochthonous index,BIX)、腐殖化指数(the humification index,HIX)。
3)固相萃取和FT-ICR MS分析。使用PPL固相萃取柱提取水样中的DOM。首先将固相萃取小柱放置于多孔真空装置上,使用18 mL甲醇(LC-MS级)活化柱子,随后使用18 mL酸化超纯水(pH=2)淋洗柱子。利用负压吸入酸化过的水样(pH=2),使水样在压力的作用下流经柱子,保持流速为5 mL·min−1左右,萃取出DOM。然后使用少量酸化超纯水淋洗萃取柱以去除杂质,用氮吹方式使萃取柱内完全干燥,最后使用6 mL甲醇洗脱。将萃取后的DOM在−18 ℃下避光保存。
萃取后的样品使用Bruker公司SolariX型FT-ICR MS检测,其磁场强度为15.0 T。离子源为电喷雾离子源(ESI),负离子模式。主要检测参数:进样方式为连续进样,进样速度为120 μL·h−1,毛细管入口电压为−3.8 kV,离子累积时间为0.2 s,采集质量为100~1 600 Da。样品检测前用 10 mmol·L−1甲酸钠对仪器进行校正,样品检测完成后用50%异丙醇进行内标校正。经校正后,检测的质量误差均小于1 mg·L−1。使用Bruker数据分析软件鉴定质谱峰的分子式。
-
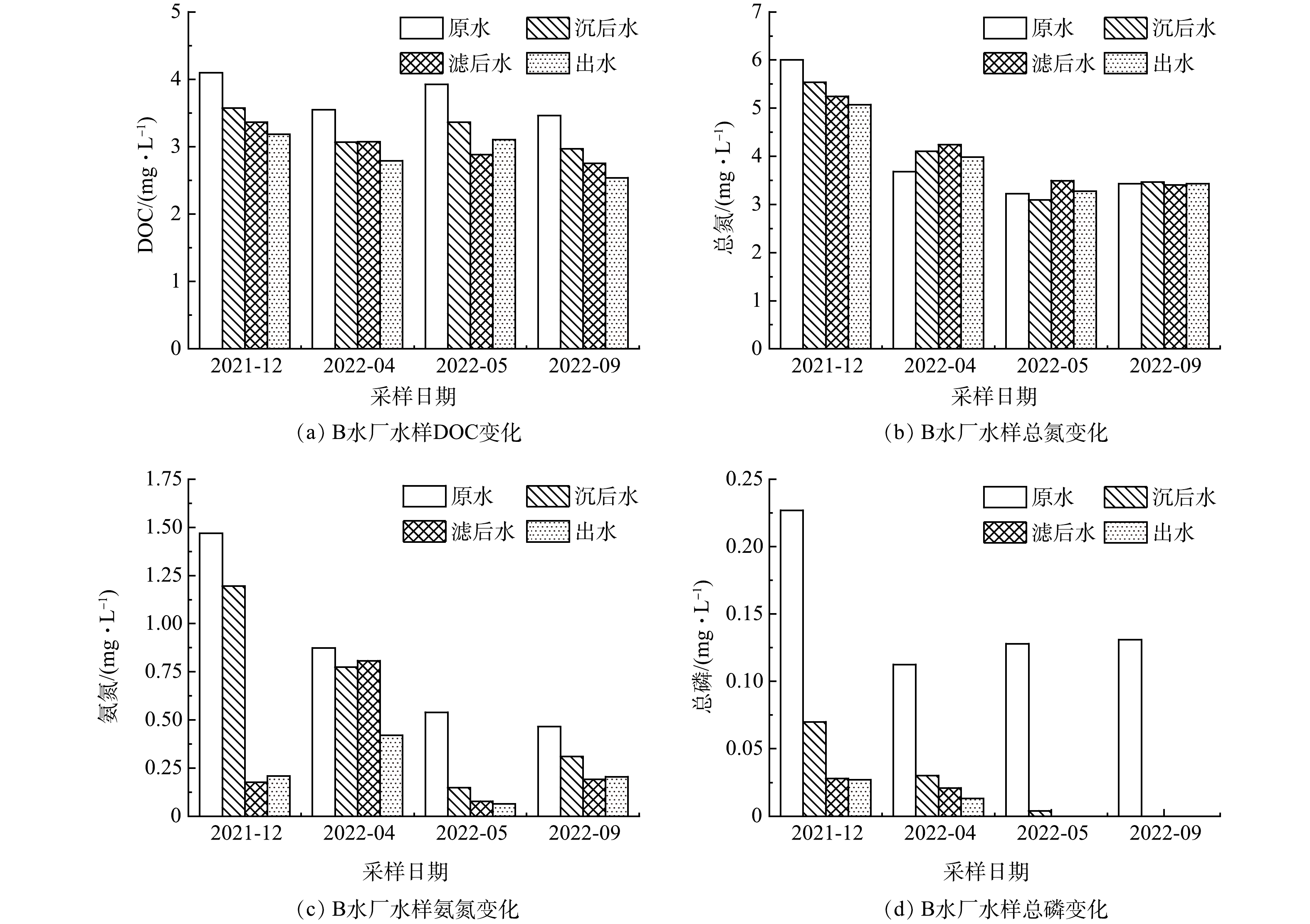
如图2所示,12月(冬季),A水厂的原水水质较差,原水中总氮与氨氮的含量分别为6.95 mg·L−1和2.05 mg·L−1,分别是其他季节的2倍和8倍,其中总磷的含量也明显高于其他季节。而4月(春)、5月(夏)和9月(秋),3次原水水质较好的原因可能是雨季大量增加了河流流量,从而降低了总氮和氨氮等营养物质的浓度[19]。12月,A水厂对水中DOC和总氮的去除效果较差,对DOC的去除率仅为8%,但对水体中总磷和氨氮的去除率分别达到96%和85%。2022年3月,优化工艺后,A水厂对DOC的去除效果明显提升,去除率达到27%~37%。这可能是因为BAF中的生物膜矿化了一部分可生物降解有机物[20]。此外,4个季度水厂出水均满足《城市污水再生利用 城市杂用水水质》(GB/T 18920-2020)的要求。
如图3所示,B水厂12月的进水水质同样是全年中最差的,与之对应的出水水质也是全年最差。该水厂混凝-砂滤工艺对总氮基本没有去除效果,对水体DOC的去除率在21%~27%,不及优化工艺后的A水厂。此外,B水厂对氨氮的去除效果不稳定。4次取样中,水厂对氨氮的去除率分别为86%(12月)、52%(4月)、88%(5月)、56%(9月)。4月原水氨氮浓度较高,水厂出水氨氮质量浓度(0.42 mg·L−1)也比较高,接近于《城市污水再生利用 城市杂用水水质》推荐的氨氮质量浓度(0.5 mg·L−1)。所以当原水氨氮浓度较高时,B水厂出水氨氮含量可能存在超标的风险。虽然B水厂出水也满足《城市污水再生利用 城市再用水水质》的要求,但B水厂的传统工艺对总氮和DOC的去除效果较差,对氨氮的去除也不稳定。由此可见,在处理复杂多变的受污染河水时,B水厂难以保障出水水质的稳定,需要对工艺进行优化。
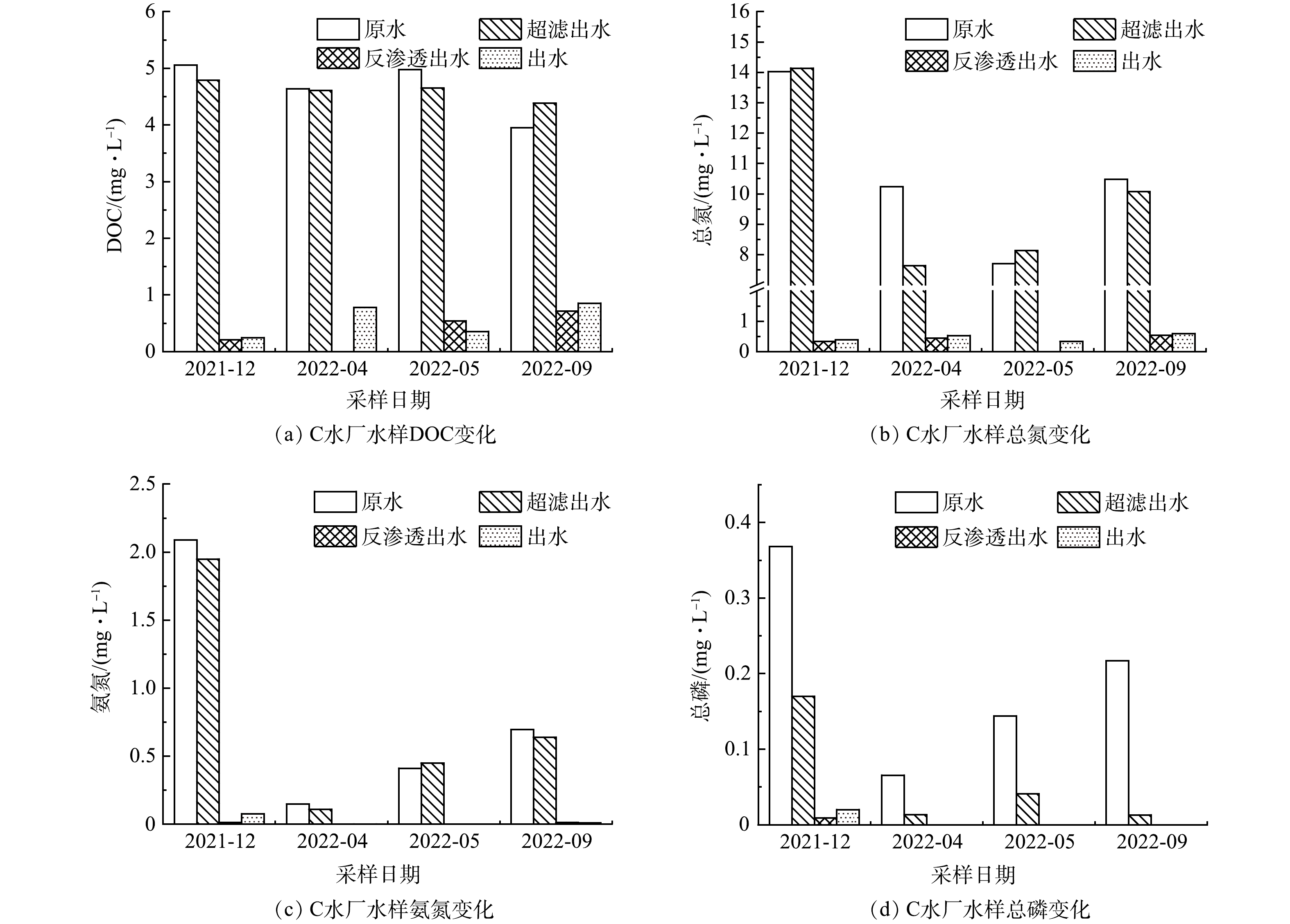
C水厂水源为生活污水厂尾水,其12月的水质同样是全年中最差的,但由于双膜法的优良效果,出水的各项水质指标一直较为稳定。如图4所示,双膜工艺不仅能够有效去除水体中的总氮、总磷和氨氮(去除率>95%),而且对DOC的去除效果也明显优于混凝工艺,去除率高达78%~95%。
3个水厂对浊度均有较好的去除效果(表1),去除率均在80%以上。但A、B水厂不能降低水体的总溶解性固体(total dissolved solids,TDS)和电导率。C水厂则能近乎完全去除水中的各种离子。由此可见,双膜工艺全面优于混凝工艺,能实现污染水源的净化。
综上所述,混凝工艺不能有效去除水体中的营养物质(DOC、总氮),对水体的离子组成(TDS、电导率)也无明显改善,同时受原水水质的影响较大。优化后的工艺能够提高工艺对营养物质的消减,能够提供较为稳定的水源。而双膜工艺能同步去除各种污染物,得到优质水资源。DOM作为水体微生物可直接利用的碳源,与水体生物稳定性密切相关。混凝工艺残留了大量DOM,是威胁水体稳定性的潜在因素,所以探究不同工艺对DOM的影响是十分必要的。
-
发色DOM(chromophoric dissolved organic matter,CDOM)具有吸光特性,其紫外-可见吸收光谱能在一定程度上表征其特性[16]。具有双键或羟基共轭系统的有机物在254 nm处具有很强的吸收,所以可以用SUVA254来表示DOM的芳香性[16],SUVA260来表示DOM的疏水性[21]。除此之外,355 nm处的吸收系数a(355)能表示CDOM的相对浓度[22],250 nm和365 nm处吸收系数之比(E2/E3)与DOM分子量呈负相关[23]。对不同水厂水样DOM的光谱数据分析结果见表2。
A水厂水样的a(355)随工艺的运行而下降,BAF处理后,水样的a(355)值从3.68降至在2.42。混凝后,a(355)再次大幅度下降至0.81,这说明BAF和混凝有效降低了水体中的CDOM。氯化消毒可以破坏DOM的芳香性结构,混凝沉淀能够有效去除水体中疏水性DOM[24],两者致使A水厂沉后水和滤后水的SUVA254和SUVA260明显下降。BAF和砂滤池能过滤掉大分子物质,水样E2/E3值有所上升。混凝倾向于去除相对分子量较大的DOM[25-26],所以混凝沉淀过后,水样E2/E3值大幅度上升。
B水厂沉后水的a(355)值从4.26降到1.26,SUVA254值从5.08降至3.96,SUVA260值从4.79降至3.68。这说明B水厂也能够有效降低水体中CDOM和芳香性DOM含量。值得注意的是,B水厂在消毒过滤后,SUVA254与SUVA260值升高。已有研究表明消毒剂会导致藻类释放有机质进入水体[27],因此推测消毒破坏了水中藻类和微生物的细胞膜,导致其释放一部分芳香类物质进入水体,随着消毒剂的持续作用,这部分物质的芳香性结构最终被破坏,使最后出水的SUVA254与SUVA260值降低。
C水厂超滤处理后,水样的紫外光谱特征值并无明显变化,表明超滤并未有效截留水中的DOM。反渗透处理后,a(355)从2.54降到0.12,水中CDOM几乎被完全去除。SUVA260从3.46降至2.71,说明反渗透对疏水性DOM的去除效果更好。反渗透能过滤掉所有大分子DOM,对比E2/E3值时,365 nm处的紫外光谱无吸收。
对比3水厂水样的紫外光谱特征值发现,在去除CDOM的过程,双膜工艺明显占优,优化工艺与传统工艺相比并无明显优劣。
-
3D-EEM可以方便、快速地表征DOM中的荧光成分。本研究采用3D-EEM分析水厂水样,以探究DOM在水厂各工艺段的变化。为探究DOM来源,计算了水样的荧光特征参数(表3)。
自身源性指数BIX(Ex=310 nm 时,Em在380 nm与430 nm处的荧光强度的比值)反映了DOM中自身源组分的大小。3个水厂原水水样BIX值均大于1,说明水体中的DOM主要由水生植物及浮游微生物代谢产生,水体有强烈的自身源特征[27]。荧光指数FI(Ex=370 nm,Em在450 nm与500 nm处荧光强度的比值)可以表征DOM中类腐殖质组分的来源情况[28],3个水厂原水的FI值均小于1.3,表明DOM中的腐殖质组分多为陆地和土壤输入。腐殖化因子HIX(Ex=254 nm时,Em在435~480 nm区域积分值与300~345 nm区域积分值之比)表征DOM的腐殖化程度[18]。有研究[28]表明,当HIX>0.9时,表明DOM有显著腐殖质特征;当HIX<0.8时DOM为弱腐殖质特征。各水厂原水HIX值均低于0.8,水样DOM腐殖化程度较低。荧光光谱特征参数共同说明了3水厂原水的DOM主要由微生物活动产生,腐殖化程度较低,含有的少量腐殖质主要由陆地和土壤输入。
此外,观察到A和B水厂沉后水与滤后水的HIX值都有明显下降,这说明混凝沉淀与消毒过滤能够去除部分腐殖质[29],使得水样的腐殖化程度降低。由于水体腐植化程度较低,A和B水厂未能改变水体DOM的主要成分。C水厂RO处理后,FI值上升至1.41~1.93,腐殖质中内源微生物输入部分的占比扩大,成为腐殖质中的主要组分。BIX大幅度上升,与之对应的HIX大幅下降,说明DOM的腐殖化程度进一步下降,自身源性增强。结合紫外光谱特征值的结论,可以推测,陆地输入的腐殖质多为大分子物质且具有一定的芳香性,而C水厂水体中残留的小分子物质主要是水生植物与微生物产生类蛋白质类物质。
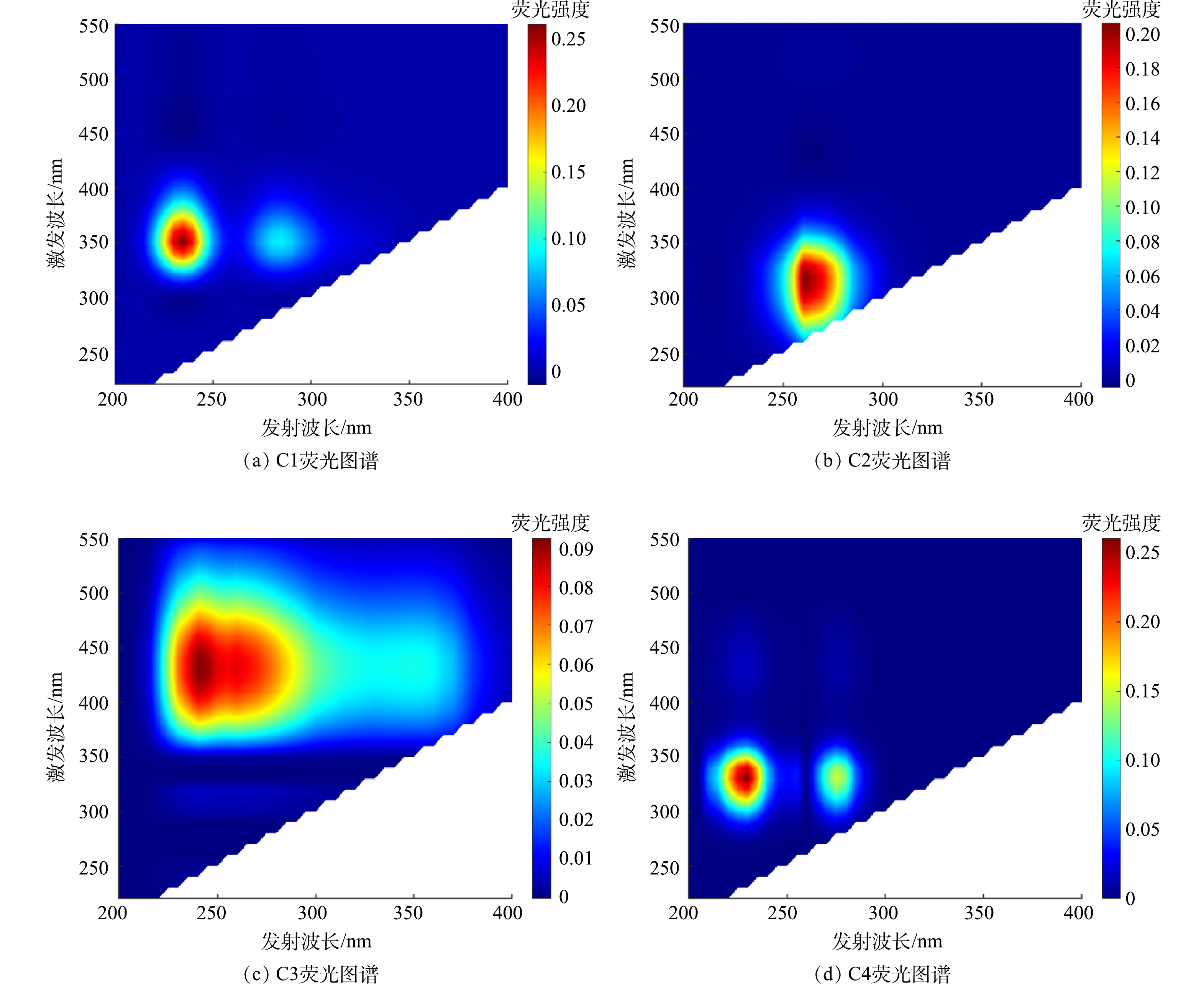
双膜工艺对DOC的去除率极高(78%~90%),这是因为反渗透膜截留了大分子物质,保障了出水安全。但混凝对DOC的去除效果差,出水残留了大量DOM,还需探究A和B水厂水体DOM的组成与变化。故使用PARAFAC算法分析2水厂水样DOM的荧光光谱,得到3组类蛋白质组分和1组类腐殖质组分(图5)。
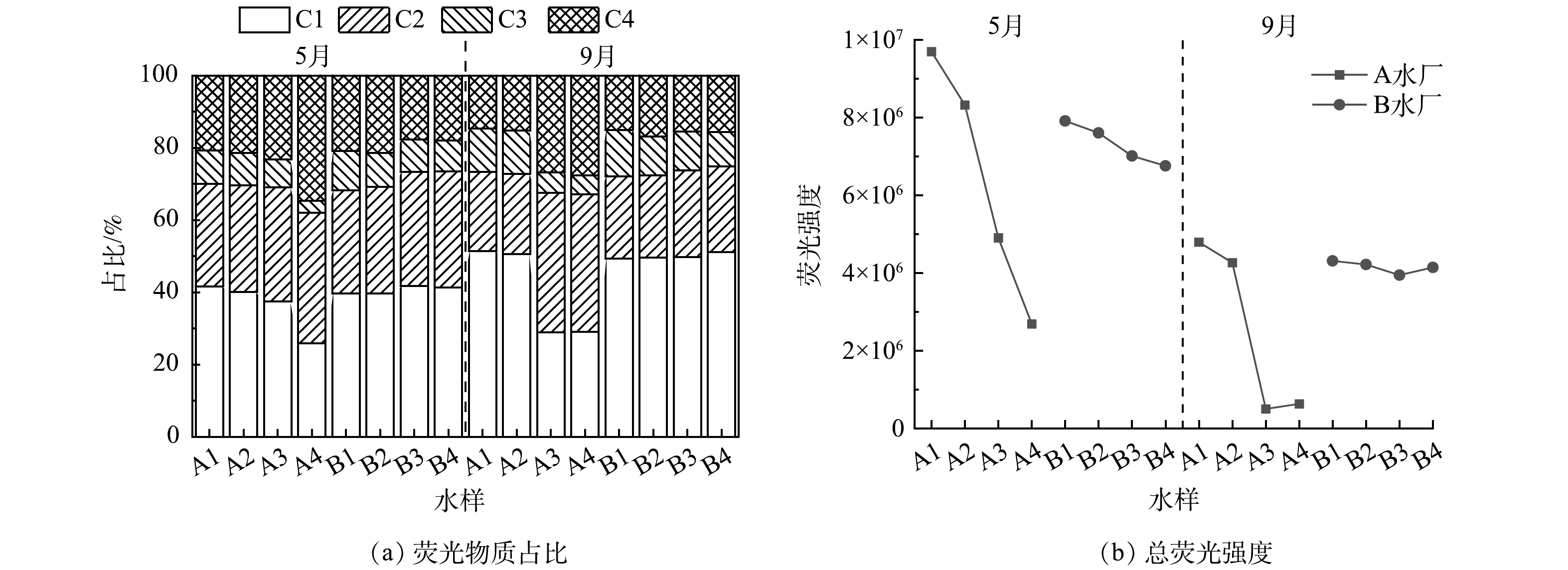
将各组分的光谱信号与OpenFluor数据库[30]进行比对,C1、C2、C3的Tucker收敛系数(TCC)均高于0.97,表明这3种荧光成分是环境中常见的物质。其中,C1(Ex/Em=240(280)/350 nm)为类色氨酸组分,属于生物降解的类蛋白质物质[31-32]。C2(Ex/Em=265/315 nm)是类蛋白质类组分,与芳香族氨基酸极为相似,在已有的研究中被认为是易被生物降解的物质[31, 33-34]。组分C3(Ex/Em<260(320)/440 nm)传统上被称为陆地来源的腐殖质类组分,通常具有较高的分子量与芳香性[34-37]。而C4(Ex/Em<230(276)/340 nm)未匹配到相似度较高的组分,但在相关研究中(0.93<TCC<0.95),该组分被识别为类色氨酸组分[18, 38-39]。如图6(a)所示,A、B水厂各工艺段水体的DOM中,类色氨酸组分C1和C4占主要地位(54%~67%),类蛋白质组分C2(22%~39%)次之,类腐殖质组分C3(4%~13%)占比最小。这一结果与荧光光谱特征参数的结果一致。因为夏(5月)、秋(9月)两季河水中水生植物与浮游微生物生长代谢迅速,产生了大量类蛋白质类的DOM,而混凝对蛋白质类脂肪族物质以及分子质量较小的DOM的去除效果较差[40]。这2个因素能在一定程度上解释2水厂各工艺段水体DOM荧光组成的变化。
在B水厂水样DOM的荧光组分中,只有C3与水样DOC含量呈正相关(P<0.05),而DOC含量随工艺进行而降低,这说明传统工艺优先去除水中类腐殖质物质。而C3组分占比太小,混凝沉淀和过滤消毒对类蛋白质组分的去除效果差,所以水厂各阶段出水的总荧光峰强度下降幅度低,水厂出水中残留了大量类蛋白质类有机物。其中C2组分易被生物降解,C1与C3为色氨酸类组分,波长较短的部分( <250nm)优先被微生物利用[41]。这表明B水厂出水的生物稳定性可能较差,微生物风险较大。
从图6(b)中可以看出,A水厂出水DOM的总荧光强度大幅度降低,说明A水厂能有效降低原水中的荧光溶解性有机质(fluorescent dissolved organic matter,FDOM)的含量。A水厂在混凝过程中添加了活性炭,活性炭能够增大混凝过程中形成的絮体,提高混凝效果[42-43],并且活性炭的吸附作用也能去除一些芳香类蛋白质。所以A水厂混凝的效果远优于B水厂。滤后水中C1与C3占比出现明显下降,C2与C4的占比升高,说明优化工艺优先去除C1和C3组分,对C2和C4组分的去除效果较差。C1、C3与DOC含量显著正相关(P<0.01),C2与DOC含量正相关(P<0.05),C4与DOC含量无相关性,4组分物质与DOC的相关性也证明了优化工艺对C1和C3组分的去除效果较好。消毒过程表现出对DOM的选择性去除,其原因可能在于C1与C3组分中含有较多的芳环和烯烃等不饱和碳键,优先与消毒剂反应,而C2与C4所含的不饱和键较少,还原性比C1与C3弱,与消毒剂的反应活性较低。有研究表明,加氯量较少时,消毒剂优先参与微生物灭活,当加氯量超过一定剂量,消毒过滤才对DOM有明显的去除[44]。所以,可能是消毒剂的用量较低,导致B水厂滤后水和A水厂沉后水(混凝前加氯)的荧光组成未出现较大变化。A水厂出水残留的荧光组分同样为C1、C2和C3,生物可利用性强,但其总荧光峰强度降低了70%,降低了出水的微生物风险。
综上所述,传统工艺能去除部分大分子陆源腐殖质,但不能有效去除水体中的类蛋白质类DOM,这类易降解的物质残留在水体中会增加水体的微生物风险。优化工艺能极大的提高水厂对FDOM的去除,实现类腐殖质与类蛋白质DOM的有效去除。双膜工艺可以有效的去除水体中大部分DOM。
-
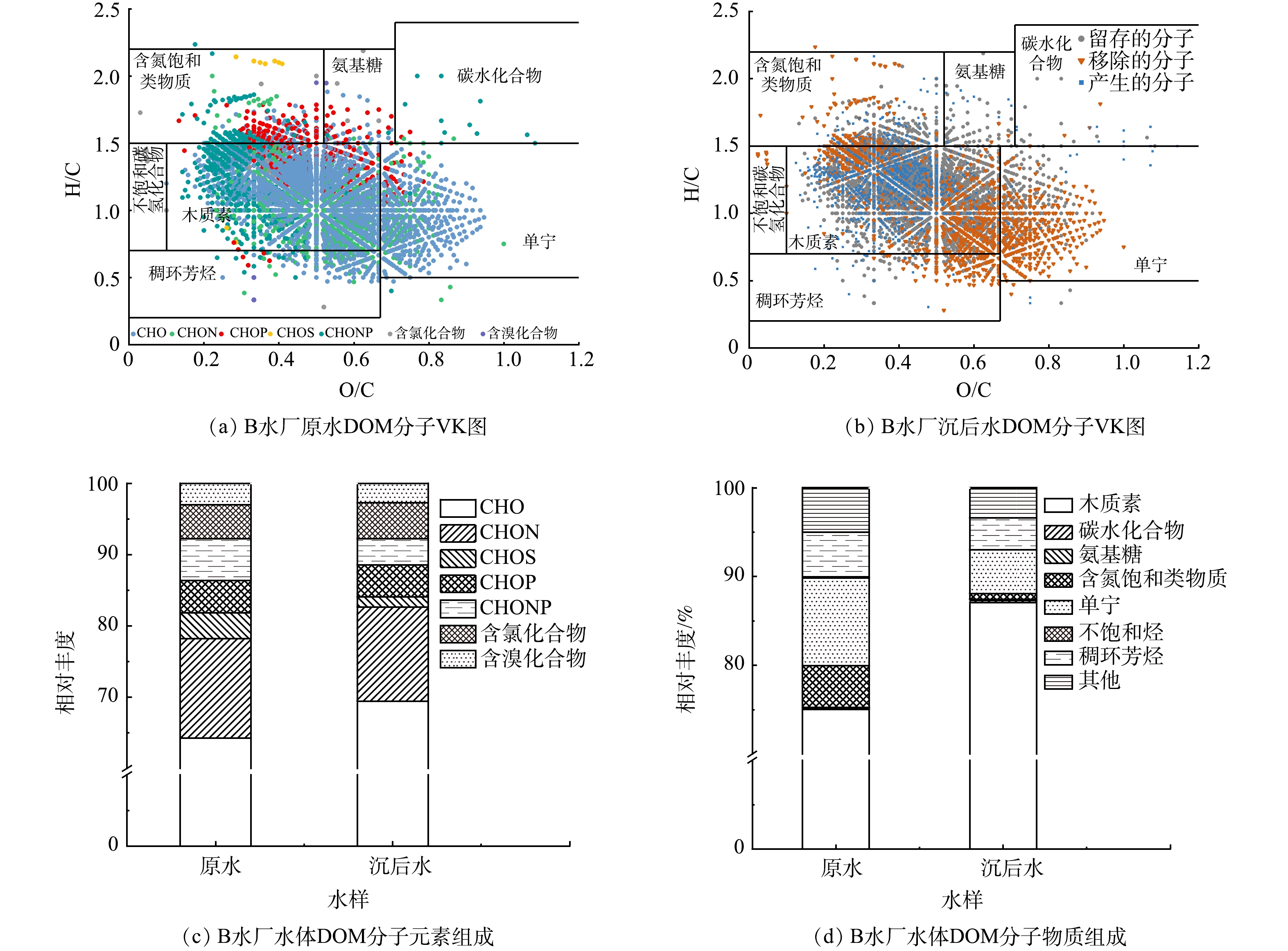
为了探究混凝过程中DOM分子组成的详细变化,取B水厂原水与沉后水进行了高分辨率质谱的分析。将原水DOM样品的分子组成用Van Krevelen(VK)图(图7(a))来表示,为了清晰对比混凝后DOM分子组成的变化,将沉后水中未变化的分子(resistant),被去除的分子(removed)和新产生的分子(produced)绘制成VK图(图7(b))。按照O/C和H/C分别为横、纵坐标把VK图分为7个区域,包括木质素、单宁、含氮饱和类物质、不饱和碳氢化合物、氨基糖、碳水化合物、稠环芳烃及其他物质,各区域代表的化合物占比如图7(d)所示。
如图7(a)和图7(d)所示,木质素是B水厂原水中的主要成分,其占比达到75%。沉淀过程后,木质素的占比进一步增加至87%,而单宁的占比由9.9%下降至4.9%,含氮饱和类物质的占比由4.7%下降至0.65%。从图7(b)可以看出,混凝倾向于去除O/C较高且H/C较低的物质。这类物质主要为单宁,还包括部分稠环芳烃与木质素,这些物质通常具有较高的芳香性和疏水性。这也是混凝后SUVA254及SUVA260降低的直接原因。从元素组成(图7(c))来看,混凝后CHON分子占比无较大的变化,说明混凝难以去除DOM中的类色氨酸组分和类酪氨酸组分。CHOS和CHONP分子的占比降低,说明混凝能有效去除水体中的溶解性有机磷与溶解性有机硫。
通过B水厂混凝前后的等效双键(double bond equivalent,DBE)与碳原子数之间的关系(图8)也能够看出,混凝过后含有高O/C比和高DBE/C比的物质被去除,C原子数大于15的分子明显减少,这些大分子高芳香性物质的去除也与前文混凝倾向于去除疏水性较高的陆源腐殖质的结论一致。
-
1)混凝工艺不能有效去除DOC与总氮,且对氨氮的去除效果不稳定。优化工艺(BAF、预氯化、活性炭助凝)能维持水厂出水的稳定。双膜工艺可以提供最优质的水资源。
2) A和B水厂水体FDOM包含3个类蛋白质组份(C1、C2和C4)和1个类腐殖质组份C3。其类蛋白质组分的含量占绝对优势,达到总荧光强度的87%以上。
3)混凝工艺(B水厂)只能去除部分陆源腐殖质,而优化工艺能大幅度消减水体FDOM。双膜法能够去除绝大部分DOM。为保障B水厂出水安全,可以通过加入BAF、添加预氧化阶段和加入助凝剂等手段来优化水处理工艺。
4)FT-ICR-MS的检测结果表明,混凝对高芳香性的木质素和单宁类物质的去除效果较好。
义乌市分质供水系统水质变化分析
Analysis of water quality changes in dual water supply system in Yiwu city
-
摘要: 为探究义乌市分质供水系统中水质及有机物的变化特征,分季度调研了3个水厂沿程水质的变化,并采用光谱技术与高分辨率质谱分析了处理工艺对溶解性有机质的去除效果。水质调研结果表明,传统工艺(混凝沉淀-砂滤)对总磷和氨氮的去除率分别达到80%与50%以上,但对水体中的总氮与总溶解性有机碳的去除效果差。双膜法(超滤-反渗透)全面优于传统工艺,可以将营养盐和有机物的浓度降至极低的水平(去除率>90%)。三维荧光结合平行因子分析结果表明,混凝沉淀仅对地表水中陆源腐殖质组分有明显的去除,对类蛋白质组分的去除效果较差。高分辨率质谱的检测结果表明,混凝对木质素、单宁及稠环芳烃等物质有较好的去除效果。在混凝前增设曝气生物滤池并在混凝过程中添加粉末活性炭,能强化工艺对类蛋白质组分和腐殖质组分的去除效果。本研究结果可为水处理工艺优化提供理论依据。Abstract: To explore the changes in water quality and organic matter in the dual water supply system of Yiwu city, the water quality changes along the process in three water treatment plants were investigated in the four quarters, and the removal effects of dissolved organic matter (DOM) by the treatment process were analyzed by spectroscopy technology and high-resolution mass spectrometry. The results showed that the removal rates of total phosphorus and ammonia nitrogen by the traditional process (coagulation/sedimentation-sand filtration) could reach over 80% and 50%, respectively, while the removal effects of total nitrogen and total dissolved organic carbon (DOC) were poor. The ultrafiltration (UF)-reverse osmosis (RO) process was superior to the traditional process, and it could reduce the concentrations of nutrients and organic matter to extremely low levels (removal rate > 90%). EEMs-PARAFAC showed that the coagulation-sedimentation only significantly removed the fractions of terrestrial humic from surface water, but was less effective in removing protein-like fractions. The data of high-resolution mass spectrometry also showed that coagulation had a good effect on the removal of lignin, tannin and condensed aromatic hydrocarbons. By adding a biological aerated filter before coagulation and dosing powdered activated carbon during the coagulation process, the removal effects of protein-like fractions and humic fractions (70% reduction in total fluorescence peak intensity) could be greatly improved. This study can provide a theoretical basis for water treatment process optimization.
-
Key words:
- dual water supply /
- water quality /
- UV spectrum /
- fluorescence spectrum /
- dissolved organic matter
-
磷在生物圈地球化学循环中具有重要作用,其对水生态系统的初级生产力具有重要作用,磷的增加是造成水体富营养化的重要指标[1-3]. 现有研究表明,磷是我国地表水环境中最常见的污染指标,也是造成水体特别是湖库富营养化的主要限制性因子[4-5]. 水体中的磷营养盐来源包括外源和内源,外源性输入和内源性释放是磷迁移转化重要方式[6]. 磷的外源性输入主要分为工业源、农业源和生活源,一般通过区域降雨降尘,排污和地表径流,船舶航行和旅游,湖区养殖投饵等方式进入水体,其中径流输入是外源性输入的最大负荷;内源性输入主要来源沉积物释放和生物死亡分解. 磷元素进入水体中后,主要在沉积物和水体之间进行迁移转化[7-9]. 与湖泊相比,河流具有流动特性,所以磷在表层水—孔隙水—沉积物中迁移转化更加复杂[10-12]. 因此,研究浅水河流不同介质中磷的分布特征及其迁移转化规律,对于河道水生态环境整治具有重要意义[13-15]. 从近年监测结果来看,典农河作为黄河宁夏段排水量最大、流域最长、水质最复杂的入黄河流,其水质整体有所改善,但极不稳定,沟渠关系复杂,水质时空差异较大,夏秋季节农业退水时段水质较好,春冬季节基流小水质差,上游污染物排放量大,下游污染物削减量小,区域性污染特征明显,特别是磷污染一直未彻底解决[16-17].
本研究通过相关性分析、聚类分析、多元回归分析等多元统计方法,基于“十二五”和“十三五”(2011—2020 年)10年典农河流域磷在水—泥不同介质中变化特征,试图探究典农河水质磷污染现状及变化特征,识别水体污染驱动因子,探究水质差异及影响因素,以期为典农河水质稳定改善及流域监管提供参考,同时也为西北干旱地区排水沟污染研究提供技术方案.
1. 材料与方法(Materials and methods)
1.1 研究区域
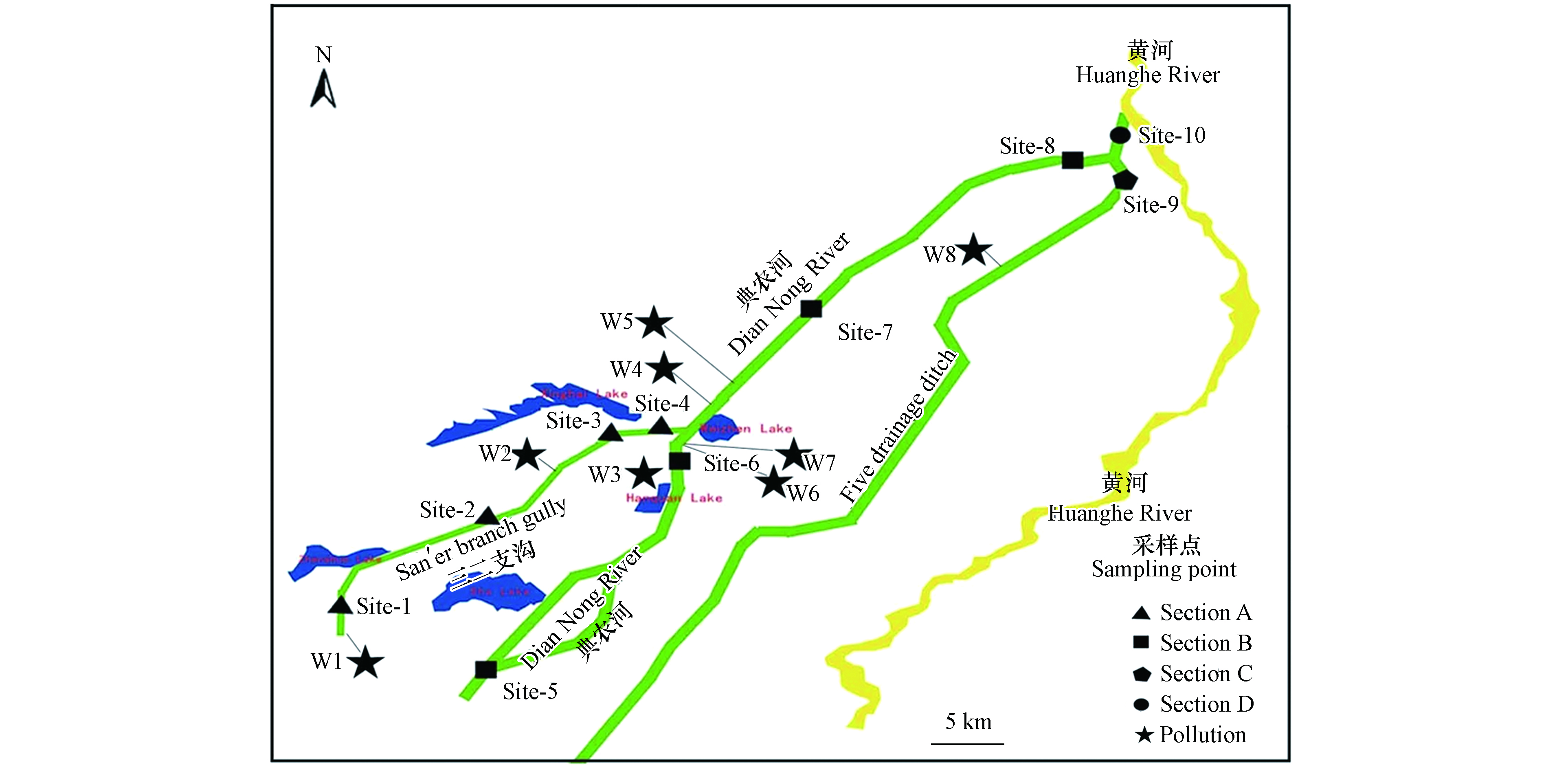
典农河为宁夏重要的入黄排水沟之一,由银川市永宁县新桥滞洪区发源,经石嘴山市惠农区园艺镇石嘴子公园流入黄河,全长180.5 km. 流经永宁县、兴庆区、金凤区、贺兰县、平罗县、惠农区等6县(区),沿途汇入第二排水沟、平二支沟、方家圈沟、三二支沟、第三排水沟等10条沟道,承接银西防洪6个拦洪库2个滞洪区来水,连接七子连湖、华雁湖、西湖、阅海、北塔湖、沙湖等湖泊湿地,水域面积约46.7 km2,径流量10.3—120 m3·s−1,平均水深约0.6 m,多年平均流量5.1 m3·s−1,年径流量约为1.6亿m3. 流经区域为半干旱荒漠地区,温带大陆性气候,流域年降雨量约200 mm,蒸发量约1800 mm.
1.2 样品的采集与分析
根据典农河流经区域、排污口分布及周边生态环境分布现状,本次采样共设10个点位,涵盖典农河整个水域(图1). 各监测点位水质采样时间为2020年,水质样品每月监测1次,按照《地表水环境质量标准》(GB 3838—2002),分别对总磷(钼锑抗分光光度法),总氮(过硫酸钾氧化紫外化分光光度法),化学需氧量(重铬酸钾氧化法),氨氮(钼酸铵分光光度法)进行检测. 沉积物采样时间为2021年3月,沉积物中磷的形态分析采用淡水沉积物中磷形态连续提取的SMT法[18],该法将沉积磷分为5种形态,即NaOH-P(主要是吸附在沉积物表面的AL、Fe、Mn氧化物和水化物结合的磷)、HCl-P(主要是与Ca结合的磷)、无机磷(IP)、有机磷(OP)和总磷(TP). 按照《地表水环境质量标准》(GB3838—2002)Ⅳ 类标准限值进行单因子水质评价;历史数据来源于石嘴山市环境质量公报.
1.3 评价方法
表层沉积物样品中TP、OP和NaOH-P的含量通过标准测试程序(SMT)法得到;最大吸附量通过25 ℃下的等温吸附实验得到;PSI通过25 ℃下100 g表层沉积物样品在75 μg·mL−1的KH2PO4溶液中振荡24 h后得到;ERI可通过式(1)至式(3)或式(4)、式(5)计算得到[19].
p=X/lgC (1) E=D/P×100% (3) D=ωNaOH−P/Qm×100% (2) S=ωTP/(ωTP+Qm)×100% (4) E=S/Qm×100% (5) 式中,P为磷吸附指数(phosphorus adsorption index,PSI),反映表层沉积物对磷缓冲能力的参数,其值越大沉积物通过吸附磷而降低水体中磷负荷的效果越明显[20];X为振荡结束后沉积物的磷吸附量,mg·kg−1;C为振荡结束后溶液中磷摩尔浓度,μmol·L−1;D为磷吸附饱和度(phosphorus adsorption saturation,DPS),反映沉积物对磷的吸附能力,随着DPS的升高,沉积物中可用于吸附磷的活性位点减少,磷释放风险增大[21];ωNaOH-P为表层沉积物中NaOH-P,mg·kg−1;Qm为根据Langumir模型拟合得到的最大吸附量,μg·g−1;E为磷释放风险指数(release risk index,ERI),ERI<10%为较低磷释放风险,10%≤ERI<20%为中度磷释放风险;20%≤ERI<25%,较高磷释放风险;ERI≥25%,高度磷释放风险[22];S为沉积物中磷饱和度(phosphorus saturation in sediment,SPS),其以TP含量和Langumir模型拟合得到的最大吸附量计算水生生态系统表层的沉积物磷饱和度[23],%;ωde为表层沉积物中TP,mg·kg−1.
1.4 质量控制
本研究严格按照《环境水质监测质量保证手册(第二版)》的要求,开展实验样品、保存、分析和数据处理,确保监测数据准确、可信. 监测项目均按照国家标准方法进行检测,所有监测仪器均经过计量部门有效检定. 同时采用平行样分析、加标回收分析、质控样对比分析等实验室内质量控制措施进行质量控制.
1.5 数据处理
本文数据分析和处理主要采用Excel表格和SPSS 16.0 软件,数据制图主要使用Origin 2017软件.
2. 结果与讨论(Results and discussion)
2.1 流域历年磷污染水平
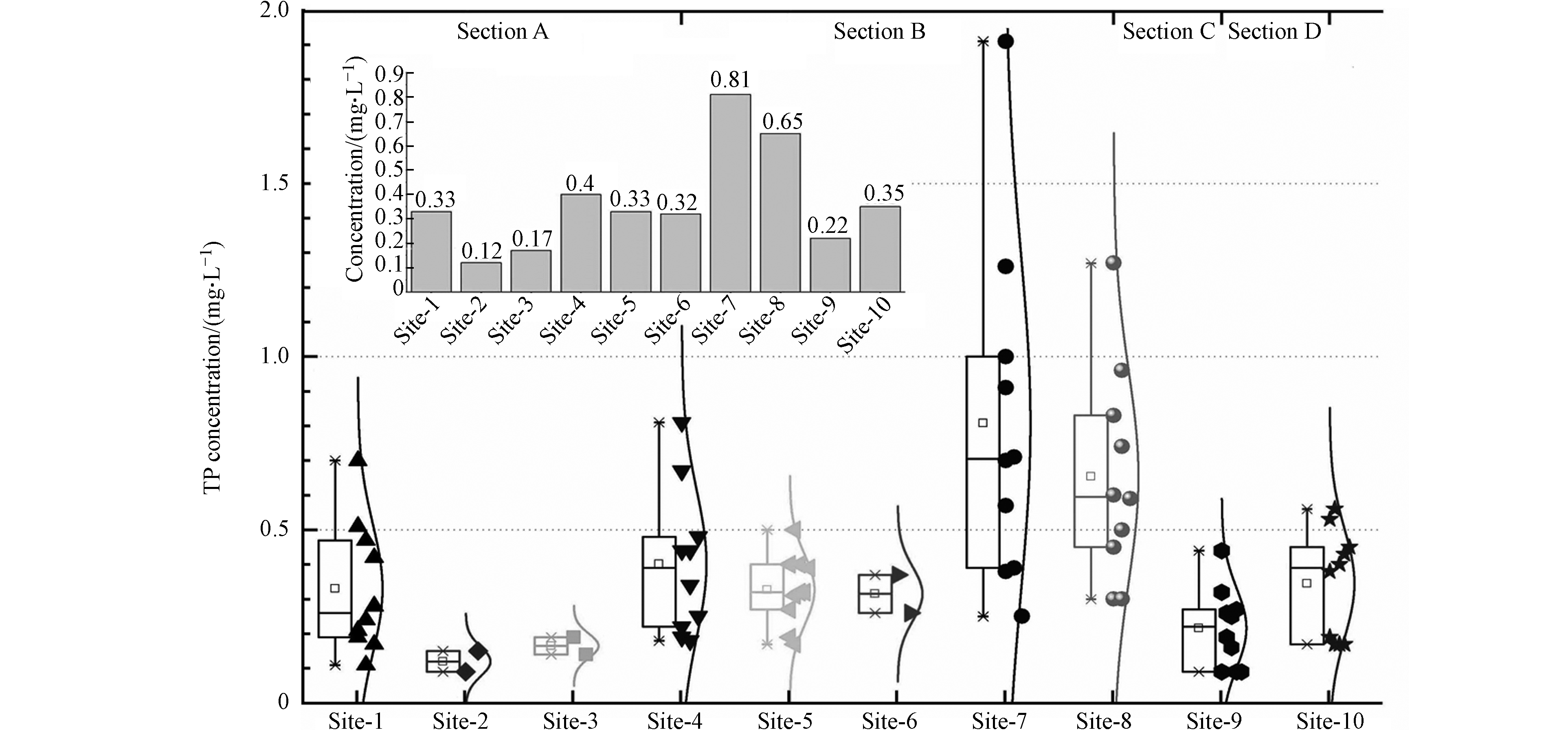
根据2011年—2020年各监测断面年均监测浓度(表1)分析,典农河流域10个监测点位水质监测磷浓度变化范围为0.09—1.91 mg·L−1,标准偏差达到0.03—1.00 mg·L−1,10个监测点位多年浓度变化趋势是Site-7>Site-8>Site-4> Site-10>Site-1=Site-5>Site-6>Site-9>Site-3>Site-2,其中Site-7和Site-8多年来总磷一直处于较高污水水平,是其他监测点位的2—3倍,直接影响到了整个典农河流域磷的整体水平,同时该两个点位标准偏差分别达到1.0和0.29,说明该区域磷波动性较大,这与点位上游临近污染源存在较大关系.
表 1 典农河流域历年磷污染水平统计表(mg·L−1)Table 1. Statistics of phosphorus pollution levels in the Diannong River Basin over the years (mg·L−1)Site-1 Site-2 Site-3 Site-4 Site-5 Site-6 Site-7 Site-8 Site-9 Site-10 2011年 0.21 — — 0.22 0.27 — 0.91 0.83 0.32 0.53 2012年 0.19 — — 0.34 0.19 — 0.38 0.45 0.26 0.19 2013年 0.51 — — 0.67 0.40 — 1.26 0.96 0.44 0.56 2014年 0.47 — — 0.44 0.31 — 1.91 1.27 0.25 0.17 2015年 0.24 — — 0.25 0.17 — 0.57 0.50 0.27 0.40 2016年 0.70 — — 0.44 0.50 — 1.00 0.59 0.09 0.43 2017年 0.28 — — 0.48 0.40 — 0.70 0.60 0.19 0.45 2018年 0.42 — — 0.81 0.32 — 0.71 0.74 0.16 0.38 2019年 0.11 0.09 0.19 0.19 0.32 0.37 0.39 0.30 0.09 0.17 2020年 0.17 0.15 0.14 0.18 0.39 0.26 0.25 0.30 0.09 0.17 最小值 0.11 0.09 0.14 0.18 0.17 0.26 0.25 0.3 0.09 0.17 最大值 0.7 0.15 0.19 0.81 0.5 0.37 1.91 1.27 0.44 0.56 标准偏差 0.18 0.03 0.03 0.20 0.10 0.06 1.00 0.29 0.11 0.15 年均值 0.33 0.12 0.17 0.40 0.33 0.32 0.81 0.65 0.22 0.35 备注:Site-2、Site-3、Site-6为新增监测点位,自2019年开始监测. Remarks: Site-2, Site-3, and Site-6 are newly added monitoring points, which have been monitored since 2019. 同时,结合典农河流域水系特征、污染源分布(W1—W8)和污染浓度变化情况,将流域分为Section A、Section B、Section C、Section D 的4个污染控制单元区,其中Section A为典农河支流,Section B为典农河上游,Section C为典农河中游,Section D为典农河末端,污染区域的划分有助于后期流域污染溯源分析和精准管控,便于后期“流域—控制区—控制单元”三级分区体系的建立[24]. 近10年监测数据呈现出整体性的类似正态分布(图2),这与“十三五”期间生态环境保护监管和治理成效有关[25].
2.2 空间变化特征
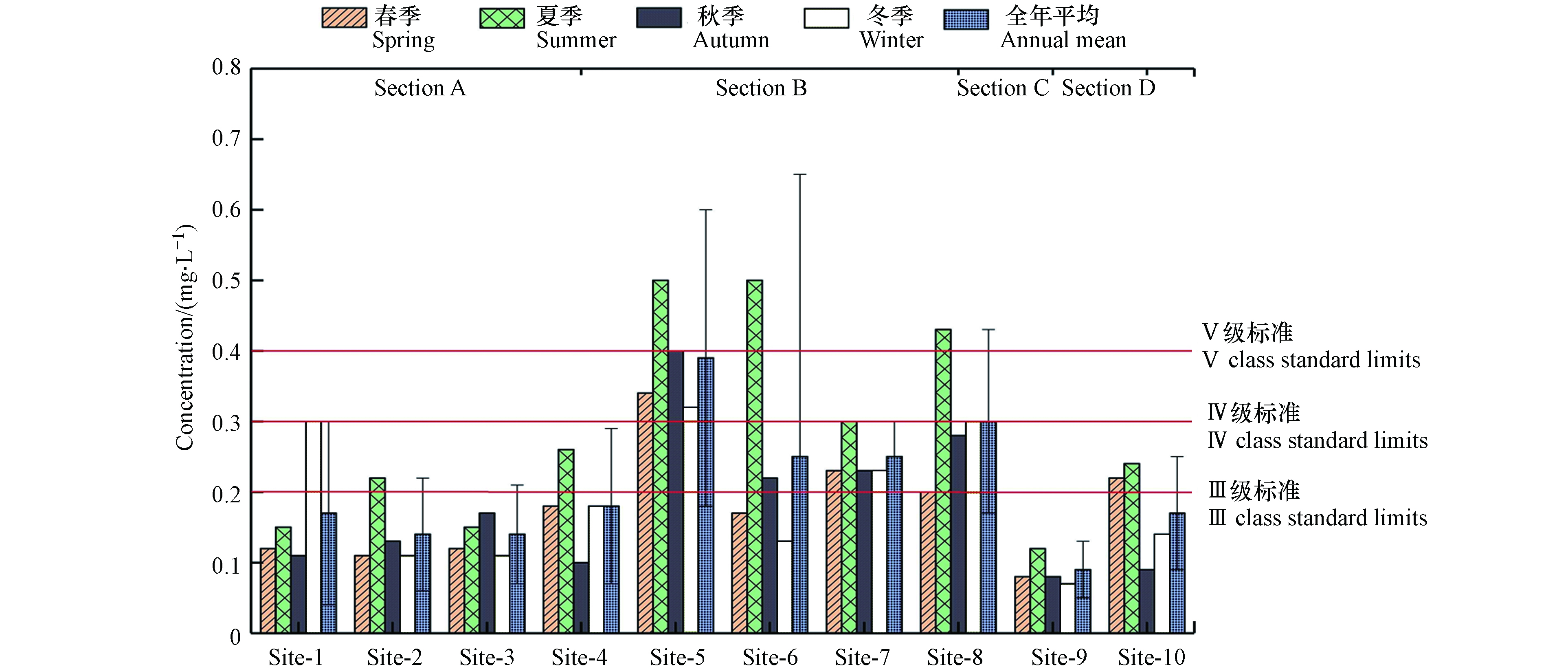
2020年典农河水体总磷ρ(TP)表现为季节性变化(表2),即:夏季(0.29 mg·L−1)>冬季(0.19 mg·L−1)>秋季(0.18 mg·L−1)=春季(0.18 mg·L−1),夏季典农河流域总磷排放浓度是其他季节的1.5倍左右,其他季节流域总磷浓度整体保持稳定,这说明夏季总磷空间分布极不均匀,这与夏季水温升高水体底泥磷释放和夏季流域农田灌溉有一定影响. 全年累计统计的120组监测数据中,其中 Ⅰ—Ⅲ 类比例为70%,劣V类比例为10%,监测点位全年劣V类总磷出现频次最高的为 Site-5和Site-8. 同时,流域区域性磷污染特征较为明显(图3),各监测点位年度标准偏差达到0.04—0.4 mg·L−1,区域性污染程度 Section B > Section C > Section A> Section D,监测点位污染程度Site-5>Site-8>Site-6=Site-7>Site-4>Site-1=Site-10>Site-2>Site-3>Site-9,其中污染较重的Site-5超标率达到58%,Site-8超标率达到42%,Site-6超标率达到17%. 按照区域分析,Section B区域污染最重,这可能和污染源分布有关.
表 2 典农河流域水体总磷统计表(mg·L−1)Table 2. Statistical table of total phosphorus in the water body of Diannong River Basin (mg·L−1)Site-1 Site-2 Site-3 Site-4 Site-5 Site-6 Site-7 Site-8 Site-9 Site-10 最小值Min 最大值Max 年均值Average 1月 0.09 0.08 0.1 0.3 0.14 0.12 0.19 0.2 0.05 0.24 0.05 0.3 0.15 2月 0.09 0.11 0.14 0.16 0.14 0.12 0.26 0.24 0.08 0.20 0.08 0.26 0.15 3月 0.18 0.13 0.11 0.08 0.73 0.28 0.24 0.17 0.12 0.23 0.08 0.73 0.23 春季 0.12 0.11 0.12 0.18 0.34 0.17 0.23 0.20 0.08 0.22 0.07 0.43 0.18 4月 0.23 0.08 0.07 0.45 0.65 0.88 0.29 0.36 0.21 0.29 0.07 0.88 0.35 5月 0.09 0.3 0.12 0.24 0.28 0.39 0.35 0.37 0.09 0.13 0.09 0.39 0.24 6月 0.13 0.27 0.26 0.08 0.56 0.23 0.27 0.56 0.07 0.3 0.07 0.56 0.27 夏季 0.15 0.22 0.15 0.26 0.50 0.50 0.30 0.43 0.12 0.24 0.08 0.61 0.29 7月 0.13 0.25 0.29 0.07 0.48 0.17 0.29 0.24 0.08 0.12 0.07 0.48 0.21 8月 0.10 0.06 0.12 0.12 0.56 0.23 0.23 0.39 0.11 0.09 0.06 0.56 0.20 9月 0.10 0.08 0.1 0.11 0.16 0.27 0.17 0.2 0.06 0.07 0.06 0.27 0.13 秋季 0.11 0.13 0.17 0.10 0.40 0.22 0.23 0.28 0.08 0.09 0.06 0.44 0.18 10月 0.26 0.11 0.14 0.16 0.38 0.14 0.19 0.22 0.06 0.07 0.06 0.38 0.17 11月 0.56 0.13 0.11 0.19 0.47 0.12 0.29 0.54 0.09 0.14 0.09 0.56 0.26 12月 0.07 0.08 0.07 0.19 0.12 0.13 0.2 0.14 0.05 0.2 0.05 0.2 0.13 冬季 0.30 0.11 0.11 0.18 0.32 0.13 0.23 0.30 0.07 0.14 0.07 0.38 0.19 超标率/% 8.3 8.3 0 8.3 58 17 8.3 42 0 0 — — — 最小值 0.07 0.06 0.07 0.07 0.12 0.12 0.17 0.14 0.05 0.07 0.05 0.2 0.13 最大值 0.56 0.3 0.29 0.45 0.73 0.88 0.35 0.56 0.21 0.3 0.09 0.88 0.35 标准偏差 0.13 0.08 0.07 0.11 0.21 0.40 0.05 0.13 0.04 0.08 0.01 0.20 0.06 年均值 0.17 0.14 0.14 0.18 0.39 0.25 0.25 0.30 0.09 0.17 0.07 0.46 0.21 2.3 沉积物不同形态磷
2.3.1 沉积物中磷污染水平
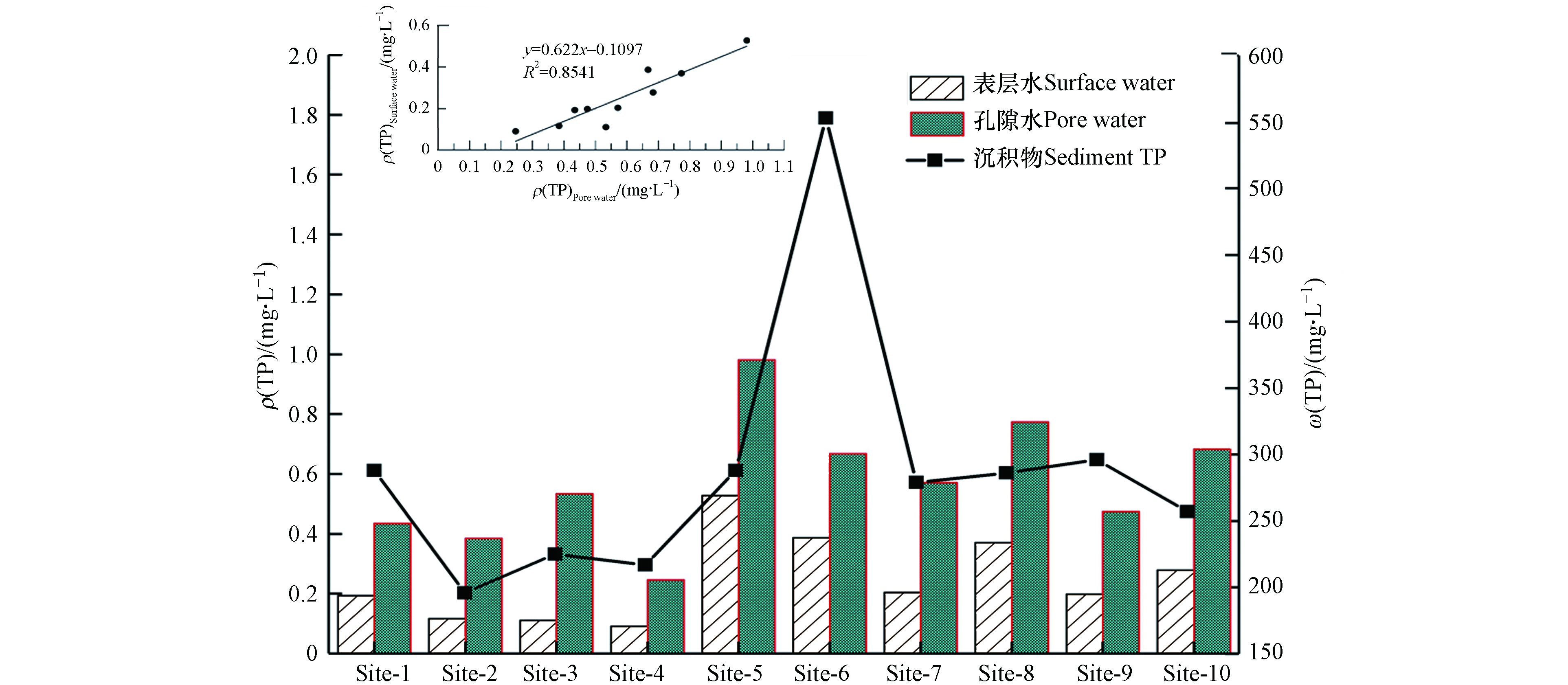
为研究沉积物与表层水中总磷迁移转化规律,同步监测表层水中总磷和沉积物孔隙水中总磷浓度(图4). 典农河流域表层水整体为Ⅳ类水质,ρ(TP)浓度范围为0.091—0.528 mg·L−1,标准偏差达到0.135 mg·L−1,其中Ⅰ—Ⅲ类比例为50%,劣V类比例为10%,监测点位全年劣V类总磷出现频次最高达到Site-5. 孔隙水整体为劣V类水质,ρ(TP)浓度范围为0.246—0.981 mg·L−1,劣V类比例达到80%. 表层水和沉积物孔隙水中磷存在显著相关性,Y表层水=0.622X孔隙水–0.1097 (r=0.8541),因不同颗粒组分形成的河床基底,磷的吸附和释放特征大不相同,其中孔隙水是沉积物向表层水扩散的主要通道,同时还存在污染物输入量的叠加作用,最终导致表层水和沉积物孔隙水中污染浓度变化既存在较强关系也存在一定差异. 分析主要原因是典农河为浅水河流,加之沉积物中磷主要以无机磷形式存在,水位波动、沉积物再悬浮和流速或流量变化引起的冲刷作用,将提高河流沉积物中总磷的释放速率[26].
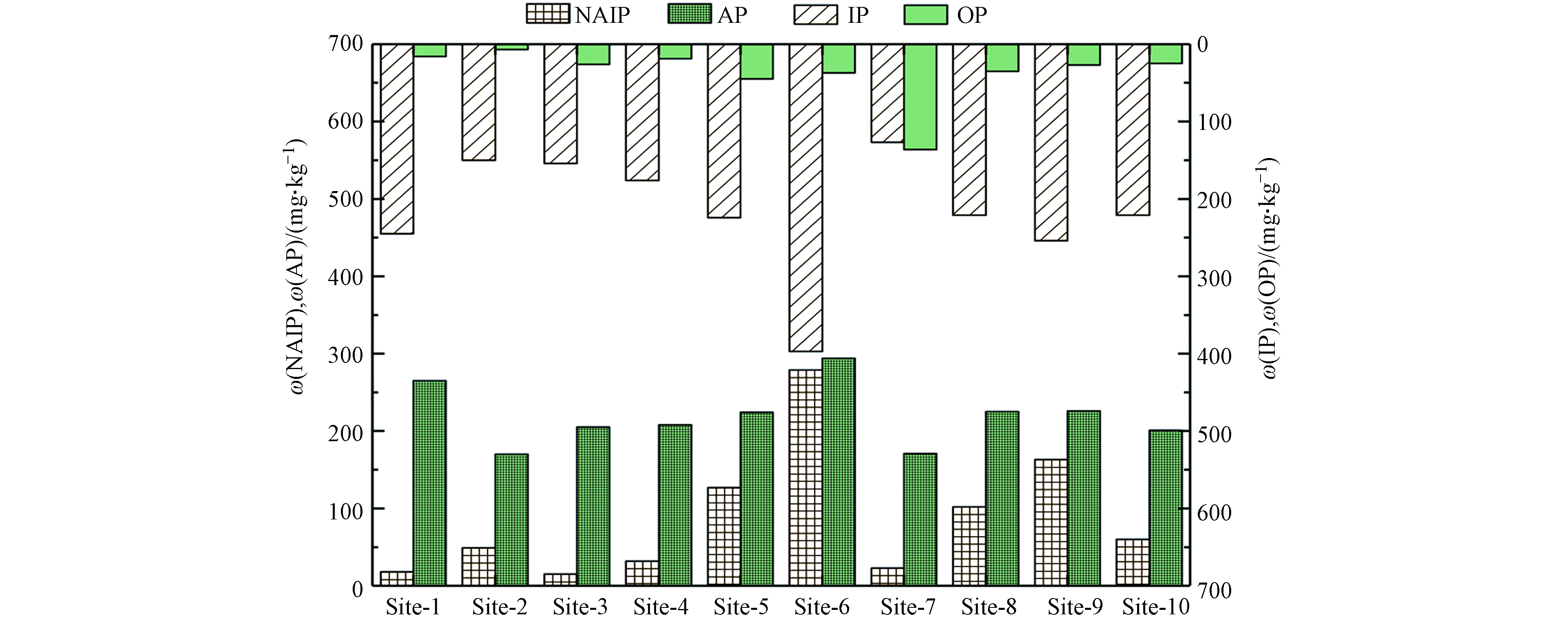
相比国内部分河湖表层沉积物中磷赋存形态[19],OP和NAIP在典农河表层沉积物中含量相对较低,AP和IP相对较高. 沉积物中非磷灰石态无机磷(NAIP)和沉积物中有机磷(OP)普遍较低,浓度范围分别为15—297 mg·kg−1和7—136 mg·kg−1,标准偏差分别达到80 mg·kg−1和34 mg·kg−1(图5).
2.3.2 相关性分析
采用二元定距变量的相关性(Pearson 相关系数),对不同介质中不同形态磷关联性进行分析(表3),同时通过线性回归进行定量分析,从而解释出各个监测断面相应污染物之间的相关特征[27]. 分析结果表明,典农河流域表层水中ρ(TP)浓度随孔隙水中总磷浓度的升高而升高 (r=0.924,P<0.01). 沉积物中ω(AP)与ω(NAIP)存在一定的正相关性(r=0.658,P<0.05),YAP=0.3XNAIP+193;沉积物中ω(IP)与ω(NAIP)存在较强的正相关性( r=0.875,P<0.01),YIP=0.797XNAIP+148;沉积物中ω(IP)与ω(AP)存在较强的正相关性( r=0.907,P<0.01),沉积物中ω(TP)与ω(NAIP)相关性达到0.862(P<0.01),线性方程YTP=1.017XNAIP+200. 沉积物中ω(TP)与ω(AP)相关性达到0.791(P<0.01),线性方程YTP=2.052XAP–161;沉积物中ω(TP)与ω(IP)相关性达到0.901(P<0.01),线性方程YTP=1.167XIP+35.
表 3 典农河流域水体和沉积物中不同形态磷的相关性分析Table 3. Correlation analysis of different forms of phosphorus in water and sediments in the Diannong River Basin表层水 Site 孔隙水 Surface water NAIP AP IP OP TP 表层水 1 0.924** 0.606 0.435 0.531 0.155 0.532 孔隙水 0.924** 1 0.405 0.203 0.290 0.250 0.336 NAIP 0.606 0.405 1 0.658* 0.875** −0.077 0.862** AP 0.435 0.203 0.658* 1 0.907** −0.297 0.791** IP 0.531 0.290 0.875** 0.907** 1 −0.256 0.901** OP 0.155 0.250 −0.077 −0.297 −0.256 1 0.127 TP 0.532 0.336 0.862** 0.791** 0.901** 0.127 1 注:**相关显著水平为0.01(双尾),*相关显著水平为0.05(双尾). Note: ** Significant level of correlation 0.01 (double tail); * Significant level of correlation 0.05 (double tail). 2.3.3 主成分分析
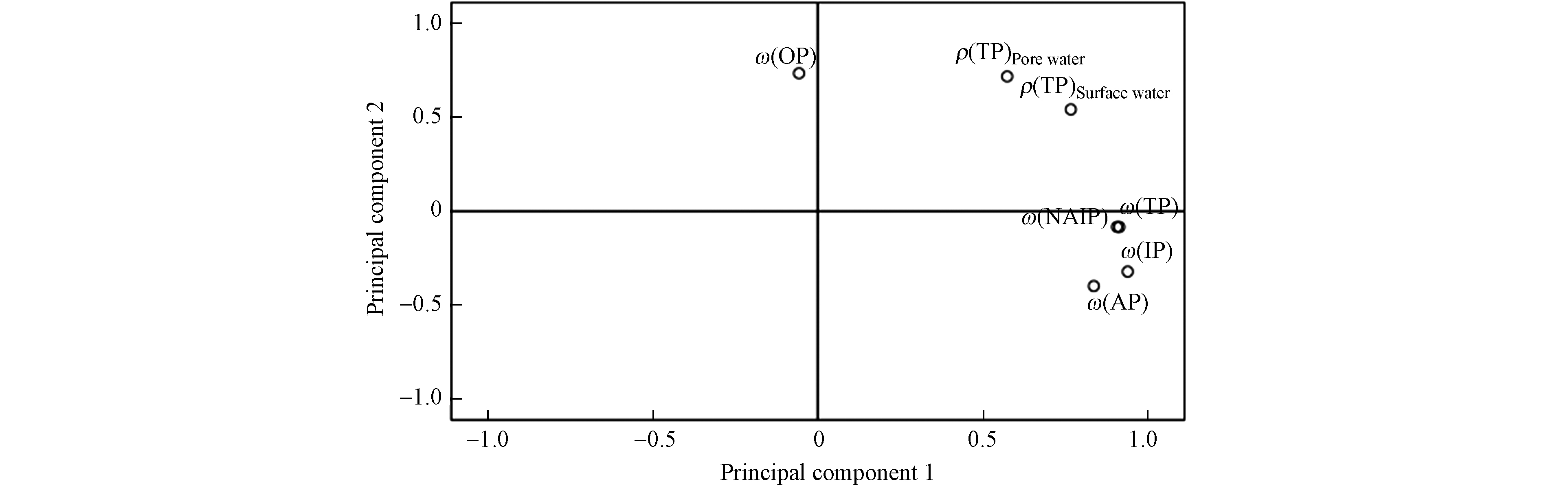
主成分分析有利于将多个污染变量压缩到极少数的污染变量,该方法主要应用到水体污染源解析中[28]. 经KMO(Kaiser-Meyer-Olkin)和Bartlett球体检验,本次分析KMO检验系数>0.5,Bartlett球体检验的统计值显著性概率P <0.05,符合因子分析要求. 结合数据综合统计和相关性分析,最终通过主成分分析揭示典农河流域不同介质中总磷的来源及迁移趋势(图6). 从表4可以知,典农河流域不同水体介质中共提取出2个主成分,揭示出83%的磷污染来源,分别解释了总因子的59%和23%,沉积物中无机磷ω(NAIP)、ω(IP)、ω(AP)和ω(TP)来源于统一污染源,沉积物中ω(OP)来源于另一污染源.
表 4 主成分特征向量及累计贡献Table 4. Principal component eigenvectors and cumulative contributions表层水Surface water 孔隙水Pore water NAIP AP IP OP TP 贡献率/%Contribution 累计贡献率/%Cumulative contribution 主成分1 0.766 0.574 0.906 0.836 0.939 –0.057 0.913 59.356 59.356 主成分2 0.542 0.718 –0.083 –0.398 –0.321 0.735 –0.084 23.22 82.576 2.4 典农河磷释放风险评估
2.4.1 基于PSI和DPS的磷释放风险评估
典农河流域各采样点DPS风险范围为13%—65%,平均值为35%(表5). ERI风险范围为23%—103%,平均值为45%,其中Site-1风险水平达到103%,主要原因该断面上游为工业园区污水处理厂W1,污染物排放不稳定. 国内研究提出[29],当沉积物中DPS>25%时,沉积物中磷的释放能力处于显著水平,本研究区域整体状况已超过该阈值,故应严格控制磷的污染输入. 典农河表层沉积物PSI计算值较小,说明沉积物中磷缓冲能力较大,从而增加了磷的释放风险;DPS 平均值相对偏高,说明大部分监测点位表层沉积物对磷的吸附能力差﹐磷的释放风险较高[30]. 典农河流域与我国不同水体表层沉积物TP和SPS存在明显差异(表6),该流域沉积物中ω(TP)相对污染水平较低,最大吸附量Qm和磷释放风险SPS相比黄河甘宁蒙段整体偏高,当先比全国其他水体整体偏低,分析原因典农河作为西北地区浅水河道,基流小、水位浅,沉积物很容易被氧化,加之区域性泥沙含量较高,沉积物对磷的吸附作用弱,释放作用强.
表 5 基于PSI和DPS的磷释放风险评价Table 5. Risk assessment of phosphorus release based on PSI and DPS采样点位 Sampling site PSI DPS/% ERI/% Site-1 15 15 103 Site-2 11 29 38 Site-3 6 13 45 Site-4 6 21 29 Site-5 18 48 38 Site-6 32 65 50 Site-7 11 26 42 Site-8 17 38 44 Site-9 13 57 23 Site-10 11 33 34 平均值 14 35 45 表 6 不同水体表层沉积物中TP、最大吸附量和SPS比较Table 6. Comparison of TP, maximum adsorption capacity and SPS in surface sediments of different water bodies2.4.2 基于最大吸附量和SPS的磷释放风险评估
典农河流域基于最大吸附量和SPS的磷释放风险评估结果见表7. SPS变化范围为51%—76%,平均值为59%,典农河流域各点位之间SPS的差异较小,相对国内相关河流[31],典农河表层沉积物的对总磷的最大吸附量偏小,而计算结果SPS较高,说明典农河表层沉积物对水体磷的吸附能力较差.
表 7 基于最大吸附量和SPS的磷释放风险评估Table 7. Risk assessment of phosphorus release based on maximum adsorption and SPS采样点位 Sampling site Qm/(mg·kg−1) SPS/% ERI/% Site-1 124 70 56 Site-2 168 54 32 Site-3 113 67 59 Site-4 156 58 37 Site-5 265 52 20 Site-6 432 56 13 Site-7 87 76 87 Site-8 265 52 20 Site-9 285 51 18 Site-10 184 58 32 平均值 208 59 37 3. 结论(Conclusion)
(1)典农河流域水体总磷ρ(TP)呈现明显的季节性和区域性,时空污染特征较为明显,水体总磷污染物浓度由高到低夏季>冬季>秋季=春季,区域性污染程度 Section B > Section A > Section D> Section C,监测点位污染程度Site-5>Site-8>Site-6 = Site-7>Site-4>Site-1=Site-10> Site-2>Site-3> Site-9. 同时,历史值显示该流域水体总磷呈现低—高—低波动性变化.
(2)典农河流域不同水体介质表层水和空隙水中总磷变化特征较为明显,其中表层水整体为Ⅳ类水质,ρ(TP)浓度范围为0.091—0.528 mg·L−1,标准偏差达到0.135 mg·L−1,Ⅰ—Ⅲ类比例为50%,劣V类比例仅为10%;孔隙水整体为劣V类水质,ρ(TP)浓度范围为0.246—0.981 mg·L−1,劣V类比例达到80%. 表层水和沉积物孔隙水中磷存在显著相关性,Y表层水=0.622X孔隙水–0.1097 (r=0.8541,P<0.01).
(3)与国内其他河湖沉积物中磷的赋存形态含量相比较,典农河表层沉积物所含OP和NAIP浓度偏低,AP和IP相对较高,不同磷形态之间存在相互迁移转化特征. 典农河流域不同水体介质中共提取的2组主成分,揭示出流域83%的磷污染来源,分别解释了总因子的59%和23%,沉积物中无机磷ω(NAIP)、ω(IP)、ω(AP)和ω(TP)来源于同一污染源,沉积物中ω(OP)来源于另一污染源.
(4)典农河流域各采样点DPS风险范围为13%—65%, ERI风险范围为23%—103%,SPS变化范围为51%—76%,典农河流域各点位之间SPS的差异较小. 无论是基于PSI和DPS的磷释放风险评估还是基于最大吸附量和SPS的磷释放风险评估统计,均显示该区已处于磷污染风险区域,后期需要加强源头管控,减少磷污染物排放,在部分时节要做好流域深度控源.
-
表 1 不同水厂对浊度、TDS和电导率的去除率
Table 1. The removal rates of turbidity, TDS and conductivity in different water treatment plants
水厂 浊度去除率% TDS去除率% 电导率去除率% A 80~97 <0.01 <0.01 B 81~97 <0.05 <0.04 C 81~97 96~97 96~98 表 2 5月各水样的DOM的紫外光谱特征参数
Table 2. UV characteristic parameters of DOM in water samples in May
水样 α(355) SUVA254 SUVA260 E2/E3 A原水 3.68 4.82 4.53 6.69 A BAF出水 2.42 4.88 4.59 9.35 A沉后水 0.81 3.25 2.94 17.99 A滤后水 0.23 2.47 2.21 32.69 A出水 0.46 2.63 2.39 36.87 B原水 4.26 5.08 4.79 6.26 B沉后水 1.62 3.96 3.68 15.27 B滤后水 1.39 4.13 3.81 18.31 B出水 1.04 3.66 3.37 21.16 C原水 2.54 3.55 3.23 10.53 C UF水 2.54 3.80 3.46 12.03 C RO水 0.12 3.13 2.71 —— C出水 0 2.82 2.18 —— 表 3 5月、9月各水样的FI、BIX、HIX
Table 3. Fluorescence index, autochthonous index and the humification index of water samples in May and September
水样 5月 9月 FI BIX HIX FI BIX HIX 原水 1.12 1.19 0.27 1.05 1.09 0.41 A BAF出水 1.13 1.20 0.26 1.03 1.07 0.40 A沉后水 1.13 1.22 0.22 1.01 1.09 0.13 A滤后水 1.26 1.40 0.10 1.00 1.10 0.13 A出水 1.21 1.33 0.14 1.30 1.44 0.11 B原水 1.09 1.16 0.31 1.03 1.08 0.41 B沉后水 1.15 1.25 0.27 1.13 1.20 0.36 B滤后水 1.21 1.32 0.23 1.11 1.17 0.35 B出水 1.22 1.34 0.23 1.15 1.26 0.30 C原水 0.96 1.03 0.67 0.95 1.01 0.66 C UF水 0.97 1.05 0.67 0.95 1.01 0.66 C RO水 1.93 2.85 0.04 1.41 1.75 0.27 C出水 1.28 1.73 0.13 1.66 1.69 0.28 -
[1] 张洪刚, 焦茹媛, 王聪, 等. 义乌市水库型水源地保护与水质提升策略研究——以岩口水库为例[J]. 环境保护科学, 2021, 47(2): 9-14. doi: 10.16803/j.cnki.issn.1004-6216.2021.02.002 [2] 鲍倩倩, 谢磊, 周杨军, 等. 水资源紧缺约束下义乌市人口承载力研究[J]. 水利规划与设计, 2020, 30(9): 47-51. doi: 10.3969/j.issn.1672-2469.2020.09.012 [3] 邵志平, 徐圣君, 秦玉, 等. 基于水资源可持续发展与水生态文明建设的义乌“五水共治”新模式[J]. 环境工程学报, 2021, 15(4): 1149-1156. doi: 10.12030/j.cjee.202008096 [4] 邵志平, 朱红斌. 义乌市全域分质供水工作机制探索与实践[J]. 中国水利, 2020, 37(21): 51-52. doi: 10.3969/j.issn.1000-1123.2020.21.023 [5] 白昊阳. 分质供水水资源优化配置研究[D]. 天津: 天津大学, 2005. [6] 田林莉. 城市分质供水系统研究[D]. 四川: 重庆大学, 2007. [7] SCHEILI A, DELPLA I, SADIQ R, et al. Impact of raw water quality and climate factors on the variability of drinking water quality in small systems[J]. Water Resources Management. 2016, 30(8): 2703-2718. doi: 10.1007/s11269-016-1312-z [8] RODRIGUES V, ESTRANY J, RANZINI M, et al. Effects of land use and seasonality on stream water quality in a small tropical catchment: The headwater of corrego agua limpa, sao paulo (brazil) [J]. Science of the Total Environment. 2018, 622(25): 1553-1561. [9] SHAFIQUZZAMAN M, HAIDER H, BHUIYAN M A, et al. Spatiotemporal variations of DOM components in the kushiro river impacted by a wetland[J]. Environmental Science and Pollution Research. 2020, 27(15): 18287-18302. doi: 10.1007/s11356-020-08192-7 [10] DELPLA I, BOUCHARD C, DOREA C, et al. Assessment of rain event effects on source water quality degradation and subsequent water treatment operations[J]. Science of the Total Environment. 2022, 866(3): 161085-161085. [11] PRICE J I, HEBERLING M T. The effects of source water quality on drinking water treatment costs: a review and synthesis of empirical literature[J]. Ecological Economics. 2018, 151: 195-209. doi: 10.1016/j.ecolecon.2018.04.014 [12] NA S H, KIM M J, KIM J T, et al. Microplastic removal in conventional drinking water treatment processes: Performance, mechanism, and potential risk[J]. Water Research. 2021, 202(13): 117417-117417. [13] LI M, YANG Q, FANG G, et al. Refractory fluorescent dissolved organic matter in conventional and membrane-based drinking water treatment processes[J]. Chemosphere. 2022(4): 293-293. [14] ZHANG Z, JING R, HE S, et al. Coagulation of low temperature and low turbidity water: Adjusting basicity of polyaluminum chloride (PAC) and using chitosan as coagulant aid[J]. Separation and Purification Technology. 2018, 206(29): 131-139. [15] HURST A M, EDWARDS M J, CHIPPS M, et al. The impact of rainstorm events on coagulation and clarifier performance in potable water treatment[J]. Science of the Total Environment. 2004, 321(13): 219-230. [16] ZHANG F, ZHANG W, WU S, et al. Analysis of UV-Vis spectral characteristics and content estimation of soil DOM under mulching practices[J]. Ecological Indicators. 2022, 138(1): 108869-108878. [17] 李惠平. 纳滤膜在高品质饮用水处理中的应用研究[D]: 兰州: 兰州交通大学, 2020. [18] DU Y, ZHANG Y, CHEN F, et al. Photochemical reactivities of dissolved organic matter (DOM) in a sub-alpine lake revealed by EEM-PARAFAC: An insight into the fate of allochthonous DOM in alpine lakes affected by climate change[J]. Science of the Total Environment. 2016, 568(15): 216-225. [19] YANG J, GAO C, ZHANG X. The impacts of precipitation on fluorescent dissolved organic matter (FDOM) in an urban river system[J]. Water. 2022, 14(15): 2323. doi: 10.3390/w14152323 [20] XIANG S, HAN Y, JIANG C, et al. Composite biologically active filter (BAF) with zeolite, granular activated carbon, and suspended biological carrier for treating algae-laden raw water[J]. Journal of Water Process Engineering. 2021, 42(1): 102188-102196. [21] WANG X W, LIU Z Q, XIONG K N, et al. Characteristics and controlling factors of soil dissolved organic matter in the rainy season after vegetation restoration in a karst drainage area, South China[J]. Catena. 2022, 217(1): 106483-106487. [22] JIANG T, WANG D Y, MENG B, et al. The concentrations and characteristics of dissolved organic matter in high-latitude lakes determine its ambient reducing capacity[J]. Water Research. 2020, 169(1): 115217-115217. [23] WANG J J, DAHLGREN R A, CHOW A T. Controlled burning of forest detritus altering spectroscopic characteristics and chlorine reactivity of dissolved organic matter: effects of temperature and oxygen availability[J]. Environmental Science & Technology. 2015, 49(24): 14019-14027. [24] ZHOU Y, XIE Y, WANG M, et al. In-situ characterization of dissolved organic matter removal by coagulation using differential UV-Visible absorbance spectroscopy[J]. Chemosphere. 2019, 242(1): 125062-125068. [25] WANG D S, ZHAO Y M, YAN M Q, et al. Removal of DBP precursors in micro-polluted source waters: A comparative study on the enhanced coagulation behavior[J]. Separation and Purification Technology. 2013, 118(30): 271-278. [26] HE H, XU H, LI L F, et al. Molecular transformation of dissolved organic matter and the formation of disinfection byproducts in full-scale surface water treatment processes[J]. Science of the Total Environment. 2022, 838(P4): 156547-156547. [27] HUGUET A, VACHER L, RELEXANS S, et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry. 2009, 40(6): 706-719. doi: 10.1016/j.orggeochem.2009.03.002 [28] MAIE N, PARISH K J, WATANABE A, et al. Chemical characteristics of dissolved organic nitrogen in an oligotrophic subtropical coastal ecosystem[J]. Geochimica et Cosmochimica Acta. 2006, 70(17): 4491-4506. doi: 10.1016/j.gca.2006.06.1554 [29] VITHARUCH Y, CHATYAPHA T, PHANWATT P. Changes in optical properties and molecular composition of dissolved organic matter and formation of disinfection by-products during conventional water treatment processes[J]. Environmental Science: Water Research & Technology. 2022, 9(1): 161-175. [30] MURPHY K R, STEDMON C A, WENIG P, et al. OpenFluor– an online spectral library of auto-fluorescence by organic compounds in the environment[J]. Analytical Methods. 2014, 6(3): 658-661. doi: 10.1039/C3AY41935E [31] MURPHY K R, HAMBLY A, SINGH S, et al. Organic matter fluorescence in municipal water recycling schemes: toward a unified PARAFAC model[J]. Environmental Science & Technology. 2011, 45(7): 2909-2916. [32] YANG L, CHENG Q, ZHUANG W E, et al. Seasonal changes in the chemical composition and reactivity of dissolved organic matter at the land-ocean interface of a subtropical river[J]. Environmental Science and Pollution Research. 2019, 26(24): 24595-24608. doi: 10.1007/s11356-019-05700-2 [33] BRüNJES J, SEIDEL M, DITTMAR T, et al. Natural asphalt seeps are potential sources for recalcitrant oceanic dissolved organic sulfur and dissolved black carbon[J]. Environmental Science & Technology. 2022, 56(12): 9092-9102. [34] PODGORSKI D C, ZITO P, MCGUIRE J T, et al. Examining natural attenuation and acute toxicity of petroleum-derived dissolved organic matter with optical spectroscopy[J]. Environmental Science & Technology. 2018, 52(11): 6157-6166. [35] CHEN M, KIM S-H, JUNG H-J, et al. Dynamics of dissolved organic matter in riverine sediments affected by weir impoundments: Production, benthic flux, and environmental implications[J]. Water Research. 2017, 121(1): 150-161. [36] PAINTER S C, LAPWORTH D J, WOODWARD E M S, et al. Terrestrial dissolved organic matter distribution in the North Sea[J]. Science of the Total Environment. 2018, 630(15): 630-647. [37] AMARAL V, ROMERA-CASTILLO C, FORJA J. Submarine mud volcanoes as a source of chromophoric dissolved organic matter to the deep waters of the Gulf of Cádiz[J]. Scientific Reports. 2021, 11(1): 3200-3211. doi: 10.1038/s41598-021-82632-3 [38] SHENG Y, YAN C, NIE M, et al. The partitioning behavior of PAHs between settled dust and its extracted water phase: Coefficients and effects of the fluorescent organic matter[J]. Ecotoxicology and Environmental Safety. 2021, 223(15): 112573-112580. [39] LEE D, KWON M, AHN Y, et al. Characteristics of intracellular algogenic organic matter and its reactivity with hydroxyl radicals[J]. Water Research, 2018 (1) , 144: 13-25. [40] WILLIAMS C J, CONRAD D, KOTHAWALA D N, et al. Selective removal of dissolved organic matter affects the production and speciation of disinfection byproducts[J]. Science of the Total Environment. 2019, 652(20): 75-84. [41] SHI J, ZHAO Y, WEI D, et al. Insight into transformation of dissolved organic matter in the Heilongjiang River[J]. Environmental Science and Pollution Research. 2018, 26(4): 3340-3349. [42] AGUILAR M I, SAEZ J, LLORENS M, et al. Nutrient removal and sludge production in the coagulation-flocculation process[J]. Water Research. 2002, 36(11): 2910-2919. doi: 10.1016/S0043-1354(01)00508-5 [43] SZLACHTA M, ADAMSKI W. Effect of powdered activated carbon on the settleability and adsorptive properties of coagulation sludge[J]. Ochrona Srodowiska. 2009, 31(1): 37-40. [44] 李璐瑶. 次氯酸钠深度处理城市污水厂二级出水的试验研究[D]. 青岛: 青岛理工大学, 2012. 期刊类型引用(1)
1. 黄振华,邵志平,史新明,何怡,郑效旭,王靖霖,姜参参,田哲,徐圣君,王东升,庄绪亮. 义乌岩口水库富营养化综合评价及水环境容量分析. 环境科学. 2024(12): 7073-7081 .  百度学术
百度学术
其他类型引用(1)
-






 下载:
下载: