-
厌氧氨氧化(anaerobic ammonium oxidation, Anammox)可以代替传统硝化反硝化工艺去除污水中的氮,具有能耗低、产泥量少、无需外加碳源和运行成本低等优势[1],被认为是最有前途的生物脱氮工艺之一。由于厌氧氨氧化生长缓慢,倍增时间长,工程上采用生物膜[2]或颗粒污泥[3]形态持留厌氧氨氧化菌(anaerobic ammonium oxidation bacteria, AnAOB),以保证系统稳定运行。目前,厌氧氨氧化工艺已成功应用于污泥厌氧消化上清液[4]等高浓度氨氮污水处理中。由于城市污水具有氨氮浓度低、温度低等特点,限制了厌氧氨氧化的主流应用[5]。为提高AnAOB活性,通常采用投加FeS[6]、Fe(Ⅲ)[7]、纳米零价铁(nZVI)[8]、羟胺(NH2OH)[9]、肼(N2H4)[10]、石墨烯[11]以及生物炭[12]等辅助材料。其中,N2H4作为厌氧氨氧化代谢中间产物受到广泛关注。N2H4可以通过抑制其他细菌生长,降低与AnAOB对底物的竞争,同时为AnAOB的生长提供额外能量,减少NO3−-N的产生,从而提高厌氧氨氧化反应器脱氮性能[13-15]。
YAO等[16]研究表明,当加入3.99 mg·L−1的N2H4时,CANON系统中颗粒污泥的厌氧氨氧化活性增加,当N2H4质量浓度为4.86 mg·L−1时,可以缓解NO2−-N对AnAOB活性的抑制[17]。MIODOŃSKI等添加了3.7 mg·L−1的N2H4后,在高基质浓度条件下厌氧氨氧化系统在42 d内完成了快速启动,平均氮负荷率(nitrogen loading rate, NLR)比对照组高2倍[18]。蔡庆等[19]通过批式实验研究N2H4对高基质浓度下(NH4+-N约225 mg·L−1,NO2−-N约280 mg·L−1)厌氧氨氧化颗粒污泥的短期影响,结果发现,当N2H4质量浓度在1.8~9.5 mg·L−1时,厌氧氨氧化活性明显增加。XIANG等[20]研究发现当N2H4质量浓度为2~5 mg·L−1时,纯颗粒污泥和絮体-颗粒混合污泥的反应器均可保持长达4个月的稳定高效运行,但纯颗粒污泥系统具有更高效的性能,总氮去除速率(total nitrogen removal rate, TNRR)达到(0.33±0.04) g·(L·d)−1。可见,N2H4对AnAOB活性的影响不仅与N2H4质量浓度有关,还与污泥形态有关。目前大部分研究集中于N2H4对颗粒形态AnAOB的影响,而低质量浓度N2H4对生物膜形态厌氧氨氧化体系的研究尚有不足。但在城市污水低氨氮浓度条件下,厌氧氨氧化颗粒污泥粒径小,难以有效持留在系统中[21],而通过载体形成的厌氧氨氧化生物膜可被有效截留于反应器中,因此,生物膜形式的厌氧氨氧化技术具有更广泛的应用。悬浮载体上的生物膜可自发富集AnAOB,加速AnAOB的粘附与生长,从而加速主流厌氧氨氧化工艺性能的提升[2]。由于生物膜传氧限制,厌氧氨氧化生物膜可以在低溶解氧(dissolved oxygen, DO)环境下生长,对正常的北方气候温度和低氨氮底物浓度适应良好[22]。因此,探究低质量浓度N2H4对厌氧氨氧化生物膜的长期影响,可以为厌氧氨氧化的在城市污水脱氮中的应用提供技术支撑。
-
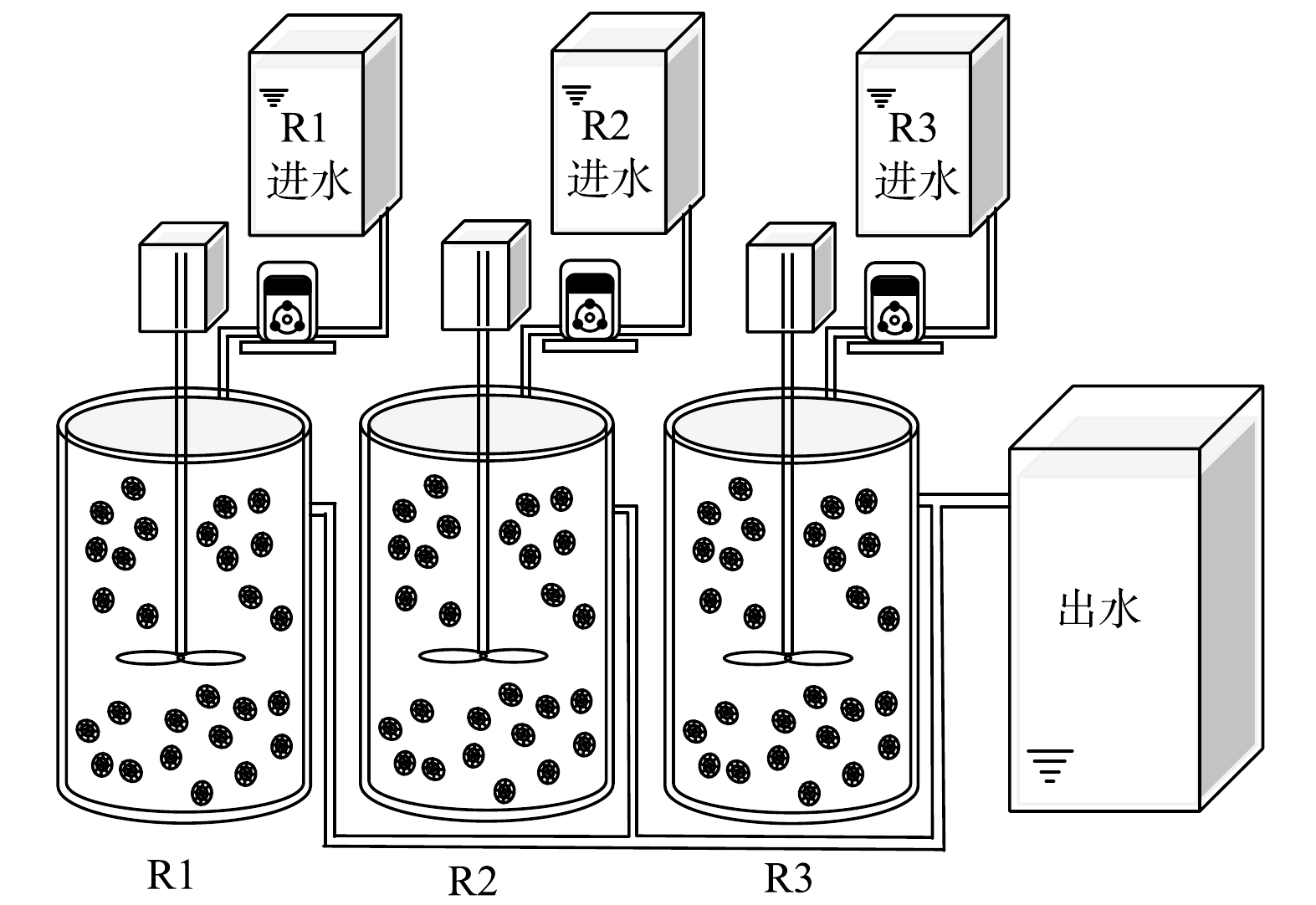
实验室规模的小试采用3个圆柱形移动床生物膜反应器,有效容积为2 L。R1为对照组,R2和R3中分别添加5 mg·L−1和10 mg·L−1的N2H4。3个反应器中均填充已挂膜的填料,填充比为35%,填料直径为25 mm,高10 mm。采用序批式活性污泥法(sequencing batch reactor activated sludge process, SBR)运行,周期为6 h (360 min),包括5 min进水,340 min搅拌,14 min沉降和1 min排水,HRT为1 d,日处理量为2 L·d−1。3个反应器均在常温条件下运行,温度在(27.6±2.4) ℃。反应器装置如图1所示。
-
实验中用到的生物膜污泥来自实验室稳定运行196 d的移动床生物膜反应器(moving bed biofilm reactor, MBBR),NLR为0.6 kg·(m3·d)−1,生物膜系统中的污泥质量浓度为(1 800±100) mg·L−1。
实验采用模拟废水,主要成分有50 mg·L−1 NH4+-N、55 mg·L−1 NO2−-N、300 mg·L−1 CaCl2·2H2O、180 mg·L−1 MgSO4·7H2O、27.2 mg·L−1 KH2PO4以及500 mg·L−1 NaHCO3。每升废水分别加入1 mL微量元素Ⅰ和Ⅱ[23]。N2H4以N2H4·H2SO4的形式投加。初始pH通过滴加1 mol·L−1的HCl或NaOH溶液调节到6.9~7.3。配水采用自来水,未对其进行脱氧处理,进水DO质量浓度为5 mg·L−1。
-
整个过程按不同运行参数分为3阶段。阶段Ⅰ(1~11 d):为获取较为稳定的实验条件,反应器在初始NLR下运行。阶段Ⅱ(12~46 d):加入N2H4运行,3个反应器N2H4质量浓度分别为0、5、10 mg·L−1。阶段Ⅲ(47~60 d):停止加入N2H4,反应器继续运行。实验设计如表1所示。
-
用比色法测定NH4+-N、NO2−-N、NO3−-N和N2H4的质量浓度。其中NH4+-N、NO2−-N和NO3−-N采用标准测试方法[24]。通过加入1 mol·L−1 HCl和0.1mol·L−1 KIO3溶液消除N2H4对NH4+-N测定的干扰[25]。N2H4依照Watt和Chrisp[26]的检测方法,通过加入0.5%的氨基磺酸溶液消除NO2−-N对N2H4测定的干扰[27]。在每个阶段结束(反应器运行第11、46和60天)留取生物样品测定生物量(suspended solids, SS)、有机物量(volatile suspended solids, VSS)、胞外聚合物(extracellular polymeric substances, EPS)、血红素和微生物群落结构。
采用水解法提取生物膜样品中的EPS(主要由蛋白质和多糖组成[28]),蛋白质(proteins, PN)用改良Folin-Lowry法测定,使用牛血清蛋白作为标准物质。多糖(polysaccharides, PS)用蒽酮-硫酸法测定,使用葡萄糖作为标准物质。EPS浓度以单位质量挥发性有机物中EPS的质量(mg·g−1)表示。
用磷酸盐缓冲液(PBS)通过细胞破碎的方式提取血红素[29],以氯化血红素作为标准物质,通过Pyridine-NaOH方法[30]测定血红素的含量。血红素浓度以单位质量挥发性有机物中血红素的物质的量(μmol·g−1)表示。
-
为直观表示出整个反应体系中的主导反应,依照亚硝化反应(式(1))、硝化反应(式(2))以及厌氧氨氧化反应(式(3))的化学计量方程计算得到含有NH4+-N、NO2−-N、NO3−-N变化量的公式。在进水无有机物的厌氧氨氧化反应器中,异养生物对NRR的贡献通常< 5%[31],可忽略其对整体反应的影响,故在计算时不考虑反硝化过程,计算得到式(4)~式(7)。
式中:
θ 为周期时间,d;C1,C2为1个周期内NH4+-N和NO2−-N的去除量,mg·L−1;C3为NO3−-N的生成量,mg·L−1。Q1为AOB对NH4+-N的氧化速率(AOR),g·(m3·d)−1;Q2为NOB对NO2−-N的消耗速率(NOR),g·(m3·d)−1。Q3 为AnAOB对NH4+-N的消耗速率(AnAOR),g·(m3·d)−1;Q4为AnAOB对NO2−-N的消耗速率(AnANR),g·(m3·d)−1。 -
在各阶段的稳定运行期内,保留生物膜样品于-80 ℃条件下冻存。实验结束后统一进行基因组DNA的提取,之后采用341F(5’-CCTACGGGNGGCWG-CAG-3’)和785R(5’- GACTACHVGGGTATCTAATCC-3’)作为扩增引物,对细菌16S rRNA基因进行2轮PCR扩增。后续使用Illumina Novaseq 6000测序平台进行高通量并行测序,将相似水平在97%的序列归为1个OTU进行生物信息统计分析。
-
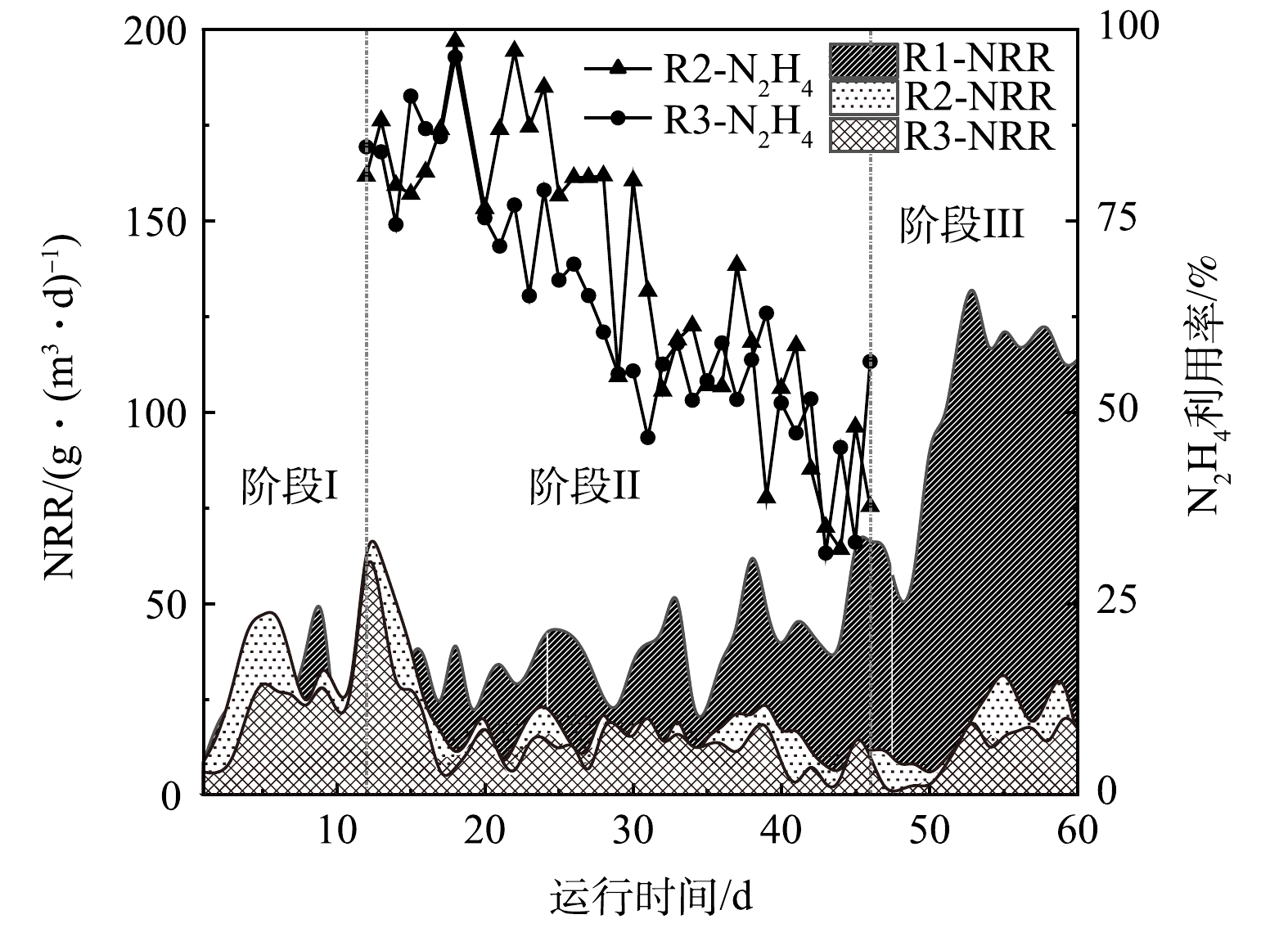
反应器各阶段运行性能如图2所示。在进水NH4+-N和NO2−-N质量浓度分别为(50.9±3.6) mg·L−1和 (55.5±3.2) mg·L−1条件下持续运行11 d后,3个反应器运行趋于平稳。阶段Ⅰ结束时NRR分别为27.7、24.7、23.2 g·(m3·d)−1,这一差异可能是由于实验前期选取的生物膜填料挂膜不均匀导致。
对照组R1内逐渐形成稳定的厌氧氨氧化环境,阶段III时NRR最高达到139.2 g·(m3·d)−1。R2和R3在加入N2H4后均表现出NRR先快速上升后下降的趋势。阶段Ⅱ运行前期(第12~15天),R2和R3中的NRR分别提升了74%和44%,此时N2H4的利用率均在74%以上。随着运行周期的增加(第16~46天),R2和R3的脱氮效能逐渐下降,其中R2内NRR下降了53%,R3内NRR下降了64%,在阶段Ⅱ结束时(第46天)R2和R3中N2H4的利用率分别从最高值(97%和79%)下降到32%。当R2和R3系统内的脱氮效能低于15 g·(m3·d)−1时停止加N2H4,开始阶段Ⅲ的运行。N2H4的抑制解除后,R2内厌氧氨氧化活性开始逐渐恢复,到阶段Ⅲ末期,NRR由阶段Ⅱ末期的11.0 g·(m3·d)−1升至到33.4 g·(m3·d)−1,R3的NRR也由10.4 g·(m3·d)−1升至22.8 g·(m3·d)−1,表明停止投加N2H4后,其抑制作用可缓慢恢复。经14 d恢复后,R2反应器的脱氮效能恢复到投加N2H4前的水平,然而,10 mg·L−1的N2H4对生物膜的抑制作用更强,生物膜恢复更加缓慢。SCHALK等[32](N2H4投加量为28.8 mg·L−1)的研究结果也证实了这一点。但GANESAN等[10](N2H4投加量为10 mg·L−1)、ZHOU等[33]( N2H4投加量为10 mg·L−1)、MIODOŃSKI等[18] (N2H4投加量为3.7 mg·L−1)和XIANG等[14](N2H4投加量为2~5 mg·L−1)的研究结果均表明,投加不同质量浓度的N2H4均能维持脱氮系统长期运行且N2H4可被快速消耗,这与本研究的结果并不一致。
本研究中出现N2H4浓度不断积累且NRR不断下降的现象,推测可能有以下2点原因。一方面,生物膜与颗粒污泥的形态结构存在差异。对比本研究中使用的生物膜,颗粒污泥结构更加密实,传质效率低,内部更容易形成较强的浓度梯度,即实际进入颗粒污泥内部的N2H4浓度会低于水中测得的浓度。溶质的浓度梯度是随着生物膜厚度的增加而形成的,生物膜厚度会影响液体的流动扩散和营养物质的传质效果,从而影响工艺整体性能[34]。本研究中生物膜厚度较薄(约550 μm),可推测扩散到生物膜内部的N2H4质量浓度较高,从而对AnAOB产生较强的毒性效应。另一方面,基质的质量浓度和N2H4质量浓度的比例不同。在前人研究N2H4对低基质(TN<100 mg·L−1)厌氧氨氧化系统的长期影响中,维持系统良好脱氮效果的基质质量浓度与N2H4质量浓度的比例在10左右。本实验中R2和R3中此比例分别为21和10.5,但显然R3受到更强的抑制作用,很可能是N2H4扩散到生物膜的速度过快,因此,需要降低N2H4的质量浓度以达到更好的TN去除效果。根据STROUS[35]提出的厌氧氨氧化分解代谢模型,可推知未反应完全的N2H4会促使反应逆向进行从而产生NH4+-N。SCHALK等[32]在加入N2H4的厌氧氨氧化批式实验中观察到,1 mol的N2H4可被转化为1.3 mol的NH4+-N,在ZEKKER等[13]的实验中,1 mol 的N2H4可形成1.63 mol NH4+-N。可见,AnAOB对N2H4有歧化作用,高质量浓度的N2H4会导致NH4+-N不断积累而升高,从而NRR也不断下降。
-
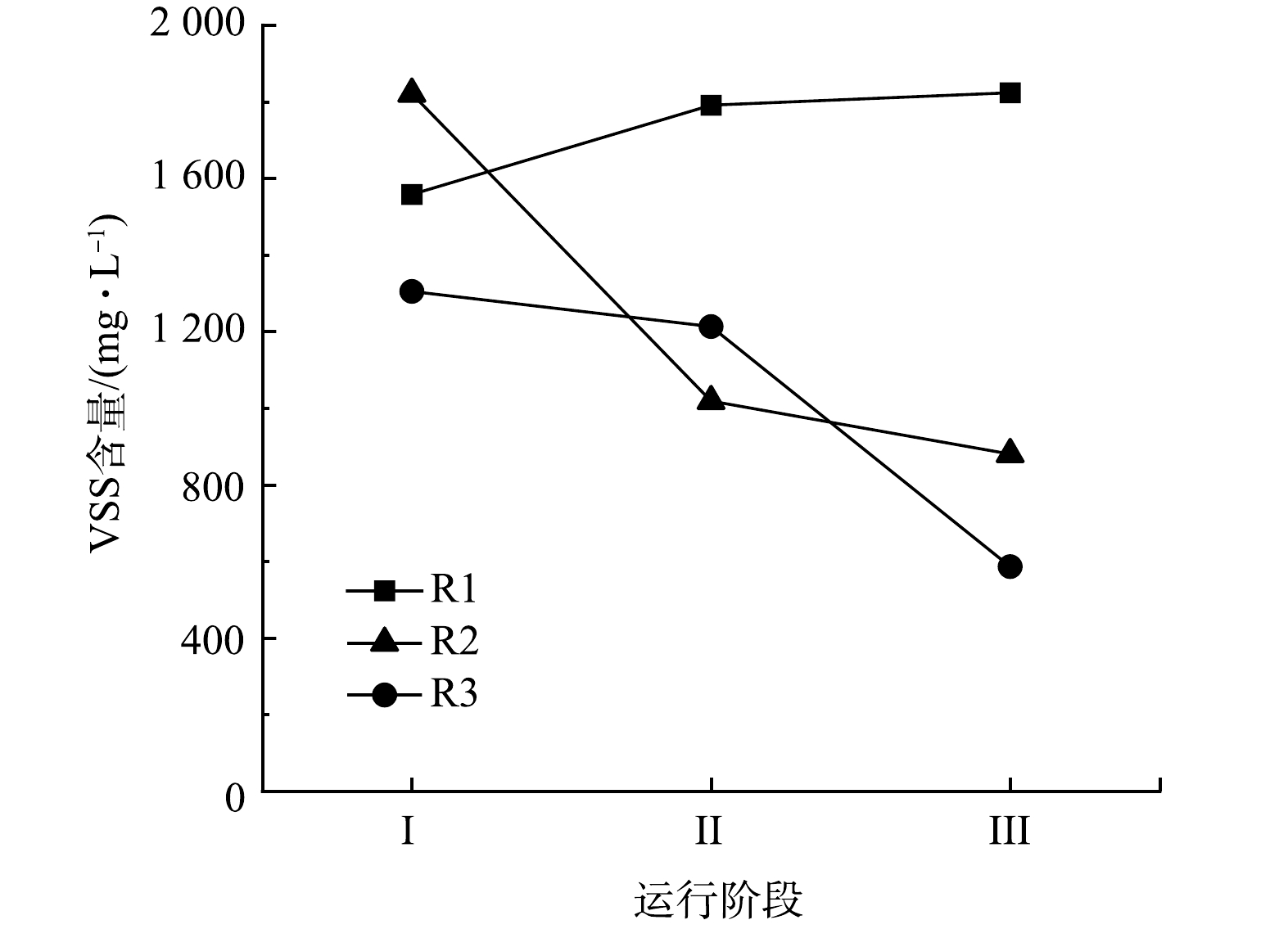
整个运行期间3个反应器内生物量变化如图3所示。对照组R1中的生物量随运行时间的增加逐渐升高,在整个实验周期结束时VSS达到1 824 mg·L−1。且R1在3个反应器中表现出最好的脱氮性能,也证实了R1内生物膜活性较高的结论。在阶段Ⅱ中,R2和R3中均出现了污泥流失情况。停止加入N2H4后,2个反应器内污泥量仍持续下降。R2在阶段Ⅱ和阶段Ⅲ结束时的VSS分别为1 019 mg·L−1和880 mg·L−1,R3在阶段Ⅱ和阶段Ⅲ内VSS分别为1 213 mg·L−1和587 mg·L−1。对比初始值,阶段Ⅲ结束时R2的VSS浓度下降了52%,R3内的VSS浓度下降了55%,可以看出,加入N2H4后反应器内部生物膜会逐渐脱落和流失,生物膜活性减弱,导致系统内部的脱氮效能下降。
-
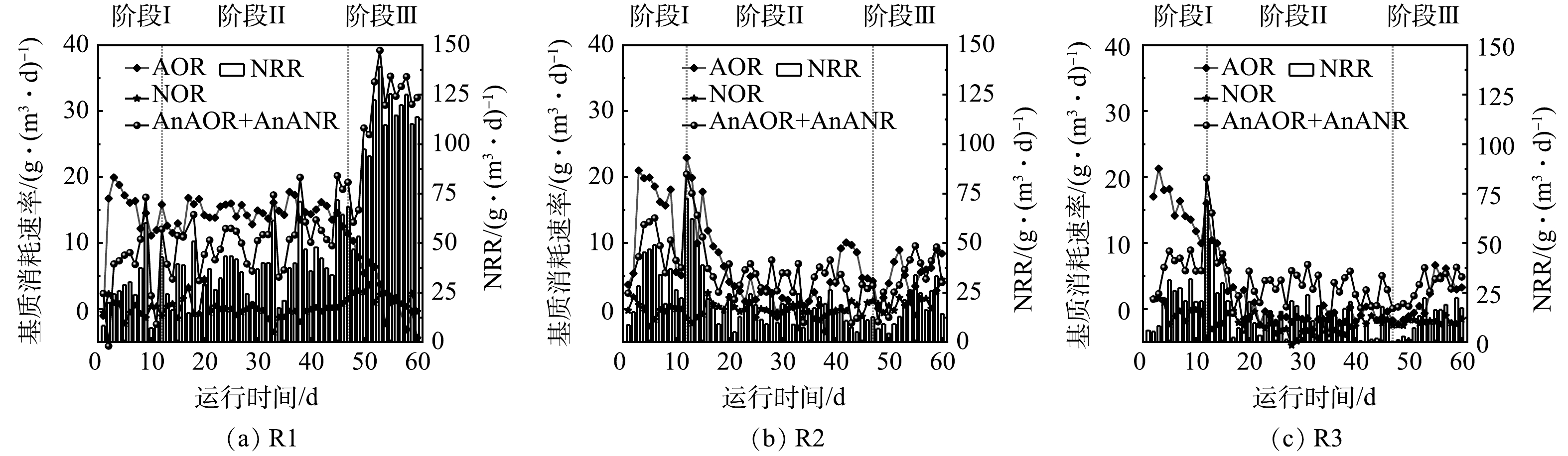
由于进水中含有一定溶解氧,促进了脱氮系统中硝化菌的生长。为评估系统中亚硝化,硝化和厌氧氨氧化效果,对反应器中各阶段的氮素变化量进行分析,从而得到各个反应体系中氨氧化菌(ammonia-oxidizing bacteria, AOB)、亚硝酸盐氧化菌(nitrite-oxidizing bacteria, NOB)和AnAOB的变化趋势,结果如图4所示。从图4(a)可以看出,在阶段Ⅰ和阶段Ⅱ,R1中的AOB和NOB均维持在稳定状态,AnAOB活性逐渐升高,阶段Ⅱ结束时提高了约80%。但在阶段Ⅲ开始时AOB作用减弱,NOB和AnAOB作用增强,NRR最高可达139.2 g·(m3·d)−1。R2以及R3内基质消耗速率分别见图4(b)和图4(c)。加入N2H4后2个反应器内AOR、AnAOR和AnANR短暂提升,与NRR变化规律相一致,说明N2H4的投加会在短期内迅速提高厌氧氨氧化生物膜系统的脱氮效能。有研究表明,外源N2H4可以直接被AnAOB利用,促进厌氧氨氧化进程[36]。对本研究中的厌氧氨氧化生物膜来说,N2H4添加量为5 mg·L−1时的脱氮效果优于10 mg·L−1。对比对照组R1,R2和R3系统内的AnAOB和AOB的活性均只在加入N2H4的前4 d得到提升,但很快就下降到较低水平,与NRR的变化规律一致。这可能是由于N2H4的长期抑制作用导致反应器内生物量随着生物膜不断脱落而流失 (SS分别为6 194 mg·L−1和4 322 mg·L−1),因此,反应器内功能菌的数量进一步降低。阶段Ⅱ运行后期(第31~46天)R2和R3出水N2H4质量浓度分别稳定在1~3 mg·L−1和 3~5 mg·L−1,推测在此阶段N2H4的投加量超过AnAOB的利用量,AnAOB不能有效降解N2H4,继续添加会导致N2H4逐渐积累从而抑制AnAOB的活性。由于N2H4对AOB和NOB均有毒性作用[16],因此,整个体系中AOB和NOB作用均较弱,而NOB比AOB更敏感,会导致NOB的占比更低。在阶段Ⅲ中,停止加入N2H4后,R2和R3中AOB和AnAOB的占比逐渐上升,体系中的脱氮效果也在缓慢提升,可见N2H4的抑制效果是可逆的,但N2H4为5 mg·L−1的R2能逐渐恢复到抑制前的脱氮水平,而投加10 mg·L−1 N2H4的R3较难恢复。
-
EPS对生物膜的形成和稳定有重要作用[37],因此,有必要探讨N2H4对生物膜EPS的影响。3个反应器中EPS变化量及蛋白质和多糖的比值(PN/PS)变化情况如图5所示。对照组R1的EPS处于稳定增长状态,各阶段EPS含量分别为6.76、10.03和11.22 mg·g−1,PN/PS稳定在2.19~2.59,与反应器中NRR的变化趋势一致。阶段Ⅱ结束时(第46天),R2中EPS由阶段I的6.60 mg·g−1增加到17.68 mg·g−1,同时PN和PS的含量也发生变化,PN/PS由3.49增加到8.23。由于外部环境的改变会刺激细菌分泌较多的EPS,这种自我保护行为会适当减轻不良环境造成的影响[38],N2H4的毒性作用导致R2内的细菌分泌大量EPS。EPS中的PN/PS通常用于定义生物膜的状态[34],活性污泥的PN/PS维持在1~4是一个适宜的水平[39]。由于PN会比PS优先响应外部环境变化[40],且较高质量浓度N2H4可通过分泌大量结合蛋白(bound protein, B-PN)触发厌氧氨氧化污泥的自我保护机制[36],导致R2中的PN增长了2倍,生物膜变得蓬松不稳定,促进了生物膜的脱落和流失,引起反应器运行效能的下降。这与阶段Ⅱ观察到的反应器出水浊度增大以及NRR的下降一致。与R2相反,R3内的EPS由9.23 mg·g−1下降到4.38 mg·g−1,PN/PS的值由2.33增加到6.88。这可能是由于R3中N2H4质量浓度过高,对生物膜产生更强的毒性致使微生物死亡,导致EPS含量下降。停止加入N2H4后,R2的EPS含量下降了42%,PN/PS为2.20,与对照组R1近乎相平。R3的EPS含量逐渐升高至8.84 mg·g−1,PN/PS为2.25。PN/PS的值越低则系统稳定性越高[41],2个反应器内PN/PS均降到适宜范围(1~4)内,可证明污泥结构已经趋于稳定,受N2H4刺激后生物膜缓慢恢复。
-
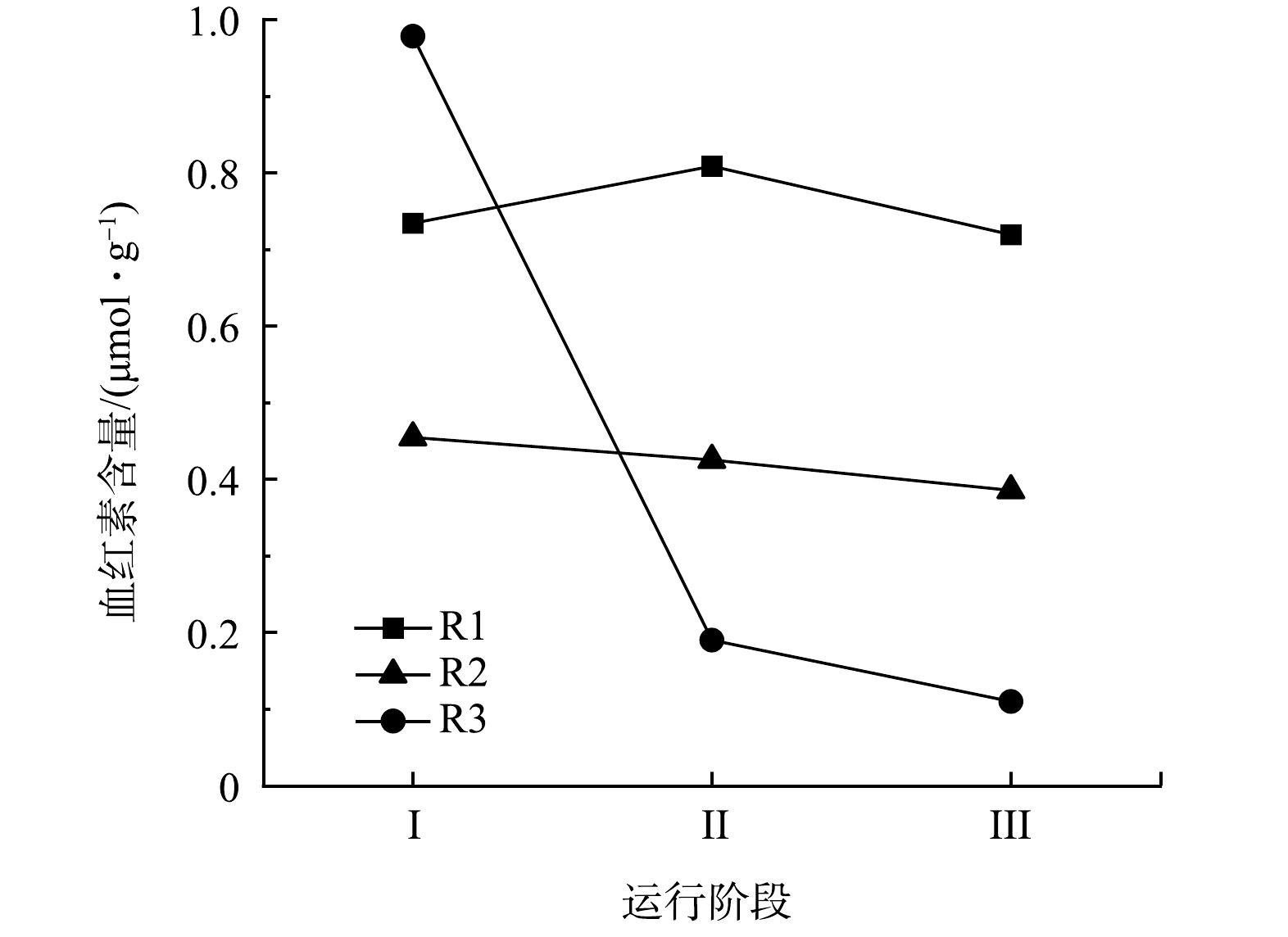
血红素参与AnAOB的主要代谢反应,具有催化和电子转移潜力,可以作为评估厌氧氨氧化性能的指标[29]。不同质量浓度N2H4对AnAOB中血红素的影响如图6所示。对照组R1各阶段的血红素含量分别为0.73、0.81、0.72 μmol·g−1,整体维持在平稳状态。R2和R3中血红素含量均呈现下降的趋势。R2从0.45 μmol·g−1 降至0.39 μmol·g−1,R3则从0.78 μmol·g−1降至0.11 μmol·g−1。在厌氧氨氧化的代谢过程中,N2H4作为厌氧氨氧化过程的中间产物,会被脱氢酶(hydrazine dehydrogenase, HDH)氧化成N2,从而完成脱氮过程[10]。细胞色素c的含量与HDH活性存在正相关,HDH酶的活性越高,处于还原状态的细胞色素c的就越多,而血红素是细胞色素c的关键组分[42]。在本研究中,加入N2H4后的生物膜中的血红素含量一直下降,即HDH的活性一直下降,阻碍了厌氧氨氧化过程中催化N2H4氧化生成N2这一反应的正向进行,从而导致N2H4积累。由于N2H4具有强毒性,HDH受到高质量浓度N2H4的抑制,血红素的还原能力下降,AnAOB的活性受抑制,最终导致系统中NRR下降。此外,通过对比R2和R3在整个反应阶段血红素的变化量,可看出N2H4的加入量越高,抑制作用越明显,厌氧氨氧化活性越难以恢复。
-
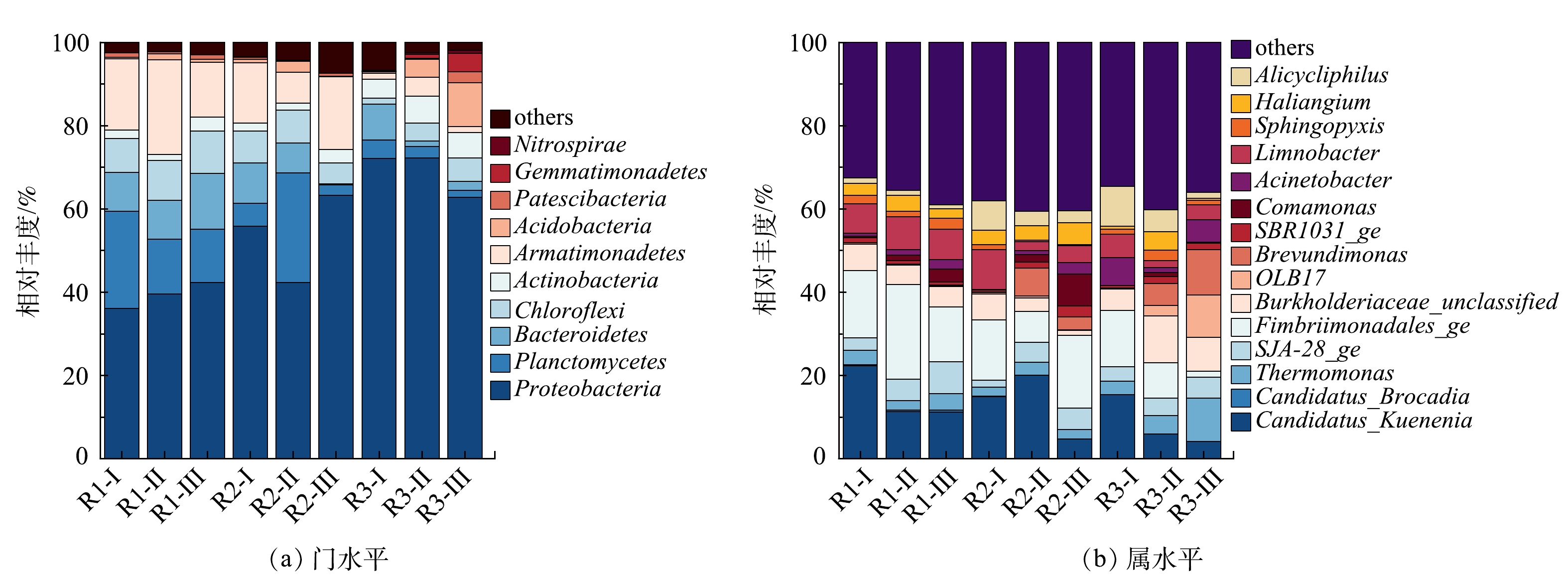
反应器在不同运行周期门水平和属水平的微生物群落结构如图7所示。可以看出,细菌的相对丰度随运行条件的改变有明显差异,表明N2H4对微生物群落的影响逐渐显现。由图7(a)中可观察到所有样本中的主要优势菌门有变形菌门(Proteobacteria)、浮霉菌门(Planctomycetes)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)和装甲菌门(Armatimonadetes),这些都是脱氮系统中常见的典型细菌[43]。有研究[44]表明AnAOB隶属于浮霉菌门,对照组R1在整个运行周期内Planctomycetes一直维持在较高水平(12.86%~23.36%),实现了MBBR脱氮系统的长期稳定运行。加入N2H4后,R2中Planctomycetes呈现先上升至26.33%,而后下降至2.50%的现象,丰度的上升与NRR的短暂增加的结果相一致。R3内几乎不存在Planctomycetes,其相对丰度从4.44%下降到2.86%,同时可观察到放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)占明显优势,其相对丰度分别由0.55%和0.31%增长至7.17%和10.46%,说明N2H4会促进其它菌门的生长,Planctomycetes与Actinobacteria等菌门之间对底物的竞争增大,降低了AnAOB的占比,破坏脱氮系统的稳定性。
图7(b)反映了了各反应器在不同运行阶段,相对丰度占比在前15的主要菌属。样品中均检测出2种属水平AnAOB,Candidatus_Kuenenia和Candidatus_Brocadia,其中以Candidatus_Kuenenia为主。对照组R1在整个运行周期内Candidatus_Kuenenia一直维持在较高水平(11.18%~22.37%),即使在阶段Ⅱ略有下降但仍占主导地位。对比阶段Ⅲ和阶段Ⅰ,R2和R3中Candidatus_Kuenenia所占比例分别下降了64%和61%,表明长期添加微量N2H4会使AnAOB相对丰度降低,这与反应器运行过程中系统脱氮效率降低的现象一致。Fimbriimonadales在对照组R1中的相对丰度较高,为13.18%~22.68%。有研究[45]表明,Fimbriimonadales是一种异养菌,也可以利用NH4+-N和NO2−-N生成N2。本研究中Fimbriimonadales可能与AnAOB共存于反应器中协同脱氮。对照组R1中Burkholderiaceae一直维持在4.89%~6.37%,R3中Burkholderiaceae的相对丰度从阶段Ⅰ的5.16%上升到阶段Ⅱ的11.17%。Burkholderiaceae属于反硝化细菌,具有还原NO3−-N或NO2−-N的能力[31]。可见,N2H4的长期加入促进了Burkholderiaceae的生长,加大了对底物NO2−-N的竞争,抑制了AnAOB生长。有研究[46]表明,Limnobacter可与AnAOB共生,这可以保护AnAOB免受不利环境的影响。对照组中Limnobacter的丰度稳定在7%左右,但该菌属在R2中的丰度由9.55%降至2.12%,R3中由5.64%降至1.62%。N2H4会破环这种保护平衡,令AnAOB暴露在不利环境中,从而降低其活性。终上所述,N2H4不仅直接降低Candidatus_Kuenenia的丰度,还对与AnAOB菌属协同脱氮的其它菌属起到抑制作用,从而降低反应器整体功能菌属的活性,进而影响脱氮效果。
-
1)在进水NH4+-N质量浓度在(50.9±3.6) mg·L−1,NO2−-N质量浓度在(55.5±3.2) mg·L−1的条件下,加入5 mg·L−1和10 mg·L−1的N2H4可以使NRR短暂增长,但长期运行后NRR分别下降了53%和 64%。N2H4的长期加入会对生物膜产生生物毒性,抑制脱氮过程。
2) 5 mg·L−1的N2H4使生物膜的EPS分泌量提高,触发生物膜保护机制,解除N2H4抑制后,EPS浓度恢复,但生物膜变得松散,易脱落,导致污泥流失。10 mg·L−1的N2H4抑制了生物膜中AnAOB的活性,EPS和血红素含量均明显下降,解除N2H4抑制后,生物膜脱氮活性也难以恢复。
3)长期添加微量N2H4会降低厌氧氨氧化生物膜脱氮系统中Planctomycetes和Candidatus_Kuenenia的丰度。
微量肼对厌氧氨氧化生物膜长期运行效果的影响
Effects of trace hydrazine on long-term operation of anammox biofilm
-
摘要: 为探究微量肼(N2H4)对厌氧氨氧化生物膜的长期影响,采用3个移动床生物膜反应器(moving bed biofilm reactor, MBBR)处理低浓度氨氮(50.9±3.6) mg·L−1废水,分别加入0 mg·L−1 (对照组,R1)、5 mg·L−1 (R2)和10 mg·L−1(R3)的微量N2H4后连续运行35 d,考察N2H4对MBBR系统中总氮去除速率(total nitrogen removal rate, TNRR)、生物量、胞外聚合物(extracellular polymeric substances, EPS)、血红素和微生物群落的影响。结果显示,运行末期相对于R1,R2和R3的NRR分别下降了53%和 64%。N2H4 质量浓度为5 mg·L−1时,生物膜的EPS分泌量提高,触发了生物膜保护机制;当N2H4 质量浓度为10 mg·L−1时,生物膜的EPS和血红素含量均明显下降,N2H4对生物膜产生抑制作用。长期添加微量N2H4导致门水平中Planctomycetes和Candidatus_Kuenenia的相对丰度降低,可见,N2H4的加入可以使NRR短暂增长,但长期加入会对厌氧氨氧化生物膜产生生物毒性,抑制厌氧氨氧化菌(AnAOB)的活性。整体而言,5 mg·L−1和10 mg·L−1的N2H4的加入都难以维持MBBR长期稳定高效运行,其对厌氧氨氧化生物膜的负面影响更为明显。Abstract: The long-term effect of trace N2H4 on the anammox biofilm was investigated in moving bed biofilm reactors (MBBR) treating wastewater with low ammonia nitrogen concentration of (50.9±3.6) mg·L−1. After adding 0 mg·L−1 (control group, R1), 5 mg·L−1 (R2) and 10 mg·L−1 (R3) of N2H4 for 35 days, the effect of N2H4 on the total nitrogen removal rate (TNRR), biomass, extracellular polymeric substances (EPS), and heme in the MBBR systems were evaluated. The results showed that compared with R1, the NRR decreased by 53% and 64% at the end of the operation period in R2 and R3, respectively. 5 mg·L−1 N2H4 could trigger the protective mechanism of the biofilm and increased EPS secretion from it. 10 mg·L−1 N2H4 resulted in the obvious decrease of EPS and heme content, and N2H4 inhibited the activity of anammox in biofilms. Meanwhile, long-term addition of trace N2H4 reduced the abundance of Planctomycetes at phylum level and reduced that of Candidatus_Kuenenia at genus level. It can be seen that the addition of N2H4 initially increased the NRR, but the long-term addition produced biological toxicity and inhibit the activity of AnAOB. Overall, the addition of 5 mg·L−1 and 10 mg·L−1 N2H4 could not lead to a stably and efficiently long-term operation of MBBR, but result in a more significant negative effect on the anammox biofilm.
-
Key words:
- exogenous N2H4 /
- Anammox /
- MBBR /
- EPS /
- heme
-
落地油泥是石油开采过程中产生的一种固体废弃物,因其环境危害大,已被列入国家危险固体废弃物名录[1-4]。对其进行有效处理,无疑具有重要的环境保护效益。目前,常用的油泥处理技术有焚烧、萃取、热解、氧化、热洗、生物修复、固化/稳定化等[5-12]。其中,焚烧、热解等技术虽然除油效果很好,但无法回收其中的石油资源;而萃取、热洗等技术存在处理成本高、原油回收效率低等问题[13-20]。
近年来,利用超声波处理油泥技术受到广泛关注。研究发现,超声波的“空化效应”可弱化土壤对原油的黏附作用,提高原油的清洗效率[21-24]。与现有的其他技术相比较,超声波处理技术具有分离效果好、成本低、操作简单等优点[21-26]。然而,研究中也发现利用超声波处理不同来源油泥时存在效果不稳定、原油回收效率差异大等问题[27-30],具体原因仍然不清楚,但怀疑与油泥中土壤的性质有关。
本研究选取了3种具有代表性的油田落地油泥,在分析土壤颗粒级配、化学组成的基础上,着重考察了土壤性质对超声处理除油效果的影响。同时,利用脱油后的油田油泥土壤进行了原油吸附和超声除油模拟实验,以期为油田落地油泥超声处理技术的开发及规模化应用提供指导。
1. 实验与方法
1.1 试剂和仪器
实验所用油泥样品取自于冀东、大庆、大港3个油田生产作业所产生的新鲜落地油泥。现场去除落地油泥中的杂草、树枝、生活垃圾及大块岩石后,将样品密封于黑色取样袋内,运回实验室4 ℃保存。
实验试剂为三氯甲烷、无水硫酸钠、四氯化碳、30%双氧水、盐酸等试剂,均为分析纯,购自国药化学试剂集团。
实验仪器:红外测油仪(126+,吉林北光,中国);X射线衍射(X’Pert PRO MPD,荷兰PANalytical分析仪器有限公司,荷兰);激光粒度仪(Mastersizer 3000,马尔文,英国);X射线荧光光谱(ARL Perform’X4200,赛默飞世尔科技(中国)有限公司,中国)。
1.2 油泥超声处理
取100 g新鲜油泥样品,加水400 g,在60 ℃恒温水浴、50 r·min−1搅拌的条件下,用0.33 W·cm−2、25 KHz的超声波进行超声处理30 min,处理结束后静置沉淀或离心分离后取下层土壤烘干测定土壤中残余原油含量,每组实验重复3次。
1.3 模拟油泥制备及处理
以三氯甲烷为萃取剂,采用索氏提取法去除冀东及大港落地油泥中的原油,风干后研磨过筛,取0.25~0.50 mm(35~60目)的土壤为模拟用土。将模拟土壤搅拌均匀后,称取10.0 g土壤、2.0 g蒸馏水,分别加入冀东原油1.0、2.0、3.0、5.0、7.0 g,充分搅拌均匀后、密封于45 ℃恒温老化24 h,每组重复3次。恒温老化结束后,加40 mL热水(45 ℃)并在45 ℃恒温搅拌10 min(50 r·min−1),搅拌结束后,静置沉淀,除去上层水及未吸附的原油,取下层土壤约2.0 g烘干后测定原油的吸附量。然后再加40 mL 温度为60 ℃的热水,按照与上述油泥超声处理同样的操作进行处理后,测定土壤中的剩余含油量。
1.4 分析及表征
1)油泥组分分析。用烘干至恒重的玻璃培养皿,取50 g左右经过搅拌混匀的新鲜油泥样品3份进行称重,然后在65 ℃下烘24 h后,转移至干燥器中冷却至室温再称重,计算油泥含水量。
将烘干后的油泥样品原样磨碎、混匀后随机取样1.00 g,转移至100 mL的分液漏斗中,加入红外测油专用的四氯化碳50.0 mL,在200 r·min−1下振荡30 min,静置10 min后,将萃取液通过装填有无水硫酸钠的层析柱,去掉最先流出的滤液35 mL,取后续滤液1.0 mL转移至25 mL比色管中用测油专用四氯化碳定容,按照《水质 石油类和动植物油类的测定 红外分光光度法》(HJ637-2012)使用红外测油仪测定油泥含油量。含固量为原样与含油、含水量之差。
2)土壤颗粒分析。将烘干的油泥原样用三氯甲烷萃取除去原油,研磨后去掉石块和杂物,按四分法取5.0 g土壤于100 mL烧杯中,加入20 mL H2O2(10%)溶液、加热至沸腾,使其充分反应,自然冷却后再加入20 mL HCl(10%)溶液,加热至沸腾;自然冷却后加蒸馏水至80 mL,置于超声波清洗机中超声15 min后静置24 h[31]。预处理结束、抽去上层蒸馏水、搅拌均匀后用激光粒度仪测试土壤颗粒粒径。
3)土壤元素及矿物种类分析。将用三氯甲烷萃取后的土壤研磨后过200目土壤筛,取筛下混合均匀的土壤样品约10 g左右,置于200 ℃下恒温2 h,然后转移至干燥器中冷却,用于X射线荧光光谱分析和X射线衍射仪分析,并按照RIR因子法计算土壤中矿物的相对含量[32-34]。
2. 结果与讨论
2.1 落地油泥组分
3个油田落地油泥中的水分、石油类和固体含量见表1。由表1可知,落地油泥中含有3%~10%的石油类、68%~90%的土壤、9%~22%的水分。其中,冀东落地油泥的固相含量最高,含油率、含水率最低;大庆落地油泥中的固相含量最低,含油率和含水率均为最高;大港落地油泥的3项含量处于冀东和大庆落地油泥之间。
表 1 3种落地油泥的组分构成Table 1. Compositions of oil sludge from different oilfields样品编号 油泥来源 含水/% 含油/% 含固/% JD-L 冀东油田 8.53±0.12 2.70±0.12 88.99±0.12 DQ-L 大庆油田 22.02±1.63 9.552±1.6 68.43±1.63 DG-L 大港油田 17.65±1.79 7.815±1.7 75.91±1.79 2.2 不同来源的油泥超声除油效果对比
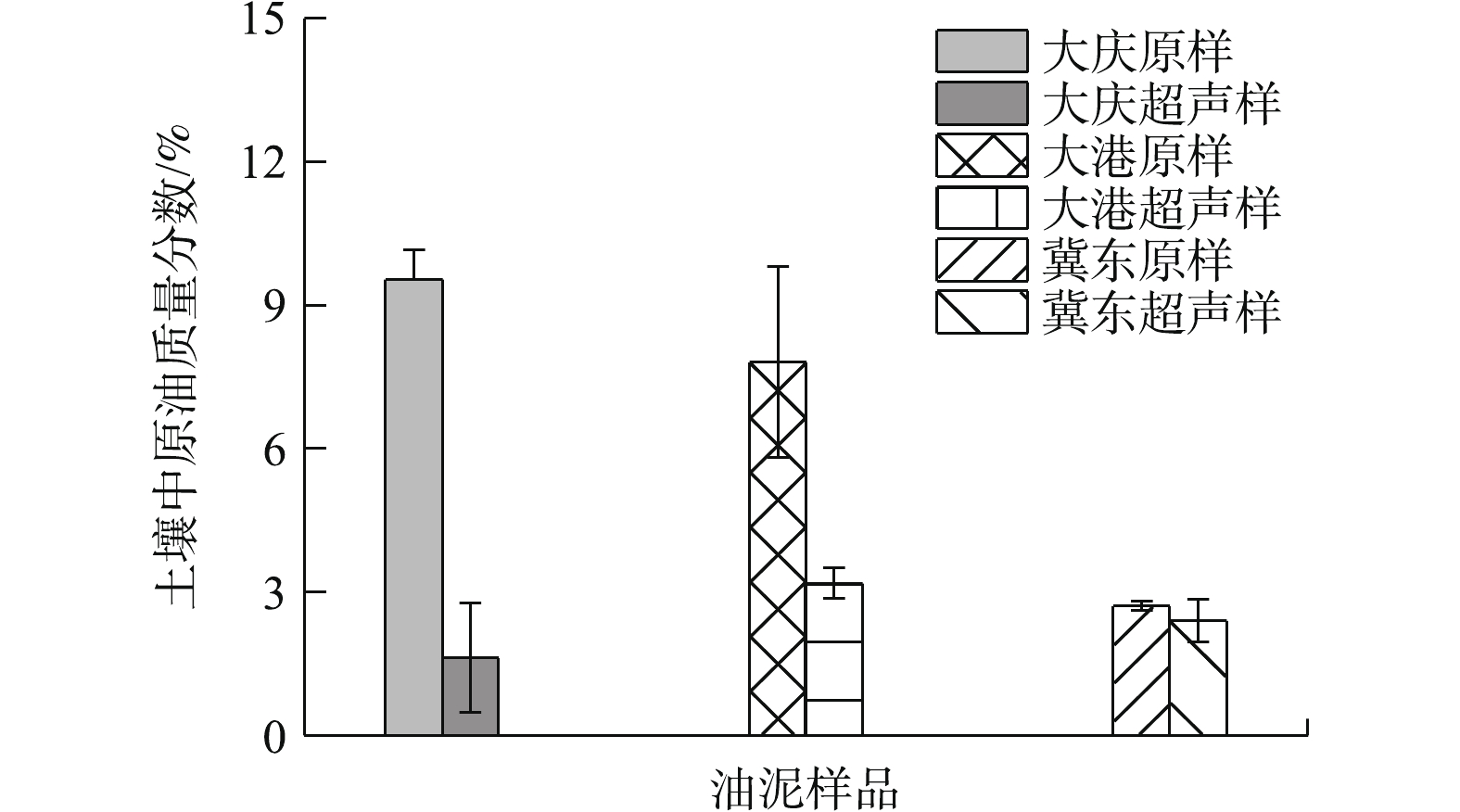
已有研究[27-30]表明, 在使用超声处理技术处理油田油泥时,不同地域来源油泥的原油去除率差异较大。本研究所选取的3种代表性的落地油泥也来自于不同地域的油田,超声处理前后土壤中原油含量如图1所示。超声处理后,大庆、大港、冀东落地油泥土壤固相中残余原油含量分别为(1.62±1.15)%、(3.18±0.32)%、(2.4±0.45)%,原油去除率分别为83.10%、59.33%、11.22%,与已有研究结果一致。其中,大庆落地油泥的处理效果最好,处理后的土壤含油量基本可以达到标准(<2%);大港落地油泥次之,冀东落地油泥的处理效果最差。
2.3 土壤颗粒级配对超声除油效果的影响
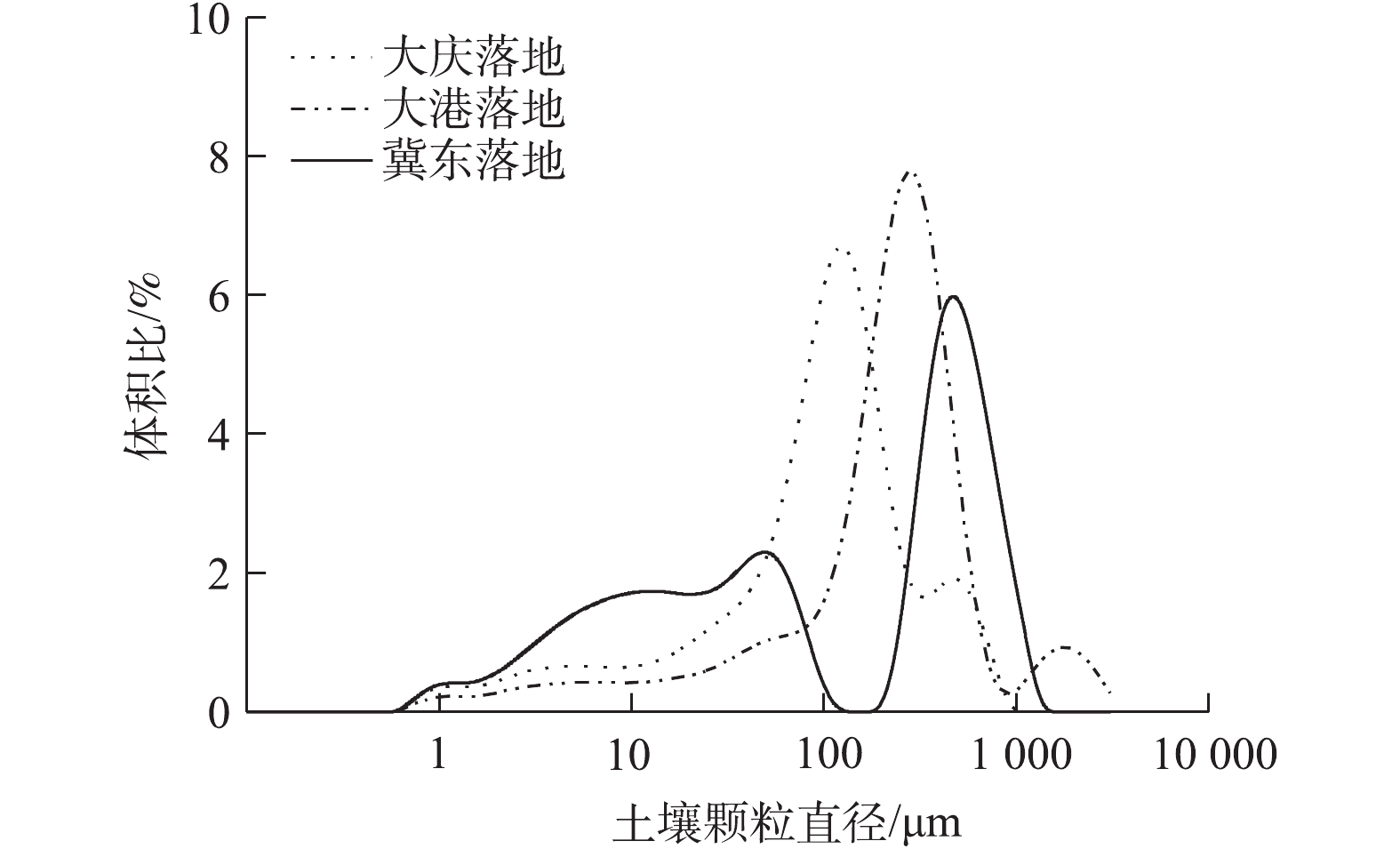
图2为3种落地油泥土壤的粒径分布情况。落地油泥中土壤颗粒粒径分布极不均匀,均表现出双峰分布的特征。大庆落地油泥土壤颗粒粒径分别在100 μm和500 μm左右出现峰,其中100 μm附近的土壤颗粒所占比重最大。大港油泥土壤颗粒的第1个峰出现在300~400 μm处,第2个则出现在2 000 μm处。而冀东落地油泥颗粒在2~60 μm处出第1个扁平峰,在500~700 μm处出现第2个陡峭峰。通过比较3种土壤颗粒粒径和比表面积(表2)发现,冀东油田落地油泥土壤粒径最小、比表面积最大,这可能是造成冀东落地油泥超声处理效果较差的重要原因。此外,采用不同粒径的河沙为模拟土壤、冀东原油为模拟油的模拟实验结果也验证了土壤颗粒越大,超声处理效果越好,土壤颗粒粒径越小,超声处理效果越差(实验数据未列出)。
表 2 落地油泥土壤颗粒粒径分布及其比表面积Table 2. Particle size distribution and surface areas of oil sludge soils油泥样品 油泥来源 比表面积/(m2·kg-1) d10/μm d50/μm DQ-L 大庆油田 311.3 9.4 113.0 DG-L 大港油田 194.9 25.3 254.0 JD-L 冀东油田 424.3 5.1 91.2 2.4 土壤组成对超声除油效果的影响
落地油泥土壤中化学氧化物质量比大于0.5%的元素含量如图3所示。由图3可知,硅、铝、铁、钙等含量相对较高,其中,硅氧化物含量最高。不同来源的油泥中铁和铝氧化物含量基本相同,而硅氧化物和钙氧化物有较大差异。在大港、大庆、冀东落地油泥土壤中,硅氧化物的含量分别为61.17%、62.27%、55.42%;钙氧化物含量分别为4.84%、5.94%、11.57%。大庆和大港落地油泥中的硅氧化物含量显著高于冀东落地油泥,而冀东落地油泥中钙氧化物含量比大庆、大港落地油泥高出1倍左右。超声处理后,大庆、大港落地油泥的除油效果较好,冀东落地油泥的效果最差,这表明油泥土壤中的硅氧化物及钙氧化物含量可能与除油效果有关。
进一步对油泥土壤中的矿物组成进行分析,XRD结果表明,落地油泥土壤中矿物的结晶度较低,钙、铁等氧化物全部以非晶态形式存在,只有小部分的硅氧化物和铝氧化物以晶体形式存在。晶体矿物主要有二氧化硅、硅酸铝钾、硅酸铝钠、磷酸铝等,其中,二氧化硅和硅酸铝钠是油泥土壤中共有的晶体矿物,占晶体矿物总量的50%以上。因此,很难从油泥土壤中晶体矿物的种类和结晶度来评价油泥的超声处理效果。
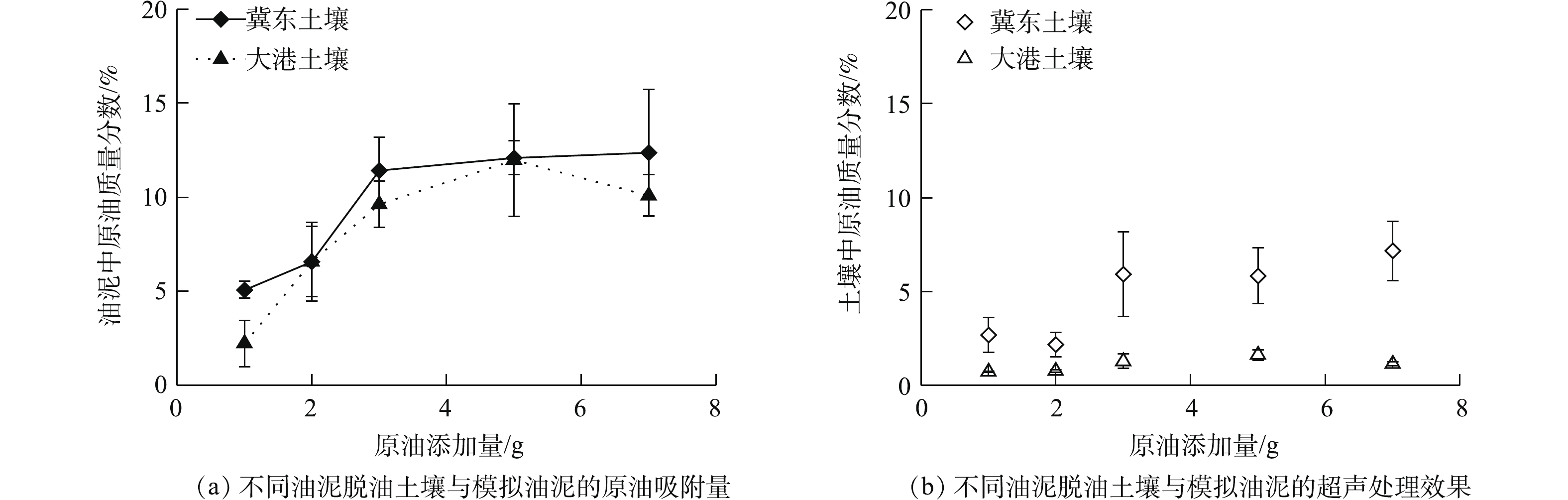
表 3 落地油泥土壤中矿物定性及半定量分析结果Table 3. Qualitative and semi-quantitive results of minerals in oil sludge soils from different oilfields.油泥名称 PDF卡片号 化学式 RIR 相对含量/% 结晶度/% 大庆落地油泥 01-086-1628 SiO2 3.09 36.00 23.64 01-084-0982 Na(AlSi3O8) 0.66 50.00 01-071-1543 K(AlSi3O8) 0.75 14.00 大港落地油泥 01-085-1054 SiO2 3.07 6.90 42.47 01-076-0228 AlPO4 3.01 12.90 01-075-0296 KCl 6.07 1.00 01-084-0982 Na(AlSi3O8) 0.66 79.20 冀东落地油泥 01-086-1629 SiO2 3.10 52.00 27.72 01-072-1245 Na(AlSi3O8) 0.66 48.00 在冀东落地油泥和大港落地油泥的土壤中,钙氧化物和硅氧化物含量差异较大。选择这2种组成不同的脱油后油泥土壤,以冀东原油为模拟油开展原油吸附和超声除油模拟实验,结果如图4所示.
模拟油泥的原油吸附量随原油添加量的增加而增大,当添加量增加到3.0 g,即原油质量占土壤质量的30%时,吸附基本达到平衡。采用Langmuir模型和多分子层吸附的BET模型拟合分析,拟合效果较差。而用Logistic模型处理,修正后的R2均大于0.9,拟合效果好。Logistic模型的计算公式如式(1)所示。
y=y2+y1−y21+(xx0)p (1) 式中:y为土壤中原油质量比,%;x为原油添加量,g;回归参数y1、y2、x0、p分别为y的最小值、y的最大值、曲线拐点及与拐点处斜率相关的参数。由拟合结果(表4)可知,Logistic方程可以很好地反映原油在土壤中的吸附过程,冀东落地油泥土壤的最大吸附量为12.12%,大港落地油泥土壤的最大吸附量为10.31%。由此可见,钙氧化物含量高的冀东落地油泥土壤对原油的吸附量大于钙氧化物含量低的大港落地油泥土壤。
表 4 原油在土壤表面的吸附过程分析Table 4. Analysis of the adsorption process of crude oil in the soil surface模拟油泥土壤来源 Logistic模型参数 R2 y1 y2 x0 p 冀东落地油泥 5.07 12.12 2.32 8.66 0.997 大港落地油泥 2.00 10.31 1.93 5.60 0.950 在经过超声处理后,冀东土壤配制的油泥的残余含油量随着原油吸附量的增加而增加,吸附平衡后土壤中原油的去除率为(47.3±4.0)%。而大港土壤配制的模拟油泥残余含油量并未随吸附量的增加而增加,吸附平衡后土壤中原油的去除率为(87.3±1.0)%。这表明钙氧化物含量高的土壤与冀东原油的吸附作用强,超声处理后油泥中原油的去除率低。
3. 结论
1)油泥土壤颗粒级配分布宽,为0.5~2 000 μm;且不同土壤级配的油泥超声除油效果不同。粒径大的土壤颗粒超声除油效果较好;粒径小的土壤颗粒超声除油效果差。
2)原油在土壤中的吸附符合Logistic模型。钙氧化物含量高的土壤对原油的吸附量大、吸附强度高、超声处理效果较差;而钙氧化物含量低的吸附量小、吸附强度弱、超声处理效果较好。
3)模拟油泥的超声处理效果均优于实际油泥,除实际油泥的土壤颗粒级配分布宽以外,油泥的老化时间也可能是影响油泥超声处理效果的重要因子,其具体机理有待进一步的研究。
-
表 1 实验设计表
Table 1. The experimental design table
反应器 阶段Ⅰ(1~11 d) 阶段Ⅱ(12~46 d) 阶段Ⅲ(47~60 d) R1 未添加N2H4 未添加N2H4 未添加N2H4 R2 添加5 mg·L-1 N2H4 R3 添加10 mg·L-1 N2H4 -
[1] JIA Z, YUAN Q, ROOTS P, et al. Partial Nitritation/Anammox and biological phosphorus removal integration in a single bioreactor under mainstream conditions[J]. Bioresource Technology, 2023, 373: 128714. doi: 10.1016/j.biortech.2023.128714 [2] YUAN Q, JIA Z, ROOTS P, et al. A strategy for fast anammox biofilm formation under mainstream conditions[J]. Chemosphere, 2023, 318: 137955. doi: 10.1016/j.chemosphere.2023.137955 [3] 卢帅宇, 由昆, 周伟伟, 等. MBBR厌氧氨氧化工艺污水脱氮的研究进展[J]. 能源环境保护, 2022, 36(6): 22-31. doi: 10.3969/j.issn.1006-8759.2022.06.003 [4] XU Y, XU Y, LI T, et al. Two-step partial nitrification-anammox process for treating thermal-hydrolysis anaerobic digester effluent: Start-up and microbial characterisation[J]. Journal of Cleaner Production, 2020, 252: 119784. doi: 10.1016/j.jclepro.2019.119784 [5] TRINH H P, LEE S H, JEONG G, et al. Recent developments of the mainstream anammox processes: Challenges and opportunities[J]. Journal of Environmental Chemical Engineering, 2021, 9(4): 105583. doi: 10.1016/j.jece.2021.105583 [6] MA J, WEI J, KONG Q, et al. Synergy between autotrophic denitrification and Anammox driven by FeS in a fluidized bed bioreactor for advanced nitrogen removal[J]. Chemosphere, 2021, 280: 130726. doi: 10.1016/j.chemosphere.2021.130726 [7] ZHANG S, ZHANG L, YAO H, et al. Responses of anammox process to elevated Fe(III) stress: Reactor performance, microbial community and functional genes[J]. Journal of Hazardous Materials, 2021, 414: 125051. doi: 10.1016/j.jhazmat.2021.125051 [8] WANG Z, LIU X, NI S Q, et al. Nano zero-valent iron improves anammox activity by promoting the activity of quorum sensing system[J]. Water Research, 2021, 202: 117491. doi: 10.1016/j.watres.2021.117491 [9] LIU W, SHEN C, LIU C, et al. Achieving stable mainstream nitrogen and phosphorus removal assisted by hydroxylamine addition in a continuous partial nitritation/anammox process from real sewage[J]. Science of the Total Environment, 2021, 794: 148478. doi: 10.1016/j.scitotenv.2021.148478 [10] GANESAN S, VADIVELU V M. Effect of external hydrazine addition on anammox reactor start-up time[J]. Chemosphere, 2019, 223: 668-674. doi: 10.1016/j.chemosphere.2019.02.104 [11] YIN X, QIAO S, ZHOU J, et al. Fast start-up of the anammox process with addition of reduced graphene oxides[J]. Chemical Engineering Journal, 2016, 283: 160-166. doi: 10.1016/j.cej.2015.07.059 [12] ADAMS M, XIE J, CHANG Y, et al. Start-up of Anammox systems with different biochar amendment: Process characteristics and microbial community[J]. Science of The Total Environment, 2021, 790: 148242. doi: 10.1016/j.scitotenv.2021.148242 [13] ZEKKER I, KROON K, RIKMANN E, et al. Accelerating effect of hydroxylamine and hydrazine on nitrogen removal rate in moving bed biofilm reactor[J]. Biodegradation, 2012, 23(5): 739-749. doi: 10.1007/s10532-012-9549-6 [14] XIANG T, GAO D. Comparing two hydrazine addition strategies to stabilize mainstream deammonification: Performance and microbial community analysis[J]. Bioresource Technology, 2019, 289: 121710. doi: 10.1016/j.biortech.2019.121710 [15] WEN R, WEI Y, ZHANG W. Recovery of nitrogen removal by N2H4 after nitrite inhibited anammox reaction[J]. Global NEST Journal, 2021, 23: 249-256. [16] YAO Z B, CAI Q, ZHANG D J, et al. The enhancement of completely autotrophic nitrogen removal over nitrite (CANON) by N2H4 addition[J]. Bioresource Technology, 2013, 146: 591-596. doi: 10.1016/j.biortech.2013.07.121 [17] YAO Z, ZHANG D, XIAO P, et al. Long-term addition of micro-amounts of hydrazine enhances nitrogen removal and reduces NO and NO3− production in a SBR performing Anammox: Long-term addition of micro-amount hydrazine enhanced Anammox[J]. Journal of Chemical Technology & Biotechnology, 2016, 91(2): 514-521. [18] MIODOŃSKI S, MUSZYŃSKI-HUHAJŁO M, ZIĘBA B, et al. Fast start-up of anammox process with hydrazine addition[J]. SN Applied Sciences, 2019, 1(6): 523. doi: 10.1007/s42452-019-0514-4 [19] 蔡庆, 黄阳全, 罗乐, 等. 厌氧氨氧化颗粒污泥的培养及影响因素[J]. 工业安全与环保, 2016, 42(11): 68-71. doi: 10.3969/j.issn.1001-425X.2016.11.019 [20] XIANG T, GAO D, WANG X. Performance and microbial community analysis of two sludge type reactors in achieving mainstream deammonification with hydrazine addition[J]. Science of the Total Environment, 2020, 715: 136377. doi: 10.1016/j.scitotenv.2019.136377 [21] YUAN Q, ZHANG Y, XUE X, et al. Morphological, kinetic, and microbial community characterization of anammox bacteria with different inoculations and biofilm types for low-ammonium wastewater treatment[J]. Journal of Water Process Engineering, 2022, 47: 102748. doi: 10.1016/j.jwpe.2022.102748 [22] YUAN Q, HE B, QIAN L, et al. Role of air scouring in anaerobic/anoxic tanks providing nitrogen removal by mainstream anammox conversion in a hybrid biofilm/suspended growth full-scale WWTP in China[J]. Water Environment Research, 2021, 93(10): 2198-2209. doi: 10.1002/wer.1592 [23] VAN DE GRAAF A, DE BRUIJN P, ROBERTSON L A, et al. Autotrophic growth of anaerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor[J]. Microbiology, 1996, 142(8): 2187-2196. doi: 10.1099/13500872-142-8-2187 [24] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. [25] CROSBY N T. Determination of ammonia by the Nessler method in waters containing hydrazine[J]. The Analyst, 1968, 93(1107): 406-408. doi: 10.1039/an9689300406 [26] WATT G W, CHRISP J D. Spectrophotometric method for determination of hydrazine[J]. Analytical Chemistry, 1952, 24(12): 2006-2008. doi: 10.1021/ac60072a044 [27] GEORGE M, NAGARAJA K S, BALASUBRAMANIAN N. Spectrophotometric determination of hydrazine[J]. Talanta, 2008, 75(1): 27-31. doi: 10.1016/j.talanta.2007.09.002 [28] YU G H, HE P J, SHAO L M. Characteristics of extracellular polymeric substances (EPS) fractions from excess sludges and their effects on bioflocculability[J]. Bioresource Technology, 2009, 100(13): 3193-3198. doi: 10.1016/j.biortech.2009.02.009 [29] MA H, ZHANG Y, XUE Y, et al. Relationship of heme c, nitrogen loading capacity and temperature in anammox reactor[J]. Science of the Total Environment, 2019, 659: 568-577. doi: 10.1016/j.scitotenv.2018.12.377 [30] BERRY E A, TRUMPOWER B L. Simultaneous determination of hemes a, b, and c from pyridine hemochrome spectra[J]. Analytical Biochemistry, 1987, 161(1): 1-15. doi: 10.1016/0003-2697(87)90643-9 [31] XIAO R, ZHU W, ZHENG Y, et al. Active assimilators of soluble microbial products produced by wastewater anammox bacteria and their roles revealed by DNA-SIP coupled to metagenomics[J]. Environment International, 2022, 164: 107265. doi: 10.1016/j.envint.2022.107265 [32] SCHALK J, OUSTAD H, KUENEN J G, et al. The anaerobic oxidation of hydrazine: A novel reaction in microbial nitrogen metabolism[J]. FEMS Microbiology Letters, 1998, 158(1): 61-67. doi: 10.1111/j.1574-6968.1998.tb12801.x [33] ZHOU S, CHEN Z, WANG J, et al. Recovery of anaerobic ammonium oxidation via hydrazine following sulfate inhibition[J]. Environmental Science:Water Research & Technology, 2022, 8(7): 1458-1465. [34] DI BIASE A, KOWALSKI M S, DEVLIN T R, et al. Moving bed biofilm reactor technology in municipal wastewater treatment: A review[J]. Journal of Environmental Management, 2019, 247: 849-866. [35] STROUS M, HEIJNEN J J, KUENEN J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J]. Applied Microbiology and Biotechnology, 1998, 50(5): 589-596. doi: 10.1007/s002530051340 [36] XIANG T, LIANG H, GAO D. Effect of exogenous hydrazine on metabolic process of anammox bacteria[J]. Journal of Environmental Management, 2022, 317: 115398. doi: 10.1016/j.jenvman.2022.115398 [37] TANG B, YU C, BIN L, et al. Essential factors of an integrated moving bed biofilm reactor–membrane bioreactor: Adhesion characteristics and microbial community of the biofilm[J]. Bioresource Technology, 2016, 211: 574-583. doi: 10.1016/j.biortech.2016.03.136 [38] SHENG G P, YU H Q, LI X Y. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: A review[J]. Biotechnology Advances, 2010, 28(6): 882-894. doi: 10.1016/j.biotechadv.2010.08.001 [39] ZHANG M, GAO J, FAN Y, et al. Combined effects of volume ratio and nitrate recycling ratio on nutrient removal, sludge characteristic and microbial evolution for DPR optimization[J]. Journal of Environmental Sciences, 2021, 104: 69-83. doi: 10.1016/j.jes.2020.12.003 [40] 杨明明, 党超军, 张爱余, 等. 厌氧氨氧化颗粒污泥胞外聚合物金属元素特性[J]. 中国环境科学, 2020, 40(11): 4728-4734. doi: 10.3969/j.issn.1000-6923.2020.11.011 [41] CHEN J, HAI Y, ZHANG W, et al. Insights into deterioration and reactivation of a mainstream anammox biofilm reactor response to C/N ratio[J]. Journal of Environmental Management, 2022, 320: 115780. doi: 10.1016/j.jenvman.2022.115780 [42] KANG D, LI Y, XU D, et al. Deciphering correlation between chromaticity and activity of anammox sludge[J]. Water Research, 2020, 185: 116184. doi: 10.1016/j.watres.2020.116184 [43] LIU W, YANG D, CHEN W, et al. High-throughput sequencing-based microbial characterization of size fractionated biomass in an anoxic anammox reactor for low-strength wastewater at low temperatures[J]. Bioresource Technology, 2017, 231: 45-52. doi: 10.1016/j.biortech.2017.01.050 [44] 杨瑞丽, 王晓君, 吴俊斌, 等. 厌氧氨氧化工艺快速启动策略及其微生物特性[J]. 环境工程学报, 2018, 12(12): 3341-3350. [45] HUANG D Q, WANG Y, WU Q, et al. Anammox sludge preservation: Preservative agents, temperature and substrate[J]. Journal of Environmental Management, 2022, 311: 114860. doi: 10.1016/j.jenvman.2022.114860 [46] WANG C, LIU S, XU X, et al. Achieving mainstream nitrogen removal through simultaneous partial nitrification, anammox and denitrification process in an integrated fixed film activated sludge reactor[J]. Chemosphere, 2018, 203: 457-466. doi: 10.1016/j.chemosphere.2018.04.016 -






 DownLoad:
DownLoad: