-
近年来,镉系量子点(quantum dots,QDs)因其优异的光响应性、带隙可调控和充足且较高的导带能位而被用于制造光催化剂、存储设备、显示器、发光二极管和化学传感器[1-2]。而镉系QDs的大规模商业应用大大增加了其释放到环境中的暴露风险,进而增大其进入污水处理厂的概率以及富集质量浓度。镉系 QDs也将随排水泄露到自然环境,最终危害微生物,藻类和动植物[3-4]。污水处理厂作为防止镉系 QDs进入自然环境的关键一环,明确其长期暴露对污水处理过程的影响至关重要。
活性污泥系统是污水处理厂实现污水净化的核心环节[5],大量研究发现,纳米颗粒(TiO2,ZnO,聚苯乙烯等)进入活性污泥后会通过物理化学吸附等作用从水相转移至污泥中富集[6-8],进而影响污泥絮凝体的结构和功能,造成出水水质恶化[9-11]。当纳米颗粒与微生物长期接触,微生物群落结构和代谢功能也将做出相应响应[12]。对于粒径更小(2~10 nm)、更易进入细胞的含镉量子点(CdSe、CdTe/CdS、CdSe/ZnS)[13],其在污泥内富集的环境风险可能更为突出。目前,尽管研究人员已经在关注镉系QDs的生物毒性研究,但目标生物(细胞、细菌、斑马鱼和少数藻类)和实验条件较为单一[14-15],其在复杂系统中的毒理效应尚不明确,镉系QDs对污水处理厂处理效能的影响和作用机制仍未可知。因此,有必要明确镉系QDs对污水处理厂出水水质、污泥絮体物化特性以及微生物群落结构的影响,从而为QDs的安全应用和排放提供理论依据。
本研究通过评估污水处理效果、污泥絮凝沉淀性能、胞外聚合物(extracellular polymeric substances,EPS)物化特征,微生物群落结构及其代谢功能对CdSe QDs长期胁迫的响应,全面揭示CdSe QDs对活性污泥的毒性效应及其内在机制,将为QDs的环境行为研究及其暴露风险评估提供理论支撑。
-
采用水相合成法制备水溶性的CdSe QDs[16]。将硼氢化钠(NaHB4)和硒粉(Se)分散于除氧超纯水,得到硒氢化钠(NaHSe)溶液。将20 μL 巯基乙酸溶于2 mmol·L−1 50 mL氯化镉(CdCl2)后,用1 mol·L−1 氢氧化钠(NaOH)溶液调节pH至10,并用高纯氮气(N2,99.999%)鼓泡30 min。将制备得到的两种溶液于500 mL三颈烧瓶内混合,溶液在氮气环境下水浴加热4 h,得到CdSe QDs溶液。经反复洗脱和冷冻干燥处理,最终制备得到CdSe QDs粉末。利用高分辨透射电子显微镜(Tecnai G2 F20,美国FEI公司)和荧光分光光度计(FP 6 500,日本JASCO 公司)测定样品的表面形貌及其荧光特性。
-
本实验采用有效工作容积为5 L的序批式活性污泥反应器(sequencing batch reactor,SBR)。反应器由进气管、曝气泵、流量计和排水管组成。接种污泥取自西安市第4污水厂曝气池,进水采用人工配制的模拟污水[17],组分和质量浓度如下:80 mg·L−1醋酸钠(CH3COONa·3H2O)、26.32 mg·L−1磷酸二氢钾(NaH2PO4·2H2O)、150 mg·L−1葡萄糖(C6H12O6)、150 mg·L−1蛋白胨、114.6 mg·L−1氯化铵(NH4Cl)、444 mg·L−1碳酸氢钠(NaHCO3)、10.6 mg·L−1氯化钙(CaCl2)、180 mg·L−1硫酸镁(MgSO4·7H2O)以及0.38 mL·L−1微量元素溶液。运行周期包括:进水0.25 h,曝气10.5 h,沉淀1 h,排水0.25 h。 污水排放比为0.5,水力停留时间和污泥龄分别为24 h和30 d。培养过程溶解氧控制在4~6 mg·L−1,混合液悬浮固体质量浓度(mixed liquid suspended solids,MLSS)保持在3 000 mg·L−1左右,通过投加NaHCO3使pH维持在7~8的范围内。
-
待污泥驯化完成后,反应器连续运行120 d,以前30 d无CdSe QDs添加阶段作为对照组。CdSe QDs暴露条件连续运行90 d,运行期内每隔30 d增加进水CdSe QDs质量浓度,各阶段质量浓度分别为0、0.1、1和10 mg·L−1。实验阶段每3 d测定1次出水水质和污泥沉降性能,每个阶段结束前对单个反应周期水质变化进行连续监测。在反应器运行的第30、60和90天提取污泥样品进行后续傅里叶红外光谱(fourier transform infrared spectroscopy,FTIR)、EPS以及微生物种群结构和多样性分析。
-
出水水质(NO3−-N、NH4+-N、 NO2−-N、COD、PO43--P)、MLSS和污泥容积指数(sludge volume index,SVI)按照《水和废水监测分析方法》(第4版)中的标准方法进行测定[18]。出水浊度采用浊度仪(Model 2 100 AN)测定。利用傅里叶红外光谱仪(IRPrestige-21,Shimadzu)对活性污泥样品表面官能团进行定性分析,取污泥粉末样品与干燥的溴化钾粉末混合均匀,在压片机上压制成片测试,扫描范围 4 000~500 cm−1,分辨率0.8 cm−1,扫描速度2.5 kHz。EPS提取采用修改的热提法[19],具体步骤如下:将30 mL泥水混合液离心10 min (4 000 r·min−1),去掉上清液后加入0.05% NaCl至30 mL,重复上述步骤3次,然后将混合液水浴加热处理30 min (60 ℃),经离心和0.45 μm醋酸纤维素膜过滤后得到的上清液即为EPS。通过荧光分光光度计(FP 6 500,JASCO)测定其三维荧光光谱(three-dimensional excitation and emission matrix fluorescence,3DEEM),并通过对光谱不同区域积分对EPS进行区域荧光积分(fluorescence regional integration,FRI)分析。污泥DNA采用E.Z.N.A. ®Tissue DNA Kit (MoBio Laboratories,Carlsbad,CA) 试剂盒提取,DNA的质量检测、扩增、纯化和测序委托上海生工生物工程技术服务有限公司完成。选取引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增16S rRNA基因V3-V4区,通过Illumina Miseq高通量测序平台测定微生物16S rRNA基因,采用QIIME(1.8.0)软件进行数据分析。利用PICRUSt2软件进一步对16S rRNA高通量测序数据进行功能预测,基于KEGG数据库,得到微生物代谢途径及其预测丰度。该项目数据已上传至SRA数据库,项目号为PRJNA941489。
-
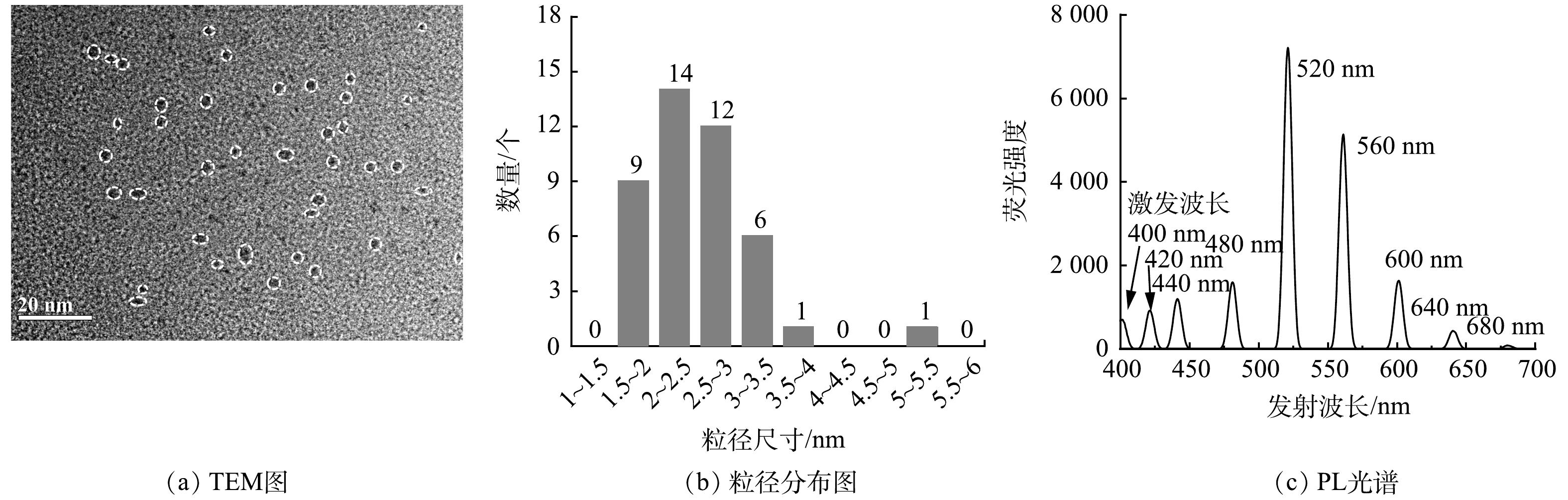
本研究制备的CdSe QDs的平均粒径为(2.54±0.7) nm (图1(a,b))并且其最大发射波长为521 nm (图1(c))。将不同质量浓度CdSe QDs投加到SBR中,其对反应器运行性能的影响如图2(a)所示。在CdSe QDs连续暴露90 d实验期间,反应器硝化作用相较于对照组几乎不受影响。NH4+-N去除率高达99%,几乎无 NO2−-N积累,NO3−-N质量浓度稳定在35 mg·L−1左右,表明硝化作用对CdSe QDs并不敏感。而石墨纳米颗粒却能通过抑制氨氧化细菌(Nitrosomonas)活性,进而影响NH4+-N的去除[20]。对比SBR运行期间的出水COD值,对照组出水COD值稳定在106 mg·L−1,而0.1 mg·L−1 CdSe QDs实验组可显著降低反应器中耗氧有机污染物的含量,出水COD值由127.1 mg·L−1降低至71.7 mg·L−1。这可能归因于微生物的毒性兴奋效应[21],微生物对耗氧有机污染物的降解量增加。然而,随着CdSe QDs暴露剂量的进一步增加,出水COD值整体呈现出上升趋势,最终达到124.7 mg·L−1。该现象表明过量的CdSe QDs会抑制活性污泥微生物对有机物的降解能力。
SBR单个反应周期的水质监测结果如图2(b)所示。CdSe QDs的存在加速了NH4+-N的降解,在1 mg·L−1 CdSe QDs胁迫下氨氧化速率由2.2 mg·(L∙h)−1增大到3.3 mg·(L∙h)−1。同时,添加CdSe QDs能够有效降低NO2−-N的累积质量浓度,在不同暴露剂量条件下NO2−-N几乎均未有积累。此外,反应过程NO3−-N生成速率也随CdSe QDs质量浓度的增加而增加。以上结果表明,CdSe QDs对硝化过程有明显的促进作用。通常,氧化反应消耗电子,而电子传递对参与硝化作用的酶活性有显著影响[22],利于电子转移的外源物质可以提高酶的活性[23]。因此,推测CdSe QDs对硝化作用的促进可能归因于其作为电子载体可加速电子传递过程。
-
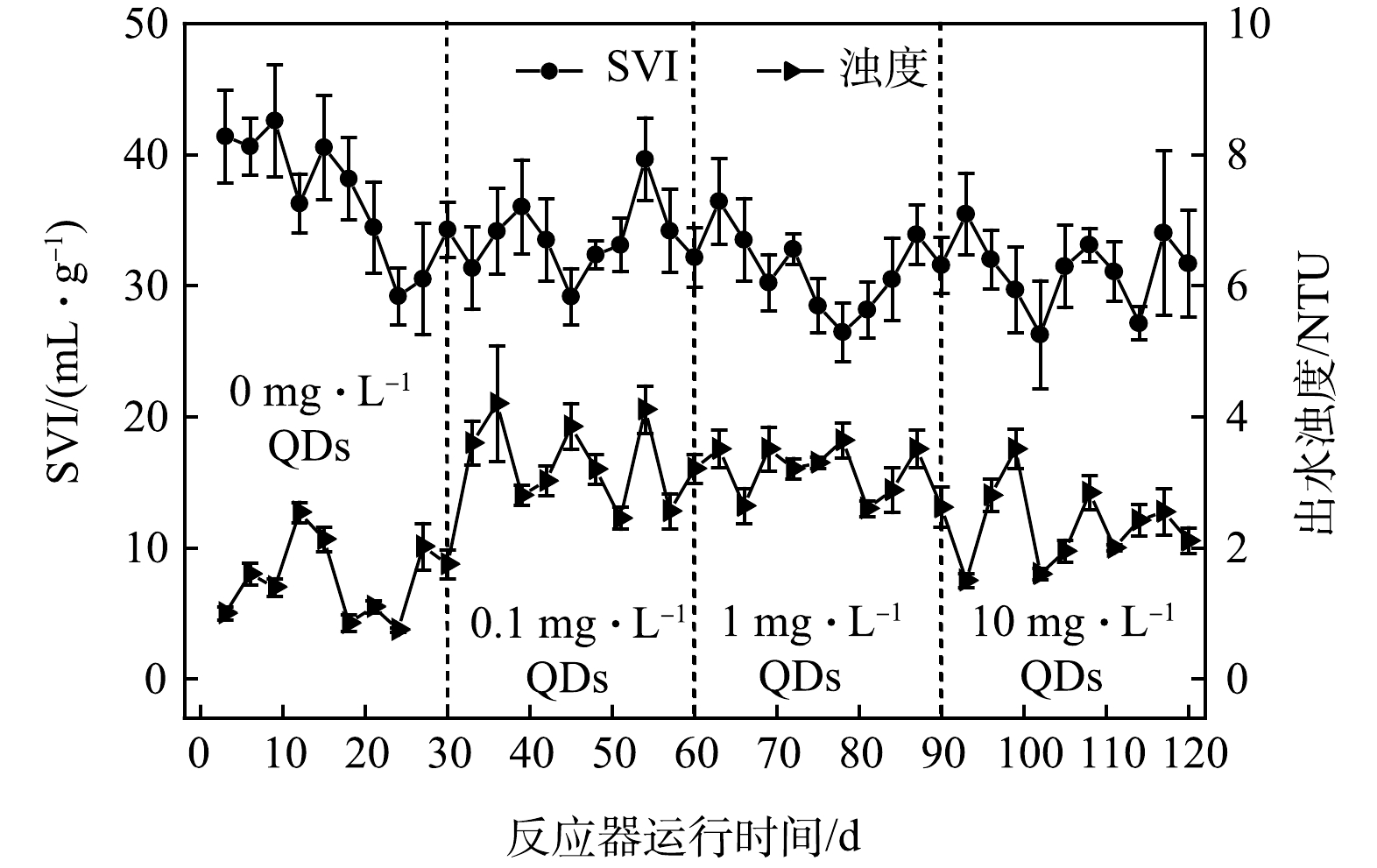
1)污泥絮凝性能对CdSe QDs的胁迫响应。CdSe QDs对污泥絮凝沉降性能的影响如图3所示。受不同质量浓度CdSe QDs(0、0.1、1和10 mg·L−1)胁迫,活性污泥的SVI分别稳定在36.8、33.6、31.2和31.2 mL·g−1左右。显然,CdSe QDs的存在不仅提高了污泥的沉降能力,而且使得污泥的SVI水平更为稳定。这可能是由于CdSe QDs粒径(2.54 nm)较小,极易通过污泥絮体网捕和物理化学吸附作用从水相转移至污泥中,增加污泥比重,提升污泥沉降能力[6-8]。该结论与纳米磁粉能够有效提升污泥沉降性能的结论一致[24]。此外,暴露于CdSe QDs条件的出水浊度稳定在2.92 NTU,高于对照组的平均浊度(1.51 NTU)。该现象可能是由于CdSe QDs在污泥表面大量聚集,影响了污泥对水中营养物质的吸收,以及由于自身生物毒性干扰了微生物代谢,导致污泥絮凝性能下降,出水浑浊。
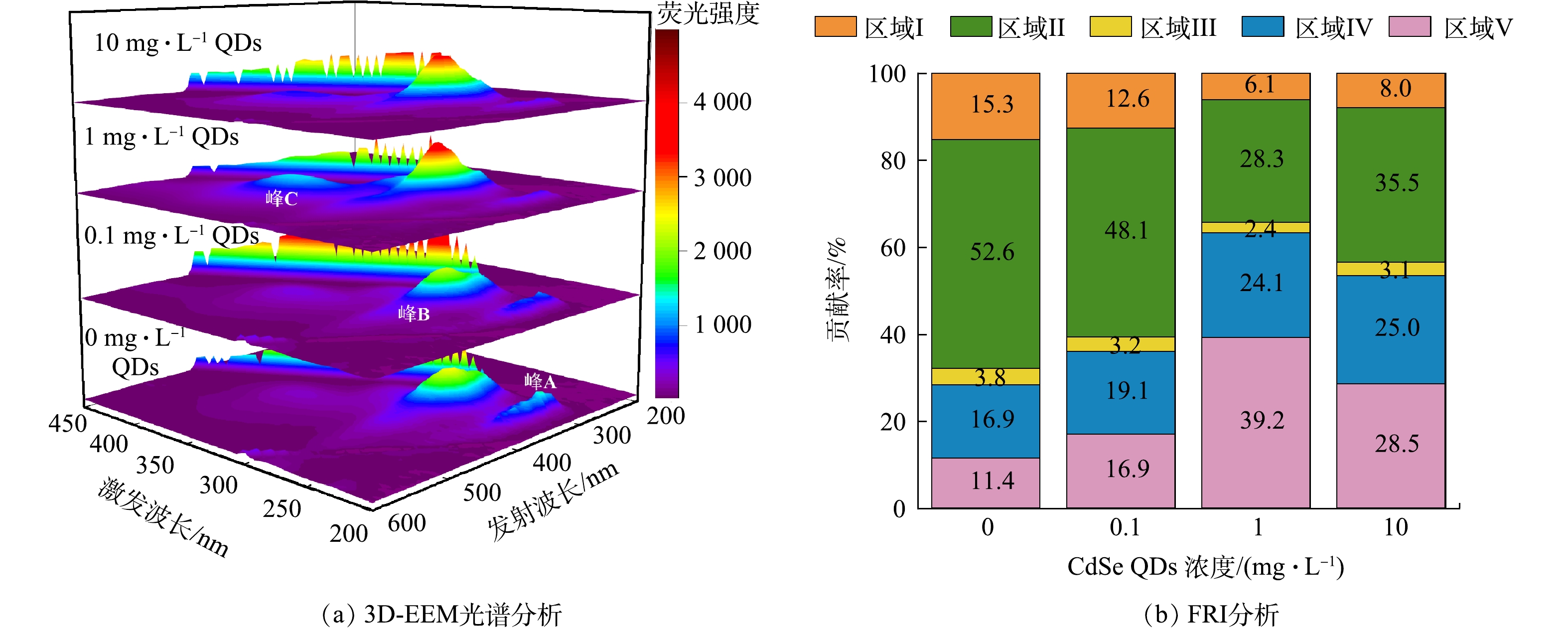
2)胞外聚合物对CdSe QDs的胁迫响应。不同剂量CdSe QDs暴露条件下EPS的3D-EEM图谱类似(图4),主要组分包括色氨酸类蛋白(峰B,Ex/Em=280~290 nm/330~365 nm),酪氨酸类蛋白(峰A,Ex/Em=225~235 nm/300~350 nm)和腐殖酸类物质(峰C,Ex/Em=340~370 nm/440~460 nm)。无CdSe QDs暴露条件下EPS中峰A和B的荧光强度分别为1 517和2 515。随着CdSe QDs累积质量浓度的增大,酪氨酸类蛋白物质的荧光峰强度逐渐下降。在1 mg·L−1和10 mg·L−1 CdSe QDs胁迫下,峰A几乎消失。该现象可能是因为酪氨酸类蛋白与CdSe QDs作用强烈,诱导发生荧光淬灭[25]。此外,CdSe QDs的存在会显著增加EPS中色氨酸类蛋白的含量,峰B的荧光强度也从2 515增至3 969。有研究表明, PN能够加速微生物聚集,减少与QDs的接触面积,从而缓解纳米毒性。ZHANG等[26]发现 Thalassiosira Pseudonana可以通过分泌大量PN缓解CdSe/ZnS QDs的毒性胁迫。因此,推测色氨酸类蛋白是污泥微生物缓解CdSe QDs刺激的主要作用物质。再者,随着CdSe QDs暴露质量浓度的增加,腐殖酸类物质的含量逐渐增加,最终导致峰C的出现。
FRI将三维荧光光谱构成的三维区域依照有机物的特性分为5个区域,包括区域Ⅰ:芳香蛋白类物质A(类酪氨酸Ex/Em: 220~250 nm/280~330 nm);区域Ⅱ:芳香蛋白类物质B(类色氨酸Ex/Em:220~250 nm/330~380 nm);区域Ⅲ:类富里酸类物质(Ex/Em:220~250 nm/380~550 nm);区域Ⅳ:微生物代谢产物(Ex/Em:250~400 nm/280~380 nm);区域Ⅴ:腐殖酸类物质(Ex/Em:250~400 nm/380~550 nm)[27]。如图4(b)所示,随着胁迫质量浓度增加,区域I类酪氨酸物质的占比由15.3%下降到8%,该现象与酪氨酸蛋白所代表的峰A荧光强度下降结果一致。此外,色氨酸类物质在EPS中的贡献率最高,分别为52.6%、48.1%、28.3%和35.5%。对于EPS中的富里酸类物质,其含量几乎不受CdSe QDs的影响。相较于对照组,CdSe QDs暴露下区域Ⅳ微生物代谢产物的占比均有所增加,最终上升到25%。此外,V区代表的腐殖酸类物质含量的变化规律也与图4(a)中峰C荧光强度的变化规律一致,在高质量浓度CdSe QDs暴露剂量条件大量累积。
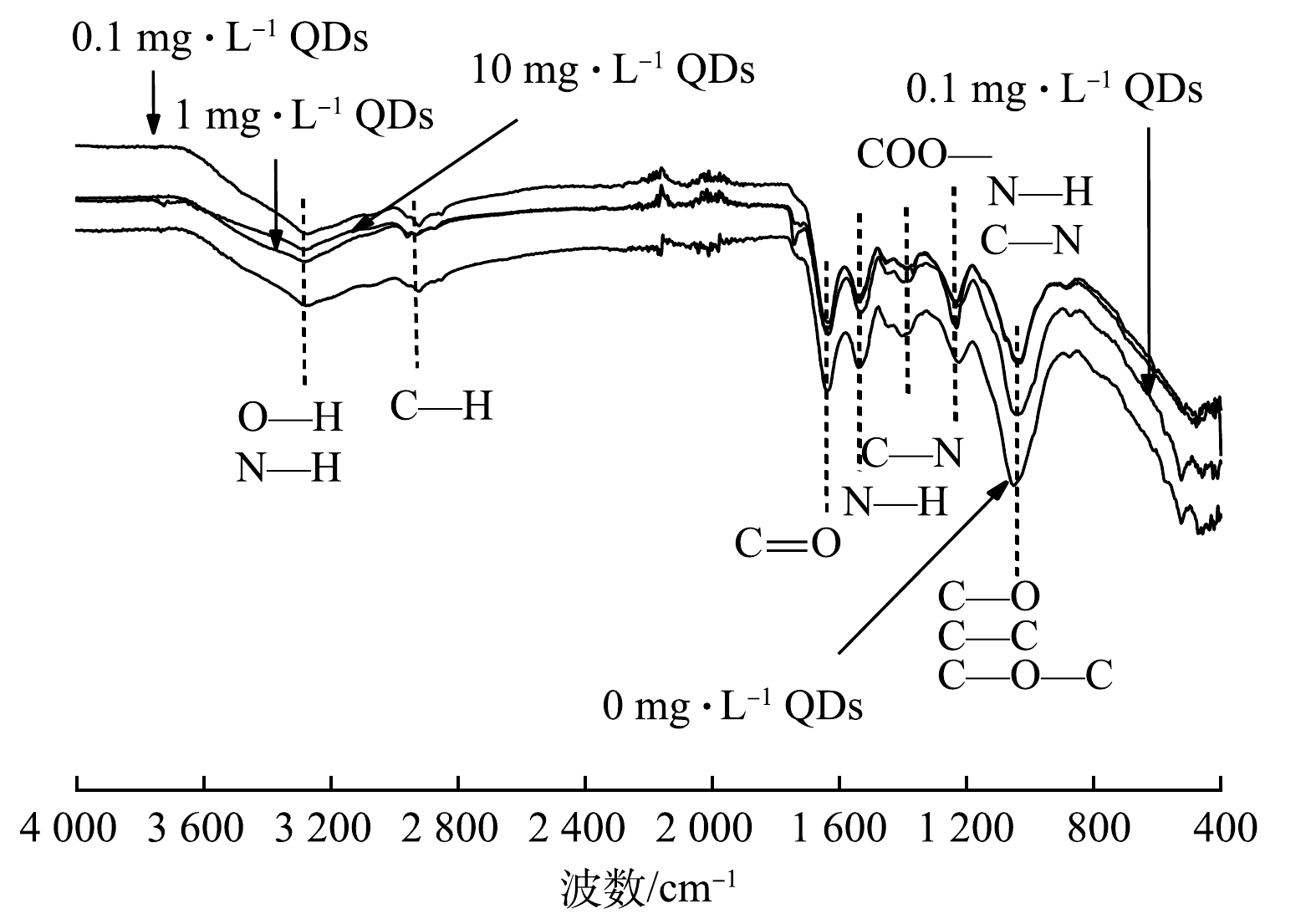
3)污泥FTIR分析。不同CdSe QDs胁迫质量浓度下活性污泥的红外光谱如图5所示。显然,红外光谱吸收峰所在的位置基本相同,说明CdSe QDs的胁迫只会影响活性污泥表面化学基团的数量,而不会改变其化学组成。3 292 cm−1处存在蛋白质和多糖O—H和N—H振动形成的宽峰[28]。2 930 cm−1处存在脂肪族 C—H 伸缩振动吸收[28]。1 638 cm−1和1 544 cm−1处为蛋白质酰胺类化合物C=O、C—N和N—H的伸缩振动[29-30]。1 403 cm−1存在羧基中C—O和 C=O的振动吸收[30]。1 229 cm−1附近的吸收峰是蛋白质中酰胺Ⅲ中N—H、C—N的伸缩振动峰[30]。1 040 cm−1处出现的吸收峰被认为是多糖的C—O—C、C—O和C—C的对称收缩振动[31]。小于1 000 cm−1的吸收峰是磷酸基团的伸缩振动[31]。
CdSe QDs会与特定物质发生相互作用,仅0.1 mg·L−1的CdSe QDs就能显著减弱各个化学基团的振幅。而1 mg·L−1和10 mg·L−1的胁迫质量浓度对化学基团的影响差异并不明显。此外,1 641 cm−1(蛋白质的酰胺Ⅰ)处峰值振动强度的降低进一步证明酪氨酸类蛋白含量的下降可能与脱酰胺作用有关[32]。同时,1 110 cm−1和420~470 cm−1峰带的伸缩振动强度也随CdSe QDs剂量的增加呈现规律性的减弱,推测CdSe QDs在活性污泥表面的主要结合位点是C—O—C、C—O、C—C和磷酸基团。
-
1)物种多样性和丰富度变化。为明确CdSe QDs对活性污泥微生物丰富度和多样性的影响,本研究对不同运行阶段的污泥样本进行Alpha分析。表1结果显示,文库的覆盖率均在99%以上,代表大部分的样本序列都被测出,并且测序结果能较好反映出活性污泥微生物的真实状况。本研究通过Chao1和ACE指数表征丰富度,通过Shannon指数表征多样性。显然,随着CdSe QDs质量浓度的增大,测序分析得到的OTUs和序列数均骤减,证明具有较强的CdSe QDs生物毒性。此外,Chao1、ACE和Shannon指数均因CdSe QDs的投加而减小,说明暴露于CdSe QDs活性污泥的物种丰富度和多样性均会降低。
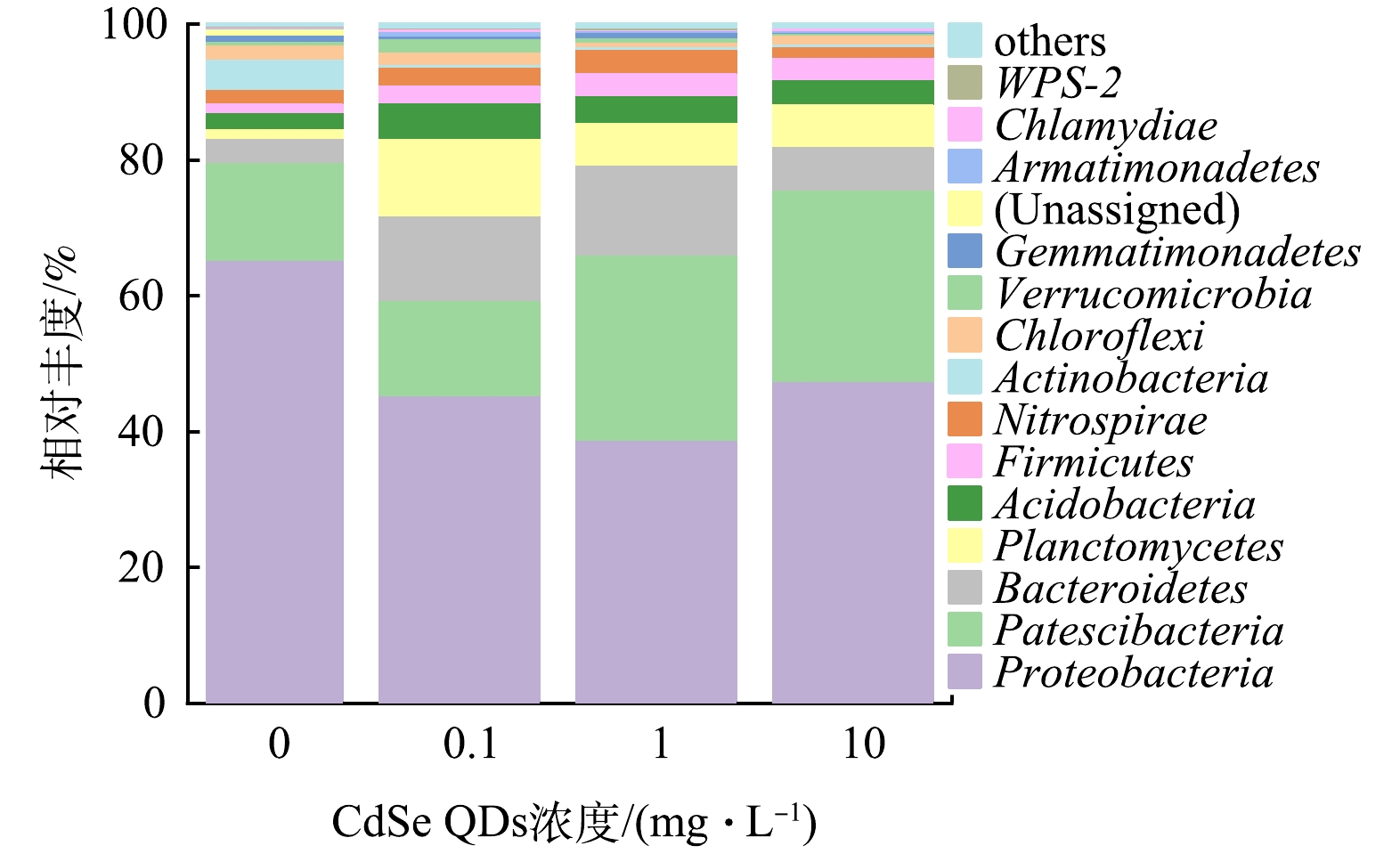
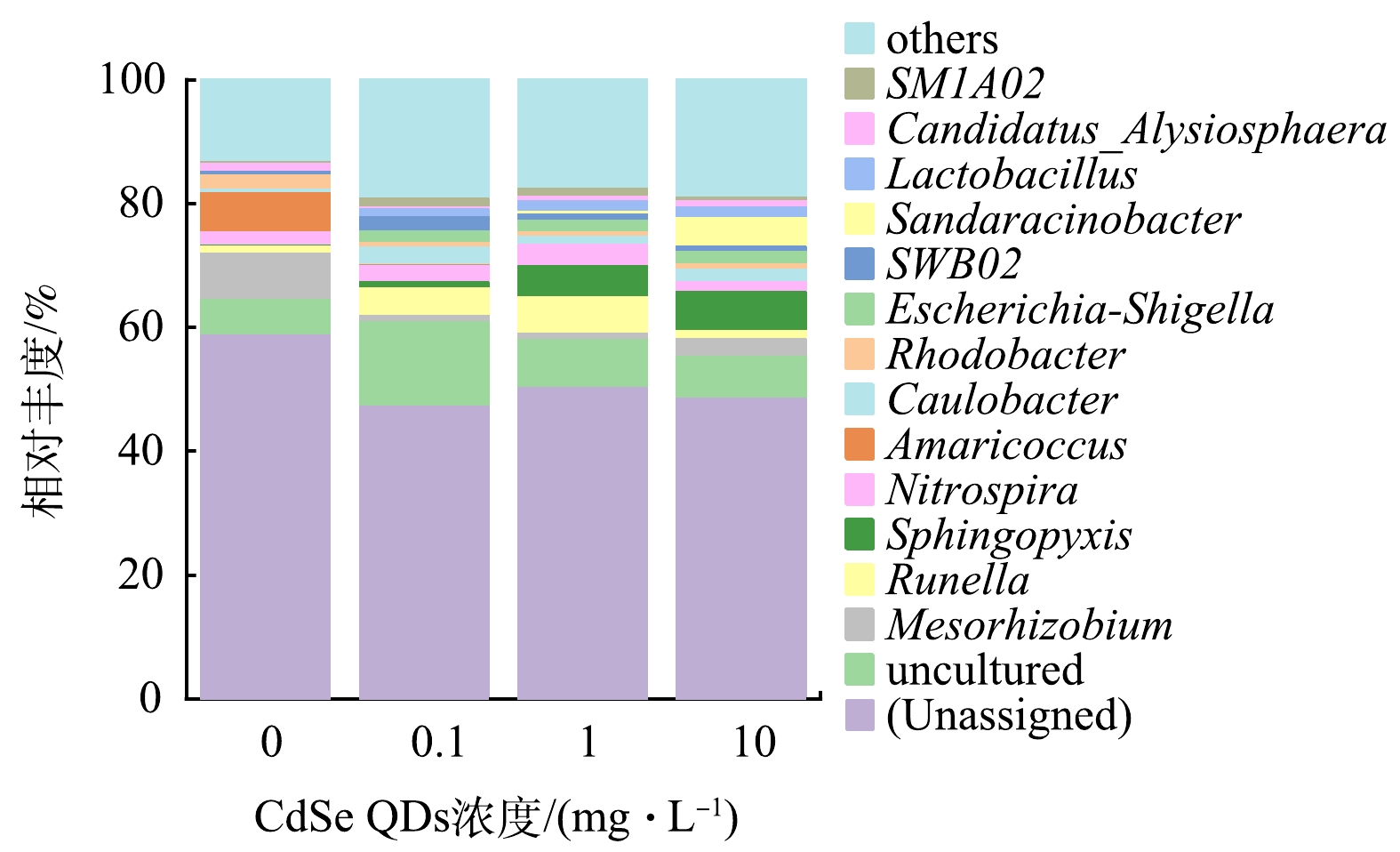
2)活性污泥种群结构的响应。不同CdSe QDs胁迫质量浓度下的活性污泥微生物群落门水平组成差异如图6所示。结果显示,变形菌门(Proteobacteria)是最主要的优势菌群,4种胁迫质量浓度下相对丰度达到65.4%、45.4%、38.8%以及47.5%。Proteobacteria广泛存在于活性污泥系统中,该门下的菌属对脱氮除磷效果有重要影响[33]。超级门(Patescibacteria)随着CdSe QDs暴露质量浓度的增大,其群落占比逐渐增大,分别为14.4%、14%、27.3%和28.2%。此外,其他优势菌群还包括拟杆菌门(Bacteroidetes:3.6%、12.5%、13.3%、6.5%)、浮霉菌门(Planctomycetes:1.4%、11.4%、6.3%、6.3%)、放线菌门(Actinobacteria:2.4%、5.2%、3.9%、3.6%)和厚壁菌门(Firmicute:1.4%、2.6%、3.4%、3.3%)。上述6类门微生物占总菌门的比例高达95%。硝化螺旋菌门(Nitrospirae)在活性污泥中的含量较小,仅为2%、2.6%、3.4%、1.5%,30 mg·L−1 CdSe QDs对其丰度表现出一定的胁迫影响。
在属水平上微生物群落差异更为明显(图7)。暴露于CdSe QDs的活性污泥中,微生物优势菌主要包括中慢生根瘤菌属(Mesorhizobium:7.5%、1.1%、0.9%、2.9%)、下水道球菌属(Amaricoccus:6.5%、0.1%、0、0)、红杆菌属(Rhodobacter:2.4%、0.8%、0.8%、0.9%)、硝化螺旋菌属(Nitrospira:2%、2.6%、3.4%、1.5%)、古字状菌属(Runella:1.2%、4.5%、5.9%、1.3%)和鞘氨醇盒菌属菌(Sphingopyxis:0.1%、0.9%、4.9%、6.3%)等。显然,除了Runella 和Sphingopyxis,大部分微生物都受到CdSe QDs的抑制。Sphingopyxis和Runella被认为具有较强的环境适应性[34-35],Sphingopyxis能够生物转化重金属并能降解多种生物毒性物质[34],Runella对100 mg·L−1聚氯乙烯以及聚苯乙烯纳米颗粒也表现出较强抗性[35],两者在本研究中对CdSe QDs同样表现出较强的耐受性。此外,Amaricoccus 属于Proteobacteria,与有机物降解有关[36]。该菌属丰度的下降也解释了反应器出水COD值逐渐增大的现象。Nitrospira属于Nitrospirae,该菌属的微生物可参与亚硝酸盐的氧化[37]。同样,10 mg·L−1 CdSe QDs对Nitrospira的抑制作用较为明显,这也解释了SBR运行后期(90~120 d)硝化速率减慢的现象。
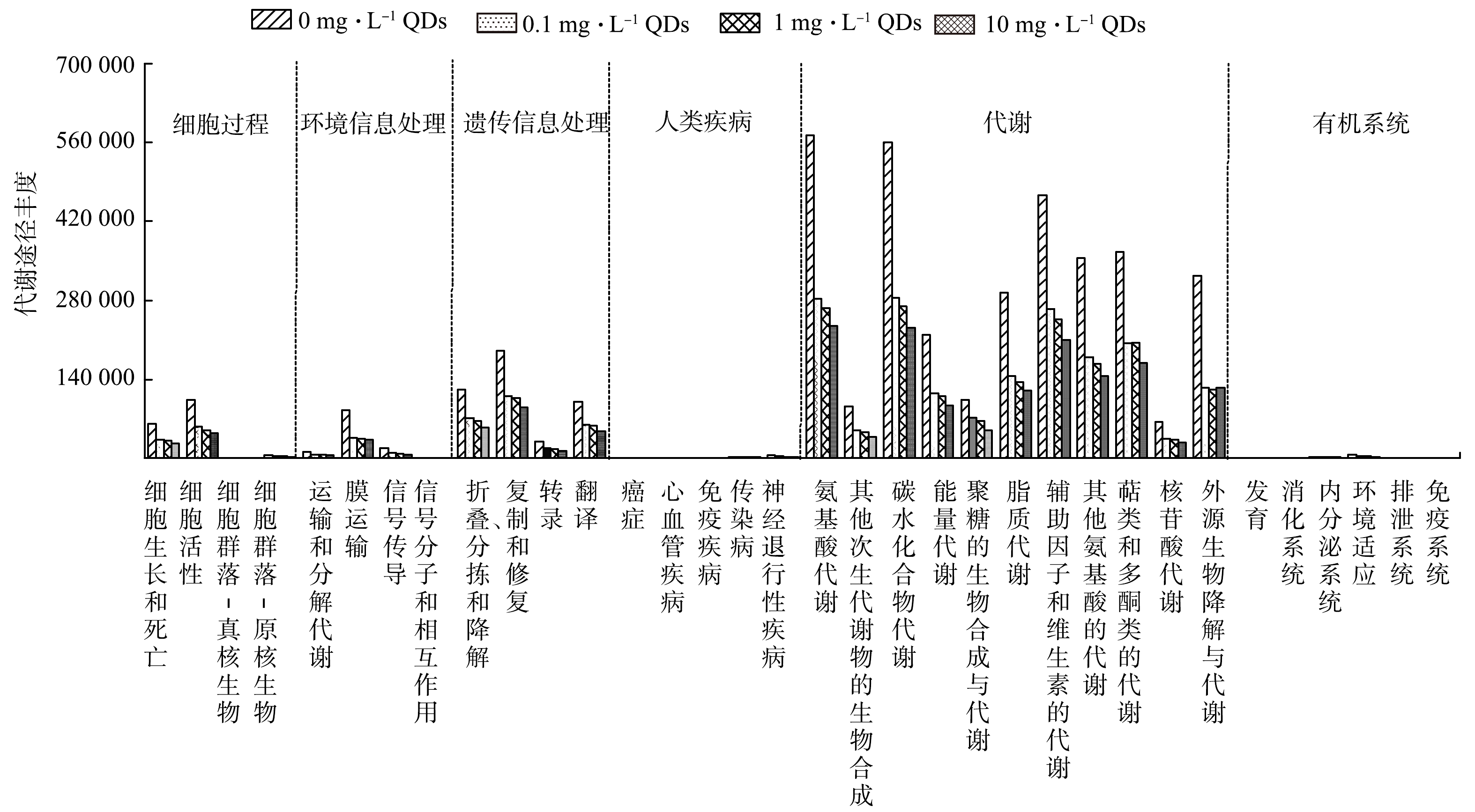
3)微生物代谢通路的响应。PICRUSt将暴露于CdSe QDs微生物的16S rRNA基因序列在KEGG数据库进行预测,最终得到微生物代谢通路的预测结果。如图8所示,活性污泥中微生物的1级功能层主要包括细胞过程、环境信息处理、遗传信息处理、人类疾病和新陈代谢。显然,基因代谢通路丰度最大的是新陈代谢,该功能区与微生物的生存和生长密切相关[38]。CdSe QDs显著降低了该功能层下的11个子功能基因代谢丰度,而这些子功能直接决定污染物的去除效果,导致高质量浓度CdSe QDs条件微生物降解有机物能力变差。此外,环境信息处理功能层下的膜传输的丰度从 85 944降至32 552,并伴随着信号传导丰度由18 563降至7 876。该现象可能归因于CdSe QDs进入细胞并造成细胞膜破裂[39],最终影响活性污泥微生物之间的物质交流和信息传递。以上结果表明 CdSe QDs长期暴露对微生物代谢功能的胁迫作用显著,进而影响活性污泥活性及其聚集性能。
-
1) CdSe QDs的长期暴露对活性污泥系统运行效能影响较小,整个运行期间硝化运行效果稳定,且CdSe QDs的存在可加速NH4+-N和NO2−-N的转化速率,但在高浓度胁迫条件下有机物降解和生物絮凝性能均受到一定程度的抑制作用。
2)当CdSe QDs与活性污泥表面的吸附位点(C—O—C、C—O、C—C和磷酸基团)结合后,会导致蛋白质的酰胺基团减少,造成酪氨酸类蛋白荧光淬灭。同时, EPS中色氨酸类蛋白荧光强度大大增加。
3) CdSe QDs进入细胞后,会进一步干扰污泥微生物的代谢途径,包括氨基酸、碳水化合物、脂质及核苷酸的代谢。同时,与环境信息处理和遗传信息处理相关代谢也受到明显抑制,表明CdSe QDs长期暴露会引起细胞膜破裂并损伤DNA,降低微生物的活性及对有机污染物的去除能力。
活性污泥对硒化镉量子点暴露的胁迫响应机制
The stress response mechanisms of activated sludge exposed to CdSe quantum dots
-
摘要: 为揭示硒化镉(CdSe)量子点(quantum dots, QDs)在复杂环境体系中的生物毒性效应,本研究以活性污泥为研究对象,探讨了CdSe QDs(0.1~10 mg·L−1)长期暴露对序批式活性污泥反应器运行效能、污泥性能以及微生物代谢作用的影响。结果表明,在实验质量浓度范围内,出水COD值和硝酸盐波动较大,而硝化作用影响较小,且低剂量CdSe QDs的存在加速了NH4+-N的降解,1 mg·L−1 CdSe QDs将平均氨氧化速率由2.2 mg·(L∙h)−1提高到3.3 mg·(L∙h)−1。尽管CdSe QDs会引起出水浊度略微增加,但污泥沉降性能始终维持稳定。CdSe QDs主要与污泥表面的C—O—C、C—O、C—C和磷酸基团结合,诱导胞外聚合物的酪氨酸类蛋白荧光淬灭。同时,微生物会通过分泌色氨酸类蛋白以缓解胁迫影响。此外,活性污泥的物种丰富度和多样性均受CdSe QDs的抑制,但低质量浓度CdSe QDs有利于Nitrospirae相对丰度的增加。PICRUSt2预测显示,微生物的新陈代谢和遗传信息处理相关的代谢通路均受到CdSe QDs的显著抑制,膜传输和信号传导的代谢通路丰度最终分别下降至32 552和7 876,导致反应器出水COD值随暴露剂量的增加而逐渐增大。因此,CdSe QDs通过改变微生物群落结构和功能影响活性污泥有机物的去除效果,但对硝化反应及污泥絮凝和沉淀性能并未表现出明显负面效果。Abstract: In order to reveal the biotoxicity of CdSe quantum dots (QDs) in complex environmental systems, activated sludge was taken as the research object to study the effects of long-term exposure to CdSe QDs (0.1~10 mg·L−1) on the operation efficiency, sludge performance and microbial metabolism in sequencing batch reactor (SBR). The results showed that COD and nitrate concentrations in effluent fluctuated greatly under the stress of CdSe QDs (0.1~10 mg·L−1), but nitrification performance was stable. Low dosed CdSe QDs accelerated degradation of NH4+-N, and 1 mg·L−1 CdSe QDs could increase average oxidation rate of NH4+-N from 2.2 to 3.3 mg·(L∙h)−1. Although CdSe QDs caused a slight increase in effluent turbidity, the sludge sedimentation maintained stable. CdSe QDs mainly bound to C—O—C, C—O, C—C and phosphate group on sludge surface, and caused the fluorescence quenching of tyrosine-like protein in extracellular polymeric substance. Meanwhile, microorganisms also secreted tryptophan-like proteins to alleviate stress. Besides, both abundance and diversity of microbes in activated sludge were inhibited by CdSe QDs, but low level CdSe QDs were conducive to abundance of Nitrospirae. The results predicted by PICRUSt found that the metabolic pathway for metabolism and genetic information processing was significantly inhibited by CdSe QDs, and the abundances of the metabolic pathway for membrane transport and signal transduction finally decreased to 32 552 and to 7 876, respectively. That might be the reason for the increase in effluent COD with the rise of exposure dosage. Therefore, CdSe QDs affected the organic matter removal by changing the structure and function of microbial community in activated sludge, but showed no obvious negative effects on nitrification, sludge settling and flocculation.
-
表 1 CdSe QDs胁迫下活性污泥微生物群落多样性指数
Table 1. Alpha diversity indexes of activated sludge exposed to CdSe QDs
CdSe QDs质量浓度/( mg·L−1) 序列数 OTUs Shannon Chao 1 ACE 覆盖率/% 0 65 288 1 720 7.07 1 720.0 1 739.5 99.9 0.1 43 101 881 7.46 882.1 951.3 99.7 1 40 025 805 6.74 805.9 881.3 99.7 10 32 356 700 6.69 701.1 801.7 99.6 -
[1] CAI Q Q, WU D, LI H K, et al. Versatile photoelectrochemical and electrochemiluminescence biosensor based on 3D CdSe QDs-DNA nanonetwork-SnO2 nanoflower coupled with DNA walker amplification for HIV detection[J]. Biosensors and Bioelectronics, 2021, 191: 113455. doi: 10.1016/j.bios.2021.113455 [2] ZHAO Z J, LIU Z L, ZHU Z X, et al. Ultrathin zinc selenide nanosheet-based intercalation hybrid coupled with CdSe quantum dots showing enhanced photocatalytic CO2 reduction[J]. Chinese Chemical Letters, 2021, 32(8): 2474-2478. doi: 10.1016/j.cclet.2021.01.004 [3] LIAN F, WANG C G, WANG C X, et al. Variety-dependent responses of rice plants with differential cadmium accumulating capacity to cadmium telluride quantum dots (CdTe QDs): Cadmium uptake, antioxidative enzyme activity, and gene expression[J]. Science of the Total Environment, 2019, 697: 134083. doi: 10.1016/j.scitotenv.2019.134083 [4] YU Z, HAO R, ZHANG L, et al. Effects of TiO2, SiO2, Ag and CdTe/CdS quantum dots nanoparticles on toxicity of cadmium towards Chlamydomonas reinhardtii[J]. Ecotoxicology and Environmental Safety, 2018, 156: 75-86. doi: 10.1016/j.ecoenv.2018.03.007 [5] LIU F, HU X M, ZHAO X, et al. Rapid nitrification process upgrade coupled with succession of the microbial community in a full-scale municipal wastewater treatment plant (WWTP)[J]. Bioresource Technology, 2018, 249: 1062-1065. doi: 10.1016/j.biortech.2017.10.076 [6] BRAR S K, VERMA M, TYAGI R D, et al. Engineered nanoparticles in wastewater and wastewater sludge-evidence and impacts[J]. Waste Management, 2010, 30(3): 504-520. doi: 10.1016/j.wasman.2009.10.012 [7] LI H X, XU S S, WANG S, et al. New insight into the effect of short-term exposure to polystyrene nanoparticles on activated sludge performance[J]. Journal of Water Process Engineering, 2020, 38:101559. [8] WEI L L, DING J, XUE M, et al. Adsorption mechanism of ZnO and CuO nanoparticles on two typical sludge EPS: Effect of nanoparticle diameter and fractional EPS polarity on binding[J]. Chemosphere, 2019, 214: 210-219. doi: 10.1016/j.chemosphere.2018.09.093 [9] 马娇, 曾天续, 宋珺, 等. 纳米单质铁对厌氧氨氧化脱氮性能的影响[J]. 中国环境科学, 2022, 42(6): 2619-2627. [10] 王树涛, 李素萍, 王未青, 等. ZnO纳米颗粒对SBR活性污泥活性的影响[J]. 中国环境科学, 2014, 34(10): 2575-2580. [11] 高静湉, 胡鹏, 蔡怡婷, 等. 纳米ZnO胁迫下SBBR污染物去除性能及微生物群落响应[J]. 中国环境科学, 2022, 42(8): 1-8. [12] YANG Y, QUENSEN J, MATHIEU J, et al. Pyrosequencing reveals higher impact of silver nanoparticles than Ag+ on the microbial community structure of activated sludge[J]. Water Research, 2014, 48: 317-325. doi: 10.1016/j.watres.2013.09.046 [13] HU L, ZHONG H, HE Z G. Toxicity evaluation of cadmium-containing quantum dots: A review of optimizing physicochemical properties to diminish toxicity[J]. Colloids and Surfaces B:Biointerfaces, 2021, 200: 111609. doi: 10.1016/j.colsurfb.2021.111609 [14] LU T, ZHANG Q, ZHANG Z Y, et al. Pollutant toxicology with respect to microalgae and cyanobacteria[J]. Journal of Environmental Sciences, 2021, 99: 175-186. doi: 10.1016/j.jes.2020.06.033 [15] ZHENG N Y, YAN J H, QIAN W, et al. Comparison of developmental toxicity of different surface modified CdSe/ZnS QDs in zebrafish embryos[J]. Journal of Environmental Sciences, 2021, 100: 240-249. doi: 10.1016/j.jes.2020.07.019 [16] YANG Y, YUAN Z, LIU X P, et al. Electrochemical biosensor for Ni2+ detection based on a DNAzyme-CdSe nanocomposite[J]. Biosensors and Bioelectronics, 2016, 77: 13-18. doi: 10.1016/j.bios.2015.09.014 [17] 曾湘梅, 李咏梅, 赵俊明. SBR工艺去除模拟城市污水中双酚A的研究[J]. 环境污染与防治, 2008, 30(10): 23-27. [18] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. [19] YIN C Q, MENG F G, CHEN G H. Spectroscopic characterization of extracellular polymeric substances from a mixed culture dominated by ammonia-oxidizing bacteria[J]. Water Research, 2015, 68: 740-749. doi: 10.1016/j.watres.2014.10.046 [20] DONG Q, LIU Y C, SHI H C, et al. Effects of graphite nanoparticles on nitrification in an activated sludge system[J]. Chemosphere, 2017, 182: 231-237. doi: 10.1016/j.chemosphere.2017.04.144 [21] GUO L K, YANG L, Ren Y X, et al. The response and anti-stress mechanisms of nitrifying sludge under long-term exposure to CdSe quantum dots[J]. Journal of Environmental Sciences, 2024, 135: 174-184. doi: 10.1016/j.jes.2022.11.016 [22] WANG C, LIU S Q, HOU J, et al. Effects of silver nanoparticles on coupled nitrification-denitrification in suspended sediments[J]. Journal of Hazardous Materials, 2020, 389: 122130. doi: 10.1016/j.jhazmat.2020.122130 [23] ZHANG H M, CAO J, TANG B P, et al. Effect of TiO2 nanoparticles on the structure and activity of catalase[J]. Chemico-Biological Interactions, 2014, 219: 168-174. doi: 10.1016/j.cbi.2014.06.005 [24] 高丽英, 汤兵, 梁玲燕, 等. 纳米磁粉协同解偶联剂作用下活性污泥性能的研究[J]. 环境科学, 2012, 33(8): 2766-2772. [25] ZHAO J F, LIU S X, LIU N, et al. Accelerated productions and physicochemical characterizations of different extracellular polymeric substances from Chlorella vulgaris with nano-ZnO[J]. Science of the Total Environment, 2019, 658: 582-589. doi: 10.1016/j.scitotenv.2018.12.019 [26] ZHANG S J, JIANG Y L, CHEN C S, et al. Ameliorating effects of extracellular polymeric substances excreted by Thalassiosira pseudonana on algal toxicity of CdSe quantum dots[J]. Aquatic Toxicology, 2013, 126: 214-223. doi: 10.1016/j.aquatox.2012.11.012 [27] 袁乙卜, 张建民, 陈希, 等. 大分子有机物作用下胞外聚合物对除磷污泥颗粒化的影响[J]. 环境工程学报, 2021, 15(4): 1321-1332. [28] 王远红, 张红波, 罗世田, 等. 胞外聚合物对水中Cd(Ⅱ)的吸附性能研究[J]. 环境工程学报, 2010, 4(10): 2185-2189. [29] 张国威, 黄建, 崔浩, 等. 活性污泥对Pb(Ⅱ)的吸附机理[J]. 环境工程学报, 2016, 10(7): 3707-3714. [30] ZHENG S M, ZHOU Q X, CHEN C H, et al. Role of extracellular polymeric substances on the behavior and toxicity of silver nanoparticles and ions to green algae Chlorella vulgaris[J]. Science of the Total Environment, 2019, 660: 1182-1190. doi: 10.1016/j.scitotenv.2019.01.067 [31] HAN F, WEI D, NGO H H, et al. Performance, microbial community and fluorescent characteristic of microbial products in a solid-phase denitrification biofilm reactor for WWTP effluent treatment[J]. Journal of Environmental Management, 2018, 227: 375-385. [32] WANG X L, ZHANG L, PENG Y Z, et al. Enhancing the digestion of waste activated sludge through nitrite addition: insight on mechanism through profiles of extracellular polymeric substances (EPS) and microbial communities[J]. Journal of Hazardous Materials, 2019, 369: 164-170. doi: 10.1016/j.jhazmat.2019.02.023 [33] 陈鑫童, 郝庆菊, 熊艳芳, 等. 铁矿石和生物炭添加对潜流人工湿地污水处理效果和温室气体排放及微生物群落的影响[J]. 环境科学, 2022, 43(3): 1492-1499. [34] SHARMA M, KHURANA H, SINGH D N, et al. The genus Sphingopyxis: Systematics, ecology, and bioremediation potential - A review[J]. Journal of Environmental Management, 2021, 280: 111744. doi: 10.1016/j.jenvman.2020.111744 [35] WANG Z Q, GAO J F, DAI H H, et al. Microplastics affect the ammonia oxidation performance of aerobic granular sludge and enrich the intracellular and extracellular antibiotic resistance genes[J]. Journal of Hazardous Materials, 2021, 409: 124981. doi: 10.1016/j.jhazmat.2020.124981 [36] WANG Q, ZHOU G Y, QIN Y X, et al. Sulfate removal performance and co-occurrence patterns of microbial community in constructed wetlands treating saline wastewater[J]. Journal of Water Process Engineering, 2021, 43: 102266. doi: 10.1016/j.jwpe.2021.102266 [37] MANNACHARAJU M, SOMASUNDARAM S, GANESAN S. Treatment of refractory organics in secondary biological treated post tanning wastewater using bacterial cell immobilized fluidized reactor[J]. Journal of Water Process Engineering, 2021, 43: 102213. doi: 10.1016/j.jwpe.2021.102213 [38] 张雪, 乔雪姣, 苏佳, 等. 垃圾渗滤液处理厂活性污泥微生物种群结构和功能分析[J]. 北京大学学报(自然科学版), 2021, 57(5): 927-937. [39] LIU N, TANG M. Toxicity of different types of quantum dots to mammalian cells in vitro: An update review[J]. Journal of Hazardous Materials, 2020, 399: 122606. doi: 10.1016/j.jhazmat.2020.122606 期刊类型引用(1)
1. 陈颖,王新雨,徐秀丽,蔡璐,郑国砥,王侃. 添加复合酶对污泥生物干化有机质降解及产热的影响研究. 宁波大学学报(理工版). 2024(03): 88-95 .  百度学术
百度学术
其他类型引用(0)
-






 下载:
下载: