-
磷在生态系统中起着重要作用,是生物生长的重要元素之一[1],但也是水体污染的主要控制指标之一,其被认为是导致湖泊和水库富营养化的关键因素[2]。水体中高浓度的磷含量会导致水生植物疯长,从而消耗水体中的溶解氧,导致水质恶化,水生生物死亡。从废水中吸附和回收磷是解决磷污染和磷短缺的重要思路。在众多除磷方法中,吸附法由于其高效、环保、方便、价格低廉等优势而受到广泛关注。生物炭具有丰富的孔隙率和高比表面积,并且表面含有丰富的官能团[3],将其作为吸附剂吸附污水中的磷成为当下的研究热点。
随着我国城市化进程的推进,污水处理厂市政污泥产量急剧上升[4]。市政污泥作为污水处理过程中产生的一种半固体副产物[5],存在土地占用、二恶英和温室气体排放等问题[6],制约着我国生态环境建设。污泥资源化成为当下亟待解决的问题,污泥热解制备生物炭成为实现污泥资源化的一个突破口。然而,由于污泥中碳(C)含量较低,与纤维素或木质素为原料的生物炭相比,污泥生物炭存在比表面积低、孔隙结构差以及重金属含量高等问题,这都会限制污泥生物炭的实际应用[7]。酒糟作为酿酒过程中的固体废物,产量大,有机质含量高,处理成本高,如果没能得到适当的处理,很容易腐烂[8],造成资源浪费。所以酒糟作为碳源与污泥共热解制备生物炭不仅提高了生物炭的比表面积和孔隙结构,还能固定污泥中重金属,降低重金属释放风险。
镧(La)基化合物与磷酸盐具有高度亲和力[9],在磷吸附方面引起越来越多的关注。目前的La载体有生物炭[10]、多孔沸石[11]、碳纳米管[12]等材料。但生物炭表面通常带有负电荷,导致其对阴离子的吸附能力较差[13],通过负载La到生物炭表面以减少表面负电荷,降低生物炭与磷酸盐之间的排斥力,提高生物炭对磷的吸附效果。LIAO[14]等制备了La(OH)3改性菠萝生物炭,磷吸附量达到101.16 mg·g−1,相比于未负载La的生物炭提升近27倍。WANG等将La负载到橡木锯末生物炭上,负载La前后磷吸附量由10.33 mg·g−1提高到46.52 mg·g−1,提高近4.5倍。因此,本研究通过共沉淀法,以酒糟污泥生物炭为载体,将对磷具有高亲和度的La负载到生物炭表面,实现高磷酸盐吸附能力和高回收率,并探究镧改性酒糟污泥生物炭的吸附过程和吸附机理。
-
实验用市政污泥取自昆明主城污泥处理处置厂(含水率约为80%),置于烘箱110 ℃烘干;玉米酒糟取自昆明市某酿酒厂,超纯水洗净后在室外风干7 d,置于烘箱110 ℃烘干。均研磨后过100目筛网,保存在密封袋中。
实验用磷酸二氢钾(KH2PO4)、氯化锌(ZnCl2)、氢氧化钠(NaOH)和盐酸(HCl)购自天津福晨化学试剂有限公司,LaCl3·7H2O购自上海麦克林生化科技有限公司。所有试剂纯度均为分析纯,实验用水为超纯水。
-
由于污泥单独热解无法获得丰富的孔隙结构,因此,在污泥中加入一定比例的酒糟作为生物质,采用ZnCl2作为活化剂进行活化。将污泥与酒糟按照质量比7:3混合后作为原材料,原材料与ZnCl2(2 mol·L−1)按固液比1:3(g:mL)混合搅拌24 h,搅拌结束后置于烘箱中以110 ℃烘12 h。将一定量烘干材料放入坩埚加盖密封,于马弗炉内升温至450 ℃(升温速率为15 ℃·min−1)保温1.5 h,自然冷却至室温后取出,用0.1 mol·L−1 HCl溶液浸泡0.5 h,然后用超纯水洗至pH接近中性,烘干研磨制得酒糟污泥生物炭(LBCZ)。
-
将1 g LBCZ加入50 mL改性剂(La(OH)3·7H2O浓度为0.1 mol·L−1)中,在40 ℃下搅拌30 min后滴加15 mL NaOH(1 mol·L−1)溶液,继续搅拌1 h,搅拌结束后置于60 ℃烘箱中老化24 h。老化完成后用超纯水洗至pH接近中性,烘干制得镧改性酒糟污泥生物炭(La-LBCZ)。
-
1)影响因素实验。通过控制改性剂浓度、La-LBCZ投加量、溶液初始pH和共存离子探讨各因素对La-LBCZ吸附磷的影响效果。溶液的初始pH用HCl(0.1 mol·L−1)和NaOH(0.1 mol·L−1)溶液控制。
2)吸附动力学。分别投加50 mg La-LBCZ于250 mL锥形瓶中,依次加入100 mL初始浓度为10、30、50 mg·L−1的磷溶液(pH=6), 室温下转速为180 r·min−1,在不同时间(5~800 min)取上清液过0.45 μm滤膜测定滤液磷浓度。采用一级动力学方程(式(1))、二级动力学方程(式(2))、颗粒内扩散方程(式(3))对吸附结果进行拟合。
式中:t为吸附时间,min;qe为平衡吸附量,mg·g−1;qt为t时刻吸附量,mg·g−1;k1、k2、kp分别为准一级动力学、准二级动力学、颗粒内扩散模型速率常数;C是常数。
3)吸附热力学。分别投加50 mg La-LBCZ于250 mL锥形瓶中,依次加入100 mL不同浓度梯度(10~500 mg·L−1)的磷溶液(pH=6), 设置实验温度为15、30、45 ℃,转速为180 r·min−1,振荡12 h后取上清液过0.45 μm滤膜测定滤液磷浓度。采用Langmuir方程(式(4))和Freundlich方程(式(5))对吸附结果进行拟合,并通过计算热力参数(式(6))~(式(8))了解吸附过程。
式中:ce为吸附平衡时的磷浓度,mg·L−1;qe为平衡吸附量,mg·g−1;qm为饱和吸附量,mg·g−1;KL为常数;KF为Freundlich方程速率常数;n为吸附有关的常数;ΔG为吉布斯自能变,kJ·mol−1;ΔH为焓变,kJ·mol−1;ΔS为熵变,J·(mol·K)−1;R为气体常数,取值为8.314 J·(mol·K)−1;T为开氏温度,K;lnK为热力学平衡常数,K为ln(qe/ce)与qe线性关系的截距。
-
投加50 mg La-LBCZ于250 mL锥形瓶中,加入100 mL初始浓度为50 mg·L−1的磷溶液(pH=6),室温下转速为180 r·min−1,振荡12 h后取上清液过0.45 μm滤膜测定滤液磷浓度。收集饱和吸附剂置于100 mL NaOH(3 mol·L−1)溶液中,65 ℃下恒温搅拌2 h,测定上清液磷浓度后烘干吸附剂,用于下一循环实验。吸附-脱附实验共进行5次。
-
1)表征方法。采用扫描电子显微镜(SEM-EDS, ZEISS Sigma 500, 英国)观察生物炭的表面形貌结构;采用Zeta电位分析仪(Zeta, NanoBrook 90plus PALS, 美国)测定生物炭表面电荷;采用全自动比表面积和孔隙度测定仪(BET, TriStar II 3020, 美国)测定生物炭的比表面积大小和孔径分布;采用X射线衍射仪(XRD, Empyrean, 荷兰)分析晶体类型;采用傅里叶红外光谱仪(FT-IR, Bruker Tensor 27, 德国)分析生物炭的表面官能团;采用x射线光电子能谱(XPS, Thermo Scientific K-Alpha, 美国)对表面元素定性和定量分析。
2)吸附实验分析方法。采用钼酸铵分光光度法测定溶液中磷的浓度。根据(式(9))计算平衡吸附量qe(mg·g−1,以P计)。
式中:c0为磷酸盐初始浓度,mg·L−1;ce为吸附平衡时的磷浓度,mg·L−1;V为溶液体积,L;m为生物炭投加量,g。
-
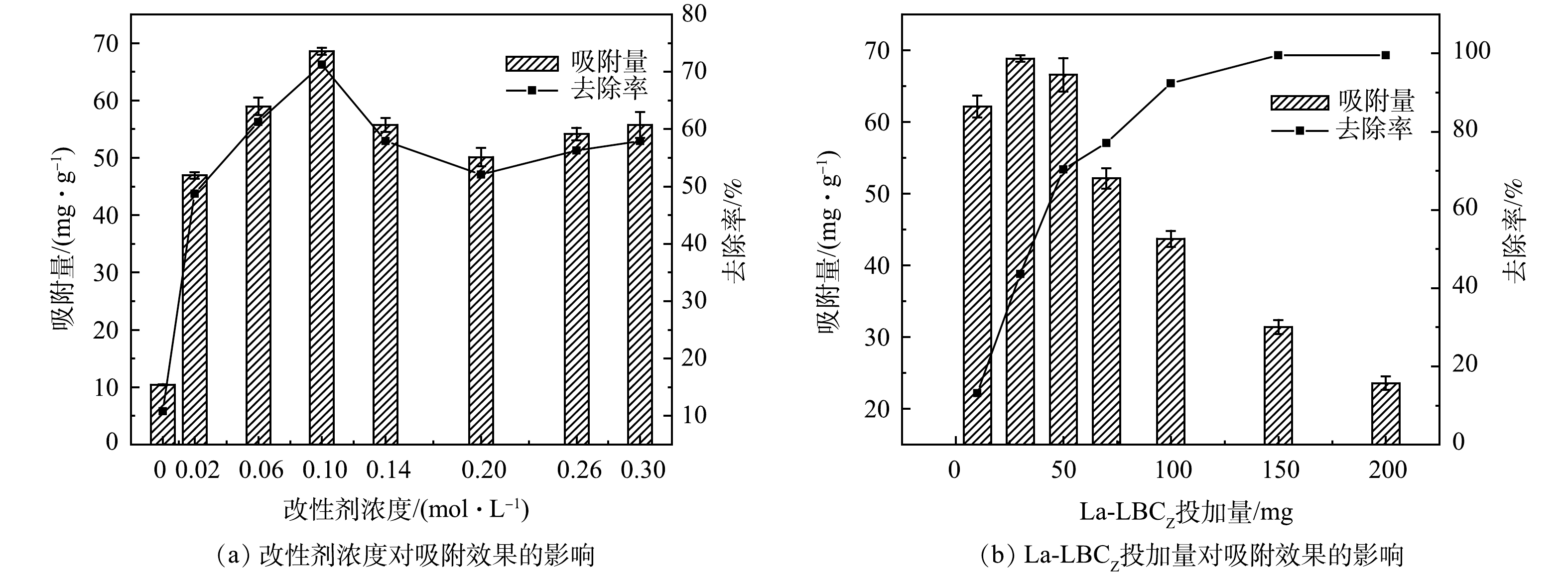
1)改性剂浓度对吸附效果的影响。为探究改性剂浓度对La-LBCZ吸附效果的影响,其他制备条件不变,设置La-LBCZ投加量为1 g,改性剂浓度为(0~0.3 mol·L−1),室温下转速为180 r·min−1,振荡12 h后取上清液过0.45 μm滤膜测定滤液磷浓度。由图1(a)可以看出,随着改性剂浓度的增加,La-LBCZ吸附量先增大后减小最后趋于稳定。这是因为在相同改性时间下,随着改性剂浓度增加,生物炭表面位点被La(OH)3占据,当改性剂浓度为0.1 mol·L−1时已经达到最大吸附吸附量(68.56 mg·g−1),为改性前的6倍,继续加大改性剂浓度不能提升吸附效果。
2) La-LBCZ投加量对吸附的影响。分别投加不同质量La-LBCZ(10~200 mg)到250 mL锥形瓶中,依次加入100 mL初始浓度为50 mg·L−1的磷溶液(pH=6),室温下转速为180 r·min−1,振荡12 h后取上清液过0.45 μm滤膜测定滤液磷浓度。由图1(b)可见,随着La-LBCZ投加量的增大,吸附量先增大后减小,磷去除率不断增大。这是因为La-LBCZ的投加为磷提供了更多的吸附位点。当投加量超过150 mg,去除率达到99%以上,表示La-LBCZ对处理高浓度含磷废水效果优异。
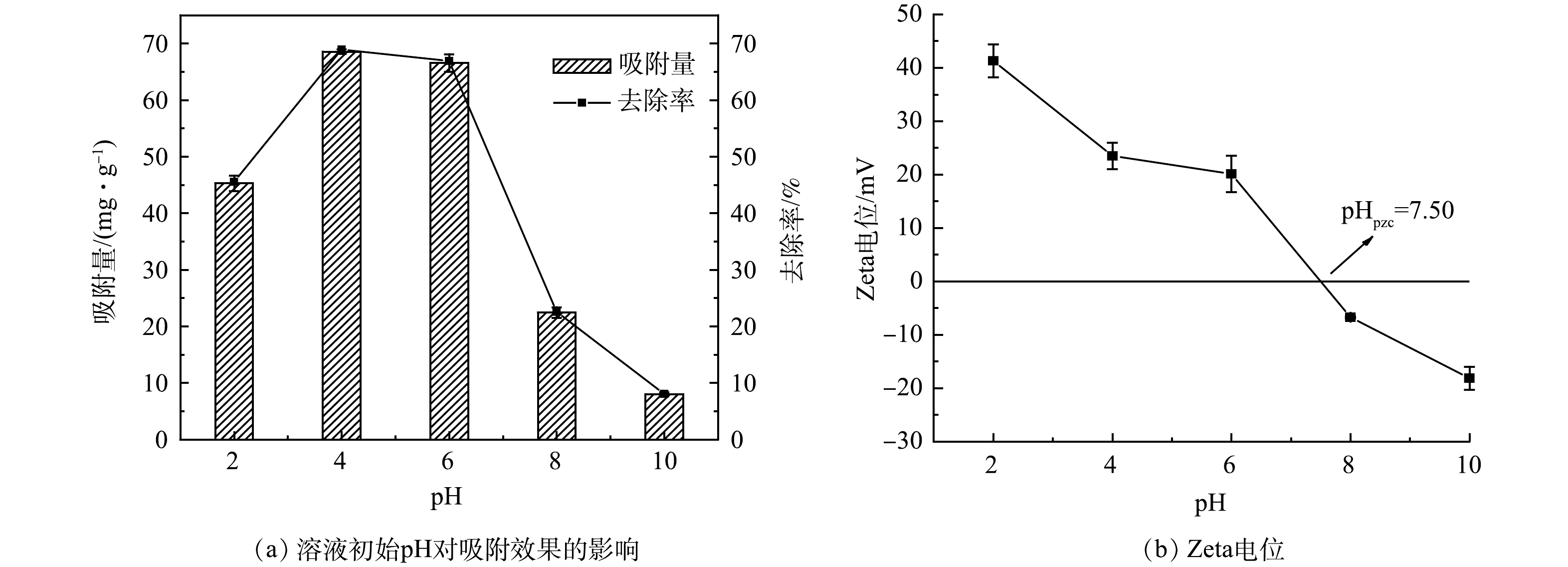
3)溶液初始pH对吸附效果的影响。溶液初始pH对生物炭的影响较大,为了探究其影响,分别投加50 mg La-LBCZ到250 mL锥形瓶中,依次加入100 mL初始浓度为50 mg·L−1的磷溶液,调溶液初始pH为(2~10),室温下转速为180 r·min−1,振荡12 h后取上清液过0.45 μm滤膜测定滤液磷浓度。由图2可以看出,随着溶液初始pH的增加,La-LBCZ对磷的吸附量先增加后减小。当pH=2时,La-LBCZ结构被破坏,La失去活性点位,对磷酸根的固定作用减弱,吸附效果较差。在pH=3~7内吸附效果最好,吸附量最高为68.56 mg·g−1(pH=4)。通过对磷酸盐的存在形式进行分析,当pH偏酸性时,溶液中磷酸根主要以H2PO4−和HPO42-的形式存在[15],与La-LBCZ表面产生静电吸附,吸附效果较好;当pH偏碱性时,溶液中磷酸根主要以HPO42-和PO43-的形式存在,溶液中的OH−与之产生位点竞争,吸附效果较差。通过对表面电荷进行分析,等电位点pHpzc=7.50,当pH小于该值时,La-LBCZ表面带有正电荷,更容易与磷酸根产生静电吸附;当pH大于该值时,La-LBCZ表面带有负电荷,磷酸根与La-LBCZ表面产生静电斥力,吸附受到抑制。
-
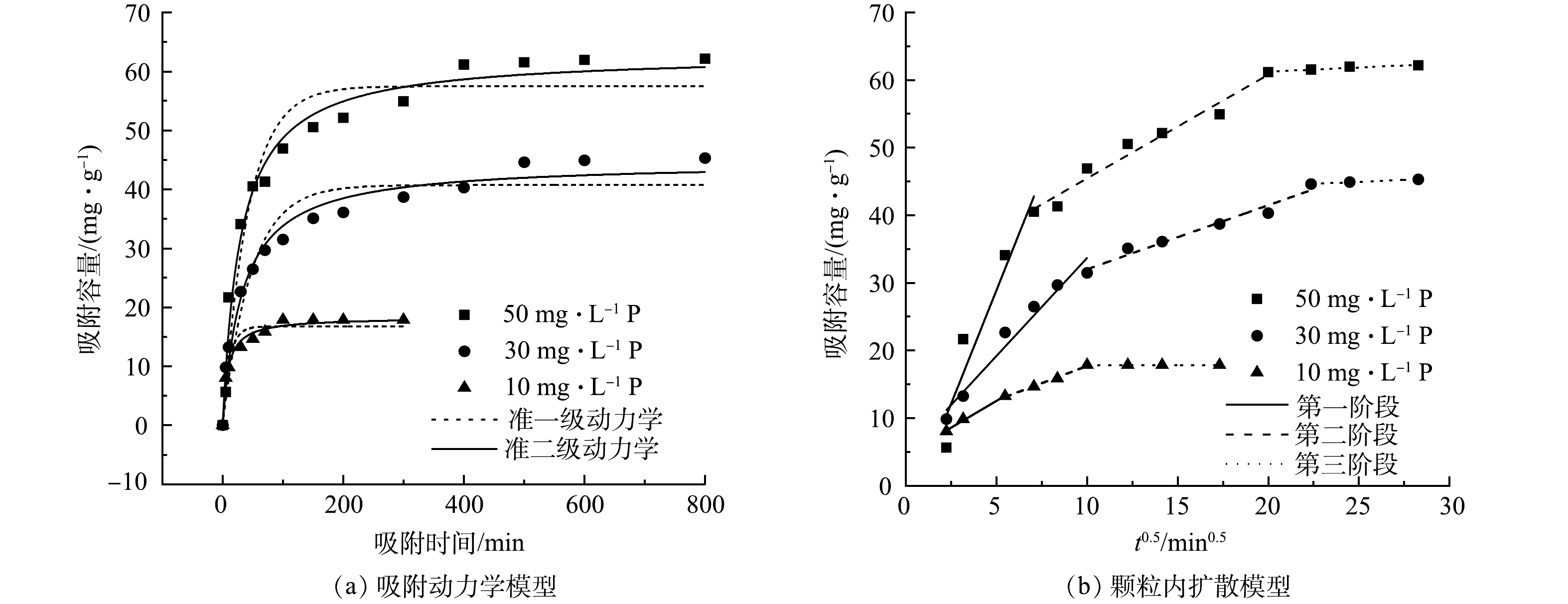
生物炭的吸附动力学拟合模型和参数见图3(a)和表1。由图3(a)可以看出,随着吸附时间的增加,吸附逐渐趋于稳定,当初始磷浓度为10 mg·L−1时,可在100 min内快速达到吸附平衡。表中数据表示准一级动力学方程和准二级动力学方程均能对La-LBCZ吸附磷的过程进行高度拟合(R2>0.90)。但准二级动力学方程能更好的描述吸附过程(R2>0.97),并且准二级动力学方程得到的qe更接近实测值,拟合结果表示La-LBCZ对P的吸附过程为化学吸附[16]。图3(b)、表2为La-LBCZ内扩散模型拟合结果。将吸附过程分为3个阶段:第1阶段为膜扩散,吸附过程较快,斜率最大;第2阶段磷酸盐向孔隙内部扩散,斜率变缓;第3阶段溶液中离子浓度趋于平衡,斜率最小。
-
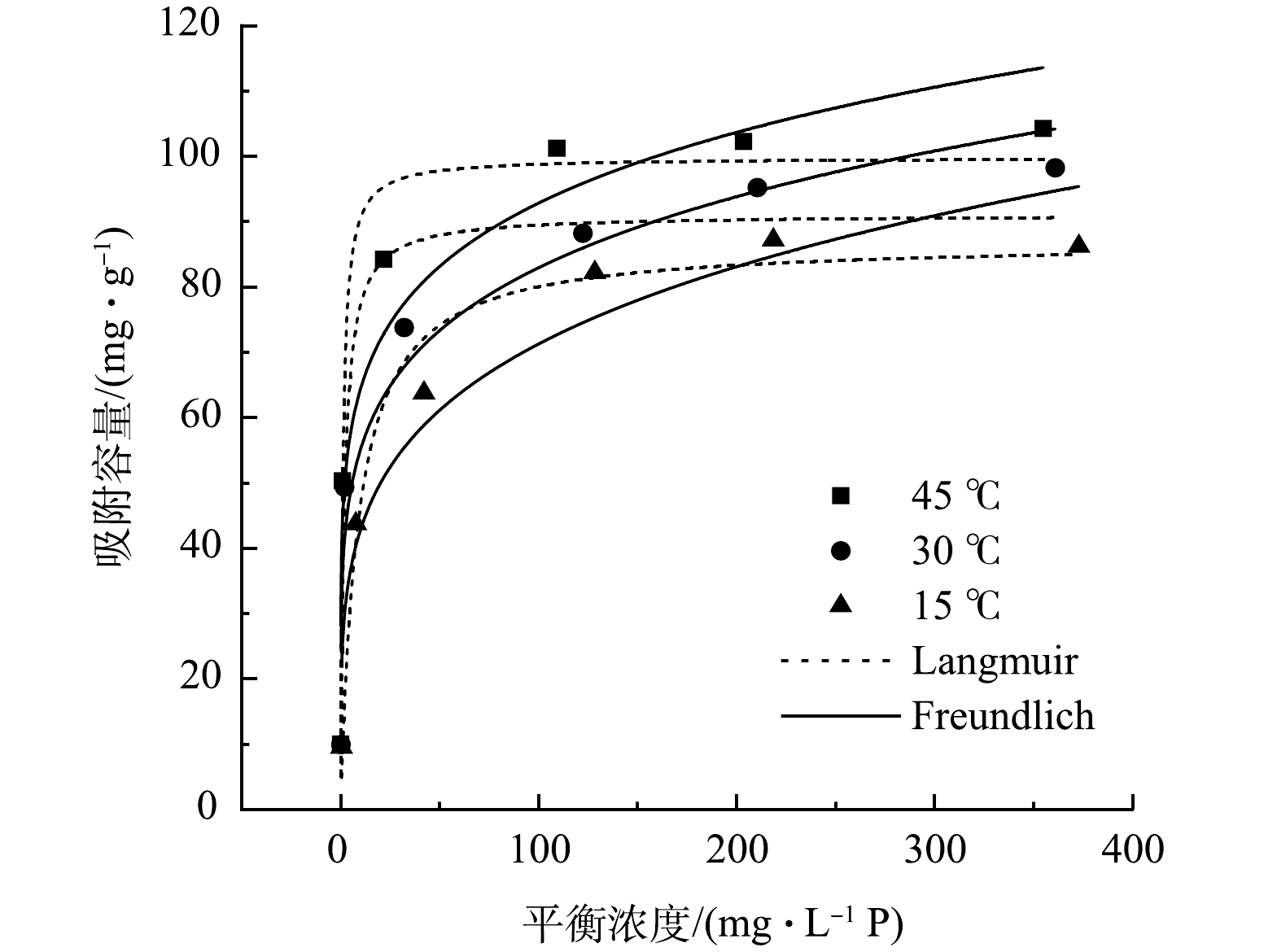
La-LBCZ对磷的吸附等温线如图4所示,随着温度的升高,吸附量也随之变大,这是因为吸附是一个吸热过程,升高温度有利于吸附的进行。等温线模型拟合参数如表3所示,Langmuir模型(R2=0.954~0.975)相比于Freundlich模型(R2=0.912~0.939)能更好的拟合La-LBCZ的吸附过程,表示La-LBCZ对P的吸附过程属于单分子层吸附[17]。在Freundlich模型中,KF代表了生物炭与污染物的结合能力[18],随着温度的升高,KF和qm均变大,说明温度的升高能提高La-LBCZ对P的吸附效果。并且1/n(0.159~0.222)在0.1~0.5,说明吸附是容易进行的[19]。
-
表4为La-LBCZ吸附磷时的热力学参数,随着温度的增加,ΔG的值减小,ΔG<0,这表示吸附是一个自发过程[20],温度的升高对吸附是有利的。ΔH>0,表示吸附是一个吸热过程,并且当ΔH>20 kJ·mol−1时,吸附过程为化学吸附,这与动力学拟合结果一致。ΔS>0表示吸附过程是一个熵增的过程,磷酸盐与La-LBCZ的亲和度较好。
-
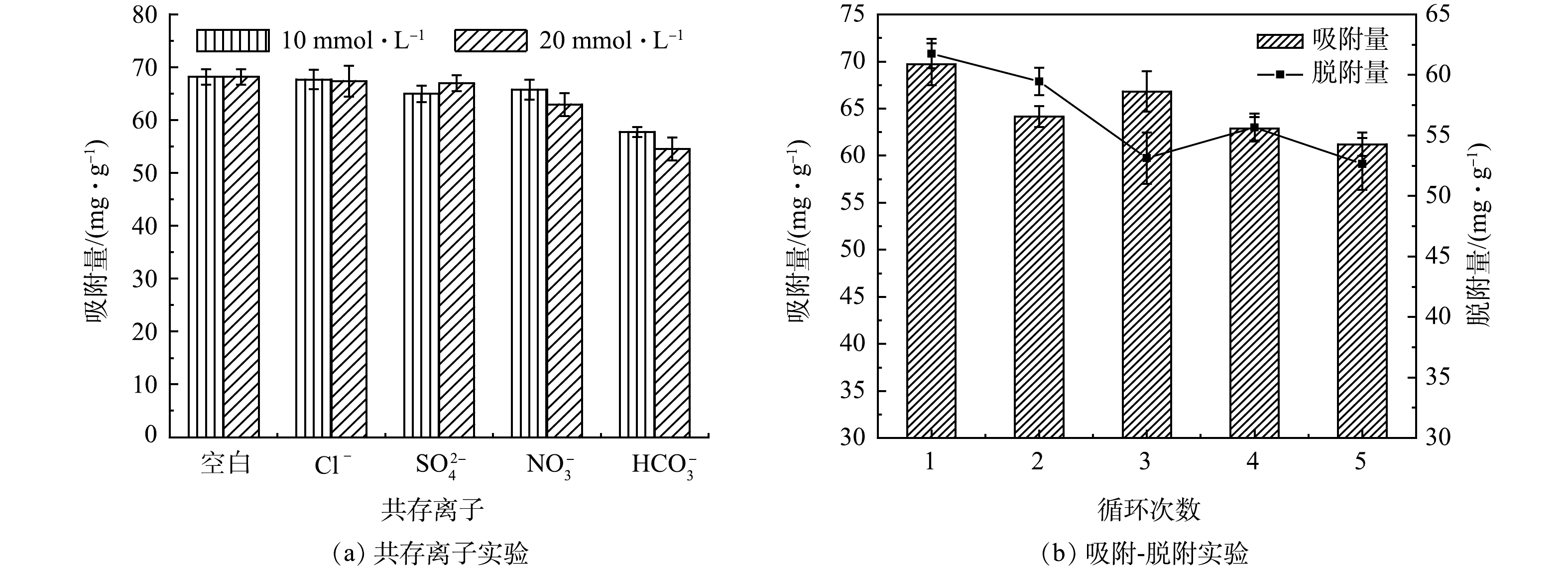
为探究共存离子对吸附效果的影响,选取常见阴离子Cl−、SO42-、NO3−和HCO3−作为共存离子。结果如图5(a)所示,Cl−、SO42-和NO3−对吸附效果的影响不大,HCO3−对吸附效果的影响最大,这是因为HCO3−和H2PO4−均通过与La-LBCZ形成内层络合物,相互竞争活性位点,从而导致吸附量降低。并且,HCO3−水解使溶液呈碱性[21],-OH与磷酸根竞争吸附位点,也不利于吸附。
-
为探究La-LBCZ的再生性能及磷回收性能,实验采取3 mol·L−1 NaOH溶液作为脱附剂,循环5次后结果如图5(b)所示,La-LBCZ的吸附量和脱附量随着循环次数的增加均降低,5次循环后吸附量为61.2 mg·g−1,吸附率为87.79%,脱附量为52.65 mg·g−1,脱附率为75.52%,表明该吸附剂具有优异的循环性能和磷回收性能。
-
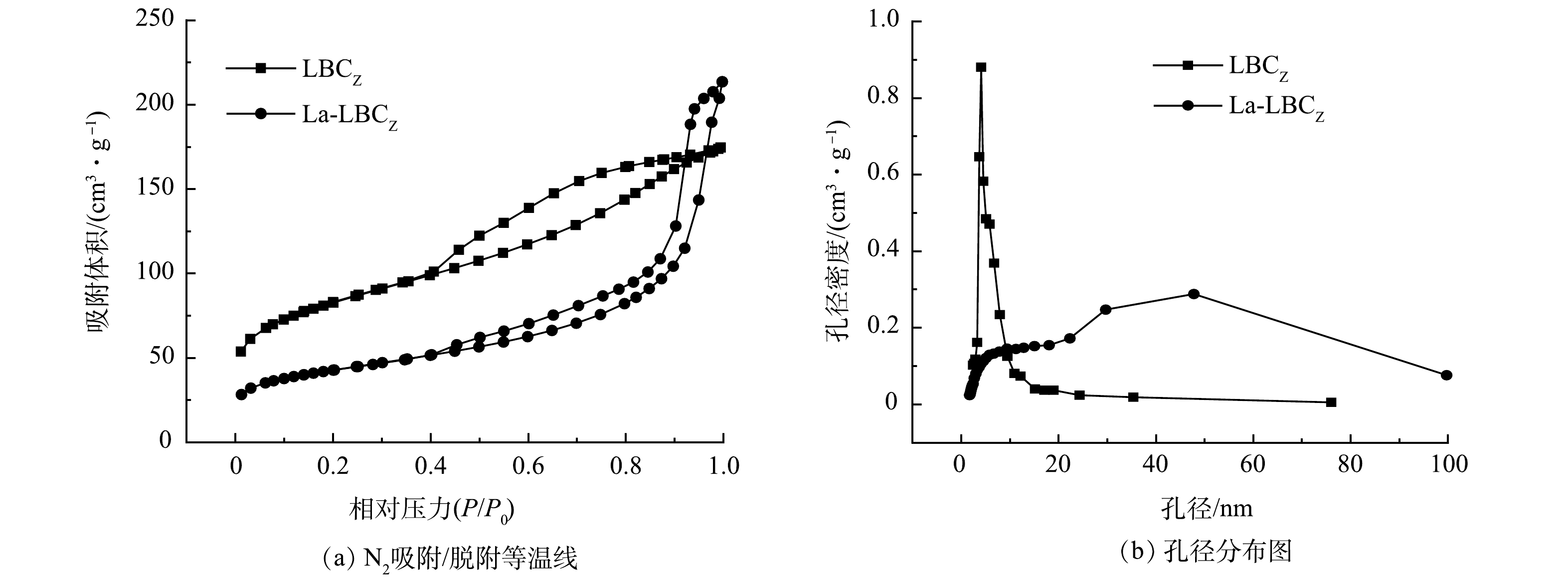
图6为改性前后生物炭的BET分析结果。N2吸附/脱附等温线均为Ⅳ型等温线,结合图6(b)可知,生物炭的孔径分布大多位于2~20 nm,表明生物炭以介孔(2~50 nm)为主。H3和H4型回滞环表示生物炭的介孔孔径分布不均匀。由表5可见,改性前后生物炭总比表面积由257.88 m2·g−1降至148.32 m2·g−1,平均孔径从4.84 nm升至11.1 nm,表明La被成功负载到生物炭表面,并且La-LBCZ的比表面积和孔隙空间百分比较小。吸附后的生物炭总比表面积和总孔容相比于吸附前略微降低,这是因为磷酸盐与La(OH)3发生化学沉淀形成LaPO4占据了生物炭的内部孔隙,这与平均孔径的变化情况一致。图7(a)和图7(b)分别为生物炭改性前后SEM图。可以看出生物炭改性前表面结构较为光滑,生物炭改性后表面被颗粒物覆盖,十分粗糙。结合图7(c)可知,生物炭中除了含有C和O外还含有大量的La,表明La被成功负载到生物炭表面[22]。
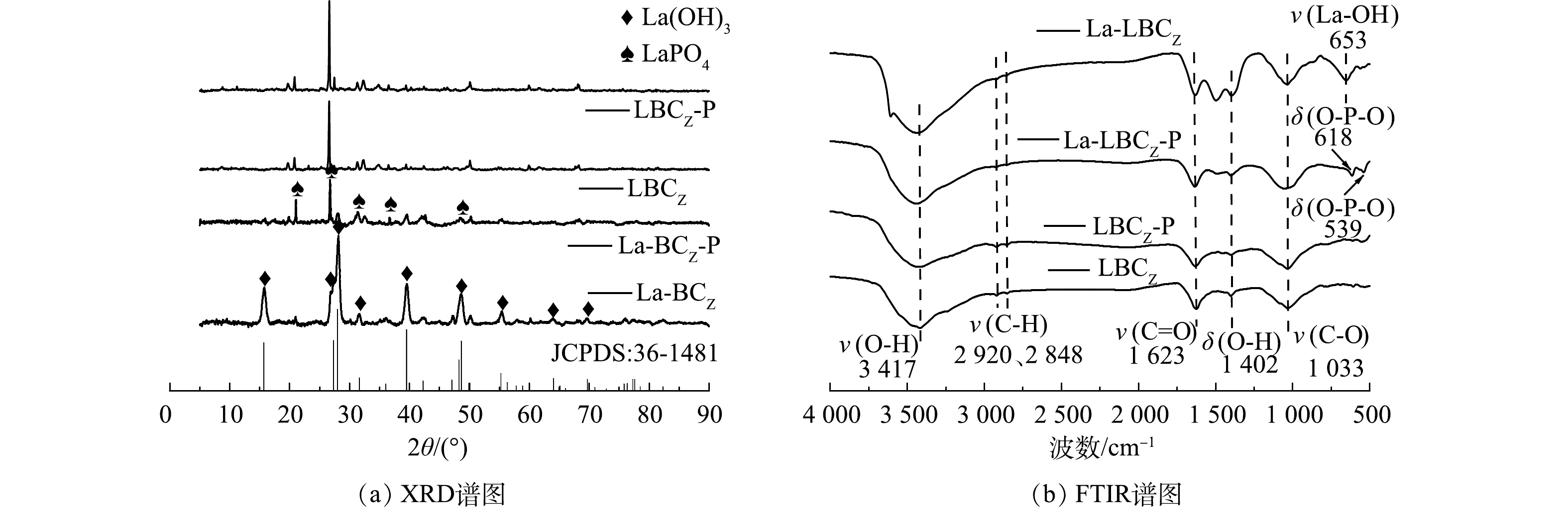
从图8(a)的XRD谱图可以看出,LBCZ吸附磷前后谱图变化较小,有很少的新晶体结构产生。反观改性后的La-LBCZ出现许多较强的衍射峰,对比标准衍射图谱JCPDS:36-1481,该晶体为La(OH)3,表示La被成功以La(OH)3的形态负载到生物炭表面。La-LBCZ吸附磷后的谱图中,La(OH)3的衍射峰明显减弱,在2θ为21.1、26.8和36.6°时峰值明显增强,对比标准衍射图谱JCPDS:28-0515,该峰为LaPO4的衍射峰,该结果表明,在磷的吸附过程中,生物炭表面-OH与磷酸根通过配体交换,La(OH)3转换为LaPO4。
图8(b)为LBCZ和La-LBCZ吸附前后的FTIR谱图。可见,在3 417 cm−1处的吸收峰来自于O—H键的伸缩振动,1 402 cm−1的位置对应O—H键的弯曲振动,这些峰的出现表明生物炭样品中含有丰富的羧基。在2 848 cm−1和2 920 cm−1附近较弱的吸收峰可归因为C—H的伸缩振动[23],而C=O的伸缩振动特征峰出现在1 623 cm−1,峰型尖锐,面积较大。1 033 cm−1处较强的吸收峰来自C—O键的伸缩振动。La-LBCZ在653 cm−1出现1个新的吸收峰,这是典型的La-OH键的振动[24],吸附磷后该峰消失,在618 cm−1和539 cm−1处出现了新的吸收峰,这与O—P—O的弯曲振动有关。这些结果表明La与磷之间通过配位体交换形成La—O—P内层络合物[25],同时也证明La-LBCZ在碱性条件下具有良好的磷回收性能和再生性能。
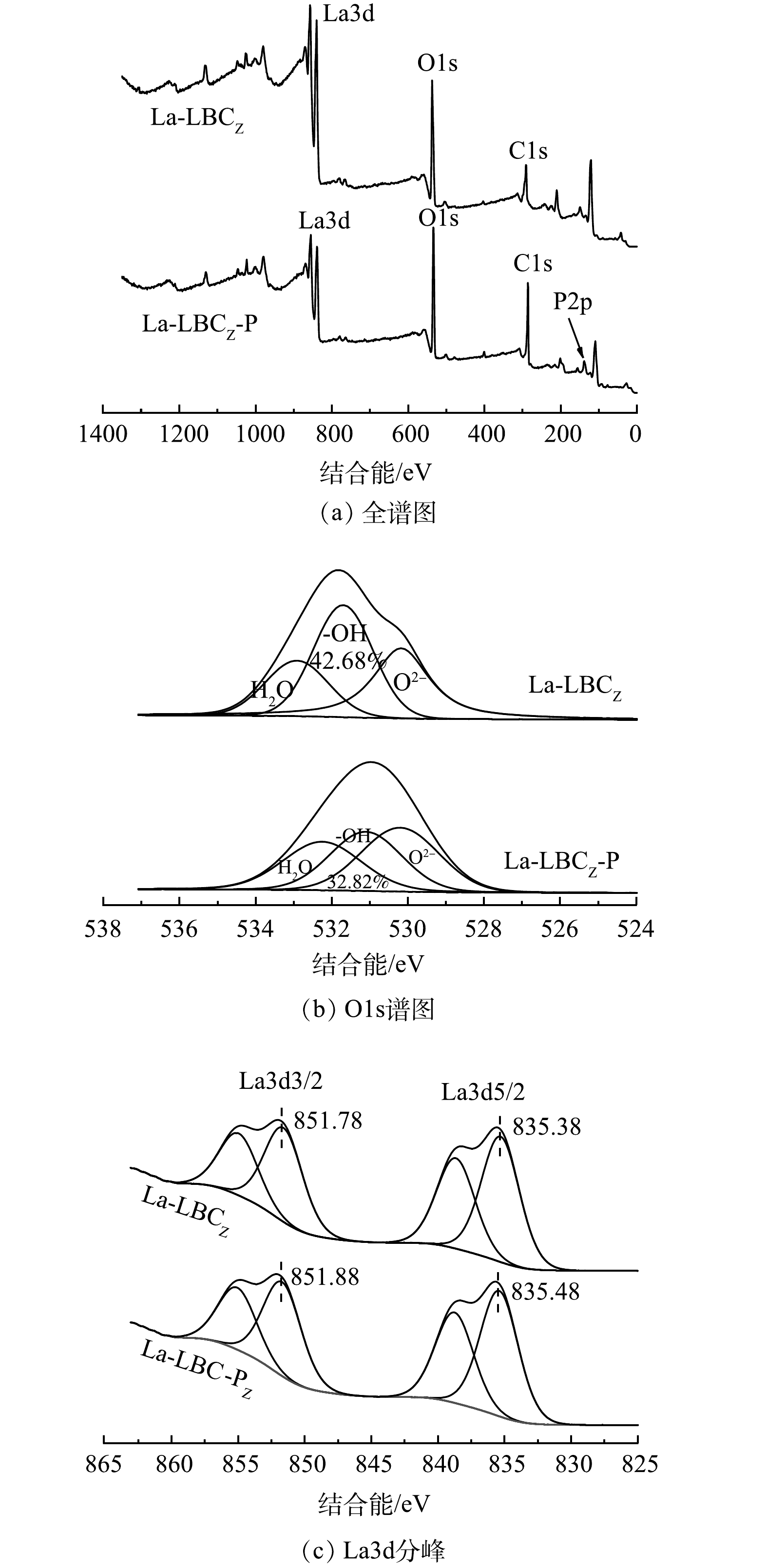
图9为吸附前后La-LBCZ的XPS谱图。由图9(a)中可以看到La3d、O1s、C1s等峰的存在,在吸附后结合能为134.51 eV处出现新峰P2p,表示La被成功负载到生物炭表面,并且对磷产生了吸附效果。由图9(b)可知,O1s被分为O2-、-OH和H2O,其中-OH的相对含量由42.68%降至32.82%,表示磷酸盐与La(OH)3发生络合反应[26],导致-OH相对含量降低。在La3d的谱图中出现La3d3/2和La3d5/2典型峰,其结合能分别由835.38 eV和851.78 eV增加到835.48 eV和851.88 eV,这是因为价带中的电子转移和内层络合物La-O-P的形成[27]。
-
市政污泥中含有重金属、合成有机物和致病微生物[28]。污泥生物炭与原始市政污泥相比,前者重金属含量更高,导致污泥生物炭在吸附过程中重金属浸出含量超过相应标准,造成潜在环境污染风险[29]。有研究发现,污泥与其他生物质共热解制备生物炭可以有效解决这一问题。YIN[30]等将污泥和酒糟共热解制备生物炭,探究了其物理化学和营养特性,结果表明,添加酒糟后污泥生物炭的重金属总浓度和潜在生态风险指数分别降低了7.31%~54.0%和5.28%~60.5%。HUANG[31]等的研究结果同样证实了这一观点,污泥生物炭中的3种金属(Cd、Ni和Pb)含量超过相应标准,但添加锯末/稻草后降低了生物炭中重金属含量,特别是Cu、Zn和Ni。以上研究结果表明酒糟和污泥共热解是可行的,不仅能显著提高污泥比表面积和孔隙结构,还能有效降低生物炭潜在环境污染风险。
-
1)通过共沉淀法将La以氢氧化物形态负载到LBCZ上使其具有优异的除磷能力,最大吸附量68.32 mg·g−1,为改性前的6倍。
2) La-LBCZ在pH=3~7内吸附效果较好,并且废水中常见阴离子对吸附影响可忽略不计。
3)吸附过程更符合准二级动力学方程和Langmuir模型,表明吸附过程主要为在单分子层上的化学吸附。
4) La-LBCZ在5次吸附-脱附循环后,仍具有87.79%的吸附率和75.52%的脱附率,有较好的循环性能和磷回收性能。
载镧酒糟污泥生物炭对磷的吸附性能及机理
Fabrication of La-LBCZ composites for phosphate removal: Adsorption performance and mechanism
-
摘要: 为实现市政污泥的无害化和资源化利用,以酒糟和市政污泥为原料热解制备酒糟污泥生物炭(LBCZ),采用共沉淀法将镧(La)负载到LBCZ表面制得La改性酒糟污泥生物炭(La-LBCZ),探究了改性剂浓度、La-LBCZ投加量、溶液初始pH和共存离子对La-LBCZ吸附磷的影响,使用SEM-EDS、BET、XRD、FTIR和XPS等表征手段分析了吸附机理。结果表明:改性剂浓度为0.1 mol·L−1时La-LBCZ对磷的吸附效果最好(吸附量为68.32 mg·g−1),为改性前的6倍;吸附过程符合准二级动力学模型和Langmuir模型,为单分子层表面的化学吸附。此外,生物炭孔隙结构不发达,La以氢氧化物形态负载到生物炭表面,络合反应是其主要的吸附机理。在吸附-脱附实验中,La-LBCZ经过5次循环后吸附量为61.2 mg·g−1,吸附率为87.79%,脱附量为52.65 mg·g−1,脱附率为75.52%,说明其具有良好的循环性能和磷回收性能。Abstract: In order to realize the harmless and resource utilization of municipal sludge, distiller's grains-sludge based biochar (LBCZ) was prepared by pyrolysis of distiller's grains and municipal sludge. La-modified distiller's grains-sludge based biochar (La-LBCZ) was prepared by coprecipitating lanthanum (La) onto the surface of LBCZ. The effects of modifier concentration, La-LBCZ dosage, initial solution pH, and coexisting ions on phosphorus adsorption by La-LBCZ were investigated. The corresponding adsorption mechanism was exposed by SEM-EDS, BET, XRD, FTIR, and XPS. The results showed that the adsorption effect of La-LBCZ to phosphorus significantly increased (68.32 mg·g−1) at 0.1 mol·L−1 modifier concentration, which was six times that of unmodified biochar. The adsorption behavior of La-LBCZ was consistent with the pseudo-second-order model and the Langmuir model, which indicated that above adsorption was the chemisorption on the monolayer. In addition, the pore structure of biochar was undeveloped, La was loaded on the biochar surface as hydroxides, and complexation reaction was the primary adsorption mechanism. After five adsorption-desorption cycles, La-LBCZ exhibited a good recycling and phosphorus recovery performance, the remained adsorption capacity was 61.2 mg·g−1, the adsorption rate was 87.79%, the desorption capacity was 52.65 mg·g−1, and the desorption rate was 75.52%.
-
Key words:
- biochar /
- lanthanum modified /
- municipal sludge /
- phosphorus /
- adsorption /
- desorption
-
地下水是地球宝贵的资源,是重要的生态环境因子和不可忽视的致灾因子[1 − 2],地下水水化学特征的变化往往会影响生态环境和人类社会的发展. 受多种因素的共同控制,地下水化学成分在空间和时间尺度上差异显著,主要有自然因素(降水、水岩相互作用等)[3]和人为因素(工农业污染等)[4],如何识别其主控因素,是地下水水化学形成研究的关键问题之一. Piper图、Gibbs图和离子比值法是研究地下水化学成分形成和演化的有效手段,近年来,同位素分析方法[5]、统计学方法[6]及水文地球化学模拟技术[7],将单一的地质和水文地质条件、水化学特征等因素结合起来,定性和定量揭示地下水的形成机制[8],也逐渐成为识别地下水来源及形成过程的关键方法[9].
中国南方岩溶地区分布广泛,面积约78万km2,发育了接近三千多个岩溶地下水系统[10 − 11],赋存了庞大的岩溶水资源,但受赋存环境、开采条件及水质情况的制约[12],区内仍严重缺水. 研究岩溶区地下水水化学特征及其形成机制,不仅有利于水环境保护和修复,而且对地下水的开发利用具有重要作用. 梅窖镇大石岭矿区位于中国南方岩溶地区中下部,岩溶地貌发育,蓄水能力弱,水资源可获取性差,可利用难度大,地下暗河和浅层地下水是居民主要的生活和饮用水源. 但近几年,区内浅层地下水水位急速下降、水质持续恶化,地下水化学特征及其形成机制等相关问题仍然未得到充分的研究和解决.
本文通过分析浅层地下水(埋深小于25 m)的基本理化参数和主要离子分布,利用数理统计、Piper图、Gibbs图、主成分分析法、正向演替模型和混合模型等方法,定性和定量地揭示了赣州梅窖镇岩溶区浅层地下水的水化学特征和水岩相互作用机制,为该区地下水资源的合理开发利用和管理提供科学依据.
1. 材料与方法(Materials and methods)
1.1 研究区概况
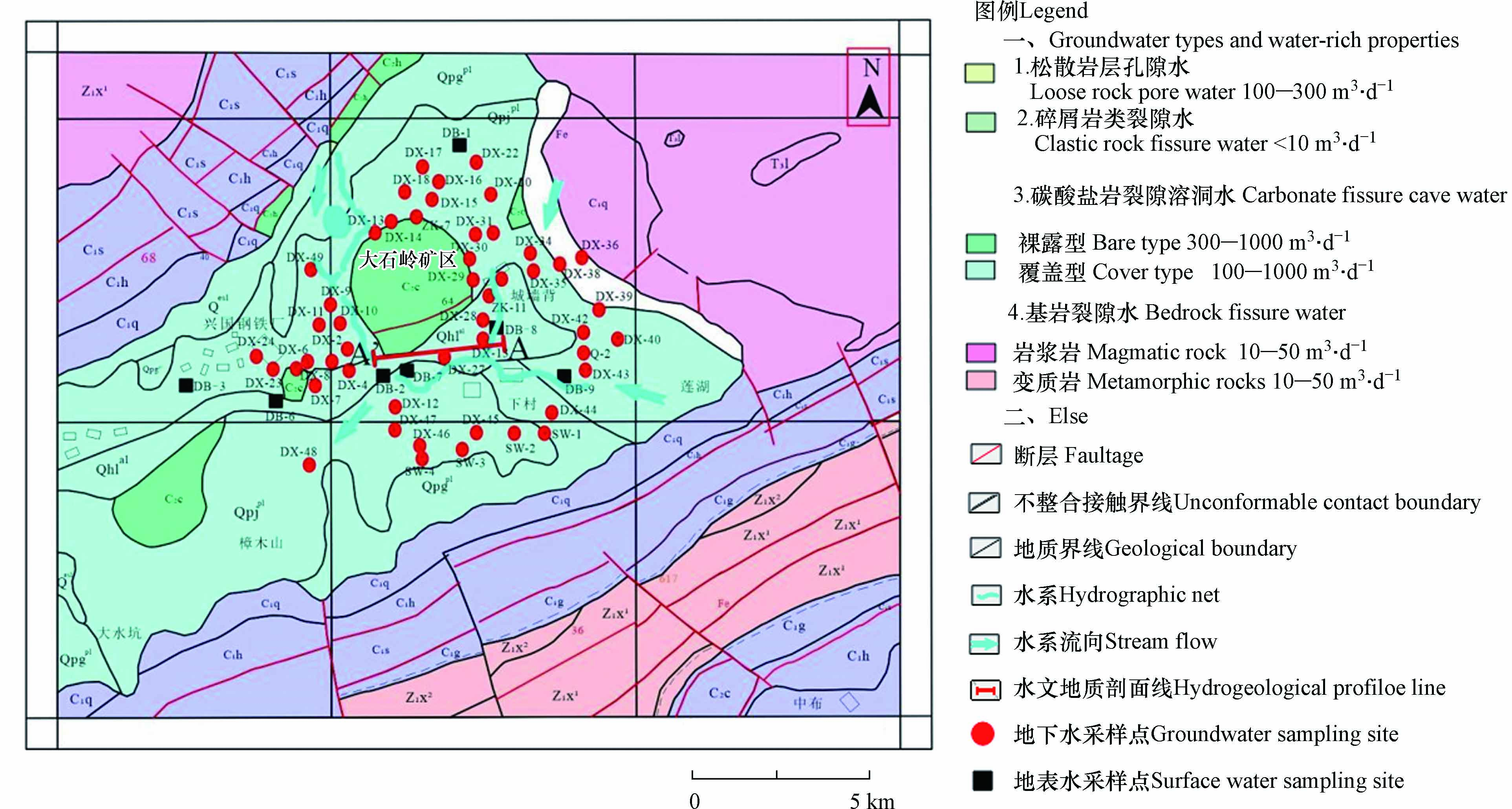
梅窖镇大石岭矿区(以下简称研究区)位于江西省赣州市兴国县梅窖镇(图1),地理坐标为:115°47′—115°42′ E,26°24′ —26°25′N,属岩溶盆地地貌,盆地呈北东向条带状展布,大石岭矿区位于盆地核心地带,属丘陵地形,基岩出露较好. 区内属亚热带东南季风气候区,年平均气温18.8 ℃,年平均降水量为1522.3 mm,年平均蒸发量1635.8 mm.
研究区出露的地层有第四系、石炭系、震旦系,依据地下水的赋存条件,地下水可划分为松散岩类孔隙水、基岩裂隙水、碎屑岩类裂隙水、碳酸盐岩岩溶裂隙水的4种类型,其中浅层地下水(埋深小于25 m)主要为第四系松散孔隙水和石炭系碳酸盐岩岩溶裂隙水(图2). 钻探浅孔共15个,遇溶洞钻孔13个,见溶洞率87%,共揭露21个溶洞,岩溶发育程度强. 浅部溶洞较为发育,一般隐伏于地表10 m以下的地方,主要集中在高程+290—+270 m,呈现半充填状态,充填物为第四系泥砂,个别溶洞见磨圆度较好的卵石.
区域碳酸盐岩岩溶裂隙水富水性较好,泉流量1.495—9.5573 L·s−1,暗河流量22.758 L·s−1,地下水位年变幅 1—8m,岩溶水主要赋存于石炭系船山组(C2c)和黄龙组(C2h),岩性主要以灰岩及白云岩为主. 其次为第四系松散孔隙水,含水层厚度5.8—29.4 m,平均17.4 m,岩性主要为粘土、含碎石粘土、碎石土及含泥砂砾石. 浅层地下水的主要补给源为大气降水的渗入补给、基岩裂隙水的侧向补给和汛期河水的反向补给,此外,经现场水文地质调查发现,研究区暗河(DB-2)流量丰水季节较枯水季节大,且雨后流量明显增加,说明暗河水受地表环境影响显著. 浅层地下水排泄方式为自然蒸发、就近向坡脚沟谷、洼地、河流排泄和以泉等形式排泄. 此外,研究区农作物丰富,以水稻、脐橙、油菜和甘蔗等为主,通过对脐橙中的重金属研究发现,施用化肥、农药等人为农业活动因素是土壤中重金属超标的主要原因[13]. 现场调查过程中,山上随处可见养殖场,据2014年赣州市疾病控制中心有关数据表明[14],农村水体污染严重,生活、农业生产及养殖是水体污染的主要来源. 因此,人为污染也是研究区地下水污染需要考虑的另一关键因素.
1.2 样品采集与测定
基于研究区的地质、构造、水文地质、水文、气象、地形地貌等基础资料, 进行水文地质踏勘,重点调查水井、暗河和泉出露点. 沿地下水的补径排路径,2021年8—9月,采集大气降水、地表水、水井地下水和泉水样品分别为1件、9件、49件和4件,采样点分布于研究区重要河流、水井、泉点和暗河出口,用于水质检分析63件、氢氧稳定同位素测试的样品49件.
利用意大利HANNA公司HI98194水质多参数测试仪现场测定水温、 pH、电导率等项目. 阳离子(K+、Ca2+、Na+、Mg2+)用原子吸收分光光度计( AAS800,美国PE公司)进行测定,阴离子(SO42−、Cl−、F−、NO3−)使用离子色谱仪测定,测试相对标准偏差在-5%到+5%之间,数据的精度和准确度均符合要求. HCO3−采用碱式滴定法测定,根据测试的阴阳离子含量计算水样的TDS. 氢氧同位素(δD、δ18O)的分析测试使用美国Picarro公司生产L2140-i液态水水汽同位素分析仪测试,δD、δ18O分析误差分别小于0.5‰、0.1‰,测定结果以相对V-SMOW标准给出.
1.3 数据分析
本文采用Piper图分析地下水水化学类型,结合氢氧稳定同位素反应地下水的补给来源[5]. 利用相关性和主成分分析法揭示地下水各离子间的相关性[15],并筛选影响地下水水化学组成的主要变量[16]. 基于Gibbs图定性的判断地下水水化学组成的来源,包括蒸发浓缩、岩石风化以及大气沉降[17],并利用[Mg2+/Na+]和[Ca2+/Na+]、[Mg2+/Ca2+]和[Na+/Ca2+]的物质的量比值[18]进一步揭示地下水水化学组成来源的主控因素. 结合[(Ca2++Mg2+)-(HCO3−+SO42−)]与[(Na++K+-Cl−)]的浓度关系分布图判断是否发生阳离子交替吸附[19],利用[(Ca2++Mg2+)-HCO3−]与[SO42−-Na++Cl−]的比值判断SO42−来源[20],并利用[NO3−/Cl−]与[Cl−]及[SO42−/Ca2+]与[NO3−/Na+]的关系判断NO3−的来源,查明人为因素对地下水化学成分的控制作用[21 − 22]. 最后,利用正向演替-端元混合模型量化大气输入、人类活动和岩石风化(碳酸盐岩、硅酸盐岩和蒸发盐岩)对地下水水化学组成的相对贡献[23 − 24],正向演替模型主要计算公式如下:
stringUtils.convertMath(!{formula.content}) (1) stringUtils.convertMath(!{formula.content}) (2) stringUtils.convertMath(!{formula.content}) (3) stringUtils.convertMath(!{formula.content}) (4) stringUtils.convertMath(!{formula.content}) (5) 式中,γ代表不同来源对地下水水化学组成的相对贡献(%),T代表阳离子与阴离子毫克当量和,大气输入、人类活动以及岩石风化中各离子组成利用元素X(K+、Na+、Ca2+、Mg2+、Cl−、NO3−、SO42−、HCO3−)的质量守恒进行计算(单位为毫克当量):
stringUtils.convertMath(!{formula.content}) (6) 为了进一步量化碳酸盐中灰岩和白云岩的贡献率,结合三端元回合模型,利用Mg2+/Ca2+比值,进行定量估算. 研究表明,低、中、高Mg2+/Ca2+比值(约0.1、0.7和1.05)分别作为石灰岩、硅酸盐和白云岩溶解物质的端元,方程如下:
stringUtils.convertMath(!{formula.content}) (7) stringUtils.convertMath(!{formula.content}) (8) 式中, f 代表地下水不同来源的贡献率(%),其中硅酸盐的贡献率可以通过正向演替模型获得,其他符号代表相应来源的端元值以及硅酸盐和碳酸盐贡献样品的Mg2+/Ca2+比值.
2. 结果与讨论(Results and discussion)
2.1 水化学组分分布特征
水体的水化学组成如表1所示. 可知,研究区地下水和地表水整体上呈弱碱性,地下水pH介于5.72—8.71,均值为7.21,地表水pH介于7.18—8.53,均值为7.82. 地下水电导率介于30—535 µs·cm−1,均值为240.72 µs·cm−1,地表水电导率介于44.9—381 µs·cm−1,均值为271.28 µs·cm−1. 区内地下水及地表水均为淡水,地下水TDS介于27.61—360.75 mg·L−1,平均值为179.13 mg·L−1,地表水TDS介于84.19—280.97 mg·L−1,平均值为201.59 mg·L−1,因地表水采样点大都位于径流和排泄区,且研究范围相对较小,出现地表水的TDS均值较地下水TDS略大. 地下水阴离子浓度表现为HCO3−>Cl−>NO3−>SO42−,以HCO3− 为主,占总阴离子浓度的79.5%,阳离子浓度表现为Ca2+>Mg2+>Na+>K+,以Ca2+为主,占总阳离子浓度的72.9%. 地表水阴离子浓度表现为HCO3−>NO3−>Cl−>SO42−,以HCO3− 为主,占总阴离子浓度的81%,阳离子浓度表现为Ca2+>Mg2+>Na+>K+,以Ca2+为主,占总阳离子浓度的71.1%. 根据Piper图(图3)显示,研究区地下水水化学类型主要为HCO3-Ca型,下部两个三角图中地下水、地表水和泉水整体较为集中,说明它们的水化学成分、含量变化较小,来源较为一致.
表 1 赣州梅窖镇大石岭矿区水体主要离子构成Table 1. Ion compositions of the water body in the Dashiling Mining Area of Meijiao Town, Ganzhou水类型 Water type 指标Index ρ/(mg·L−1) pH 电导率/(µs·cm −1)Electrical conductivity Ca2+ Mg2+ K+ Na+ Cl− SO42− NO3− HCO3− TDS 浅层地下水 最大值 71.12 15.64 18.82 16.40 20.71 20.45 27.08 244.00 360.75 8.71 535 最小值 4.20 0.13 0.33 0.16 ND. 0.09 ND. 10.00 27.61 5.72 30 平均值 31.48 4.02 2.65 4.31 4.38 4.62 8.06 113.21 179.13 7.21 240.72 标准差 19.65 3.63 3.91 4.23 4.60 5.07 6.94 65.74 89.49 0.75 120.98 地表水 最大值 55.77 13.29 8.19 3.37 18.77 20.94 33.66 195.20 280.97 8.53 381 最小值 15.93 1.07 0.75 0.84 ND. 2.77 ND. 61.00 84.19 7.18 44.9 平均值 40.71 8.20 2.84 1.89 4.81 6.78 6.45 136.34 201.59 7.82 271.28 标准差 14.16 3.25 2.55 0.65 5.06 5.13 9.83 37.46 53.74 0.40 104.65 2.2 地下水的补给来源
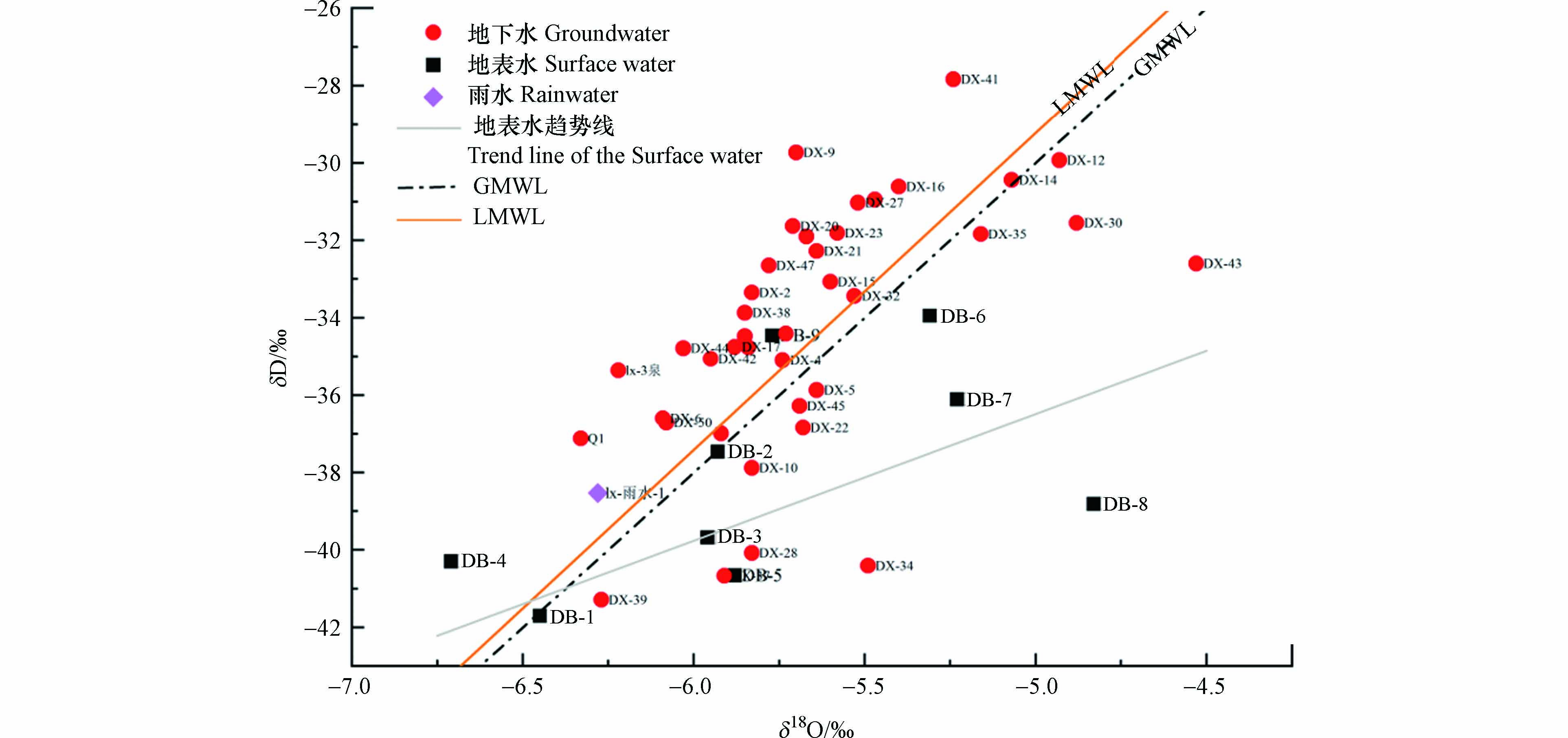
同位素分析方法广泛用于解译地下水的形成、地表水和地下水的转化和演化过程,对分析地下水的形成机制的演化规律具有重要的指示意义[5]. 地下水和地表水氢氧稳定同位素(δD和δ18O)分析结果表明,地下水δD值变化范围介于−41.29‰—−27.84‰之间,平均值为−34.26‰,标准差为3.22‰,δ18O值变化范围为−6.33‰—−4.53‰,平均值为−5.67‰,标准差为0.38‰;地表水δD值变化范围介于−41.7‰—−33.95‰之间,平均值为−38.13‰,标准差为2.79‰,δ18O值变化范围为−6.71‰—−4.83‰,平均值为−5.79‰,标准差为0.59‰. 整体上看,研究区浅层地下水δD和δ18O较地表水的分布范围大,且相对较为富集.
本文从国际原子能机构获得了位于赣州东部福州地区观测站长期的月平均大气降水δD、δ18O同位素数据(70组),回归拟合得到当地大气降水线(LMWL):δD=8.19δ18O+11.73. 该方程的斜率大于全球大气降水线(GMWL)[25](δD=8δ18O+10)斜率,表明研究区受局地水汽和二次蒸发影响小. 矿区地下水和地表水δD与δ18O均分布在大气降水线LMWL附近(图4),表明地下水及地表水主要源于大气降水的补给. 对比,地下水地表水水样点则大多分布于LMWL左下方,受蒸发作用影响较大,其中DB-4和DB-9为山上引水,具有山泉水的特征,蒸发作用不明显. 地下水的水样点大都分布在LMWL附近,部分点(点DX-28、DX-34、DX-39和DX-43)分布在LMWL线下方,经调查发现,DX-28和DX-43分布在小溪周边,DX-34和DX-39分布在坡脚水塘边,受地表水的混合作用影响,造成δD与δ18O具有蒸发作用的特征. 总体上,地下水δD与δ18O相对较为富集,说明地下水在径流过程中,除了受大气降水补给和地表水的混合作用外,还受到了其他水文地球化学作用的影响,如研究区岩溶个构造断层发育,暗河出露(DB-2),深部基岩裂隙水和岩溶水,通过孔隙、裂隙和断层,汇入浅层松散孔隙水,造成水中δD与δ18O富集.
2.3 水化学形成机制
2.3.1 地下水离子来源
主成分和相关性分析是揭示地下水水化学组成来源一致性、差异性及关联程度的有效数理统计方法[26]. 对研究区地下水水化学组成进行主成分及相关性分析,结果见表2和表3. 运用主成分分析法提取了3个主成分,累计解释了总因子的29.512%、53.349%和75.051%,揭示地下水离子3种不同的来源. 第一主成分包括Ca2+、Mg2+和HCO3−,其权重系数分别为0.513、0.517和0.522,3个指标对地下水化学成分的控制作用相当;第二主成分包括Cl−、SO42−、NO3−,其权重系数为0.298、0.267和0.399,NO3−对地下水组分的影响相对较大;第三主成分包括K+和Na+,其权重系数分别为0.343和0.272,说明K+是该主成分的主要控制指标.
表 2 研究区地下水水样旋转成分矩阵Table 2. Rotational composition matrix of groundwater samples in the study area指标 Index f1 f2 f3 Ca2+浓度 0.849 0.304 0.237 Mg2+浓度 0.856 -0.060 -0.108 K+浓度 0.063 -0.004 0.901 Na+浓度 0.171 0.349 0.715 Cl−浓度 0.152 0.680 0.475 SO42−浓度 0.321 0.608 0.164 NO3−浓度 -0.044 0.909 -0.012 HCO3−浓度 0.864 0.176 0.304 特征值 2.361 1.907 1.736 贡献率/% 29.512 23.837 21.702 累积贡献率/% 29.512 53.349 75.051 表 3 地下水水化学参数间的线性相关矩阵Table 3. Linear correlation matrix among groundwater hydrochemical parameters指标Index Ca2+ Mg2+ K+ Na+ Cl− SO42− NO3− HCO3− pH TDS Ca2+ 1 0.529** 0.206 0.518** 0.362* 0.476** 0.189 0.912** 0.425** 0.950** Mg2+ 1 -0.048 0.035 0.018 0.200 -0.108 0.545** 0.285 0.545** K+ 1 0.493** 0.631** 0.257 0.116 0.214 0.139 0.298* Na+ 1 0.455** 0.527** 0.274 0.464** 0.280 0.555** Cl− 1 0.370* 0.356* 0.352* -0.042 0.439** SO42− 1 0.215 0.394** 0.154 0.495** NO3− 1 0.081 -0.221 0.140 HCO3− 1 0.492** 0.985** pH 1 0.471** TDS 1 注:*表示P<0.05, **表示P<0.01 主成分f1中Ca2+与Mg2+和HCO3−之间具有显著的相关性,表明这3种离子主要来源于碳酸盐岩风化[27]. 主成分f2中Cl−、SO42−和NO3−三者具有相同的来源(23.837%),且研究区附近常年有居民居住,水稻的种植及牲畜的蓄养会存在化肥和农药的使用以及粪便和生活污水的排放[28],表明这3种离子主要来源于人为因素的影响[29 − 30]. 但Cl−、SO42−和NO3−间相关性不明显(r<0.4,P<0.05),指示Cl−和SO42−还可能存在其它来源,如蒸发盐岩和石膏的风化[31]. 主成分f3中K+和Na+具有一定的相关性(r>0.4,P<0.01),K+的权重系数较高,且主成分分析显示具有相同的来源(21.702%),表明这两种离子可能的来源为硅酸盐岩和(或)蒸发盐岩风化[32].
2.3.2 水岩相互作用
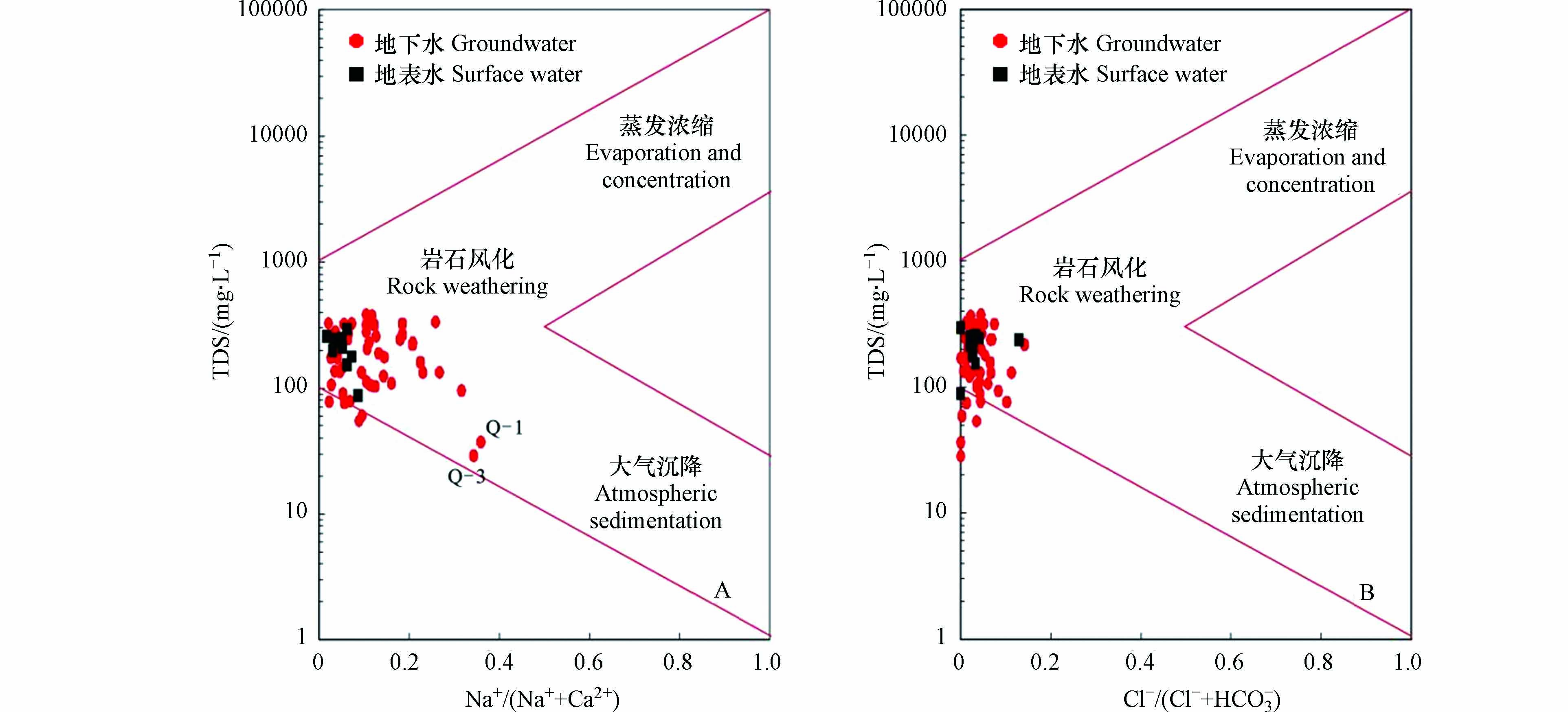
Gibbs图可宏观查清地下水水化学组成和演化过程的控制因素[17]. 如图5所示,水样的离子含量比Na+/(Na++Ca2+)为0.02—0.37,Cl−/(Cl−+HCO3−)为0—0.14,平均值分别为0.14和0.04. 样点基本集中在Gibbs图中部,说明地下水离子组分主要来自于岩石风化作用,但Q-1和Q-3为山泉水样,出露条件较好,径流路径较短,主要为大气降水入渗补给,故会受到大气沉降影响. 部分水样点落在Gibbs三角区域之外,指示人类活动的影响也是控制研究区地下水的主要因素之一. 地表水离子组分也主要来自于岩石风化作用,但蒸发盐岩溶解作用的影响较地下水弱. Mg2+/Na+和Ca2+/Na+、Mg2+/Ca2+和Na+/Ca2+的物质的量比值可以定性判别研究区内不同岩石风化溶解作用对水体溶质的影响[18]. 图6表明,地下水和地表水主要受到碳酸盐岩风化作用的影响,硅酸盐岩和蒸发盐岩风化作用较弱,碳酸盐岩中起作用的主要是灰岩及白云岩的溶解.
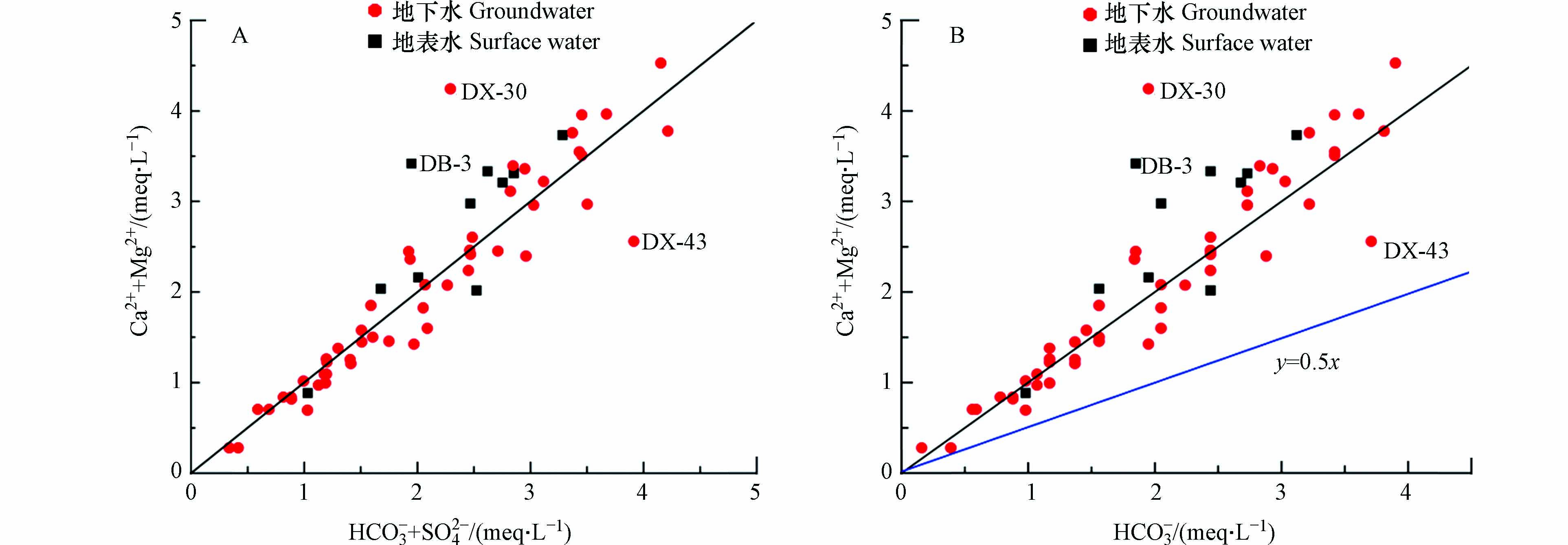
为进一步查清灰岩和白云岩对水体中Ca2+、Mg2+和HCO3−的控制作用,绘制(Ca2++Mg2+)/(HCO3−+SO42−)以及(Ca2++Mg2+)/HCO3−的毫克当量浓度比值图[33]. 根据图7可知,(A)中地下水和地表水离子比值大都位于1∶1等值线附近,说明地下水和地表水中的Ca2+、Mg2+和HCO3−主要来源于碳酸盐岩、硅酸盐岩和石膏、杂卤石等蒸发盐岩的溶解,(B)中地下水离子比值多数远离1∶0.5等值线,整体更为靠近1∶1等值线,由此可知以灰岩和白云岩为主的碳酸盐岩的溶解是Ca2+、Mg2+和HCO3−的主要来源,其中灰岩占主导作用[34]. 图7(A)中点DX-43处于1∶1等值线下方较远处,在图7(B)处于1∶1和1∶0.5之间,说明DX-43水化学成分受白云岩和灰岩的共同作用. 而DB-3及DX-30较偏离1∶1等值线,处于上方,即[Ca2++Mg2+]/[HCO3−+SO42−]远大于1,水体中Ca2+和Mg2+过剩,需要Cl−来平衡,表明水样点DB-3及DX-30中Ca2+和Mg2+不仅来自碳酸盐岩、硅酸盐岩和蒸发盐岩的溶解,还有其他重要来源,如阳离子交替吸附作用等[35]. 调查发现研究区存在大量水泥加工厂,CaCl2是白水泥生产过程中的有效矿化剂和增白剂,DB-3和DX-30分别位于人工沟渠和小池塘旁,推测DB-3及DX-30中Ca2+和Mg2+还可能来源于人类活动.
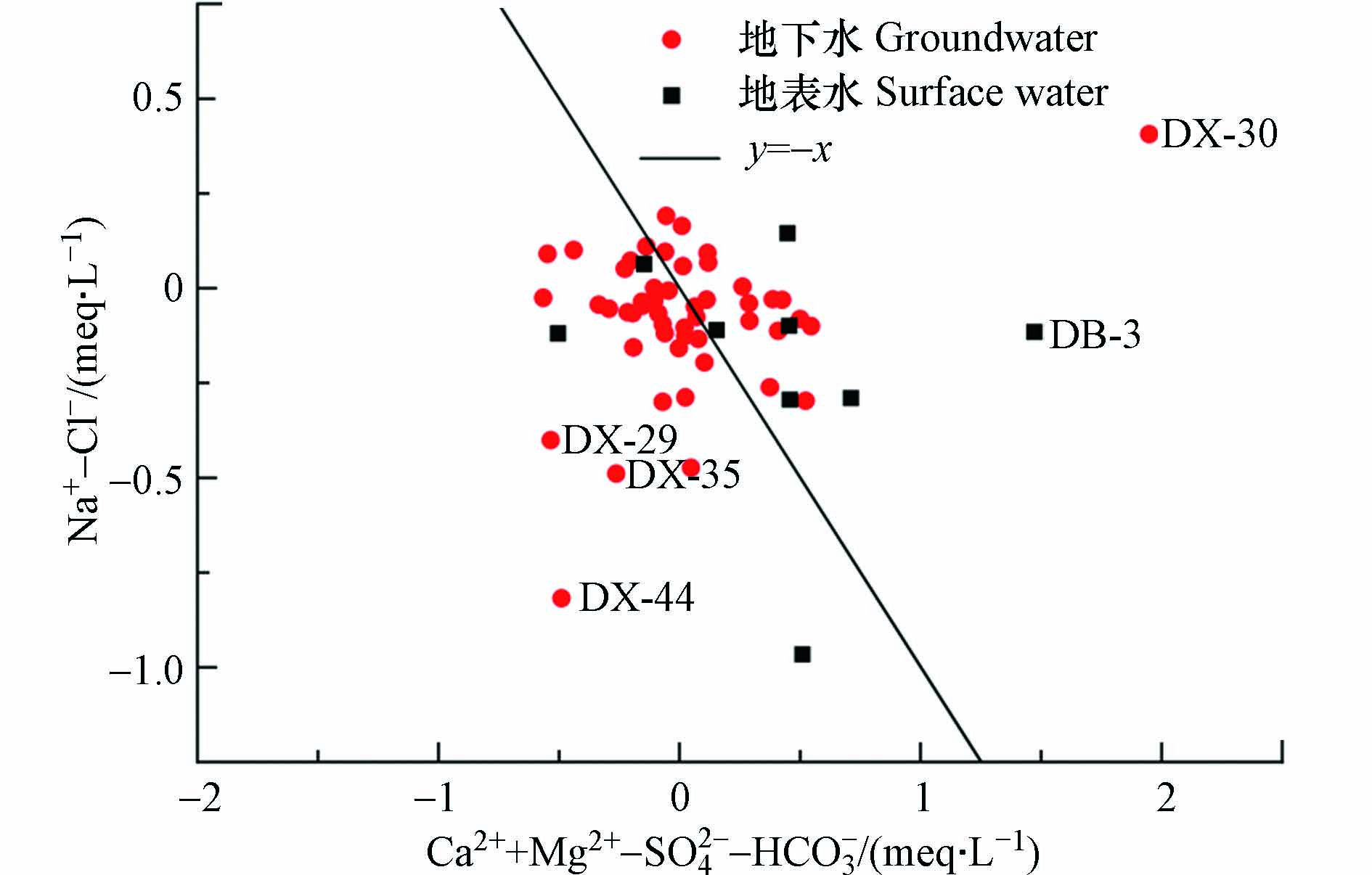
为进一步查明阳离子交替吸附作用对各水点水化学成分的影响,运用(Ca2++Mg2+)-(HCO3−+SO42−)与(Na+-Cl−)的毫克当量浓度关系揭示阳离子交替吸附作用的过程[36 − 37]. 据图8,研究区浅层地下水与地表水均大都处于1∶-1等值线的两侧,说明水文地球化学过程中阳离子交替吸附作用是控制地下水和地表水水化学的主要机制. 水样点DB-3和DX-30在1∶-1等值线右上方,是由于其Ca2+和Mg2+除来自于碳酸盐岩、硅酸盐岩和蒸发盐岩的溶解外,还有阳离子交替吸附和人类活动的影响[35],与图7结果一致. 部分水样点(DX-29、DX-35、DX-44)偏离1∶-1等值线位于左下方,说明Ca2+和Mg2+相较于SO42−处于贫化状态,且地下水中SO42−含量也较高,需要进一步探讨.
为此,利用(Ca2++Mg2+)-HCO3−与SO42−-Na++Cl−的毫克当量比值进一步分析SO42−来源[20]. (Ca2++Mg2+)-HCO3−代表水体中石膏溶解产生的Ca2+浓度,SO42−-Na++Cl−代表石膏溶解产生的SO42−浓度. 图9显示研究区大部分水样点均处于1∶1等值线两侧,表明水体中SO42−主要来自于石膏的溶解. 部分点位于1∶1等值线上方,如DB-3和DX-30,结合前期的分析结果(图7、图8),主要是地下水受到了水泥生产等人为因素的影响所致. 还有部分点处于直线较下方(DB-7、DX-29、DX-35、DX-44等),水点主要位于居民生活区,附近人类活动特征显著,如养殖、厕所等,且这些点的Cl−和SO42−呈现同步分布趋势,结合主成分分析推断,这部分水点也归因于人为污染的影响[38]. 因此,研究区地表水和地下水中SO42−主要受到石膏溶解和人为因素的控制.
2.3.3 人为因素的影响
自然状态下NO3−的环境本底浓度较低,NO3−是反应人类活动的特征离子[39],多来自于农业活动中化肥和农药的使用以及粪便和生活污水的排放[28]. 由表1可知,研究区域浅层地下水NO3−的浓度介于0—27.08 mg·L−1之间,平均值为8.06 mg·L−1,标准差为6.94‰,部分水点超过WHO的饮用水推荐值(20 mg·L−1);地表水NO3−的浓度介于0—33.66 mg·L−1之间,平均值为6.45 mg·L−1,标准差为9.83‰,10%的样品NO3−浓度超过20 mg·L−1. 主成分分析结果表明Cl−、SO42−和NO3−具有共同的人为污染来源(表2). 此外,研究区附近常年有居民居住,显然人为污染是研究区地表水和地下水水化学组成的另一重要影响因素.
[NO3−/Cl−]与[Cl−]及[SO42−/Ca2+]与[NO3−/Na+]的浓度关系常被用来判断NO3−的来源[21 − 22]. 如图10所示,地下水和地表水的[NO3−/Cl−]及[NO3−/Na+]大都大于0.5,而[Cl−]和[SO42−/Ca2+]则大都小于0.5,表明研究区内地下水和地表水中NO3−大部分来自于农业活动,少部分来自于工业活动、粪便和生活污水,与以往研究结果一致[40]. 调查发现,赣州市农村年氮肥使用量为265271 t,复合肥使用量为288906 t,均位于全省第一,磷肥使用量是131062 t,农药使用量达15444 t,也均位于全省前列. 随着化肥、农药的大量使用,农业污染是造成地下水NO3−污染的重要因素[41]. 野外调查也发现周边山体存在大量养殖场和果树,进一步证明了研究区地下水中NO3−主要来源于上游农业和养殖业受污染的水[42].
2.3.4 正向演替模型
为了量化大气输入、人类活动以及岩石风化(碳酸盐岩、硅酸盐岩和蒸发盐岩)对地下水水化学组分的相对贡献,采用正向演替模型分析各因素的主控作用[23]. Chetelat等[43]提出硅酸盐提供的Mg2+与Na+物质的量比值介于0.15—0.25之间,蒸发盐岩提供的Ca2+与Na+和Mg2+与Na+的比值分别介于0.15—5和0.01—0.5之间. Li等[24]认为蒸发盐岩风化末端构件的Na+/Cl−及SO42−/Ca2+的物质的量比均为1,Ca2+/Na+及Mg2+/K+则介于0.17—0.84和0.11—0.88之间. Gaillardet等[44]提出蒸发盐岩风化末端构件的HCO3−/Na+的物质的量比介于1—3之间. 根据上述相关文献,可知硅酸盐贡献各离子的比例关系为K+∶Ca2+∶Na+∶Mg2+∶HCO3−=2∶2∶5∶1∶12.5,蒸发盐贡献各离子的比例为SO42−∶Ca2+∶Mg2+∶Na+∶Cl−=15∶15∶9∶100∶100. 利用质量守恒计算出大气输入、人类活动以及岩石风化中各离子组成浓度,结果表明,大气输入、人类活动和岩石风化的相对贡献平均值分别为12.50%±7.75%、8.76%±4.94%以及78.74%±10.92%,说明岩石风化是该岩溶区浅层地下水成分的主要来源,与前文利用Gibbs模型判断地下水水化学组成来源的结果一致. 在岩石风化中碳酸盐岩、硅酸盐岩和蒸发盐岩的贡献平均值分别为67.64%±13.97%、7.33%±7.90%以及3.77%±3.62%,说明碳酸盐岩风化对地下水成分的贡献最大,硅酸盐岩与蒸发盐岩对于地下水成分的贡献较小. 前人研究也显示岩溶地下水化学组成主要受碳酸盐风化作用的影响,硅酸盐岩与蒸发盐岩的控制作用较弱[45 − 46],与本文研究结果吻合.
结合Mg2+/Ca2+和Na+/Ca2+的物质的量比值关系(图6B)可知,碳酸盐岩中的白云岩和灰岩对地下水成分贡献较大. 采用三端元混合模型,定量计算白云岩和灰岩对地下水化学组成来源的贡献率. 如表4所示,灰岩对研究区碳酸盐的贡献最大,平均贡献率达60.33%,白云岩平均贡献率达29.76%,硅酸盐平均贡献率仅有9.91%,表明岩溶区地下水化学组成主要受以灰岩和白云岩为主的碳酸盐岩溶解的控制. 通过本次研究,初步查明研究区浅层地下水的形成机制,揭示了研究区地下水的水质状况,为解决赣南岩溶区缺水问题提供了科学依据.
表 4 灰岩、白云岩和硅酸盐岩对地下水化学组成来源贡献率Table 4. Contribution rate of limestone, dolomite and silicate rock to chemical composition of groundwater类型Type 指标Index 不同来源平均贡献率/%Contribution rate of different sources/% 石灰岩Limestone 白云岩Dolomite 硅酸盐岩Carbonate rocks 碳酸盐岩 平均值 60.33 29.76 9.91 最大值 100.00 100.00 39.60 最小值 ND. ND ND. 标准差 1.56 1.58 0.10 3. 结论(Conclusion)
(1)研究区浅层地下水整体上呈弱碱性,阴离子浓度表现为HCO3−>Cl−>NO3−>SO42−,HCO3− 占总阴离子浓度的79.5%,阳离子浓度表现为Ca2+>Mg2+>Na+>K+,Ca2+占总阳离子浓度的72.9%,水化学类型以HCO3-Ca型为主.
(2)地下水氢氧稳定同位素分布在当地大气降水线附近,指示地下水主要受大气降水补给,且发生地表水和地下水的交互作用.
(3)地下水水化学组成来源的主控因素是岩石风化和人类活动,其中Ca2+、Mg2+以及HCO3−主要来源于碳酸盐、硅酸盐和蒸发盐的溶解,其次为阳离子交替吸附作用或人类活动的控制,Cl−、SO42−及NO3−反映了农业活动、工业活动、粪便和生活污水等人为因素的影响,Na+、K+主要来源于硅酸盐溶解.
(4)通过正向演替模型可知,岩石风化对地下水成分的平均贡献为78.74%,大气输入和人类活动相对较小,分别占12.50%和8.76%. 在岩石风化中碳酸盐岩所占贡献最大(平均值67.64%),硅酸盐岩(平均值7.33%)与蒸发盐岩(平均值3.77%)对于地下水成分的贡献较小;其中碳酸盐岩中灰岩的贡献最大,平均贡献率达60.33%,其次为白云岩,平均贡献率达29.76%.
-
表 1 La-LBCZ吸附磷的动力学模型拟合参数
Table 1. Fitting parameters of phosphorus adsorption kinetics model on La-LBCZ
初始溶液磷质量浓度/(mg·L−1) 准一级动力学 准二级动力学 k1/(min−1) qe/(mg·g−1) R2 k2/(min−1) qe/(mg·g−1) R2 50 0.023 57.94 0.941 0.001 63.61 0.981 30 0.022 40.25 0.921 0.001 44.04 0.974 10 0.089 16.76 0.939 0.007 18.27 0.981 表 2 La-LBCZ吸附磷的颗粒内扩散模型拟合参数
Table 2. Fitting parameters of intraparticle diffusion model for phosphorus adsorption on La-LBCZ
初始溶液磷质量浓度/(mg·L−1) 第1阶段 第2阶段 第3阶段 kd1/(mg·(g·min0.5)−1) C1 R2 kd2/(mg·(g·min0.5)−1) C2 R2 kd3/(mg·(g·min0.5)−1) C3 R2 50 6.706 −4.63 0.878 1.534 30.09 0.960 0.122 58.78 0.886 30 2.899 4.67 0.957 3.449 22.55 0.958 0.002 42.03 0.983 10 1.582 4.62 0.991 1.013 7.56 0.989 0.001 17.84 0.906 表 3 La-LBCZ的吸附等温模型拟合参数
Table 3. Fitting parameters of adsorption isotherm model on La-LBCZ
温度/ ℃ Langmuir模型 Freundlich模型 qm/(mg·g−1) KL/(L·mg−1) R2 KF/(g·(mg·min)−1) 1/n R2 15 86.95 0.116 0.975 25.676 0.222 0.930 30 91.09 0.554 0.954 36.570 0.178 0.939 45 99.81 0.972 0.975 44.581 0.159 0.912 表 4 La-LBCZ的吸附热力学参数
Table 4. Adsorption thermodynamic parameters of La-LBCZ
温度/℃ lnK ΔG/(kJ·mol−1) ΔH/(kJ·mol−1) ΔS/(J·(mol·K)−1) 15 1.31 -3.25 22.21 85.43 30 1.74 -4.53 45 2.13 -5.81 表 5 La-LBCZ的BET分析
Table 5. BET analysis of La-LBCZ
样品 总比表面积/(m²·g−1) 总容积/(cm³·g−1) 介孔容积/(cm³·g−1) 平均孔径/nm LBCZ 287.88 0.25 0.22 4.84 LBCZ-P 270.65 0.22 0.21 4.77 La-LBCZ 148.32 0.31 0.28 11.10 La-LBCZ-P 116.32 0.24 0.22 9.67 -
[1] LIAO Y, CHEN S, ZHENG Q, et al. Removal and recovery of phosphorus from solution by bifunctional biochar[J]. Inorganic Chemistry Communications, 2022, 139: 1-11. [2] PAYEN S, COSME N, ELLIOTT A H. Freshwater eutrophication: Spatially explicit fate factors for nitrogen and phosphorus emissions at the global scale[J]. International Journal of Life Cycle Assessment, 2021, 26(2): 388-401. doi: 10.1007/s11367-020-01847-0 [3] DAI Y, WANG W, LU L, et al. Utilization of biochar for the removal of nitrogen and phosphorus[J]. Journal of Cleaner Production, 2020, 257: 1-15. [4] WANG X, CHANG V W-C, LI Z, et al. Co-pyrolysis of sewage sludge and organic fractions of municipal solid waste: Synergistic effects on biochar properties and the environmental risk of heavy metals[J]. Journal of Hazardous Materials, 2021, 412: 1-12. [5] ZHOU H, BROWN R C, WEN Z. Biochar as an additive in anaerobic digestion of municipal sludge: Biochar properties and their effects on the digestion performance[J]. Acs Sustainable Chemistry & Engineering, 2020, 8(16): 6391-6401. [6] LI Y H, CHANG F M, HUANG B, et al. Activated carbon preparation from pyrolysis char of sewage sludge and its adsorption performance for organic compounds in sewage[J]. Fuel, 2020, 266: 1-11. [7] WANG Z, XIE L, LIU K, et al. Co-pyrolysis of sewage sludge and cotton stalks[J]. Waste Management, 2019, 89: 430-438. doi: 10.1016/j.wasman.2019.04.033 [8] HSU D, LU C, PANG T, et al. Adsorption of ammonium nitrogen from aqueous solution on chemically activated biochar prepared from sorghum distillers grain[J]. Applied Sciences-Basel, 2019, 9(23): 1-16. [9] ELKHLIFI Z, SELLAOUI L, ZHAO M, et al. Lanthanum hydroxide engineered sewage sludge biochar for efficient phosphate elimination: mechanism interpretation using physical modelling[J]. Science of the Total Environment, 2022, 803: 1-12. [10] TANG Q, SHI C, SHI W, et al. Preferable phosphate removal by nano-La(III) hydroxides modified mesoporous rice husk biochars: Role of the host pore structure and point of zero charge[J]. Science of the Total Environment, 2019, 662: 511-520. doi: 10.1016/j.scitotenv.2019.01.159 [11] HE Y, LIN H, DONG Y, et al. Preferable adsorption of phosphate using lanthanum-incorporated porous zeolite: Characteristics and mechanism[J]. Applied Surface Science, 2017, 426: 995-1004. doi: 10.1016/j.apsusc.2017.07.272 [12] ZONG E, LIU X, WANG J, et al. Facile preparation and characterization of lanthanum-loaded carboxylated multi-walled carbon nanotubes and their application for the adsorption of phosphate ions[J]. Journal of Materials Science, 2017, 52(12): 7294-7310. doi: 10.1007/s10853-017-0966-0 [13] HOLLISTER C C, BISOGNI J J, LEHMANN J. Ammonium, nitrate, and phosphate sorption to and solute leaching from biochars prepared from corn stover (Zea mays L. ) and oak wood (Quercus spp. )[J]. Journal of Environmental Quality, 2013, 42(1): 137-144. doi: 10.2134/jeq2012.0033 [14] LIAO T, LI T, SU X, et al. La(OH)3-modified magnetic pineapple biochar as novel adsorbents for efficient phosphate removal[J]. Bioresource Technology, 2018, 263: 207-213. doi: 10.1016/j.biortech.2018.04.108 [15] NGUYEN T A H, NGO H H, GUO W S, et al. Modification of agricultural waste/by-products for enhanced phosphate removal and recovery: Potential and obstacles[J]. Bioresource Technology, 2014, 169: 750-762. doi: 10.1016/j.biortech.2014.07.047 [16] GUO Y, HUANG W, CHEN B, et al. Removal of tetracycline from aqueous solution by MCM-41-zeolite A loaded nano zero valent iron: Synthesis, characteristic, adsorption performance and mechanism[J]. Journal of Hazardous Materials, 2017, 339: 22-32. doi: 10.1016/j.jhazmat.2017.06.006 [17] 桑倩倩, 王芳君, 赵元添, 等. 铁硫改性生物炭去除水中的磷[J]. 环境科学, 2021, 42(5): 2313-2323. doi: 10.13227/j.hjkx.202008302 [18] ZHAO X, JIANG T, DU B. Effect of organic matter and calcium carbonate on behaviors of cadmium adsorption-desorption on/from purple paddy soils[J]. Chemosphere, 2014, 99: 41-48. doi: 10.1016/j.chemosphere.2013.09.030 [19] LIU Y, HU X. Kinetics and thermodynamics of efficient phosphorus removal by a composite fiber[J]. Applied Sciences-Basel, 2019, 9(11): 1-19. [20] LI Z, LIU X, WANG Y. Modification of sludge-based biochar and its application to phosphorus adsorption from aqueous solution[J]. Journal of Material Cycles and Waste Management, 2020, 22(1): 123-132. doi: 10.1007/s10163-019-00921-6 [21] 许润, 石程好, 唐倩, 等. 氢氧化镧改性介孔稻壳生物炭除磷性能[J]. 环境科学, 2019, 40(4): 1834-1841. doi: 10.13227/j.hjkx.201809140 [22] 张海婷, 张永敏, 王天慧, 等. 镧改性介孔材料对砷、磷的吸附[J]. 环境工程学报, 2019, 13(8): 1791-1799. doi: 10.12030/j.cjee.201811112 [23] 周可人, 张世熔, 彭雅茜, 等. 镧、锆改性油菜杆和菱角壳去除养猪废水中的磷[J]. 环境工程学报, 2021, 15(1): 20-29. doi: 10.12030/j.cjee.202002147 [24] ZHANG L, ZHOU Q, LIU J, et al. Phosphate adsorption on lanthanum hydroxide-doped activated carbon fiber[J]. Chemical Engineering Journal, 2012, 185: 160-167. [25] 孙晓菲, 陈桂芳, 安东海, 等. 粉末活性焦对水中磷酸盐的吸附性能[J]. 中国环境科学, 2019, 39(9): 3797-3806. doi: 10.3969/j.issn.1000-6923.2019.09.024 [26] 宋小宝, 何世颖, 冯彦房, 等. 载镧磁性水热生物炭的制备及其除磷性能[J]. 环境科学, 2020, 41(2): 773-783. doi: 10.13227/j.hjkx.201906088 [27] QU J, AKINDOLIE M S, FENG Y, et al. One-pot hydrothermal synthesis of NaLa(CO3)2 decorated magnetic biochar for efficient phosphate removal from water: Kinetics, isotherms, thermodynamics, mechanisms and reusability exploration[J]. Chemical Engineering Journal, 2020, 394: 1-10. [28] HUANG H-J, YUAN X-Z. The migration and transformation behaviors of heavy metals during the hydrothermal treatment of sewage sludge[J]. Bioresource Technology, 2016, 200: 991-998. doi: 10.1016/j.biortech.2015.10.099 [29] AGRAFIOTI E, BOURAS G, KALDERIS D, et al. Biochar production by sewage sludge pyrolysis[J]. Journal of Analytical and Applied Pyrolysis, 2013, 101: 72-78. doi: 10.1016/j.jaap.2013.02.010 [30] YIN X, XI M, LI Y, et al. Improvements in physicochemical and nutrient properties of sewage sludge biochar by the co-pyrolysis with organic additives[J]. Science of the Total Environment, 2021, 779: 1-12. [31] HUANG H J, YANG T, LAI F Y, et al. Co-pyrolysis of sewage sludge and sawdust/rice straw for the production of biochar[J]. Journal of Analytical and Applied Pyrolysis, 2017, 125: 61-68. doi: 10.1016/j.jaap.2017.04.018 -




 下载:
下载: