-
近年来,我国污水排放总量不断增加,大量的污染物排放到水环境中将给水环境造成严重影响,城市污水处理是关系国计民生的重要问题。城市污水处理厂作为城市重要的基础设施之一,在水环境污染防治和生态文明建设方面发挥重要作用。活性污泥法因其高效、经济、环保等优点,成为我国乃至世界上大部分城市污水处理厂普遍采用的工艺[1]。活性污泥作为活性污泥工艺的主体,含有高度复杂的微生物群落,构成一种独特的微生物生态系统,并依靠这些微生物降解有机物、营养物质等,从而实现活性污泥系统稳定运行和良好处理性能[2-3]。马切切等[4]对活性污泥微生物群落结构及与环境因素响应关系研究发现,温度与Nitrospira、Aquihabitans、Terrimonas和Dechloromona等多种关键的脱氮微生物呈负相关,当温度低于15 ℃时,污水处理厂对TN和NH4+-N的去除率仅有49.67%和63.19%;Zoogloea、Arcobacter、Acidovorax和Acinetobacter等优势功能性菌属相对丰度越高,污染物的去除率也越高。因此,污水处理厂的稳定运行在很大程度上依赖于系统微生物群落的特征,特别是一些功能菌的多样性、丰度。深入分析、研究污水处理厂系统中微生物群落组成、功能菌的生理特性,从而选择性调控微生物群落,对于提高污水处理厂活性污泥处理能力具有至关重要的意义。
群体感应(quorum sensing,QS)是微生物间通过自发产生、释放并接收特定化学信号而建立起来的一种通讯机制,所依赖的化学信号分子就是他们的“通讯语言”[5]。近年来,群体感应在有机物降解、生物脱氮等废水生物处理过程中的调控作用受到越来越多的关注[6-8]。LI等[6]在不同乙酸/油酸比条件下对序批式反应器(sequencing batch reactor,SBR)进行了研究,发现N酰化高丝氨酸内脂(N-acyl homoserine lactones,AHLs)介导的群体感应对化学需氧量(COD)和总氮(TN)去除、污泥沉降性等均具有显著的调控作用。WANG等[8]总结了AHLs介导的群体感应在废水生物反应器氮代谢效率、颗粒聚集和生物膜的形成等方面的调控作用。大量研究[9-10]表明,群体感应在废水生物处理中发挥重要作用。因此,本研究对天津市某城市污水处理厂进行了为期1 a的监测研究,重点分析了其微生物群落结构特征和群体感应信号分子变化以探索污水处理厂活性污泥系统的群体感应调控作用,以期为提升污水处理厂处理能力及稳定性提供参考。
-
对天津市某城市污水处理厂的曝气池活性污泥进行样本采集,该城市污水处理厂主体采用A/O处理工艺,并辅以化学法去除尾水中余磷。采样时间为2019年1月、3月、5月、7月、9月和11月中旬,分别命名为S1、S3、S5、S7、S9和S11。样品采集后于−80 ℃保存,待所有样品收集完毕后进行测序。每月的5、15、25日取活性污泥混合液用于群体感应信号分子的提取和检测。
-
AHLs类信号分子采用Bond Elut ENV固相萃取柱(500 mg,6 mL,Agilent)进行固相萃取,具体操作步骤如下:用0.45 μm滤膜过滤水样,分别用5 mL甲醇(Fisher Scientific,LC-MS级)和5 mL纯水活化Bond Elut ENV固相萃取柱,然后以5~10 mL·min−1的速度将过滤后的水样载入固相萃取柱,之后用5mL 5%甲醇水溶液淋洗,待固相萃取柱抽干后用10 mL甲醇(Fisher Scientific,LC-MS级)洗脱萃取的AHLs信号分子,并收集洗脱液。将洗脱液用旋转蒸发仪脱溶后,使用初始流动相定容至2 mL,采用高效液相色谱(Agilent 1290 Infinity II)-质谱(Agilent 6470)联用仪参考LI等[11]采用的方法对AHLs进行定量分析。
-
待所有活性污泥样本收集完毕后送往苏州金唯智生物科技有限公司进行DNA提取。使用Magen Hipure Soil DNA Kit从污泥样品中提取DNA,并使用Qubit® dsDNA HS Assay Kit 检测DNA样品浓度。采用金唯智设计的包含“CCTACGGRRBGCASCAGKVRVGAAT”序列的上游引物和包含“GGACTACNVGGGTWTCTAATCC”序列的下游引物对V3和V4这2个高度可变区进行扩增。对扩增纯化后的DNA通过Illumina MiSeq测序平台进行2×250bp双端测序。
-
对序列进行质量过滤、去除嵌合体后采用VSEARCH(1.9.6)进行OTU聚类(97%相似度),利用RDP classifier贝叶斯算法对OTU进行分类学注释,参考数据库为Silva 132。根据OTU结果进行α多样性指数分析,通过主坐标分析(PCoA)比较各样本间微生物群落差异,利用Tax4Fun进行功能预测分析[12]。
-
本研究中城市污水处理厂不同活性污泥样本微生物α多样性指数如表1所示。由表1可知,所有活性污泥样本的覆盖率均不低于99.8%。这表明样本中的绝大部分微生物均被检测到,测序结果可以反映样本的真实情况。S5样本的ACE指数和Chao指数是所有样本中最低的,表明5月份微生物群落的丰富度较其他时期较低。这是由于此时处于污泥膨胀恢复期,样本内微生物的种类较少。Shannon指数和Simpson指数均反映样本的多样性,Shannon指数可以反映物种均匀度,其值越大表示物种均匀性更高,Simpson指数越大,其多样性越大。而9月份污泥样本的Shannon指数和Simpson指数比其他时期内污泥样品低,表明9月份样品中微生物群落的均匀度和多样性最低。这可能是由于9月份系统运行温度及运行条件适宜某些功能微生物生长,其相对丰度较高,从而使整个系统微生物群落的均匀度降低(Shannon指数低),同时部分微生物无法适应该运行条件而被演替使整个系统微生物多样性降低(Simpson指数降低)。
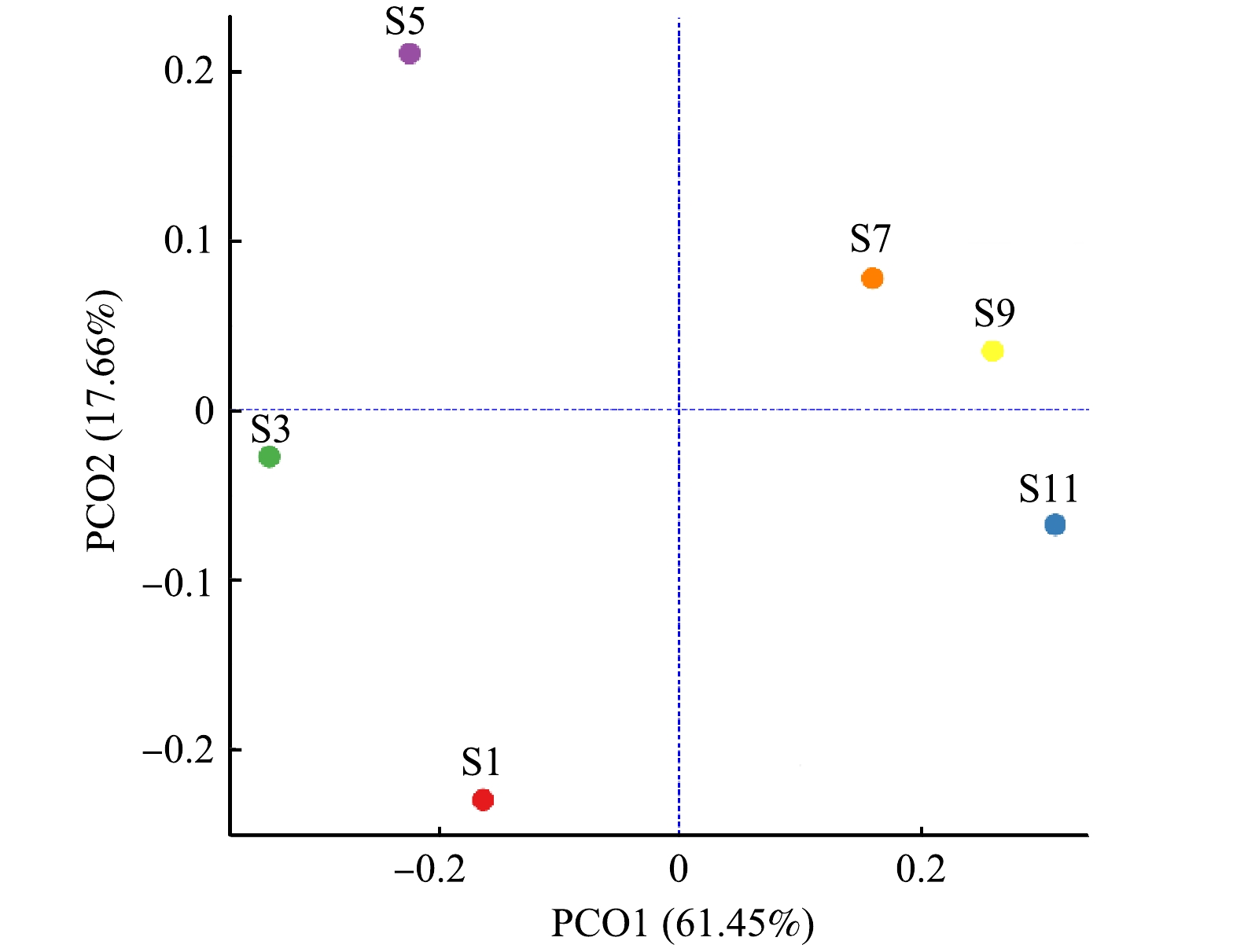
为分析不同样本间群落组成的差异性,基于Bray-Curtis距离算法,采用PCoA分析衡量样本间物种多样性差异,结果如图1所示。由图1可知,PCO1与PCO2分别解释方差为61.45%和17.66%,累计解释能力达79.11%,PCO1将样本S1、S3、S5的OTU与S7、S9和S11明显区分开,样本S1、S3、S5的污泥处于污泥膨胀状态和污泥膨胀恢复状态,样本相似性高;而S7、S9和S11均处于污泥正常状态,故具有高度相似性。同时,注意到S1、S3和S5之间明显分离,而S7、S9和S11之间虽然存在分离,但距离较小,表明在1—5月份污水处理厂由于发生污泥膨胀,微生物群落发生较大的变化,而7—11月份污水处理厂微生物群落差异变化不大,系统比较稳定。
-
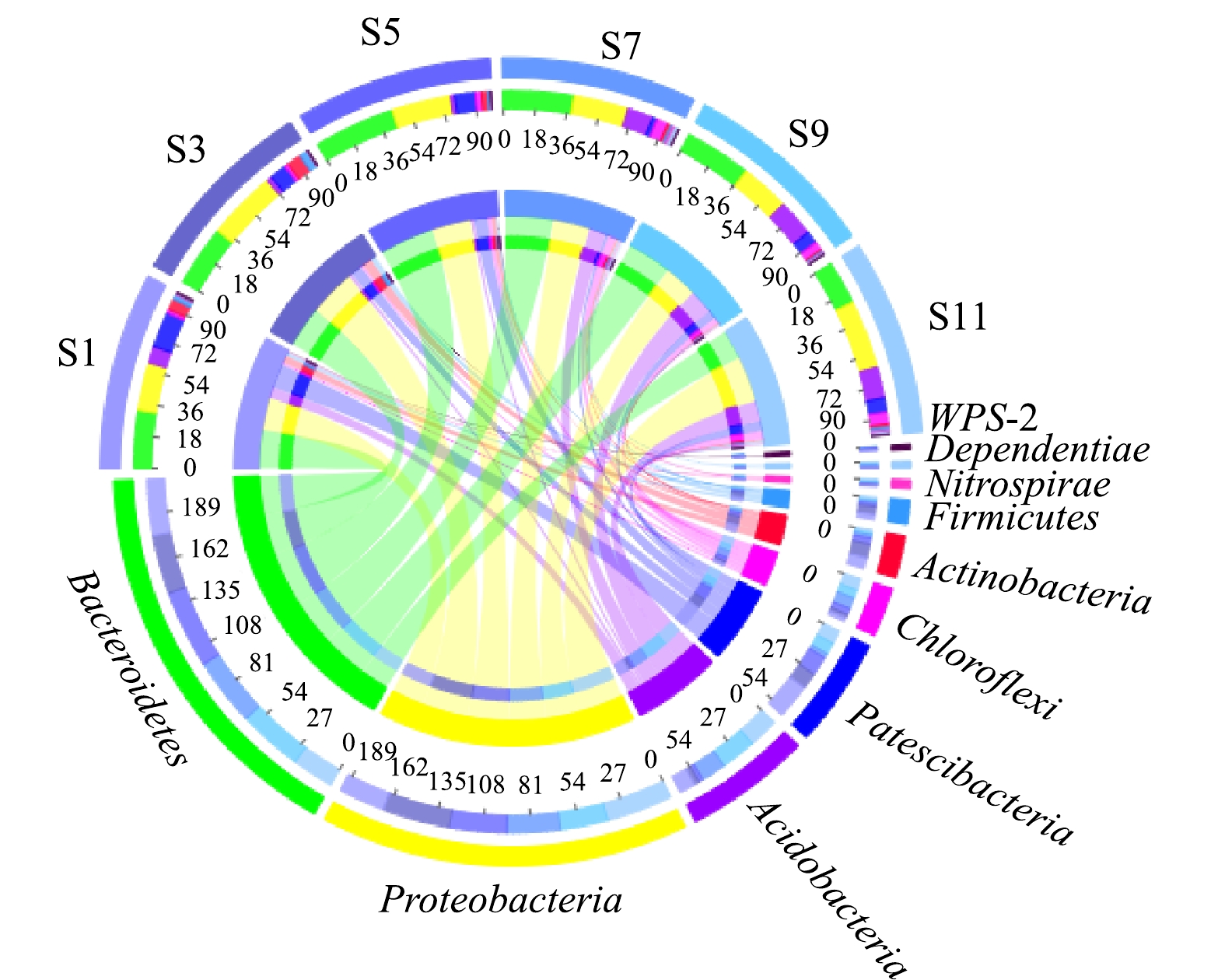
1)门水平上微生物群落结构分析。在门水平上,所有样本均检测到18~26个菌门,其中S3样本仅18个菌门,而S9和S11样本检测到26个菌门,相对丰度在前10的菌门见图2。由图2可见,S1、S3、S5样本中相对丰度较高的菌门为Bacteroidetes、Proteobacteria和Patescibacteria;而S7、S9和S11中主要优势菌门为Bacteroidetes、Proteobacteria和Acidobacteria。在活性污泥系统中,Proteobacteria和Bacteroidetes作为优势菌门已被多次报道[13-14]。在废水生物处理系统中,绝大部分具有去除有机物和脱氮除磷等功能的微生物属于Proteobacteria和Bacteroidetes菌门[14],其相对较高的丰度可保证该污水处理厂污染物的稳定去除。
同时值得注意的是,不同样本的菌门相对丰度存在较大的差异,如Actinobacteria和Chloroflexi,这可能主要是由于污水处理厂进水水质差异以及不同时间段环境温度差异所致。有研究表明,Actinobacteria和Chloroflexi是活性污泥中的主要丝状菌门,其中属于Actinobacteria的丝状菌如Candidatus Microthrix常常引发污泥膨胀,而隶属Chloroflexi的丝状菌通常充当菌胶团骨架[15]。因此,由图2可以看到,在污水处理厂发生污泥膨胀的S1和S3样本中Actinobacteria相对丰度高于其他样本,而在其他样本中Chloroflexi相对丰度比在S1和S3样本中的相对丰度高。
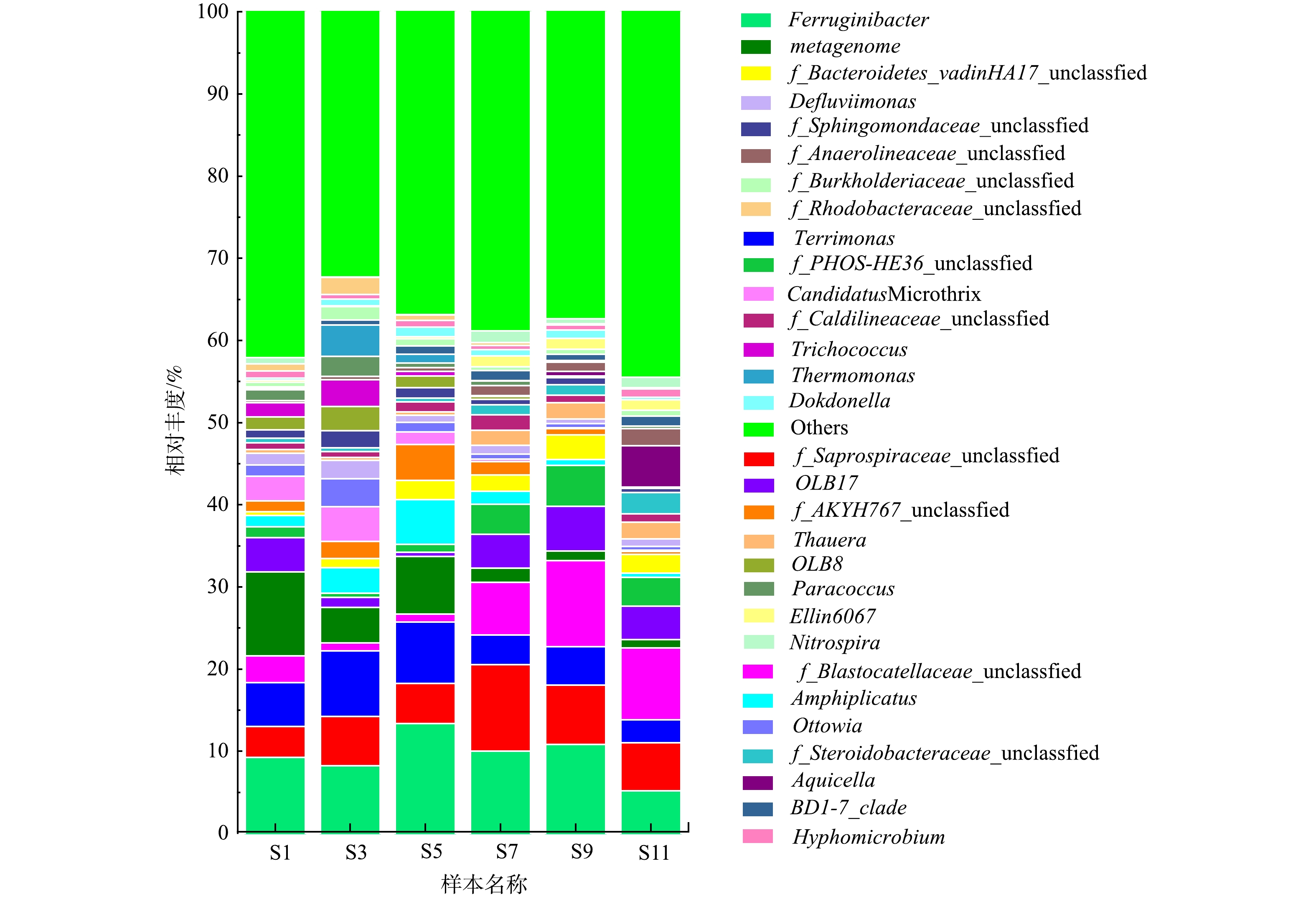
2)属水平微生物群落结构。属水平上微生物群落结构分析更有助于理解系统微生物群落的组成和演替,6个污水处理厂活性污泥样本中相对丰度前30的细菌属见图3。由图3可以看出,该污水处理厂活性污泥中主要菌属有Ferruginibacter、f_Saprospiraceae_unclassified、Terrimonas、f_Blastocatellaceae_unclassified和metagenome,相对丰度分别为5.19%~13.36%、3.73%~10.56%、2.79%~8.01%、0.96%~10.47%、1.06%~10.22%。贺赟等[16]对不同季节城市污水处理厂微生物群落研究也发现Ferruginibacter和Blastocatellaceae是污水处理厂的主要优势菌属。Ferruginibacter具有将复杂有机物分解为小分子有机物的能力[17],Blastocatellaceae能够降解复杂有机物同时可以完全还原NO- 3-N[18]。Saprospiraceae是活性污泥系统中的核心菌属,其不仅能够降解有机物和蛋白质,还具有反硝化除磷能力[19]。Terrimonas是一种典型的反硝化菌[20]。综上所述,这些优势菌属均为能够去除污染物的功能菌,其较高的相对丰度保证了污水处理厂的稳定运行。
同时可以注意到,经常报道能够引发活性污泥膨胀的一种丝状菌属Candidatus Microthrix [21]有被检测到。由图3可以看到,污水处理厂S1和S3样本中Candidatus Microthrix相对丰度较高,分别为3.03%和4.24%,在S5和S7样本中其相对丰度降低至1.49%和0.28%,并在S9和S11中相对丰度进一步降低。在1—3月份,该污水处理厂发生污泥膨胀,污泥SVI均在150 mL·g−1以上,自3月下旬开始其逐渐降低,污泥沉降性能逐渐恢复。由此可以推断,该污水处理厂污泥沉降性能的恶化主要是由于Candidatus Microthrix过度生长所导致,这与春季低温条件利于Candidatus Microthrix的生长有关[21]。故Candidatus Microthrix是1—3月份引发污泥膨胀的主要菌属。这与WANG等[22]对北方城市污水处理厂研究发现是冬春季节引发污泥膨胀的主要菌属是Candidatus Microthrix的研究结果是一致的。
3)功能菌群分析。功能菌群对污水处理厂的稳定运行具有重要作用,活性污泥系统中目前已报道的主要功能菌群有聚糖菌(GAO)、聚磷菌(PAO)、氨氧化菌(AOB)、亚硝酸盐氧化菌(NOB)、反硝化菌(DNB)、反硝化聚磷菌(DPB)、胞外聚合物(EPS)分泌菌等。根据对所研究污水处理厂样本在属水平上检测到的功能菌群进行分类,结果如表2所示。
典型聚糖菌Candidatus Competibacter在该污水处理厂样本内检测到,其相对丰度(0.17%~1.5%)高于典型聚磷菌Candidatus Accumulibacter的相对丰度(0.02%~0.29%),较低丰度的Candidatus Accumulibacter则会影响系统的除磷效果。Candidatus Accumulibacter与Candidatus Competibacter间的竞争关系已被多次报道,系统中Candidatus Competibacter相对丰度较高,则会抑制Candidatus Accumulibacter,使系统除磷效果较差。此外,另一种具有除磷功能的聚磷菌Tetrasphaera[23]在该污水处理厂样品中检出,且其相对丰度(0.02%~1.32%)也显著高于Candidatus Accumulibacter。Tetrasphaera也是一种引起污泥膨胀的丝状菌属,该属的丝状菌能够利用疏水性的长链脂肪酸等,使其在低温条件下占据优势生态位[34]。可以注意到,在污水处理厂发生污泥膨胀期间(1月和3月)Tetrasphaera的相对丰度较高,而非膨胀期间(9月和11月)其相对丰度较低,故该污水处理厂中检测到的Tetrasphaera可能主要是引发污泥膨胀的丝状菌。
此外,2种具有反硝化除磷功能的菌属f_Saprospiraceae_unclassified和Paracoccus也在该污水处理厂样品中检测到。对全球污水处理厂的调查研究表明,Saprospiraceae是活性污泥中的核心菌属[2],其具有代谢葡萄糖、半乳糖、特定蛋白质等能力[33]。同时,Saprospiraceae能够将亚硝酸盐氮作为电子受体,是反硝化除磷系统中的优势菌[19]。Paracoccus在缺氧条件下能够以亚硝酸盐氮为电子受体氧化厌氧条件下合成的聚β-羟基丁酸盐(PHB)以产生能量用于吸磷[24]。2种反硝化除磷功能菌的存在表明系统中存在反硝化除磷现象,且f_Saprospiraceae_unclassified和Paracoccus的相对丰度(3.73%~10.56%和0.15%~2.39%)明显高于聚磷菌Candidatus Accumulibacter的相对丰度,故该污水处理厂可能以反硝化除磷为主。
Nitrosomonas和Nitrospira分别是活性污泥中经常出现的AOB和NOB,在该污水处理厂中其相对丰度分别为0.03%~0.95%和0.04%~1.42%。在3月份和5月份的污泥样品中,Nitrosomonas和Nitrospira的相对丰度均为最低,表明Nitrosomonas和Nitrospira受污泥膨胀影响较大,污泥膨胀发生期间,丝状菌的过度生长抑制了Nitrosomonas和Nitrospira的生长。
此外,该污水处理厂污泥样品中还检测到了多种DNB菌属,丰度相对较高的是Ferruginibacter (5.19%~13.36%)、Terrimonas(2.79%~8.01%)、f_Blastocatellaceae_unclassified (0.96%~10.47%)、Amphiplicatus (0.48%~5.46%)、Ottowia (0.46%~3.41%)等。这些相对丰度较高的反硝化菌是系统实现脱氮的保证。Ferruginibacter菌属能够水解尿素、明胶等有机物,具备将大分子有机物分解为小分子的能力[17],同时也具有反硝化能力[25]。1—9月的样品中Ferruginibacter均为优势反硝化菌,11月样品中优势反硝化菌却为f_Blastocatellaceae_unclassified,故Ferruginibacter对该污水处理厂有机物的降解和脱氮具有重要作用。f_Blastocatellaceae_unclassified能够代谢复杂有机聚合物,同时它也可以利用聚羟基脂肪酸酯(PHA)完全还原硝酸盐氮[18]。故1—9月Ferruginibacter与11月f_Blastocatellaceae_unclassified优势反硝化菌转变的主要原因可能是进水水质差异(如有机物种类、含量等)所致。可以注意到,在整个研究周期内活性污泥样品中f_Blastocatellaceae_unclassified相对丰度变化比较大,污泥膨胀发生期间(3月和5月)f_Blastocatellaceae_unclassified的相对丰度较其他月份显著降低,表明其受污泥膨胀影响较大。据报道,Terrimonas是一种好氧反硝化菌属,能够还原硝酸盐氮,是改良两级A/O和传统两级A/O工艺中的优势菌属[26]。Amphiplicatus是严格好氧型细菌,具备反硝化脱氮性能,却不能水解纤维素、果胶、酪蛋白等基质[27]。Ottowia不仅报道与反硝化作用有关,还是一种重要的具有水解功能细菌,所以能够同时发挥脱氮和有机物降解的作用[28]。此外,经常报道的优势反硝化菌如Thauera等,在该污水厂中相对丰度并不高,且可以注意到在1—5月其相对丰度较低,表明其受低温影响较大。这些反硝化菌的存在保证该污水处理厂脱氮性能的稳定。
能够分泌EPS的絮凝菌也是活性污泥微生物的重要组成部分。有报道称,Terrimonas通过分泌EPS在微生物聚集体中起促进絮凝和聚集的重要作用[32]。HE等[30]总结了不同操作条件下能够产生EPS的关键功能菌,其中Thauera和Devosia能够分泌EPS并进行反硝化。这些EPS产生菌有助于维持活性污泥的聚集和稳定以及对部分营养物质的去除。
-
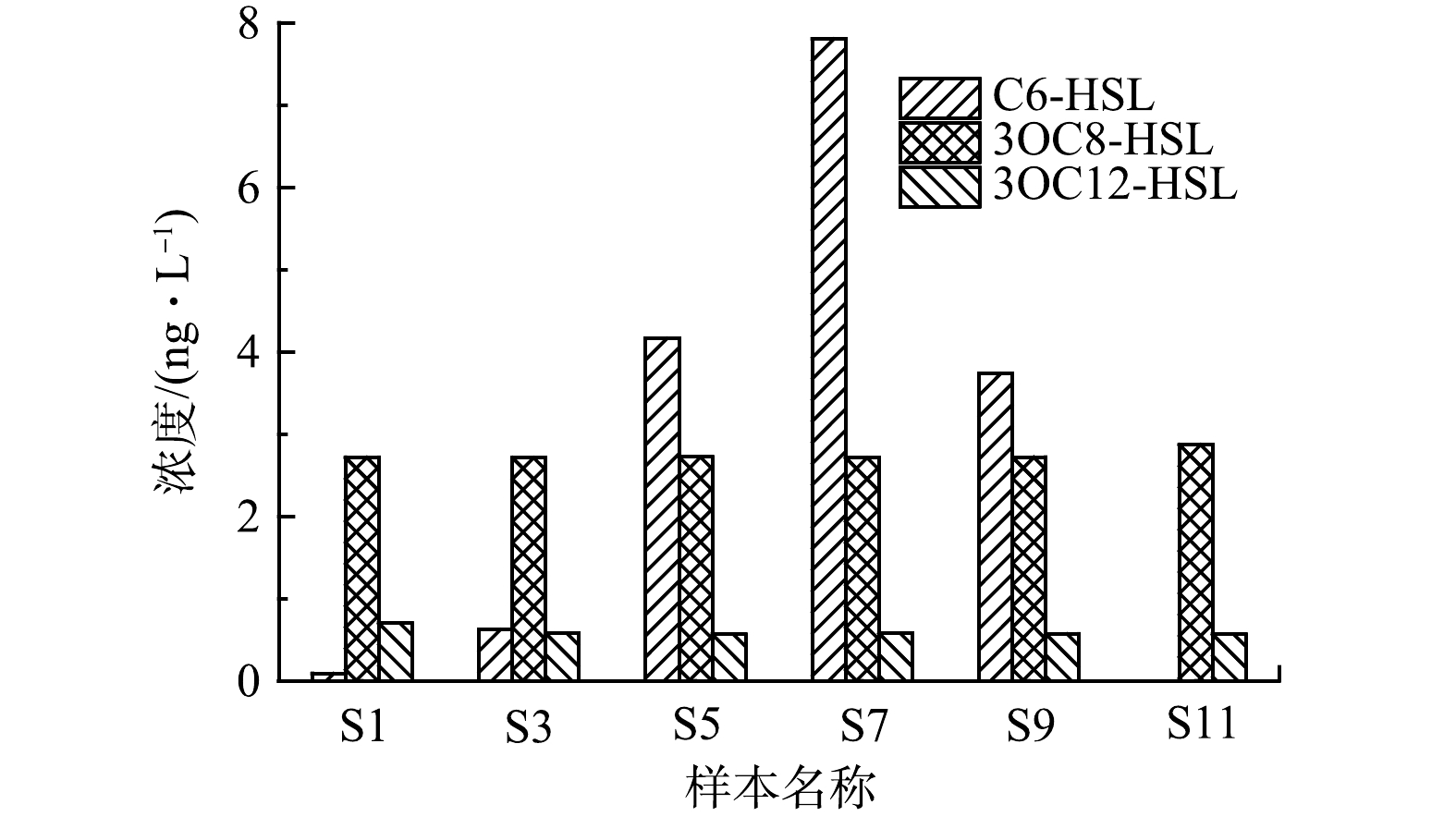
1)群体感应信号分子。在该污水处理厂样品中检测到N-己酰高丝氨酸环内酯(C6-HSL)、3-羰基辛酰基高丝氨酸内酯(3OC8-HSL)和3-羰基十二酰基高丝氨酸内酯(3OC12-HSL)共3种AHLs,其每月平均浓度变化如图4所示。由图4可知,3OC8-HSL和3OC12-HSL的质量浓度相对比较稳定,分别维持在2.7 ng·L−1和0.6 ng·L−1(略有浮动)。而C6-HSL变化较大,1—7月其质量浓度逐渐由0.09 ng·L−1升高至7.8 ng·L−1,此后又降低至3.7 ng·L−1,而在11月份样品中未检出。可以注意到,较低气温下C6-HSL浓度也较低,而较高温度下其浓度也比较高,表明C6-HSL的产生可能与温度呈现一定的相关性。另外,污泥膨胀期间,C6-HSL浓度较低,而非膨胀期间,其浓度相对比较高,故C6-HSL可能与污泥膨胀或丝状菌生长存在调控关系。
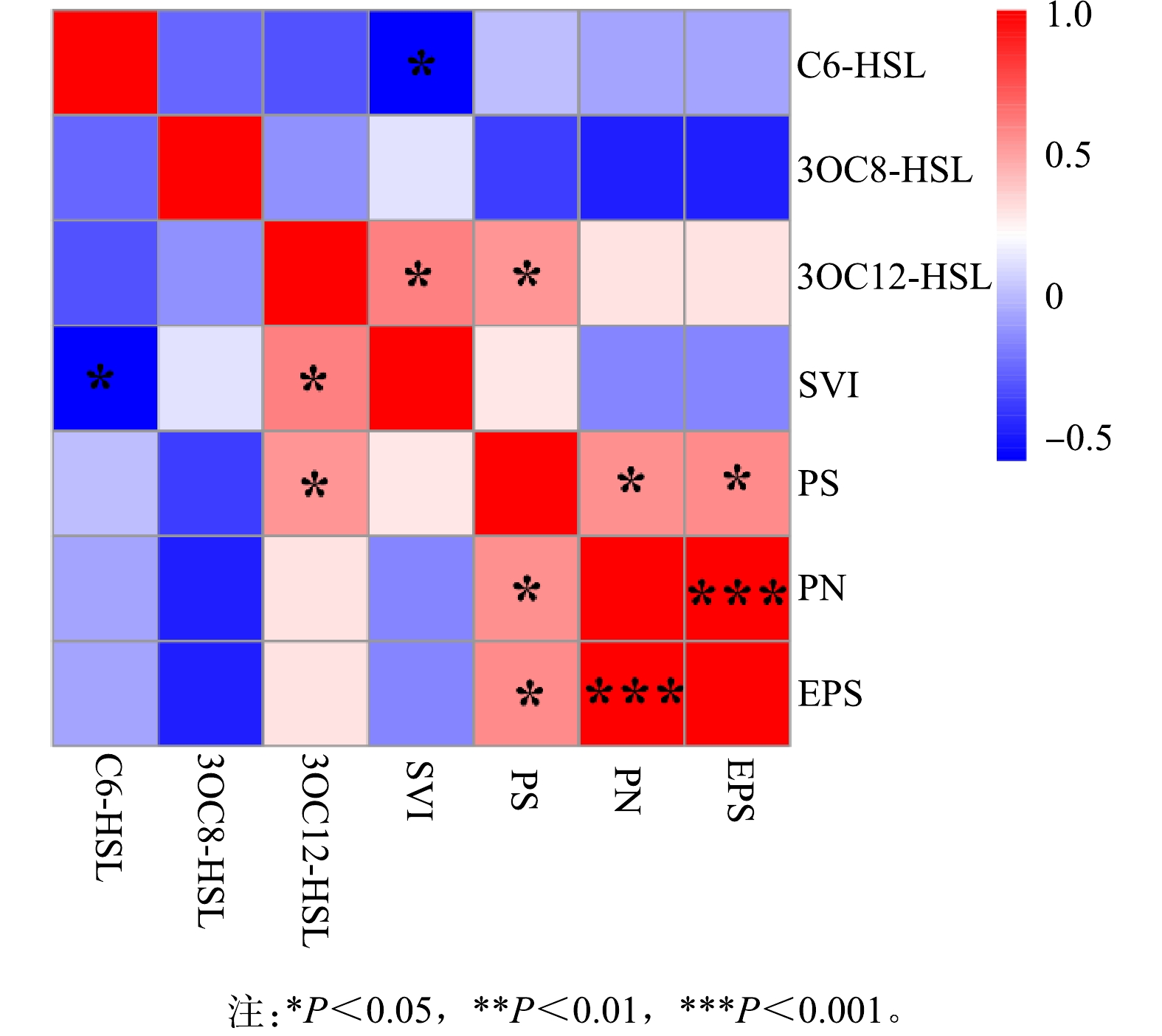
2)群体感应与污泥沉降性。为研究群体感应调控作用,进行Person相关性分析结果如图5所示。可见污泥容积指数(SVI)与C6-HSL呈显著负相关(P<0.05),与3OC12-HSL呈显著正相关(P<0.05),则C6-HSL、3OC12-HSL均与污泥沉降性有关。其中,C6-HSL能够调控抑制系统污泥膨胀的发生,使系统污泥沉降性能良好,而3OC12-HSL能够调控引发系统污泥膨胀的发生,使系统污泥沉降性能恶化。C6-HSL与污泥膨胀之间的调控作用与之前LI等[6]的研究结果是一致的,故鉴于C6-HSL对污泥膨胀的调控作用可以向发生污泥膨胀的系统中投加C6-HSL或者促进C6-HSL信号分子的产生以控制污泥膨胀。此外,3OC12-HSL与多糖(PS)含量呈显著正相关(P<0.05),表明3OC12-HSL主要调控多糖的产生。群体感应对EPS产生的调控作用在不同反应器和城市污水处理厂中均有报道,但在本研究中并没有观察到,这可能主要是工艺、运行条件等的差异[35]。
3)群体感应与微生物群落调控作用。为分析群体感应与微生物群落间的调控作用,将相对丰度前50的菌属与AHLs进行Person相关分析,与AHLs信号分子具有显著相关的细菌属只有f_Saprospiraceae_unclassified、f_Bacteroidetes_vadinHA17_unclassified、SWB02、OLB12、f_Caldilineaceae_unclassified(图6)。f_Saprospiraceae_unclassified、f_Caldilineaceae_unclassified、SWB02与C6-HSL呈显著正相关,其相关系数分别为0.913、0.864、0.904,OLB12与C6-HSL呈极显著正相关,其相关系数为0.982,表明f_Saprospiraceae_unclassified、f_Caldilineaceae_unclassified、SWB02、OLB12是主要的C6-HSL产生菌。而f_Bacteroidetes_vadinHA17_unclassified与3OC12-HSL呈显著负相关,相关系数为−0.819,表明f_Bacteroidetes_vadinHA17_unclassified是3OC12-HSL的群体淬灭菌。
-
为进一步分析该污水处理厂微生物群落的关键功能基因表达情况,采用Tax4Fun基于该污水处理厂污泥样品高通量测序进行KEGG功能基因预测,分析结果见表3。氨基酸代谢(amino acid metabolism)、碳水化合物代谢(carbohydrate metabolism)、膜转运(membrane transport)、能量代谢(energy metabolism)和辅酶因子和维生素代谢(metabolism of cofactors and vitamins)为该污水处理厂中相对丰度较高的代谢功能。氨基酸代谢(amino acid metabolism)、碳水化合物代谢(carbohydrate metabolism)、能量代谢(energy metabolism)和辅酶因子和维生素代谢(metabolism of cofactors and vitamins)均属于新陈代谢(metabolism)功能模块,而膜转运(membrane transport)属于环境信息处理(environmental information processing)功能模块。碳水化合物代谢(carbohydrate metabolism)途径可以将大分子碳水化合物分解、稳定为小分子物质,氨基酸代谢(amino acid metabolism)过程可为反硝化脱氮提供电子,能量代谢(energy metabolism)途径在ATP代谢、电子传输等能量运输中起着关键作用[36],膜转运(membrane transport)在物质运输、群体感应调控方面发挥重要作用[30],这些代谢功能保证了该污水处理厂的正常运行。可以发现一些代谢功能的相对丰度在不同样品中差异较大,可能是由进水水质、运行条件等差异所导致,从而影响污水处理厂有机物的降解、脱氮除磷等性能。
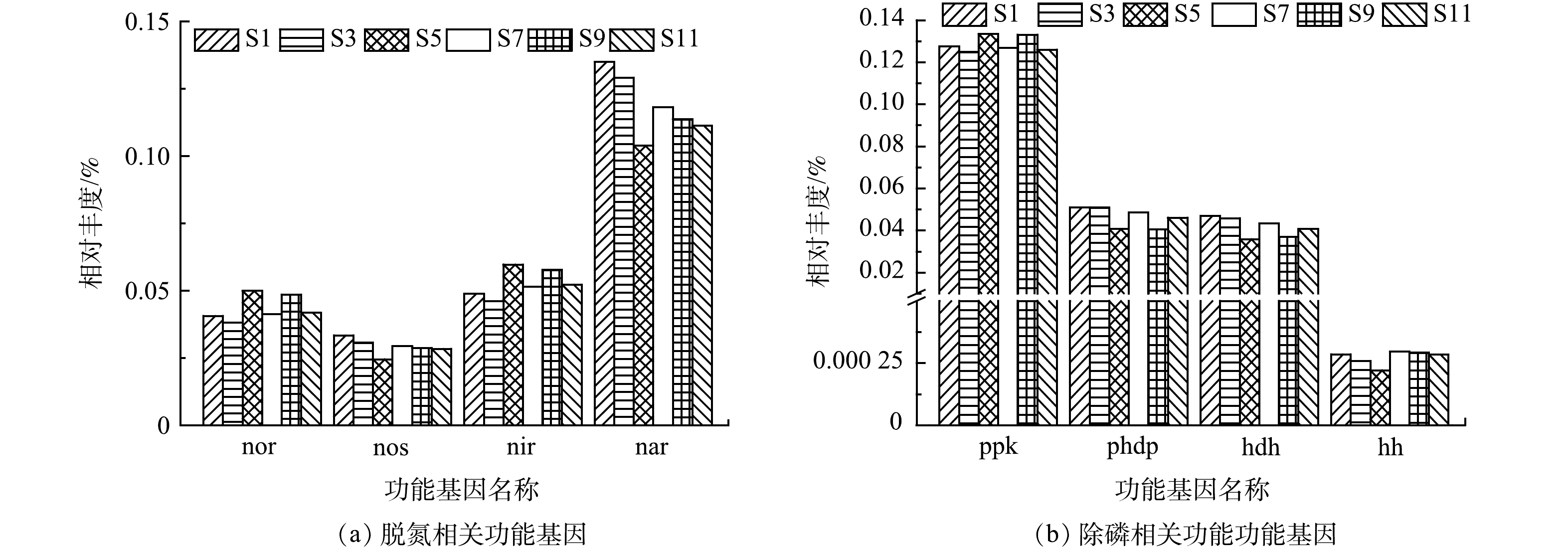
此外,通过深入分析脱氮除磷过程中相关基因的相对丰度表达情况,发现4种参与反硝化过程的nor(一氧化氮还原酶)、nos(一氧化二氮还原酶)、nir(亚硝酸盐还原酶)和nar(硝酸盐还原酶)[37],其中在硝酸盐氮还原为亚硝酸盐氮过程中起重要作用的nar(硝酸盐还原酶)相对丰度(0.104%~0.135%)明显高于其他还原酶((图7(a))。硝酸盐氮的还原是反硝化过程的第一步,是影响脱氮性能的关键过程,因此nar(硝酸盐还原酶)是影响脱氮性能的重要基因,对脱氮性能具有重要决定作用。S5样品的nar(硝酸盐还原酶)相对丰度是所有样品中最低的,同时该样品中nos(一氧化二氮还原酶)相对丰度也是最低的,表明5月份污水处理厂的脱氮性能较其他月份较差。
发现4种参与除磷相关的功能基因,其中ppk(聚磷酸盐激酶)的相对丰度(0.125%~0.133%)明显高于phdp(聚-β-羟基丁酸解聚酶,相对丰度0.041%~0.051%)、hdh(羟丁酸脱氢酶,相对丰度0.036%~0.047%)和hh(羟基丁酸二聚体水解酶,相对丰度0.000 221%~0.000 297%)。ppk(聚磷酸盐激酶)与Poly-P形成相关,而其他3种均与聚-β-羟基丁酸降解有关[37],虽然具有较高的Poly-P形成能力,但受限于较低的聚-β-羟基丁酸降解能力,导致系统的除磷能力较低,故仍需借助化学除磷实现磷的去除。S5样品中与聚-β-羟基丁酸降解有关的3种功能基因相对丰度在所有样品中最低,表明5月份污水处理厂的磷去除能力略逊于其他月份。
-
1)在1—3月污水处理厂发生污泥膨胀为微生物多样性和微生物群落结构存在差异的主要原因,Candidatus Microthrix过量生长是引发污泥膨胀的主要原因。
2) Bacteroidetes、Proteobacteria和Acidobacteria为该污水处理厂的主要优势菌门,Ferruginibacter、f_Saprospiraceae_unclassified、Terrimonas、f_Blastocatellaceae_unclassified和metagenome为该污水处理厂中主要优势菌属。Candidatus Accumulibacter、Nitrosomonas、Nitrospira、Ferruginibacter、Terrimonas等相关功能菌的存在使系统维持相对稳定运行。
3)污水处理厂中检测到C6-HSL、3OC8-HSL和3OC12-HSL3种AHLs,C6-HSL主要调控抑制系统污泥膨胀的发生,3OC12-HSL主要调控多糖的产生。群体感应与微生物群落间的调控作用分析表明f_Saprospiraceae_unclassified、f_Caldilineaceae_unclassified、SWB02、OLB12是主要的C6-HSL产生菌,f_Bacteroidetes_vadinHA17_unclassified是3OC12-HSL的群体淬灭菌。
4)功能预测分析结果表明,5月份样品中nar(硝酸盐还原酶)、nos(一氧化二氮还原酶)、phdp(聚-β-羟基丁酸解聚酶)、hdh(羟丁酸脱氢酶)和hh(羟基丁酸二聚体水解酶)相对丰度均较其他样品低,故其脱氮除磷性能均略逊于其他月份。
城市污水处理厂微生物群落特征与群体感应调控
Microbial community characteristics and their quorum sensing regulation in municipal wastewater treatment plants
-
摘要: 微生物群落在活性污泥中发挥有重要作用,为了解采用活性污泥法的城市污水处理厂微生物群落特征和群体感应调控作用,采集天津市某城市污水处理厂活性污泥样品,采用高通量测序对其微生物群落特征进行解析,并分析其群体感应调控作用。结果表明,该污水处理厂一年间活性污泥样品的微生物多样性和微生物群落结构存在一定差异性,主要是由于冬春季节发生了污泥膨胀。Ferruginibacter、f_Saprospiraceae_unclassified、Terrimonas、f_Blastocatellaceae_unclassified和metagenome等是该污水处理厂中主要优势菌属,冬春季节引发污泥膨胀的主要菌属是Candidatus Microthrix。群体感应调控作用分析表明C6-HSL能够抑制污泥膨胀,3OC12-HSL能够调控促进多糖的产生,f_Saprospiraceae_unclassified、f_Caldilineaceae_unclassified、SWB02、OLB12是主要的C6-HSL产生菌,f_Bacteroidetes_vadinHA17_unclassified是3OC12-HSL的群体淬灭菌。基于高通量测序的Tax4fun功能预测分析表明5月份污水处理厂的脱氮除磷性能均略逊于其他月份。Abstract: Microbial community plays an important role in activated sludge. To understand the microbial community characteristics and quorum sensing regulation in municipal wastewater treatment plant (WWTP) using the activated sludge process, the activated sludge samples from a municipal WWTP in Tianjin were collected, the microbial community characteristics were analysed by high-throughput sequencing, and their quorum sensing regulation was also analysed. The results showed that there were some differences in the microbial diversity and community structure of activated sludge samples during the year, which was mainly caused by sludge bulking in winter and spring. Ferruginibacter, f_Saprospiraceae_unclassified, Terrimonas, f_Blastocatellaceae_unclassified and metagenome were the dominant genera in the municipal WWTP, and Candidatus Microthrix was the main bacterium causing sludge bulking in winter and spring. Analysis of quorum sensing regulation showed that C6-HSL could inhibit sludge bulking, and 3OC12-HSL could promote the production of polysaccharides. f_Saprospiraceae_unclassified, f_Caldilineaceae_unclassified, SWB02 and OLB12 were the main C6-HSL producing bacteria, and f_Bacteroidetes_vadinHA17_unclassified was a quorum quenching bacterium of 3OC12-HSL. The functional prediction analysis by Tax4fun based on high-throughput sequencing showed that the nitrogen and phosphorus removal performance of WWTP in May was slightly inferior to that of other months.
-
挥发性有机物(volatile organic compounds,VOCs)为饱和蒸汽压在标准状况下大于133.3 Pa、沸点低、分子量小、常温状态下易挥发的有机化合物[1]. VOCs来源丰富且复杂,来源包括生物源(如植物排放和火山爆发等)和人为源(如溶剂挥发、燃料燃烧和机动车排放等),其中城市地区主要来自于人为源的VOCs因为其危害较大而受到广泛关注. VOCs的危害性主要分为两个方面:一是环境影响,VOCs能发生氧化反应,产生臭氧(O3)和二次有机气溶胶(SOA)从而影响空气质量[2 − 3],具体表现为在对流层中,光化学反应活性较强的VOCs物种既可在光照条件下与NOx(氮氧化物)发生反应生成O3[4 − 5],也可与大气中的氧化剂(如羟基自由基等)发生反应生成较弱挥发性的VOCs,进而经过吸附等物理过程分散到颗粒相中转化为SOA[6];另一方面,部分VOCs会损害人体的生理功能和免疫系统等,例如苯、甲苯、乙苯和二甲苯(BTEX)和卤代烃会损害神经和造血系统,甚至导致癌症[7 − 8]. 因此,更好地了解大气中VOCs的特征,是深入分析VOCs对O3、SOA污染形成和人类健康影响的关键.
VOCs和O3是我国城市大气复合污染中的重要组成部分. 与其他大气污染物相比,O3污染问题更加复杂,治理难度更大、周期更长[9]. 西北地区大气环境特殊,沙尘量高且湿度较低,近年来大气二次污染程度不断加剧,防治形势严峻[10]. 胡琳等[11]在西北城市O3污染的研究中指出当温度高于30 ℃、相对湿度低于60%时,容易出现高浓度臭氧现象. 刘松等[12]研究了2013—2016年西安O3时空变化特性与影响因素,发现高浓度O3主要出现在高温度、低湿度且风向为东南风或南风的天气背景下. 除气象因素外,许多研究也关注了人为排放和大气化学方面对臭氧的影响. 张瑞欣[13]研究西北工业城市乌海市臭氧污染成因时指出VOCs排放与O3污染高度相关,而VOCs主要来源包括工艺过程源、生物质燃烧源、炼焦及精细化工源、非金属制品源. 曹泽磊[14]研究西安市高新区O3及其前体物污染时指出,机动车尾气排放、汽车维修与喷漆过程排放是VOCs和臭氧浓度较高的主要原因. 兰州市是甘肃省政治经济中心,主体产业为石化与冶炼. 主城区地形上两山环绕南北,海拔约1520 m,河谷型地形地貌导致扩散条件差,区域内光照较强,极易发生光化学反应造成臭氧污染. 上世纪70、80年代,兰州西固区就发生过由高浓度VOCs引起的光化学烟雾现象[15]. 随着城市化进程的加快,兰州市城区环境形势愈发严峻,2019年兰州市轻度(含)以上污染中,以臭氧为首要污染物的天数占36.6%[16]. 近年来兰州大力整治石化行业VOCs排放,大气臭氧浓度却没有得到有效控制,2022年夏季臭氧平均质量浓度为151 µg·m−3,接近空气质量二级标准,可见兰州市大气VOCs污染已经转变为复合污染源排放型. 鉴于兰州市VOCs与O3污染来源和成因的复杂性,为实现兰州市整体O3污染治理与管控,进行大气VOCs与O3污染精细化特征分析及来源解析十分必要.
兰州大气组分超级监测站以臭氧污染机理研究为目的,实现兰州市城关区大气污染立体监测,构建“天、地、空”全方位立体管控体系,为研判臭氧污染演变趋势、预警决策、科学治理及区域联防联控提供技术支持. 本研究通过监测2021年兰州市大气O3、VOCs和其他大气组分,开展O3和VOCs污染特征研究,同时评估其臭氧生成潜势(ozone formation potential,OFP),利用正交矩阵因子模型(positive matrix factorization,PMF)对VOCs进行来源解析,为兰州市大气环境O3和VOCs污染管控提供数据基础和科学支撑.
1. 研究方法(Research method)
1.1 采样地点
本研究观测实验点位于甘肃省兰州市城关区兰州大学学生活动中心顶楼(103.87° E,36.05° N),是甘肃省第一个大气综合观测超级监测站. 该点位于城市政治、经济、文化中心的混合区域,周边2 km范围内分布有居民区、学校和商业区,西侧毗邻贯穿城市南北的主干道天水路,距中国西部最大的石油化工基地、城市核心工业区西固区约22 km. 观测点配置挥发性有机物连续自动监测系统、过氧乙酰硝酸酯自动监测仪、氮氧化物自动监测仪、紫外辐射计、总辐射计、臭氧激光雷达等监测仪器.
1.2 采样分析方法
研究采用杭州谱育科技发展有限公司2000-315L型在线监测仪器、Metcon公司PAN、KIPPZONEN公司紫外辐射计、赛默飞世尔公司42i型NO/NO2/NOx在线监测仪器开展24 h连续分析. 监测的挥发性有机物组分共108种,包括13种含氧有机物、17种芳香烃、35种卤代烃、31种烷烃、11种烯烃和1种硫化物等. 监测期间严格按照中国环境监测总站《国家环境空气监测网环境空气挥发性有机物联系自动监测质量控制技术规定(试行)》(总站气函2019〔785〕号)文件开展质控工作.
1.3 正交矩阵因子分解法(PMF受体模型)
PMF是一种根据长时间序列的受体点物种组分数据对物种来源进行识别和定量的多元统计模型[17],该模型假设污染物环境浓度是不同污染源排放的各污染物组分的线性加和,基于监测点的观测数据,运用最小二乘法估算污染源的组成及其贡献率[18]. 本研究使用美国环境保护署推荐的PMF 5.0模型对VOCs进行来源解析. PMF模型将输入的数据分成因子贡献矩阵和因子成分谱矩阵. 因此,PMF模型可以表示为:
X=GF+E (1) 式中,X为数据矩阵;G为因子贡献矩阵;F为因子成分谱矩阵;E为残差矩阵. G和F是根据不确定度迭代计算使目标函数Q达到最小而得到的,Q值计算公式为:
Q=∑ni=1∑mj=1[xij−∑pk=1gikfkjuij]2 (2) 式中,n为样本总数,m为VOCs物种总数,p为因子总数,xij为样本i中物种j的浓度,gik为第k个因子对样本i的贡献,fkj为第k个因子中物种j的含量,uij为样本i中物种j的不确定度.
PMF模型需要输入VOCs物种浓度数据文件和不确定度数据文件. 本研究中,若VOCs物种体积浓度低于或等于其方法检出限,其体积浓度替换为对应方法检测限(MDL)的0.5倍,不确定度替换为MDL的5/6;若高于MDL,不确定度通过下式计算:
Uj=√(EFj×Cj)2+(0.5×MDLj)2 (3) 式中,Uj为物种j的不确定度,EFj为物种j的误差分数(本研究中该值为20%),Cj为物种j的体积浓度,MDLj为物种j的方法检出限.
1.4 臭氧生成潜势
臭氧生成潜势(ozone formation potential, OFP)表征不同VOCs生成臭氧的潜能,是综合衡量VOCs物种的反应活性对臭氧生成的指标参数. OFP可根据最大增量反应活性(MIR)[19]计算,如式(4)所示.
OFP=[VOC]×MIR (4) 其中,VOC和MIR分别为单个VOC组分的浓度和最大增量反应活性.
2. 结果与讨论(Results and discussion)
2.1 臭氧及其前体物污染特征
2021年兰州市O3浓度均值变化如图1所示. 春季(3—5月)O3浓度均值为112 µg·m−3、夏季(6—8月)为144 µg·m−3、秋季(9—11月)为90.3 µg·m−3、冬季(12—2月)为38.2 µg·m−3. 2013—2017年,兰州市O3浓度年均值从55 µg·m−3提高到104 µg·m−3,2021年O3浓度年均值为96.1 µg·m−3,O3浓度的上升得到了抑制,但仍处于较高水平[20]. O3污染呈现典型的季节特征,兰州市夏季O3污染最严重. 在NOx及VOCs等O3前体物全年排放稳定的情况下,夏季由于日照充足、紫外辐射强(图1)、光化学反应强烈,更易发生光化学污染[16]. 其中7月是O3污染最严重的月份,超标天数(>160 µg·m−3)最多,达到14 d.
2021年兰州市夏季O3、过氧乙酰硝酸酯(PAN)、VOCs和NO2日均浓度变化如图2所示. Pearson相关系数显示,PANs(r=0.56, P=0.01)、芳香烃(r=0.43, P =0.01)、烷烃(r=0.36, P =0.03)、烯烃(r=0.25, P =0.02)、NO2(r=0.28, P=0.04)与O3间呈一定的正相关,其它前体物(−0.11<r<0.05, 0.03< P<0.11)对O3浓度没有明显贡献. PAN是VOCs和NO2光化学反应生成的二次有机污染物,是光化学烟雾中的重要污染物之一[21 − 23],PAN和NO2与兰州市夏季O3有较明显的关联,说明兰州市夏季的臭氧污染与光化学反应密切相关. 不同种类VOCs与O3的相关性差异较大,芳香烃、烷烃和烯烃与O3的相关性较显著,是兰州市夏季臭氧污染的主要VOCs贡献物种. 2021年夏季长三角地区苏州臭氧平均值为137 μg·m−3,臭氧浓度对芳香烃和烯烃最为敏感,烷烃次之,与兰州近似,但污染峰值出现在6月[24]. 7、8月份长三角地区受降水影响较大,臭氧浓度下降[25],说明气候对不同地区臭氧浓度有较大影响. 关中城市群各国控站2015—2021年O3浓度评价值多年平均值为135—164 μg·m−3,主要浓度区别在冬季,关中城市冬季O3浓度均值在50—60 μg·m-3[9]. 关中城市群及周边区域冬季O3浓度升高主要与冬季NOx减排幅度高于VOCs减排幅度,区域滴定效应减弱有关,同时汾渭平原其他城市大气区域传输也有一定影响[9,26].
2.2 VOCs污染特征
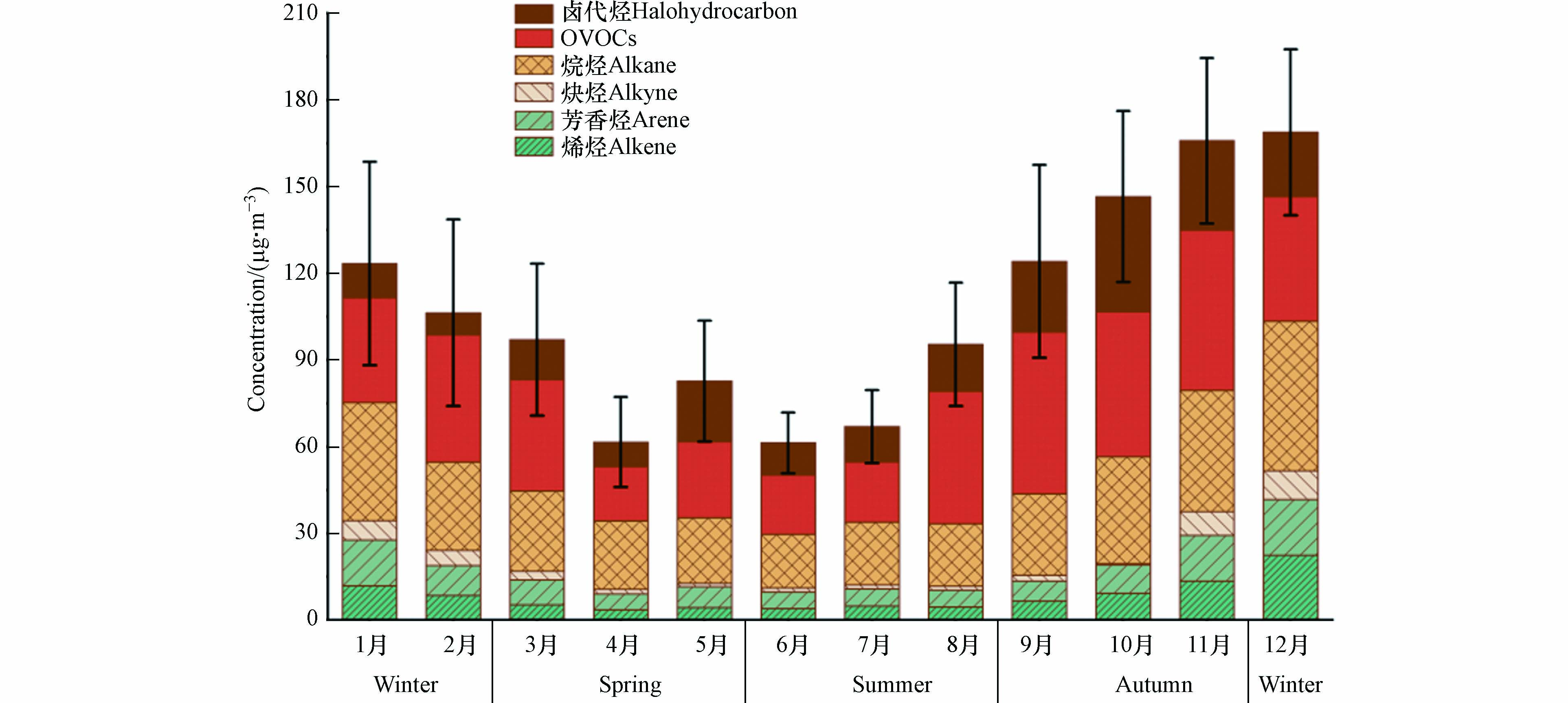
兰州市2021年VOCs及其各组分物种(烷烃、OVOCs、卤代烃、烯烃、芳香烃、炔烃和硫化物)的月均浓度特征如图3所示. 总体上,TVOCs的月均浓度呈现秋冬季较高,春夏季较低的特征,春夏秋冬的季节平均浓度分别为72.46、66.28、135.68、121.01 µg·m−3. 兰州市VOCs月均浓度差异显著,其中12月份和6月份的VOCs月均浓度水平为最高和最低,分别达到152.06 µg·m−3和45.11 µg·m−3. 夏季臭氧污染严重,其中7月份浓度达到155 µg·m−3,然而夏季VOCs浓度水平较低,6—8月的VOCs浓度分别为45.11、63.57、90.25 µg·m−3,较其他季节低,主要是因为夏季O3的大量生成对VOCs损耗较大导致其浓度水平较低[27],另一方面,夏季温度高、光照强度强、大气边界层高、空气对流强和污染扩散条件好[28],综合导致VOCs浓度进一步下降. 而在相同的VOCs排放源和排放水平下,臭氧对其消耗较少和污染物积累条件良好的冬季则表现出最高的VOCs浓度水平.
兰州市2021年大气环境中VOCs的主要组成特征为:OVOCs和烷烃为主要的VOCs贡献物种,其在VOCs中的占比分别达到35.7%和30.8%,芳香烃、卤代烃、烯烃和炔烃对于大气环境VOCs的贡献相对较少,分别为10.7%、10.0%、8.0%和4.5%. 兰州2019年大气VOCs主要特征组分为烷烃(68%)、烯烃(19%)和芳香烃(9.5%)[29],相比于2019年,2021年OVOCs的排放占比提升显著. 2021年兰州市各季节VOCs组成特征中,均表现为OVOCs和烷烃占比最高,表明机动车排放源、燃烧源和化工源等可能为该地区VOCs的主要排放源[30 − 32]. 烯烃类占比在冬季显著升高,推测可能与冬季居民采暖燃烧源排放大量烯烃类物质有关[31]. 兰州市2021年大气环境中VOCs优势物种的年均浓度水平如图4所示,10种含量最高的VOCs物种分别为:乙醇、丙酮、二氯甲烷、乙烷、三氯乙烯、丙烷、乙烯、正丁烷、异戊烷、乙炔,其中OVOCs类2种、烷烃类4种、卤代烃类2种、烯烃类1种、炔烃类1种,其中乙醇、丙酮和二氯甲烷等物种可能与该地区化工源有关[33 − 34],待进一步分析. 在夏季臭氧高污染时期,该地区大气环境中VOCs优势组分类别与全年相似,表明该地区VOCs排放源季节差异性较小;但占比有些许差别,具体表现为OVOCs和卤代烃占比提高,分别为39.4%和17.6%,而烷烃类占比相对降低为27.4%.
2.3 VOCs来源解析
本研究将处理后的VOCs数据输入PMF模型,经过多次模拟运行,最终解析出6个因子. 因子1中含量较高的成分为乙烷、丙烷、正丁烷、苯,煤炭燃烧产生的气体中主要为正构烷烃[35],因此将因子1标记为化石燃料燃烧源;因子2中环戊烷与正戊烷占其总量的70%以上,丙烷和戊烷是液化石油气和天然气的主要成分[36],所以将因子2标记为机动车排放源;对因子3贡献较大的成分为乙烯、乙炔、苯乙烯和1-丁烯,与有机化工和化学品的制造有关[37],因此认为因子3代表化工工艺源;因子4中2-甲基戊烷、乙烷占比较高,2-甲基戊烷是汽油挥发的示踪物[35],故将因子4标记为汽油挥发源;因子5中乙苯、苯乙烯贡献较大,乙苯、苯乙烯是油漆类物质的主要成分[38],故将因子5标记为溶剂使用源; 因子6中异戊二烯含量最高,占植物排放的示踪剂[39]异戊二烯总量的83.1%,因此将因子6归于天然源. 可见,兰州市VOCs的主要来源有化石燃料燃烧源、机动车排放源、化工工艺源、汽油挥发源、溶剂使用源和天然源.
兰州市2021年各排放源对VOCs的贡献如图5所示. VOCs的天然源贡献占比较小(4.5%),主要来自于人为源. 机动车排放源占比最高,达到27.1%,其次为化石燃料燃烧源(23.8%)和化工工艺源(17.9%),汽油挥发源(16%)与溶剂使用源(10.7%)占比相对较低. 周茜的研究揭示[10],2017年兰州VOCs来源主要有8类:混合工业过程-煤炭(13.5%),二次形成(13.2%),混合工业过程-燃油(11.8%),住宅生物燃料和废物处理(13.8%),溶剂使用(10.1%),汽车尾气(11.8%),生物来源(13.8%)和生物质燃烧(12.0%). 对比发现,2021年兰州市机动车排放源占比相对2017年大幅上升,化石燃料燃烧排放保持较高水平. 兰州市人口密集,车辆保有量大,石化和冶炼行业发达,因此机动车排放源与化石燃料燃烧源贡献较大,石化行业排放整治后,重点应集中在机动车管理和冶炼行业的治理上.
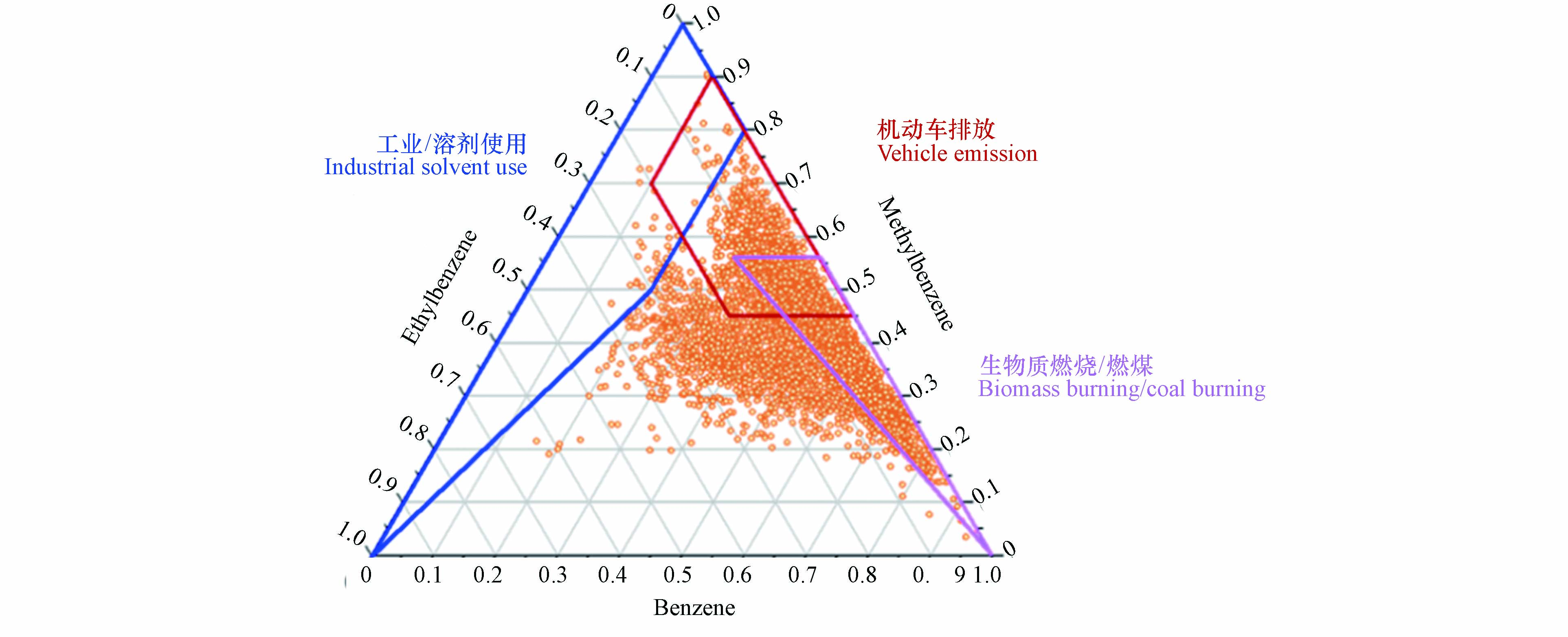
苯系物对人体健康影响较大,同时不同种类苯系物的比值也可指示不同VOCs排放源的贡献. 兰州市2021年日均苯系物排放特征如图6所示,乙苯相对排放量在0.5以下,甲苯相对排放量集中在0.4—0.8之间,苯相对排放量在0.6以上,乙苯排放较少,主要以苯和甲苯排放为主. 苯和甲苯的比值在0.5附近时表明机动车尾气排放污染为主[40 − 41];当苯/甲苯大于0.8时,主要受到燃煤等影响[42 − 43],而当苯/甲苯小于0.5时,主要受溶剂使用等影响[42]. 兰州市苯/甲苯的值基本处于0.6以上,属于机动车尾气与燃煤混合污染,苯系物治理应着重在机动车管理与工业燃煤排放上.
兰州市夏季臭氧污染阶段VOCs贡献源如图7所示,机动车排放源贡献最高(6月31.6%,7月30.2%,8月31.0%),其次为化石燃料燃烧源(6月20.1%,7月18.1%,8月20.8%)、汽油挥发源(6月16.1%,7月17.5%,8月13.8%)和化工工艺源(6月13.0%,7月10.7%,8月14.3%),溶剂使用源(6月10.6%,7月13.2%,8月12.2%)和天然源(6月8.6%,7月10.4%,8月7.8%)贡献较少. 机动车排放源、天然源、溶剂使用源和化石燃料源的占比变化较小,极数小于2.7%,而汽油挥发源和化工工艺源占比变化相对较大,极数分别为3.7%和3.6%. 石化和化工行业排放量随时间变化波动较大,建立相关行业高时间分辨率的VOCs排放监测和清单对进一步治理汽油挥发源和化工工艺源VOCs排放有重要意义.
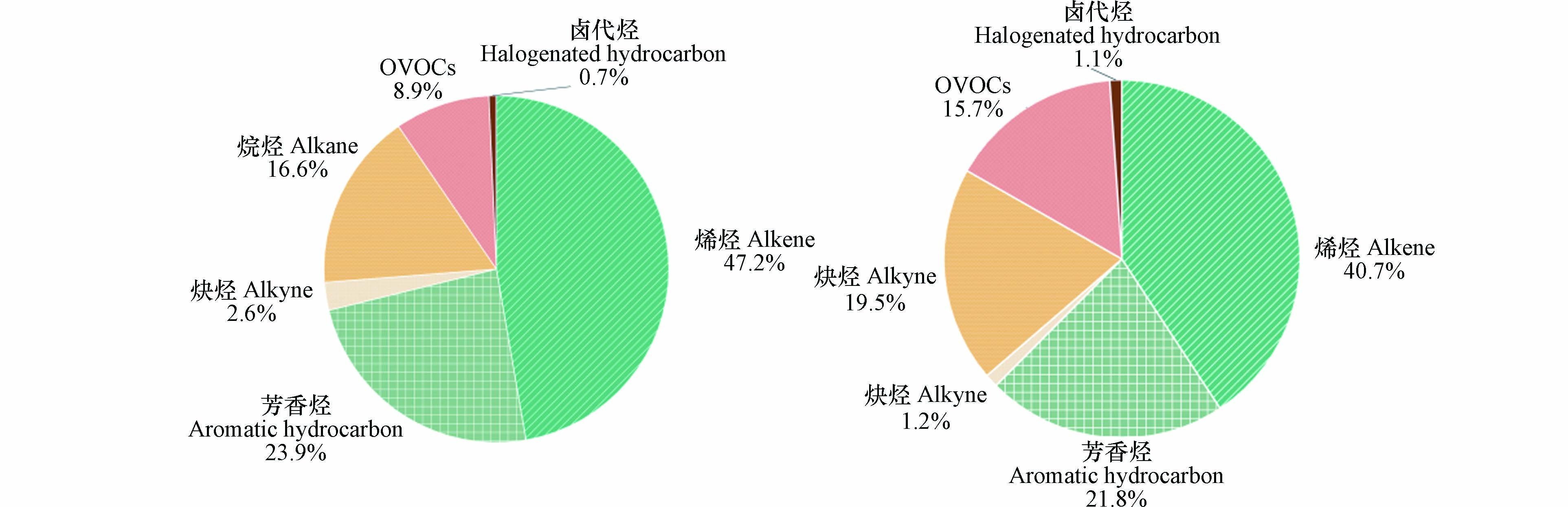
2.4 VOCs对臭氧生成潜势的贡献
大气中不同VOCs物种的反应活性由于其化学结构的不同,对臭氧生成的影响也存在较大差异,因此采用MIR来计算VOCs的OFP,以此来评估VOCs不同组分对于臭氧生成的不同贡献. 本研究计算了全年年均和夏季阶段不同VOCs的OFP贡献比例,结果如图8所示. 烯烃的浓度水平在全年和夏季VOCs中均较低(分别为8%和6%),然而烯烃是大气环境中活性较强的组分[44],因此其对臭氧生成的影响贡献最大,分别达到了47.2%和40.7%. 芳香烃具有反应活性强的特点,在兰州大气环境中对O3的形成贡献仅次于烯烃,年均贡献和夏季贡献比例分别为23.9%和21.8%. 而在大气环境中浓度水平占比最大的OVOCs和烷烃,由于其相对较弱的化学反应活性,对于臭氧的形成贡献相对较低. 兰州市2021年年均OFP贡献较大的VOCs物种类别和夏季阶段相似,分别为乙烯、丙烯、甲苯、醋酸乙烯酯、丙烯醛、异戊烷、正丁烷、反-2-丁烯、1.3-丁二烯、邻二甲苯,其中,乙烯、丙烯、甲苯对臭氧生成潜势贡献较大,应重点关注.
3. 结论(Conclusion)
(1)兰州市2021年夏季O3污染严重,其中7月份超标天数(>160 µg·m−3)达到14 d,PANs、VOCs和NO2与兰州市夏季O3有正相关关系,表明兰州市夏季的臭氧污染主要影响因素为光化学反应.
(2)兰州市2021年TVOCs的月均浓度呈现秋冬季节较高,春夏季节较低的趋势,其中12月份和6月份的VOCs月均浓度水平为最高和最低,分别达到152.06 µg·m−3和45.11 µg·m−3. VOCs组成的季节性差异不大,占主要贡献的VOCs物种为OVOCs和烷烃.
(3)源解析结果表明,兰州市VOCs主要来自于人为源排放,其中主要来自机动车排放源,贡献达到27.1%,化石燃料燃烧源(23.8%)和化工工艺源(17.9%)次之. 另外,该地区的苯系物排放主要受到机动车和工业燃煤排放影响.
(4)烯烃和芳香烃为大气中影响臭氧生成的主要VOCs物种,其对年均OFP的贡献分别达到47.2%和23.9%,烷烃虽在大气中浓度水平较高但对臭氧生成影响较小. 其中,乙烯、丙烯、甲苯对臭氧生成潜势贡献较大,应为VOCs排放重点监测组分.
-
表 1 样品中微生物多样性指数
Table 1. Microbial diversity index in samples
样品 ACE Chao1 Shannon Simpson 覆盖率/% S1 613.16 613.50 7.015 0.983 99.8 S3 588.12 600.84 6.920 0.983 99.8 S5 576.22 577.28 7.009 0.978 99.9 S7 646.34 644.04 7.167 0.982 99.8 S9 643.03 644.96 6.826 0.974 99.8 S11 647.57 650.17 7.118 0.982 99.9 表 2 功能菌属相对丰度
Table 2. Relative abundance of functional bacteria %
功能菌分类 功能菌属 相对丰度 参考文献 S1 S3 S5 S7 S9 S11 GAO Candidatus Competibacter 0.17 0.32 0.5 0.47 0.48 1.50 [3] PAO Tetrasphaera 0.87 1.32 0.48 0.19 0.03 0.02 [3, 23] Candidatus_Accumulibacter 0.02 0.04 0.29 0.11 0.05 0.11 [3] DPB f_Saprospiraceae_unclassified 3.73 5.99 4.9 10.56 7.23 5.82 [19] Paracoccus 1.35 2.39 0.57 0.58 0.15 0.27 [24] AOB Nitrosomonas 0.18 0.03 0.04 0.95 0.93 0.61 [3] NOB Nitrospira 0.76 0.1 0.04 1.42 0.63 1.25 [3] DNB Ferruginibacter 9.26 8.22 13.36 9.99 10.81 5.19 [25] Terrimonas 5.35 8.01 7.48 3.60 4.69 2.79 [26] f_Blastocatellaceae_unclassified 3.27 0.97 0.96 6.39 10.47 8.74 [18] Amphiplicatus 1.36 3.13 5.46 1.61 0.71 0.48 [27] Ottowia 1.38 3.41 1.19 0.59 0.49 0.46 [28] Defluviimonas 1.40 2.22 0.87 1.07 0.60 0.91 [29] Thauera 0.48 0.37 0.39 1.84 1.95 2.03 [3] Dokdonella 0.24 0.79 1.2 0.76 1.03 0.33 [11] Hyphomicrobium 0.86 0.56 0.79 0.54 0.61 0.99 [30] f_Rhodobacteraceae_unclassified 0.87 2.07 0.68 0.33 0.14 0.19 [30] Rhodobacter 0.84 1.85 0.61 0.20 0.09 0.06 [3] Novosphingobium 0.36 0.7 0.51 0.22 0.16 0.18 [30] Devosia 0.62 0.72 0.28 0.17 0.1 0.12 [30] Thiobacillus 1.28 0.28 0.29 0.03 0.01 0.02 [31] EPS分泌菌 Terrimonas 5.35 8.01 7.48 3.60 4.69 2.79 [32] Thauera 0.48 0.37 0.39 1.84 1.95 2.03 [30] Devosia 0.62 0.72 0.28 0.17 0.1 0.12 [30] 水解菌 Ferruginibacter 9.26 8.22 13.36 9.99 10.81 5.19 [17] f_Saprospiraceae_unclassified 3.73 5.99 4.9 10.56 7.23 5.82 [33] Ottowia 1.38 3.41 1.19 0.59 0.49 0.46 [28] 表 3 功能基因相对丰度
Table 3. Relative abundance of functional gene %
代谢功能 基因相对丰度 S1 S3 S5 S7 S9 S11 氨基酸代谢 13.94 13.88 12.82 13.63 12.96 13.52 碳水化合物代谢 12.58 12.66 11.77 12.33 11.87 12.26 膜转运 12.42 12.04 11.07 12.01 11.58 11.79 辅酶因子和维生素代谢 7.37 7.35 7.19 7.33 7.27 7.34 能量代谢 7.35 7.30 7.32 7.37 7.43 7.45 信号转导 6.62 6.74 7.47 6.94 7.38 7.05 核苷酸代谢 5.44 5.45 5.64 5.54 5.62 5.61 转译 4.34 4.45 4.69 4.44 4.57 4.52 外来生物的生物降解和代谢 4.68 4.61 4.33 4.56 4.34 4.45 复制和修复 3.80 3.88 4.48 4.01 4.33 4.10 脂质代谢 3.69 3.69 3.72 3.67 3.63 3.61 其他氨基酸代谢 2.98 2.97 2.95 2.95 2.90 2.89 萜类和多酮类化合物代谢 2.57 2.57 2.40 2.50 2.38 2.44 折叠、分类和降解 2.24 2.26 2.34 2.28 2.33 2.31 细胞运动 2.03 2.00 2.64 2.21 2.58 2.29 聚糖的生物合成和代谢 2.02 2.11 2.55 2.15 2.41 2.23 细胞生长和死亡 1.66 1.62 1.92 1.74 1.93 1.79 其他次生代谢物生物合成 0.91 0.92 0.90 0.89 0.87 0.88 运输和分解代谢 0.35 0.36 0.36 0.35 0.34 0.34 细胞群落—原核生物 0.32 0.32 0.36 0.32 0.35 0.33 转录 0.19 0.19 0.26 0.21 0.24 0.21 信号分子和相互作用 0.002 0.001 0.02 0.007 0.016 0.009 -
[1] SHEIK A R, MULLER E E L, WILMES P. A hundred years of activated sludge: time for a rethink[J]. Frontiers in Microbiology, 2014, 5: 47. [2] WU L, NING D, ZHANG B, et al. Global diversity and biogeography of bacterial communities in wastewater treatment plants[J]. Nature Microbiology, 2019, 4(7): 1183-1195. doi: 10.1038/s41564-019-0426-5 [3] 鞠峰, 张彤. 活性污泥微生物群落宏组学研究进展[J]. 微生物学通报, 2019, 46(8): 2038-2052. [4] 马切切, 袁林江, 牛泽栋, 等. 活性污泥微生物群落结构及与环境因素响应关系分析[J]. 环境科学, 2021, 42(8): 3886-3893. [5] 程珂珂, 曾艳华, 蔡中华, 等. 微生物的交流信号[J]. 生物化学与生物物理进展, 2022, 49(6): 960-974. [6] LI S, FEI X, CHI Y, et al. Impact of the acetate/oleic acid ratio on the performance, quorum sensing, and microbial community of sequencing batch reactor system[J]. Bioresource Technology, 2020, 296: 122279. doi: 10.1016/j.biortech.2019.122279 [7] HU H, LIU Y, LUO F, et al. Stable and rapid partial nitrification achieved by boron stimulating autoinducer-2 mediated quorum sensing at room & low temperature[J]. Chemosphere, 2022, 304: 135327. doi: 10.1016/j.chemosphere.2022.135327 [8] WANG N, GAO J, LIU Y, et al. Realizing the role of N-acyl-homoserine lactone-mediated quorum sensing in nitrification and denitrification: A review[J]. Chemosphere, 2021, 274: 129970. doi: 10.1016/j.chemosphere.2021.129970 [9] LIU Q, FENG X, SHENG Z, et al. Enhanced wastewater treatment performance by understanding the interaction between algae and bacteria based on quorum sensing[J]. Bioresource Technology, 2022, 354: 127161. doi: 10.1016/j.biortech.2022.127161 [10] MADDELA N R, SHENG B, YUAN S, et al. Roles of quorum sensing in biological wastewater treatment: A critical review[J]. Chemosphere, 2019, 221: 616-629. doi: 10.1016/j.chemosphere.2019.01.064 [11] LI S, FEI X, CAO L, et al. Insights into the effects of carbon source on sequencing batch reactors: Performance, quorum sensing and microbial community[J]. Science of the Total Environment, 2019, 691: 799-809. doi: 10.1016/j.scitotenv.2019.07.191 [12] AßHAUER K P, WEMHEUER B, DANIEL R, et al. Tax4Fun: predicting functional profiles from metagenomic 16S rRNA data[J]. Bioinformatics, 2015, 31(17): 2882-2884. doi: 10.1093/bioinformatics/btv287 [13] CHU H, LIU X, MA J, et al. Two-stage anoxic-oxic (A/O) system for the treatment of coking wastewater: Full-scale performance and microbial community analysis[J]. Chemical Engineering Journal, 2021, 417: 129204. doi: 10.1016/j.cej.2021.129204 [14] FENG Z, LI T, LIN Y, et al. Microbial communities and interactions in full-scale A2/O and MBR wastewater treatment plants[J]. Journal of Water Process Engineering, 2022, 46: 102660. doi: 10.1016/j.jwpe.2022.102660 [15] WANG P, YU Z, QI R, et al. Detailed comparison of bacterial communities during seasonal sludge bulking in a municipal wastewater treatment plant[J]. Water Research, 2016, 105: 157-166. doi: 10.1016/j.watres.2016.08.050 [16] 贺赟, 李魁晓, 王佳伟, 等. 不同季节城市污水处理厂微生物群落特性[J]. 环境科学, 2021, 42(3): 1488-1495. doi: 10.13227/j.hjkx.202007015 [17] 黎镛, 袁辉洲, 柯水洲, 等. 微生物载体对MBBR工艺性能及微生物群落结构的影响[J]. 环境工程, 2021, 39(12): 100-106. doi: 10.13205/j.hjgc.202112015 [18] ZHANG L, HAO S, WANG Y, et al. Rapid start-up strategy of partial denitrification and microbially driven mechanism of nitrite accumulation mediated by dissolved organic matter[J]. Bioresource Technology, 2021, 340: 125663. doi: 10.1016/j.biortech.2021.125663 [19] 顾晓丹, 黄勇, 丁永伟, 等. 改良型UNITANK工艺冬季运行特性及微生物群落分析[J]. 环境工程学报, 2021, 15(7): 2480-2487. doi: 10.12030/j.cjee.202102134 [20] 尚越飞, 王申, 宗倪, 等. 污水生物处理工艺低温下微生物种群结构[J]. 环境科学, 2020, 41(10): 4636-4643. doi: 10.13227/j.hjkx.202004116 [21] FAN N, QI R, HUANG B, et al. Factors influencing Candidatus Microthrix parvicella growth and specific filamentous bulking control: A review[J]. Chemosphere, 2020, 244: 125371. doi: 10.1016/j.chemosphere.2019.125371 [22] WANG J, QI R, LIU M, et al. The potential role of ‘Candidatus Microthrix parvicella’ in phosphorus removal during sludge bulking in two full-scale enhanced biological phosphorus removal plants[J]. Water Science and Technology, 2014, 70(2): 367-375. doi: 10.2166/wst.2014.216 [23] LIU H, ZENG W, MENG Q, et al. Phosphorus removal performance, intracellular metabolites and clade-level community structure of Tetrasphaera-dominated polyphosphate accumulating organisms at different temperatures[J]. Science of the Total Environment, 2022, 842: 156913. doi: 10.1016/j.scitotenv.2022.156913 [24] 叶丽红, 李冬, 张杰, 等. 亚硝化-反硝化除磷技术研究进展[J]. 北京工业大学学报, 2016, 42(4): 585-593. doi: 10.11936/bjutxb2015070009 [25] 赖永恒, 刘敏. A/O-MBBR工艺处理生活污水性能及菌群结构[J]. 中国环境科学, 2022, 42(5): 2120-2128. doi: 10.3969/j.issn.1000-6923.2022.05.016 [26] CHEN X, XU P, YANG C, et al. Study of enhanced nitrogen removal efficiency and microbial characteristics of an improved two-stage A/O process[J]. Environmental Technology, 2021, 42(27): 4306-4316. doi: 10.1080/09593330.2020.1754924 [27] 张晶晶, 杨翠春, 丁鹏霖, 等. MBBR工艺用于唐山某污水厂提标改造效能分析[J]. 中国给水排水, 2020, 36(15): 78-85. [28] LI J, DU Q, PENG H, et al. Optimization of biochemical oxygen demand to total nitrogen ratio for treating landfill leachate in a single-stage partial nitrification-denitrification system[J]. Journal of Cleaner Production, 2020, 266: 121809. doi: 10.1016/j.jclepro.2020.121809 [29] WANG L, ZHAN H, WU G, et al. Effect of operational strategies on the rapid start-up of nitrogen removal aerobic granular system with dewatered sludge as inoculant[J]. Bioresource Technology, 2020, 315: 123816. doi: 10.1016/j.biortech.2020.123816 [30] HE Q, CHEN L, ZHANG S, et al. Hydrodynamic shear force shaped the microbial community and function in the aerobic granular sequencing batch reactors for low carbon to nitrogen (C/N) municipal wastewater treatment[J]. Bioresource Technology, 2019, 271: 48-58. doi: 10.1016/j.biortech.2018.09.102 [31] ZHANG R, CHEN C, XU X, et al. The interaction between Pseudomonas C27 and Thiobacillus denitrificans in the integrated autotrophic and heterotrophic denitrification process[J]. Science of the Total Environment, 2022, 811: 152360. doi: 10.1016/j.scitotenv.2021.152360 [32] ZHAO Y, JIANG B, TANG X, et al. Metagenomic insights into functional traits variation and coupling effects on the anammox community during reactor start-up[J]. Science of the Total Environment, 2019, 687: 50-60. doi: 10.1016/j.scitotenv.2019.05.491 [33] 郑向阳, 罗晓, 袁立霞, 等. AO工艺处理淀粉污水效能及微生物群落解析[J]. 环境工程学报, 2018, 12(3): 804-814. doi: 10.12030/j.cjee.201708047 [34] 王萍, 余志晟. 污水处理厂污泥膨胀和污泥发泡的比较分析[J]. 微生物学通报, 2019, 46(8): 1971-1981. [35] HUANG J, SHI Y, ZENG G, et al. Acyl-homoserine lactone-based quorum sensing and quorum quenching hold promise to determine the performance of biological wastewater treatments: An overview[J]. Chemosphere, 2016, 157: 137-151. doi: 10.1016/j.chemosphere.2016.05.032 [36] 罗景阳, 张乐, 张腾, 等. 不同工艺对污水处理效能及细菌代谢功能的影响[J]. 中国给水排水, 2021, 37(23): 61-67. doi: 10.19853/j.zgjsps.1000-4602.2021.23.011 [37] FANG D, ZHAO G, XU X, et al. Microbial community structures and functions of wastewater treatment systems in plateau and cold regions[J]. Bioresource Technology, 2018, 249: 684-693. doi: 10.1016/j.biortech.2017.10.063 -






 下载:
下载: