-
我国是抗生素生产和使用大国,抗生素产量约占全球总产量的20%~30%[1]。与此同时,会产生大量的抗生素菌渣,据统计,我国每年菌渣总产量高达2×106 t[2]。此外,新鲜的菌渣含水率高达90%以上,极易腐败发臭,其中残留的抗生素会造成水土环境的污染,加剧细菌耐药性,危害人群健康[3-4]。
目前,抗生素菌渣的处理处置技术主要包括焚烧、填埋和堆肥等[5]。2021年新版《国家危险废物名录》[6]禁止将菌渣作为肥料和饲料的添加剂。因此,寻找适合的菌渣处理处置方法是亟待解决的问题。厌氧消化是一种可将高有机质废弃物资源化利用的处理方式。经过厌氧消化后的沼渣不再具有生物毒性,可进一步被处理加工成高品质的肥料。因此,菌渣的厌氧消化处理更能实现其减量化、资源化和无害化[7-8]。含固率(TS)对系统内pH、挥发性脂肪酸(VFAs)、氨氮、微生物群落结构及抗生素抗性基因都有一定的影响[9-10],是厌氧消化的重要影响因素。PELLERA等[11]研究表明,不同底物的TS对厌氧发酵进程有较大影响。近年来,针对TS对污泥、粪便、秸秆以及厨余垃圾厌氧消化影响的研究已相对广泛[12-13],但针对TS对抗生素菌渣厌氧消化影响的研究相对较少。
邹书娟等[14]的研究表明,菌渣中挥发分含量较高,主要以C、O、N和H为主,含有蛋白质和糖类等化合物。土霉素具有广谱性,在医疗和动物养殖方面均有较为广泛的应用[15],故本研究以土霉素菌渣为研究对象。研究TS对土霉素菌渣厌氧消化系统稳定性以及残留抗生素去除的影响,并对最佳TS下系统优势菌群进行分析。以期为抗生素菌渣的减量化、资源化和无害化处理提供参考。
-
厌氧接种污泥取自河北省石家庄某制药废水处理厂的厌氧反应器,对其进行为期20 d的活化培养,然后加入实验所用的土霉素菌渣进行10 d左右的驯化。土霉素菌渣取自河北省石家庄市某制药厂。将高压板框压滤之后的土霉素菌渣经过破碎机粉碎过100目的筛子后备用。厌氧污泥及土霉素菌渣初始理化性质见表1。
-
实验设置5组不同的含固率(4%、8%、12%、16%和20%),每组设置3个平行。实验装置为自动甲烷潜力测试系统(Automatic Methane Potential Test System),该系统包括3个部分,厌氧消化发生单元、CO2吸收单元以及气体测量设备。厌氧消化发生单元包括15个厌氧反应器,每个反应器容积为500 mL,设置有效容积为400 mL。在每个反应器内加入240 mL经过培养驯化的污泥,根据设置好的TS加入相应体积的土霉素菌渣和蒸馏水,以加入相同体积接种物的反应作为空白处理(CK)。用0.1 mol·L−1的NaOH和HCl将初始消化液的pH调节至6.8~7.2。实验开始前充入2~3 min的氮气以排出反应装置中的空气,所有反应器的温度均控制在(35±1) ℃。每2 d取其上清液,用作理化性质的检测,直到反应结束,另取结束后的样品,对其中残留土霉素的质量浓度进行检测。
-
菌渣的TS和VS采用重量法测定;pH采用自动电位滴定仪测定(PHS-2F,上海仪电科学仪器股份有限公司);产气量由产甲烷潜力测试系统记录(AMPTSⅠ,北京碧普华瑞环境技术有限公司)(实际产气量扣除空白组的产气量)。将所有样品高速离心(8 000 r·min−1、10 min),取上清液过0.25 μm滤膜,对所得滤液进行氨氮、化学需氧量(COD)和VFAs的测定。氨氮采用纳氏试剂法,紫外分光光度计测定(UV-5100,上海元析仪器有限公司);SCOD和TCOD采用重铬酸钾法,快速消解分光光度计测定(5B-3B(V8),北京连华永兴科技发展有限公司);VFAs采用气相色谱法测定(GC7900/氢火焰检测器,上海天美科学仪器有限公司);土霉素残留采用液相色谱法测定(LCMS8050,日本岛津公司)。
-
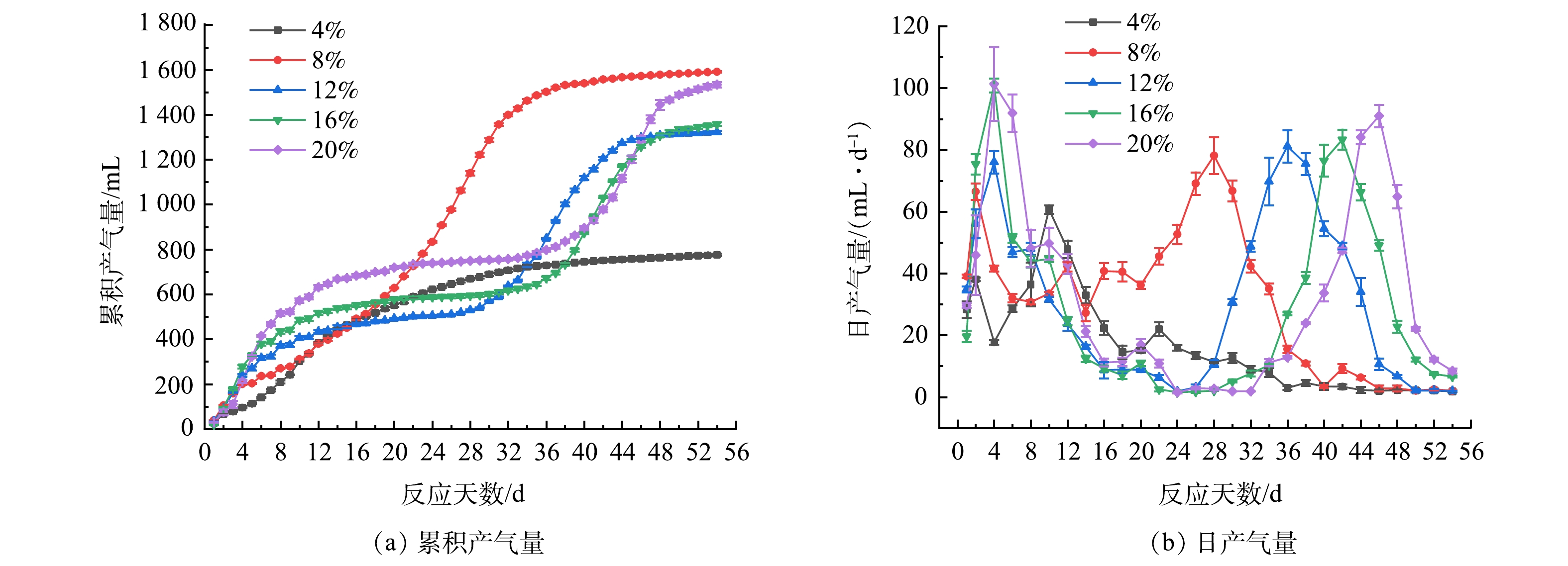
产气情况反映系统内微生物对有机物的利用情况以及厌氧消化的进程,是衡量厌氧消化系统性能的关键因素之一[16]。不同TS下累积产气量和日产气量变化规律见图1。
由图1(a)可看出,当TS为8%时,累计产气量最大。但单位VS产气量(以每gVS计)分别为101.87、78.56、40.22、29.81和26.36 mL·g−1,产气效率随TS的增加而降低,这与杨祎楠等[17]的研究结果相似。尽管当TS为8%时累积产气量最大,但其有机物的利用率较TS为4%时降低了22.3%。
由图1(b)可以看出,反应开始时,日产气量迅速增加,在4 d之内达到第1个产气高峰,经过一段时间的产气迟滞后,逐渐上升达到第2个产气峰值。这可能是因为,在反应前期有机物的含量较高,反应开始前系统的pH设定为厌氧微生物适宜生存的范围,微生物代谢速率快。刘中军等[18]的研究表明,微生物在活性较高的情况下会加快水解酸化的进程。在产甲烷的同时,CO2和H2等非甲烷气体的产量也随之增加,故导致反应前期日产气量达到峰值。随着反应的进行,可能由于VFAs的积累、氨氮抑制以及残留抗生素的毒害作用等原因,使产甲烷菌的活性受到了不同程度的抑制,故导致TS分别为8%、12%、16%和20%的反应组均出现了较长的产气迟滞,且TS越大迟滞期越长。5个TS下的第2个产气高峰出现的时间分别为第10、28、36、42和46 d,峰值随TS的增加而增大。王乐乐等[19]的研究表明,高TS的反应由于发酵液黏度高,气固液传质过程受阻碍,在发酵后期仍保持较高的甲烷产量,这与本研究结果相似。
尽管高TS的反应体系在发酵后期仍具有较高的产气潜力,但其存在产气迟滞的现象,且随TS的增加迟滞期越长。因此,综合考虑产气效率、有机物利用效率以及发酵周期等因素,在有限的时间内,TS大于8%时产气优势无太大差别。
-
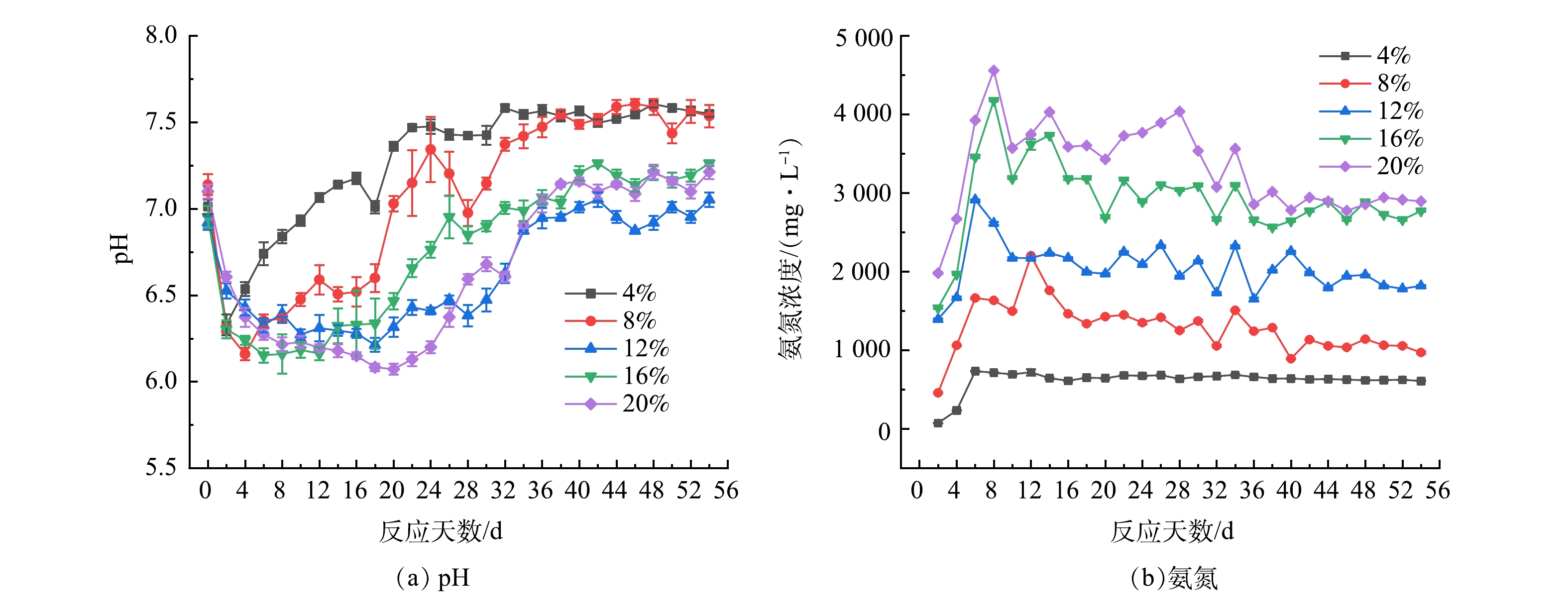
厌氧消化处理是依靠系统内的产酸菌和产甲烷菌共同作用的结果,微生物的生长与环境条件的关系非常密切。在消化过程中,水解酸化菌分解有机物生成大量的VFAs。同时,含氮大分子逐渐分解,产生大量的氨氮[20]。体系内稳定的环境是依靠消化过程中产生的弱酸、弱碱共同作用的结果。因此,pH、氨氮以及VFAs的变化是考察系统稳定性的重要因素[21],其在不同TS下的变化见图2和图3。
图2(a)为pH的变化,5组反应体系初始pH均设置在6.8~7.2之间。随着反应的进行,pH开始下降,在6.0~6.5范围内维持一段时间后开始回升,最后稳定在6.7~7.7之间。但值得注意的是,TS为4%和8%的2组反应分别在第2 d和第4 d出现最低值后迅速上升,而其他3组反应随着TS的增加,在低pH范围内维持的时间变长。产生这一现象的原因可能是,在反应前期,水解酸化菌分解有机物,生成大量的有机酸,故导致pH下降。而大多数产甲烷菌适宜的pH为6.8~7.2,在较低pH下其活性不高,代谢速率缓慢,使得VFAs大量积累[22]。但由于菌渣中含氮大分子逐渐分解,产生大量的氨氮,为体系内提供部分碱度,与产生的酸共同作用,使pH逐渐回升,厌氧消化系统也逐渐趋于稳定[23]。
研究表明,当系统内产生氨氮浓度过高时,反而会对厌氧消化系统产生抑制作用。由图2(b)可以看出,5组反应的氨氮浓度在短时间内都迅速上升。各组反应的最大氨氮浓度随着TS的增加而增加,分别为734.07、2202.69、2915.22、4178.25和4559.77 mL·g−1。JIANG等[24]的研究表明,当氨氮浓度大于3 000 mg·L−1时,会使50%的产甲烷菌失去活性;徐颂等[23]的研究表明,当氨氮浓度大于1 000 mg·L−1时,产甲烷过程就受到了抑制。根据图1(b)中产气特征可发现,TS为12%的反应氨氮浓度整体水平在2 000~3 000 mg·L−1。此时系统由于产生了抑制作用,故导致产气迟滞期相对较长。这与JIANG等[24]和徐颂等[23]的研究中氨氮抑制的限值不同。产生这一现象的原因可能是,氨氮抑制限值受底物的影响较大,菌渣和粪便等物质氮含量较高,在进行厌氧消化时更易受到氨氮的抑制作用。
厌氧消化过程中有机物水解产生的VFAs是产甲烷菌的主要碳源。由图3可知,VFAs浓度随着TS的增加而增加。TS为4%和8%的2组反应在初期VFAs的浓度达到最大值,而其他3组反应VFAs在反应前期大量积累,当反应进行到20 d左右时才达到峰值。这与图1(b)中出现的产气迟滞现象以及图2(a)中低pH维持的时间相对应。VFAs的这一变化可能是由于,在反应前期,水解酸化菌分解有机物生成大量有机酸,但由于该阶段氨氮的积累、pH的下降,造成产甲烷菌的数量不多且活性不高,产气出现迟滞现象,故导致VFAs的消耗速率小于其水解生成速率,使其大量积累[25]。随着反应的进行,系统逐渐恢复相对的稳定,产甲烷菌的活性也逐渐恢复,VFAs的消耗速率大于其水解速率,浓度逐渐降低。由产气特征和pH变化可发现,当TS大于8%、VFAs的浓度大于4 000 mg·L−1时,会对厌氧消化系统产生抑制作用。
综上所述,土霉素菌渣厌氧消化系统中氨氮浓度和VFAs的限制分别为2 000和4 000 mg·L−1,这与孟晓山等[26]的研究结果相似。这说明,在土霉素厌氧消化体系内,当TS大于8%时,系统稳定性较差,开始产生抑制作用。而且,VFAs和氨氮的浓度随TS的增加不断增加,抑制作用不断增强。
-
不同TS下系统内SCOD和反应前后TCOD的变化以及TCOD的去除率见图4。从图4(a)中可以看出,随着反应的进行,体系内SCOD逐渐升高。TS为4%、8%和12%的3组反应进行到22 d左右时,体系内SCOD达到最大,然后呈下降趋势后趋于稳定。而TS为16%和20%的2组反应体系内SCOD出现2个峰值,在第2个峰值出现后,SCOD一直呈下降趋势。这说明,在发酵后期,TS大的反应仍具有良好的产气性能,但由于系统内出现了明显的抑制现象,造成了产气迟滞,所以有机物利用效率并不高。
初始反应体系内的有机物包括2种形式,一种是溶解性的有机物,可以被产酸菌直接利用;另一种是不溶性的有机物,这部分有机物首先要经过水解菌的作用逐渐水解为可溶性的有机物才能进一步被酸化菌利用进而产生VFAs[21]。周富春[27]的研究表明,水解酸化阶段产生的VFAs使消化体系pH较低,导致产甲烷菌的活性不高,有机物水解的速率大于消耗速率,造成可溶性有机物的积累,SCOD逐渐升高。随着系统的逐渐稳定,产甲烷菌活性恢复,有机物的消耗速率大于水解速率,SCOD开始逐渐下降最终达到平稳,与上述pH的变化及产气迟滞现象相对应。
此外,TCOD的去除率可以体现底物在厌氧消化系统内降解的情况。由图4(b)可知,5组反应中TCOD的去除率分别为90.03%、79.72%、63.15%、56.69%和51.13%,随TS的增加而降低。张涛[28]、高妍[29]的研究表明,COD的去除率随着负荷的升高而降低,而TS的增加意味着反应体系负荷也随之增加,导致TCOD的去除率逐渐降低。
-
抗生素菌渣危害性主要包括2方面:一是其有机物含量高;另一方面主要是含有大量残留的抗生素,其进入到环境中会导致微生物产生耐药性,进而威胁到人群健康[4]。土霉素是一种典型的生物抑制药物,当其质量浓度过高时会对厌氧消化系统产生中度甚至重度的抑制作用[30-31]。经检测,土霉素菌渣中残留的土霉素为2 106.47 mg·kg−1。5组反应前后系统内土霉素的质量浓度及其去除效率见表2。
由表2可以看出,随着TS的增大,系统内土霉素的质量浓度也相应增加。经过厌氧消化反应后,TS为4%和8%的反应残留土霉素分别降低了89.85%和87.29%,而另外3组反应残留土霉素的去除率均小于80%。对比5组实验的产气特征、产气效率以及有机物去除效率可知,残留的土霉素对厌氧菌有毒害作用,会抑制厌氧菌的活性,从而导致系统产气效率和有机物的去除效率降低,会出现产气迟滞现象。而且,随着土霉素质量浓度的增加,这些现象愈发明显,这一结果与朱晓磊[32]和SHI等[33]的研究结果一致。综合考虑5组反应过程中系统内各指标的变化发现,当系统含固率为4%和8%时,土霉素对系统的毒害作用较小,系统也比较稳定。而且,残留土霉素的去除率可达85%以上,可基本实现土霉素菌渣的资源化利用和无害化处理。
-
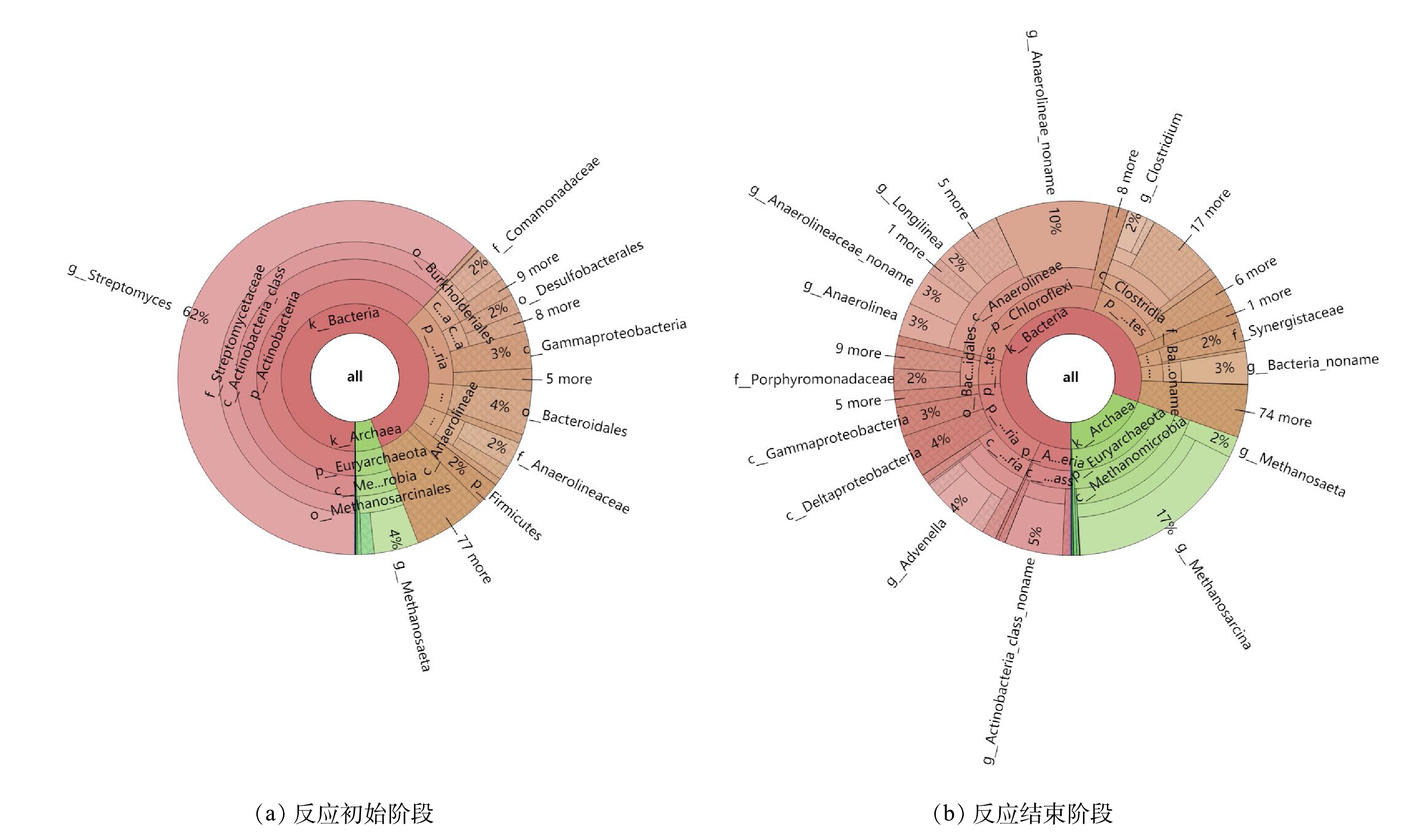
综合比较VS产气效率、有机物降解率以及残留土霉素去除率可知,TS为4%的反应在各方面均优于其他组,故对其体系内微生物群落结构进行了分析,结果如图5所示。
系统内微生物主要包括水解酸化细菌和产甲烷古菌,细菌在微生物中所占的比例要远高于古菌[34]。由图5(a)可知,在反应初始阶段,细菌和古菌在微生物中所占比例分别为90.32%和5.53%。细菌中的优势微生物在门水平上主要包括放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和绿弯菌门(Chloroflexi),其相对丰度分别为59.74%、13.34%、4.64%和4.14%。古菌中的优势微生物在门、纲、目、科水平上分别为广古菌门(Euryarchaeota)、甲烷微菌纲(Methanomicrobia)、甲烷八叠球菌目(Methanosarcinales)下的甲烷鬓菌科(Methanosaetaceae)和甲烷八叠球菌科(Methanosarcinaceae)。其相对丰度分别为5.46%、5.35%、5.03%、3.89%和1.11%。在反应结束阶段,古菌所占比例有所提高,如图5(b)所示,其丰度达到17.98%。而且,与反应初始阶段相比,水解酸化细菌的群落结构分布相对均匀,主要包括Chloroflexi、Proteobacteria、厚壁菌门(Firmicutes)、Actinobacteria和Bacteroidetes,其相对丰度分别为24.25%、15.94%、11.80%、6.42%和4.60%。在古菌中门、纲、目水平上的优势菌群与反应初始阶段相同,但在科水平上Methanosarcinaceae的相对丰度要大于Methanosaetaceae,达到15.47%。
研究表明,Actinobacteria、Proteobacteria和Chloroflexi都可水解有机物,并且均以乙酸为主要产物。Actinobacteria的部分菌属还可以产生丙酸;Proteobacteria可利用的物质包括葡萄糖、丙酸盐、丁酸盐等小分子化合物等[35-36];Chloroflexi对单糖和多糖都具有降解能力,还可以分解由Bacteroidetes、Proteobacteria和Firmicutes水解产生的葡萄糖和可溶性小分子有机物,产生乙酸和氢气[37]。在产甲烷古菌中Methanosarcinales可利用的底物较广泛,能将乙酸、甲醇、三甲胺和CO2等物质转化成CH4[38],但Methanosaetaceae中的甲烷鬃菌属(Methanosaeta)是目前已知的唯一以乙酸为底物的产甲烷菌属[39]。因此,可推测土霉素菌渣的厌氧发酵以乙酸型发酵为主。
-
1)当TS大于8%时,氨氮浓度大于2 000 mg·L−1、VFAs大于4 000 mg·L−1,对厌氧消化系统产生了抑制作用。此外加上土霉素对微生物的毒害作用,导致系统出现产气迟滞现象。VS产气效率、有机物去除效率和残留土霉素的去除效率均随TS的增加而降低。因此,在有限的时间内TS大于10%并不利于菌渣的厌氧消化。
2) TS为4%和8%的反应在系统的稳定性、有机物降解率和残留土霉素的去除效率方面有良好的效果,但TS为8%的反应有机物利用效率比4%的反应降低了22.3%。因此,TS为4%的反应在各方面均优于其他组,更能实现菌渣的减量化、资源化和无害化处理。
3)最佳反应体系内水解酸化的优势菌群包括Actinobacteria、Proteobacteria、Bacteroidetes、Chloroflexi和Firmicutes,产甲烷菌的优势菌群主要包括Methanosarcinaceae和Methanosaetaceae,土霉素菌渣的厌氧发酵以乙酸型发酵为主。
体系含固率对土霉素菌渣厌氧消化的影响
Effect of system solids content on anaerobic digestion of oxytetracycline residues
-
摘要: 针对抗生素菌渣危害性大、处理处置困难等的问题,采用厌氧消化技术可在降低污染物的同时产生清洁能源,是实现抗生素菌渣减量化、资源化和无害化处理的重要途径。含固率(TS)是厌氧消化的重要影响因素之一,通过改变体系的含固率,研究其对土霉素菌渣厌氧消化系统的影响。结果表明,系统内氨氮、挥发性脂肪酸(VFAs)均随TS的增加而增加,当氨氮浓度大于2 000 mg·L−1、VFAs大于4 000 mg·L−1时,会对系统产生明显的抑制作用。系统稳定性能、产气效率以及有机物去除效率均随TS的增加而降低。TS为4%的反应组在各方面均优于其他组,且其中残留的土霉素去除效率最高,可基本实现菌渣的无害化处理。对体系内优势微生物群落进行分析发现,产甲烷菌的优势菌群以Methanosarcinaceae和Methanosaetaceae为主,可知,土霉素菌渣的厌氧发酵以乙酸型发酵为主。本研究结果可为厌氧消化技术在抗生素菌渣处理处置中的应用提供理论参考。Abstract: In response to the problems of hazardous antibiotic residues and difficulties in treatment and disposal, the use of anaerobic digestion technology can reduce pollutants while generating clean energy, which is an important way to achieve the reduction, resourcefulness and harmless treatment of antibiotic residues. Solids content (TS) is one of the important influencing factors of anaerobic digestion, and its effect on the anaerobic digestion system of oxytetracycline residue was investigated by varying the solids content of the system. The results showed that the content of ammonia nitrogen and volatile fatty acids (VFAs) in the system increased with the increase of TS, and when the ammonia nitrogen was more than 2,000 mg·L−1 and VFAs was more than 4,000 mg·L−1, it would have a significant inhibitory effect on the system. System stability performance, gas production efficiency and organic removal efficiency all decrease with increasing TS. The reaction with TS of 4% outperformed the other groups in all aspects, and the highest efficiency of residual hygromycin removal was achieved, which could basically realize the harmless treatment of bacterial residue. Analysis of the dominant microbial community within its system revealed that the dominant methanogenic bacteria were dominated by Methanosarcinaceae and Methanosaetaceae, according to this analysis, the anaerobic digestion of oxytetracycline residue may be mainly acetic acid fermentation. The results of this study can provide a theoretical reference for the application of anaerobic digestion technology in the treatment and disposal of antibiotic residues.
-
表 1 厌氧污泥及土霉素菌渣初始理化性质
Table 1. Initial physical and chemical property of anaerobic sludge and oxytetracycline residue
供试样品 pH TS VS SCOD/(mg·L−1) 氨氮/(mg·L−1) 土霉素残留/(mg·kg−1) 厌氧污泥 6.4~7.2 2.65% 1.12% — — 2.33 土霉素菌渣 2.3-2.8 46.5% 36.75% 787.67 21.03 2 106.47 表 2 不同含固率下厌氧消化系统土霉素残留及其去除率变化
Table 2. Residual oxytetracycline content and its removal rate in anaerobic digestion system with different solid content
含固率 初始土霉素的质量浓度/(mg·L−1) 结束后土霉素的质量浓度/(mg·L−1) 去除率 4% 110.56 11.22 89.85% 8% 219.77 37.10 87.29% 12% 472.50 123.45 73.87% 16% 654.39 131.45 79.91% 20% 835.38 269.21 67.78% -
[1] 钟为章, 冯卫博, 许彬, 等. 抗生素菌渣中活性物质的提取及应用现状[J]. 科学技术与工程, 2021, 21(33): 14049-14055. doi: 10.3969/j.issn.1671-1815.2021.33.003 [2] 陈黎, 孔祥生, 刘秋新, 等. 抗生素菌渣生物炭的制备及特性[J]. 环境科学与技术, 2019, 42(6): 128-133. [3] YANG G, WANG J, SHEN Y. Antibiotic fermentation residue for biohydrogen production using different pretreated cultures: Performance evaluation and microbial community analysis[J]. Bioresource Technology, 2019, 292: 122012. doi: 10.1016/j.biortech.2019.122012 [4] CAI C, HUA Y, LI H, et al. Hydrothermal treatment of erythromycin fermentation residue: Harmless performance and bioresource properties[J]. Resources, Conservation and Recycling, 2020, 161: 104952. doi: 10.1016/j.resconrec.2020.104952 [5] 陈冠益, 刘环博, 李健, 等. 抗生素菌渣处理技术研究进展[J]. 环境化学, 2021, 40(2): 459-473. doi: 10.7524/j.issn.0254-6108.2020061302 [6] 生态环境部, 国家发展和改革委员会, 公安部, 交通运输部, 国家卫生健康委员会. 国家危险废物名录(2021年版)[EB/OL]. [2020-11-25]. https://www.mee.gov.cn/xxgk2018/xxgk/xxgk02/202011/t20201127_810202.html. [7] 孔祥娟, 魏亮亮, 姜珺秋, 等. 有机固废厌氧产沼气产业发展现状及政策需求[J]. 中国给水排水, 2013, 29(20): 26-29. [8] ALVAREZ J A, OTERO L, LEMA J M, et al. The effect and fate of antibiotics during the anaerobic digestion of pig manure[J]. Bioresource Technology, 2010, 101(22): 8581-8586. doi: 10.1016/j.biortech.2010.06.075 [9] SUI Q, MENG X, WANG R, et al. Effects of endogenous inhibitors on the evolution of antibiotic resistance genes during high solid anaerobic digestion of swine manure[J]. Bioresource Technology, 2018, 270: 328-336. doi: 10.1016/j.biortech.2018.09.043 [10] 宋云鹏, 刘吉宝, 陈梅雪, 等. 餐厨垃圾干式厌氧消化工艺中甲烷转化率及其限制性因素[J]. 环境工程学报, 2021, 15(5): 1697-1707. doi: 10.12030/j.cjee.202101031 [11] PELLERA F M, GIDARAKOS E. Effect of substrate to inoculum ratio and inoculum type on the biochemical methane potential of solid agro-industrial waste[J]. Journal of Environmental Chemical Engineering, 2016, 4(3): 3217-3229. doi: 10.1016/j.jece.2016.05.026 [12] 陈欣, 涂德浴, 隋倩雯, 等. 固体浓度对猪粪厌氧消化甲烷产出特性的影响[J]. 中国农业气象, 2014, 35(2): 149-155. doi: 10.3969/j.issn.1000-6362.2014.02.005 [13] ARELLI V, MAMINDLAPELLI N K, BEGUM S, et al. Solid state anaerobic digestion of food waste and sewage sludge: Impact of mixing ratios and temperature on microbial diversity, reactor stability and methane yield[J]. Science of the Total Environment, 2021, 793: 148586. doi: 10.1016/j.scitotenv.2021.148586 [14] 邹书娟, 王一迪, 张均雅, 等. 抗生素菌渣理化性质分析[J]. 环境科学与技术, 2018, 41(S1): 47-52. [15] 宁高阳. 土霉素菌渣的减量化及菌渣溶液的生物处理研究[D]. 兰州: 兰州交通大学, 2020. [16] 徐文倩, 董红敏, 斌尚, 等. 典型畜禽粪便厌氧发酵产甲烷潜力试验与计算[J]. 农业工程学报, 2021, 37(14): 228-234. doi: 10.11975/j.issn.1002-6819.2021.14.026 [17] 杨祎楠, 强虹, 裴梦富, 等. 进料浓度对鸡粪连续中温厌氧消化的影响[J]. 环境工程学报, 2019, 13(12): 2963-2972. doi: 10.12030/j.cjee.201902117 [18] 刘中军, 丁岳峰, 于钦, 等. 不同粒径玉米秸秆与猪粪混合厌氧发酵特性研究[J]. 可再生能源, 2020, 38(10): 1301-1306. doi: 10.3969/j.issn.1671-5292.2020.10.004 [19] 王乐乐, 郑讯涛, 张寓涵, 等. 总固体浓度对猪粪厌氧消化的影响及菌群结构分析[J]. 江苏农业科学, 2019, 47(5): 244-248. [20] MICOLUCCI F, GOTTARDO M, CAVINATO C, et al. Mesophilic and thermophilic anaerobic digestion of the liquid fraction of pressed biowaste for high energy yields recovery[J]. Waste Management, 2016, 48: 227-235. doi: 10.1016/j.wasman.2015.09.031 [21] 孟晓山. 高含固率猪粪污厌氧消化特征及其氨氮抑制的研究[D]. 徐州: 中国矿业大学, 2019. [22] XU Y, LU Y, ZHENG L, et al. Perspective on enhancing the anaerobic digestion of waste activated sludge[J]. Journal of Hazardous Materials, 2020, 389: 121847. doi: 10.1016/j.jhazmat.2019.121847 [23] 徐颂, 吴铎, 吕凡, 等. 含固率和接种比对林可霉素菌渣厌氧消化的影响[J]. 中国环境科学, 2010, 30(3): 362-368. [24] JIANG Y, MCADAM E, ZHANG Y, et al. Ammonia inhibition and toxicity in anaerobic digestion: A critical review[J]. Journal of Water Process Engineering, 2019, 32: 100899. doi: 10.1016/j.jwpe.2019.100899 [25] 詹瑜. 高含固剩余污泥厌氧消化过程中氮素转化规律研究[D]. 无锡: 江南大学, 2018. [26] 孟晓山, 张玉秀, 隋倩雯, 等. 氨氮浓度对猪粪厌氧消化及产甲烷菌群结构的影响[J]. 环境工程学报, 2018, 12(8): 2346-2356. doi: 10.12030/j.cjee.201802064 [27] 周富春. 基于VS的有机固体废物厌氧消化的趋势分析[J]. 环境科学与技术, 2009, 32(6): 121-122. doi: 10.3969/j.issn.1003-6504.2009.06.027 [28] 张涛. 高压均质/碱预处理-强化厌氧处理土霉素菌渣试验研究[D]. 石家庄: 河北科技大学, 2018. [29] 高妍. 基于厌氧消化的青霉素菌渣无害化处理技术研究[D]. 石家庄: 河北科技大学, 2015. [30] 朱晓磊, 田在锋, 王路光, 等. 土霉素对厌氧生物处理的抑制作用研究[J]. 中国给水排水, 2010, 26(1): 93-95. [31] 马清佳, 田哲, 员建, 等. 9种抗生素对污泥高温厌氧消化的急性抑制[J]. 环境工程学报, 2018, 12(7): 2084-2093. doi: 10.12030/j.cjee.201712098 [32] 朱晓磊. 厌氧处理中抗生素残留抑制因子的控制研究[D]. 保定: 河北大学, 2009. [33] SHI J C, LIAO X D, WU Y B, et al. Effect of antibiotics on methane arising from anaerobic digestion of pig manure[J]. Animal Feed Science and Technology, 2011, 166-167: 457-463. doi: 10.1016/j.anifeedsci.2011.04.033 [34] 唐涛涛, 李江, 杨钊, 等. 污泥厌氧消化功能微生物群落结构的研究进展[J]. 化工进展, 2020, 39(1): 320-328. [35] NELSON M C, MORRISON M, YU Z T. A meta-analysis of the microbial diversity observed in anaerobic digesters[J]. Bioresource Technology, 2011, 102(4): 3730-3739. doi: 10.1016/j.biortech.2010.11.119 [36] RIVIERE D, DESVIGNES V, PELLETIER E, et al. Towards the definition of a core of microorganisms involved in anaerobic digestion of sludge[J]. The ISME Journal, 2009, 3(6): 700-714. doi: 10.1038/ismej.2009.2 [37] YI J, DONG B, JIN J W, et al. Effect of increasing total solids contents on anaerobic digestion of food waste under mesophilic conditions: performance and microbial characteristics analysis[J]. PLOS One, 2014, 9(7): 1025-1029. [38] VRIEZE J D, HENNEBEL T, BOON N, et al. Methanosarcina: the rediscovered methanogen for heavy duty biomethanation[J]. Bioresource Technology, 2012, 112(5): 1-9. [39] SCHATTAUER A, ABDOUN E, WEILAND P, et al. Abundance of trace elements in demonstration biogas plants[J]. Biosystems Engineering, 2011, 108(1): 57-65. doi: 10.1016/j.biosystemseng.2010.10.010 -




 下载:
下载: