-
污水处理厂的能耗问题已成为关注的焦点。目前,众多研究都在优化污水处理厂的运行模式,以期实现能源的循环利用。污水处理厂存在大量有机能源和生物质可以被利用和回收。剩余污泥作为一种重要的运行副产物,具有污染物与可利用资源的双重特性。一方面,剩余污泥中含有丰富的有机质和多样的微生物群落,通过厌氧消化等处理可实现可再生清洁燃料的有效回收;另一方面,在污水处理阶段未能被清除从而迁移进入剩余污泥中的多种污染物,如重金属、无机纳米颗粒、微塑料、抗生素等,这些物质已被证实具有毒害性[1]。厌氧消化作为一项依赖多级生化反应相互关联、相互协调进行的处理技术,其发酵产能的高效性和稳定性离不开功能微生物的积极参与。研究发现,在水处理阶段,大量污染物会转移到剩余污泥中,它们的存在会不可避免地干扰厌氧消化的正常运行[2-4],这给剩余污泥的处置带来了新的挑战。基于此,部分研究探究了污染物对污泥厌氧消化的影响机制:如在污泥厌氧消化过程中,微塑料会释放浸出物以干扰系统正常运行[5, 6];罗红霉素会降低产甲烷菌的丰度,限制反应的进行[2]。然而,目前鲜有研究关注到抗生素与微塑料在剩余污泥中共存而导致的复合污染,其对厌氧消化体系的影响机理有待进一步阐明。
根据剩余污泥复杂的污染现状,多种污染物将于同一时间集中在污泥中。氧氟沙星(OFL)因其具有的特殊官能团,表现出与污泥较好的亲和力,通常是剩余污泥中检出浓度最高的抗生素[7]。与此同时,微塑料以其强大的吸附力,被证实可与环境中其他难降解污染物结合形成危害性更高的团聚体[8, 9]。本研究拟探究2种新型污染物对厌氧产甲烷系统的联合影响。选用聚苯乙烯(PS)微塑料和OFL为目标污染物,在考察其单一抑制作用的基础上,进一步考察在二者耦合影响下的复合作用,以了解复合污染负荷下厌氧消化的性能。本研究可为剩余污泥资源化过程的污染调控提供参考。
-
实验底泥取自长沙市某污水处理厂,过筛处理除去大颗粒固体杂质,提高污泥均质性。实验接种污泥为实验室厌氧发酵装置长期驯化的种泥,装置以剩余污泥为底物,培养温度为37 ℃,pH控制在7.00±0.10,实验开始前,装置运行已达稳定。实验底泥及接种污泥的各项理化性质如表1所示。PS微塑料外观为白色粉末,平均粒径为50 μm;OFL化学式为C18H20FN3O4,纯度>98%,使用前储存于2~8 ℃条件下。
-
1)生化甲烷势(BMP)实验。为分别考察PS微塑料及OFL的单一污染和复合污染2种条件下对污泥厌氧消化的影响,本研究设置单一OFL组、单一PS微塑料组以及复合组3种实验条件。单一OFL组仅投加OFL作为污染物,OFL质量浓度分别为50与500 mg∙L−1,即R1(OFL50)、R2(OFL500)组;单一PS微塑料组仅投加PS微塑料作为污染物,PS微塑料质量浓度分别为50与100 mg∙L−1,即R3(PS50)、R4(PS100)组;复合组内同时投加PS微塑料与OFL,其中PS微塑料质量浓度固定为100 mg∙L−1,而OFL质量浓度分别为50与500 mg∙L−1,即R5(OFL50-PS100)、R6(OFL500-PS100)组。另设未添加污染物的对照组,即R0组。生化甲烷势(Biochemical Methane Potential, BMP)批式实验在全自动甲烷潜力测定仪(AMPTS II, Bioprocess Control)中开展。AMPTS II提供的厌氧培养瓶有效容积为400 mL,实验底泥和接种污泥投加量分别为75和225 mL。反应开始前,将污泥与污染物充分混合后,加入PBS缓冲液。通入氮气5 min排除顶空空气,创造无氧环境。实验过程中采用水浴装置全程控制温度在(37±1) ℃,搅拌器持续工作保持物料均匀混合。产气终点以反应器连续3 d日产量不足累积产量的1%作为指示[10]。
2)厌氧消化阶段模拟实验。本研究设置4组模拟实验以考察在污染物介入下厌氧消化增溶、水解、产酸、产甲烷4个代谢过程的变化。增溶实验以新鲜污泥为消化底物,通过溶解性化学需氧量(SCOD)的质量浓度考察有机物的溶出程度;水解实验以含牛血清蛋白(BSA)的合成废水为底物,等量代替BMP实验中的实验底泥,观察3 d后BSA降解率;产酸实验通过投加定量谷氨酸、葡萄糖分别模拟蛋白和糖类底物,测定其产物即挥发性脂肪酸(VFAs)产量;产甲烷实验采用乙酸钠作为底物,测定甲烷产量。为保持微生物的正常代谢,合成废水成分主要有:1.0 g∙L−1 KH2PO4、0.6 g∙L−1 MgCl2·6H2O、0.4 g∙L−1 CaCl2以及1.0 mL∙L−1微量元素储备液(含Fe2+、Co2+、Zn2+等)。除产甲烷实验外,其余3组实验均添加10 g∙L−1甲烷抑制剂2-溴乙烷磺酸钠,阻断有机物向甲烷的转化,其余操作与BMP实验保持一致。
-
BMP实验产气量由AMPTS Ⅱ仪器自动进行计量。实验进程中定期取样,对样品做8 000 r∙min−1离心、0.45 μm过滤处理后,测定其相关理化指标。COD采用消解分光光度法[11]测定;可溶性蛋白和多糖的测定方法分别为Folin-Lowry法[12]和蒽酮硫酸法[13];VFAs的测定采用气相色谱法(7820A,Agilent Technologies)[14];胞外聚合物(EPS)采用热提取法[15];溶解性有机物(DOM)及EPS组分结构的测定采用三维荧光法(Horiba Aqualog,HORIBA Scientific)。
-
采用修正Gompertz模型[16]评估厌氧消化性能,进一步讨论2类污染物的作用机制。BMP实验结束后,将采集到的产甲烷数据导入Origin软件进行拟合。修正Gompertz模型如式(1)所示。
式中:P为累积甲烷产量,mL∙g−1(以单位VS的产量计);Pm为最大产甲烷潜力,mL∙g−1;Rm为最大产甲烷速率,mL∙(g∙d)−1(以单位VS在单位时间内的产量计);λ为滞后期,d;t为反应时间,d;e取2.718 3。
-
16S rRNA测序工作委托第三方进行,细菌与古菌的测序引物分别为338F-806R与524F10extF-Arch958RmodR。BMP实验结束后,采集R0、R2、R4及R6组的样品,考察其细菌与古菌群落变化。
-
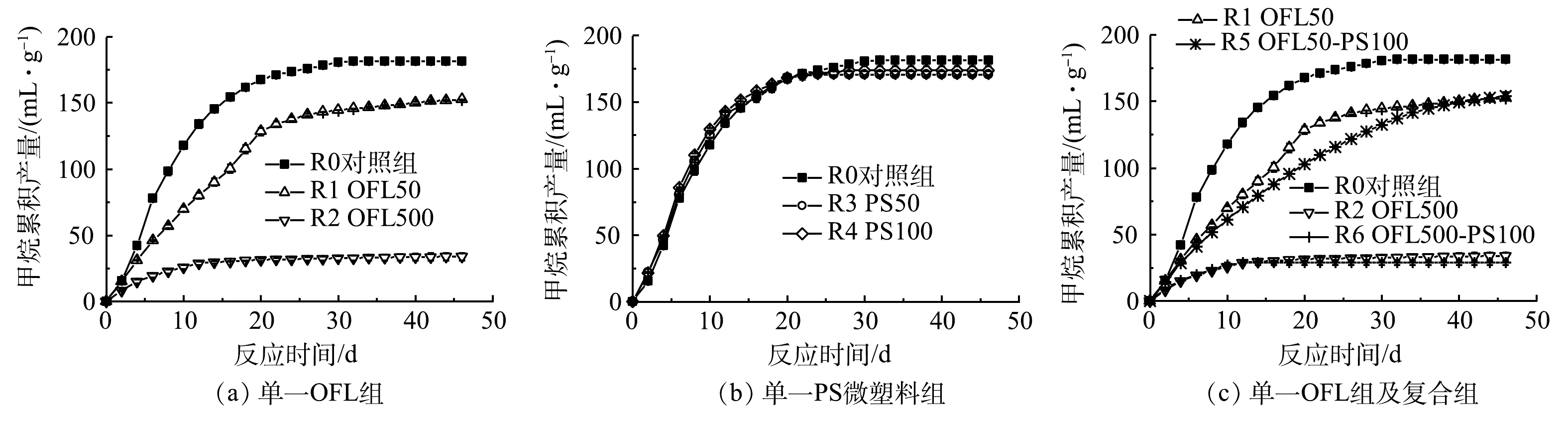
1)单一污染对累积甲烷产量的影响。图1(a)所示为R0、R1、R2的累积甲烷产量(以单位VS的甲烷产量计)。运行初期,各组立即表现出不同的增长速率。50 mg∙L−1 OFL反应初期对产气量影响较小,后期抑制作用逐渐增强,而500 mg∙L−1 OFL条件下自初期就呈现出较强的抑制。至反应结束时,R1累积产量较对照组降低了15.95%(P<0.05),R2产气量于第18 d不再显著增加,最终产量与对照组相比显著降低了81.36%(P<0.05)。可见,OFL抑制了甲烷产量,且随着OFL质量浓度的提升,抑制逐渐增强。
由图1(b)中甲烷累积产量增长趋势可以发现,反应初期PS微塑料的存在会提升甲烷产生速率,而运行20 d后甲烷产量增长趋势逐渐平缓。反应结束时,R3和R4甲烷累积产量较对照组分别降低了5.78%和4.25%。可见,PS微塑料在一定程度上会造成产甲烷能力的下降,但其胁迫作用未随投量的增加而明显增强。在厌氧消化进程中,一些尺寸微小的污染物,如PVC微塑料[5]、纳米零价铁[17]等,被证实可有效促进污泥的增溶或水解,以缓解限速步骤对产气的影响,这也可能是PS微塑料对初期产气量具有轻微促进作用的原因。然而,PS微塑料的毒性也不可忽视。有研究发现,PS微塑料会刺激EPS的蛋白二级结构和表面官能团发生改变[18, 19],也会引起微生物群落的变化[3]。如图1(b)所示,实验后期PS微塑料的生物毒性逐渐占主导地位,故导致了产气量增长的滞缓以及累积产量的降低。
2)复合污染对累积甲烷产量的影响。图1(c)为PS微塑料与不同质量浓度OFL复合污染下甲烷产量随反应时间的变化。至反应结束时,R5与R6的总产气量较对照组均显著降低(P<0.05)。将R5与R1的甲烷产量增长趋势进行对比发现,加入100 mg∙L−1PS微塑料后甲烷产量增速有所变缓;100 mg∙L−1 PS微塑料与500 mg∙L−1 OFL复合作用时,R6产气量自第11 d起未见明显增长,与其对应单一条件组R2与R4对比,产气停止时间有所提前。上述实验结果表明,在厌氧消化产甲烷过程中2种污染物具有联合胁迫作用,但在不同复合条件下,协同抑制作用具体表现略有不同:低浓度抗生素复合PS微塑料主要会引起产气速率的降低,而高浓度抗生素与PS微塑料的复合则会导致反应提前终止。
3)厌氧消化产甲烷动力学分析。通过数据拟合可获得最大产甲烷潜力(Pm),最大产甲烷速率(Rm)和滞后期(λ)3个重要参数,拟合结果如表2所示。在所有条件下,滞后期λ值均为0 d,这说明实验接种的微生物性能良好,能迅速适应环境并利用有机质[20]。在不同质量浓度OFL的作用下,R1和R2组的Pm和Rm较对照组均有所降低,进一步说明OFL会抑制厌氧消化产甲烷。投加PS微塑料后,Rm拟合值较对照组有所增长,符合R3与R4前期产甲烷速率略高于对照的结果。与此同时,相比于R1,R5组的Rm下降了27.5%。这与图1(c)中R1与R5组产气量增长趋势的差异相一致。
-
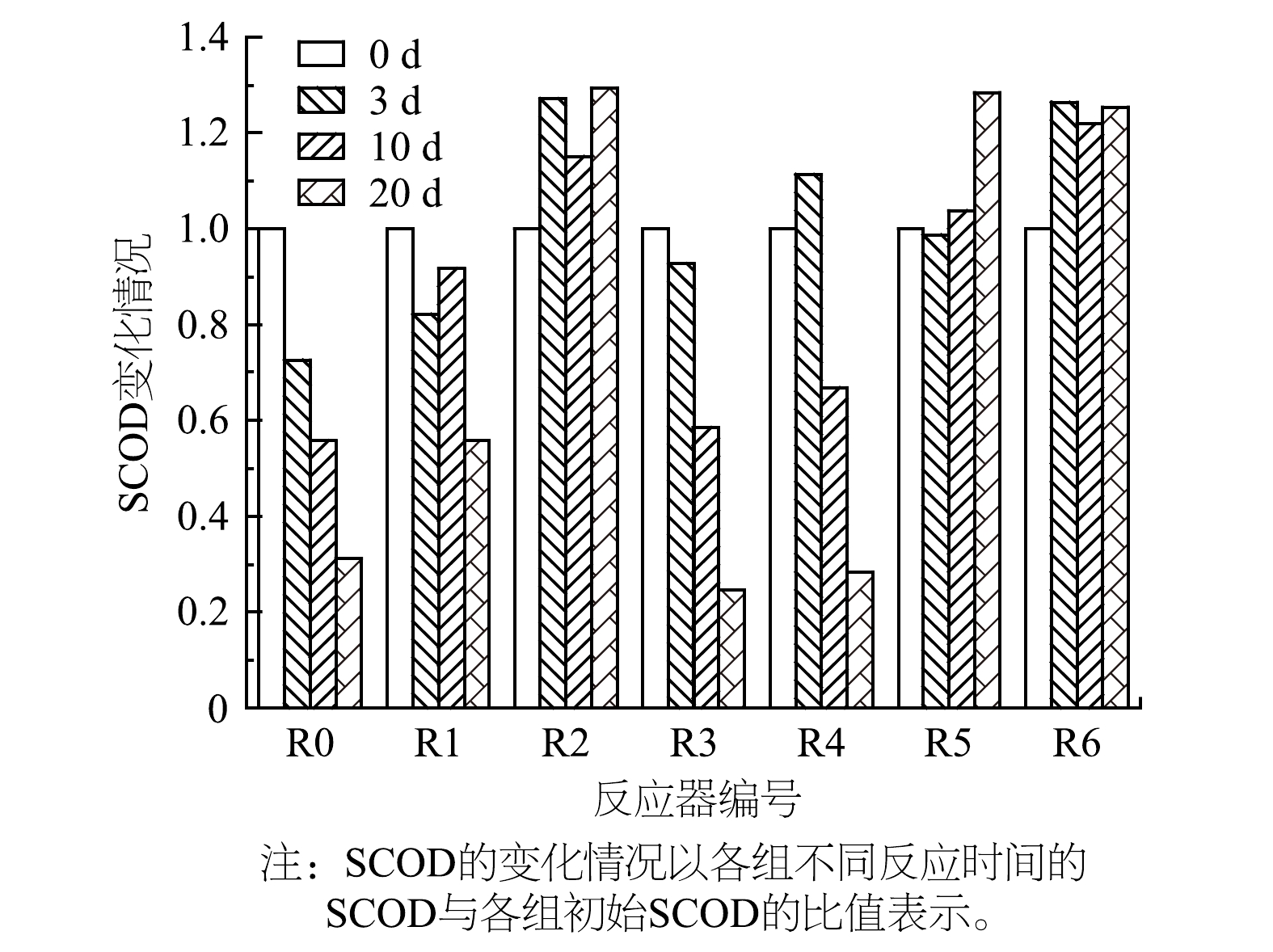
厌氧消化过程中SCOD的变化是溶出与消耗2个进程共同进行的动态结果。如图2所示,R0的SCOD持续降低。可见,微生物能迅速参与污泥分解和有机物降解,保证了甲烷化过程的稳定性。R1和R2中出现了SCOD升高的现象。这表明,OFL的存在不利于消化过程中有机物的降解。R4组SCOD在第3 d有所升高,随后迅速降低。这说明,R4前期有机物溶出速率大于消耗速率。将各组反应后期的SCOD进行对比可以发现,单一OFL组(R1与R2)有机物降解的能力明显弱于单一PS微塑料组(R3与R4)。此外,复合组在10 d到20 d内SCOD积累效应加剧。这意味着,复合条件下有机物转化利用效率较单一组进一步降低,对消化过程产生不良影响。
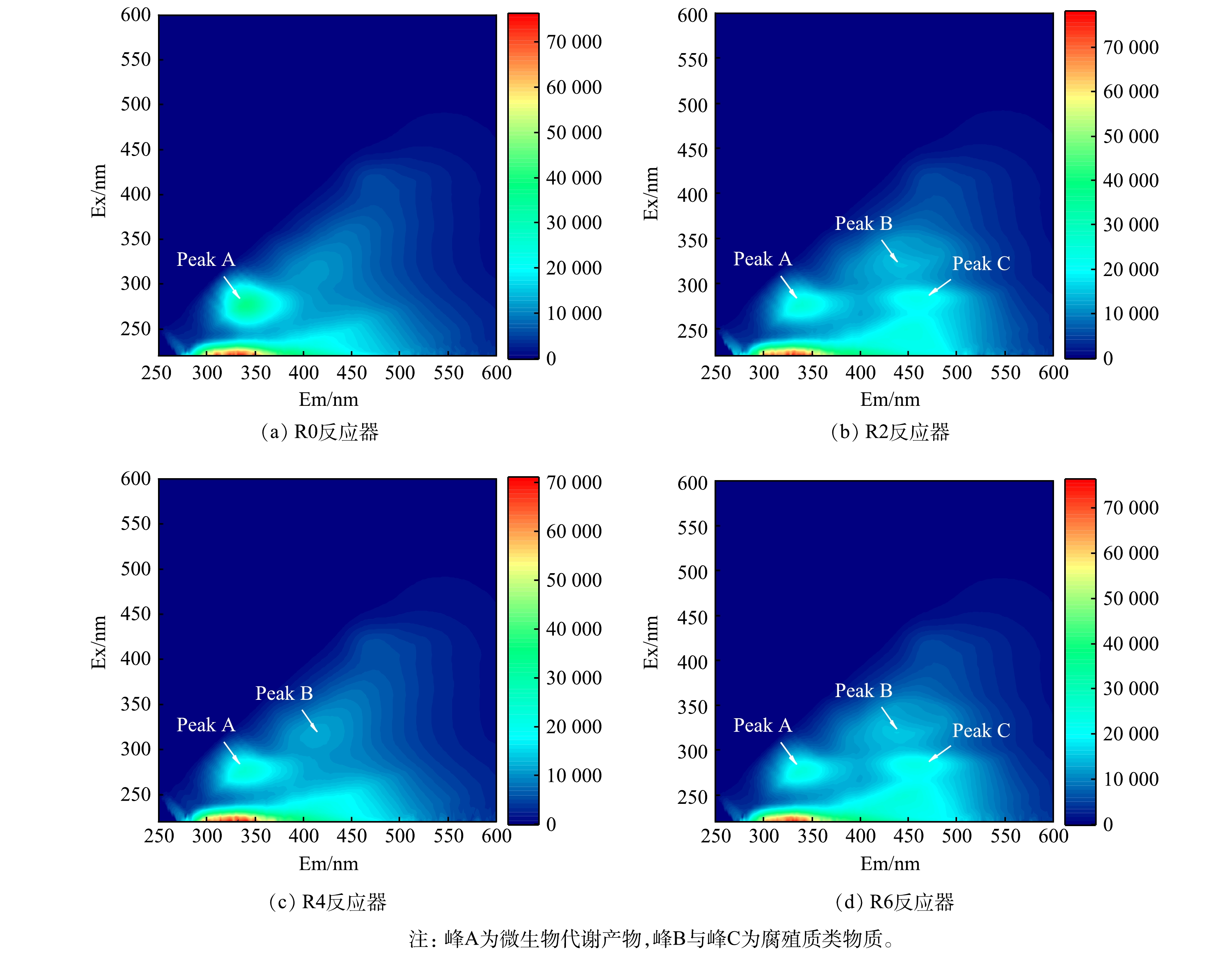
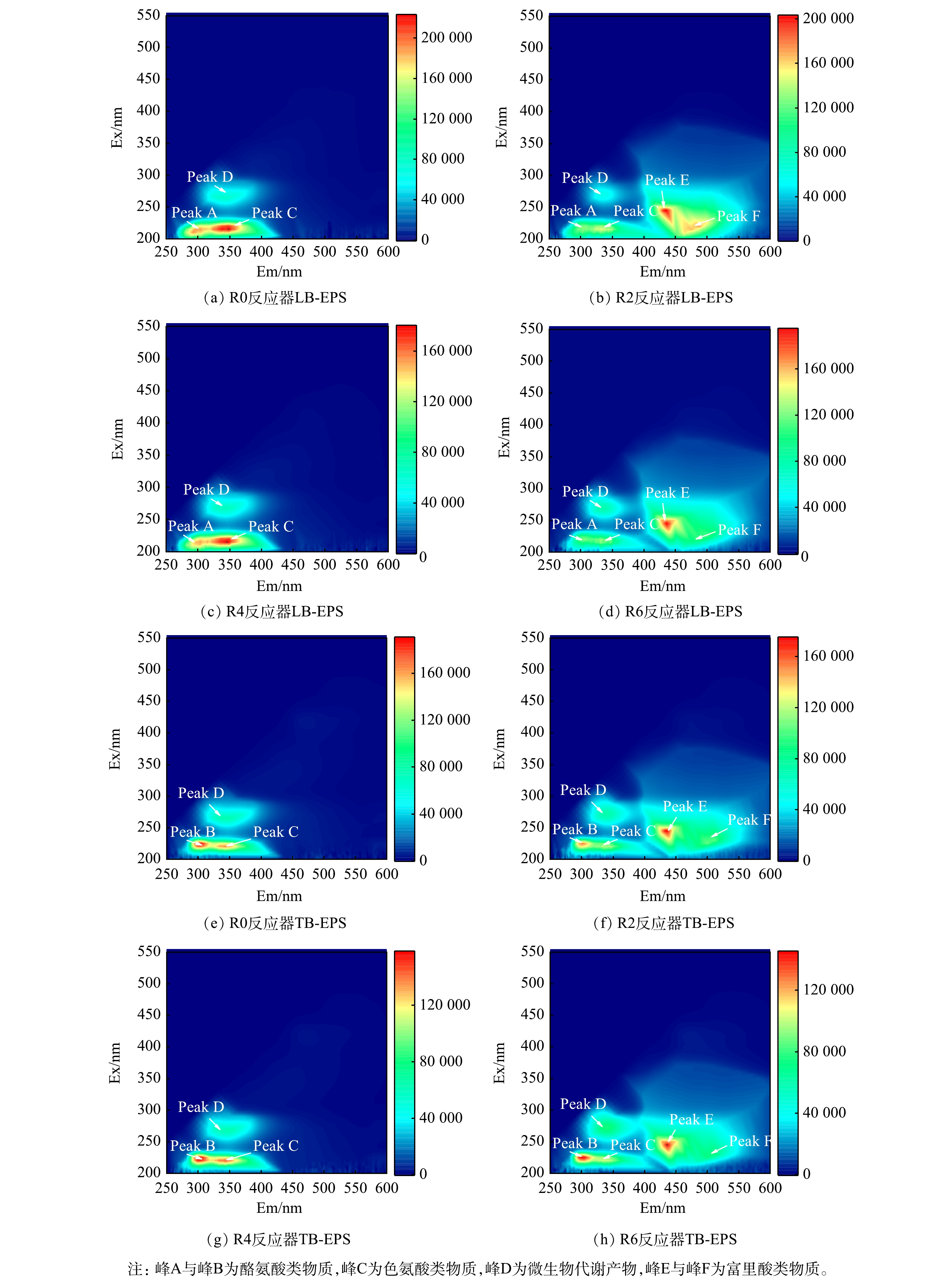
为进一步探讨DOM的组分变化,通过三维荧光技术对R0、R2、R4、R6反应器内第3 d样品进行了测定。采用Chen提出的区域积分法(FRI)[21],将三维荧光区域分为5个区,分别表示不同类型的有机物:区域Ⅰ(Ex/Em=200-250/250-330)表征酪氨酸类物质、区域Ⅱ(Ex/Em=200-250/330-380)表征色氨酸类物质、区域Ⅲ(Ex/Em=200-250/380-600)表征富里酸类物质、区域Ⅳ(Ex/Em=250-600/250-380)表征溶解性微生物代谢产物、区域Ⅴ(Ex/Em=250-600/380-600)表征腐殖质类物质,并根据分区计算不同类型物质荧光响应百分比Pi,n值。如图3所示,R0中峰A的荧光强度最高,而在R2、R4、R6中荧光强度均有所下降,各污染组中区域IV的Pi,n也呈现出降低趋势(表3)。这说明,2种污染物会降低微生物可利用的有机物的相对含量。相较R0,R2与R6中新增峰B与峰C,且区域Ⅲ、Ⅴ的Pi,n随污染物的添加同步增长。此外R6中峰B和峰C的荧光强度在R2基础上有所增强,且R6中峰C在Em方向上出现红移。这表示,R6中腐殖质类物质的荧光团浓度及其特定官能团有所增加[22],而富里酸与腐殖质类物质的积累不利于生物降解[23]。可见,在复合条件下溶解性有机物在结构上明显趋于难降解,这也是造成产甲烷性能低下的潜在原因之一。
-
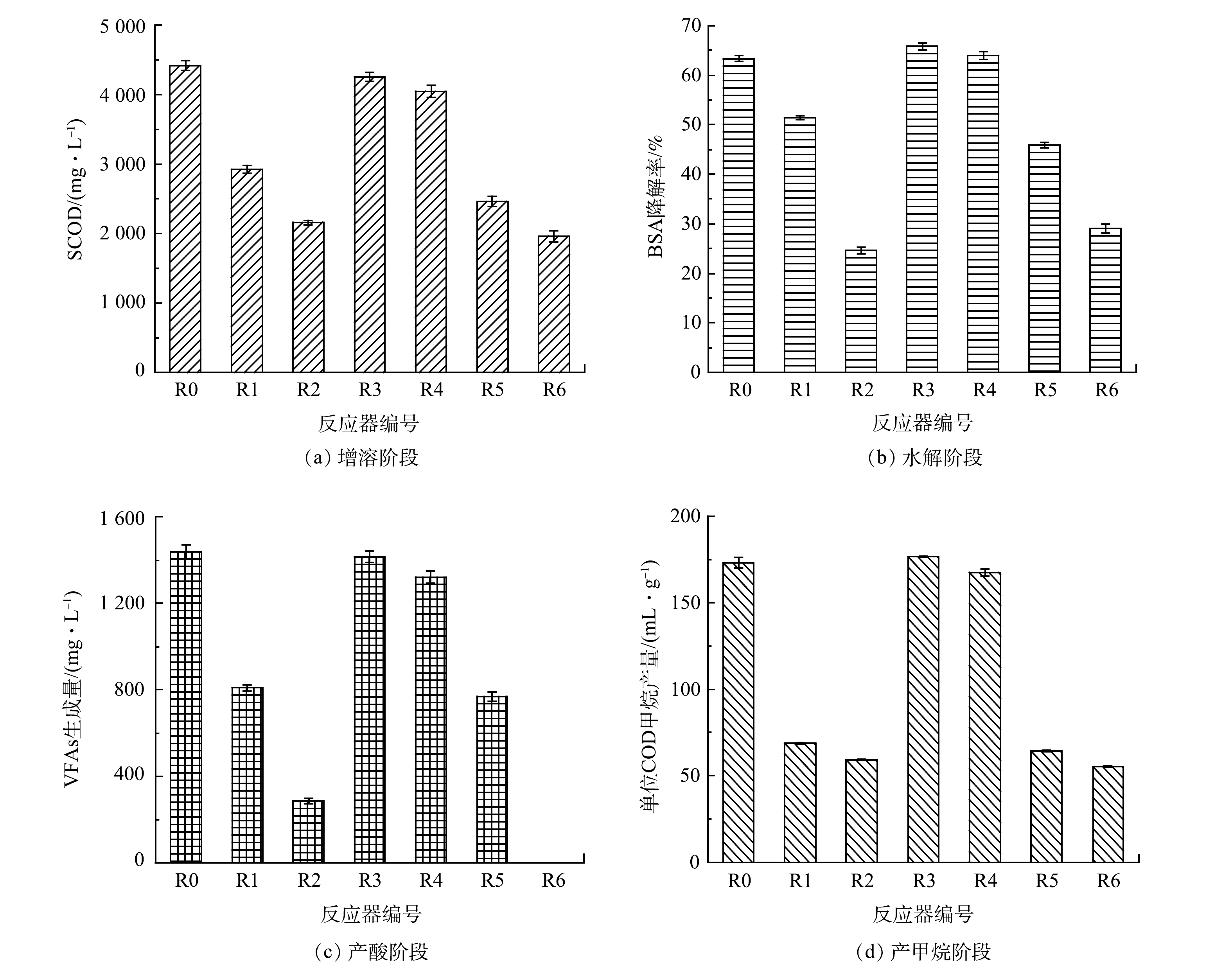
1)对增溶阶段的影响。增溶阶段的代谢过程主要表现为有机物的溶出,通过图4(a)中各组第3 d SCOD的质量浓度考察单一及复合污染对这一阶段的影响。如图4(a)所示,R1与R2反应器SCOD质量浓度显著低于对照组(P<0.05)。可见,OFL会降低可溶性有机质的释放。相较之下,PS微塑料对增溶阶段的影响较弱,与对照组相比,R3与R4抑制率分别仅有3.81%和8.37%(P<0.05)。复合污染情况下存在协同作用,R5与R6较对照组抑制率增加至44.36%和55.66%。基于2种污染物对增溶阶段的单一影响,可以看出,在复合污染下OFL的抑制作用处于主导地位,PS微塑料的加入强化了OFL在增溶阶段的抑制作用,对污泥结构的转化和可溶性物质的溶出造成影响,严重限制后续阶段的反应。
2)对水解阶段的影响。在水解阶段,微生物将大分子复杂底物分解成为小分子有机物,图4(b)显示了第3 d各组牛血清蛋白(BSA)的降解率。OFL降低了BSA的降解率,且抑制作用随着投加量的增加而呈递增趋势。外源污染物的存在会造成微生物部分代谢功能(如水解酶代谢)紊乱[6],或者酶与底物碰撞结合的概率降低[24],从而抑制水解底物的降解。不同于单一OFL组,含PS微塑料的R3和R4组BSA降解率略高于对照组。基于OFL的强抑制作用,加入PS微塑料之后,R5的BSA降解率较R1降低了10.63%(P<0.05)。这表明,低浓度OFL与PS微塑料复合加强了OFL对水解的抑制效果。然而,相较R2,R6中BSA降解率提高了18.19%。其原因可能是,PS微塑料强大的吸附能力削弱了高浓度OFL在厌氧体系中的扩散与分布,减少OFL与微生物或水解酶之间的直接接触,一定程度上维持了水解过程的正常进行[25]。
3)对产酸阶段的影响。产酸模拟实验以谷氨酸、葡萄糖为底物,考察了发酵4 d后系统内VFAs质量浓度的变化。乙酸、丙酸和丁酸等主要产物均按比例换算为单位体积的COD来计算总VFAs质量浓度,以考量底物的转化情况。如图4(c)所示,VFAs生成量随着OFL投加量逐渐增加而明显下降。这表明,OFL对产酸阶段具有抑制作用。相较对照组,50和100 mg∙L−1 PS微塑料对产酸过程的抑制率分别为1.68%(P>0.05)和8.18%(P<0.05)。ZHANG等[26]统计了5 μm PS微塑料对葡萄糖降解率的影响,发现50~200 mg∙L−1 PS微塑料未显著影响产酸,当质量浓度达250 mg∙L−1时,降解率较对照组下降了3.81%。这表明,较低剂量的PS微塑料可能不足以抑制产酸。此外,复合污染对产酸活动的抑制更为明显,尤其是R6,在第4 d仍然检测不到VFAs的生成。这表明,复合条件下抑制程度加剧,致使氨基酸、葡萄糖等小分子有机物无法有效转化成产甲烷菌可利用的底物,从而影响体系的能源利用和转化效率。
4)对产甲烷阶段的影响。如图4(d)所示,产甲烷阶段模拟实验进行了10 d。在提供充足乙酸钠为底物的情况下,R1与R2甲烷产量较对照组显著下降(P<0.05),可见OFL会阻碍乙酸盐的转化。而在单一PS条件下,R3与R4甲烷产量与对照组相比未见显著性差异(P>0.05)。这说明,产甲烷微生物受PS微塑料的影响相对较小。在复合条件下,R5组产甲烷阶段的效率较R1降低了6.68%,该阶段效率的下降也是导致BMP实验中R5产甲烷速率低于R1的原因之一。产甲烷菌易受外界环境的影响,多项研究也证明有毒污染物会严重影响产甲烷菌的生长代谢情况[2]。因此,根据单一OFL组与复合组中产甲烷阶段效率的下降推测,对应条件下产甲烷功能微生物的生长代谢水平可能受到了限制。
-
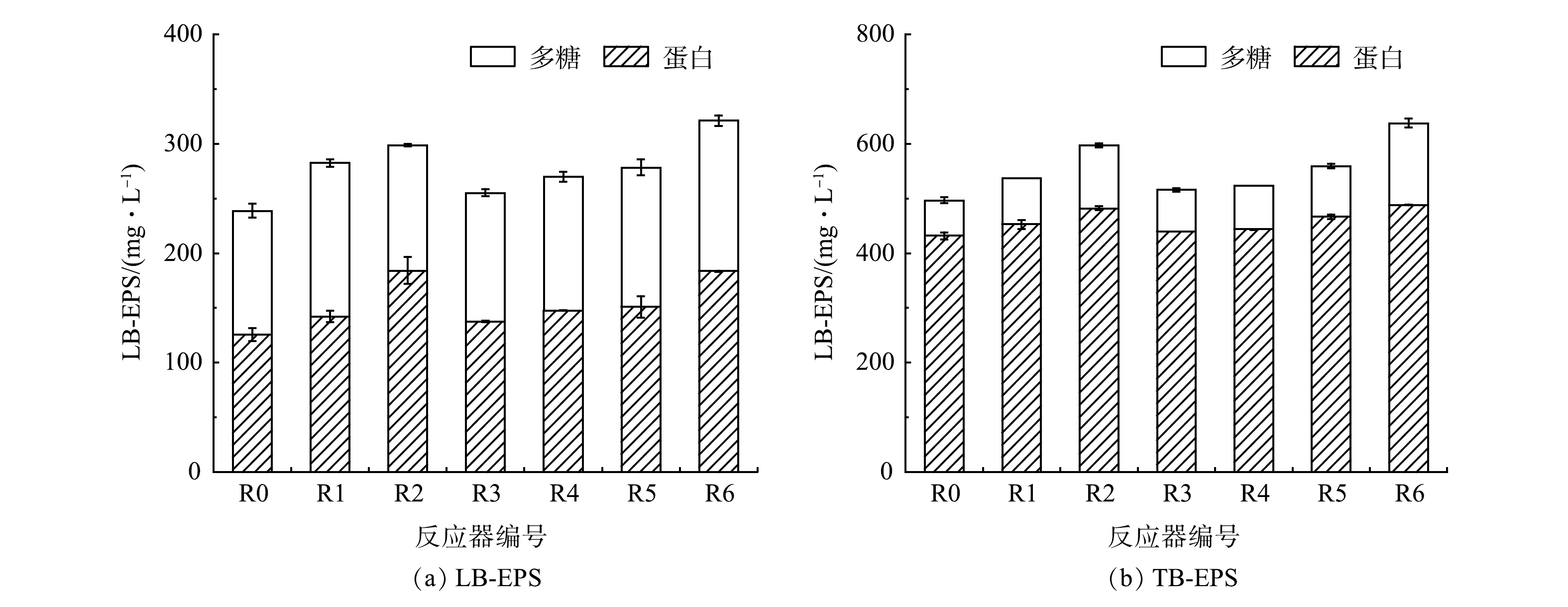
EPS的分泌是微生物防御有毒侵害的关键机制之一。由图5可看出,两类污染物均刺激了EPS的分泌,随着投加量的增长,EPS质量浓度(以单位体积COD计)也在增加。单一条件下,R1、R2组中2类EPS质量浓度均高于R3、R4组。这表明,OFL较PS微塑料具有更强的毒性。将复合组与单一OFL组进行对照发现,R5的EPS总质量浓度与R1基本相当(P>0.05),R6较R2则显著提高了7.03%(P<0.05)。这表明,高浓度OFL条件下生物毒性复合效应更强。
污染物在到达细胞体之前需要穿过EPS层,通过三维荧光检测不同EPS的组分变化可以大致揭示不同污染条件对微生物的潜在毒性威胁。如图6(a)~图6(h)所示,R2和R6组中峰A、峰B的荧光强度及对应I区+II区的Pi,n值均明显低于对照组,即其中可生物降解物质的相对含量有所降低。基于表4,R4中Ⅲ区与Ⅴ区的Pi,n值与对照组基本相当,而投加了OFL的R2与R6组中富里酸类物质(Ⅲ区)与腐殖质类物质(Ⅴ区)的相对含量高于对照,且这2组中新增了峰E与峰F,可见EPS中富里酸类与腐殖质类物质的增加与OFL有直接关系。EPS中的腐殖质通常来源于自身分泌与环境吸附,与蛋白质和多糖不同,腐殖质难以生物降解。因此,EPS中腐殖质的富集相当于增加了细胞体外层结构的复杂性,使得相关酶与有机物的接触受限,这将对水解产酸等过程造成不利影响[27]。
-
根据细菌属水平的结果(图7),相对丰度最高的细菌菌属依次为:Hydrogenispora、Dechlorobacter、Clostridium_sensu_stricto_1。优势菌属Hydrogenispora具有良好的产酸性能[28],在R2、R4和R6中的相对丰度均低于对照,依次降低了55.63%、57.93%、60.47%,这与OFL抑制产酸的结果相吻合。结合2.3节的结果,PS微塑料对产酸的抑制远不及OFL和复合污染,尽管R4中Hydrogenispora相对丰度大幅降低,但其余一系列产酸菌,如通过水解蛋白产酸的Lutispora、Proteiniclasticum等[29, 30]在R4中的相对丰度要明显高于对照以及其他污染组。这说明,其水解产酸功能细菌群落结构出现了变化。次优势菌种Dechlorobacter被证实具有降解抗生素的能力[31],在R2与R6中的相对丰度明显大于R0与R4。据此推测,该菌可能参与了抗生素的生物降解过程。产酸细菌Clostridium_sensu_stricto_1在各污染组的丰度要高于对照组。这表明,该菌属对有毒污染物具有一定的耐受能力,这也与其他研究结果一致[4, 32]。
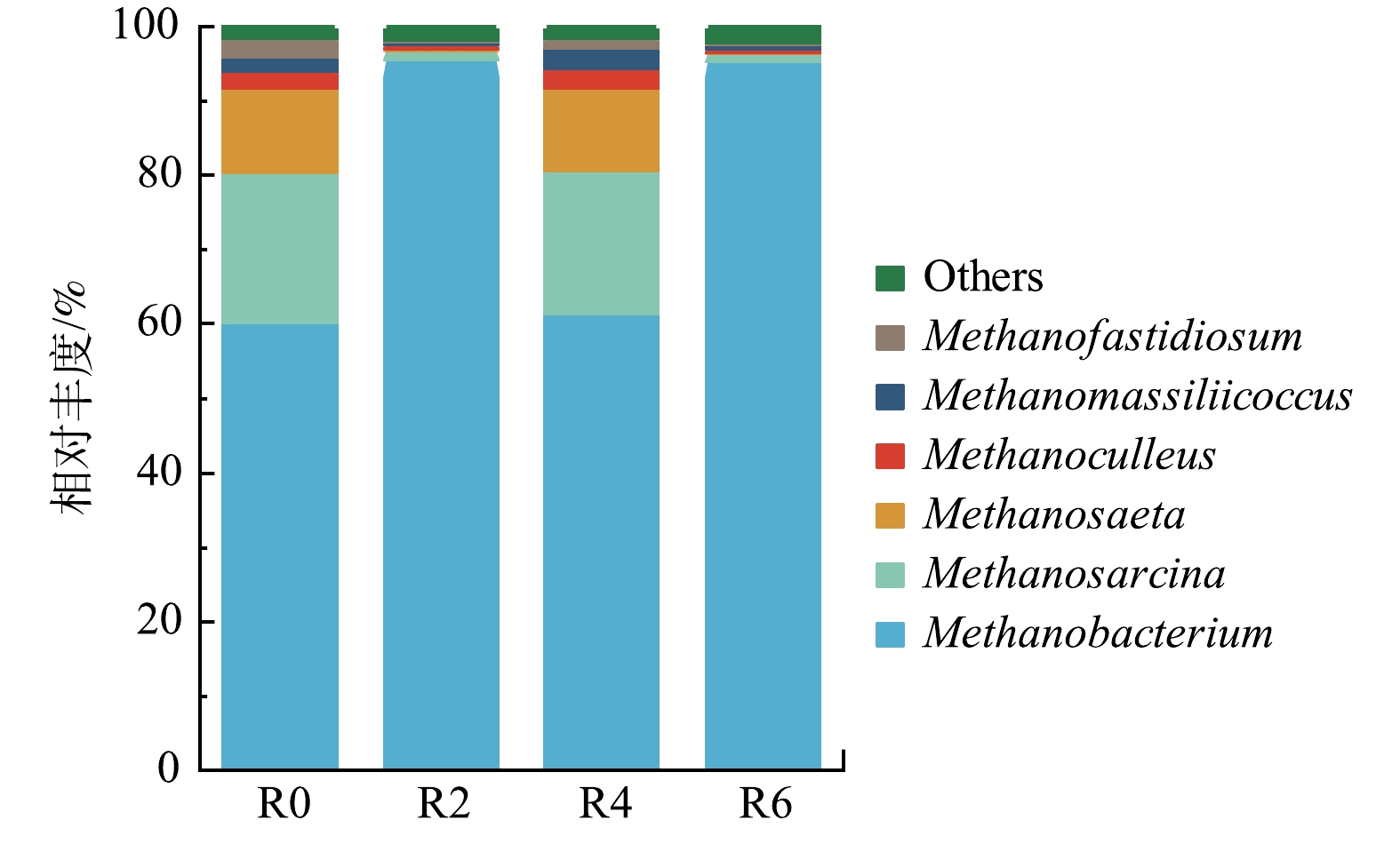
古菌在属水平的优势菌属分别为Methanobacterium、Methanosarcina、Methanosaeta(图8)。这3种菌分别代表了不同的产甲烷方式。丰度最高的Methanobacterium是嗜氢产甲烷菌,在R0、R2和R4中相对丰度分别为60.22%、95.62%和61.51%。复合组R6中Methanobacterium丰度水平与R2较为接近,为95.34%。这说明,复合污染体系内古菌受OFL影响主导。由于嗜氢产甲烷菌在OFL的影响下几乎覆盖了R2与R6的古菌群落。因此,在这2组中其他产甲烷菌的相对丰度降低。以乙酸为底物的Methanosaeta在R0和R4中的相对丰度为11.40%和11.17%,可视作重要的产甲烷途径之一,而在R2与R6中的占比仅为0.28%和0.21%。据此推测,OFL严重阻碍了利用乙酸产甲烷的代谢途径[33]。次优势菌属Methanosarcina为兼性产甲烷菌,可利用的底物更为多样,其丰度排序为:R0(20.29%)>R4(19.14%)>R2(1.14%)≈R6(1.13%)。综上可知,OFL对古菌群落的影响表现在改变了其主要的产甲烷途径,结合2.3节OFL对产酸过程的抑制,推断在厌氧消化过程中,R2与R6乙酸生成受到限制,导致嗜乙酸产甲烷菌的底物缩减,从而诱导古菌群落向氢营养为主导的代谢途径演替。
-
1)当厌氧消化受到OFL胁迫时,甲烷产量会随其投加量增加而显著降低。机理分析发现,OFL会导致DOM生物降解性降低,EPS结构复杂化。产酸细菌Hydrogenispora等以及嗜乙酸产甲烷菌Methanosaeta丰度明显减少,导致产酸性能下降,不利于甲烷化。
2) PS微塑料对甲烷产量的抑制弱于OFL,且对初期甲烷生成速率略有提高;PS微塑料有利于Lutispora、Proteiniclasticum等消耗蛋白产酸的细菌的富集。
3)低浓度OFL与PS微塑料复合污染会减缓产甲烷速率,高浓度OFL与微塑料复合污染则会严重阻碍产酸活动的正常代谢。复合组微生物群落的变化主要受OFL影响,古菌群落向氢营养为主导的代谢途径演替。
氧氟沙星与聚苯乙烯微塑料复合污染对剩余污泥厌氧消化的影响
Effects of combined ofloxacin and polystyrene microplastics on anaerobic digestion of waste activated sludge
-
摘要: 为探究抗生素与微塑料复合污染对厌氧消化的作用影响,采用BMP实验考察了不同质量浓度氧氟沙星(OFL)、聚苯乙烯(PS)微塑料对剩余污泥厌氧消化产甲烷的影响行为,并通过分析溶解性有机物(DOM)、胞外聚合物(EPS)变化规律、厌氧发酵4阶段代谢以及微生物群落探讨其影响机理。结果表明,与对照组相比,单一OFL和单一PS微塑料污染使甲烷累积产量分别下降了15.95%~81.36%、4.25%~5.78%;而在复合条件下,两者表现出协同效应,故导致产甲烷速率的进一步下降和有效产气时间的缩短,其中OFL胁迫占主导。机理探究发现,不论单一OFL还是复合污染,DOM中腐殖质类物质均明显增加,EPS组分结构趋于复杂化,厌氧消化4阶段均受到明显抑制。单一PS微塑料污染在反应初期可提高产甲烷速率,且对厌氧消化4阶段的影响相对较小。微生物群落分析发现,复合组与单一OFL组群落分布更为相近,产酸细菌与嗜乙酸产甲烷菌的相对丰度均明显下降,这导致乙酸营养型产甲烷途径受到严重抑制。本研究结果可为复杂污染情况下剩余污泥资源化处理的工艺调控提供参考。Abstract: In order to explore the influence of combined antibiotic and microplastic on anaerobic digestion, the effects of two pollutants, ofloxacin (OFL) and polystyrene (PS) microplastics, on anaerobic digestion were investigated at different mass concentrations by BMP tests. The mechanism was explored by analyzing dissolved organic matter (DOM), extracellular polymeric substance (EPS), four stages metabolic process of anaerobic digestion and microbial community. The results showed that the individual OFL and individual PS microplastics decreased the methane cumulative production by 15.95%~81.36% and 4.25%~5.78%, respectively, compared to the control. However, under the combined conditions, the two showed synergistic effects, leading to the further decrease in methane production rate and the reduction in effective gas production time, in which OFL stress was dominant. The mechanism analysis revealed that both individual OFL pollution and combined pollution greatly increased the humic substances in DOM, complicated the structure of EPS components and inhibited the efficiency of the four stages of anaerobic digestion. The individual PS microplastics pollution increased methane production rate at the beginning of the reaction, and caused relatively less effect on the four stages. Microbial community analysis indicated that the combined pollution had a more similar community distribution to the individual OFL pollution. The relative abundance of acidification bacteria and acetic acid methanogen decreased significantly, which resulted in a severe suppression of methanogenic pathway of acetic acid nutrition. The results of this study can provide a reference for the process regulation of waste sludge resource treatment under complex pollution situations.
-
Key words:
- ofloxacin /
- microplastics /
- polystyrene /
- anaerobic digestion /
- microbial community
-
在2014—2018年,我国年产酚醛树脂量由8.970×105 t增加到1.303×106 t,年复合增长率为9.78%。随着酚醛树脂产量的增加,其相应生产废水的量也在逐年增加。据统计,每生产1 t热固性酚醛树脂约产生0.90 m3 的高浓度有机废水[1]。酚醛废水中含有大量挥发酚、苯酚和游离甲醛,还含有部分甲醇和少量低分子树脂等有毒物质,其中,甲醛>1 000 mg·L−1、苯酚>5 000 mg·L−1、COD>10 000 mg·L−1。
目前,通常采用多种工艺联合的方法来处理酚醛废水,以化学-生物联用法较为普遍[2-6]。然而,化学法的预处理需要添加药剂,不仅提高了运行成本,而且残留的药剂还会影响后续生化反应。例如,在微电解+Fenton氧化预处理过程中,H2O2的残留会对后续生化反应造成不利影响,同时氧化剂的大量消耗会导致运行成本升高[2]。因此,本课题组前期开发了微生物辅助铁炭微电解的预处理工艺,实现了酚醛废水中有机物低成本的有效去除,且提供了废水的可生化性。厌氧处理工艺和好氧处理工艺的联合是当前处理酚醛废水的常用生物处理方法[3-5],然而,微生物对苯酚和甲醛浓度较为敏感,苯酚对大部分微生物有毒,是生物转化过程中的抑制性底物。但在低浓度时,苯酚可以被生物降解[4-5]。甲醛具有抗微生物性质,能与细胞内蛋白质结合,使细胞失去活力。2.40 mol·L−1的甲醛对厌氧生物过程造成50%的抑制[7]。有研究[8]还表明,甲醛的生物降解需要将甲醛浓度控制在100 mg·L−1以下。相对于好氧菌,厌氧菌对苯酚和甲醛的浓度更为敏感[6]。然而,对于高浓度有机废水,厌氧生物处理具有产能和治污相结合的优点,是目前污染物资源化最有效最直接的方式[9]。且本课题组前期研究结果也表明,传统的厌氧生物技术对高浓度苯酚的降解具有一定的限制性。因此,如何实现厌氧工艺处理对高浓度苯酚废水的高效处理是本研究要解决的问题。
虽然传统的厌氧技术对苯酚和甲醛的降解能力有限,但近年来兴起的微生物电化学系统(bio-electrochemical system, BES)为厌氧系统中乙酸的高效利用和加快有机物梯级降解提供了新的研究思路和技术创新路线[10]。作为BES的一种,微生物电解池(microbial electrolysis cell, MEC)的产甲烷过程能在无质子膜的单室MEC中轻易实现,这样的MEC可以看成是耦合了微生物电化学催化的厌氧反应器,只需要在厌氧系统中插入电极并施加一定的电压即可实现在阳极氧化有机物和在阴极产甲烷。此外,产甲烷MEC的电极制作还无需贵金属催化剂从而大大降低了运行成本并提高了可操作性[11]。因此,MEC在实际应用中更受青睐[12-13]。有研究[14]表明,厌氧折流板反应器耦合微生物电解池体系(anaerobic baffled reactor, ABR-MECs)对高浓度难降解有机废水的去除具有优势。同时还发现中温的ABR-MECs中试系统实现了对污水中有机能源的高效挖掘,微生物电化学强化对厌氧系统的产甲烷增益作用远大于其增加的能耗[15]。
基于以上研究结果,本研究在构建酚醛废水处理组合工艺过程中,在借鉴常用的预处理-厌氧-好氧的工艺联合的基础上,进行了新的技术探究,引入ABR-MECs作为酚醛废水处理组合工艺的厌氧段工艺,且采用前期探究中获得的高效低成本的微生物辅助铁炭微电解为预处理工艺,好氧段选择运行高效稳定且操作简单序批式活性污泥反应器(sequencing batch reactor, SBR),并针对新构建的组合工艺进行了酚醛废水的处理性能分析和技术经济分析。
1. 实验材料与方法
1.1 实验材料
预处理实验选用的铁碳填料购买于南京宝热化工公司,其密度约为1 200 kg·m−3,比表面积约为1.20 m2·g−1, 空隙率>65%,规格直径为2.50 cm,物理强度≥1 000 kg·cm−2。铁碳填料纯度为87%,其中,含铁量为75%,碳含量为12%,金属催化剂(铜和锰)含量为5%,其他部分为高黏土。首次使用铁碳填料前,使用1%~2%稀盐酸搅拌清洗3~5 min以进行激活。为了保证污泥种群多样性,体系中接种了2种不同来源的厌氧活性污泥,即柠檬酸废水和淀粉废水处理的厌氧污泥,2种污泥混合后的污泥VSS为22.63 g·L−1、VSS/TSS为0.65。
好氧段SBR反应接种污泥来自厦门市集美污水厂的二沉池污泥,取回污泥后,过筛去除杂物和沙子,以乙酸纳为碳源,对污泥进行间歇曝气培养,每天曝气2 h,曝气培养1周。本实验中污泥的MLSS为4 g·L−1,按照SBR的工作体积(2.50 L)进行污泥接种,比例为20%。
1.2 组合工艺流程
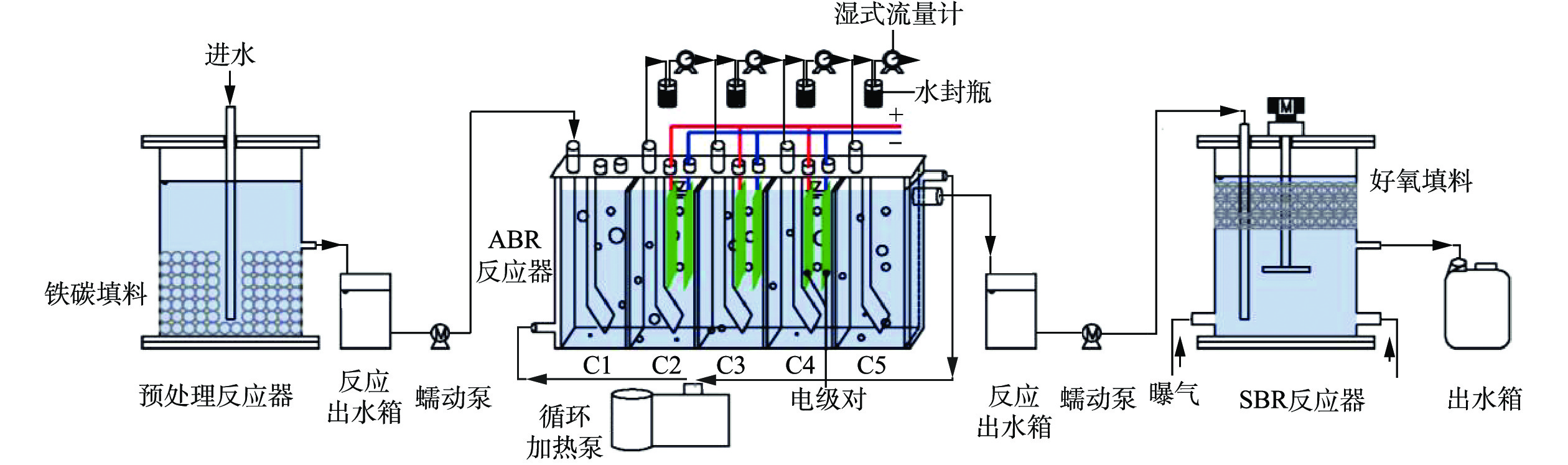
预处理反应器为直径为14 cm,高度为18 cm的有机玻璃圆柱体,反应器中间设置排水口,排水口以下体积为1 L。ABR反应器为5格室(C1~C5)有机玻璃结构,有效体积2.50 L,单格有效体积0.50 L。下流区和上流区体积比1:3。通过加热恒温循环槽实现控温,温度为(37±1.50) ℃。每一格室都有1个出水口和1个排气口,气体通过5 L的铝箔气袋收集。电极对安置于ABR中C2、C3和C4的上流区,阴阳电极的间距为15 mm,通过内置隔离棒隔离,电极的输入电压为0.90 V,由稳压电源提供。SBR反应器选用直径14 cm,高度18 cm的圆柱体,底部有2个曝气口,反应器工作体积为2.50 L,其中每个周期排水1.50 L,反应体中间设置排水口,排水口以下体积为1 L。反应器上部接电动磁力搅拌器(100 W),每个运行周期以200 r·min−1搅拌1 h。预处理-厌氧-好氧的联合的组合工艺示意图见图1。
1.3 实验方法
1)厌氧ABR-MECs系统对苯酚的降解实验。采用中温ABR-MECs系统,水力停留时间为24 h。以葡萄糖和苯酚为底物,逐步提高苯酚的浓度,对ABR-MECs体系降解苯酚的性能进行研究。实验分为5个阶段(表1)。由于实验室在前期的研究中发现,C1~C4已经基本可以完成有机物的梯级降解,因此本研究主要在C1~C4进行。
表 1 ABR-MECs工艺处理苯酚废水的实验阶段Table 1. Experimental stages in the treatment of phenol wastewater by ABR-MECs process运行阶段 运行时间/d 进水COD/(mg·L−1) HRT/d 苯酚浓度/(mg·L−1) 进水碱度/(mg·L−1) 第1阶段 1~4 5 000 1 0 2 155 第2阶段 4~8 5 000 1 100 2 155 第3阶段 8~10 5 000 1 200 2 155 第4阶段 10~16 5 000 1 300 2 155 第5阶段 16~22 5 000 1 400 2 155 2)组合工艺的启动运行。预处理反应器的工作体积为2.50 L,每次排水1.50 L,系统运行工艺参数如下:反应温度为室温 (25 ℃左右),水力停留时间为12 h。铁碳填料添加量1 400 g·L−1,污泥接种量为10%,进水负荷为16.56 kg·(m3·d)−1(以COD计),未曝气。反应进水管插入底部,由蠕动泵将稀释5倍的酚醛生产废水打入反应器中,反应进行12 h后从出水口排出,出水口设置定时排水阀门,可实现对反应器出水的自动控制运行。预处理出水进行3倍(2倍)稀释后,由蠕动泵将稀释后的预处理出水打入ABR-MECs反应器中进行厌氧反应,水力停留时间为24 h。SBR进行一个反应周期的时间为12 h,分别包括进水1 h、厌氧搅拌1 h、曝气8 h、沉降2 h、排水(小于1 min),采用定时器实现每个过程的自动控制。
1.4 分析方法
pH、SS、VSS、BOD5和COD测定采用《水和废水监测分析方法》[16]中的标准方法;CH4和H2的测定采用福立GC9790Ⅱ型气相色谱仪来测量,具体方法见PAN等[17]的研究。
苯酚和甲醛的测定采用高效液相色谱(HPLC)(日立L-2000),液相色谱条件如下:C18色谱柱(250 mm×4.60 mm,粒径为5 μm);柱温为35 ℃;流动相A为甲醇、流动相B为超纯水,流动A和B比例为50:50(v:v),流速为1 mL·min−1;检测器为紫外检测器,检测波长分别为340 nm(甲醛)和278 nm(苯酚)。
2, 4 -二硝基苯脐溶液:称取2, 4 -二硝基苯肼1 g放入100 mL容量瓶中,加乙睛溶解并稀释至刻度,摇匀后置于暗处待用。甲醛(10 mg·mL−1)和苯酚(分析标准品≥99.50%)标准品购置于阿拉丁。以甲醇/水(1∶1, v∶v)配制标准储备液,制备200 mg·L−1的甲醛的标准储备液和1 000 mg·L−1的苯酚标准储备液。实验用水为重蒸馏水。
甲醛标液的样品准备:取配制的甲醛溶液(200 mg·L−1)2 mL,置于10 mL容量瓶中,加入4 mL 2,4-二硝基苯脐溶液,用蒸馏水稀释,置于40 ℃水浴锅中避光放置12 h,经0.45 μm的微孔滤膜过滤。将滤液逐步稀释,配制成40、20、10、5、1和0.10 mg·L−1不同质量浓度的甲醛标准溶液(现配现用)。然后,用取1 mL滤液到棕色色谱瓶中,待测。苯酚测试的样品制备:直接将1 000 mg·L−1的苯酚标准储备液用蒸馏水进行梯度稀释配制成50、25、10、5、1和0.1 mg·L−1的苯酚标准溶液(现配现用)。取1 mL滤液到棕色色谱瓶中待测。样品溶液与甲醛和苯酚的标准溶液用相同的处理方法处理后进样,绘制工作曲线,使用外标法进行定量检测。
2. 结果与讨论
2.1 ABR-MECs工艺对苯酚的降解性能
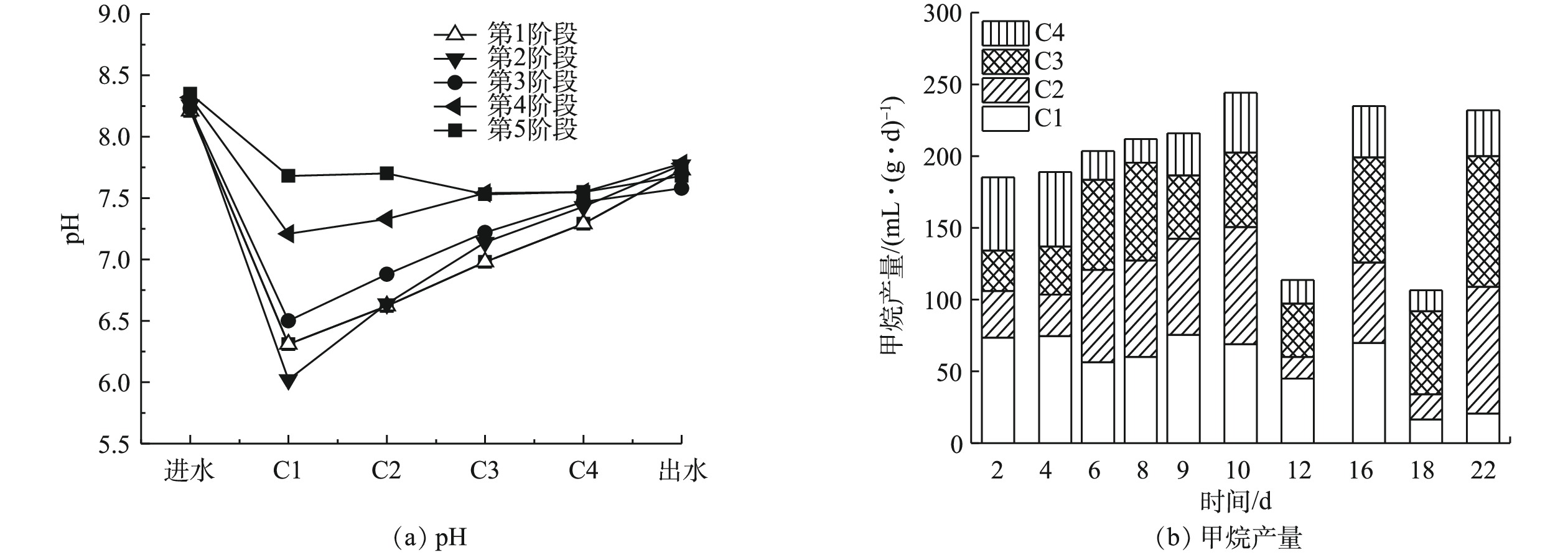
虽然在不同的反应阶段,C1和C2中的pH存在差异,但最终出水的pH基本保持一致(图2(a)),这说明ABR-MECs可以通过不同格室的反应来缓冲外界有机负荷的变化,从而最终达到对有机物进行有效稳定去除的效果。产气结果表明(图2(b)),在ABR-MECs进水中苯酚的浓度提高到300 mg·L−1(第12天)和400 mg·L−1(第18天)的初期中,产气量会受到苯酚冲击负荷的影响而下降;然而,稳定运行2个周期后,系统的产气性能得到恢复。由C1~C4对产气量的贡献占比来看,苯酚浓度越高,C3和C4的产气量占比越大。这说明ABR-MECs体系可以通过各个格室的作用调节来实现对难降解有机物的去除[14-15]。这一结果也与pH的数据相吻合。同时,苯酚浓度的提高并未对反应器的运行造成不利影响,反而随着反应的进行,COD的去除率略有升高,由94.50%升高至99.60%(表2)。
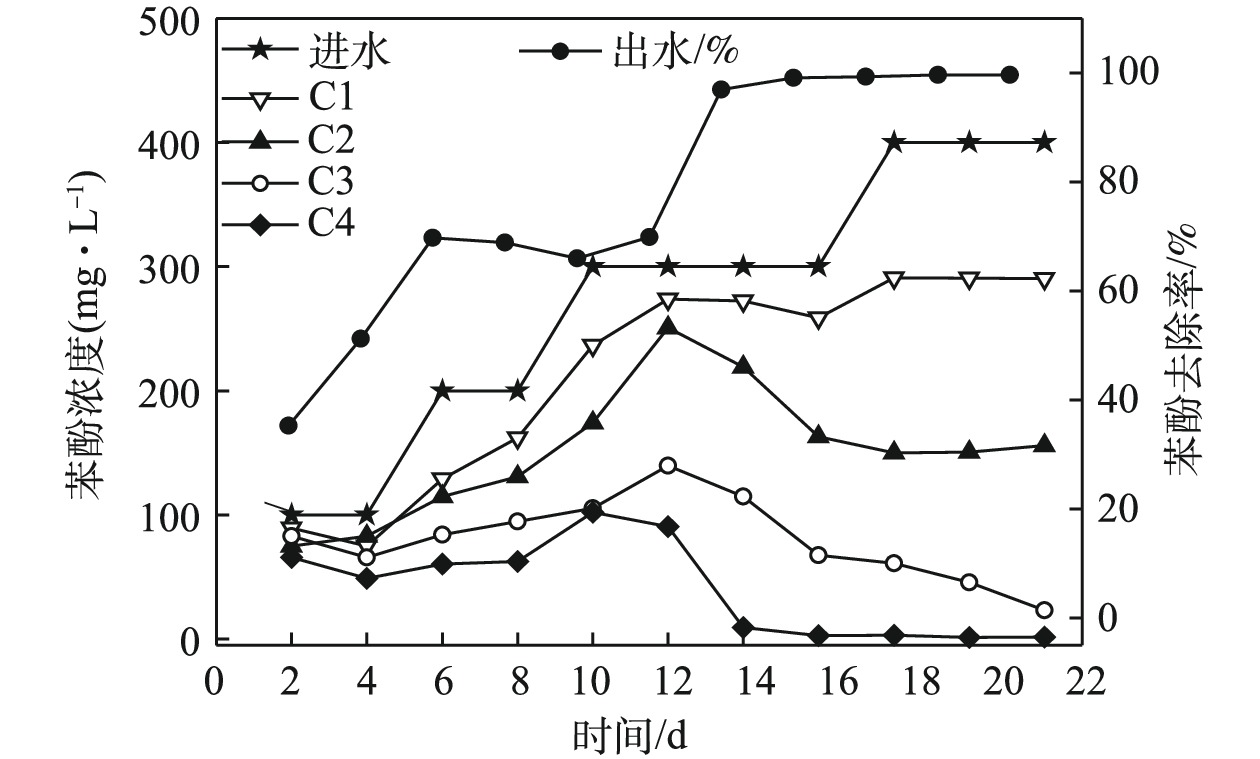
表 2 各个运行阶段末期ABR-MECs中COD变化情况Table 2. Changes of COD in ABR-MECs at the end of each stage运行阶段 进水/(mg·L−1) C1/(mg·L−1) C2/(mg·L−1) C3/(mg·L−1) C4/(mg·L−1) 出水/(mg·L−1) 去除率/% 第1阶段 5 000 978 1 347 1 076 730 346.15 95.31 第2阶段 5 200 3 138 2 197 955.50 511.50 285.88 94.50 第3阶段 5 400 1 091 842.50 413.85 218.20 301 94.44 第4阶段 7 016.25 1 128.50 672.70 495.10 61.70 52.70 99.24 第5阶段 7 025.60 451.50 916.50 500.20 45.15 30.25 99.60 随着苯酚浓度的提高,微生物对苯酚的去除效果也有明显增强(图3)。在400 mg·L−1下,ABR-MECs对苯酚的去除率达到98%以上。而有研究[18]表明,当苯酚浓度达到200 mg·L−1时,苯酚对厌氧微生物出现抑制作用。从反应器的C1~C4中苯酚的浓度来看,前期反应(苯酚浓度低于400 mg·L−1),C1对苯酚的降解作用不大,发挥作用的主要是C2和C3。由图3可见,在ABR反应器C2~C4内增加了MEC。由此可以推测,ABR-MECs对高浓度苯酚的高效去除可能得益于MEC的添加。但值得注意的是,在苯酚浓度为400 mg·L−1时,ABR-MECs系统中C1表现出对苯酚一定程度的去除:一方面可能是因为,随着苯酚浓度逐渐提高,系统中微生物培养出对环境的适应性(比如冲击负荷),从而逐渐发挥其生物学活性;此外,高浓度可以满足所有的微生物生长代谢,包括C1的产酸过程主导的系统。
2.2 组合工艺的运行性能分析
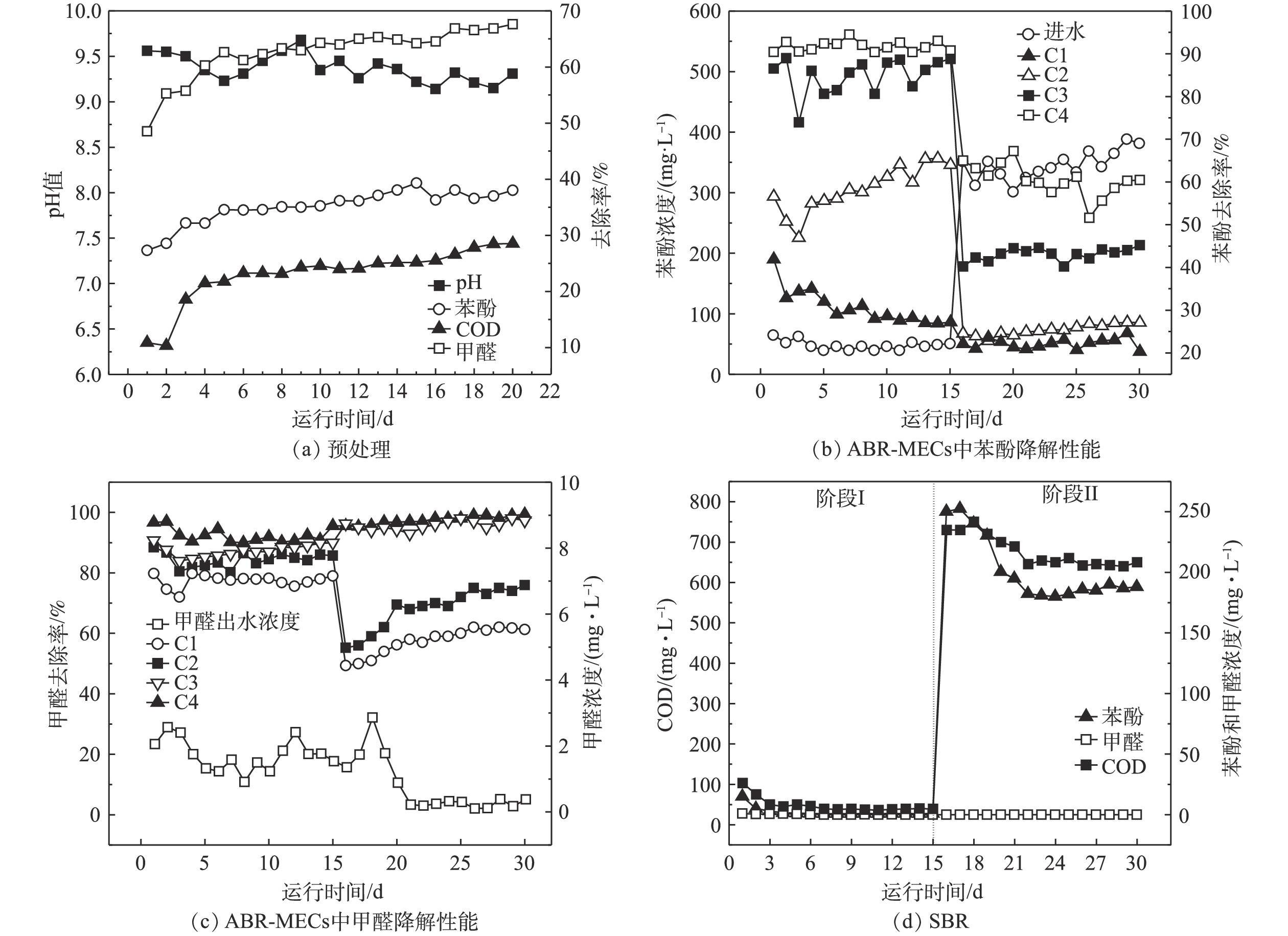
1)预处理运行性能。由于实际酚醛废水的有机物浓度过高,需要对原水进行稀释,根据前期的探究,稀释倍数为5倍。预处理阶段进水中COD、苯酚和甲醛的浓度分别为13.80、3.10和0.60 g·L−1。由图4(a)可知,预处理反应后,出水偏碱性,pH稳定在9~10。其可能的原因是,微生物产酸发酵过程产生的H+被铁碳填料中的Fe所消耗,促进了铁炭微电解反应。通过对预处理工艺的运行,BOD5/COD也从0.11升高到了0.50以上,废水的生化性能得到大幅度的提高,有助于进行后续的厌氧生物处理。随着反应的进行,苯酚、甲醛和COD的去除率均有所上升,然后趋于稳定,在稳定期苯酚、甲醛和COD的降解率分别在34%~36%、64%~66%和22%~25%。COD去除率比其他使用铁碳微电解预处理的系统略低[6],主要是本研究目的在于开发低成本处理工艺,因此,预处理阶段并未进行曝气处理。预处理后废水的可生化性的提高和部分COD的去除,主要是通过微生物进行的产酸发酵和铁炭微电解共同作用来实现的。铁炭微电解发挥作用时,发生如式(1)和式(2)的反应。
阳极(Fe):Fe−2e−→Fe2+ (1) 阴极(C):2H++2e−→2[H]→H2 (2) 反应中产生的Fe2+和原子[H]具有较高的化学活性,能改变废水中许多有机物的结构和特性,使有机物发生断链、开环等作用。产酸菌降解有机物产生挥发酸,为铁炭微电解提供H+。此外,有研究[19]还表明,铁炭微电解会通过促进乙酸激酶、磷酸转乙酰、丁酸激酶和磷酸转丁酰酶等挥发酸合成过程中关键酶实现对产酸发酵的强化。后续的生物处理阶段会进行剩余COD的去除。由于预处理提高了废水的可生化性,为后续微生物提供可利用的底物,且通过对苯酚和甲醛的去除,可减少高浓度酚醛废水对厌氧生物的毒害作用。采用预处理稳定期的出水作为后续厌氧反应的进水,即COD、苯酚和甲醛的浓度分别在10 350、1 984和264 mg·L−1左右。虽然ABR-MECs可以进行高浓度有机废水的处理,但是考虑到厌氧微生物对苯酚和甲醛的耐受性,对预处理的出水进行2~3倍稀释。
2)ABR-MECs的运行性能。为了探究ABR-MECs作为厌氧阶段进行酚醛废水处理的降解性能,首先将预处理的出水进行3倍稀释(COD、苯酚和甲醛分别为3 450、661和88 mg·L−1),待系统稳定后,保持其他运行参数不变的前提下,提高进水负荷,进水设置为2倍稀释的预处理出水(COD、苯酚和甲醛分别在5 175、991.50和132 mg·L−1左右)。实验结果表明:将出水进行3倍稀释时,系统的平均甲烷产量为181 mL·(g·d)−1;而将出水进行2倍稀释时,系统的平均甲烷产率降低至110 mL·g−1。如图4(b)所示,当ABR-MECs的进水为3倍稀释的预处理出水时,苯酚的出水浓度为39.66~64.77 mg·L−1,去除率达到90%以上。随着反应的进行,ABR-MECs不同格室发挥着不同的作用,C1的作用逐渐减弱,C2和C3对苯酚的去除率在逐渐升高。其可能的原因是,酚醛废水经过ABR-MECs反应器的处理过程中,首先进入C1,此时体系中的微生物因前期进行的400 mg·L−1苯酚的降解实验,具有很高的生物活性,所以在反应开始前几天,具有较高的去除率(35%~40%)。而随着持续高浓度的酚醛废水的暴露,部分微生物的活性受到高浓度苯酚的抑制,从而导致后期C1中苯酚的去除率下降至27%左右。虽然C1中的苯酚的浓度会随进水浓度的升高而升高,但未被降解的苯酚被后续格式中的微生物所降解,体现了厌氧折流板反应器的优势[15]。由于有C1的部分降解作用,进入C2的有机废水中苯酚和甲醛的浓度已经有所降低,加上C2中有MEC的促进作用,使C2对苯酚的去除率具有很大的贡献,同样C3中也有MEC的作用,同时进入C3的有机废水中苯酚浓度已经降低至约为100 mg·L−1,可以被微生物很快地降解。进入C4的有机物的含量已经相对较少,故C4发挥作用的空间有限。由此可见,ABR-MECs对苯酚具有很高的去除率,达到90.20%~94%,且其中主要起作用的是前3个格室。由甲醛的降解特征来看,当进水中甲醛的浓度为88 mg·L−1时,主要是C1发挥作用,其去除率达到70%以上,反应器最终去除率在97%以上,厌氧反应器出水中甲醛的浓度为0.91~2.56 mg·L−1。
为了使ABR-MECs的各个格室都能充分发挥作用,将进水的负荷提高,采用2倍稀释的预处理出水作为厌氧反应的进水,图4(b)和4(c)中第16~30天的数据为这一阶段反应的苯酚和甲醛去除特征。在高浓度的苯酚进水条件下,C1和C2都暴露在很高的苯酚浓度下,分别为990 mg·L−1和770 mg·L−1左右,导致ABR反应器的C1和C2中苯酚的降解率下降。而此时,C3和C4对苯酚的降解速率较前一阶段明显提高,特别是C4充分地发挥了作用。然而由于负荷的提高超出系统降解能力,且高浓度的苯酚对厌氧微生物的生长有抑制作用[18],因此,最终苯酚的降解率为51%~66%,ABR-MECs出水中苯酚的浓度为301.26~388 mg·L−1。虽然,系统中苯酚的降解率出现大幅下降,但甲醛的降解并未受到影响,反而随着反应器的运行,系统对甲醛的降解效能逐渐上升,最终的去除率达到99%以上,厌氧出水中甲醛的浓度极低,为0.10~1.35 mg·L−1,且各格室均发挥了重要作用。有研究[20]表明,高温UASB反应器(55 ℃)对含酚废水进行处理时,苯酚的去除率达到99%,这与本研究的结果相当,但后者采用中温厌氧处理体系,较高温体系更具有成本优势。
3)SBR的运行性能。SBR阶段的进水完全来自于ABR-MECs的出水,因此,SBR阶段的运行也分为2个阶段:即阶段I (1~15 d)为ABR-MECs进水为3倍稀释的预处理出水时,进水COD为530~549 mg·L−1、苯酚为39.66~64.77 mg·L−1、甲醛为0.91~2.56 mg·L−1;阶段II(15~30 d)即为ABR-MECs进水为2倍稀释的预处理出水时,进水COD为1 820~2 000 mg·L−1、苯酚为301.26~388 mg·L−1、甲醛为0.10~1.35 mg·L−1。
如图4(d)所示,阶段I中SBR运行过程较为稳定,随着运行时间的增加,出水苯酚和COD均有所降低,体系中苯酚的浓度由反应初期(1~3 d)的15 mg·L−1降低至后期的(10~15 d)的0.85 mg·L−1,COD由103.20 mg·L−1降低至39 mg·L−1左右,而甲醛由于进水浓度低,故被SBR降解完全,已经无法检测甲醛的浓度。根据《中华人民共和国污水综合排放标准》(GB 8978-1996)[21],本研究的酚醛废水处理组合工艺达到GB 8978-1996的三级排放标准。然而在第II阶段,由于进水浓度的大幅提高,导致系统运行不稳定。虽然SBR出水中的pH和甲醛的浓度满足污水的排放标准,但是COD和苯酚的浓度达到600 mg·L−1和180 mg·L−1,均远远超过出水排放标准。这说明阶段II中SBR的进水已经超过了SBR系统的降解能力。
2.3 组合技术经济分析
根据组合工艺的运行过程,组合工艺支出主要包括电耗、填料的费用和稀释水的费用等。其中,电费参考厦门市工业用电平、峰值,统一以1元·kWh−1进行计算;水费以2.20元·t−1进行计算。具体能耗分析如下。
1)预处理的成本主要由铁碳填料消耗、稀释用水的费用和进料泵电耗3部分组成。其中,预处理反应器添加铁碳填料1.40 kg,单价为6元·kg−1;每吨水损失20%铁碳填料,每吨酚醛废水铁碳填料支出为1.68元;每升酚醛废水用水稀释5倍, 稀释每吨酚醛废水增加的用水支出为8.80元;进料泵的提升水头为1 m(含估算的沿程和局部水头损失),按照进料泵的电机效率按60%计算,需要消耗的电功为16.33 kJ,进料泵的电耗支出为0.004 5元·t−1。因此,预处理部分的成本为10.48元·t−1。
2)ABR-MECs反应阶段主要的成本来自稀释用水支出和电耗(进料泵、水热循环泵、电化学组件)。由于每吨酚醛废水需要稀释3倍,处理每吨废水稀释用水支出为4.40元。电耗的计算中,电化学组件电耗参考汪涛[22]的计算,电化学组件运行一天消耗的电能为0.036 kWh,本工艺处理1 t废水需要16.67 d,电化学组件的电耗支出为0.60元·t−1;水热循环泵电耗按平均水温由室温(25 ℃)提高10 ℃计算(厦门,运行温度35 ℃),提升1 t水需要的热量为4.20 J·(kg·℃)−1×1 000 kg×10 ℃=42 000 kJ,按照电能利用率按60%计算,此部分需要的电耗为19.44元·t−1;根据预处理中计算获得进料泵的电耗支出为0.004 5元·t−1。此外,ABR-MECs进行厌氧酚醛废水处理时,会产生可再生能源物质甲烷,本研究中甲烷的产率为181 mL·g−1(以COD计),厌氧处理的进水有机物浓度为34 500 g·m−3,平均COD去除率为90.70%,可算出平均产甲烷率为0.56。采用单位体积甲烷发电量经验值3.59 kWh·m−3计算[14],ABR-MECs系统产甲烷可回收电能为2.01 kWh·m−3,甲烷回收电能为2.01元·t−1。因此,厌氧反应阶段总成本为(电化学组件+进料泵电耗+水热循环泵) 22.35元·t−1。
3) SBR反应过程的成本主要包括进料泵的电耗(0.004 5元·t−1)、曝气和电器搅拌支出。然而,由于本实验为小试,反应器较小,会导致单位体积的曝气支出和电器搅拌支出的计算结果会远远超出实际工程中的数值。因此,这部分计算的意义不大。
因此,本研究中构建的组合工艺以微生物辅助铁炭微电解作为预处理反应,相较于其他化学反应可大大降低药剂添加的费用(表3)。常规的工艺预处理费用为35元·t−1,铁碳微电解+Fenton预处理技术处理酚醛废水的成本为28.92元·t−1[6],其中药剂费为主要成本(20.07元·t−1),而本工艺无需添加药剂,预处理成本仅为10.48元·t−1。电化学氧化与生物流化床组合的处理成本为103.66元·t−1[3],而本研究中处理预处理和厌氧段合计费为32.83元·t−1,一般好氧工艺的成本小于20元·t−1,无论从预处理还是组合工艺来说,都具有一定的成本优势。虽然预处理阶段和厌氧阶段的进水都进行了稀释,但稀释的目的是降低酚醛废水中的苯酚的浓度,从而减少对微生物的毒害。因此,该技术还可以考虑采用其他需要处理的有机废水对酚醛废水进行稀释,既降低了稀释的成本,同时可实现不同种类的有机废水的同步处理。
表 3 不同酚醛废水处理组合工艺成本对比Table 3. The cost comparison of different combined processes treating phenolic wastewater3. 结论
1)相比传统的厌氧工艺,ABR-MECs对处理高浓度含苯酚的废水具有优势。
2)构建的微生物辅助铁炭微电解-ABR-MECs-SBR组合工艺可以实现酚醛生产废水的高效去除,且最终SBR出水达到GB 8978-1996的三级排放标准。
3)本研究中的组合工艺具有一定的经济优势,预处理成本大约为10.48元·t−1,厌氧处理的成本大约为22.35元·t−1。
-
表 1 实验底泥及接种污泥的理化性质
Table 1. Physicochemical properties of substrate sludge and inoculum sludge
污泥类型 pH TS/(g·L−1) VS/(g·L−1) COD/(g·L−1) SCOD/(g·L−1) 实验底泥 7.20±0.01 38.08±0.23 14.75±0.11 30.74±0.02 1.76±0.04 接种污泥 6.75±0.02 18.12±0.54 5.95±0.25 16.11±0.06 1.82±0.03 表 2 修正Gompertz动力学模型拟合参数
Table 2. Modified Gompertz kinetic model fitting parameters
反应器 Pm/(mL·g−1) Rm/(mL·(g·d)−1) λ/d R2 R0 181.07±0.66 11.78±0.15 0 0.994 3 R1 151.92±0.18 7.49±0.03 0 0.999 9 R2 31.15±0.11 3.29±0.10 0 0.989 0 R3 169.06±3.66 12.76±0.32 0 0.980 5 R4 175.26±0.72 13.32±0.21 0 0.996 5 R5 158.86±0.76 5.43±0.01 0 0.996 6 R6 28.34±0.35 5.27±0.13 0 0.988 2 表 3 DOM各区域荧光响应占比(Pi,n)
Table 3. DOM fluorescence response percentages by region
% 编号 区域I 区域II 区域III 区域IV 区域V R0 26.27 34.31 16.37 17.39 5.66 R2 26.30 34.06 19.23 13.36 7.05 R4 27.53 34.90 17.74 13.78 6.05 R6 26.17 33.33 19.99 13.01 7.50 表 4 LB-EPS与TB-EPS各区域荧光响应占比(Pi,n)
Table 4. DOM fluorescence response percentages by region
% 样品类型 编号 区域I 区域II 区域III 区域IV 区域V LB-EPS R0 37.84 42.37 6.12 12.59 1.08 R2 26.77 24.86 33.46 8.70 6.21 R4 37.12 41.90 6.07 13.75 1.16 R6 25.98 24.75 28.23 13.25 7.80 TB-EPS R0 37.49 38.32 5.81 16.74 1.64 R2 27.55 24.48 26.93 13.98 7.06 R4 38.57 38.20 5.83 15.97 1.43 R6 28.20 24.65 23.29 16.54 7.32 -
[1] 聂宇, 陈娅婷, 孙照勇, 等. 污水/城市污泥中抗生素对厌氧消化的影响研究进展[J]. 应用与环境生物学报, 2020, 26: 479-488. [2] NI B J, ZENG S T, WEI W, et al. Impact of roxithromycin on waste activated sludge anaerobic digestion: Methane production, carbon transformation and antibiotic resistance genes[J]. Science of The Total Environment, 2020: 703. [3] FU S F, DING J N, ZHANG Y, et al. Exposure to polystyrene nanoplastic leads to inhibition of anaerobic digestion system[J]. Science Of the Total Environment, 2018, 625: 64-70. doi: 10.1016/j.scitotenv.2017.12.158 [4] ZHI S L, ZHANG K Q. Antibiotic residues may stimulate or suppress methane yield and microbial activity during high-solid anaerobic digestion[J]. Chemical Engineering Journal, 2019, 359: 1303-1315. doi: 10.1016/j.cej.2018.11.050 [5] WEI W, HUANG Q S, SUN J, et al. Polyvinyl Chloride Microplastics Affect Methane Production from the Anaerobic Digestion of Waste Activated Sludge through Leaching Toxic Bisphenol-A[J]. Environmental Science & Technology, 2019, 53(5): 2509-2517. [6] WEI W, HAO Q, CHEN Z J, et al. Polystyrene nanoplastics reshape the anaerobic granular sludge for recovering methane from wastewater[J]. Water Research, 2020, 182: 116041. doi: 10.1016/j.watres.2020.116041 [7] MENG Y, LIU W Y, FIEDLER H, et al. Fate and risk assessment of emerging contaminants in reclaimed water production processes[J]. Frontiers of Environmental Science & Engineering volume 2021, 15(5): 104. [8] LUO J Y, ZHANG Q, ZHAO J, et al. Potential influences of exogenous pollutants occurred in waste activated sludge on anaerobic digestion: A review[J]. Journal of Hazardous Materials, 2020, 383: 121176. doi: 10.1016/j.jhazmat.2019.121176 [9] SU Y, ZHANG Z, ZHU J, et al. Microplastics act as vectors for antibiotic resistance genes in landfill leachate: The enhanced roles of the long-term aging process[J]. Environmental Pollution, 2021, 270: 116278. doi: 10.1016/j.envpol.2020.116278 [10] HOLLIGER C, ALVES M, ANDRADE D, et al. Towards a standardization of biomethane potential tests[J]. Water Science and Technology, 2016, 74(11): 2515-2522. doi: 10.2166/wst.2016.336 [11] 河北省环境监测中心站. 水质 化学需氧量的测定 快速消解分光光度法[S]. 行业标准-环保. 2007: 12P. ;A14 [12] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the Folin phenol reagent[J]. The Journal of biological chemistry, 1951, 193(1): 265-275. doi: 10.1016/S0021-9258(19)52451-6 [13] MADHUSUDANAN NAIR P, VAIDYANATHAN C S. A colorimetric method for determination of pyrocatechol and related substances[J]. Analytical Biochemistry, 1964, 7(3): 315-321. doi: 10.1016/0003-2697(64)90136-8 [14] XIE S B, MA J W, LI L, et al. Anaerobic caproate production on carbon chain elongation: Effect of lactate/butyrate ratio, concentration and operation mode[J]. Bioresource Technology, 2021, 329: 124893. doi: 10.1016/j.biortech.2021.124893 [15] WANG H, CAI W W, LIU W Z, et al. Application of sulfate radicals from ultrasonic activation: Disintegration of extracellular polymeric substances for enhanced anaerobic fermentation of sulfate-containing waste-activated sludge[J]. Chemical Engineering Journal, 2018, 352: 380-388. doi: 10.1016/j.cej.2018.07.029 [16] BATSTONE D J, TORRIJOS M J, RUIZ C, et al. Use of an anaerobic sequencing batch reactor for parameter estimatiorr in modelling of anaerobic digestion[J]. Water Science and Technology, 2004, 50(10): 295-303. doi: 10.2166/wst.2004.0663 [17] 方慧莹, 王端立, 陈皓, 等. 纳米零价铁对厌氧消化影响的反应动力学模型[J]. 化工学报, 2017, 68: 2042-2048+2217. [18] FENG Y, FENG L J, LIU S C, et al. Emerging investigator series: inhibition and recovery of anaerobic granular sludge performance in response to short-term polystyrene nanoparticle exposure[J]. Environmental Science:Water Research & Technology, 2018, 4(12): 1902-1911. [19] QIAN J, HE X X, WANG P F, et al. Effects of polystyrene nanoplastics on extracellular polymeric substance composition of activated sludge: The role of surface functional groups[J]. Environmental Pollution, 2021, 279: 116904. doi: 10.1016/j.envpol.2021.116904 [20] KAFLE G K, CHEN L. Comparison on batch anaerobic digestion of five different livestock manures and prediction of biochemical methane potential (BMP) using different statistical models[J]. Waste Management, 2016, 48: 492-502. doi: 10.1016/j.wasman.2015.10.021 [21] CHEN W, WESTERHOFF P, LEENHEER J A, et al. Fluorescence excitation - Emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 2003, 37(24): 5701-5710. [22] WANG D B, DUAN Y Y, YANG Q, et al. Free ammonia enhances dark fermentative hydrogen production from waste activated sludge[J]. Water Research, 2018, 133: 272-281. doi: 10.1016/j.watres.2018.01.051 [23] REYNOLDS D M. The differentiation of biodegradable and non-biodegradable dissolved organic matter in wastewaters using fluorescence spectroscopy[J]. Journal of Chemical Technology & Biotechnology, 2002, 77(8): 965-972. [24] 刘旭冉. 聚丙烯酰胺对剩余污泥厌氧消化过程影响行为的解析与调控[D]. 长沙: 湖南大学, 2019. [25] LI J, HAO X D, VAN LOOSDRECHT M C M, et al. Relieving the inhibition of humic acid on anaerobic digestion of excess sludge by metal ions[J]. Water Research, 2021, 188: 116541. doi: 10.1016/j.watres.2020.116541 [26] ZHANG J J, ZHAO M X, LI C, et al. Evaluation the impact of polystyrene micro and nanoplastics on the methane generation by anaerobic digestion[J]. Ecotoxicology and Environmental Safety, 2020: 205. [27] FERNANDES T V, VAN LIER J B, ZEEMAN G. Humic Acid-Like and Fulvic Acid-Like Inhibition on the Hydrolysis of Cellulose and Tributyrin[J]. BioEnergy Research, 2015, 8(2): 821-831. doi: 10.1007/s12155-014-9564-z [28] WANG X Q, LYU T, DONG R J, et al. Revealing the link between evolution of electron transfer capacity of humic acid and key enzyme activities during anaerobic digestion[J]. Journal of Environmental Management, 2022, 301: 113914. doi: 10.1016/j.jenvman.2021.113914 [29] JIANG X R, LYU Q Y, BI L F, et al. Improvement of sewage sludge anaerobic digestion through synergistic effect combined trace elements enhancer with enzyme pretreatment and microbial community response[J]. Chemosphere, 2022, 286: 131356. doi: 10.1016/j.chemosphere.2021.131356 [30] WEI W, HUANG Q S, SUN J, et al. Revealing the Mechanisms of Polyethylene Microplastics Affecting Anaerobic Digestion of Waste Activated Sludge[J]. Environmental Science & Technology, 2019, 53(16): 9604-9613. [31] SONG H L, LU Y X, YANG X L, et al. Degradation of sulfamethoxazole in low-C/N ratio wastewater by a novel membrane bioelectrochemical reactor[J]. Bioresource Technology, 2020, 305: 123029. doi: 10.1016/j.biortech.2020.123029 [32] LI J J, LI C X, LI Y L, et al. Elucidation of high removal efficiency of dichlorophen wastewater in anaerobic treatment system with iron/carbon mediator[J]. Journal of Cleaner Production, 2022, 330: 129854. doi: 10.1016/j.jclepro.2021.129854 [33] CHE L X, YANG B, TIAN Q, et al. Iron-based biochar derived from waste-activated sludge enhances anaerobic digestion of synthetic salty organic wastewater for methane production[J]. Bioresource Technology, 2022, 345: 126465. doi: 10.1016/j.biortech.2021.126465 -




 下载:
下载: