-
在污水处理工艺中,生物法具有友好、简单、廉价等优点。生物脱氮是我国污水处理领域的重要方法,其中厌氧氨氧化(anaerobic ammonium oxidation,anammox)工艺应用前景良好。与传统的硝化-反硝化脱氮技术相比,厌氧氨氧化具有无需供氧、节省能耗,以及自养脱氮、无需外加碳源、污泥产量低等优点[1]。基于anammox的城镇污水脱氮处理工艺主要有2种:主流工艺即在城镇污水处理工艺的主线部分(即主流污水)采用anammox工艺;侧流工艺即在污泥消化液、压滤液等侧流污水的处理中应用该工艺,其水量仅占污水处理厂总进水约2%。通常,侧流工艺处理的污水具有高温高氨氮的特点[2]。目前,国内学者对anammox的研究大多在实验室规模反应器中进行,而在污水处理厂其应用主要集中在处理高温、高氨氮城镇污水的侧流工艺。若将该工艺大规模应用于常温或低温、低氨氮的主流污水处理中尚需深入研究。
在实际工程中,厌氧氨氧化常与短程硝化(partial nitrification,PN)、反硝化(denitrification,DN)工艺组合应用。从反应器类型划分,这些组合工艺分为一体式和分体式2种。分体式工艺,即在前端增加1个将进水中部分氨氮转化为亚硝氮的处理单元,为后续厌氧氨氧化反应提供亚硝氮基质;一体式工艺,即将亚硝氮的积累与厌氧氨氧化反应设计在同一处理单元中以完成氮的去除。近年来,一体式厌氧氨氧化工艺受到越来越多学者的青睐。
本文在概述一体式厌氧氨氧化工艺的基础上,总结分体式与一体式厌氧氨氧化工艺在实际应用中的特点,再按照功能菌群的生长形态将一体式工艺系统中的污泥分为颗粒污泥、生物膜、悬浮污泥3类,并分别探讨其脱氮特征,在对新型一体式厌氧氨氧化脱氮工艺的不同生长系统中anammox反应的机理、特征、效能及其工程案例等进行详细阐述后,指出其在应用中的难点及关键点,并展望未来研究方向,以期为该技术的应用提供参考。
-
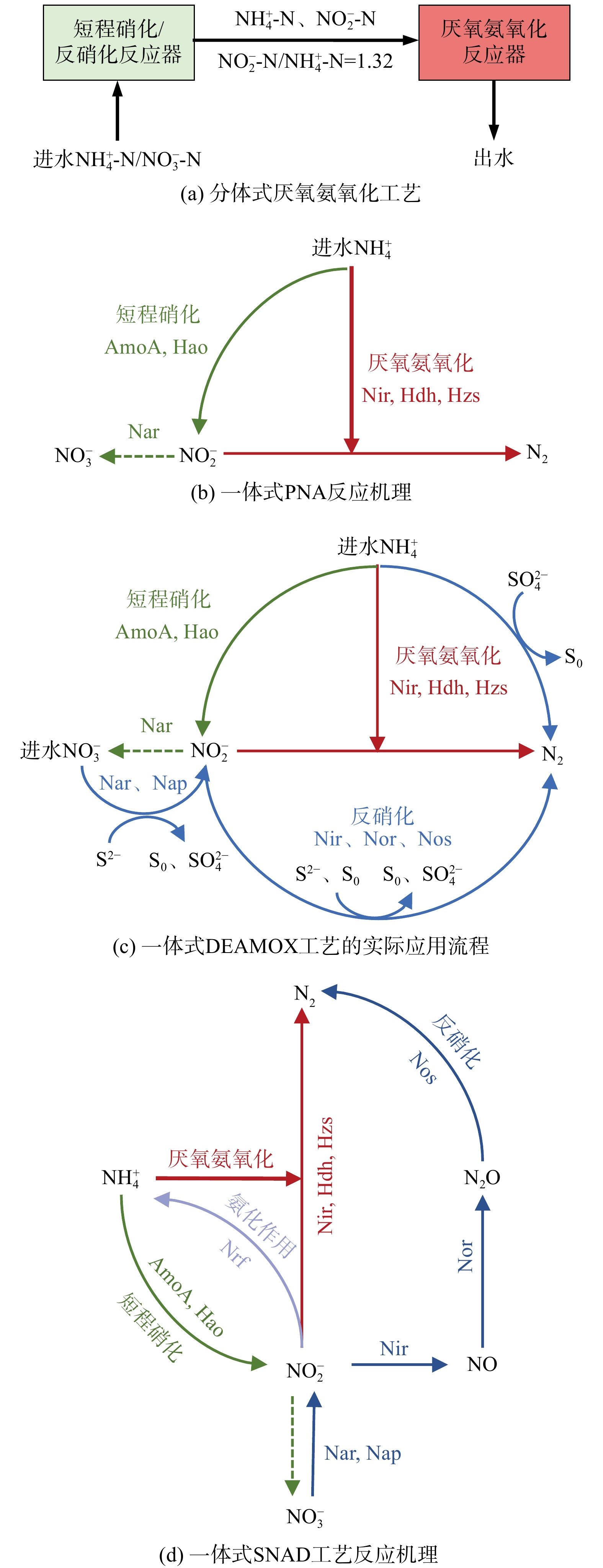
厌氧氨氧化工艺的组合应用形式分为一体式和分体式2种。一体式工艺按其系统中主要功能菌群的营养类型分为自养脱氮工艺与异养脱氮工艺。其中,自养脱氮工艺分为自养反硝化厌氧氨氧化(denitrifying ammonium oxidation,DEAMOX)工艺及短程硝化厌氧氨氧化(partial nitrification anammox,PN/A)两类。根据不同工艺组合,自养脱氮工艺已发展出完全自养脱氮(completely autotrophic nitrogen removal over nitrite,CANON)工艺、低氧自养硝化反硝化(oxygen-limited autotrophic nitrification and denitrification,OLAND)工艺、单级厌氧氨氧化和亚硝化脱氮(single-stage nitrogen removal using anammox and partial nitrification,SNAP)工艺、好氧反氨化(aerobic deammonification,DEMON)工艺等组合形式;异养脱氮工艺主要指短程硝化—厌氧氨氧化—反硝化耦合(simultaneous partial nitrification anammox and denitrification,SNAD)工艺。另外,按照不同的亚硝氮来源,可将分体式工艺分为短程硝化-厌氧氨氧化(SHARON – ANAMMOX)工艺、短程反硝化-厌氧氨氧化(partial denitrification anammox,PDA)工艺。各工艺在实际应用中的流程如图1[3-4]所示。
-
分体式工艺与一体式工艺的运行状况如表1所示。相比而言,一体式厌氧氨氧化工艺具有如下优点。1) 占地面积少,投资成本明显较低。在实际应用中,受设施建设和运行成本的限制[5],侧流PN/A工艺和大多数主流PN/A工艺均在成本较低的一体式系统中进行。2014年的一项调查表明[6],超过80%的全规模厌氧氨氧化应用装置采用了单级PN/A装置。2)亚硝酸盐对AnAOB的抑制风险更低。3)一体式反应器的结构可满足氨氧化和厌氧氨氧化反应的灵活切换,使其在处理非常高、不稳定和不确定氮负荷的污水时更具优势。4)相较于分体式工艺,一体式工艺释放的温室气体氧化亚氮(N2O)更少。CONNAN等[7]发现,一体式PN/A工艺可使用较小的反应器,且在保持与两段PN/A工艺相当的总氮负荷(total nitrogen removal rate,TNRR)时,排放的N2O明显减少。一般情况下,一体式工艺过程的N2O排放量为TNRR的0.4%~1.3%[8-10],而分体式工艺的排放量则为TNRR的2.3%~6.6%[11-12]。
在一体式厌氧氨氧化工艺中,由于不同生长条件及功能的微生物存在于同一空间,且其复杂的相互作用对过程控制提出了更高要求,故精确的操作与控制是保持稳定、高效脱氮性能的关键。事实上,共存于这类系统中的微生物往往会自行组成特定结构的颗粒或生物膜,以便于自身发展。LIU等[13]利用基于生物膜系统的一体式PN/A工艺处理综合污水,总氮去除率(total nitrogen removal rate,TNRE)达到了(81.10±3.60)%,TNRR为1.2 kg·(m−3·d−1)。WANG等[14]利用基于悬浮污泥系统的一体式PN/A工艺处理综合污水,TNRE达到了90%,TNRR为2.3 kg·(m−3·d−1)。CHEN等[15]利用基于悬浮污泥系统的一体式PN/A工艺处理低浓度模拟污水,TNRE达到了71.8%,TNRR为0.72 kg·(m−3·d−1)。VÁZQUEZ-PADÍN等[16]分别采用分体式SHARON–ANAMMOX和一体式CANON工艺处理中低温高氨氮污水时发现,在20 ℃及相同操作条件下,分体式系统会受厌氧氨氧化的步骤限制,而一体式系统的容积氮负荷(volumetric nitrogen load,NLR)为分体式系统的10倍,故一体式系统更适合在低温下运行。综上所述,一体式工艺具有占地面积小、基建投资少、控制方便,且可降低亚硝酸盐对AnAOB的抑制并低温室气体N2O排放量的优点[17],故应用前景更加广阔。
-
1)一体式工艺系统的启动需要更多的种泥,且其中菌群关系复杂,经受负荷冲击时易失稳、系统崩溃后恢复期更长。2)目前,已经成功启动的一体式工艺流程的操作及其作用机理尚未明确。3) DO的调控对一体式系统至关重要,不同系统对DO耐受力各不相同,但各类工艺具体的DO控制范围和方式尚未明确。4)在低温下,AnAOB活性会降低使得整个系统处理效率降低,且低温条件会增加NOB的抑制难度。
-
目前,一体式厌氧氨氧化工艺应用的多样性主要体现在工艺生长形式的多样性。在实际应用中,可按微生物不同的生长形态将一体式厌氧氨氧化工艺分为颗粒污泥系统、生物膜系统及悬浮污泥系统。从系统中主要功能菌的营养类型又可分为一体式自养脱氮与异养脱氮系统,因此,根据不同的生长形态来详细叙述各类一体式工艺的应用特征、效能及关键点。
-
由于AOB和AnAOB是自养菌,其世代时间长、生长缓慢,且在实际应用中存在菌种易流失的问题,因此,要保证新型厌氧氨氧化工艺能稳定、高NRR运行,则应在短时间内保持反应器内有充足的功能微生物、有效的生物质及高效地生物质分散(用于实现高效的物质转移)[27]。通过培养颗粒化的污泥,可大幅提升污泥的沉降性能,提高体系内的生物总量,进而实现反应器的高效率运行。
在实际应用中,自养系统与异养系统均有在颗粒污泥系统中成功启动的案例。一体式厌氧氨氧化颗粒污泥系统的反应器主要有上流式厌氧污泥床(upflow anaerobic sludge blanket,UASB)、气提式颗粒污泥床反应器(air lift granule sludge bed reactor,ALR)、连续搅拌反应器(continuous stirred-tank reactor,CSTR)等。然而,颗粒污泥的培养存在诸多问题,其培养条件苛刻,影响因素复杂,故成功的难度大。因此,如何快速启动颗粒污泥系统是其应用难点之一。在实际应用中,多通过接种污泥来快速启动颗粒污泥系统。
1)一体式颗粒污泥自养脱氮系统。在一体式颗粒污泥自养脱氮系统的成功启动案例中,多数通过接种污泥来快速启动,接种污泥通常为颗粒污泥与絮体污泥。从一体式自养脱氮工艺的反应机理来看,接种的污泥类型有好氧硝化污泥、厌氧氨氧化污泥及一体式系统污泥。
WANG等[28]以硝化颗粒污泥为接种体,成功在ALR中启动了自养脱氮工艺(GSB-ANR process),在(30±1) ℃、DO为0.2~0.8 mg·L−1条件下处理高氨氮模拟污水时的NLR和NRR分别达到了5.44和2.57 kg·(m3·d)−1。WANG等[29]从某低溶解氧条件下稳定运行400 d的CSTR反应器中接种絮体污泥,成功用于以CSTR为反应器的一体式PN/A自养脱氮工艺启动中,在(25±1)℃、DO<0.11 mg·L−1、水力停留时间(hydraulic retention time,HRT)为12 h的条件下,TNRE达到了82%,NLR以及NRR分别达到了1.5 和2.5 kg·(m3·d)−1。LI等[30]通过接种厌氧氨氧化颗粒污泥和当地市政污水处理厂的曝气池活性污泥,在(35±1) ℃、DO≤0.5 mg·L−1的条件下,以逐步降低NO2−-N/NH4+-N比例、同时提高曝气量的方式,在UASB反应器中成功启动一体式PN/A自养脱氮工艺,且达到了88%的TNRE。上述案例表明,通过接种适宜的污泥、并合理地调控运行参数可促进一体式系统的成功启动。
已有研究并未对DO的最佳范围进行确定,而以上案例均为在低溶解氧条件下实现一体式PN/A自养脱氮。在高DO条件下成功启动一体式颗粒污泥自养脱氮系统的案例亦有报道。如QIAN等[31]在平均粒径为0.9 mm的CSTR颗粒污泥反应器中成功启动一体式PN/A自养脱氮工艺;该工艺在(30±1) ℃、DO为1.9 mg·L−1、HRT为1 h的条件下,TNRE达到了80%以上,且NLR与NRR分别达到了4.9和3.9 kg·(m3·d)−1。LIU等[32]接种好氧全程硝化颗粒污泥,用于启动低氨氮一体式CANON自养脱氮工艺以富集AnAOB,在运行257 d后启动成功;在DO为0.8~1.5 mg·L−1、HRT<1.0 h、T为15 ℃的恶劣条件下,该工艺处理低氨氮(约50 mg·L−1)污水的NRR和TNRE分别达到1.26 kg·(m3·d)−1和(68±8)%。该研究获得的氮去除率远远高于在低温(<20 ℃)条件下运行的CANON系统的报道值[32],为CANON工艺的实际应用提供了参考。
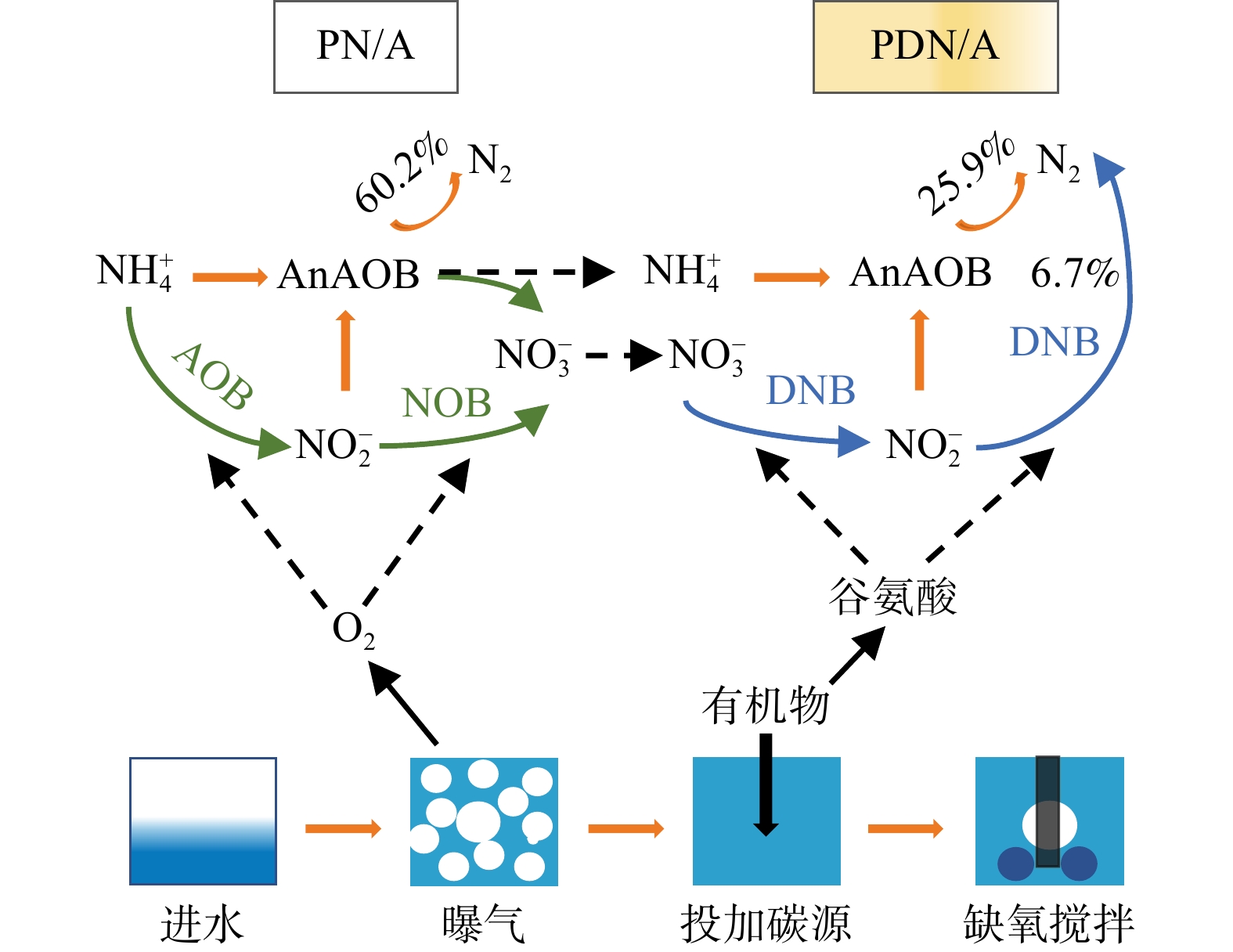
2)一体式颗粒污泥异养脱氮系统。一体式颗粒污泥异养脱氮系统的启动与自养系统类似,可通过接种颗粒污泥或絮体污泥实现快速启动。接种污泥分好氧硝化污泥、厌氧氨氧化污泥及反硝化污泥。LIU等[33]在厌氧氨氧化颗粒污泥反应器的基础上成功启动一体式SNAD异养脱氮系统,在C/N比和DO分别为0.2~1.0和0.2~0.4 mg·L−1,粒径为0.3~0.6 mm的颗粒污泥系统中,实现了TNRE大于90%。LI等[34]在SBR中接种PN/A悬浮颗粒污泥建立了一体式PN/A与PDNA交替运行的异养脱氮系统,在(30±2) ℃、C/N为0.3、DO为0.25 mg·L−1的条件下处理主流污水,TNRE达到了94.6%,NRR达到了0.54 kg·(m3·d)−1。PN/A-PDNA是一种新型工艺(如图2所示),可充分利用SBR在时间控制上的优势,使得PN/A与PDNA反应分别在好氧和缺氧段发生。该工艺将两种反应耦合在同一反应器中,提高了厌氧氨氧化的效率及稳定性,为新型工艺的开发提供了新思路,具有巨大应用潜力。因此,尽管接种污泥为硝化污泥,但通过调控适宜的运行参数仍可启动反硝化异养系统。
DO是一体式颗粒污泥异养脱氮系统的重要运行参数。过低的DO会限制AOB的活性,过高的DO会限制AnAOB的浓度,同HB会与AOB竞争溶解氧来降解有机物。在大多数报道中,SNAD工艺在DO低于0.5 mg·L−1的连续曝气条件下运行,且以上成功案例也在低DO连续曝气下进行。然而,在连续曝气条件下,HB对DO的消耗会增加操作成本,故间歇曝气被提出来应用于SNAD异养系统中,并通过好氧和缺氧的交替来促进有机物在反硝化过程中被利用,以实现更低的曝气成本、更高的脱氮效率。因此,间歇曝气的曝停时间及曝气浓度等参数还需要深入研究来确定。
低C/N比是一体式异养脱氮SNAD系统成功启动的另一个重要因素。以上报道均在低C/N条件下成功启动。亦有报道表明,当C/N>1.0时,SNAD系统中的AnAOB活性将大幅降低;而当C/N增至3时,AnAOB近乎淘汰;同时,AOB与HB竞争DO失败而导致其丰度降低[33]。
由以上案例可知,在一体式厌氧氨氧化颗粒污泥系统的启动初期需接种大量的厌氧氨氧化颗粒污泥,而在一些厌氧氨氧化技术不太发达的地区,这将成为其开展技术研究的瓶颈。因此,研究出通过接种普通活性污泥来启动一体式anammox工艺也应成为未来重点方向。另外,在颗粒污泥系统中,微生物的活性还受颗粒形态和大小的影响,适宜的颗粒分布可为反应器内的沉降和生物质滞留量奠定基础。VLAEMINCK等[35]发现,粒径为0.5~1.6 mm的颗粒可自动去除氮,而不会产生过多的好氧亚硝酸盐或严重的缺氧亚硝酸盐限制。WANG等[36]发现,随着颗粒污泥粒径的增大,ALR的脱氮性能逐渐下降,粒径为0.5~0.9 mm的小颗粒污泥比大颗粒具有更高的脱氮能力。因此,探究颗粒污泥系统中粒径大小分布对污水处理效果的影响尤为重要。
-
由于AnAOB是自养菌,其世代时间长,故需要提高系统的生物质保留能力同时抑制NOB的生长。通过固定化细菌并冲刷NOB可满足以上要求,而固定化细菌的方法包括形成颗粒状的生物质、将生物质捕获形成凝胶颗粒或在载体表面附着生成生物膜[22]。REN等[37]发现,生物膜法更简单、更有效,不仅能提高反应器保留生物质的能力,对反应器总活性的贡献亦很大。生物膜的高厌氧氨氧化活性有助于微生物在低温条件下保持较好状态,并在较宽的DO/NH4+-N通量比范围内抑制NOB。
一体式生物膜工艺的反应器类型主要有生物转盘(rotating biological reactor,RBC)、序批式污泥反应器(SBR)、膜生物反应器(membrane bioreactor,MBR)、生物滤池(biofilter,BF)。一体式生物膜系统在启动时可通过接种生物膜或活性污泥使填料挂膜。挂膜有2种:采用直接挂膜法将污泥淋洒在填料上并逐步提高进水量至设计值进行挂膜;采用分步挂膜法先培养出适宜处理目标污水的活性污泥,之后按直接挂膜法进行挂膜。
1)一体式生物膜自养脱氮系统。一体式生物膜自养脱氮系统的挂膜方式多为直接挂膜法。接种污泥可为好氧硝化污泥、厌氧氨氧化污泥或混合污泥。WANG等[38]在固定床反应器(fixed bed reactor,FBR)中采用直接挂膜法接种短程硝化污泥与厌氧氨氧化污泥的混合物,并在反应器中安装体积为80%的蜂窝载体;该反应器在21 d内快速启动了低氨氮一体式CANON自养脱氮工艺;在反应器运行的第95天 ,系统的NRR和TNRE分别达到0.184 kg·(m3·d)−1和91.81%,表现出良好的抗载荷冲击和迅速恢复反应状态的能力。这是由于反应器中的生物膜结构决定了其相对稳定的运行性能。在成熟的CANON工艺中,生物膜表现为聚集体形态,具有多孔和微孔结构,该特点有利于改善基质和产物的转移。GONG等[39]将无纺布载体(厚度为0.5 cm)包裹在透气性碳管(直径为8.9 mm)外层,并将其作为膜曝气生物反应器(membrane aeration bioreactor,MABR)的载体,采用直接挂膜法在其中接种含AnAOB和AOB的污泥;在35 ℃、HRT为6 h、DO为0.5 mg·L−1的条件下实现了高氨氮污水一体式自养脱氮工艺的成功启动;系统的NLR和NRR分别达到0.87和0.77 kg·(m3·d)−1。武文君等[40]将粒径为3~5 mm的火山岩滤料安装入曝气生物滤池(Biological aerated filter,BAF)中,并采用直接挂膜法培养成熟的anammox系统后再接种硝化污泥;将系统内DO调节为0.5 ~1.0 mg·L−1后,成功于该BAF中启动低氨氮一体式自养脱氮工艺,TNRE仅为53.44%;在整个运行期间,系统未亚硝积累现象,且氨氧化速率为该研究的限速步骤。由于AOB为好氧菌,故氨氧化速率与DO息息相关。由此说明,低DO并不是成功启动一体化生物膜自养脱氮系统的关键条件。
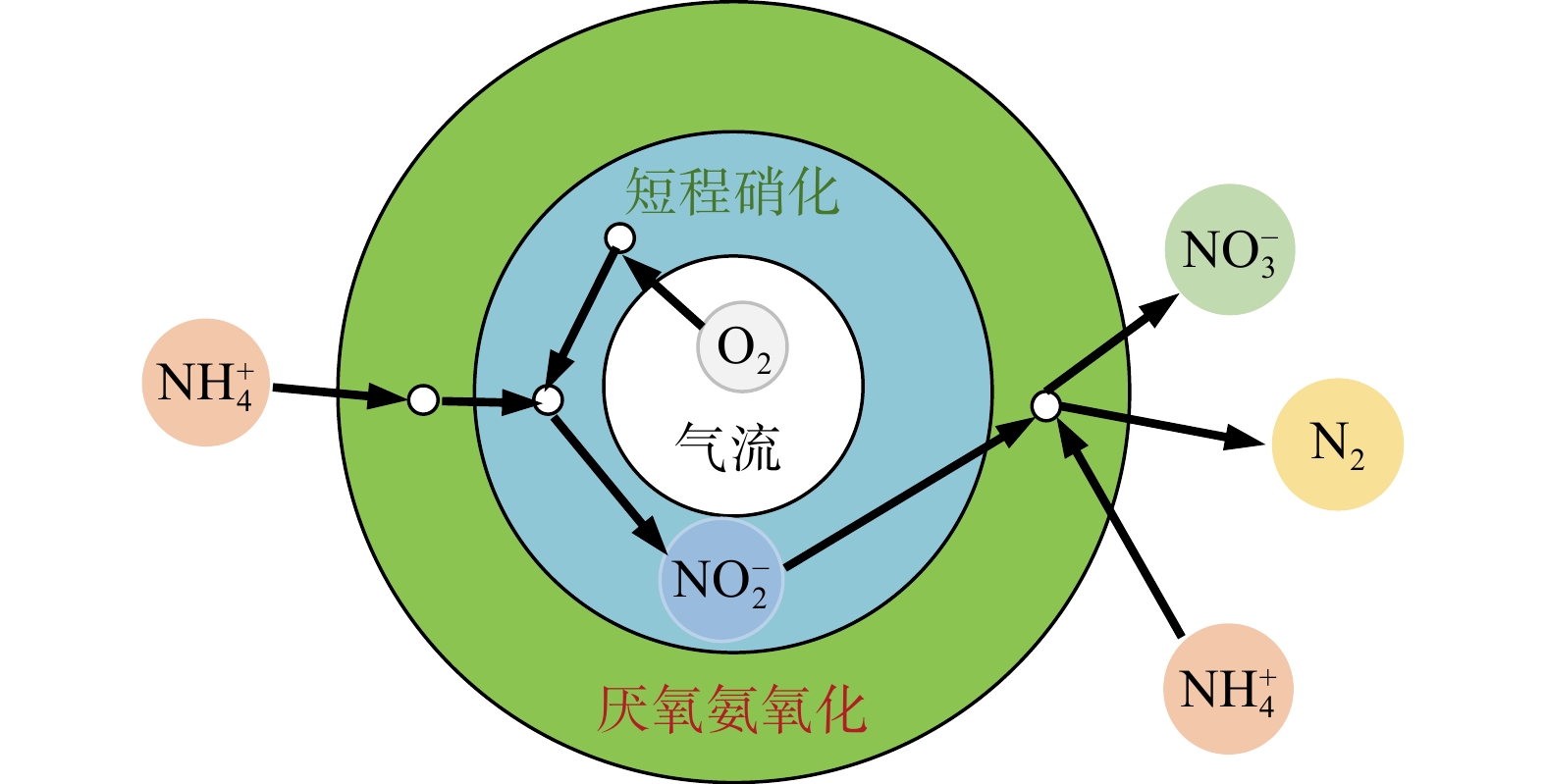
一体式PN/A颗粒污泥和生物膜自养脱氮系统中的AnAOB对DO有更高的耐受力[41]。在一级生物膜和颗粒体系中,外层AOB层可保护AnAOB免受氧的侵害[42]。这种状态即在生物膜中不同的微环境相互靠近,使得厌氧、缺氧和好氧的微生物活动可同时发生在一个反应器中[43],这也是生物膜系统的优势。杨庆等[44]将粒径为3~5 mm的火山岩滤料安装于BAF中并接种二沉池回流污泥,再采用直接挂膜法进行挂膜,并在短程硝化后回流anammox滤池的出水中接种少量AnAOB;在系统运行140 d后即成功启动BAF高氨氮污水一体式自养脱氮工艺;池体内DO为2.94 mg·L−1、TNRE稳定在85.47%、NRR达0.91 kg·(m3·d)−1。AUGUSTO等[45]在限氧条件下于MABR中接种厌氧氨氧化活性污泥,并成功启动低氨氮污水一体式SNAP自养脱氮工艺(如图3所示);在(31.3±0.7) ℃、HRT为24 h、DO为(0.53±0.33) mg·L−1的条件下,NLR达到0.05 kg·(m3·d)−1、TNRE稳定在(78±6)%。在MABR系统中,AOB生长在更接近膜的内侧,而AnAOB在外侧,这与传统的生物膜组成相反。在如此高的HRT及高温下处理低氨氮污水得到的NLR相比其他报道,并不是很高,这表明在低氨氮污水的条件下系统的脱氮效果会大幅下降。因此,在常温下建立并完善高效处理低氨氮污水的机制是目前面临的主要挑战。
2)一体式生物膜异养脱氮系统。一体式生物膜异养系统的挂膜法与自养系统相同,启动方法多采用分步启动法,即先建立一个稳定的自养脱氮系统,再通过添加有机物基质富集反硝化菌后启动SNAD工艺。此启动方法的接种污泥类型亦与自养系统相同,为硝化污泥、厌氧氨氧化污泥或混合污泥。CHEN等[46]在在无纺布生物转盘(non-woven rotating biological contactor,NRBC)中接种anammox污泥和短程硝化污泥,并在系统的氨氮去除率(ammonia nitrogen removing ratio,ARE)达到80%后在进水中引入COD基质,使得生物膜附着在无纺布载体上,最后成功启动一体式SNAD异养脱氮工艺用以处理高氨氮污水;在温度为35 ℃、COD为100 mg·L−1、C/N为0.5、DO为0.4~0.6 mg·L−1的条件下,NRR和COD负荷分别为0.69 kg·(m3·d)−1、 0.34 kg·(m3·d)−1、ARE为79%、TNRE为70%、COD去除率为94%。XUE等[47]在BAF中接种anammox污泥和短程硝化污泥,并在成功启动CANON系统后向进水中添加碳源;在COD为60 mg·L−1、C/N为0.2、DO为1.3~1.7 mg·L−1的条件下,SNAD中的处理效果最佳,即NRR为2.3 kg·(m3·d−1)、 TNRE和COD去除率分别为92.0%和 82.9%。因此,低DO也并非成功启动一体化生物膜异养脱氮系统的关键因素,而低C/N仍是其成功启动的重要因素。
以上案例说明,生物膜反应器的处理效果与载体的选择,以及载体的粒径、厚度、填充率等参数亦是研究中应考虑的重要因素。另外,控制生物膜的厚度也是一体式脱氮工艺运行中的挑战之一[48]。若生物膜的厚度非常薄则很难在有氧条件下形成厌氧层,而过厚的生物膜也不便于工艺的进行,甚至会因限制厌氧层而缺乏底物[49]。实际上,生物膜的厚度对工艺操作的影响与溶解氧存在密切联系。在生物膜厚度较薄的系统中,较低的DO即足够,而相对较厚的生物膜会限制DO扩散,则需要更高的DO来满足反应进行。当生物膜达到最佳厚度后,即使生物膜继续发展,脱氮能力也不会再有提升。这是由于较厚的生物膜并不利于形成DO梯度,反而会抑制AOB和AnAOB的生物活性[50]。最佳DO可由不同的生物膜厚度来确定,而在不同的DO条件下,也需要最佳的生物膜厚度[51]。由于反应器中不断发生曝气和混合,生物膜的内层也被剪切作用不断地暴露出来。而生物膜的无限增长是不可能的,随之会带来菌群对空间的竞争。因此,应摸清工艺的控制步骤,以及工艺性能和微生物群落组成的影响机制素,才能更好地掌握工艺的调控和优化脱氮反应的过程。
-
在悬浮污泥系统中,污泥以絮凝体形状存在。絮凝体是由胞外聚合物包围的微菌落组成的松散和可渗透的聚集体。结构松散的悬浮絮凝体在基质从液相向絮凝体的输送和扩散方面具有优势。悬浮和游离AnAOB比颗粒和生物膜AnAOB有更快的生长速度和更高的活性[52-54],这说明絮凝体这一状态可强化微生物的生长及污染物的去除。然而,悬浮生长系统中生物质的保留能力是最微小的,这取决于生物质的沉降性,而生物质沉降性会影响到生物质的量,进而影响一体式体系的NLR。值得注意的是,在系统中,絮凝体状态的污泥比颗粒污泥更难维持。因此,悬浮生长系统的2个重要挑战即是对系统中生物质的保留和维持微生物的活性[35]。
在一体式厌氧氨氧化过程中,小团聚体和大团聚体发挥不同功能,这两种类型的微生物聚集物比预想的更常共存[55]。悬浮污泥系统中有颗粒污泥存在,而不同反应器配置及操作条件会使絮凝体作为初始团聚体聚集形成颗粒污泥[56]。因此,在悬浮污泥系统中,生物质常以絮凝体及颗粒污泥2种形式共存或与固定生物膜相组合来增强生物质的保留。
1)一体式悬浮污泥自养脱氮系统。一体式悬浮污泥自养脱氮系统可通过接种污泥实现快速启动。接种污泥分好氧硝化污泥、厌氧氨氧化污泥及混合污泥3种。MIAO等[57]向SBR中接种anammox颗粒污泥和短程硝化活性污泥用以启动一体式PN/A自养脱氮工艺,并通过间歇曝气将DO控制为0.4 ~0.6 mg·L−1以便成功抑制NOB;该工艺在(32±1) ℃时处理低氨氮生活污水,其TNRE稳定在75%以上、NRR为0.073 kg·(m3·d)−1。CHU等[58]在SBR中接种来自某中试厌氧滤池的反硝化生物膜,成功启动了一体式PN/A自养脱氮系统,将其用于处理高氨氮污水;在温度为(33±1) ℃时,通过间歇曝气将DO控制为0.3~0.5 mg·L−1,使得系统NLR稳定在0.5 kg·(m3·d)−1、TNRE稳定在85%;与此同时,悬浮絮凝体中出现了明显的红色颗粒,且在启动过程中红色颗粒数量逐渐增加。因此,尽管SBR没有水力旋流器的选择性生物质保留功能,亦可保持长期运行,最终形成厌氧氨氧化颗粒污泥。以上研究采用了不同类型的污泥进行了一体式自养脱氮系统的启动,证明了悬浮污泥系统对运行参数调控的灵敏性,这表明可通过探究不同接种污泥的类型对系统快速启动的影响来选取最优种泥。
絮凝体与生物膜的组合已成功应用于集成固定生物膜—活性污泥反应器(integrated fixed biofilm-activated sludge reactor,IFAS)。在IFAS系统中,生物膜和絮凝体间形成独立的微生物群落及其独特的功能,可用于改善一体式PN/A工艺[59]。IFAS系统的启动与生物膜系统的启动类似,通常在悬浮污泥系统启动后投加填料采用直接挂膜法进行挂膜。YANG等[60]在IFAS反应器中安装聚氨酯海绵载体,并接种厌氧氨氧化菌和同步硝化反硝化污泥,已成功启动高氨氮一体式自养脱氮工艺;在温度为27~29 ℃、DO为0.1 ~0.35 mg·L−1的条件下,其TNRE稳定在85%、NRR稳定在2.0~2.5 kg·(m3·d)−1。ZHANG等[61]已成功启动IFAS一体式PN/A侧流工艺来处理高氨氮污水;在温度为28~29 ℃、DO逐渐降至0.3~0.5 mg·L−1的条件下,系统的TNRE稳定在85%、NRR为1.2 kgN·(m3·d−1)。在IFAS系统中,厌氧氨氧化菌共存于污泥与生物膜上,但不同系统中所占比例不尽相同。在不同空间内,AnAOB发挥着不同作用。而到目前为止,AnAOB在某一空间存在比例对脱氮效果的尚未被研究。值得注意的是,以上案例均在低DO下启动,关于高DO对一体式悬浮污泥自养脱氮系统启动的影响仍鲜有研究。
2)一体式悬浮污泥异养脱氮系统。一体式悬浮污泥异养脱氮系统通过接种好氧活硝化污泥、厌氧氨氧化污泥、反硝化污泥或混合污泥可实现快速启动。ANJALI等[62]在SBR中接种来自曝气池的活性污泥成功启动了高氨氮一体式SNAD异养脱氮系统;在温度为30~36℃、C/N为1、通过间歇曝气控制DO为0.17~0.35 mg·L−1的条件下,TNRE和COD的去除率分别为82%、92%。WANG等[63]在处理主流污水的最佳C/N比(1.2 ± 0.2)下已成功启动一体式SNAD异养脱氮系统;在温度为(25±2) ℃、通过间歇曝气控制DO为(0.4±0.1) mg·L−1的条件下,实现了TNRE为(72 ± 2)%、COD平均去除率为88%的理想效果。与颗粒污泥系统和生物膜系统相同,C/N仍是悬浮污泥系统成功启动一体式异养脱氮系统的关键因素。为节省曝气量,更多研究集中在低DO下如何成功启动一体式悬浮污泥异养脱氮系统,。
以上案例表明,与生物膜和颗粒污泥系统相比,悬浮污泥系统的优势是液相悬浮污泥浓度高、扩散限制明显较低,这使得通过间歇曝气保持低水平DO以控制AOB/NOB竞争成为可能。此外,悬浮污泥系统的污泥龄期可独立于生物膜之外进行控制,并在耐受高进水COD/N比的前提下,为洗除HB和淘洗NOB提供了另一种选择。而对于悬浮污泥系统对生物质的保留能力较差这一缺点,可在实际工程应用中通过与生物膜及颗粒污泥系统相结合的形式来改善;同时,还应深入研究其与不同微生物形态系统的组合对氮去除效果的影响。对比3种形态污泥对应的生长系统,结果如表2所示。
-
一体式与分体式厌氧氨氧化工艺各有优势。由于一体式基础设施成本低,其应用更广泛。然而,使厌氧氨氧化工艺更快更广泛地投入主流污水处理的工程应用中是尚待解决的问题。在季节性变化很大的环境条件下,如何快速启动厌氧氨氧化工艺,在低温低氨氮下高效培养厌氧氨氧化菌,如何获得稳定的亚硝来源并有效地抑制NOB活性,这些问题均为厌氧氨氧化工艺应用过程中的主要挑战。
目前,一体式厌氧氨氧化工艺已被应用于多种污水的脱氮,且处理效果良好。然而,这些工程主要针对侧流污水及其他高氨氮污水,关于主流污水的处理应用仍鲜有报道。尽管已有一体式工艺成功应用与低温污水处理中,但AnAOB在低温下活性的降低仍是主要问题。为获得低DO下的高除氮率,主流污水的处理需保持低HRT、且AnAOB生长缓慢。在低HRT下,由于系统中存在剪切作用,良好的生物量保留是保证处理效果的先决条件。因此,一体式厌氧氨氧化工艺在主流污水处理中的应用仍是业内需要努力研究的方向,可着重研发新型高效的一体式反应器,并加强对优质菌种的筛选与富集工作。
另外,较高的碳氮比会导致污泥中异养细菌大量存在,导致AnAOB和AOB的种群数量和活性降低,氮去除率较低,故一体式厌氧氨氧化工艺多适用于处理低碳氮比的污水。因此,在高碳氮比的污水前端加上除碳预处理工艺亦为值得关注的方向。
值得注意的是,在主流污水的处理中,获得稳定的亚硝来源并有效地抑制NOB活性是保证anammox反应器稳定运行的关键,故anammox与短程硝化技术的组合应用比较广泛。因此,获得稳定的短程硝化技术亦是该领域的研究重点之一。特别是对于一体式PN/A工艺而言,AOB、NOB和AnAOB之间复杂的菌群关系会干扰短程硝化的稳定性。近年来,反硝化、短程反硝化技术与厌氧氨氧化技术的一体式组合,为同时去除污水中的有机物和硝氮提供了新思路。在不同组合中,各类菌群关系不尽相同,需要结合每种系统自身特点和适应性,以此优化一体式生物脱氮系统的运行参数和操作条件。未来将会有更多的中试和污水处理厂去实验与应用这些技术和方案,以支撑一体式厌氧氨氧化工艺在主流污水处理中的应用发展。
一体式厌氧氨氧化工艺系统的研究与应用进展
Research and application progress of integrated anammox process system
-
摘要: 厌氧氨氧化技术凭借无需投加碳源、节省能耗、污泥产量低等优势成为污水脱氮领域中具有创新性与高效性的研究之一。学者们对相关组合工艺的反应机理、微生物群落、应用形式等开展大量研究。相对于分体式厌氧氨氧化工艺,一体式工艺布局更紧凑,大大降低了设施建设和运营的成本。从工程应用角度梳理了一体式厌氧氨氧化工艺的优势,结合国内外一体式厌氧氨氧化工艺在城镇污水处理中的工程案例,从颗粒污泥、生物膜、悬浮污泥系统及主要功能菌的营养类型等方面对一体式工艺系统中厌氧氨氧化微生物的研究进展进行了综述,并阐述了不同一体化系统的工艺性能、应用情况及影响因素,最后探讨了一体式工艺在城镇污水处理中的应用瓶颈及发展方向,以期为一体式厌氧氨氧化工艺的工程应用提供参考。Abstract: Anaerobic ammonium oxidation (anammox) technology has become one of the most innovative and efficient researches in the field of wastewater deammonification due to its advantages such as no need to add carbon sources, energy saving and low sludge yield. Researchers have carried out a lot of research on reaction mechanism, microbial community, application form Compared to the the split anammox process, the layou of integrated process is more compact, which significantly reduces the cost of infrastructure and operation. In this paper, the advatages of integrated anammox technology were summarized from the point of engineering application. Combined with the engineering cases of integrated anammox process in municipal wastewater at home and abroad, the research progress of anammox microorganisms in integrated process system was reviewed from the aspects of granular sludge, biofilm, suspended sludge system and the nutrition type of main functional bacteria. The process performance, application and influence factors of different integrated process were also discussed. The application bottleneck and development direction of the integrated process in urban sewage treatment were discussed in order to provide reference for engineering application of the integrated anammox process.
-
Key words:
- anammox /
- integrated /
- granular sludge /
- biofilm /
- suspended sludge /
- engineering application
-

-
图 2 PN/A-PDN/A工艺:单级SBR反应器组合工艺[34]
Figure 2. PN/A-PDN/A process: combined process of single stage SBR reactor
图 3 膜曝气生物反应器及内部反应示意图[45]
Figure 3. Schematic diagram of membrane aerated bioreactor and internal reaction
表 1 一体式和分体式厌氧氨氧化工艺的运行状况对比
Table 1. Comparison of operation status of integral and separate anammox processes
工艺类型 潜在游离氨毒性 潜在亚硝
酸盐毒性pH敏感性 温度敏感性 菌群复杂性 控制NOB
生长的难度装置复杂性 操作复杂性 基础设施成本 N2O排放量 一体式工艺 在温度(30±1)℃、pH 7~8的条件下,CANON颗粒污泥系统在游离氨(FA)为34、20、10 mg·L−1的条件下运行稳定[18] 一体式反应器中PN反应产生的亚硝酸盐被持续消耗,能有效避免因亚硝酸盐积累造成的抑制[20] 适宜的pH需同时兼顾PN与anammox反应,取交集。DEMON过程对pH带宽非常敏感。若pH带宽大于0.02,会导致系统不稳定[22] 在中低温下处理高氨氮污水,在20 ℃时及相同操作条件下,一体式系统的NLR为分体式系统的10倍,但降温至15 ℃时,NRR迅速下降[5, 16] AnAOB、AOB、NOB、异养菌(Heterotrophic bacteria,HB)等同时存在于同一体系 同时考虑AOB、AnAOB与NOB的协同作用,不可避免NOB与anammox竞争[23−24] 一个独立的反应器 与菌群复杂性、运行参数对系统的影响均有关 实际应用中,由于一体式基础设施成本低,故应用广泛[5−6] 总氮负荷的0.4%~1.3%[8−10] 分体式工艺 FA对AnAOB和氨氧化菌(ammonia oxidizing bacteria,AOB)产生抑制作用的浓度分别为50 ~178 mg·L−1和10 ~150 mg·L−1[19] 亚硝酸盐浓度为16 mmol·L−1时,50%的anammox活性被抑制[21] 分别考虑PN与anammox反应适宜的pH,互不干扰 在中低温下处理高氨氮污水,在20 ℃时以及相同操作条件下,一体式系统的NLR为分体式系统的10倍,但降温至15 ℃时,NRR迅速下降[5, 16] AnAOB与AOB、NOB、HB等分别存在于2个体系 主要在PN反应器中抑制NOB,不会在anammox反应器中竞争基质 [25] 2个独立的反应器。在实际应用中,短程硝化反应器之后可能需要设置沉淀池[26] 与菌群复杂性、运行参数对系统的影响均有关 与装置的复杂性有关 总氮负荷的2.3%~6.6%[11−12] 表 2 一体式厌氧氨氧化生长系统比较
Table 2. Comparison of integrated anammox growth systems
污泥形态 AnAOB
存在形式生物质
保留能力菌群
复杂性冲洗NOB
的难度扩散能力 DO忍耐力 AnAOB活性 颗粒污泥 颗粒污泥、
絮体高 高 可通过固定化细菌冲刷NOB DO扩散受到限制[52] AnAOB对DO有更高的耐受力[41] 保持生物量和活性平衡的理想条件[35] 生物膜 生物膜 高 高 可通过固定化细菌冲刷NOB DO、亚硝基质扩散速率受到限制[52] 外层的AOB层可以保护AnAOB免受氧的侵害[42] 较厚的生物膜会抑制AOB和AnAOB的活性[50] 悬浮污泥 絮体、颗粒污泥/生物膜 适中 高 悬浮污泥系统的污泥龄期为淘洗NOB提供了另一种选择 结构松散的悬浮絮凝体在基质从液相向絮凝体的输送和扩散方面具有优势[53, 54] 扩散能力较强,对DO浓度的变化敏感 悬浮和游离的AnAOB有更高的活性[52] -
[1] 王刚, 高会杰, 孙丹凤, 等. 厌氧氨氧化技术在废水脱氮领域的应用进展[J]. 化工环保. 2020, 40(2): 111-117. [2] 谢军祥, 姜滢, 常尧枫, 等. 城镇生活污水厌氧氨氧化处理的研究进展[J]. 化工进展. 2020, 39(10): 4175-4184. [3] ZHAO Z C, XIE G J, LIU B F, et al. A review of quorum sensing improving partial nitritation-anammox process: Functions, mechanisms and prospects[J]. The Science of the total environment, 2021, 765: 142703 [4] WANG Y M, LIN Z Y, HE L, et al. Simultaneous partial nitrification, anammox and denitrification (SNAD) process for nitrogen and refractory organic compounds removal from mature landfill leachate: Performance and metagenome-based microbial ecology[J]. Bioresource Technology, 2019, 294: 122166 [5] CAO Y, LOOSDRECHT M C, DAIGGER G T. Mainstream partial nitritation-anammox in municipal wastewater treatment: status, bottlenecks, and further studies[J]. Applied Microbiology and Biotechnology, 2017, 101(4): 1365-1383 [6] LACKNER S, GILBERT E M, VLAEMINCK S E, et al. Full-scale partial nitritation/anammox experiences–An application survey[J]. Water Research, 2014, 55: 292-303 [7] CONNAN R, DABERT P, MOYA-ESPINOSA M, et al. Coupling of partial nitritation and anammox in two- and one-stage systems: Process operation, N2O emission and microbial community[J]. Journal of Cleaner Production, 2018, 203: 559-573 [8] WEISSENBACHER N, TAKACS I, MURTHY S, et al. Gaseous nitrogen and carbon emissions from a full-scale deammonification plant[J]. Water Environment Research, 2010, 82(2): 169-175 [9] JOSS A, SALZGEBER D, EUGSTER J, et al. Full-scale nitrogen removal from digester liquid with partial nitritation and anammox in one SBR[J]. Environmental Science & Technology, 2009, 43(14): 5301-5306 [10] KAMPSCHREUR M J, POLDERMANS R, KLEEREBEZEM R, et al. Emission of nitrous oxide and nitric oxide from a full-scale single-stage nitritation-anammox reactor[J]. Water Science and Technology, 2009, 60(12): 3211-3217 [11] KAMPSCHREUR M J, STAR W R L, WIELDERS H A, et al. Dynamics of nitric oxide and nitrous oxide emission during full-scale reject water treatment[J]. Water Research, 2008, 42(3): 812-826 [12] DESLOOVER J, CLIPPELEIR H, BOECKX P, et al. Floc-based sequential partial nitritation and anammox at full scale with contrasting N2O emissions[J]. Water Research, 2011, 45(9): 2811-2821 [13] LIU Y, NIU Q G, WANG S P, et al. Upgrading of the symbiosis of Nitrosomanas and anammox bacteria in a novel single-stage partial nitritation-anammox system: Nitrogen removal potential and Microbial characterization[J]. Bioresource Technology, 2017, 244: 463-472 [14] WANG X L, GAO D W. The transformation from anammox granules to deammonification granules in micro-aerobic system by facilitating indigenous ammonia oxidizing bacteria[J]. Bioresource Technology, 2018, 250: 439-448 [15] CHEN R, JI J Y, CHEN Y J, et al. Successful operation performance and syntrophic micro-granule in partial nitritation and anammox reactor treating low-strength ammonia wastewater[J]. Water Research, 2019, 155: 288-299 [16] VÁZQUEZ-PADÍN J R, FERNÁNDEZ I, MORALES N, et al. Autotrophic nitrogen removal at low temperature[J]. Water Science and Technology, 2011, 63(6): 1282-1288 [17] VLAEMINCK S E, CLIPPELEIR H, VERSTRAETE W. Microbial resource management of one-stage partial nitritation/anammox[J]. Microbial Biotechnology, 2012, 5(3): 433-448 [18] 韩晓宇, 孙延芳, 张树军, 等. 进水氨氮浓度对两种污泥系统CANON工艺的冲击影响[J]. 哈尔滨工业大学学报. 2018, 50(2): 40-45. [19] TOMASZEWSKI M, CEMA G, ZIEMBIŃSKA-BUCZYŃSKA A. Influence of temperature and pH on the anammox process: A review and meta-analysis[J]. Chemosphere, 2017, 182: 203-214 [20] JOSS A, SALZGEBER D, EUGSTER J, et al. Full-Scale Nitrogen Removal from Digester Liquid with Partial Nitritation and Anammox in One SBR[J]. Environmental Science & Technology, 2009, 43(14): 5301-5306 [21] OSHIKI M, SHIMOKAWA M, FUJII N, et al. Physiological characteristics of the anaerobic ammonium-oxidizing bacterium ‘Candidatus Brocadia sinica’[J]. Microbiology, 2011, 157(6): 1706-1713 [22] JAROSZYNSKI L W, OLESZKIEWICZ J A. Autotrophic ammonium removal from reject water: partial nitrification and anammox in one-reactor versus two-reactor systems[J]. Environmental Technology, 2011, 32(3-4): 289-294 [23] SCHRAA O, ROSENTHAL A, WADE M J, et al. Assessment of aeration control strategies for biofilm-based partial nitritation/anammox systems[J]. Water Science and Technology, 2020, 81(8):1757-1765 [24] De CLIPPELEIR H, VLAEMINCK S E, De WILDE F, et al. One-stage partial nitritation/anammox at 15 °C on pretreated sewage: feasibility demonstration at lab-scale[J]. Applied Microbiology and Biotechnology, 2013, 97(23): 10199-10210 [25] PÉREZ J, LOTTI T, KLEEREBEZEM R, et al. Outcompeting nitrite-oxidizing bacteria in single-stage nitrogen removal in sewage treatment plants: A model-based study[J]. Water Research, 2014, 66: 208-218 [26] ÇELEN-ERDEM İ, KURT E S, BOZÇELIK B, et al. Upflow packed bed Anammox reactor used in two-stage deammonification of sludge digester effluent[J]. Water Science and Technology, 2018, 78(9): 1843-1851 [27] GUO Y, XIE C L, CHEN Y J, et al. Achieving superior nitrogen removal performance in low-strength ammonium wastewater treatment by cultivating concentrated, highly dispersive, and easily settleable granule sludge in a one-stage partial nitritation/anammox-HAP reactor[J]. Water Research, 2021, 200: 117217 [28] WANG L, ZHENG P, CHEN T T, et al. Performance of autotrophic nitrogen removal in the granular sludge bed reactor[J]. Bioresource Technology, 2012, 123: 78-85 [29] WANG S P, LIU Y, NIU Q G, et al. Nitrogen removal performance and loading capacity of a novel single-stage nitritation-anammox system with syntrophic micro-granules[J]. Bioresource Technology, 2017, 236: 119-128 [30] LI X J, SUNG S. Development of the combined nitritation-anammox process in an upflow anaerobic sludge blanket (UASB) reactor with anammox granules[J]. Chemical Engineering Journal, 2015, 281: 837-843 [31] QIAN F Y, GEBREYESUS A T, WANG J F, et al. Single-stage autotrophic nitrogen removal process at high loading rate: granular reactor performance, kinetics, and microbial characterization[J]. Applied Microbiology and Biotechnology, 2018, 102(5): 2379-2389 [32] LIU W R, WANG Q, SHEN Y L, et al. Enhancing the in-situ enrichment of anammox bacteria in aerobic granules to achieve high-rate CANON at low temperatures[J]. Chemosphere, 2021, 278: 130395 [33] LIU T, MA B, CHEN X M, et al. Evaluation of mainstream nitrogen removal by simultaneous partial nitrification, anammox and denitrification (SNAD) process in a granule-based reactor[J]. Chemical Engineering Journal, 2017, 327: 973-981 [34] LI J L, PENG Y Z, ZHANG L, et al. Improving efficiency and stability of anammox through sequentially coupling nitritation and denitritation in a single-stage bioreactor[J]. Environmental Science & Technology, 2020, 54(17): 10859-10867 [35] VLAEMINCK S E, TERADA A, SMETS B F, et al. Aggregate size and architecture determine microbial activity balance for one-stage partial nitritation and anammox[J]. Applied and Environmental Microbiology, 2010, 76(3): 900-909 [36] WANG L, ZHENG P, XING Y T, et al. Effect of particle size on the performance of autotrophic nitrogen removal in the granular sludge bed reactor and microbiological mechanisms[J]. Bioresource Technology, 2014, 157: 240-246 [37] REN Y H, LI D, LI X K, et al. High-rate nitrogen removal and microbial community of an up-flow anammox reactor with ceramics as biomass carrier[J]. Chemosphere, 2014, 113: 125-131 [38] WANG X, WANG T, YUAN L Z, et al. One-step start-up and subsequent operation of CANON process in a fixed-bed reactor by inoculating mixture of partial nitrification and Anammox sludge[J]. Chemosphere, 2021, 275: 130075 [39] GONG Z, YANG F L, LIU S T, et al. Feasibility of a membrane-aerated biofilm reactor to achieve single-stage autotrophic nitrogen removal based on Anammox[J]. Chemosphere, 2007, 69(5): 776-784 [40] 武文君, 刘秀红, 崔斌, 等. 溶解氧对Anammox滤池内功能菌群及活性的影响[J]. 中国环境科学. 2021, 41(3): 1415-1421. [41] JIANG H, PENG Y Z, LI X Y, et al. Advanced nitrogen removal from mature landfill leachate via partial nitrification-Anammox biofilm reactor (PNABR) driven by high dissolved oxygen (DO): Protection mechanism of aerobic biofilm[J]. Bioresource Technology, 2020, 306: 123119 [42] WINKLER M K H, KLEEREBEZEM R, KUENEN J G, et al. Segregation of biomass in cyclic anaerobic/aerobic granular sludge allows the enrichment of anaerobic ammonium oxidizing bacteria at low temperatures[J]. Environmental Science & Technology, 2011, 45(17): 7330-7337 [43] VANGSGAARD A K, MAURICIO-IGLESIAS M, GERNAEY K V, et al. Sensitivity analysis of autotrophic N removal by a granule based bioreactor: Influence of mass transfer versus microbial kinetics[J]. Bioresource Technology, 2012, 123: 230-241 [44] 杨庆, 周桐, 刘秀红, 等. 常温下接种回流污泥实现BAF一体化自养脱氮工艺[J]. 化工学报. 2017, 68(5): 2081-2088. [45] AUGUSTO M R, CAMILOTI P R, SOUZA T S O D. Fast start-up of the single-stage nitrogen removal using anammox and partial nitritation (SNAP) from conventional activated sludge in a membrane-aerated biofilm reactor[J]. Bioresource Technology, 2018, 266: 151-157 [46] CHEN H, LIU S T, YANG F L, et al. The development of simultaneous partial nitrification, ANAMMOX and denitrification (SNAD) process in a single reactor for nitrogen removal[J]. Bioresource Technology, 2009, 100(4): 1548-1554 [47] 薛嘉俊, 张绍青, 张立秋, 等. 火山岩填料曝气生物滤池的SNAD工艺启动特性及功能菌丰度演替[J]. 环境科学. 2020, 41(6): 2796-2804. [48] ZHANG Z P, ADAV S S, SHOW K, et al. Characteristics of rapidly formed hydrogen-producing granules and biofilms[J]. Biotechnology and Bioengineering, 2008, 101(5): 926-936 [49] PENG L, LIU Y W, NI B J. Nitrous oxide production in completely autotrophic nitrogen removal biofilm process: A simulation study[J]. Chemical Engineering Journal, 2016, 287: 217-224 [50] TERADA A, YAMAMOTO T, IGARASHI R, et al. Feasibility of a membrane-aerated biofilm reactor to achieve controllable nitrification[J]. Biochemical Engineering Journal, 2006, 28(2): 123-130 [51] LIU T, QUAN X, LI D. Evaluations of biofilm thickness and dissolved oxygen on single stage anammox process in an up-flow biological aerated filter[J]. Biochemical Engineering Journal, 2017, 119: 20-26 [52] STAR W R L, ABMA W R, BLOMMERS D, et al. Startup of reactors for anoxic ammonium oxidation: Experiences from the first full-scale anammox reactor in Rotterdam[J]. Water Research, 2007, 41(18): 4149-4163 [53] GILBERT E M, AGRAWAL S, SCHWARTZ T, et al. Comparing different reactor configurations for Partial Nitritation/Anammox at low temperatures[J]. Water Research, 2015, 81: 92-100 [54] PÉREZ J, PICIOREANU C,LOOSDRECHT M. Modeling biofilm and floc diffusion processes based on analytical solution of reaction-diffusion equations[J]. Water Research, 2005, 39(7): 1311-1323 [55] WINKLER M K H, KLEEREBEZEM R, LOOSDRECHT M C M. Integration of anammox into the aerobic granular sludge process for main stream wastewater treatment at ambient temperatures[J]. Water Research, 2012, 46(1): 136-144 [56] LI J L, PENG Y Z, ZHANG Q, et al. Rapid enrichment of anammox bacteria linked to floc aggregates in a single-stage partial nitritation-anammox process: Providing the initial carrier and anaerobic microenvironment[J]. Water Research, 2021, 191: 116807 [57] MIAO Y Y, ZHANG L, YANG Y D, et al. Start-up of single-stage partial nitrification-anammox process treating low-strength swage and its restoration from nitrate accumulation[J]. Bioresource Technology, 2016, 218: 771-779 [58] CHU Z R, WANG K, LI X K, et al. Microbial characterization of aggregates within a one-stage nitritation–anammox system using high-throughput amplicon sequencing[J]. Chemical Engineering Journal, 2015, 262: 41-48 [59] LAURENI M, WEISSBRODT D G, VILLEZ K, et al. Biomass segregation between biofilm and flocs improves the control of nitrite-oxidizing bacteria in mainstream partial nitritation and anammox processes[J]. Water Research, 2019, 154: 104-116 [60] YANG S H, PENG Y Z, ZHANG L, et al. Autotrophic nitrogen removal in an integrated fixed-biofilm activated sludge (IFAS) reactor: Anammox bacteria enriched in the flocs have been overlooked[J]. Bioresource Technology, 2019, 288: 121512 [61] ZHANG L, ZHANG S J, PENG Y Z, et al. Nitrogen removal performance and microbial distribution in pilot- and full-scale integrated fixed-biofilm activated sludge reactors based on nitritation-anammox process[J]. Bioresource Technology, 2015, 196: 448-453 [62] ANJALI G, SABUMON P C. Development of simultaneous partial nitrification, anammox and denitrification (SNAD) in a non-aerated SBR[J]. International Biodeterioration & Biodegradation, 2017, 119: 43-55 [63] WANG C, LIU S T, XU X C, et al. Achieving mainstream nitrogen removal through simultaneous partial nitrification, anammox and denitrification process in an integrated fixed film activated sludge reactor[J]. Chemosphere, 2018, 203: 457-466 -



 下载:
下载: