-
传统污水处理技术多为“以能耗换水质”。国际污水处理行业正形成污染物削减功能进一步强化、低碳处理和能源开发技术收到重视、实现处理过程与资源回收同步等3个明显的发展态势[1]。我国已明确提出“碳达峰”和“碳中和”战略目标,在节能低碳和资源能源回收的污水处理新需求下,也面临污水处理技术的革新。
厌氧消化能将有机污染物转化为清洁能源甲烷,具有运行能耗低、能源回收效率高、占地面积小等优势,可为主流城市污水处理实现可持续发展提供新思路[2]。然而,在厌氧消化过程中,有机物含有的氮最终被转化为氨氮(
${\rm{NH}}_4^{+} $ -N),还需进一步脱氮处理以实现污水的达标排放[3]。厌氧氨氧化(anaerobic ammonium oxidation,anammox)是一种资源节约、环境友好的污水脱氮技术。厌氧氨氧化菌(anaerobic ammonium oxidation bacteria,AnAOB)能在厌氧条件下,以亚硝氮(${\rm{NO}}_2^{-} $ -N)为电子受体将${\rm{NH}}_4^{+} $ -N转化为N2,而无需曝气和外加碳源[4]。主流城市污水经厌氧消化处理后其出水C/N低,与anammox耦合可充分发挥二者的技术优势[5]。在实际应用中,anammox工艺已成功实现对污泥消化液[6]、垃圾渗滤液[7]等废水的处理。然而,对于氨氮较低(C/N比亦较低)的主流城市污水处理的研究则较少,这是由于在该反应体系内反应基质${\rm{NO}}_2^{-} $ -N很难稳定获取。目前,普遍采用短程硝化(partial nitrification,PN)过程来获取
${\rm{NO}}_2^{-} $ -N。然而,anammox工艺的理论最高脱氮效率仅为89%[8],且PN难以稳定控制亚硝酸盐氧化菌(nitrite oxidizing bacteria,NOB),导致出水硝氮(NO3−-N)质量浓度偏高,这也进一步限制了该过程的脱氮效果[9]。基于此,本研究拟通过外加人工合成城市污水来提供碳源,在移动床生物膜反应器(moving bed biofilm reactor,MBBR)中,通过调控运行参数,将短程反硝化(partial denitritation,PD)与PN/A进行耦合,从而强化其对主流厌氧消化出水的脱氮效果,以期为类似低C/N比污水的处理提供参考。 -
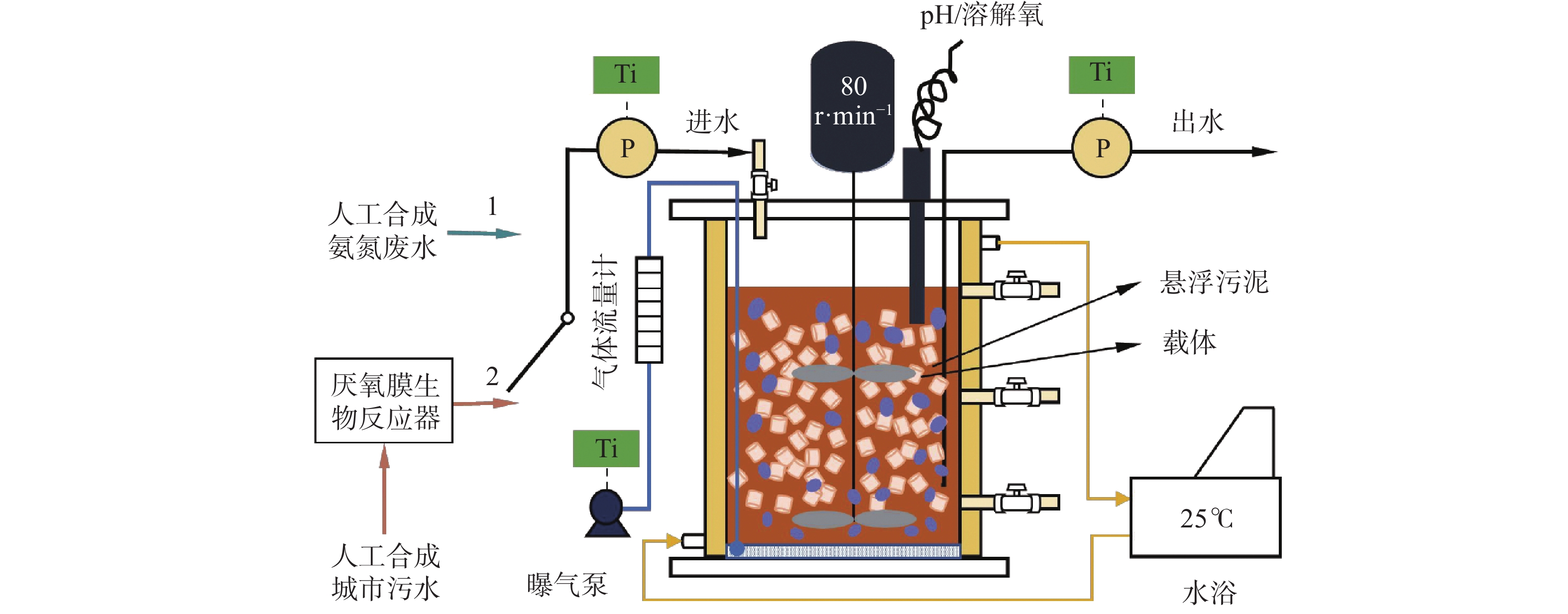
实验装置如图1所示。MBBR为有机玻璃制成,其工作体积为(2.0~2.3)L、内径为14 cm、外径为45 cm、高度为20 cm。反应器的外部设有水浴层,可通过恒温水浴装置实时将温度控制在(25 ± 1)℃。反应器的进出水通过定时装置控制蠕动泵(BT100J-1A,慧宇;中国)的启闭来实现。主体反应区内部有填充率为20%的填料作为生物膜附着生长的载体,且中间设机械搅拌桨,转速为80 r·min−1。填料由疏水性聚丙烯树脂制成,为中空圆柱体,其尺寸为φ4 mm×4 mm、比重为0.98 g·cm−3、比表面积为1 500 m2·m−3[10]。反应器底部内置微孔曝气盘,由定时装置控制其中的微型真空泵(VBY7506-24V,气海;中国)来实现间歇曝气,同时曝气量由玻璃转子气体流量计(LZB-4WB,双环;中国)控制;顶部设哈希便携式多功能测定仪(HQ30d,HACH;美国)用于温度、pH和DO的实时监测;侧壁设取样口便于排泥及样品采集。
-
接种污泥取自西安市第四污水厂一期A2O缺氧池末端(含AnAOB)[11]。接种后反应器中污泥的混合液悬浮固体(mixed liquor suspended solid,MLSS)和混合液挥发性悬浮固体(mixed liquor volatile suspended solid,MLVSS)质量浓度分别为2.64和1.44 g·L−1,而MLVSS/MLSS为0.55。在实验前期,进水为人工合成氨氮废水[12],以NH4HCO3为NH4+-N来源,投加800 mg·L−1 NaHCO3、21.9 mg·L−1 KH2PO4(5.00 mg·L−1 PO43--P)、36.0 mg·L−1 CaCl2·2H2O、25.0 mg·L−1 MgCl2·6H2O、0.5mL·L−1微量元素Ⅰ(5.00 g·L−1 Na2·EDTA·2H2O、5.00 g·L−1 FeSO4·7H2O)和0.5 mL·L−1微量元素Ⅱ(3.30 g·L−1 Na2·EDTA·2H2O、0.215 g·L−1 ZnSO4·7H2O、0.120 g·L−1 CoCl2·6H2O、0.495 g·L−1 MnCl2·4H2O、0.125 g·L−1 CuSO4·5H2O、0.110 g·L−1 Na2MoO4·2H2O、0.095 g·L−1 NiCl2·6H2O、0.078 g·L−1 Na2SeO3、0.007 g·L−1 H3BO4)作为营养物质。在反应器稳定运行后,进水采用主流厌氧消化出水(来自处理人工合成城市污水的厌氧膜生物反应器出水),其[NH4+-N]为(51.0 ± 2.3) mg·L−1、COD为(24.9 ± 2.8) mg·L−1、碱度(以CaCO3计)为(370 ± 10) mg·L−1、pH为(7.58 ± 0.16)。人工合成城市污水的COD为(500 ± 50) mg·L−1, TN为(50.0 ± 5.0) mg·L−1[13]。
-
MBBR以序批式模式连续运行68 d,其运行参数及调配策略如表1所示。实验分为2个阶段:阶段Ⅰ主要通过处理人工合成氨氮废水进行污泥驯化;阶段Ⅱ分两部分,前期通过外加110~160 mL人工合成城市污水以调整适宜的C/N,后期则处理主流厌氧消化出水并结合外加碳源策略强化脱氮性能。
-
水样采用0.45 μm滤膜过滤后测定其水质指标:NH4+-N采用纳氏试剂分光光度法、NO2−-N采用N-(1-萘基)-乙二胺分光光度法、NO3−-N采用紫外分光光度法、COD采用快速消解分光光度法(哈希快速消解仪)[14]。采用热提法[15]提取污泥混合液胞外聚合物(extracellular polymeric substances,EPS),并分别采用苯酚-硫酸法和福林-酚法测定蛋白质和多糖的含量。MLSS、MLVSS采用重量法测定,用到105 ℃恒温烘箱、600 ℃马弗炉及梅特勒天平等设备。
-
氮转化活性主要包括氨氧化活性(specific ammonia oxidation activity,SAOA)、亚硝酸盐氧化活性(specific nitrite oxidation activity,SNOA)、厌氧氨氧化活性(specific anammox activity,SAA)和反硝化活性(specific denitrification activity,SDA)。在实验开始前,分别测定絮体污泥和生物膜的MLSS和MLVSS,且批实验均设置平行实验[16]。
1) SAOA和SNOA的测定。取反应器中污泥混合液160 mL,经5‰氯化钠淘洗后分别置于2个250 mL广口瓶中;各加入200 mL基质(其中含有50.0 mg·L−1 NH4+-N、50.0 mg·L−1 NO2−-N),于25 ℃恒温磁力搅拌水浴中持续充分曝气,再间隔20 min取样。结束后测定NH4+-N、NO2−-N、NO3−-N的质量浓度并计算SAOA和SNOA。
2) SAA和SDA的测定。取反应器中污泥混合液80 mL,经5‰氯化钠淘洗后分别置于2个120 mL血清瓶中,各加入80 mL基质(SAA测定含25.0 mg·L−1 NH4+-N和25.0 mg·L−1 NO2−-N,SDA测定含50.0 mg·L−1 NO3−-N和225 mg·L−1 COD),再用氮气吹扫血清瓶顶空进行除氧并密封置于25 ℃恒温水浴摇床中,每间隔1 h取样,结束后测定NH4+-N、NO2−-N、NO3−-N浓度并计算SAA和SDA;取50颗载体测定生物膜的SAA,步骤同上。
-
反应器运行全周期过程中,在曝气、厌氧搅拌阶段每间隔5~8 min取样测定NH4+-N、NO2−-N和NO3−-N的质量浓度,并分析耦合系统中氮的去除路径。
-
采用荧光原位杂交技术(fluorescence in situ hybridization,FISH)观察微生物菌群分布。先用磷酸盐缓冲溶液洗涤絮体污泥和载体生物膜样品,并将其于4 ℃的4%多聚甲醛溶液中固定4 h;再将絮体污泥涂片,载体生物膜包埋并采用薄片切片机(CM1950,徕卡;德国)分成30 μm厚度的切片后固定在载玻片上;将其分别杂交后通过激光共聚焦显微镜(TCS SP8,徕卡;德国)进行观察并采集图像,使用Image J软件计算功能菌的目标生物量。实验所用探针:总菌采用EUBmix (EUB338、EUBⅡ、EUB338Ⅲ、EUB338Ⅳ);氨氧化细菌(ammonia oxidizing bacteria,AOB)采用Nso1225;AnAOB采用Amx820;NOB采用NOBmix(NIT3和CNIT3)[17]。
-
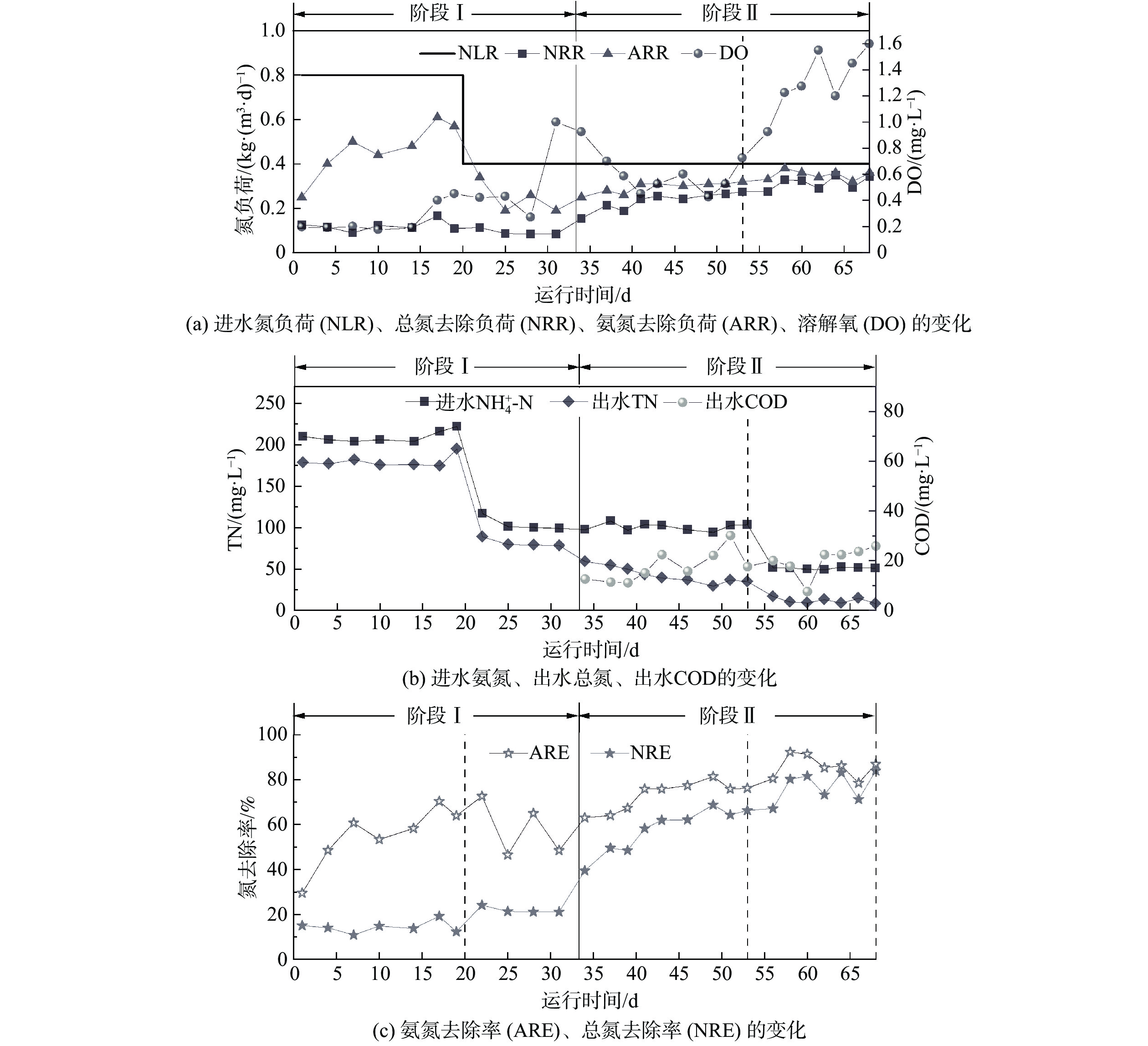
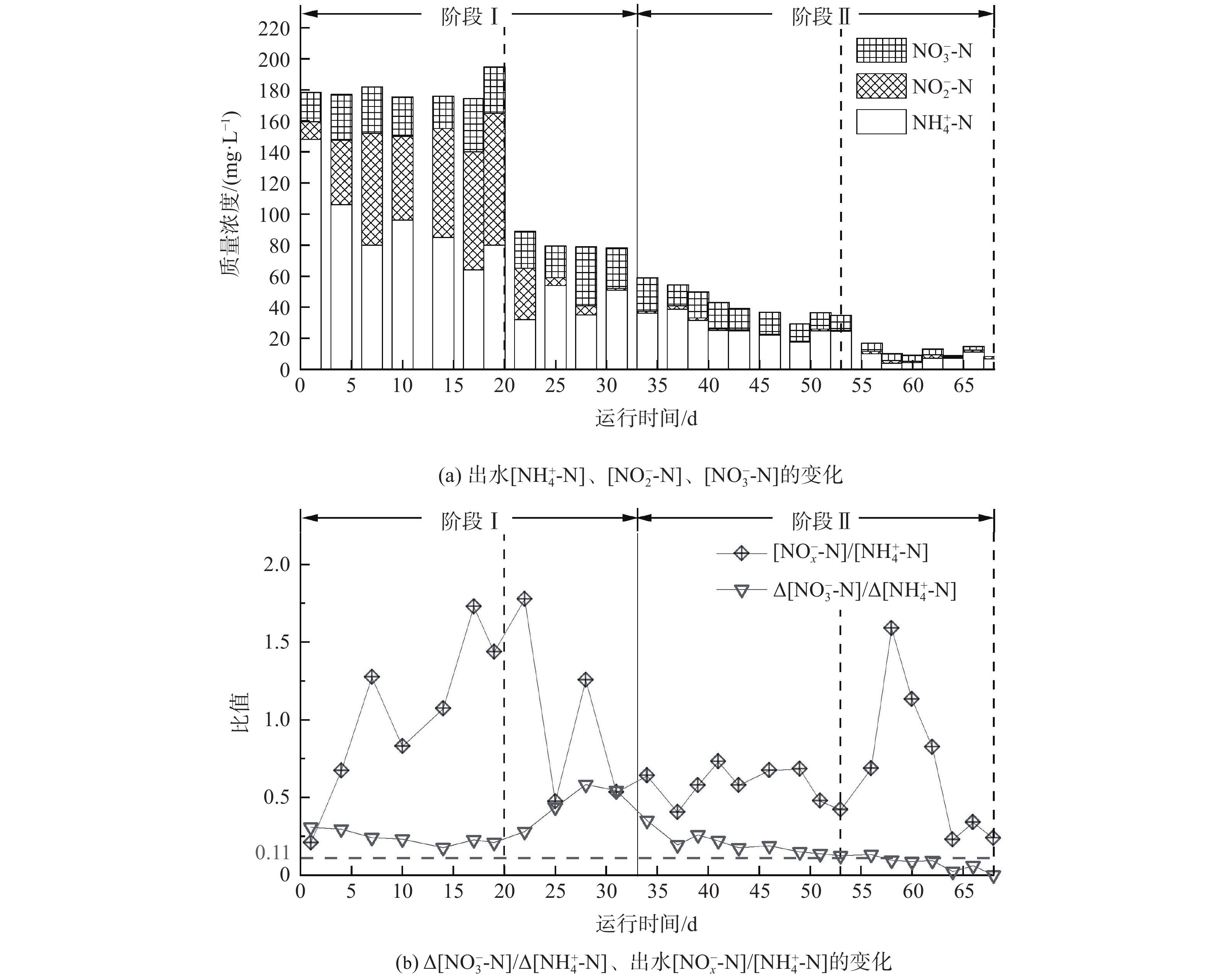
在连续运行的68 d里,MBBR对不同阶段污染物的去除效果如图2所示。阶段I(1~33 d)为污泥驯化培养阶段。其中,在运行初期(1~20 d),反应器中氮负荷(NLR)为0.80 kg·(m3·d)−1、溶解氧(DO)稳定在(0.21 ± 0.02)mg·L−1、曝气/厌氧时间比为3﹕1,需通过维持较长的曝气时间来实现AOB活性的快速提高。在此阶段,出水[NH4+-N]由148.0 mg·L−1逐步降至(76.3 ± 9.0)mg·L−1、[NO2−-N]和[NO3−-N]分别为(77.0 ± 6.2)mg·L−1和(28.4 ± 5.6)mg·L−1(图3(a)),而NO2−-N/NO3−-N为2.71表明了NOB可被有效抑制。这与进水较高浓度的NH4+-N产生高游离氨(FA)浓度[18]有关(FA为1.71~4.20 mg·L−1)。[NOx−-N]/[NH4+-N]、[NO2−-N]/[NH4+-N]分别用于表征系统氨氧化和亚硝氮累积性能。在此期间,[NOx−-N]/[NH4+-N]逐渐增大,NH4+-N转化率(ARE)由29.5%增至(67.2 ± 3.2)%,此时的[NO2−-N]/[NH4+-N]达到(1.13 ± 0.06),表明高效的PN系统已构建完成。运行至第21~33 天,将NLR降至0.40 kg·(m3·d)−1,此时Δ[NO3−-N]/Δ[NH4+-N]增至0.56,远高于理论值0.11。这是由于进水[NH4+-N]降低,导致出水FA降至(0.68~1.34)mg·L−1,故NOB对FA的抑制作用减弱[19-20]。
阶段Ⅱ(34~68 d)为调整运行模式阶段。在此阶段,通过增加厌氧搅拌时长和降低曝气/厌氧时间比,可优化AnAOB生存条件以强化AnAOB对NO2−-N的竞争。此外,为降低出水[NO3−-N],强化脱氮性能,曝气结束后实施外加碳源策略,即根据[NO3−-N]和反硝化化学计量关系计算对COD的需求量,逐渐往MBBR内添加110~160 mL人工合成城市污水,将C/N调整为0.25~0.34以促进NO3−-N的反硝化。在阶段Ⅱ前期(34~53 d),为保证曝气阶段NH4+-N的转化率,将曝气量从0.65 L·min−1逐渐增至1.05 L·min−1,此时的DO维持在(0.52 ± 0.06) mg·L−1,而出水[NH4+-N]由37.4 mg·L−1降至22.3 mg·L−1、[NO3−-N]由21.6 mg·L−1降至9.8 mg·L−1、ΔNO3−-N/ΔNH4+-N由0.35降至0.12,且几乎无NO2−-N残留(图3)。结果表明,NH4+-N转化率和TN去除率(NRE)最高分别达81.4%和68.8%,TN去除负荷(NRR)增至0.27 kg·(m3·d)−1。在此系统中,低质量浓度的有机物会诱导系统中异养反硝化菌(denitrifying bacteria,DB)通过短程反硝化和/或反硝化作用避免NO3−-N的过量积累[21],还可避免有机物对AOB和AnAOB活性的潜在抑制,以提高系统脱氮性能。在阶段II后期(54~68 d),反应器进水采用主流厌氧消化出水。此时,缩短HRT以保持NLR不变。有研究表明,在处理主流厌氧消化出水过程中,低DO环境并不能长期保持AOB的活性[22-23],因此为保障NH4+-N转化,需要增加曝气量使DO进一步提高,最终达到(1.45 ± 0.15) mg·L−1。在第58~68天,NH4+-N的转化率提高至(86.8 ± 4.5)%,NH4+-N去除负荷(ARR)达到0.35 ± 0.02 kg·(m3·d)−1;出水中TN低至(10.7 ± 2.4) mg·L−1、平均TN去除率为(78.9 ± 4.9)%、最高达84.0%,TN去除负荷达到0.38 kg·(m3·d)−1。Δ[NO3−-N]/Δ[NH4+-N]远低于0.11。这表明系统中AnAOB和反硝化菌能稳定共存并协同高效作用。值得注意的是,中高DO运行的MBBR不仅能保证较高的NH4+-N转化率,而且其中载体对AnAOB的有效持留和保护会使系统具有较强的抗冲击负荷能力,并稳定脱除主流厌氧消化出水中的氮。
-
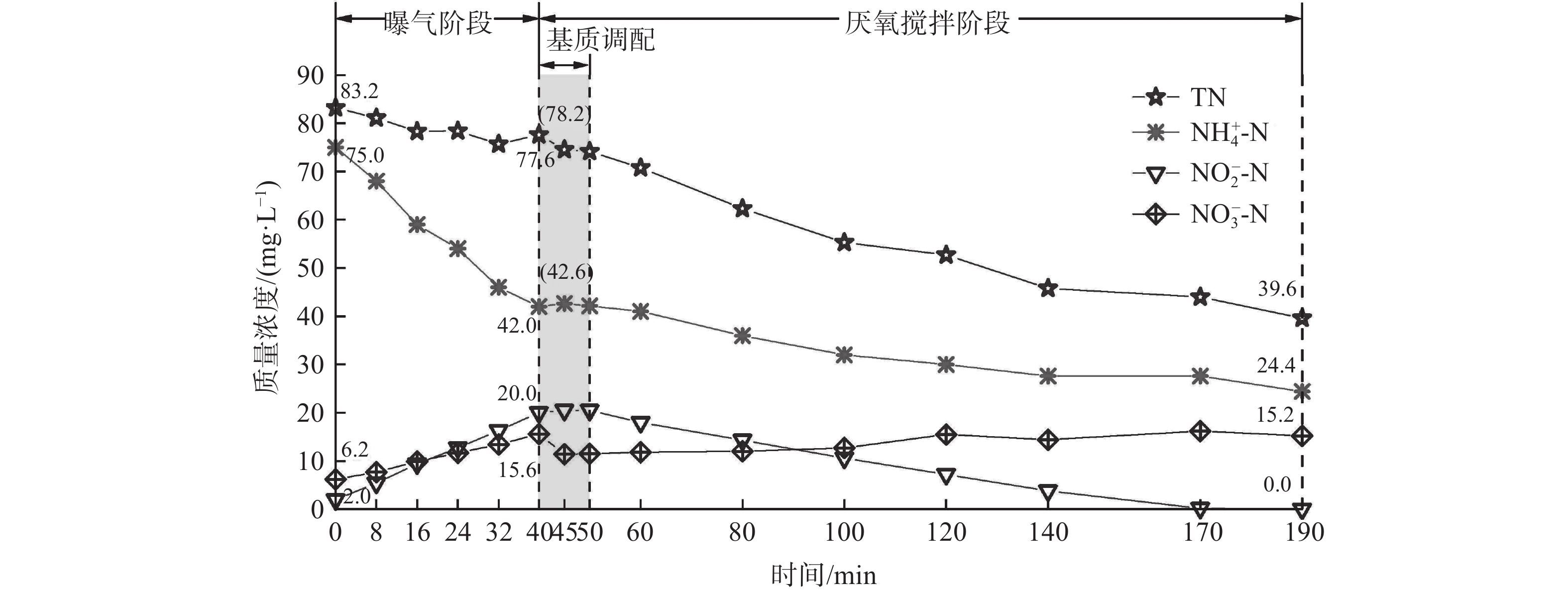
在MBBR运行第43 天开始进行全周期实验,以探究系统的氮去除过程及路径。整个过程中N的变化情况如图4所示。曝气阶段无有机碳源添加,故不考虑异养反硝化作用。在整个过程中,[NH4+-N]降低33.0 mg·L−1,[NO2−-N]、[NO3−-N]分别增加18.0 mg·L−1、9.4 mg·L−1,因此,系统的脱氮效率为6.7%,全部来源于厌氧氨氧化过程。再由化学计量关系分析系统内发生的短程硝化、硝化、厌氧氨氧化反应[24]。系列反应包括:部分NH4+-N发生PN反应转化为NO2−-N,剩余部分参与anammox反应生成NO3−-N;系统中的NO2−-N来自初始NO2−-N和PN过程,其部分参与anammox反应,而另一部分发生硝化反应转化为NO3−-N,剩余部分为残留。该过程中氮的转化关系参见式(1)~(3)。
式中:M1为PN消耗的NH4+-N;M2为anammox消耗的NH4+-N;M3为硝化消耗的NO2−-N。
以上计算结果表明:91.8% 的NH4+-N参与了PN过程、剩余8.2%参与了anammox反应;11.9% NO2−-N参与anammox反应、28.7%由NOB转化为NO3−-N,并积累59.4%为后续反应提供基质。这说明曝气阶段以PN反应为主,伴随少量anammox反应。
在厌氧搅拌开始的10 min内(40~50 min),逐步向反应器内加入共计160 mL人工合成城市污水,使得COD/NO3−-N为1.40~2.15。系统内主要发生的厌氧氨氧化、短程反硝化和/或反硝化反应有:NH4+-N全部参与anammox反应,故anammox过程的脱氮量为((1+1.32-0.26)×Δ[NH4+-N]);NO2−-N来自初始NO2−-N及PD过程,亦有部分参与了anammox反应,其余部分残留;NO3−-N来自初始NO3−-N及anammox反应,亦有部分发生PD和/或反硝化作用,其余部分残留。该过程中氮的转化关系参见式(4)~(7)。
式中:M4为anammox消耗的NH4+-N;M5为PD生成的NO2−-N;M6为反硝化消耗的NO3−-N。
当反应结束时,Δ[NO2−-N]/Δ[NH4+-N]为1.10,低于理论值1.32,这说明有的NO2−-N((1.32−1.10)×Δ[NH4+-N])来源于短程反硝化,计算结果表明,消耗的NO3−-N中有78.4%被还原为NO2−-N,而剩余21.6%被还原为N2。据报道,COD/NO3−-N低于2.5有利于实现更高的NO2−-N积累[25],这与本研究的结论相同。厌氧搅拌阶段anammox的脱氮贡献率为97.1%,而反硝化的脱氮贡献率为2.9%。这表明通过外加碳源提供有机物后,诱导反硝化菌主要发生短程反硝化反应,仅存在少量反硝化脱氮过程,其主要原因有:1)根据反应过程的吉布斯自由能[26],NO3−-N还原为NO2−-N较NO2−-N还原为N2更容易发生,而且由于反硝化还原酶的差异性,NO2−-N的还原速率比NO3−-N更低[27],适当的反应时间可引起NO2−-N的积累;2)有研究表明[27],反硝化菌对电子受体的利用存在选择性,即在相同条件下会优先选择NO3−-N而产生NO2−-N累积,在少量NO3−-N且碳源充足时才会利用NO2−-N。
综上所述,系统脱氮贡献主要来源于anammox反应。本研究通过调控使短程反硝化在系统脱氮过程中承担重要角色,可在降低出水[NO3−-N]的同时为anammox基质的获取提供途径。这两种作用相互协同,可实现低C/N条件下系统的稳定高效脱氮。
-
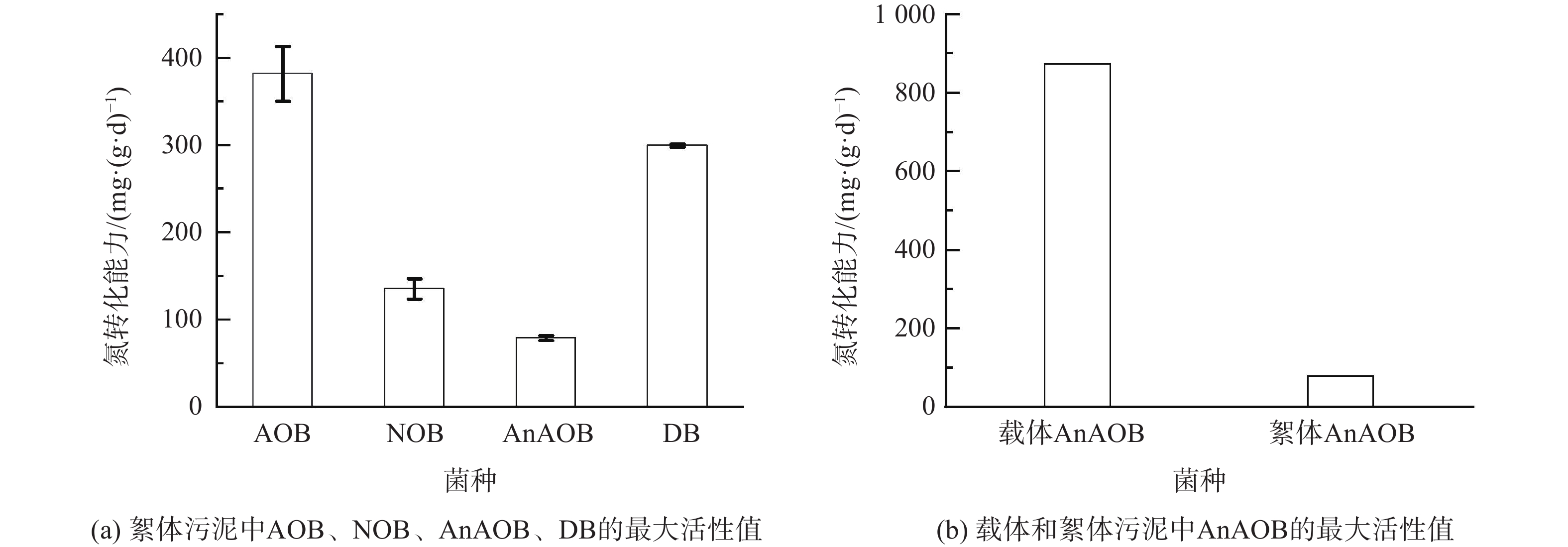
在MBBR脱氮效率持续提升的阶段(第50 天之后),反应器内絮体污泥MLVSS为1.44 g·L−1,此时测定相关功能菌群AOB、NOB、AnAOB和DB的最大活性值。如图5(a)所示,絮体污泥中AOB和NOB的活性(以每克MLVSS中的N计)分别为(381.6 ± 31.8) mg·(g·d)−1和(135.0 ± 11.7) mg·(g·d)−1,且DB的短程反硝化活性可达(299.3±1.7) mg·(g·d)−1。这表明AOB和DB可为anammox反应提供稳定充足的底物NO2−-N,以保证耦合系统持续实现NH4+-N和NO3−-N的同步去除。如图5(b)所示,载体和絮体中AnAOB的活性分别为873.9 mg·(g·d)−1和79.0 mg·(g·d)−1,这说明载体上已有效富集了AnAOB。
-
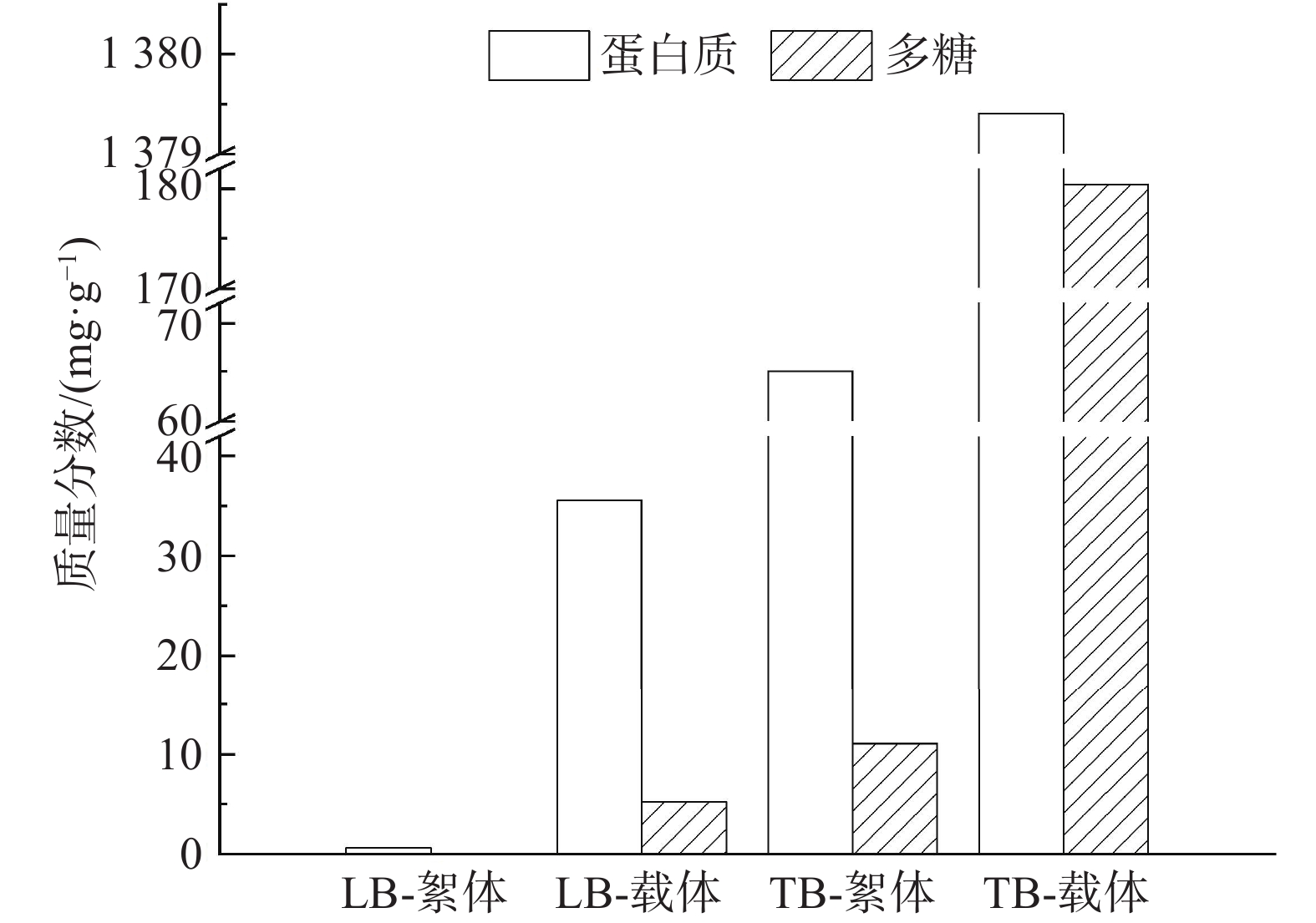
EPS是微生物生长代谢分泌的一类高分子聚合物,主要具有物质能量交换、自我保护和相互黏附的作用,能促进聚集体的形成和沉降,是生物膜的主要成分,对微生物的持留有重要意义。EPS分为松散结合型EPS(LB-EPS)和紧密结合型EPS(TB-EPS)。LB-EPS通常存在于外层,而TB-EPS在内层[28]。在MBBR运行的第50 天测定EPS中蛋白质(污泥形成的骨架)和多糖(促使污泥形成稳定结构)的含量,结果如图6所示。TB-载体、TB-絮体的含量(以每克MLVSS中的质量计)分别为1 554.4 mg·g−1、76.1 mg·g−1,分别占总EPS的97.4%和99.2%。这表明TB-EPS是EPS的主要成分,使得污泥结构紧凑。TB-载体上蛋白质的质量分数(1 374.3 mg·g−1)是TB-絮体的21倍,有利于加强微生物的黏附使其聚集到载体表面形成生物膜;多糖的质量分数(180.4 mg·g−1)是絮体的16倍,则有利于生物膜的结构稳定。
-
AnAOB是一种富含血红素的菌群,具有鲜明的外观特征。在MBBR系统中,载体形貌如图7(a)所示。随着系统的长期稳定运行,载体颜色逐渐变红,载体上AnAOB的荧光信号如图7(b)所示。这表明载体可为AnAOB提供受保护的附着表面,AnAOB在载体上以生物膜的形式得到有效富集和保留,并在DO高达(1.45 ± 0.15)mg·L−1的系统中生长繁殖,使得系统具有一定的抗冲击能力。利用ImageJ软件计算絮体污泥中微生物的占比,AOB、AnAOB和NOB丰度分别占总菌的(38.7 ± 5.9)%、(29.0 ± 6.4)%、(7.8 ± 2.8)%。这说明NOB得到一定程度的抑制,且反应器内AOB和AnAOB为优势菌,可促进耦合系统的稳定脱氮。
-
1)一段式短程硝化-厌氧氨氧化耦合短程反硝化工艺处理主流厌氧消化出水实现了高效脱氮。
2)采用中高DO运行有利于长期保持AOB的活性,提高NH4+-N的转化率,且载体上的生物膜能有效持留和保护AnAOB,以避免持续中高DO冲击使AnAOB活性受到抑制。
3)低浓度有机物可通过促进短程反硝化产生NO2−-N,从而增加anammox反应的基质获取途径,同时减少NO3−-N的积累量,强化耦合系统的协同脱氮效果。
一段式短程反硝化耦合厌氧氨氧化工艺处理厌氧膜生物反应器出水
Treatment of effluent from anaerobic membrane bioreactor by one-stage partial denitrification coupled with an am mox
-
摘要: 采用移动床生物膜反应器,通过一段式短程硝化-厌氧氨氧化耦合短程反硝化工艺处理主流厌氧消化出水。在溶解氧浓度(DO)维持在(1.45 ± 0.15)mg·L−1的条件下,出水TN低至(10.7 ± 2.4)mg·L−1、
${{\rm{NH}}_4^{+}} $ -N转化率达到(86.8 ± 4.5)%,平均TN去除率为(78.9 ± 4.9)% (最高达84.0%)、TN去除负荷为0.38 kg·(m3·d)−1。分析氮的去除路径表明,低浓度有机物诱导反硝化菌主要发生短程反硝化,耦合系统脱氮贡献主要来源于厌氧氨氧化。在载体上,生物膜实现了厌氧氨氧化菌的有效富集,其中菌的活性为873.9 mg·(g·d)−1;而氨氧化细菌主要存在于絮体污泥中,占总菌比例为(38.7 ± 5.9)%;亚硝酸盐氧化细菌则仅占(7.8 ± 2.8)%,说明其受到一定程度抑制。本研究结果可为anammox在主流厌氧消化出水深度处理中的应用提供参考。Abstract: In this study, the mainstream anaerobic digestion effluent was treated through integrated partial denitrification with one-stage partial nitrification-anaerobic ammonium oxidation in a moving-bed biofilm reactor. When the concentration of dissolved oxygen (DO) remained at (1.45 ± 0.15) mg·L-1, the total nitrogen (TN) concentration in the effluent was as low as (10.7 ± 2.4) mg·L-1, and the NH4+-N conversion rate reached (86.8 ± 4.5) %. The average TN removal efficiency reached (86.8 ± 4.5)% (up to 84.0%), and the TN removal load was 0.38 kg·(m3·d)-1. Nitrogen removal pathway analysis revealed that partial denitrification was induced by the low organic concentration, and nitrogen removal of coupling system was mainly contributed by anaerobic ammonium oxidation. The biofilm could effectively enrich anammox bacteria on the carrier, and the activity of the bacteria was 873.9 mg·(g·d)-1, while ammonia-oxidizing bacteria mainly existed in sludge flocs, accounting for (38.7 ± 5.9)% of the total bacteria. Nitrite oxidizing bacteria (NOB) only accounted for (7.8 ± 2.8)%, indicating that they were suppressed in the system. The results of this study can provide a reference for the application of anammox in mainstream anaerobic digestion effluent treatment. -

-
表 1 反应器运行工况
Table 1. Operational conditions of the reactor
运行阶段 时间/d 进水基质 调配策略 NH4+-N/
(mg·L−1)COD/
(mg·L−1)HRT/h 运行模式 Ⅰ 1~20 人工合成氨氮废水 — 200 — 6 进水10 min、曝气30 min、
厌氧搅拌10 min、沉淀30 min、出水10 minⅠ 21~33 人工合成氨氮废水 — 100 — 6 Ⅱ 34~53 人工合成氨氮废水 外加碳源 100 19.6~34.8 6 进水20 min、曝气40 min、厌氧
搅拌150 min、沉淀30 min、出水30 minⅡ 54~68 主流厌氧消化出水 外加碳源 51.0 ± 2.3 34.8~58.0 3 进水15 min、曝气20 min、
厌氧搅拌55min、沉淀30 min、出水15 min -
[1] 王庆. 中国污水处理概念厂探索展望[N]. 中国建设报, 2014-01-17(007). [2] CHEN C, LIU Z W, HUANG X. Anaerobic Membrane Bioreactors for Sustainable and Energy-efficient Municipal Wastewater Treatment. //Current Developments in Biotechnology and Bioengineering[M].Netherland: Elsevier, 2020: 335-366. [3] RONG C, LUO Z B, WANG T J, et al. Chemical oxygen demand and nitrogen transformation in a large pilot-scale plant with a combined submerged anaerobic membrane bioreactor and one-stage partial nitritation-anammox for treating mainstream wastewater at 25 °C[J]. Bioresource Technology, 2021, 341: 125840. doi: 10.1016/j.biortech.2021.125840 [4] CHEN H, HU H Y, CHEN Q Q, et al. Successful start-up of the anammox process: Influence of the seeding strategy on performance and granule properties[J]. Bioresource Technology, 2016, 211: 594-602. doi: 10.1016/j.biortech.2016.03.139 [5] MCCARTY P L. What is the best biological process for nitrogen removal: When and why?[J]. Environmental Science & Technology, 2018, 52(7): 3835-3841. [6] NIKOLAEV Y, KALLISTOVA A, KEVBRINA M, et al. Novel design and optimisation of a nitritation/anammox set-up for ammonium removal from filtrate of digested sludge[J]. Environmental Technology, 2018, 39(5): 593-606. doi: 10.1080/09593330.2017.1308442 [7] HUANG X W, MI W K, ITO H, et al. Unclassified Anammox bacterium responds to robust nitrogen removal in a sequencing batch reactor fed with landfill leachate[J]. Bioresource Technology, 2020, 316: 123959. doi: 10.1016/j.biortech.2020.123959 [8] VAN LOOSDRECHT MCM, BRDJANOVIC D. Anticipating the next century of wastewater treatment[J]. Science, 2014, 344(6191): 1452-1453. doi: 10.1126/science.1255183 [9] AGRAWAL S, SEUNTJENS D, DE COCKER P, et al. Success of mainstream partial nitritation/anammox demands integration of engineering, microbiome and modeling insights[J]. Current Opinion in Biotechnology, 2018, 50: 214-221. doi: 10.1016/j.copbio.2018.01.013 [10] CHEN R, TAKEMURA Y, LIU Y, et al. Using partial nitrification and anammox to remove nitrogen from low-strength wastewater by co-immobilizing biofilm inside a moving bed bioreactor[J]. ACS Sustainable Chemistry & Engineering, 2019, 7(1): 1353-1361. [11] LI J W, PENG Y Z, ZHANG L, et al. Quantify the contribution of anammox for enhanced nitrogen removal through metagenomic analysis and mass balance in an anoxic moving bed biofilm reactor[J]. Water Research, 2019, 160: 178-187. [12] WANG S P, LIU Y, NIU Q G, et al. Nitrogen removal performance and loading capacity of a novel single-stage nitritation-anammox system with syntrophic micro-granules[J]. Bioresource Technology, 2017, 236: 119-128. doi: 10.1016/j.biortech.2017.03.164 [13] LEI Z, YANG S M, WANG L X, et al. Achieving successive methanation and low-carbon denitrogenation by a novel three-stage process for energy-efficient wastewater treatment[J]. Journal of Cleaner Production, 2020, 276(5): 124245. [14] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. [15] 王刚. 基于同时亚硝化/厌氧氨氧化/反硝化(SNAD)技术的污泥消化液脱氮工艺研究[D]. 大连: 大连理工大学, 2017. [16] WANG J, LEI Z, WANG L X, et al. Insight into using up-flow anaerobic sludge blanket-anammox to remove nitrogen from an anaerobic membrane reactor during mainstream wastewater treatment[J]. Bioresource Technology, 2020, 314: 123710. doi: 10.1016/j.biortech.2020.123710 [17] CHEN R, JI J Y, CHEN Y J, et al. Successful operation performance and syntrophic micro-granule in partial nitritation and anammox reactor treating low-strength ammonia wastewater[J]. Water Research, 2019, 155: 288-299. doi: 10.1016/j.watres.2019.02.041 [18] HE S L, YANG W, QIN M, et al. Performance and microbial community of anammox in presence of micro-molecule carbon source[J]. Chemosphere, 2018, 205: 545-552. doi: 10.1016/j.chemosphere.2018.04.136 [19] LI X J, KLAUS S, BOTT C, et al. Status, Challenges, and Perspectives of Mainstream Nitritation-Anammox for Wastewater Treatment[J]. Water Environment Research, 2018, 90(7): 634-649. doi: 10.2175/106143017X15131012153112 [20] 付昆明, 周厚田, 苏雪莹, 等. 生物膜短程硝化系统的恢复及其转化为CANON工艺的过程[J]. 环境科学, 2017, 38(4): 1536-1543. [21] 杜睿, 彭永臻. 城市污水生物脱氮技术变革: 厌氧氨氧化的研究与实践新进展[J]. 中国科学: 技术科学, 2022,52(3): 389-402. [22] WANG F, XU S H, LIU L J, et al. One-stage partial nitrification and anammox process in a sequencing batch biofilm reactor: Start-up, nitrogen removal performance and bacterial community dynamics in response to temperature[J]. Science of the Total Environment, 2021, 772: 145529. doi: 10.1016/j.scitotenv.2021.145529 [23] LEI Z, WANG L X, WANG J, et al. Partial-nitritation of low-strength anaerobic effluent: A moderate-high dissolved oxygen concentration facilitates ammonia-oxidizing bacteria disinhibition and nitrite-oxidizing bacteria suppression[J]. Science of the Total Environment, 2021, 770: 145337. doi: 10.1016/j.scitotenv.2021.145337 [24] YANG X H, JIA Z W, FU J W, et al. Achieving Single-Stage Partial Nitritation and Anammox (PN/A) Using a Submerged Dynamic Membrane Sequencing Batch Reactor (DM-SBR)[J]. Water Environment Research, 2021, 93(5): 762-773. doi: 10.1002/wer.1468 [25] GONG L X, HUO M X, YANG Q, et al. Performance of heterotrophic partial denitrification under feast-famine condition of electron donor: A case study using acetate as external carbon source[J]. Bioresource Technology, 2013, 133: 263-269. doi: 10.1016/j.biortech.2012.12.108 [26] RITTMANN B E, MCCARTY P L. Environmental Biotechnology: principles and applications [M]. Beijing: Tsinghua University Press, 2002: 59-135. [27] DU R, PENG Y Z, CAO S B, et al. Mechanisms and microbial structure of partial denitrification with high nitrite accumulation[J]. Applied Microbiology and Biotechnology, 2016, 100(4): 2011-2021. doi: 10.1007/s00253-015-7052-9 [28] YANG X T, ZHOU J H, HUO T R, et al. Metabolic insights into the enhanced nitrogen removal of anammox by montmorillonite at reduced temperature[J]. Chemical Engineering Journal, 2020, 410: 128290. -




 下载:
下载: