-
近年来,随着环保督察力度的加大,许多传统养殖区域被划入生态红线范围。有调查[1]发现,90%以上的尾水净化塘没有尾水处理设施,难以实现达标排放,处理并削减水产养殖尾水中过量的氮、磷、有机物等污染物对环境及养殖本身造成的影响日益受到关注[2]。水产养殖尾水的处理方法主要包括物理法(曝气法、过滤法、泡沫分离技术等)、化学法(絮凝沉降、臭氧法等)和生物法(微生物处理、微藻处理、水生动植物调控等)[3-4]。目前,已有一些研究者开展了组合处理方法对养殖尾水处理效果的实验研究。刘梅等[5]采用“三池两坝”多级组合处理工艺处理3种养殖品种对应的养殖尾水,结果表明水质净化效果明显,达到排放要求;LI等[6]构建的三级净化塘对尾水中化学需氧量、总氮和总磷的去除率高达74.4%~91.2%、66.9%~86.8%和76.2%~95.9%。然而却鲜有针对组合尾水处理工艺构建水生态系统模型的研究。虽然集装箱水产养殖系统已经在近3年连续被评为了“农业农村部十项重大引领性农业技术”,但在养殖过程中仍暴露出以下2个方面的问题:一是氮磷荷载过大,尾水净化塘建成初期,脱氮除磷率低,不利于养殖对象正常生长,也不能满足养殖尾水排放要求;二是大型浮游动物对藻类的捕食作用抑制了有益藻类的生长。针对以上2个问题,本研究构建串联的三级尾水净化塘AQUATOX模型,通过情景分析模拟池塘生态演变过程,探究生物处理技术在尾水净化塘中的应用。
水生态模型的构建综合考虑了自然界中多因素的相互作用和时空变化,耦合了水质、水生生物、点面源污染及其他因素,能较好地模拟生态系统各组分之间的关系。目前,常用的淡水生态模型主要包括Ecopath with Ecosim(EWE)模型[7]、CE-QUAL-W2模型[8]、WASP模型[9]、AQUATOX模型[10]等,这些模型在湖泊、河流、池塘等多种水生态系统中得到广泛应用,但对串联式的养殖尾水净化塘的模拟研究较少。
AQUATOX模型能够模拟化学物质在水生态系统中的归宿及其对生物的影响,可利用连接模块构建模型[11],适用于构建串联的三级尾水净化塘水生态系统模型。本研究基于新建的集装箱养殖系统,运用AQUATOX模型构建串联的水生态系统,利用中试实验基地实测数据对模型参数进行了率定和验证;将模型进行6个月的模拟预测,探究尾水净化塘水质及水生生物的演变过程;通过2种情景模拟,分析生物处理技术对尾水净化塘中污染物去除率及水生态系统组成的影响,探究生物处理技术在尾水净化塘的利用途径。本研究结果可为管理者调整集装箱式循环水养殖模式的喂养结构提供借鉴,为提高尾水净化塘生态净化能力和推广生物处理技术净化水产养殖尾水的养殖模式提供参考。
-
1)养殖概况。中试实验场地位于广东省广州市农业技术推广中心(113.28°E,23.13°N)。集装箱循环水养殖系统于2019-09-08开始施工,2019-11-04和2019-11-05放苗。第1茬大口黑鲈(Micropterus salmoides)鱼苗的养殖周期为2019-11-05—2020-04-16。集装箱中放苗总计约11 939尾,每条鱼起始质量约为100 g,到2020-04-16,每条质量约为489.57g,日均增加2.39 g。到2020-01-13,累计死亡1 066尾,成活率为89.29%。投料34包,总质量为668.45 kg。每日投饵率约为0.49%,每天投喂1次。
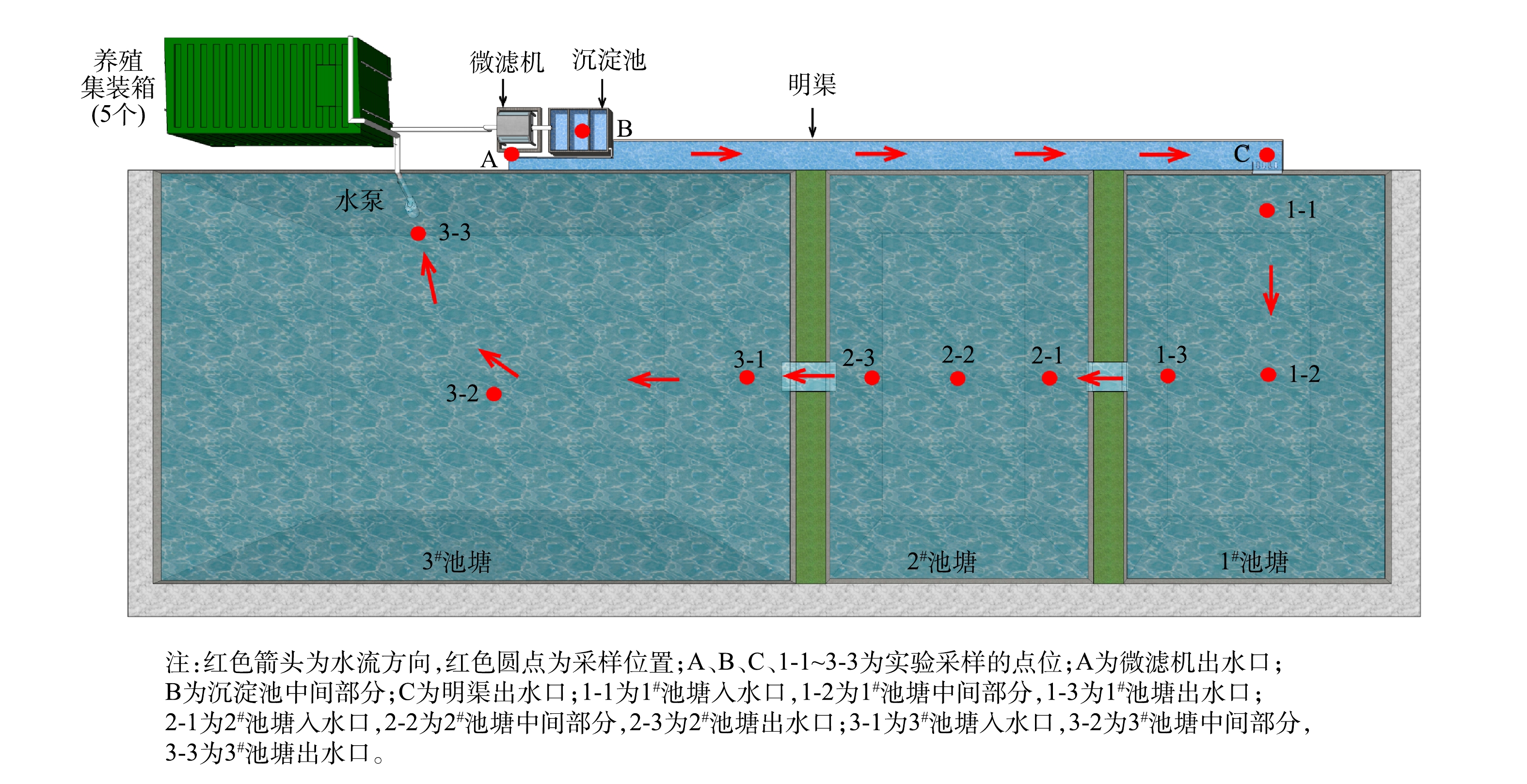
2)养殖系统组成。集装箱式水产养殖系统由集装箱养殖区、微滤机、沉淀池、明渠、三级尾水净化塘和水泵组成。养殖尾水从集装箱进入微滤机后,可以分离约90%的固体废弃物,废弃物进入沉淀池。而过滤后的养殖尾水通过明渠流入三级尾水生态池塘,尾水经生态池塘净化后,返回集装箱,实现养殖水体循环利用。
3)指标测定。实验日期为2019-12-03—2020-01-13,每次实验周期为7 d。实验期间,日均光照强度为1.92~6.47 kWh·(m2·d)−1,风速为0.38~2.84 m·s−1,气温为15~20 ℃。净化塘水体交换流量为50 m3·h−1。现场测定水质理化指标。水质物理指标包括溶解氧(DO)、水温(T)、pH和电导率(EC);水质化学指标包括氨氮(NH4+)、亚硝酸盐(NO2−)、硝酸盐(NO3−)、正磷酸盐(PO43−)、总有机碳(TOC)、总氮(TN)、总磷(TP)。水质物理指标使用便携式水质物理指标监测仪器现场测定,水质化学指标参照《水和废水监测分析方法(第4版)》中的方法进行测定。水质指标的监测及采样位置见图1。监测及采样位置包括点位A、B、C及点位1-1~3-3,共12个点位。实验场地物理特征参数如表1所示。
-
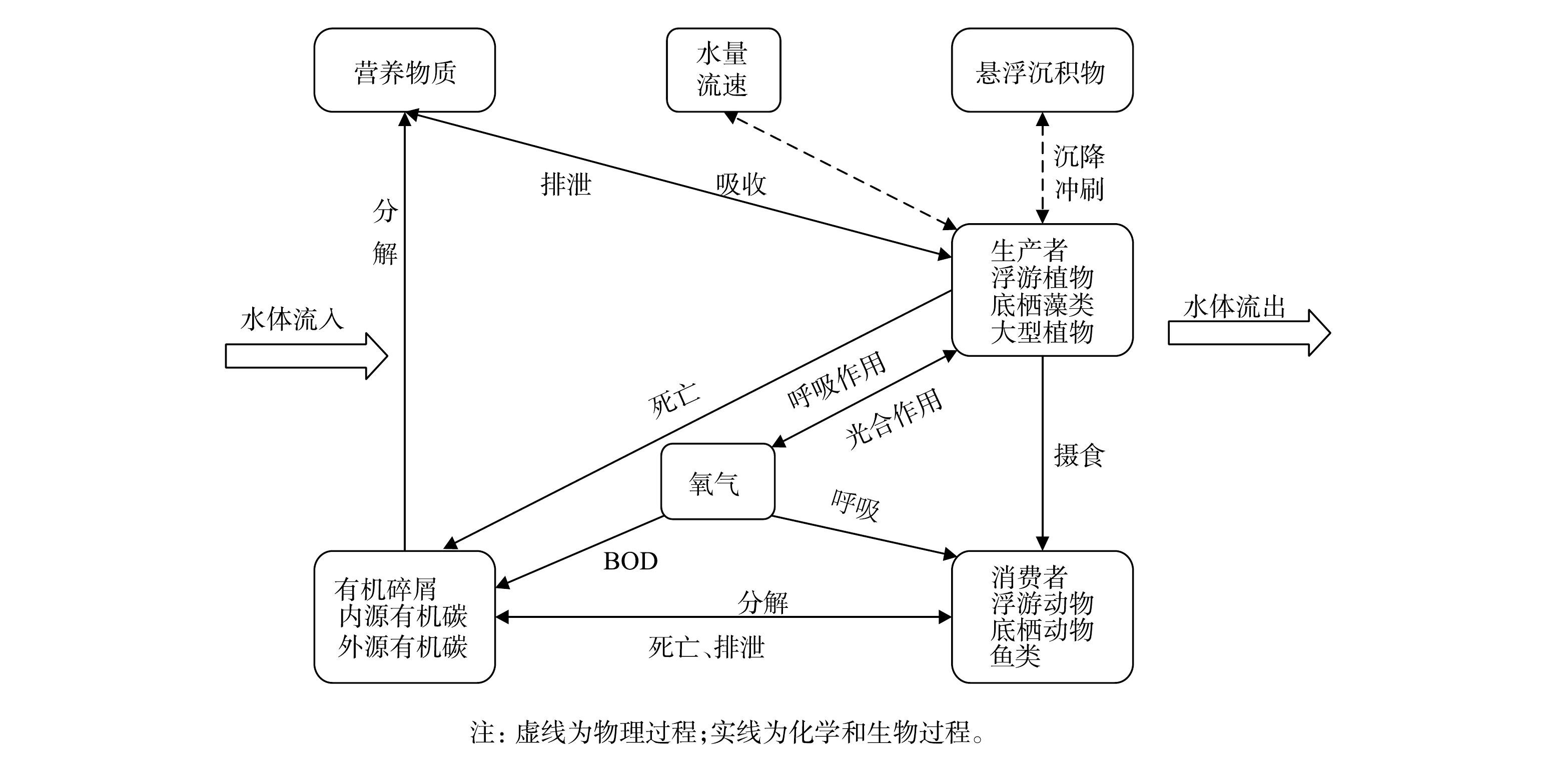
AQUATOX模型是美国环境保护局(EPA)开发的一种水生态系统模型,可通过同时计算模型模拟时段中每天或每小时所进行的重要的物理、化学和生物过程来模拟化学物质(营养盐、有机化学物质等)、生物量在水生态系统中的变化过程,构建水质-水生生物响应的关系[12-13]。其基本原理如图2所示。
本研究采用AQUATOX模型对三级尾水净化塘分别建模,再利用模型自带的模块连接功能(linked segments)连接成串联的三级尾水净化塘水生态模型。尾水净化塘的场地物理特征参数如表1所示。模型模拟日期为2019-12-03至2020-01-13,模拟时间步长为1 d。模型选用的状态变量(溶解氧、营养物质、生物组分等)及驱动变量(温度、光照、风速、pH、进出流量等)共计21个[12]。光照、气温、风速均采用实测的长时间序列数据。
浮游植物生物量根据流式细胞仪计数结果及镜检结果,采用经验公式[10]计算获得;浮游动物及底栖动物生物量参考广州地区养殖池塘生物量的研究统计[14-15]获得。模型模拟生物的初始生物量为硅藻0.92 mg·L−1、绿藻3.08 mg·L−1、蓝藻0.1 mg·L−1、轮虫7.00 mg·L−1、桡足类0.82 mg·L−1、摇蚊2.06 mg·m−2和正颤蚓0.36 mg·m−2,营养相互作用关系参考AQUATOX模型内置数据库中的数据(表2)。
-
图表的绘制使用Origin 2021,数据分析采用SPSS 26。正态分布检验结果表明,模拟结果不服从正态分布,采用Spearman非参数相关分析计算指标秩相关系数。
-
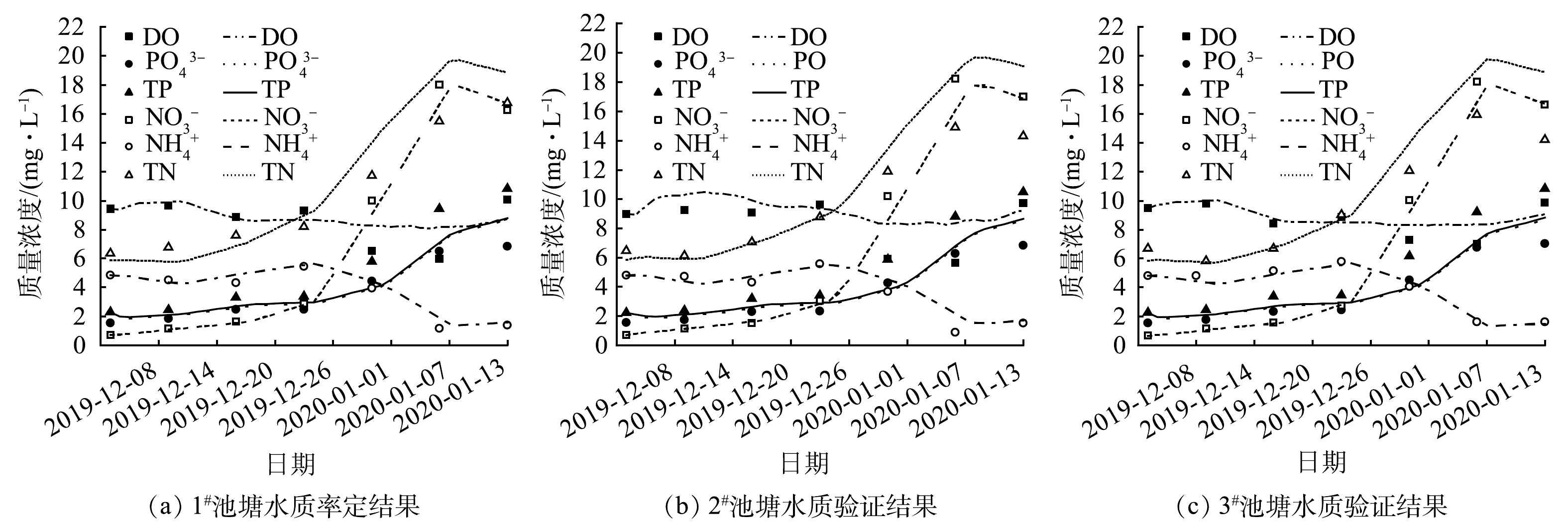
模型参数的设定参考已有研究中的方法[16-17]。在该模型中,1#池塘的数据用于矿化参数、浮游藻类参数、浮游动物和底栖动物参数的率定,使用2#池塘和3#池塘的数据进行验证。一些重要参数率定结果见表3~表5,模型率定结果如图3(a)所示,模型的验证结果如图3(b)和图3(c)所示。
使用均方根误差(RMSE)、平均相对误差(MRE)和建模效率(EF)[18]评估模型的拟合优度(表6)。对比结果表明,除TP质量浓度模拟值比实测值整体偏小外,其他指标都与实测值较为符合,模拟值与实测值的MRE为4.98% ~ 23.37%。
-
基于以上构建的AQUATOX尾水净化塘水生态系统模型,将2020-01-14—06-03作为模型的预测阶段,预测模型的总计算时间为6个月,为2019-12-03—2020-06-03。模拟阶段物理特征及入流边界条件不变,气象数据采用模型默认的年平均气象数据,营养输入负荷数据的输入日期为2019-12-03—2020-01-13,数据值与率定验证数据相同。
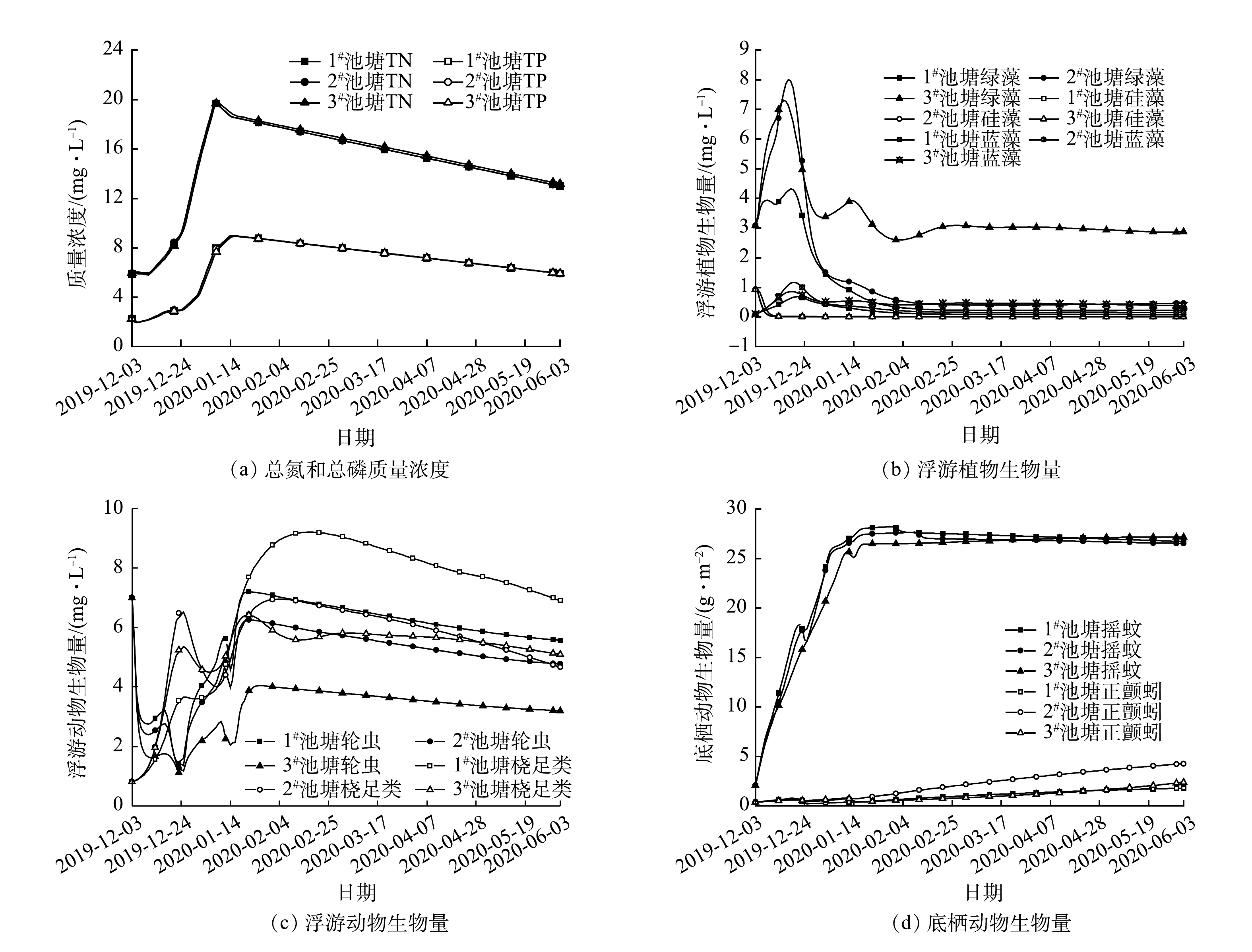
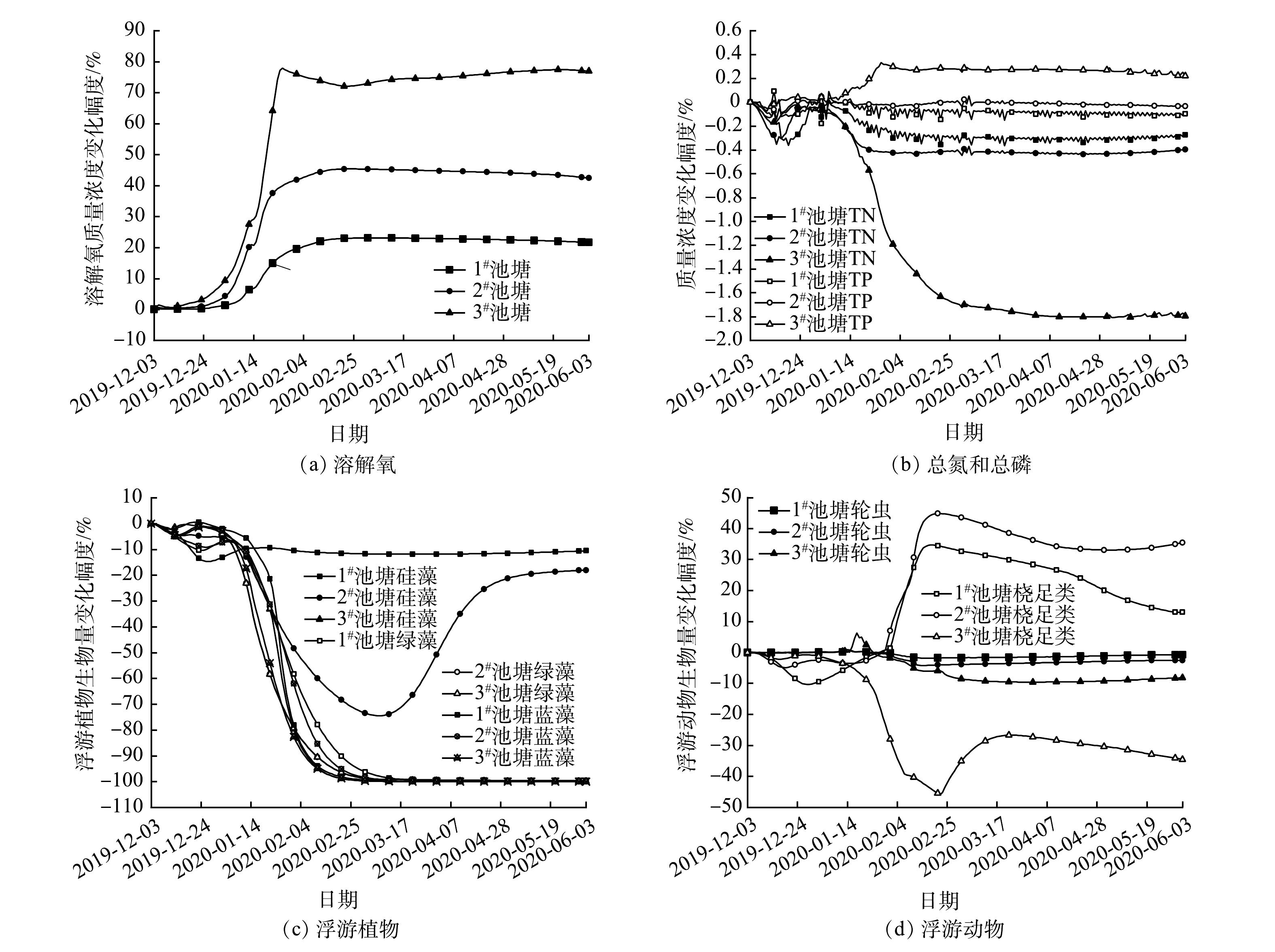
模拟预测阶段尾水净化塘中总氮和总磷的变化趋势如图4(a)所示。3个尾水净化塘中总氮质量浓度在2020-01-07—09达到最大值,分别为19.70、19.68和19.69 mg·L−1;在2020-06-03分别降至12.98、12.99和13.16 mg·L−1,降幅约为34%。总磷质量浓度的最大值出现在2020-01-15—16,分别为8.99、8.98和8.92 mg·L−1,此后下降至5.91 mg·L−1,降幅约为35%,但是整体依旧处于较高水平。
模拟预测阶段尾水净化塘中浮游植物生物量的变化情况如图4(b)所示。硅藻的生物量在初期迅速下降至0.01 mg·L−1以下,并在整个预测阶段一直保持在接近0的水平;绿藻和蓝藻的生物量在预测阶段较为稳定,但在3#池塘中两者的生物量都远高于1#池塘和2#池塘。绿藻的生物量在3个池塘分别保持在0.22、0.45和2.85 mg·L−1,蓝藻的生物量在3个池塘分别保持在0.08、0.15和0.40 mg·L−1。
模拟预测阶段尾水净化塘中浮游动物和底栖动物生物量的变化情况如图4(c)和图4(d)所示。轮虫生物量呈现先下降再上升再下降的趋势,桡足类生物量总体呈上升趋势,轮虫和桡足类在1#池塘中的生物量略高于2#池塘和3#池塘。轮虫的生物量在2020-06-03分别为5.57、4.77和3.20 mg·L−1,相比于初始生物量降低了20.41%~50.23%;桡足类的生物量分别为6.90、4.67和5.11 mg·L−1,相比于初始生物量增长了469.41%~742.02%。摇蚊和正颤蚓生物量快速增长,摇蚊的生物量从初期2.06 mg·m−2增至27.17~28.22 mg·m−2,在2020-01-20以后一直保持该生物量水平;2#池塘中正颤蚓的生物量增长速度高于其他池塘,3个池塘中正颤蚓的生物量从初期0.36 mg·m−2分别增至1.78、4.25和2.38 mg·m−2。
-
针对集装箱运行过程中暴露出的2大问题,本研究采用添加沉水植物和低密度滤食性鱼类2种生物处理技术对尾水净化塘进行情景分析,以寻求提高尾水净化塘处理效率和改善生态系统的措施。当前,添加沉水植物和添加滤食性鱼类被普遍应用于富营养化和污水处理中[19-21]。本研究选取水藓和鳙作为模拟对象,探究生物处理技术在养殖尾水净化塘中的应用。
1) 添加水藓的尾水生态净化结果。水藓具有较强的有机和无机化学物质的元素积聚能力[22]。向模型中添加5 g·m−2水藓(干质量)。水藓的饱和光强为0.47 kWh·(m2·d)−1,光呼吸速率为0.027 g·(g·d) −1,20 ℃呼吸速率为0.002 g·(g·d) −1,最适温度为15 ℃,最大光合速率为0.19 d−1,死亡系数为0.000 1 g·(g·d) −1。比较加入水藓前后溶解氧、总氮和总磷质量浓度变化、藻类生物量和浮游动物生物量的变化,结果如图5所示。
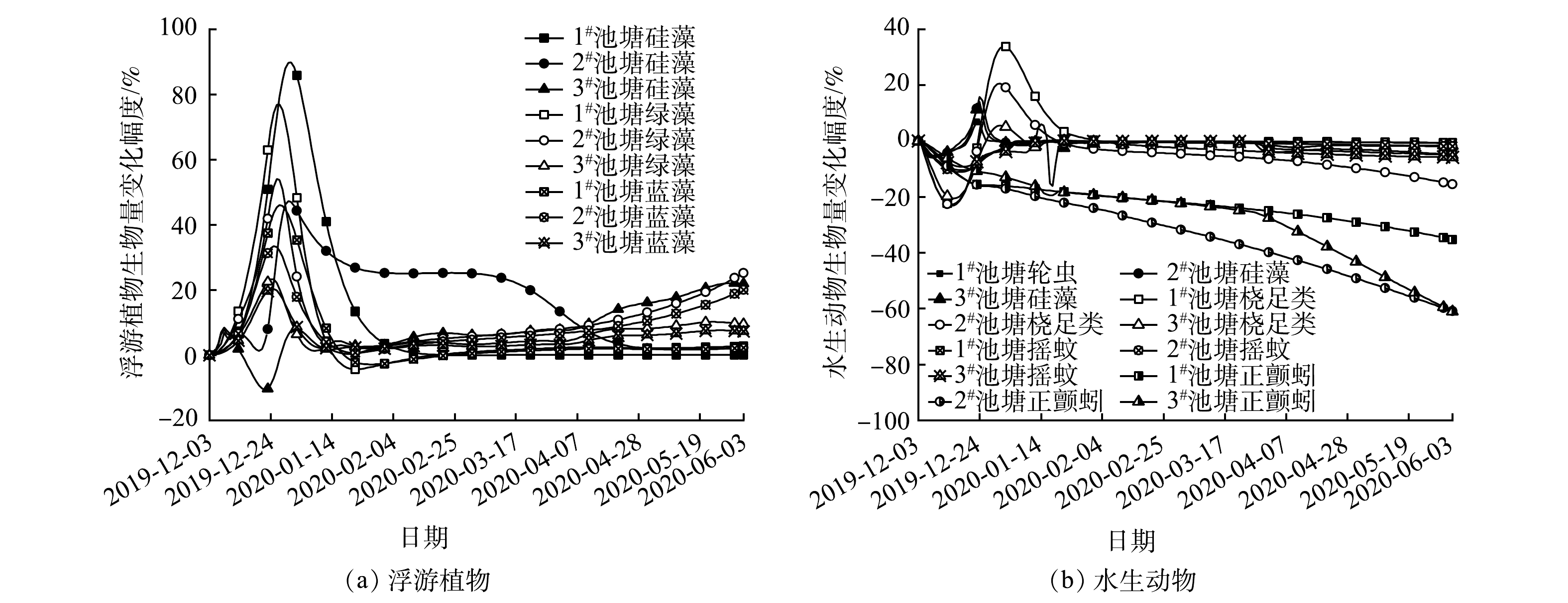
添加水藓对养殖水质最主要的影响是提高了水体中溶解氧质量浓度,溶解氧的增幅在2020-01-20前随时间逐渐增大,3个池塘变化最大值分别为23.11%、45.39%和77.90%。添加水藓可以降低生态池塘中总氮的质量浓度,但最大降幅仅为1.81%,出现在3#池塘;未能降低水体中总磷的质量浓度,这可能与水藓生物量较少和浮游植物生物量减少有关。
添加水藓不利于藻类生物量的增加。添加水藓后,3个池塘中藻类的生物量都呈现明显下降。硅藻的下降幅度最大值分别为−14.68%、−74.43%和−99.99%,绿藻的下降幅度最大值分别为−99.74%、−99.99%和−99.99%,蓝藻的下降幅度最大值分别为−99.50%、−99.99%和−99.99%。添加水藓后3#池塘中桡足类生物量相比于未添加水藓的情况显著下降,而1#池塘和2#池塘中桡足类生物量在2020-01-29以前略微下降,之后显著上升。1#池塘、2#池塘和3#池塘中桡足类生物量变化幅度最大值分别为34.69%、44.84%和−45.99%。
2) 添加鳙的养殖尾水生态净化结果。因为浮游动物摄食藻类,导致集装箱循环水养殖系统中藻类生物量较低,因此加鳙控制浮游动物数量,以维持需要的较高的藻类生物量从而对水体复氧增氧有利[20, 23]。模拟时分别往3个生态池塘中添加20 g·m−2鳙(干质量),鳙的半饱和喂养参数为0.5 mg·L−1,最大消费率为0.037 g·(g·d) −1,最小生物量为0.25 g·m−2,最适温度为27 ℃,呼吸速率为0.05 d −1,配子死亡率为0.9 d −1,死亡系数为0.000 05 d −1,平均生命周期为1 460 d −1,平均湿质量为50 g。3个生态池塘加入鳙前后的总氮和总磷质量浓度、藻类生物量和水生动物生物量差异如图6所示。
添加鳙不会降低尾水净化塘水体的总氮和总磷质量浓度,反而可能因为引入鳙,水体中的鱼类排泄物增加,导致水体氮磷质量浓度上升[21]。添加鳙有利于浮游植物生物量增长,3个生态池塘中硅藻生物量的最大增幅为89.80%、47.22%和22.06%,绿藻生物量的最大增幅为76.95%、54.05%和23.29%,蓝藻生物量的最大增幅为45.99%、33.37%和20.30%。添加鳙对池塘水生动物生物量变化影响如图6(b)表示。添加鳙有利于抑制正颤蚓生物量,3个池塘中正颤蚓生物量的最大降幅分别为−35.29%、−60.97%和−61.03%,轮虫生物量最大降幅分别为−5.29%、−5.99%和−16.11%,桡足类生物量的最大降幅分别为−22.71%、−23.09%和−20.64%,摇蚊生物量的最大降幅分别为−10.53%、−11.08%和−9.26%。
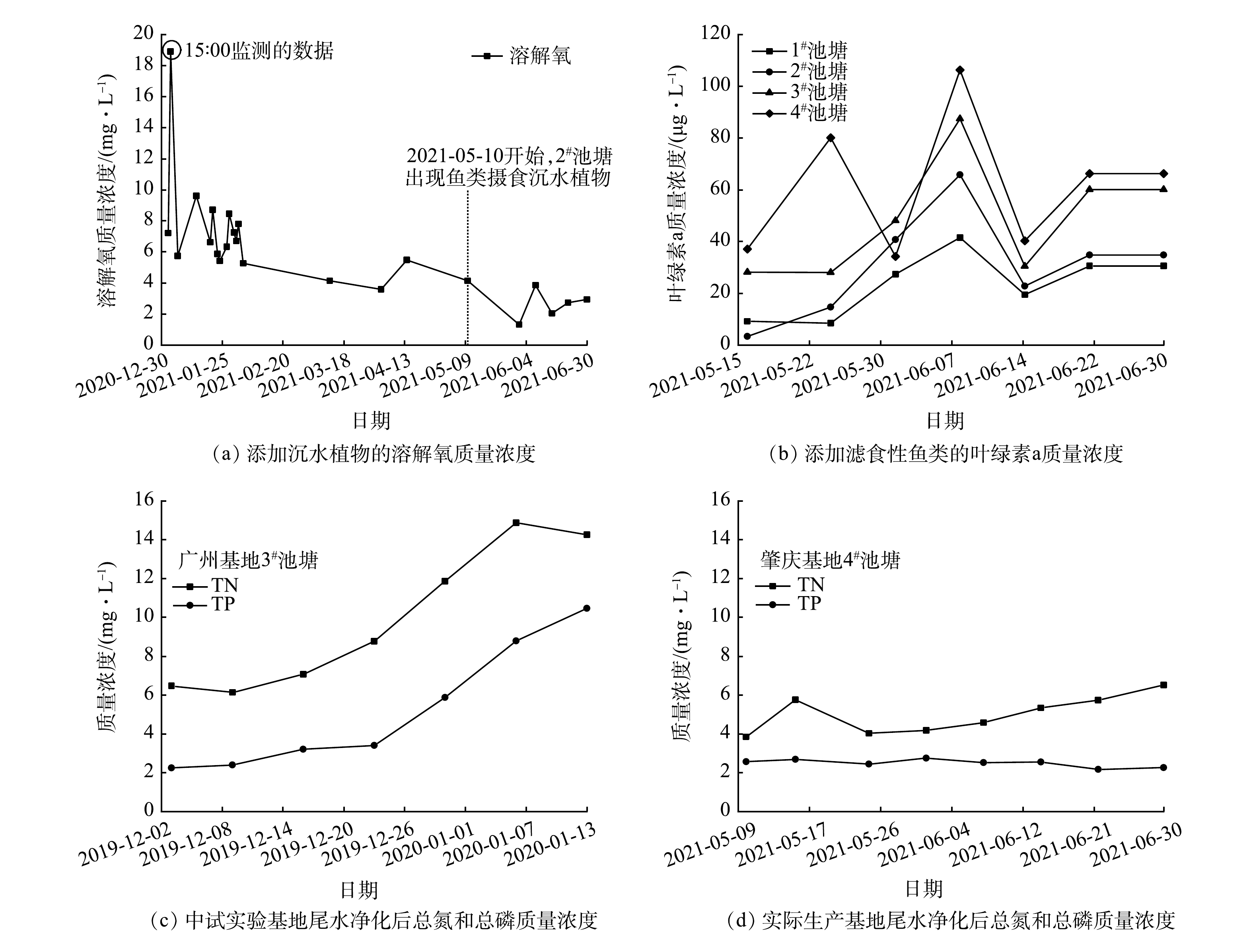
为了佐证以上情景模拟所得结论,将添加沉水植物和滤食性鱼类推广至实际生产基地。实际生产基地位于广东省肇庆市,在2021-05-10前,尾水净化塘无滤食性鱼类,有沉水植物。在实际生产基地,对有沉水植物时溶解氧质量浓度进行现场监测。同时,在加入滤食性鱼类后,对叶绿素a、总氮和总磷质的量浓度进行现场监测。监测结果表明:有沉水植物时,池塘溶解氧质量浓度维持在(7.24±3.40) mg·L−1(平均值±标准差);随着沉水植物生物量的逐渐减少(从2021-05-10开始),溶解氧质量浓度呈下降趋势(图7(a));有滤食性鱼类后,叶绿素a质量浓度维持在较高水平,为(41.28 ± 24.78) μg·L−1(平均值±标准差)(图7(b));实际生产基地净化后的养殖尾水的总氮和总磷质量浓度比中试实验基地小(图7(c)和图7(d))。
-
在持续6个月的养殖运行过程中,新建的尾水净化塘内菌群逐渐形成和稳定下来,系统对养殖废水中氮、磷的净化处理能力增强,总氮和总磷质量浓度呈现先上升后缓慢下降的趋势。养殖水体及底泥中充足的营养碎屑是浮游动物和底栖动物生长的基础,前期硅藻、绿藻和蓝藻受到浮游动物捕食的影响,生物量较低,后期由于光照、气温等条件的改善,藻类光合作用增强,绿藻和蓝藻的生物量水平基本稳定,绿藻成为池塘的优势藻种。Spearman非参数相关分析表明,硅藻与总氮和总磷的秩相关系数小于-0.705,显著性Sig.<0.01,呈显著负相关;绿藻与总氮和总磷的秩相关系数小于-0.372,Sig.<0.01,呈显著负相关。这说明当绿藻和硅藻生物量增大时,氮、磷质量浓度降低,绿藻和硅藻能够去除水体中一定数量的氮、磷营养盐。
浮游动物生物量的变化受pH和非离子氨质量浓度影响明显。非参数相关分析也表明,轮虫与pH的秩相关系数为-0.355,Sig.<0.01,二者呈显著负相关。净化塘中pH较高,导致水体非离子氨质量浓度较高,增大了对浮游动物的毒害作用,导致轮虫和桡足类死亡率较高[24-25]。鱼类的养殖场所转移到集装箱中,浮游动物食物来源减少,底栖动物捕食者减少,因此,轮虫和桡足类的生物量变化较小,摇蚊和正颤蚓的生物量得以快速增长,从而提高了底泥中营养碎屑的处理效率。根据模型预测结果,当外界条件不变化的情况下,池塘从建设初期生态系统不稳定的“生塘”向生态系统稳定、处理效率提高的“熟塘”的转变,能够为管理者调整喂养结构提供借鉴与帮助。
-
生物处理技术对池塘复氧、抑制浮游动物生长或促进浮游植物生物量增长具有一定作用。水藓常在改善富营养化湖泊、河流等的生态系统中用于抑制浮游植物生长、为浮游动物提供庇护场所[26-27],但对尾水净化塘富营养化净化效果并不明显。在提升水质方面,添加水藓的作用主要表现为提升水体中的氧含量,水藓与溶解氧的秩相关系数为0.579,Sig.<0.01,二者呈显著正相关。但水藓脱氮除磷的效果不明显,其与总磷没有相关性,Sig.>0.05,与总氮的秩相关系数为-0.175,Sig.<0.01,呈显著负相关,但相关性较弱。可能的原因是水藓抑制了藻类的生长,导致磷的吸收转化量减少,但水藓本身对氮的吸收转化能力比对磷的强[28],因此,其脱氮效果比除磷效果好。
水藓通过营养盐竞争与化感作用抑制了浮游植物生长。非参数相关分析表明,水藓与浮游藻类生物量的秩相关系数为-0.933,Sig.<0.01,二者呈显著负相关。种植水藓会降低水中的透光量,导致浮游植物光合作用速率下降,不利于浮游植物的生长[21, 29]。浮游植物生物量下降对3#池塘中的浮游动物生长形成抑制,但1#池塘和2#池塘中的桡足类由于食物结构相比于轮虫较为复杂,因此,在2020-01-31后,生物量可以增大。综上所述,有2种情形适合在生态系统中培植水藓:一是在浮游植物生物量过高、需要控制浮游植物生物量的区域可适量种植水藓;二是在有复氧需求的区域,可种植适量水藓,增强该处的复氧能力。
鳙是我国的“四大家鱼”之一,具有较好的经济效益,常与鲢鱼搭配作为防控水体“水华”的生态治理措施。但也有研究[30]表明,低密度鳙鱼可以控制水体大型浮游动物。在尾水净化塘中添加鳙,对桡足类、摇蚊和正颤蚓生物量的控制效果较为明显。模拟初期,由于水体的pH变化较大,增大了鳙的死亡率,因此,在该阶段,轮虫和桡足类的生物量有较大的增幅,后期由于养殖水体水质条件较为稳定,添加鳙能较好地降低浮游动物生物量。鳙滤食水体中悬浮物质,使底栖动物食物来源减少,因而抑制了底栖动物生物量增长。鳙与底栖动物摇蚊的秩相关系数为-0.678,Sig.<0.01,呈显著负相关。生态池塘中藻类生物量较低,投放鳙在一定程度上减缓了浮游动物对藻类的消耗,抑制了浮游动物过快生长,有利于池塘生态系统之间的稳定平衡,从而提升水质观感[31]。但也有研究[20, 30]表明,鳙对浮游植物的控制效果与鳙的密度、水体营养程度、浮游植物组成等有关。因此,要使滤食性鱼类达到对水生态的调控效果,掌握鱼类调控密度的阈值、理解调控机理至关重要。
-
1) 利用AQUATOX构建的串联的三级尾水净化塘水生态系统模型,水质模拟效果较好,且6项水质指标的误差均在合理范围内,较准确地反映了池塘水质变化的实际情况。将AQUATOX模型运用于构建串联池塘生态系统具有实际操作的可行性。
2) 尾水净化塘系统经过6个月的发展与演化,从建设初期生态系统不稳定的“生塘”向生态系统稳定、污染物处理效率提高“熟塘”转化,生态系统结构逐步完善,管理者可根据尾水净化塘污染物处理效率调整喂养结构。经过6个月的运行,系统脱氮除磷率可高达34%,同时维持绿藻生物量在0.22~2.85 mg·L−1,蓝藻生物量在0.08~0.40 mg·L−1,硅藻生物量低于0.01 mg·L−1;水生动物中除轮虫生物量略微下降外,桡足类、摇蚊和正颤蚓的生物量均显著增加。
3) 对尾水净化塘的水质调控措施表明:添加沉水植物水藓对废水中过高的氮、磷去除效果不明显,也将导致藻类生物量迅速下降,但可以有效提高水体中溶解氧质量浓度,3个池塘变化率最大值分别为23.11%、45.39%和77.90%。添加沉水植物适用于有复氧需求的水体。添加低密度的滤食性鱼类鳙对水体氮磷质量浓度没有明显影响,但是鳙通过对水生动物的捕食与食物竞争,可减少浮游植物的被捕食损失,促进浮游植物增长,3个生态池塘中硅藻生物量的最大增幅为89.80%、47.22%和22.06%,绿藻生物量的最大增幅为76.95%、54.05%和23.29%,蓝藻生物量的最大增幅为45.99%、33.37%和20.30%。生物处理技术适用于集装箱式循环水养殖模式的尾水生态处理,有利于水生态组分功能的恢复和平衡。
基于AQUATOX模型的集装箱养殖尾水净化塘生态系统模拟及调控预测
Simulation and regulation prediction of container aquaculture wastewater-ponds ecosystem based on AQUATOX model
-
摘要: 为解决传统养殖中养殖尾水的环境污染问题,促进池塘养殖可持续发展,基于新建的集装箱式循环水养殖系统,构建了三级养殖尾水净化塘水生态系统模型,对池塘水质、浮游植物及水生动物生物量以及池塘生态系统的演变进行了为期6个月的模拟预测,并设置添加沉水植物和添加低密度滤食性鱼类2种情景模拟。结果表明:水质模拟值的变化趋势与实测值基本一致,模拟值与实测值的平均相对误差为4.98% ~ 23.37%;模拟预测的设定条件下和模拟时段中,池塘生态系统的结构趋于稳定,形成以绿藻为主的藻类群落、以摇蚊和桡足类为主的水生动物群落;在尾水净化塘中,添加沉水植物对氮磷去除效果不明显,但对增加水体中溶解氧质量浓度作用明显,3个池塘溶解氧变化率最大值分别为23.11%、45.39%和77.90%;添加低密度滤食性鱼类有助于浮游植物的生长,3个池塘硅藻生物量的最大增幅为89.80%、47.22%和22.06%,绿藻生物量的最大增幅为76.95%、54.05%和23.29%,蓝藻生物量的最大增幅为45.99%、33.37%和20.30%。综上所述,基于AQUATOX构建串联的尾水净化塘水生态系统模型并模拟培植沉水植物和添加低密度滤食性鱼类的生物处理方法,不仅能够为管理者调整喂养结构提供借鉴与帮助,也可用于调控水生态系统组分,有利于水生态系统功能的恢复和平衡。本研究结果可为管理集装箱式循环水养殖模式的喂养结构、构建尾水净化塘生态系统、改进其他利用生物处理技术处理养殖尾水的养殖模式提供参考。Abstract: To solve the environmental pollution of wastewater in traditional aquaculture and promote the sustainable development of pond aquaculture, based on newly built container recirculating aquaculture system, the tertiary aquaculture wastewater-ponds ecosystem model was built, the evolution of wastewater quality, phytoplankton, aquatic animal biomass and pond ecosystem were simulated for 6 months, and the simulation of two scenarios of adding submerged plants and filter-feeding fish was set. The results showed that the trends of simulated values were basically consistent with that of the measured values, the average relative error between simulated and measured values ranged from 4.989% to 23.37%. Under the set conditions by simulation and in the prediction period, the structure of pond ecological system approached stable, the pond ecosystem formed an aquatic community dominated by green algae, chironomid and copepods. Adding submerged plants to the wastewater-purification-ponds had no obvious removal effect on nitrogen and phosphorus, while increased the concentration of dissolved oxygen in water, the maximum variation rates of the three ponds were 23.11%, 45.39% and 77.90%, respectively. Adding low-density filter feeding fish was beneficial to phytoplankton biomass growth, the maximum increase rates of diatom, green algae and cyanobacterial biomass in 3 ponds were 89.80% 47.22% and 22.06%, 76.95% 54.05% and 23.29%, 45.99% 33.37% and 20.30%, respectively. To sum up, AQUATOX was used to build the linked-ponds’ ecosystem model, and the model was used to simulate the biological treatment methods of adding submerged plants and low-density filter-feeding fish, which can not only provide reference and help for managers to adjust the feeding structure, but also be used to regulate the composition of aquatic ecosystems, it is conducive to the restoration and balance of aquatic ecosystem functions. The results of this research may provide an important reference for managing the feeding structure of container recirculating aquaculture system, constructing the restoration ecology of wastewater-ponds and improving other aquaculture models using biological treatment techniques.
-
Key words:
- AQUATOX model /
- aquaculture /
- wastewater treatment /
- biological treatment techniques
-
人工湿地(constructed wetlands,CWs)被认为是处理废水的低成本技术,其较低的建设和运营成本、便利的管理和高效的去除氮磷效率适合低浓度水平污染物的去除,能够较好地削减水体的污染物负荷,同时还具有良好的生态效应[1-2],已经广泛应用于污水处理。在人工湿地中,氮磷平衡是分析氮磷去除途径和评估各自去除贡献的常用方法[3]。人工湿地氮磷的去除途径主要是通过植物、基质和微生物的物理、化学和生物作用完成的[4]。WU等[5]发现,表面流人工湿地中植物同化吸收氮、磷的能力分别为8.46%~30.98%和0.46%~2.13%。LU等[6]指出,表面流人工湿地基质填料的吸附、截留、交换等作用去除水中磷的比例大约为26%。ZHANG等[7]发现,微生物的硝化反硝化作用是人工湿地去除废水中TN(66.9%~80.5%)的主要途径。
人工湿地植物不仅具有美学价值,还显示出对污染物的去除作用,它通过提供理想的附着位点来调节微生物群落,且根系分泌物可加速异养反硝化细菌的生长,增加微生物群落丰富度和多样性[8],有利于水中氮磷去除。DU等[9]发现,植物的种植增加了微生物的丰富度和生物多样性;同时,相关的反硝化属假单胞菌、不动杆菌、根瘤菌、芽孢杆菌和红假单胞菌丰度的增加,增强了微生物对氮的去除作用。HE等[10]发现,γ-变形菌、α-变形菌和β-变形菌是人工湿地基质中的主要细菌,并在减少硝酸盐和亚硝酸盐的功能上发挥了重要作用。DU等[11]发现,植物的种植改变了垂直流人工湿地微生物的组成,并指出假单胞菌属可能是微生物除磷吸附的主要参与者。但是,现有的研究缺少了人工湿地污染物去除途径和微生物群落相结合的分析,以及植物的种植对微生物群落以及微生物氮磷净化作用的影响分析。因此,为了系统地研究人工湿地净化机制和人工湿地处理效果与微生物群落之间的关系,采用5种人工湿地系统种植不同植被用于处理低浓度污水,通过人工湿地的氮磷平衡和高通量测序相结合的手段,研究种植不同植物的人工湿地系统氮磷净化效果差异、污染物的去除途径以及微生物群落的变化,并探讨了植物的种植对微生物群落和微生物氮磷净化作用的影响,以期为提高人工湿地对污水的净化效果提供参考。
1. 材料与方法
1.1 人工湿地装置与运行
人工湿地装置位于重庆大学校内,采用100 L的LLDPE桶(上口直径520 mm,下口直径430 mm,高度610 mm),湿地填料为沸石(粒径为2~5 mm),铺设高度为30 cm,湿地水深为20 cm。设置5组人工湿地实验,分别为无植物组(Ⅰ组)、黄菖蒲组(Ⅱ组)、水生美人蕉组(Ⅲ组)、梭鱼草组(Ⅳ组)和风车草组(Ⅴ组),植物的种植密度为30株·m-2,每组设置3个平行实验。
正式实验日期为2018-07-03—2018-09-30,水温维持在23.4~32.2 ℃。实验分为2个阶段:第1阶段(2018-07-03—2018-09-14),为低负荷阶段(COD=(45±5) mg·L−1、
NH+4 -N=(3.56±0.48) mg·L−1、TN=(5.18±0.30) mg·L−1、TP=(0.425±0.044) mg·L-1);第2阶段(2018-09-14—2018-09-30),为高负荷阶段(COD=(45±5) mg·L−1、NH+4 -N=(6.06±0.16) mg·L−1、TN=(8.15±0.18) mg·L−1、TP=(0.806±0.035) mg·L−1)。采用间歇性进水的方式,水力停留时间3 d后,收集水样用于后续的分析并排出湿地的污水,通入新配制的污水。实验中及时对实验植物进行维护,对死亡的植物用生长良好的备用植物替换。1.2 水质指标分析方法
在实验期间,每3 d对人工湿地的进、出水进行取样分析。其中,温度、pH、DO通过溶解氧仪(520M-01A,Thermo,USA)和pH计(8107UWMMD,Thermo,USA)测量。
NH+4 -N采用纳氏试剂分光光度法测定,TN采用过硫酸钾氧化-紫外分光光度法测定,TP采用钼酸铵分光光度法测定。1.3 基质和植物相关指标分析方法
在实验开始和结束阶段,采用梅花取样法分3层采样,然后将收集的各层基质混匀,采用H2SO4-H2O2溶液消解,采用半微量凯氏法测定全氮,用钼锑抗比色法测定全磷。在低负荷实验结束阶段,收集植物根系附近的基质样品,并置于无菌密封袋中,基质样品用于分析微生物群落结构,并储存在−80 ℃,直至DNA提取。在实验的开始和结束时测定湿地中植物的湿重,挑选代表性的植株样品在105 ℃下干燥10 min,以灭活植物中酶的活性,然后在70 ℃下干燥12 h,测定干重。将植物粉碎成粉末,混合均匀并密封保存,采用H2SO4-H2O2溶液消解,采用半微量凯氏法测定全氮,用钼锑抗比色法测定全磷。
1.4 高通量测序分析方法
通过OMEGA Soil DNA试剂盒提取根系基质样品中微生物DNA。使用通用细菌引物16S rRNA的5′-ACTCCTACGGGAGGCAGCAG-3′和5′-GGACTACHVGGGTWTCTAAT-3′(V3~V4区)对提取的DNA进行PCR扩增。PCR扩增条件:98 ℃(3 min)初始变性,然后进行25个循环,98 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,最后5 min延伸至72 ℃。将所有序列读数聚类到操作分类单位(OTU)(相似性阈值为97%)。高通量测序服务由上海美吉生物平台提供(上海,中国)。
1.5 人工湿地氮磷平衡计算方法
氮的去除是由植物吸收、基质吸附、微生物硝化-反硝化作用和NH3的挥发决定的,因为进水中氨氮相对较低并且pH为中性,NH3的挥发可忽略不计[12]。磷的去除由植物吸收、基质吸附和微生物作用决定。
基质总氮和总磷积累速率的计算见式(1)。
ηSR=(CSC1−CSC0)MSA−1t−1 (1) 式中:ηSR为基质的总氮和总磷积累速率,mg·(m2·d)−1;CSC0和CSC1为实验开始和结束时基质的总氮和总磷含量,mg·kg−1;MS为基质的质量,kg;A为湿地面积,m2;t为实验总运行时间,d。
植物总氮和总磷吸收速率的计算见式(2)。
ηPR=(CPC1M1,1−CPC0M1,0)A−1t−1 (2) 式中:ηPR为植物的总氮和总磷吸收速率,mg·(m2·d)−1;CPC0和CPC1为实验开始和结束时植物的总氮和总磷含量,mg·kg−1;M1,0和M1, 1为实验开始和结束时植物的干重,kg;A为湿地面积,m2;t为实验总运行时间,d。
微生物总氮和总磷去除速率的计算见式(3)。
ηMR=n∑i=1(Ci,0V−Ci,1V)A−1t−1−ηSR−ηPR (3) 式中:ηMR、ηSR和ηPR为微生物、基质和植物的总氮和总磷去除速率,mg·(m2·d)−1;Ci, 0和Ci, 1为每次进水和出水总氮和总磷浓度,mg·L−1;V为每次进水的水量,L;A为湿地面积,m2;t为实验总运行时间,d。
1.6 统计分析
用单因素方差分析(One-way ANOVA)进行差异性分析,检验数据间的差异性。用Pearson检验方法进行相关性分析,检验数据间的相关水平。所有统计分析均使用SPSS 22.0版软件进行,并且在P<0.05水平时被认为是显著的。
2. 结果与讨论
2.1 人工湿地对污水中氮磷的净化效果
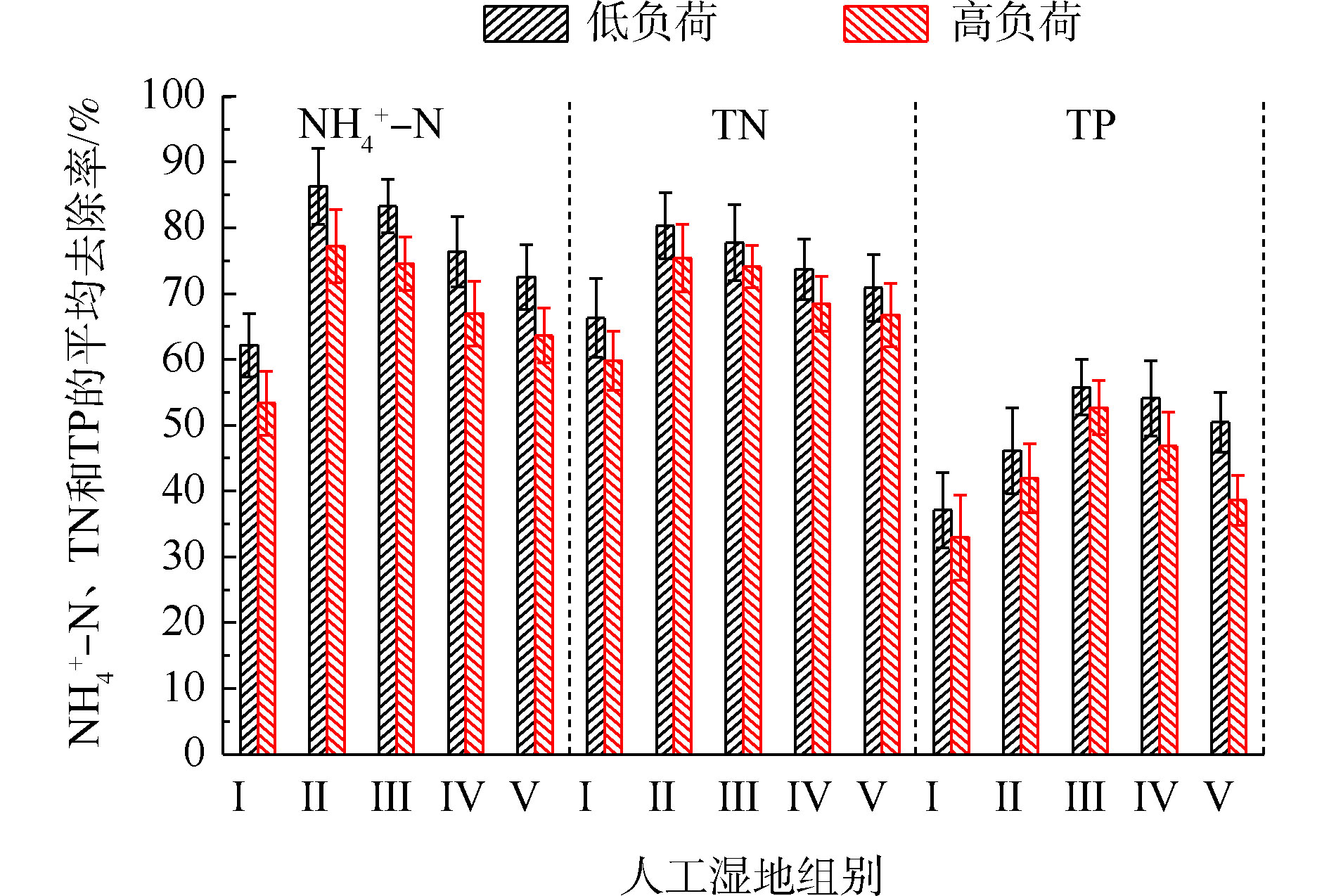
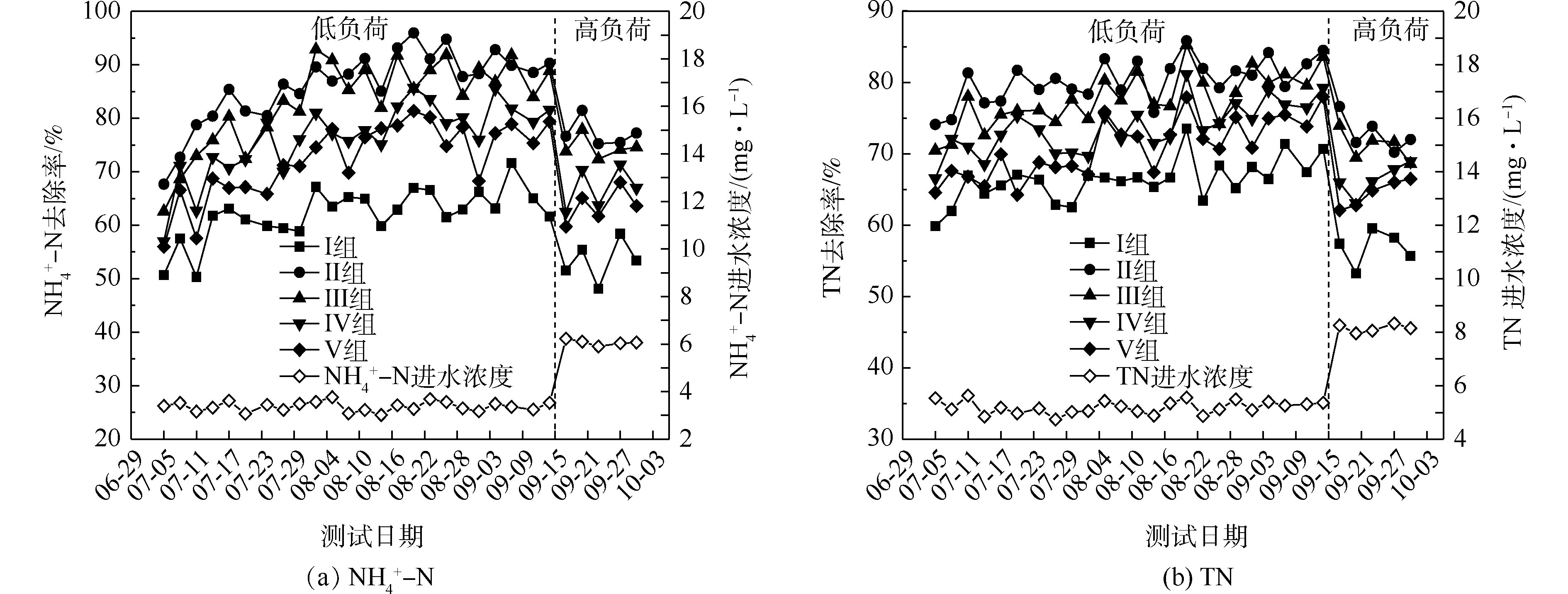
氮的去除率随取样时间的变化情况如图1所示。5组人工湿地系统都能有效地去除水中氨氮和总氮。在低负荷测试期间,
NH+4 -N的去除率为50%~94%,Ⅱ组(黄菖蒲)的去除率最高。如图2所示,Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组和Ⅴ组的平均去除率分别为62.16%、86.31%、83.28%、76.38%和72.51%。在低负荷测试期间,TN的去除率为59%~85%,Ⅱ组(黄菖蒲)表现出最高的去除性能。如图2所示,Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组和Ⅴ组的平均去除率分别为66.29%、80.30%、77.71%、73.68%和70.89%。夏季的人工湿地有高NH+4 -N和TN去除率,这与ZHANG等[13]的研究结论相似。在高负荷期间,各组NH+4 -N去除率均降低了9%~11%,TN去除率均降低了3%~8%,说明随着氮浓度的升高,氮的去除率会降低。NH+4 -N和TN表现出相似的去除趋势,这是因为NH+4 -N是进水中氮的主要来源,NH+4 -N经过硝化-反硝化作用去除,说明人工湿地有较强的反硝化作用。通过种植植物组与Ⅰ组比较发现,对NH+4 -N和TN去除有显著差异(P<0.05)。这是因为NH+4 -N容易被植物吸收和利用[14]以及植物的种植改变了基质微生物群落。磷的去除率随取样时间的变化情况如图3所示。5组人工湿地系统都能有效地去除水中总磷。在低负荷测试期间,TP的去除率为28%~73%,种植Ⅲ组(美人蕉)表现出最高的去除性能。如图2所示,Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组和Ⅴ组的平均去除率分别为37.09%、46.12%、55.77%、54.07%和50.45%。在高负荷期间,各组TP去除率均降低了3%~12%,说明随着TP浓度的升高,TP的去除率降低。通过种植植物组与Ⅰ组比较发现,TP的去除率显著提高(P<0.05)。这是因为植物生长过程中能吸收和利用磷酸盐,提高了TP的去除率[15]。
实验期间,进水和出水的pH、DO和水温T的平均值如表1所示。与进水DO相比,各组出水DO浓度都下降了1.80~2.64 mg·L−1。这是因为微生物去除COD和氨氧化过程中消耗了水体中的DO。另外,种植植物组比Ⅰ组DO要高,这是由于植物根系有泌氧功能,从而导致水体中DO浓度的增加。Pearson检验表明,DO与pH呈显著正相关(相关系数为0.923,P<0.05)。这是因为植物的光合作用会影响水体的碳酸电离平衡,导致氢氧根离子的浓度增加[16]。DO与
NH+4 -N去除率不存在相关性(P>0.05)。这可能与各组植物吸收作用和根系富集微生物群落不同有关。表 1 人工湿地进出水的参数Table 1. Characteristics of the influent and effluent in CWs组别 pH DO/(mg·L−1) 水温T/℃ 进水 7.73±0.25 5.12±1.22 27.63±2.31 Ⅰ组出水 7.11±0.31 2.48±0.32 27.42±2.68 Ⅱ组出水 7.22±0.13 2.74±0.45 27.11±2.12 Ⅲ组出水 7.29±0.23 2.93±0.34 26.66±2.78 Ⅳ组出水 7.36±0.18 3.32±0.51 26.87±2.43 Ⅴ组出水 7.33±0.29 3.12±0.41 27.23±2.92 2.2 人工湿地氮磷平衡分析
2.2.1 基质和植物的氮磷去除速率
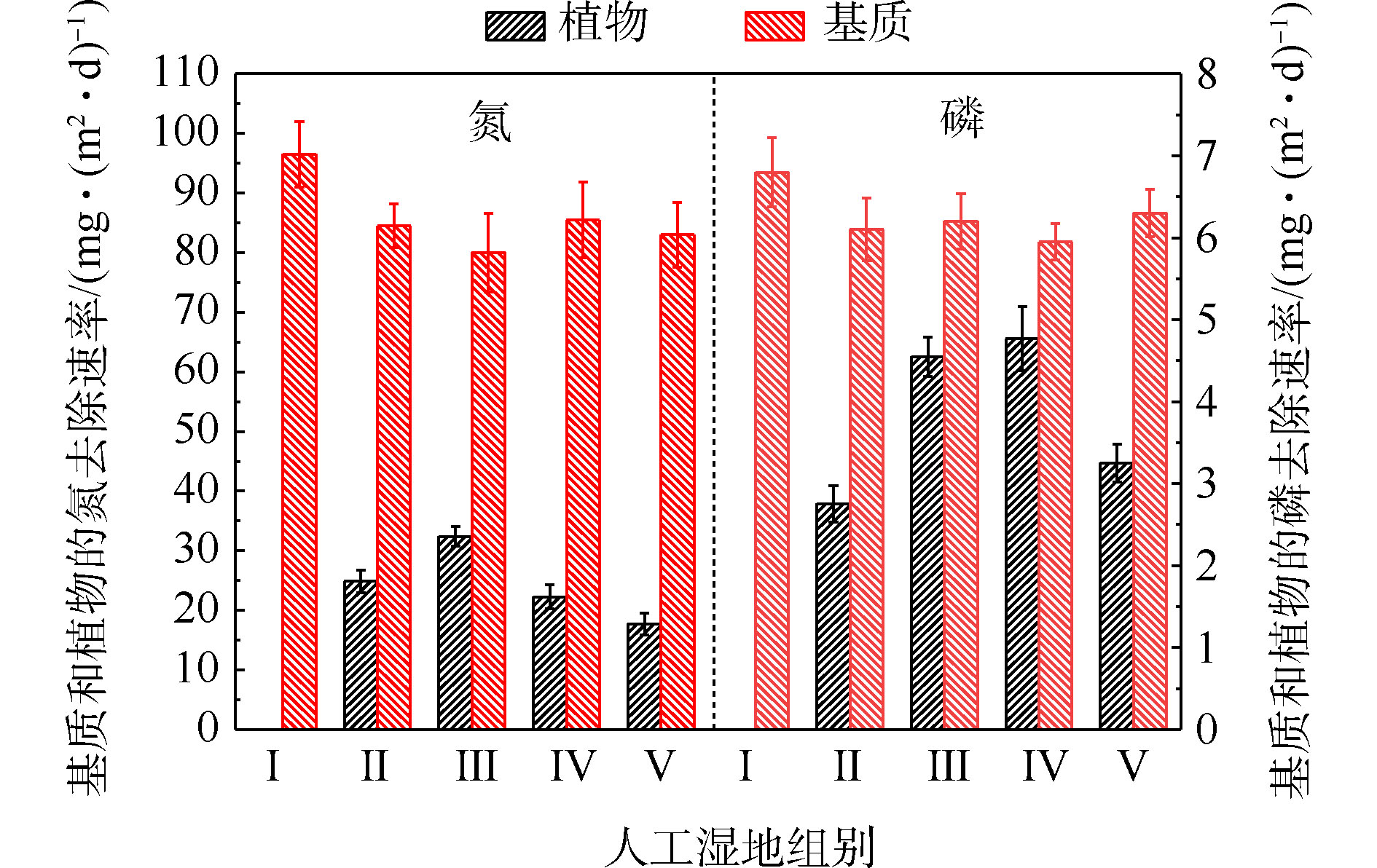
基质的氮磷平均积累速率如图4所示。由图4可知,Ⅱ组(84.46 mg·(m2·d)−1)、Ⅲ组(80.11 mg·(m2·d)−1)、Ⅳ组(85.53 mg·(m2·d)−1)和Ⅴ组(83.04 mg·(m2·d)−1)平均TN积累速率显著低于Ⅰ组(96.52 mg·(m2·d)−1)(P<0.05)。Ⅱ组(6.10 mg·(m2·d)−1)、Ⅲ组(6.21 mg·(m2·d)−1)、Ⅳ组(5.95 mg·(m2·d)−1)和Ⅴ组(6.42 mg·(m2·d)−1)平均TP积累速率低于Ⅰ组(6.81 mg·(m2·d)−1)( P <0.05)。这说明人工湿地中种植植物会降低基质中氮磷的积累速率,并与植物吸收和基质吸附2个氮磷积累过程存在竞争关系有关。种植植物组间的基质氮磷积累效果差异,与不同的植物具有不同生长状况有关[8]。
植物的氮磷平均吸收速率如图4所示。可以看出,平均氮吸收速率Ⅲ组(32.41 mg·(m2·d)−1)>Ⅱ组(24.87 mg·(m2·d)−1)>Ⅳ组(22.24 mg·(m2·d)−1)>Ⅴ组(17.73 mg·(m2·d)−1),平均磷吸收速率Ⅳ组(4.77 mg·(m2·d)−1)>Ⅲ组(4.55 mg·(m2·d)−1)>Ⅴ组(3.25 mg·(m2·d)−1)>Ⅱ组(2.75 mg·(m2·d)−1)。结果表明,水生美人蕉的氮吸收速率最高,梭鱼草的磷吸收速率最高。植物的氮磷平均吸收速率不同,与植物干重增加量、植物体内氮磷含量不同有关。
2.2.2 人工湿地氮磷平衡
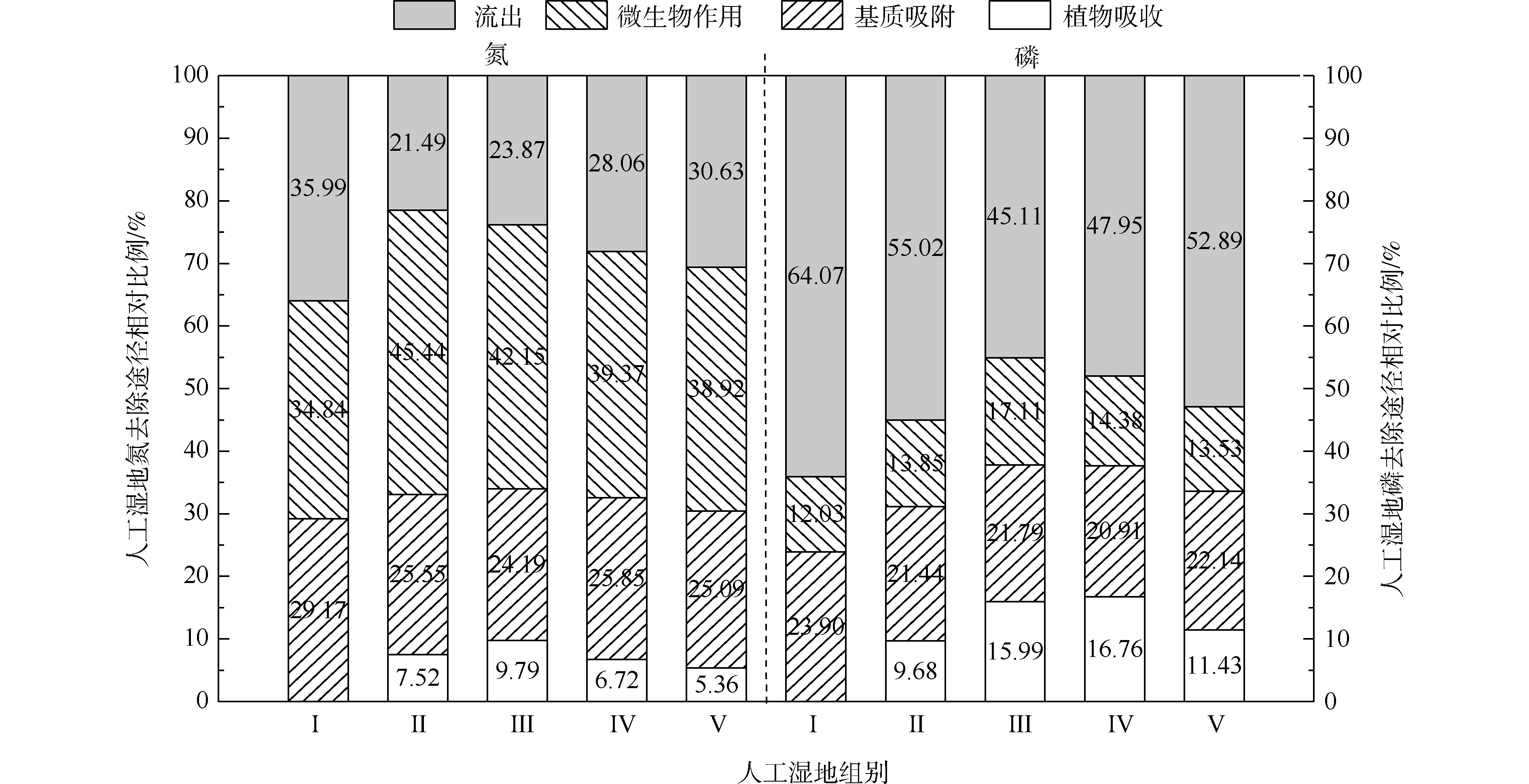
人工湿地水体氮磷的去除主要通过基质、植物、微生物和排水4种途径,各组人工湿地的基质、植物、微生物和排水的氮磷去除率占比如图5所示。在5个不同的实验组中,系统排水中的氮含量占总负荷的23.87%~35.99%,植物吸收的氮约占5.36%~9.79%,基质吸附氮约占24.19%~29.17%,系统微生物去除氮约占34.84%~45.44%。在氮的去除方面,微生物去除>基质吸附>植物吸收的作用。植物吸收氮仅占5.36%~9.79%,说明植物对水中氮直接吸收作用很小。郑于聪[17]研究了中试规模的人工湿地处理污水发现,植物对水中氮的去除贡献仅占5.80%~13.90%,即植物对污水中氮的去除贡献很小,与本实验的结果相似。微生物去除氮约占34.84%~45.44%,说明微生物作用是人工湿地氮去除的最主要的途径。通过与Ⅰ组比较,发现种植植物组微生物氮去除率明显增加(P<0.05)。这可能与植物根系分泌物能改善微生物生长环境,有利于反硝化微生物的附着生长有关。植物的种植不仅对氮有吸收作用(5.36%~9.79%),还增强了微生物对氮的去除作用(增加了4.08%~10.60%)。
在5个不同的实验组中,系统排水中的磷含量占总负荷的45.10%~64.07%,植物吸收的磷约占9.68%~16.76%,基质吸附磷约占20.91%~23.90%,系统微生物去除磷约占12.73%~17.11%。在磷的去除方面,排水中的磷含量达到45.10%~64.07%,说明人工湿地对总磷去除效果较差。这可能与TP浓度低和运行条件不利于人工湿地对其去除有关。基质吸附比植物吸收和微生物作用对磷去除作用强,说明了基质吸附是人工湿地中磷去除的主要途径。植物吸收磷仅占9.68%~16.76%,说明植物对水中磷直接吸收作用很小。吴海明[18]研究中试湿地处理污水发现,植物吸收的磷仅占湿地中磷总去除量的4.81%~22.23%。沈莹等[19]研究中试潜流湿地处理污染河水发现,植物的磷吸收量占湿地磷去除量的8.80%。以上研究均发现,植物对湿地中磷去除的贡献较小,与本实验有相似的结论。通过与Ⅰ组比较,种植植物组微生物磷去除率出现增加现象,Ⅲ组与各组有显著差异。这是因为植物根系分泌物的不同影响了基质中微生物群落分布[20]。植物的种植不仅对磷(9.68%~16.76%)有吸收作用,还增强了微生物对磷(增加了1.82%~5.08%)的去除作用。
2.3 人工湿地微生物群落分析
2.3.1 微生物序列和多样性分析
微生物多样性和丰富度如表2所示。各组湿地微生物测序中样本文库覆盖率(coverage)均大于0.98,说明测序结果可以很好地代表样本的真实情况[21]。Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组和Ⅴ组检测到的OTU数目分别为1 441、1 736、1 594、1 464和1 478,Ace分别为1 770.18、2 004.13、1 747.37、1 754.82和1 672.91,Chao分别为1 754.28、2 063.44、1 772.99、1 806.11和1 705.38,发现了Ⅱ组与其他组有明显差异(P<0.05),说明黄菖蒲的种植改善了微生物丰富度。Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组和Ⅴ组的Shannon指数为4.99、6.38、6.01、5.79和5.59,Simpson指数为0.024 5、0.003 3、0.006 7、0.011 0和0.020 8,植物组与Ⅰ组有明显差异(P<0.05)。其中Ⅱ组和Ⅲ组的多样性最高,说明种植植物能有效地改善群落多样性。植物种植改善了微生物群落多样性和丰富度,这与植物根系泌氧和根系分泌的碳源有利于微生物富集生长有关[22]。另外,通过逐步线性回归分析发现,Shannon和Sobs决定系数分别为0.828和0.208(P<0.05)。说明微生物丰富度和多样性的改善有利于微生物对氮的去除作用。
表 2 人工湿地微生物多样性和丰富度Table 2. Microbial diversity and richness in samples of CWs组别 测序数量/个 多样性指数 丰富度指数 覆盖率 Shannon Simpson Sobs Ace Chao Ⅰ 37 707 4.99 0.024 5 1 441 1 770.18 1 754.28 0.985 Ⅱ 42 513 6.38 0.003 3 1 736 2 004.13 2 063.44 0.986 Ⅲ 74 434 6.00 0.006 7 1 594 1 747.37 1 772.99 0.994 Ⅳ 38 033 5.79 0.011 0 1 464 1 754.82 1 806.11 0.982 Ⅴ 49 548 5.59 0.020 8 1 478 1 672.91 1 705.38 0.991 2.3.2 微生物门、纲分类水平组成差异分析
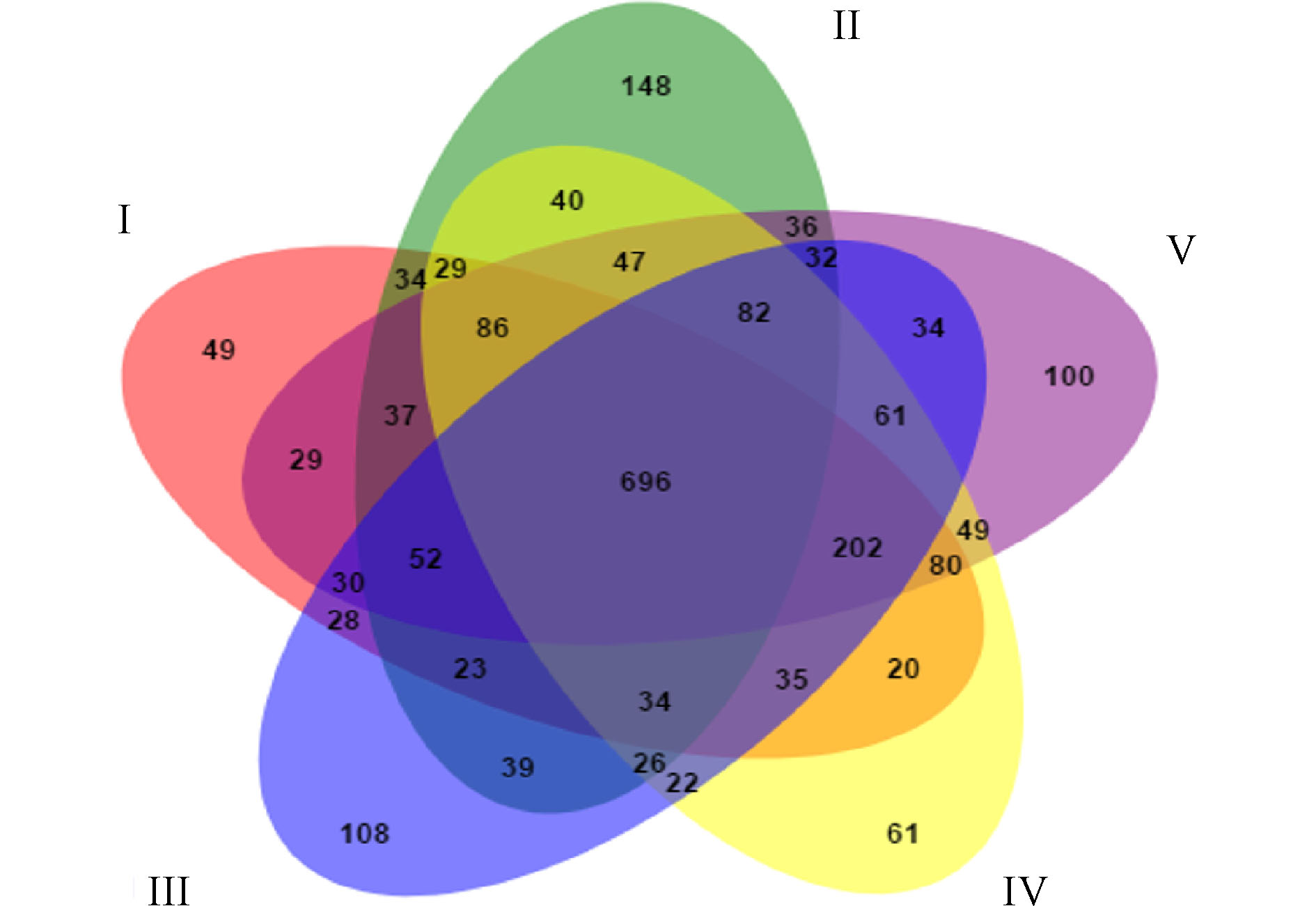
图6展示了人工湿地各组微生物独有和共有的OTU数目。5组中共有的OTU数目为696,分别占Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组和Ⅴ组检测到的OTU数目的48.33%、40.09%、43.66%、47.54%和47.09%,说明人工湿地基质微生物群落出现了显著的变化。这是因为植物根系改变了微生物生长的环境,使得微生物群落出现差异。
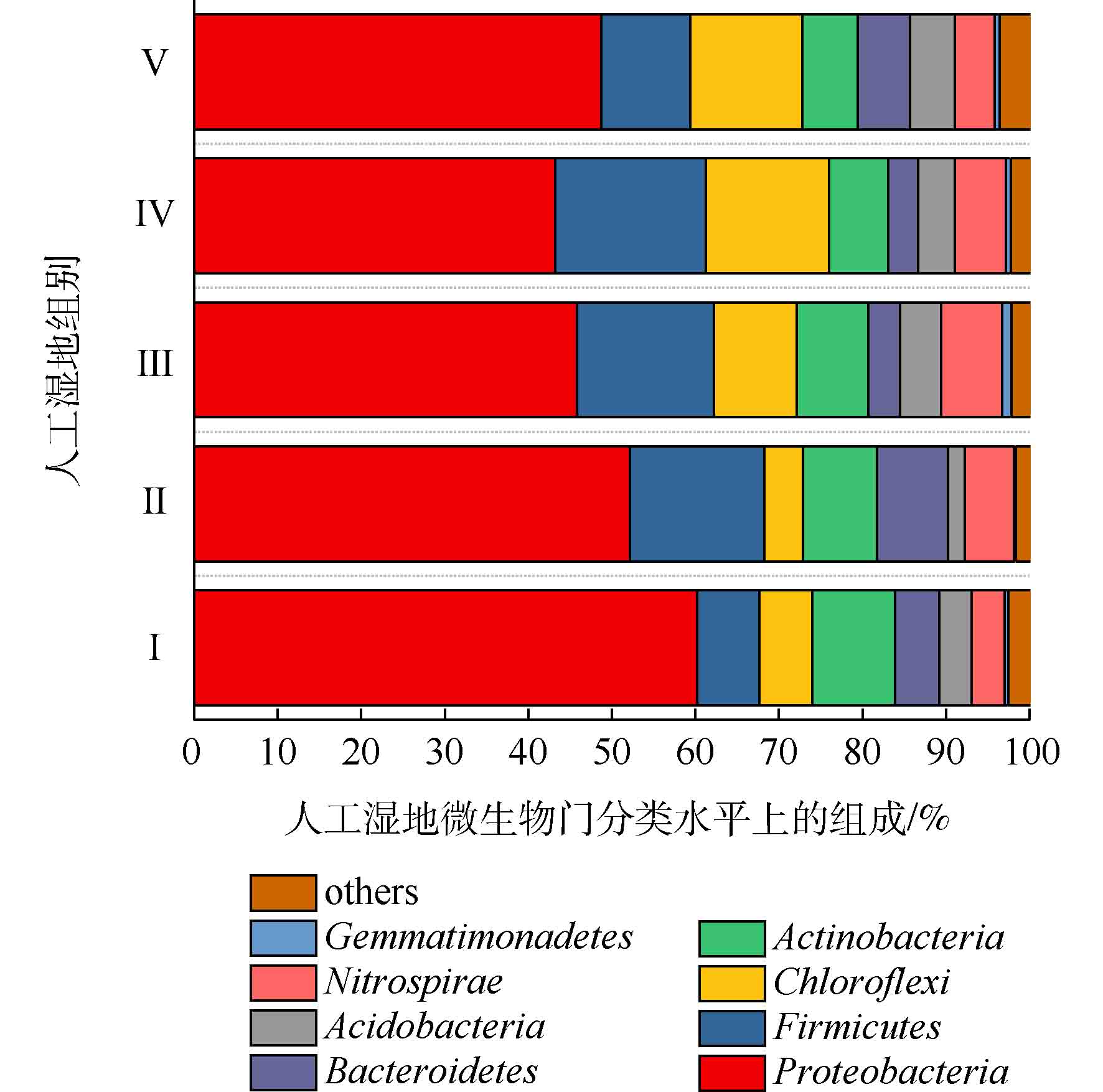
人工湿地各组微生物门水平组成如图7所示。可将微生物检测频率>1%的菌门做为主要的菌门[23]。共发现8个菌门,分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)、硝化螺旋菌门(Nitrospirae)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)和芽单胞菌门(Gemmatimonadetes)。其中5大优势菌门分别为变形菌门、厚壁菌门、绿弯菌门、放线菌门和硝化螺旋菌门。ZHANG等[24]研究三亚河红树林湿地发现,湿地基质的优势菌门为变形菌、拟杆菌、放线菌和厚壁菌。LI等[25]研究发现,多级表面流湿地基质的优势菌门为变形菌、厚壁菌、绿弯菌和放线菌,其中变形菌为最主要的菌门。以上研究中人工湿地的优势菌门,与本实验的优势菌门相似,说明了人工湿地基质有相似的优势菌门。变形菌为最主要菌门,Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组和Ⅴ组的相对丰度为60.23%、52.15%、45.80%、43.19%和48.70%,其次是厚壁菌门(分别为7.39%、16.08%、16.42%、18.06%和10.64%),绿弯菌门(分别为6.39%、4.64%、9.91%、14.72%和13.46%),放线菌门(分别为9.88%、8.84%、8.53%、7.06%和6.59%)和硝化螺旋菌门(分别为3.94%、5.89%、7.31%、6.09%和4.74%)。相对于Ⅰ组,植物组变形菌门的相对丰度降低,这是因为植物的种植改善了微生物多样性。据相关研究,变形菌门和厚壁菌门对反硝化有至关重要的作用[26],硝化螺旋菌门含有丰富的硝化功能的菌属[27]。相对于Ⅰ组,植物组的厚壁菌门和硝化螺旋菌门相对丰度增加,这可能是植物组微生物有较高的氮去除率的原因。
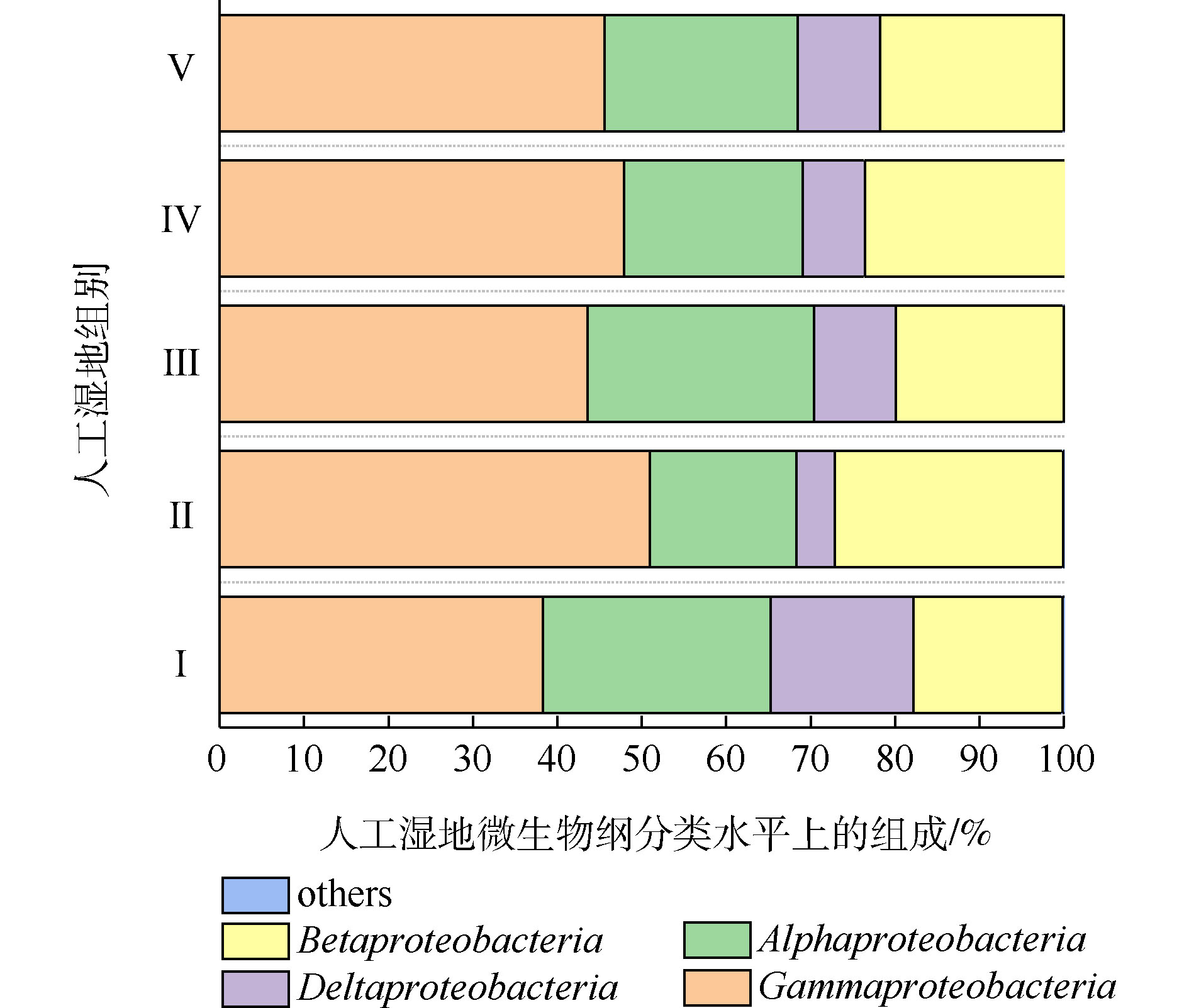
变形菌为最主要菌门。据相关研究,变形菌在人工湿地微生物氮磷去除中起到主要作用[28]。人工湿地各组变形菌的纲水平组成如图8所示。可将微生物检测频率>1%的菌纲做为主要的菌纲。共发现4个菌纲,分别为γ-变形菌纲(Gammaproteobacteria)、β-变形菌纲(Betaproteobacteria)、α-变形菌纲(Alphaproteobacteria)和δ-变形菌纲(Deltaproteobacteria),其中γ-变形菌纲、α-变形菌纲和β-变形菌纲是主要的菌纲。4个菌纲都属于革兰氏阴性菌,说明了人工湿地基质富集革兰氏阴性菌。这有利于污染物的生物降解。LI等[29-30]发现β-变形菌和γ-变形菌在去除硝酸盐和亚硝酸盐的生态功能方面发挥重要作用。ZHONG等[31]发现人工湿地中大多数可能的异养反硝化菌属于β-变形菌。LIU等[32]发现γ-变形菌纲中高丰度的假单胞菌属和动杆菌属细菌包含能发生高效聚磷的细菌。如图8所示,相比于Ⅰ组,植物组的β-变形菌和γ-变形菌的丰度均高于Ⅰ组,说明了植物根系富集β-变形菌和γ-变形菌。这可能是植物组微生物氮磷去除率高于Ⅰ组的原因。
2.3.3 功能微生物差异分析
据有关研究,不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、硫杆菌属(Thiobacillus)、脱氯单胞菌属(Dechloromonas)、罗思河小杆菌属(Rhodanobacter)、热单胞菌属(Thermomonas)和索氏菌属(Thauera)等具有反硝化的作用,参与氮的转化[33-35]。另据有关研究,硝化杆菌属(Nitrobacter)和硝化螺菌属(Nitrospira)具有硝化功能[36],氨基杆菌属(Aminobacterium)、亚硝化单胞菌属(Nitrosomonas)、亚硝化螺菌属(Nitrosospira)和亚硝化球菌属(Nitrosococcus)具有氨氧化功能[23,37]。另外,YAO等[38]发现不动杆菌可以通过异养来转化氮硝化和好氧反硝化。DU等[11]认为不动杆菌或假单胞菌可能是主要的在人工湿地中负责TP去除的属。STREICHAN等[39]发现假单胞菌具有高磷的PAO清除能力。
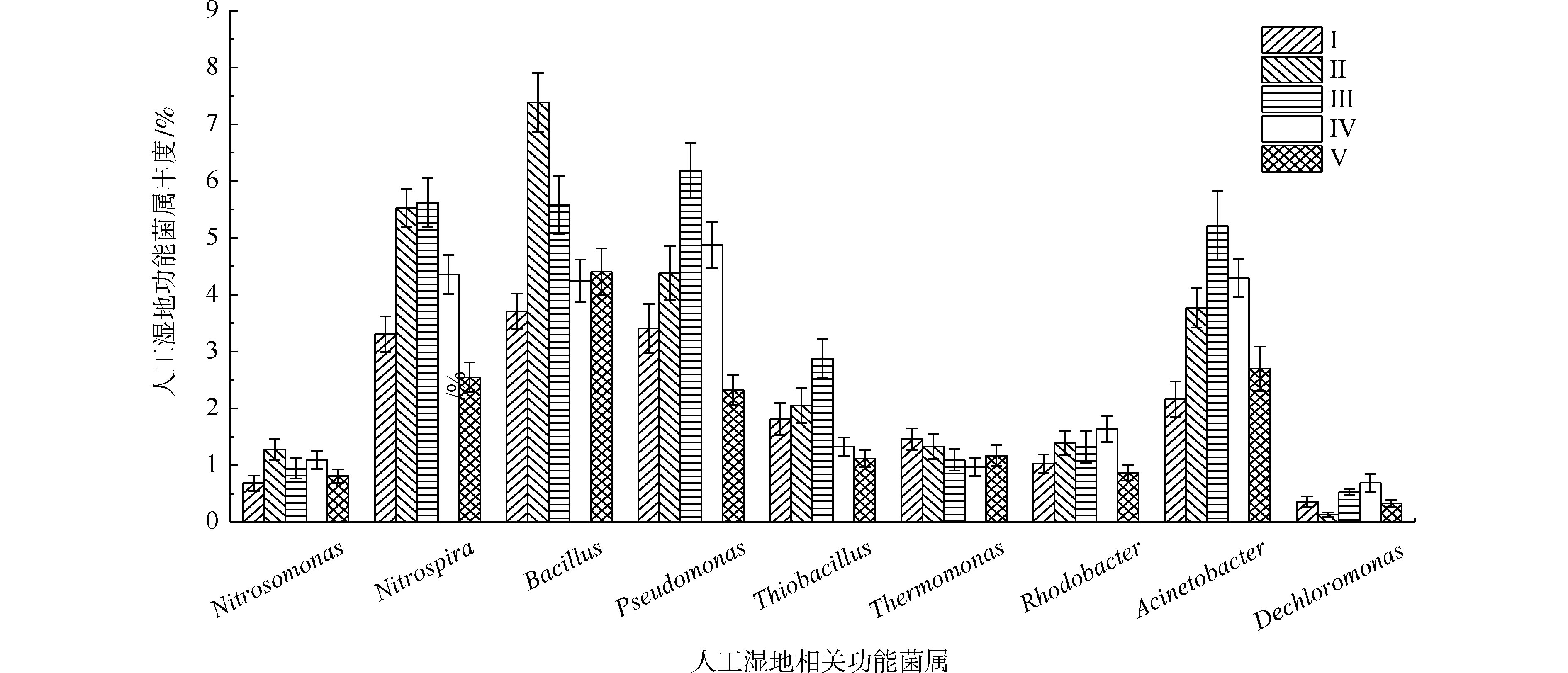
如图9所示,在人工湿地中检测出相对丰度大于0.5%的9种脱氮除磷功能菌属,分别是不动杆菌属、假单胞菌属、芽孢杆菌属、硫杆菌属、脱氯单胞菌属、红杆菌属、热单胞菌属、硝化螺菌属和亚硝化单胞菌属,发现了具有氨氧化细菌亚硝化单胞菌属丰度(0.68%~1.27%)远低于硝化作用硝化螺菌属(2.54%~5.62%)。据相关研究,某些硝化螺菌属能将
NH+4 -N完全氧化成NO−3 -N[40],这可能是人工湿地各组均有较好氨氮去除效果的原因。自养反硝化的硫杆菌的丰度(1.12%~2.87%)明显低于异养反硝化的不动杆菌属、假单胞菌属、芽孢杆菌属、热单胞菌属、红杆菌属和脱氯单胞菌属的总丰度(12.13%~19.91%),说明人工湿地易于富集异养反硝化菌。这是因为实验有较高的C/N(7.8~10.2),同时植物根系分泌碳源,可加速异养反硝化细菌的生长。不动杆菌属、假单胞菌属和芽孢杆菌属是丰度最高的异养反硝化菌属,占异养反硝化菌属总丰度的66.5%~75.9%,故认为这3个菌属在TN去除过程中起主要作用。植物组的不动杆菌属、假单胞菌属、芽孢杆菌属和硝化螺菌属丰度明显高于Ⅰ组,在Ⅱ组和Ⅲ组(最高微生物氮去除率的2组)丰度最高,表明不动杆菌、假单胞菌和芽孢杆菌丰度与人工湿地微生物氮去除率有关,其丰度的增加是植物组微生物氮去除率较高的原因。不动杆菌属、假单胞菌属具有高效聚磷作用和分泌有机酸和磷酸酶将难溶性磷转化可以被植物吸收利用的
H2PO−4 和HPO2−4 形态[41]。通过植物组与Ⅰ组比较发现,植物的种植提高了除磷功能菌属(不动杆菌属和假单胞菌属)的丰度,增强了微生物磷去除率,其中Ⅲ组(最高微生物磷去除率的组)丰度最高,表明不动杆菌和假单胞菌的丰度与人工湿地微生物磷去除率有关,其丰度的增加是植物组微生物磷去除率较高的原因。3. 结论
1)夏季人工湿地各组可有效地去除污水中
NH+4 -N、TN和TP污染物。低负荷下,NH+4 -N、TN和TP的平均去除率为51.48%~80.95%、62.43%~80.30%和37.09%~55.77%。高负荷下,NH+4 -N、TN和TP的平均去除率为45.53%~75.14%、53.67%~71.11%和32.97%~52.69%。种植植物的人工湿地比未种植人工湿地,在去除NH+4 -N、TN和TP污染物方面具有更好的性能。其中Ⅱ组(黄菖蒲)对氮的去除效果最好,Ⅲ组(美人蕉)对磷的去除效果最好。2)微生物作用(34.84%~45.44%)是人工湿地氮去除的主要途径,基质吸附(20.90%~23.91%)是人工湿地磷去除的主要途径。植物的种植不仅对氮(5.36%~9.79%)和磷(9.68%~16.76%)有吸收作用,还增强了微生物对氮(4.08%~10.60%)和磷(1.82%~5.08%)的去除作用。
3)植物的种植改善了基质微生物的丰富度和生物多样性,并发现微生物丰富度和多样性的改善有利于微生物对氮的去除作用。植物的种植提高了脱氮除磷功能微生物的丰度,增强了微生物对氮磷去除作用。人工湿地富集了假单胞菌属、不动杆菌属、芽孢杆菌属和硝化螺菌属等优势硝化和反硝化菌属,其中假单胞菌属、不动杆菌属、芽孢杆菌属和硝化螺菌属是人工湿地中主要的脱氮菌属,其丰度的增加是种植植物的人工湿地实验组微生物氮去除率较高的原因。人工湿地富集了优势聚磷菌属(不动杆菌和假单胞菌),不动杆菌和假单胞菌丰度增加是植物组微生物磷去除率较高的原因。
-
表 1 三级池塘主要物理特征参数
Table 1. Physical characteristics of the three ponds
尾水净化塘 水体体积/m3 水面长/m 水面宽/m 池底长/m 池底宽/m 最大水深/m 平均水深/m 水力停留时间/d 1#池塘 170.25 9.00 14.00 5.00 10.00 2.00 1.35 0.142 2#池塘 170.25 9.00 14.00 5.00 10.00 2.00 1.35 0.142 3#池塘 727.89 23.00 14.00 16.00 7.00 3.50 2.26 0.607 表 2 摄食者的捕食偏好百分比
Table 2. Preference percentage of predator for prey
食物种类 轮虫/% 桡足类/% 摇蚊/% 正颤蚓/% 沉积物稳定碎屑 — — — 50.0 沉积物不稳定碎屑 — — 83.3 50.0 颗粒状稳定碎屑 — — — — 颗粒状不稳定碎屑 100.0 22.2 — — 硅藻 — 33.3 16.7 — 绿藻 — 22.2 — — 蓝藻 — 22.2 — — 表 3 浮游植物重要参数率定结果
Table 3. Calibration results of the important parameters of phytoplankton
浮游植物种类 饱和光强/(kWh·(m2·d)−1) 磷的半饱和参数/(mg·L−1) 氮的半饱和参数/(mg·L−1) 最适温度/℃ 最大光合速率/d−1 沉降速率/(m·d−1) 硅藻 0.262 0.06 0.12 20 1.87 0.01 绿藻 0.581 0.1 0.8 22 1.5 0.01 蓝藻 1.744 0.03 0.4 15 2.2 0.01 表 4 浮游动物和底栖动物重要参数率定结果
Table 4. Calibration results of the important parameters of zooplankton and benthic animals
水生动物种类 半饱和喂养参数/(mg·L−1) 最大消耗率/(g·(g·d)−1) 最小生物量 最适温度/℃ 呼吸速率/d−1 承载能力 死亡系数/d−1 干湿比 浮游动物/(mg·L−1) 底栖动物/(g·m−2) 浮游动物/(mg·L−1) 底栖动物/(g·m−2) 轮虫 0.5 5 0.1 — 25 0.34 4 — 0.08 5 桡足类 1 1.2 0.05 — 26 0.2 8 — 0 5 摇蚊 1 3 — 0 11.5 0.04 — 25 0 5 正颤蚓 1 0.5 — 0 15 0 — 51.38 0 0.08 表 5 矿化作用的重要参数率定结果
Table 5. Calibration results of the important parameters of mineralization
数值及参考范围 不稳定碎屑最大分解速率/(g·(g·d) −1) 稳定碎屑最大分解速率/(g·(g·d) −1) 最适温度/℃ 碎屑沉降速率/(m·d−1) 碎屑降解的最小pH 碎屑降解的最大pH 数值 0.08 0.04 25 0.69 5 8.5 范围 0.08~0.26 0.01~0.04 25~30 — — 8.5~9.5 表 6 尾水净化塘拟合优度指数
Table 6. Values of the goodness-of-fit criteria of wastewater-ponds
水质参数 1#池塘拟合优度 2#池塘拟合优度 3#池塘拟合优度 RMSE MRE EF RMSE MRE EF RMSE MRE EF 溶解氧 0.75 0.068 7 0.76 1.21 0.105 1 0.57 1.48 0.126 4 0.41 氨氮 0.26 0.061 9 0.98 0.40 0.109 5 0.94 0.62 0.155 2 0.87 硝酸盐氮 0.62 0.049 8 0.99 0.64 0.053 6 0.99 1.03 0.070 3 0.98 正磷酸盐 0.74 0.154 2 0.89 0.81 0.146 6 0.85 0.76 0.153 4 0.87 总氮 2.27 0.108 4 0.67 1.85 0.128 2 0.80 2.38 0.102 8 0.58 总磷 1.39 0.233 7 0.82 1.39 0.220 6 0.82 1.32 0.222 2 0.82 -
[1] 朱泽闻, 舒锐, 谢骏. 集装箱式水产养殖模式发展现状分析及对策建议[J]. 中国水产, 2019, 62(4): 28-30. [2] SUBASINGHE R, SOTO D, JIA J S. Global aquaculture and its role in sustainable development[J]. Reviews in Aquaculture, 2009, 1(1): 2-9. doi: 10.1111/j.1753-5131.2008.01002.x [3] 黄世明, 陈献稿, 石建高, 等. 水产养殖尾水处理技术现状及其开发与应用[J]. 渔业信息与战略, 2016, 31(4): 278-285. [4] 袁新程, 施永海, 徐嘉波, 等. 光合细菌与水生植物联合作用对暗纹东方鲀养殖尾水的净化效果[J]. 环境工程学报, 2021, 15(4): 1311-1320. doi: 10.12030/j.cjee.202009150 [5] 刘梅, 原居林, 倪蒙, 等. “三池两坝”多级组合工艺对内陆池塘养殖尾水的处理[J]. 环境工程技术学报, 2021, 11(1): 97-106. doi: 10.12153/j.issn.1674-991X.20200153 [6] LI Z F, YU E M, ZHANG K, et al. Water treatment effect, microbial community structure, and metabolic characteristics in a field-scale aquaculture wastewater treatment system[J]. Frontiers in Microbiology, 2020, 11: 1-13. doi: 10.3389/fmicb.2020.00001 [7] 曾宪磊, 魏宝成, 刘兴国, 等. 基于Ecopath模型的复合养殖池塘构建[J]. 水产学报, 2018, 42(5): 711-719. [8] COSTA C M D B, MARQUES L D, ALMEIDA A K, et al. Applicability of water quality models around the world: A review[J]. Environmental Science and Pollution Research International, 2019, 26(36): 36141-36162. doi: 10.1007/s11356-019-06637-2 [9] 冯斌, 李大鹏, 周琦, 等. 基于WASP模型计算尾水回用河道污染负荷[J]. 环境工程学报, 2014, 8(10): 4196-4202. [10] AKKOYUNLU A, KARAASLAN Y. Assessment of improvement scenario for water quality in Mogan Lake by using the AQUATOX model[J]. Environmental Science and Pollution Research International, 2015, 22(18): 14349-14357. doi: 10.1007/s11356-015-5027-0 [11] COSTA C M D S, LEITE I R, ALMEIDA A K, et al. Choosing an appropriate water quality model: A review[J]. Environmental Monitoring and Assessment, 2021, 193(1): 1-15. doi: 10.1007/s10661-020-08746-9 [12] PARK R A, CLOUGH J S, WELLMAN M C. AQUATOX: Modeling environmental fate and ecological effects in aquatic ecosystems[J]. Ecological Modelling, 2008, 213(1): 1-15. doi: 10.1016/j.ecolmodel.2008.01.015 [13] 李建茹, 李兴, 李卫平, 等. 基于AQUATOX模型的乌梁素海富营养化模拟及控制研究[J]. 生态环境学报, 2020, 29(6): 1215-1224. [14] 李志斐, 谢骏, 王广军, 等. 珠江三角洲养殖池塘底栖动物群落结构及水质生物学评价[J]. 湖泊科学, 2017, 29(4): 896-906. [15] 李志斐, 谢骏, 张晓可, 等. 珠三角高产养殖池塘浮游动物群落结构及水质评价[J]. 水生生物学报, 2017, 41(5): 1071-1079. doi: 10.7541/2017.134 [16] SIMSEK A, KUCUK K, BAKAN G. Applying AQUATOX for the ecological risk assessment coastal of black sea at small industries around Samsun, Turkey[J]. International Journal of Environmental Science and Technology, 2019, 16(9SI): 5229-5236. [17] 杨漪帆, 朱永青, 林卫青. 淀山湖蓝藻水华及其控制因子的模型研究[J]. 环境污染与防治, 2009, 31(6): 58-63. doi: 10.3969/j.issn.1001-3865.2009.06.017 [18] SOURISSEAU S, BASSERES A, PERIE F, et al. Calibration, validation and sensitivity analysis of an ecosystem model applied to artificial streams[J]. Water Research, 2008, 42(4/5): 1167-1181. [19] 徐志嫱, 刘维, 赵洁, 等. 沉水植物对再生水景观水体水质变化的影响和净化效果[J]. 水土保持学报, 2012, 26(2): 214-219. [20] 唐汇娟, 谢平. 围隔中不同密度鲢对浮游植物的影响[J]. 华中农业大学学报, 2006, 51(3): 277-280. doi: 10.3321/j.issn:1000-2421.2006.03.015 [21] WANG Q, XIA L, XU X, et al. Changes of phytoplankton and water quality under the regulation of filter-feeding fishes and submerged aquatic plants in a large-scale experiment[J]. Clean-Soil Air Water, 2015, 43(12SI): 1598-1608. [22] 李玲鹤, 吴锦忠, 秦路平. 水藓植物的综合利用[J]. 中国野生植物资源, 2007, 26(6): 16-19. doi: 10.3969/j.issn.1006-9690.2007.06.005 [23] 王银平, 谷孝鸿, 曾庆飞, 等. 控(微囊)藻鲢、鳙排泄物光能与生长活性[J]. 生态学报, 2014, 34(7): 1707-1715. [24] ARAUZO M. Harmful effects of un-ionised ammonia on the zooplankton community in a deep waste treatment pond[J]. Water Research, 2003, 37(5): 1048-1054. doi: 10.1016/S0043-1354(02)00454-2 [25] 林青, 由文辉, 徐凤洁, 等. 滴水湖浮游动物群落结构及其与环境因子的关系[J]. 生态学报, 2014, 34(23): 6918-6929. [26] 乔菁菁. 基于AQUATOX模拟的公园水体生态构建研究[D]. 北京: 北京林业大学, 2017. [27] ANATOLY P, SAMUEL T, SYLVIA B, et al. Restoration potential of biomanipulation for eutrophic peri-urban ponds: The role of zooplankton size and submerged macrophyte cover[J]. Hydrobiologia, 2009, 634(1): 125-135. doi: 10.1007/s10750-009-9888-4 [28] 陈彦熹, 牛志广, 张宏伟, 等. 基于AQUATOX的景观水体水生态模拟及生态修复[J]. 天津大学学报, 2012, 45(1): 29-35. [29] 黎慧娟, 倪乐意. 浮游绿藻对沉水植物苦草生长的抑制作用[J]. 湖泊科学, 2007, 19(2): 111-117. doi: 10.3321/j.issn:1003-5427.2007.02.001 [30] 刘其根, 张真. 富营养化湖泊中的鲢、鳙控藻问题: 争议与共识[J]. 湖泊科学, 2016, 28(3): 463-475. doi: 10.18307/2016.0301 [31] 卫臻, 卫晓露, 朱明, 等. 生物操控技术在城市静态受污染水体生态修复中的应用[J]. 水资源保护, 2009, 25(6): 45-47. doi: 10.3969/j.issn.1004-6933.2009.06.012 -




 下载:
下载: