-
根据第21届联合气候变化大会通过的《巴黎气候协定》,我国提出到2030年实现“碳达峰”、2060年实现“碳中和”的“双碳”目标。在污水处理过程中,由于大量药剂,以及曝气、污泥脱水设备、水泵等的电耗非常大,因此,污水处理行业在保护水环境的同时,实际为高耗能产业。同时,一些污水处理过程还伴有CH4、N2O等温室气体排放。据估算,全球污水处理行业的整体温室气体贡献率约为1%~3%[1-2]。因此,污水处理过程的碳排放问题不可小觑。
以实现碳中和 (Carbon neutrality) 或能量自给自足(Energy self-sufficiency)为目标,多个国家对污水处理碳中和运行制定了相关政策。荷兰提出NEWs概念,将未来污水处理厂描述为“营养物 (Nutrient) ”、“能源 (Energy) ”、“再生水 (Water) ”三厂 (Factories) 合一运行的模式;新加坡国家水务局推行“NEWater”计划,并制定水行业能源自给自足的三阶段目标,其远期目标为完全实现能源自给自足,甚至向外提供能量;美国以“Carbon-free Water”为目标,期望实现对水的取用、分配、处理、排放全过程以实现碳中和;日本发布“Sewerage Vision 2100”,宣布本世纪末将完全实现污水处理过程中能源的自给自足。
而已有国家通过不同手段已实现了污水处理厂的“能量中和”或“碳中和”运行[3-8]。奥地利Strass污水处理厂利用初沉池可截留进水悬浮物 (SS) 中近60%的COD,并以A/B工艺最大化富积剩余污泥,将初沉与剩余污泥共厌氧消化并热电联产 (CHP) 后可实现108%的能源自给率[3]。美国Sheboygan污水处理厂利用厂外高浓度食品废弃物与剩余污泥厌氧共消化并热电联产实现产电量与耗电量比值达90%~115%、产热量与耗热量比值达85%~90%[4]。德国Bochum-Ölbachtal污水处理厂通过节能降耗与热电联产实现能源中和率96.9%、碳中和率63.2%[9]。德国Köhlbrandhöft/Dradenau污水处理厂通过厌氧消化与污泥干化焚烧实现能源中和率>100%,并实现42.3%的碳中和率[10]。希腊Chania污水处理厂通过厌氧消化实现70%的能源中和率,碳中和率达到58.5%[11]。德国布伦瑞克市Steinhof污水处理厂通过剩余污泥单独厌氧消化并热电联产获得79%的能源中和率,再通过补充出水农灌、污泥回田等手段额外实现了35%的碳减排量,使碳中和率高达114%[2]。芬兰Kakolanmäki污水处理厂通过热电联产与余温热能回收最终实现高达640%能源中和率与332.7%碳中和率[12-13]。
以上案例表明,为实现碳中和目标,国外污水处理厂大都采取超量有机物厌氧消化并热电联产的方案。然而,我国市政污水处理厂普遍存在碳源低下的情况,故该思路可能无法实现。这就需要全方位分析污水自身潜能及利用方式来制定适宜于我国污水处理领域的碳中和规划。在国内,基于碳中和的污水处理运行机制研究才刚起步。在技术层面,各种节能降耗、能量回收方式直接或间接补偿污水处理碳排放量似乎是实现污水处理碳中和的重要方式[4-6,9,13]。基于此,本文从能量中和与碳中和基本概念入手,梳理污水处理行业的碳减排策略,同时探讨其能量潜力、技术路径及可操作性等,以期为我国污水处理领域选择适宜的碳中和路径提供参考。
-
1) 通过技术升级实现节能减排。污水处理过程碳排放分直接碳排放与间接碳排放[14]。其中,按联合国政府间气候变化专门委员会 (Intergovernmental Panel on Climate Change, IPCC) 规定由污水中生源性COD产生的CO2 (直接排放) [15]不应纳入污水处理碳排放清单,而甲烷 (CH4) 、氧化亚氮 (N2O) 及污水COD中化石成分[14]产生的CO2则应纳入污水处理直接碳排放清单。因此,间接碳排放包括:电耗 (化石燃料) 碳排放,即污水、污泥处理全过程涉及的能耗;以及药耗碳排放,指污水处理所用碳源、除磷药剂等在生产与运输过程中形成的碳排放。
在污水、污泥处理过程中,直接产生的CH4、N2O是节能减排中应重点关注的物质。控制污水处理过程中产生的CH4有2种方式:一是严防其从污泥厌氧消化池中逃逸,二是在污水处理其他单元及管道中避免沉积物聚积的死角,也要注意沉砂池 (需选用曝气沉砂池或旋流沉砂池) 去除沙粒表面有机物是否被撇除干净。对N2O的控制则比CH4显得难度要大,N2O主要产生于硝化和反硝化过程。目前,有关N2O形成的机理研究已渐清晰,硝化过程是N2O形成的主因,反硝化过程对N2O形成的作用为次因[16-17]。根据N2O产生机理,提高硝化过程溶解氧 (DO) 浓度,增加反硝化过程有效碳源量有助于抑制N2O的形成[18-20],然而这势必会增加碳排放量。
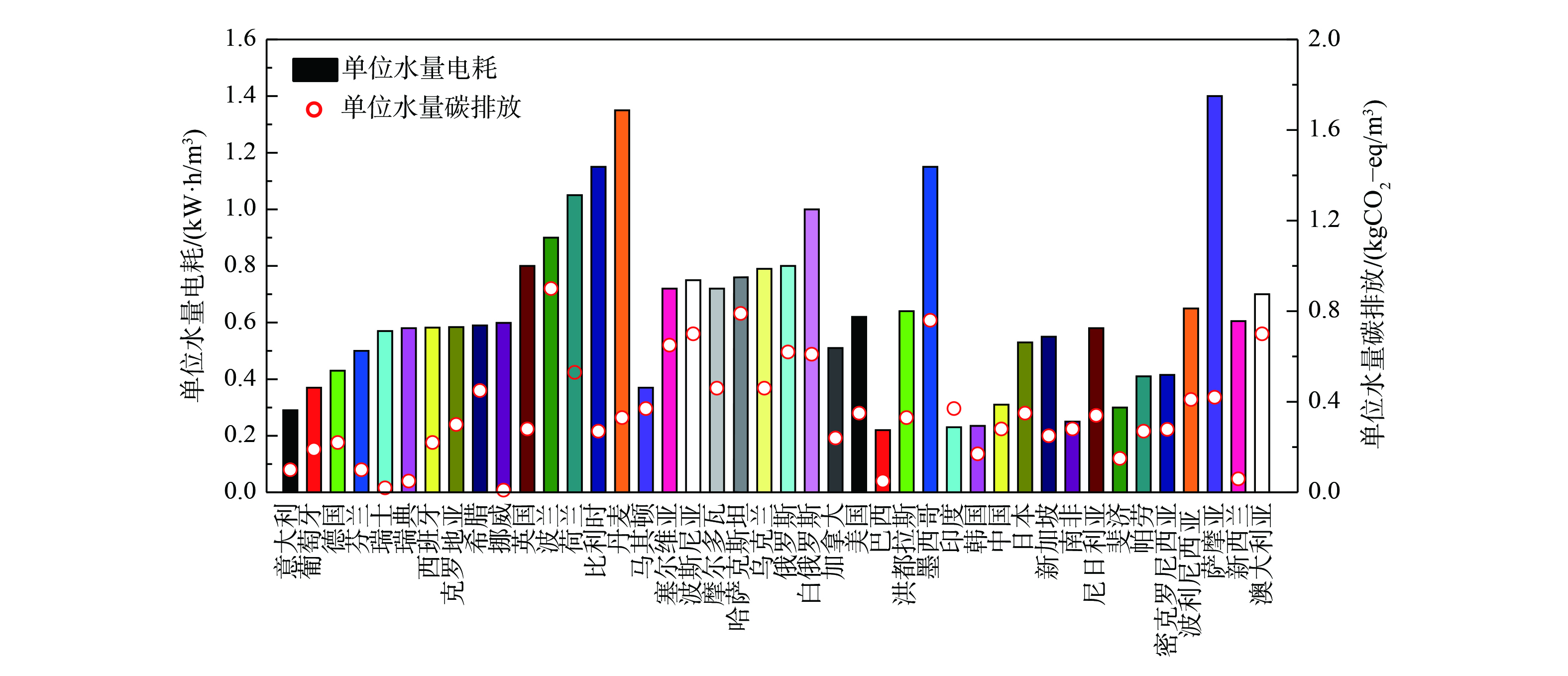
间接排放主要是能耗和药耗。由于在污水处理厂运行种最直接反映的是能耗,而药耗形成的碳排放一般在污水处理以外的行业 (化工、运输等) 产生 (但应计入污水处理碳排放清单) ,故污水处理厂并不关心。图1为不同国家污水处理能耗以及所对应的碳排放量[21]。不同地区能耗差异较为明显,但大数国家的处理能耗为0.5~0.6 kW·h·m−3;我国平均处理能耗为0.31 kW·h·m−3,巴西和印度处理能耗仅有0.22 kW·h·m−3,而丹麦、比利时、萨摩亚 (1.4 kW·h·m−3) 等国家污水处理平均能耗超过1.0 kW·h·m−3。然而,碳排放量结果显示,瑞士、巴西单位水处理碳排量最低,仅为0.05 kg CO2-eq·m−3,墨西哥最高,达0.76 kg CO2-eq·m−3,我国则处于中等水平 (平均值约0.28 kg CO2-eq·m−3)。高能耗一般伴随着那里有着严格的出水排放标准。图1表明,上述高能耗国家碳排放量水平却处于与我国一样的中等水平 (≤0.4 kg CO2-eq·m−3) 。这说明以上国家的污水处理大都利用了污泥厌氧消化与热电联产、甚至余温热能等清洁能源利用方式,从而抵消了一部分碳排放量。
药耗碳排放因工艺本身使用的药剂所产生,因此,应考虑减少碳源与化学除磷药剂投加量,以减少此类间接碳排放。因此,强化生物脱氮除磷技术以减少对碳源和药剂的依赖,将是今后污水处理的主流。如德国Bochum-Ölbachtal污水处理厂通过对原有前置反硝化工艺进行改造,不仅出水可满足严格排放标准,而且能耗也从原来的0.47 kW·h·m−3降至0.33 kW·h·m−3[9]。
另外,通过模型软件对工艺流程进行优化,或基于在线数据实现实时的参数调整也可实现污水处理工艺的节能降耗。欧盟开发“ENEWATER”项目,用于污水处理厂能量在线平衡分配。该项目可采用模糊逻辑、人工神经网络及随机森林等机器学习技术,对实际污水处理厂的水泵、鼓风机等设备进行优化,可不同程度降低污水处理厂运行能耗,最高节能可达80%[22]。然而,“零能耗”的污水处理工艺是很难实现的,除非采用基于自然的处理系统 (nature-based solutions,NBS) 。因此,仅仅靠节能降耗这种间接碳减排方式,尚不能完全实现碳中和运行的目标。
2) 污泥厌氧消化产CH4以实现能源转化。在碳中和目标提出后,剩余污泥的厌氧消化重获关注。上述从污水中获取有机 (COD) 能源来弥补污水处理中的能耗,成为实现碳中和目标的有效思路。然而,污泥厌氧消化所能回收的有机能量取决于进水中有机物浓度 (BOD/COD) 的多寡及厌氧消化有机物能源转化效率[23],尚不能完全照搬。
因生活水平、食物结构、无化粪池设置等原因,欧美等国家地区污水处理厂的进水COD普遍高于我国,COD大于600 mg·L−1的情况非常普遍。因此,通过初沉池以悬浮固体 (suspended solid,SS) 形式截留大部分COD,以及剩余污泥厌氧共消化并热电联产可获得较高的有机能源转化率。另外,以上通过污泥厌氧消化并热电联产实现碳中和案例大多还通过外源有机物添加 (厨余垃圾或食品废物) 以保证入水有机物的浓度,从而保证其实现碳中和运行目标[3,24]。然而,我国市政污水的进水COD普遍偏低,COD一般为100~300 mg·L−1,甚至难以满足基本脱氮除磷对碳源的需求,以至于为保留碳源而不设初沉池已成为主流工艺设计思路。这也使得仅依靠剩余污泥厌氧消化转化有机能源无法实现碳中和运行目标,即使存在热水解等手段强化污泥厌氧消化,在最佳运行状况下也难突破50%CH4的增产量[25]。
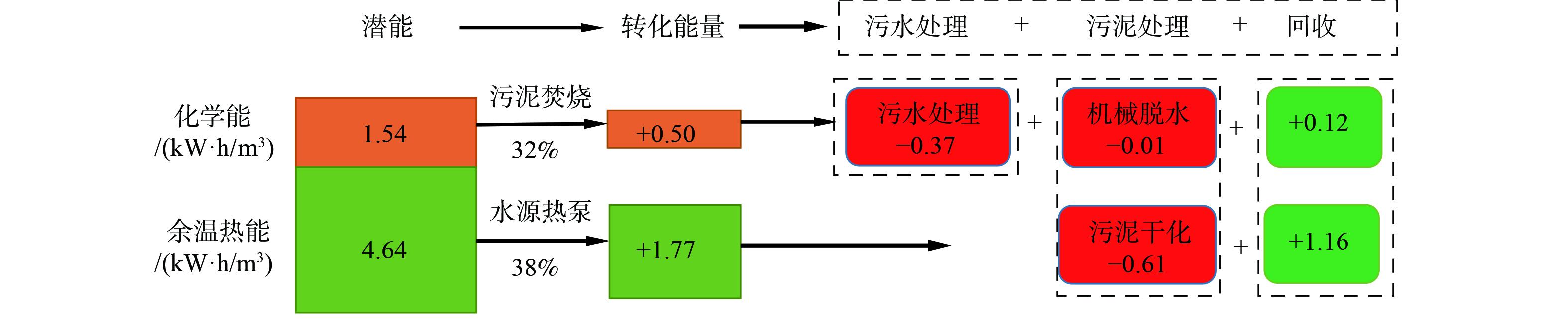
表1为几个污水处理厂污泥有机能源回收过程中COD平衡数据,展示了污泥厌氧消化有机能源转率。数据表明,进水COD中有机能最终只有不到15%可通过厌氧消化与热电联产转化为电或热。如进水COD为400 mg·L−1 (理论电当量1.54 kW·h·m−3) 的市政污水在完成脱氮除磷目的后所产生的剩余污泥经中温厌氧消化产CH4并热电联产,转化率仅13%,即实际转化电当量仅为0.20 kW·h·m−3[23,26]。
3) 与污水处理相关的清洁能源工艺。既然仅靠节能降耗和污泥厌氧消化并热电联产很难实现碳中和目标,那可考虑通过吸收/捕捉CO2 (如植树造林) 或在污水处理工艺或厂区使用清洁能源来达到碳减排目的。因此,传统意义上的可再生能源成为首要选择。近年来,微型发电机、光伏能、风能等新型能源用于英国、土耳其和澳大利亚等国的污水处理厂,产生的新能源大约可弥补7%~60%的污水处理厂能耗。POWER等[30]将微型发电机技术成功用于英国和爱尔兰等国的污水处理厂,产生约50%的电能,用于弥补厂区能耗。澳大利亚的污水处理厂充分利用太阳能、风能和污水水力发电技术,最终产生能源可满足该水厂69%的运行能耗[6]。希腊的克里特岛某污水处理厂利用光伏发电项目减排25%、风力发电环节减排25%、人工种植林固碳减排至少30%,并辅以污泥厌氧消化能源回收方来实现碳中和目标[5]。
具有可行性清洁能源还有太阳能。然而,受限于污水处理厂的地理位置、自然环境 (光照、风速) 等条件,经详细测算,即使将太阳能光伏发电板铺满整个污水处理厂最多也只能弥补约10%的污水处理能耗[26],距离碳中和目标仍有差距。
4) 通过余温热能利用回收能源的相关技术。污水中被忽视的另外一种潜能——水热 (余温热能) 实际上潜力巨大,可通过热交换 (水源热泵) 方式回收并加以利用[23,26]。污水余热 (<30 ℃) 排放约占城市总废热排放量的40%,且其流量稳定,具有冬暖夏凉的特点[31-32]。
热能衡算表明,若提取处理后出水4 ℃温差,实际可产生1.77 kW·h·m−3电当量(热)和1.18 kW·h·m−3电当量(冷)[23]。这是上述实际可转化有机能 (0.20 kW·h·m−3) 的9倍,亦表明有机能与热能分别为污水总潜能的10%和90% [23,29,33]。因此,污水余温热能蕴含量巨大,不仅能完全满足污水处理自身碳中和运行 (案例污水处理平均能耗约0.37 kW·h·m−3) 需要,而且还有更多余热 (约85%) 可外输供热或自身使用 (如用以进行污泥的低温干化) ,能形成大量可进行碳交易的碳汇。
污水热能的有效利用可使污水处理厂转变成“能源工厂”。芬兰Kakolanmäki污水处理厂的案例[12]表明,该厂2020年的总耗能为21.0 GWh·a−1,通过热能回收等主要手段使能源回收总量高达211.4 GWh·a−1,产能几乎为运行能耗的10倍。其污泥厌氧消化产能仅占3.7%,只能满足36.8%的运行能耗 (0.31 kW·h·m−3) ,而余温热能回收占比达95%。
-
现有研究表明,污泥厌氧消化有机能源转化率普遍不高,仅靠此路径很难实现碳中和目标,且厌氧消化至少还有50%有机质需进行进一步的稳定处理[23-24,27],因此,在污泥处理中跳过厌氧消化,而直接干化、焚烧污泥应该是污泥处置与能源回收的上策[34],也成为国内外普遍采用的方法。前文提及的进水COD为400 mg·L−1的案例[23,26],若采用直接干化焚烧工艺来处理污泥,其有机能转化率可升至0.50 kW·h·m−3 (电当量) ,远远高于厌氧消化的0.20 kW·h·m−3,扣除污水处理厂运行能耗 (0.37 kW·h·m−3) 后,可盈余电当量0.12 kW·h·m−3。若再进一步考虑出水的热能利用,按上述热能实际转化计算,水源热泵提取4 ℃温差后,可获得热能1.77 kW·h·m−3 (电当量) ,再扣除污泥干化能耗0.61 kW·h·m−3,可盈余热能1.16 kW·h·m−3 (电当量) (见图2) 。因此,污泥焚烧热能与余温热能回收可实现污水处理自身能源中和、甚至碳中和运行,还可使其变成能源工厂,向社会输电、供热。
以上案例表明,污水处理仅靠节能降耗难以实现碳中和,还应通过开源来达到目标。利用光伏发电、剩余污泥化学能厌氧消化回收与水源热泵余温热能回收方式,分别核算3种能量回收方式对运行能耗的贡献率。结果表明,若进水COD为400 mg·L−1,污水化学能通过厌氧消化产CH4并热电联产 (combined heat and power,CHP) 最多仅可弥补约一半的污水处理运行能耗,剩余一半能量赤字仍需靠其他途径来补充。若利用出水余温热能,仅需要<10%热能或<15%冷能交换 (通过碳交易) 便可弥补能量赤字,间接实现碳中和目标。剩余约90%热能或85%冷能则可用于周边建筑物空调、温室供暖等,以减少外部的化石能源 (煤电、油电) 消耗。相比之下,光伏发电可获得的能量则显得有些“微不足道”,最多也就能提供<10%的运行能耗。因此,污水处理厂若考虑余温热能回收不仅可实现碳中和运行目标,亦可向厂外供热/冷,从而实现向能源工厂的转变。这种认知在颠覆传统能量利用观念的同时,也揭示了污水化学能的利用局限,表明可将COD的利用向高附加值产品 (如藻酸盐、PHA等) 资源化方向转变,而无需再去刻意强调污泥厌氧消化产CH4[23]。
余温热能的回收与应用并无障碍,唯一的设备水源热泵已较成熟。热能利用的最大问题是这是一种低品位热能 (60~80 ℃) ,只适合热量的直接利用,尚不能用于发电。在作为热源外输冬季供暖时,较低的水温又决定了热量的有效输送半径不能太大,仅适用于3~5 km的输送半径。而且在余温热能的实际利用中,政府部门的决策与规划最为重要。个别北欧国家的作法值得借鉴,其热能利用已涵盖建筑供暖、温室加温、人工养鱼等多个方面。如瑞典首都斯德哥尔摩建筑物中有40%采用水源热泵技术供热,其中10%热源来自污水处理厂出水[35];芬兰Kakolanmäki污水处理厂对出水余温热能予以回收利用,并向图尔库市居民供热、制冷,形成了大量碳汇[12-13];荷兰于2021年在乌特勒支De Stichtse Rijnlanden污水处理厂建成25 MW水源热泵系统,为周边10 000户家庭提供供热服务[36]。奥地利学者通过全生命周期影响评价 (life cycle impact assessment, LCIA) 方法得出,该国总共173个污水处理厂中约3/4的出水潜热可被利用,并在厂区周围有稳定的热源用户[37]。
尽管对污水处理厂余温热能的近距离外输利用可大大提高工艺的能耗利用,然而在现状难以调整的已规划区域,若外部无法利用这部分热能,则只能在污水处理厂内部进行利用。如将余温热能可原位用于低温干化污泥,随后将污泥集中运送至具有邻避效应的焚烧厂集中焚烧利用。这样便可将不能发电的低品位热能间接转化为可高温发电的高品位热能[34,38-40]。另外,在冬季寒冷的北方城市,还可考虑用出水余温热能加热前端进水,以确保在冬季维持生物处理效率。
-
“碳中和”已成为的热词。污水处理厂固然可通过节能降耗、污泥厌氧消化、太阳能源等方式很大程度上减少碳排放量。然而,由于我国污水存在有机质含量低的特点,要通过这些常规手段实现真正的碳中和目标差距较大。尽管污水余温热能的利用是使污水处理厂转型为“能源工厂”的有效手段,但在我国污水余温热能尚未被视为清洁能源,更未被列入碳交易清单。因此,除了在常规“降碳”技术上下功夫,还应在管理层面,从整个污水处理领域的整体规划、污水处理厂的设计布局,以及碳汇政策等多方面着手,来选择适合我国国情的污水处理厂碳中和路径。
污水处理行业实现碳中和的路径及其适用条件分析
Analysis on the path and applciable conditions of carbon neutrality in wastewater treatment industry
-
摘要: 节能降耗、厌氧消化产甲烷、工艺相关的能源利用等策略可有助于碳减排,但这些常规方法的潜力距碳中和目标仍有相当距离。国外诸多案例表明,污水余温热能利用技术是污水处理领域实现碳中和运行的可行方案。在总结污水处理领域碳减排策略的基础上,评价分析其对碳中和的贡献。通过对国内案例计算分析余温热能潜力并与有机 (COD) 能转化率进行比较发现,污水中蕴含的余温热能潜力为有机能的9倍。余温热能利用可使污水处理厂达到碳中和目标,还可将剩余热能 (约75%~85%) 向外以供热/制冷形式输出,或用于原位低温干化污泥,实现污水处理厂向“能源工厂”的转型。Abstract: Strategies such as energy conservation, anaerobic digestion and methanogenesis, and process-related energy use can contribute to carbon emission, but the potential of these conventional approaches is still far from carbon neutrality. Many cases abroad indicated that waste water heat energy utilization technology was a feasible scheme to achieve carbon neutrality in wastewater treatment. Based on the summary of carbon reduction strategies in the field of wastewater treatment, the contribution to carbon neutrality was evaluated and analyzed. By calculating and analyzing the waste heat energy potential of domestic cases and comparing with the conversion rate of organic energy (COD), it was found that the waste heat energy potential contained in sewage was 9 times that of organic energy. The use of residual heat energy can make the waste water treatment plants (WWTP) achieve carbon neutrality, and also export the residual heat energy (about 75% ~85%) outward for outside heating/cooling, or for in situ low temperature desiccating sludge to realize the transformation of WWTP into “energy plants”.
-
溶解性固体总量(total dissolved inorganic salt,TDS)的质量分数大于1%的含氮废水通常称为高盐含氮废水[1]。目前,高盐含氮废水排放量大且来源广泛,如腌制食品工业[2]、海产品加工[3]、皮革生产[4]等。由于来源不同,高盐含氮废水的性质复杂各异,不仅含有氮、磷等营养元素和中低碳链的有机物,也含有高浓度的
SO2−4 、Cl−、Ca2+、Mg2+、Na+等无机离子,是一种污染严重且处理难度较大的废水。传统的膜分离法、电解法、离子交换法虽能去除盐度,但对污染物的降解效果甚微。
MFCs微生物燃料电池(microbial fuel cells,MFC)是一种新型废水处理技术,因能以产电微生物作为催化剂,氧化水中污染物并且实现化学能向电能的转换而备受国内外关注。研究者们对MFCs性能的考察,最初主要集中于低盐条件下的废水处理、营养物质回收或生物传感设备。2002年,TENDER等[5]将阳极嵌入海洋沉积物中,阴极置于上覆海水中,利用沉积微生物的活动在水-沉积物表面形成电压梯度,产生电能,实现了MFC在高盐环境下产电的可能性,为高盐废水的处理提供了新思路。盐度会对MFC的性能产生影响。LIU等[6]研究发现,当离子强度由100 mmol·L−1增加到400 mmol·L−1时,以乙酸钠为碳源的单室MFC的产电性能便得以改善; TREMOULI等[7]考察了盐度对COD去除率的影响,发现当盐度从2.7 g·L−1增加至6.7 g·L−1时,COD的去除率从70%下降至52%;黄志鹏[8]研究了盐度分别对单室MFC中
NH+4 -N、
NO−3 -N和
NO−2 -N的处理效果影响,发现随着盐度的增加,
NH+4 -N的去除率逐渐减小,而
NO−3 -N和
NO−2 -N的还原速率呈现先升高后降低的趋势。目前,MFC处理高盐废水的研究大多集中于盐度对电池产电性能以及有机物去除的影响方面,而对高盐条件下同步硝化反硝化除氮的影响还鲜见报道。
为优化以高盐含氮废水为底物的MFC的性能,并为今后MFC应用于实际废水提供参考,本研究根据实际废水的水质变化情况,设置了5组不同碳氮比(C/N分别为3∶1、4∶1、5∶1、6∶1和7∶1)的高盐模拟废水作为单室MFC的底物,探讨了碳氮比对单室MFC产电性能、COD去除率以及同步硝化反硝化脱氮的影响,同时,通过高通量测序技术对接种泥和电极生物膜进行了检测,并对优势菌种进行了分析,以进一步为高盐含氮废水的处理提供参考。
1. 材料与方法
1.1 单室MFC的制作
单室无膜空气阴极MFC装置如图1所示。反应器由有机玻璃板构成,长×宽×高为60 mm×60 mm×70 mm,腔体有效体积为252 cm3。阳极采用有效面积为36 cm2的正方形碳毡,其尺寸为60 mm×60 mm。阴极采用有效面积为42 cm2的长方形碳能碳布,其尺寸为60 mm×70 mm。 阴阳极均由钛丝引出,并经铜导线与电阻箱连接构成闭合回路。外电阻设置为1 000 Ω,电池运行过程中,采用磁力搅拌器对电极液进行搅拌,并在反应器的上部预留直径为8 mm的圆孔用于电极液的更换。
电极材料在使用前需进行预处理。碳布的处理步骤如下:首先在碳布的疏水侧均匀涂抹20%的聚四氟乙烯乳液,待液体凝固后,置于370 ℃的马弗炉中烘烤15min,以上步骤重复4次;其次,在碳布的亲水侧做催化处理,将20%的Pt/C催化剂、异丙醇、去离子水及Nafion黏接剂按照一定比例混合后均匀涂抹于碳布的有效范围,再在70 ℃烘箱中烘烤2 h。其中,Pt/C催化剂的使用量取决于催化剂的浓度和有效面积,本研究采用催化剂浓度为0.5 mg·cm−2,因此,Pt/C催化剂的使用量为21 mg;异丙醇、Nafion黏接剂以及去离子水的使用量与Pt/C催化剂的使用量有关, 每mg Pt/C催化剂需0.83×10−6 L异丙醇溶液、6.67×10−6 L Nafion黏接剂、3.33×10−6 L去离子水,因此,异丙醇、Nafion黏接剂和去离子水的使用量分别为69.93×10−6、140.07×10−6和17.43×10−6 L。碳毡需采用1 mol·L−1的硫酸、1 mol·L−1的氢氧化钠及无水乙醇依次浸泡12 h,以去除碳毡表面的颗粒污染物和金属离子。
1.2 模拟高盐废水
在常规的污水处理系统中,相比于进水中氮的含量,进水中有机物浓度的变化幅度更大。因此,本研究依据榨菜废水处理厂厌氧池出水中污染物的浓度变化情况,在碳氮比的设置中,固定氮的浓度,再根据不同碳氮比确定COD值。实验所采用的水样均为模拟废水,氮源由NH4Cl(0.497 g·L−1)提供、碳源由CH3COONa提供,CH3COONa的使用量依据碳氮比确定,当碳氮比分别为3∶1、4∶1、5∶1、6∶1、7∶1时,CH3COONa的使用量依次为0.50、0.67、0.83、1和1.17 g·L−1,其余成分主要包括CaCl2 0.208 g·L−1、KCl 0.1 g·L−1、MgSO4·7H2O 0.1 g·L−1、Na2SO4 0.23 g·L−1、KH2PO4 0.176 g·L−1,模拟废水均用NaCl调至TDS为15 g·L−1。配水在4 ℃的冰箱内保存。配水水质特征如表1所示。
表 1 配水水质特征Table 1. Quality of the synthetic medium碳氮比 COD/(mg·L−1) 氨氮/(mg·L−1) TN/(mg·L−1) TP/(mg·L−1) 盐度/(g·L−1) pH 3∶1 397.50 131.53 132.31 40 15 7.0 4∶1 524.06 131.56 132.18 40 15 7.0 5∶1 652.19 131.53 132.28 40 15 7.0 6∶1 780.31 131.56 132.20 40 15 7.0 7∶1 911.56 131.53 132.31 40 15 7.0 1.3 电池启动与运行
同时启动5套单室无膜空气阴极MFCs,记为1#、2#、3#、4#和5# MFC,分别以碳氮比为3∶1、4∶1、5∶1、6∶1和7∶1的模拟废水为电极液,实验采用序批式模式运行。在启动阶段,分批次向反应器中接种15 mL取自井口污水厂且经实验室培养的反硝化污泥,并使电极液充满整个反应器腔室,当电池运行电压降至50 mV以下时则视为完成1个产电周期,并及时更换新鲜电极液。若连续3个周期电池均能达到相似电压,则认为MFCs启动成功。再向反应器中接种10 mL取自榨菜废水处理厂且经实验室培养的高盐硝化污泥,待出水水质稳定,采集实验数据。为保持反应器的厌氧状态,电极液在更换前需用氮气吹脱10 min,并且换液孔需用胶带密封。
1.4 检测方法和指标
电池输出电压(U,mV)通过PISO数据采集器(中国台湾泓格科技公司)进行采集,采集频率为1 min·次−1,并记录于存储设备;开路电压和阴阳极电势采用UT39A数字万用表测得。极化曲线和功率密度曲线通过变电阻法测得。电流、功率密度和库仑效率根据式(1)~式(3)进行计算。
I=UR (1) PV=U2VAnR (2) CE=MO2∫t0IdtF⋅bVAn⋅D (3) 式中:I为电流,mA;PV为功率密度,mW·m−3;CE为库仑效率,%;R为外电路电阻,Ω;VAn为反应器有效体积,m3;
MO2 为以氧为标准的有机物摩尔质量,32 g·mol−1;F为法拉第常数,96 485 C·mol−1;b为以氧为标准,氧化1 mol有机物需要转移的电子数,取值4 mol;D为在时间0~t内COD的变化,g·mol−1。
水质检测指标和方法包括COD(重铬酸盐法);氨氮(纳氏试剂比色法);硝态氮(氨基磺酸紫外分光光度法);亚硝氮(N-(1-萘基)-乙二胺光度法);总氮(碱性过硫酸钾消解紫外分光光度法)。盐度通过电导率仪(FE-30K,Metter-Toledo)进行检测,pH和溶解氧通过便携式仪器进行检测。
1.5 高通量测序分析方法
接种污泥的取样:驯化成功后,取少量接种污泥,在4 ℃环境下以10 000 r·min−1离心15 min,然后将样品保存在−80 ℃冰箱中。电极生物膜的取样:待实验结束,将电极生物膜从单室MFC中取出,用手术刀剪裁成检测所需尺寸后,保存在−80 ℃冰箱中。使用E.Z.N.A.®土壤DNA试剂盒(Omega Bio-tek,Norcross,GA,USA)提取接种污泥和电极生物膜DNA,采用16S rRNA基因测序技术对样本进行检测并对优势菌种进行分析。接种污泥及电极生物膜样品交至上海美吉生物平台(上海,中国),由该公司通过PCR扩增技术进行高通量测序。
2. 结果与讨论
2.1 碳氮比对单室MFC产电性能的影响
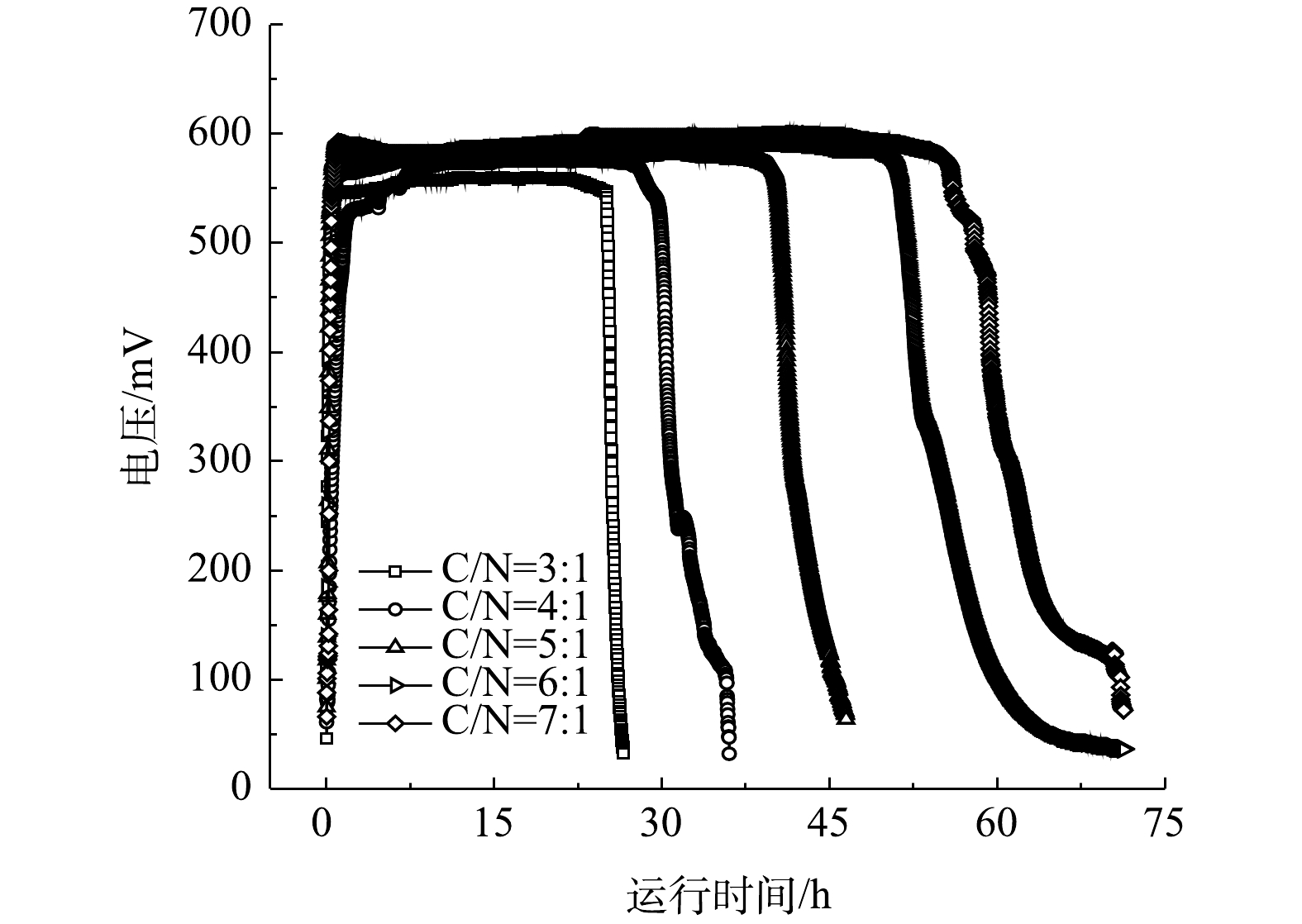
以不同碳氮比的模拟废水为底物的单室MFCs的输出电压如图2所示。由图2可以看出,MFCs经换水后均可以迅速达到峰值电压并维持稳定。碳氮比分别为3∶1、4∶1、5∶1、6∶1和7∶1的单室MFCs的产电周期和峰值电压存在差异,电池的最高输出电压依次为552、576、588、606及610 mV,产电周期长依次为26、36、48、60和71 h。其原因是,碳氮比的提高使电极微生物可利用底物浓度增大,同时也使得反应器厌氧环境相应增强,电极微生物的活性提高,从而促进其对底物的利用。
当电池连续稳定运行5个周期后,通过变电阻法测定电池的功率密度曲线和极化曲线,结果如图3所示。在5个碳氮比水平下单室MFCs的开路电压和内阻分别为:688 mV和90 Ω、713 mV和87.6 Ω、740 mV和81.6 Ω、749 mV和80.9 Ω、765 mV和78.4 Ω(图3(a)和图3(b));相应的最大功率密度依次为5.17、5.71、6.48、6.97和7.33 W·m−3(图3(b))。黄浩斌等[9]开发的单室MFC在盐度为20 g·L−1的条件下的最大输出功率为1.11 W·m−2。系统的极化由阴阳极极化共同决定,5套MFCs系统的阳极电势均随着电流密度的增大,出现逐渐加重的极化现象,而阴极电势呈现平缓的极化现象,这说明阳极电势的改变比阴极电势更能影响单室MFCs的电压。产生以上现象的主要原因是:碳氮比的增加可有效促进溶液中离子的迁移,电极生物膜为了适应电极液底物浓度的变化,传质内阻和活化内阻降低,功率密度增大,从而造成电池性能的提升。
2.2 碳氮比对单室MFC中库仑效率及污染物去除效果的影响
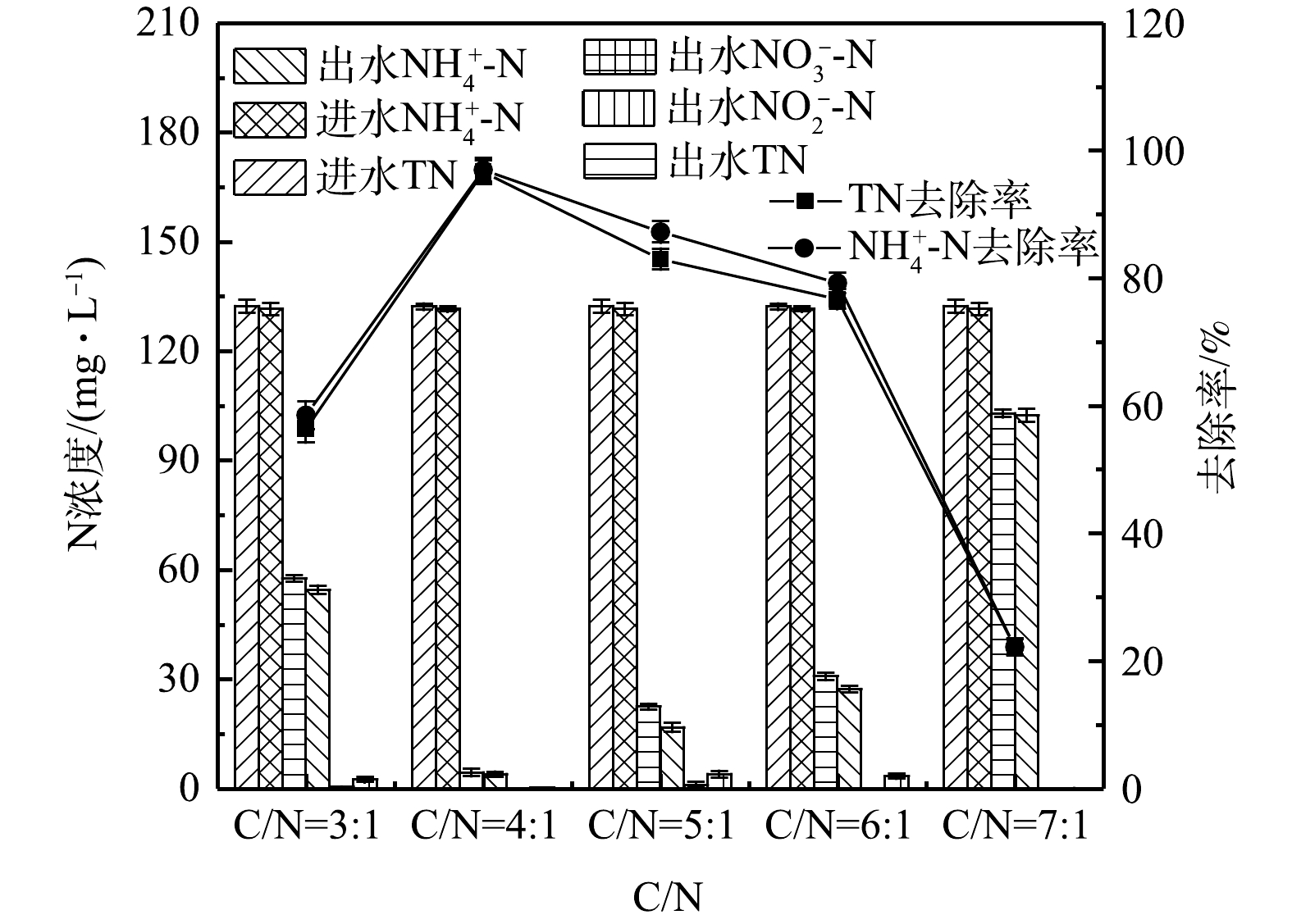
由图4可以看出,当5组单室MFCs的进水中仅含有
NH+4 -N并且
NH+4 -N浓度保持在(131.53±1.7) mg·L−1时,电池稳定运行的周期出水中,均没有
NO−3 -N的积累,1#、3#和4#MFCs中有少量的
NO−2 -N,说明该单室MFC在高盐条件下可以实现同步硝化反硝化脱氮。当碳氮比为4∶1时,TN的去除效果最佳,
NH+4 -N和TN的去除率高达(96.98±1.8)%和(96.64±1.8)%;当碳氮比为5∶1和6∶1时,
NH+4 -N和TN的去除率有所下降,但仍在75%以上;而当碳氮比为7∶1时,
NH+4 -N和TN的去除率仅为(22.21±1.2)%和(22.18±1.3)%。
导致以上现象的原因可能是:单室MFCs的接种源以好氧反硝化菌Thauera为主。有研究[10-12]表明,Thauera也能够进行异养硝化;同时,COD的增加并没有抑制
NH+4 -N对氧气的利用,推测除了传统的自养硝化作用,异养硝化可能是
NH+4 -N的主要转换途径,而有机物浓度是影响异养硝化效率的重要因素[13],高浓度的有机物有利于异养硝化菌的生长代谢;此外,产电周期过短也可能限制
NH+4 -N的降解。因此,当碳氮比由3∶1升至4∶1时,底物浓度增加,碳源更加丰富,产电周期延长,脱氮效果显著提高。而当碳氮比为7∶1时,
NH+4 -N和TN的去除率低于25%,这可能是因为系统中其他异养菌大量富集,加剧了对耗氧有机物(以COD计)的竞争作用,导致系统的脱氮功能受到抑制。
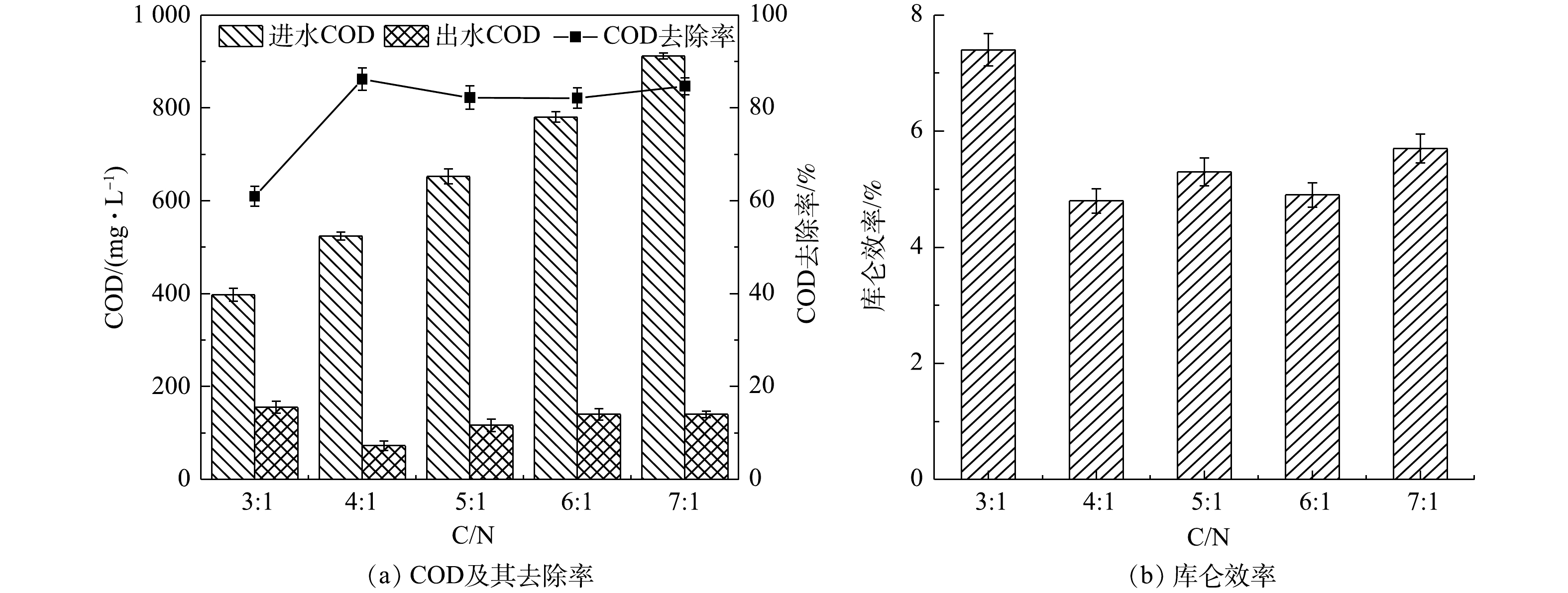
由图5(a)可得,当碳氮比从3∶1升高至4∶1时,COD的去除率从(60.93±2.1)%增加至(86.17±2.4)%,而当碳氮比继续升高至7∶1,COD的去除率分别为(82.18±2.5)%、(82.10±2.1)%、(84.68±1.8)%。这可能是因为:一方面随着碳氮比的增加,单位面积的微生物活性增强[14],降解耗氧有机物(以COD计)并且进行新陈代谢的能力也提高,但当电极微生物与底物结合的酶数量达到饱和状态,即使继续增加碳氮比,COD的去除率也不再提高;另一方面,在同时脱氮除碳的单室MFCs系统中,氮的去除过程也需要消耗有机物,而在不同碳氮比环境下,菌种间对有机物的竞争作用存在差异,从而影响有机物及氮的去除效果。乔龙胜[14]以不同浓度的人工配水为单室MFC的底物时COD的去除率仅为42.64%~55.90%。
1#~5#MFCs的库仑效率分别为7.4%、4.8%、5.3%、4.9%、5.7%(图5(b))。LIU等[15]以醋酸盐作为空气阴极单室MFCs的底物时库仑效率高达28.3%,这说明在本研究的反应器中除发电以外的其他过程消耗了大量的耗氧有机物(以COD计)。对以上结果的原因分析如下:首先,5组单室MFCs均没有采用质子交换膜,为氧气的渗入提供了便利,部分有机物被氧气消耗,导致库仑效率降低,LIU等[16]的研究表明,不使用质子交换膜的MFC的氧气通量比使用质子交换膜的MFC高2.7倍;其次,1#MFC表现出比其他MFCs更高的库仑效率,这可能与电极微生物优先利用溶液中的耗氧有机物(以COD计)进行产电有关,2#、3#和4#电池库仑效率降低可能是因为部分耗氧有机物(以COD计)作为碳源被反硝化菌消耗,而5#MFC反应器中可能富集了大量其他异养菌,加剧了对耗氧有机物(以COD计)的竞争,库仑效率降低。
2.3 单室MFCs污染物去除过程分析
在MFCs运行的一个完整周期,以4 h为间隔,对电极液水质进行检测,结果如图6所示。由图6可以看出,在不同碳氮比条件下,单室MFCs体系中DO的浓度各不相同,且对耗氧有机物(以COD计)和
NH+4 -N的降解过程存在差异,但污染物的变化趋势具有一致性,这说明单室MFCs可以实现电极液中有机物的自动分配。表2和表3分别表示
NH+4 -N和耗氧有机物(以COD计)在不同运行阶段的降解速率。结果表明:在周期运行的初始阶段,电极液中底物充足,电极微生物对耗氧有机物(以COD计)的竞争作用较弱,耗氧有机物(以COD计)和
NH+4 -N均以较大速率降解;而随着运行时间的增加,底物浓度降低,单位面积的微生物活性减弱,降解耗氧有机物(以COD计)并且进行新陈代谢活动的能力也受到影响,导致COD的去除速率降低,同时由于系统中电极微生物对耗氧有机物(以COD计)的竞争作用逐渐加强,
NH+4 -N的降解速率也减缓;在周期运行的后期,COD值继续降低,一方面,产电微生物活性减弱使传递到阴极的电子数量减少,另一方面,可用于消耗通过碳布扩散进入电池的氧气的耗氧有机物(以COD计)不足,导致氧气在电池中的不断累积。詹亚力等[17]向MFC中更换含有饱和溶解氧和不含溶解氧的醋酸钠溶液,发现高含量的氧气不利于电池电能的输出,因此,氧气浓度的增加反过来又对阳极产电微生物起到一定的抑制作用。1#、2#、3#和4#MFCs在电池运行的后期出现
NH+4 -N降解速率的小幅提高可能与反应器中溶解氧浓度的增加有关,间接促进了
NH+4 -N的降解。5#电池的
NH+4 -N在运行的中后期以0.26 mg·(L·h)−1的速率降解,说明系统的脱氮功能受到严重的抑制作用。5组MFCs的pH始终保持稳定,是因为该实验单室MFCs系统通过同步硝化反硝化过程脱氮,硝化产生的酸度可以中和部分反硝化过程产生的碱度[18]。 表 2 5组MFCs的氨氮在不同阶段的去除速率Table 2. Removal rate of ammonia in five MFCs at different stages
表 2 5组MFCs的氨氮在不同阶段的去除速率Table 2. Removal rate of ammonia in five MFCs at different stagesmg·(L·h)−1 运行阶段 氨氮去除速率 C/N=3∶1 C/N=4∶1 C/N=5∶1 C/N=6∶1 C/N=7∶1 第1阶段 5.48(0~8 h) 5.31(0~12 h) 4.78(0~8 h) 4.14(0~8 h) 0.94(0~20 h) 第2阶段 1.83(8~16 h) 2.04(12~28 h) 1.40(8~28 h) 0.96(8~44 h) 0.26(20~72 h) 第3阶段 3.18(16~24 h) 3.50(28~36 h) 2.24(28~48 h) 1.78(44~60 h) — 表 3 5组MFCs的COD在不同阶段的去除速率Table 3. Removal rate of COD in five MFCs at different stagesmg·(L·h)−1 运行阶段 COD去除速率 C/N=3∶1 C/N=4∶1 C/N=5∶1 C/N=6∶1 C/N=7∶1 第1阶段 18.13(0~8 h) 15.63(0~16 h) 15.00(0~24 h) 18.68(0~28 h) 14.73(0~44 h) 第2阶段 7.19(8~24 h) 11.88(16~36 h) 6.25(24~48 h) 5.78(28~60 h) 9.34(44~72 h) 综上所述,单室MFCs体系中耗氧有机物(以COD计)可能参与以下4种反应:被阳极生物膜中的产电菌所利用;被渗入反应器中的氧气直接消耗;作为反硝化过程中的碳源被利用;被其他异养菌利用,即单室MFCs体系中耗氧有机物(以COD计)的去除是多种反应相互作用、相互反馈的结果,变量间的变化规律不呈单向,因此,DO与COD、C/N之间并未呈现明显的变化规律。验证上述推测还需要对电极生物膜进行高通量测序分析。
2.4 单室MFCs微生物群落结构分析
1)门水平下微生物群落结构分析。门水平下接种物及电池阴阳极生物膜的主要菌属如图7所示。其中好氧和厌氧接种物由IA和IC表示,5种碳氮比水平对应的阴阳极生物膜由C1/A1、C2/A2、C3/A3、C4/A4和C5/A5表示。可以看出,单室MFCs的阴极碳布上也附着了大量的微生物。厌氧接种物中的优势菌种为Proteobacteria(44.62%)、Bacteroidetes(36.45%)和Firmicutes(11.69%);好氧接种物种的优势菌种为Proteobacteria(51.30%)、Bacteroidetes(18.56%)和Patescibacteria(12.91%)。在1#~5#MFC中,阴极生物膜以Proteobacteria和Bacteroidetes为优势菌种,但丰度存在显著差异。其中Proteobacteria的丰度依次为75.66%(C1)、64.64%(C2)、46.25%(C3)、53.17%(C4)和44.24%(C5);Bacteroidetes的丰度分别为11.37%(C1)、23.14%(C2)、43.97%(C3)、41.42%(C4)和30.78%(C5)。C5中Planctomycetes以及Firmicutes的丰度增加,分别为3.53%和3.08%;而阳极生物膜以Proteobacteria、Bacteroidetes和Chloroflexi为优势菌种,Proteobacteria的丰度依次为38.78%(A1)、38.28%(A2)、48.28%(A3)、60.28%(A4)和47.19%(A5);Bacteroidetes的丰度分别为45.68%(A1)、19.38%(A2)、18.33%(A3)、16.20%(A4)和26.71%(A5);Chloroflexi的丰度分别为1.43%(A1)、14.14%(A2)、20.85%(A3)、8.76%(A4)和4.02%(A5)。有研究[19]表明,Proteobacteria和Bacteroidetes是高盐废水处理系统中的主要菌种;Firmicutes在一些极端环境中可以生存并且特定的属种能够进行异养硝化[20];而Actinobacteria可以进行反硝化,将
NO−3 和
NO−2 还原为N2O气体释放[21],5组阴极生物膜中均检出了Actinobacteria,但丰度较低,依次为2.67%(C1)、1.04%(C2)、0.51%(C3)、0.52%(C4)和1.58%(C5);Chloroflexi门在有氧或无氧条件下均可以优先利用葡萄糖和N-乙酰氨基葡萄糖,但在pH较低的环境下利用率降低[22]。在门水平下,接种泥中的优势菌种在反应器中得以延续。
2)属水平下微生物群落结构分析。属水平下接种物及电池阴阳极生物膜的主要菌属如图8所示。由图8(a)和图8(b)可以看出,在属水平下,厌氧接种泥的主要菌属为Thauera(37.63%)、norank_f_ML635J-40_aquatic_group(22.30%)和Lentimicrobium(5.24%);好氧接种泥的主要菌属为Thauera(26.87%)、Luteibacter(20.35%)、norank_o_Saccharimonadales(12.89%)和unclassified_o__Chitinophagales(10.60%),接种泥以Thauera为主。有研究[10-12]表明,Thauera能够在厌氧MFC中实现产电和有机物去除,并在同步硝化反硝化系统中通过异养硝化-好氧反硝化途径脱氮。
5组单室MFCs的阴极、阳极生物膜的菌属在属水平下有显著差异,同时为适应高盐水质,与接种污泥相比较微生物群落更为丰富,但Thauera始终为优势菌种,其丰度分别为30.59%和25.79%(C1、A1)、32.75%和34.75%(C2、A2)、25.01%和33.89%(C3、A3)、27.67%和27.30%(C4、A4)以及17.32%和18.06%(C5、A5)。除Thauera外,不同碳氮比条件下的优势菌种各有不同。在属水平下,发现15种与脱氮相关的功能菌,包括Thauera、Stappia、Acinetobacter、Arcobacter、Paracoccus、Rheinheimera、Sedimenticola、Sulfurimonas、Thioalbus、unclassified_f_Rhodocyclaceae、unclassified_f_Rhodobacteraceae、Soehngenia、Caldithrix、unclassified_f_Flavobacteriaceae和Flavobacterium。其中,Stappia[23]、Arcobacter[23]、Sedimenticola[24]、Thioalbus[25]、Soehngenia[26]、Sulfurimonas[27]为硫型自养反硝化菌,能够将底物中的硫化物氧化为高价硫,同时为硝酸盐的还原提供电子,以实现反硝化过程。有研究表明,Arcobacter[23]氧化硫化物的电子也可以提供给二氧化碳,用于合成有机物。Thauera、unclassified_f_Rhodocyclaceae[28-29]、Rheinheimera[30]、Acinetobacter[31]、Paracoccus[32-33]、unclassified_f_Rhodobacteraceae[34]、Flavobacterium[35]经证实具有异养硝化-好氧反硝化脱氮的功能,其中,Rheinheimera可以利用不同的碳源实现好氧反硝化[30];Acinetobacter能够在酸性条件下通过异养硝化-好氧反硝化过程实现了氮的去除[31]。而Caldithrix可利用分子氢或乙酸盐作为电子供体还原硝酸盐,也可以利用厌氧氨氧化过程产生的硝酸盐以实现更高的氮去除率[36]。unclassified_f_Flavobacteriaceae在溶解氧较低的条件下可以有机物为电子供体、硝酸盐或亚硝酸盐作为电子受体进行无氧呼吸代谢,若有机物充足,硝酸盐或亚硝酸盐可被还原为氮气[37]。在阴极生物膜中,具有异养硝化功能的微生物丰度依次为35.72%(C1)、46.90%(C2)、40.17%(C3)、35.63%(C4)和21.38%(C5),反硝化菌的丰度依次为47.17%(C1)、62.41%(C2)、51.28%(C3)、56.09%(C4)和21.38%(C5),其中,好氧反硝化菌的丰度分别为35.72%(C1)、52.60%(C2)、49.59%(C3)、45.08%(C4)和21.38%(C5)。值得注意的是,好氧接种物中自养硝化菌的丰度为3.07%,而该5组单室MFCs中自养硝化菌的丰度均低于<1%,说明硝化菌在与异养菌的竞争中处于劣势而逐渐被淘汰。推测异养硝化可能是该系统中氨氮转换的主要途径,同时,参与反硝化过程的菌属中,好氧反硝化菌所占比例较高,说明该单室MFCs主要通过好氧反硝化途径实现氮的去除。但由图6可见,各单室MFCs体系在周期运行的过程中,氨氮逐渐下降,同时未出现
NO−3 -N和
NO−2 -N的积累,即硝化和反硝化作用是同时进行的,而DO的浓度仅在周期反应的后期有小幅增加,这主要是因为氧气能够通过碳能碳布和阴极生物膜进入电极液中,但在周期反应的前期,实验监测到电极液中的DO为零,即氧气在透过阴极生物膜的时候已被完全消耗,并达成动态平衡。因此,氧气跨膜的过程,为好氧反硝化菌对硝酸盐的利用提供了良好的条件,从而实现了好氧反硝化脱氮。
在属水平下,还发现7种硫酸盐还原菌,分别为Desulfotignum[38]、Desulfomicrobium[24]、Dethiosulfatibacter[39]、Desulfococcus[40]、Desulfuromonas[41]、Desulfofustis[42]和Sulfurovum[43]。KAMARISIMA等[38]研究发现,当硝酸盐浓度(1 mmol·L−1)低于硫酸盐浓度(5 mmol·L−1)时,Desulfotignum可以将硫酸盐还原成硫化物;Dethiosulfatibacter通常以硫代硫酸盐作为电子受体将其还原为低价态硫[39];Desulfuromonas能够以Fe3+作为电子受体氧化乙醇、丙醇和丁醇[41];在厌氧环境下,Desulfofustis能够利用有机物将硫酸盐还原为H2S[42];Sulfurovum可以氢为电子供体实现硫酸盐的还原,并在硫酸盐浓度较高的环境中富集[43]。在阳极生物膜中,硫酸盐还原菌的丰度为1.0%(A1)、1.0%(A2)、4.33%(A3)、20.77%(A4)和27.15%(A5),SRB的丰度随着电极液中碳氮比的升高逐渐增大,并且SRB菌种也越来越丰富,即在硫酸盐浓度极低的条件下,SRB也可以在该单室MFCs中富集,同时,可以对系统的脱氮效率产生影响。值得注意的是,在C5生物膜中也检测出了硫酸盐还原菌Desulfotignum和Desulfomicrobium,丰度高达10.78%和2.39%,说明当电极液碳氮比为7∶1时,单室MFC呈现完全厌氧的状态。
3. 结论
1)单室MFCs在以不同碳氮比的高盐模拟废水(盐度为15 g·L−1)为阳极液时,可实现污染物去除和同步产电。
2)当碳氮比由3∶1依次增加至7∶1时,单室MFCs的产电性能逐渐优化,当碳氮比为7∶1时,功率密度最大,为7.33 W·m−3。
3)碳氮比不同的单室MFCs的污染物去除率存在差异。当C/N=4∶1时,耗氧有机物(以COD计)、
NH+4 -N和TN的去除效果最佳,去除率分别为(86.17±2.4)%、(96.98±1.8)%和(96.64±1.8)%。
4)碳氮比不同的单室MFCs对污染物的去除过程存在差异。在稳定产电周期内,COD及
NH+4 -N在不同阶段表现出不同的去除速率,这主要与底物浓度有关。
5)当接种物以Thauera为主时,单室MFCs可通过异养硝化-好氧反硝化途径实现氮的去除。
-
-
[1] LARSEN T A. CO2-neutral wastewater treatment plants or robust, climate-friendly wastewater management? A systems perspective[J]. Water Research, 2015, 87: 513-521. doi: 10.1016/j.watres.2015.06.006 [2] JIM F. Encouraging energy efficiency in US wastewater treatment[J]. Water 21, 2011, 11(3): 32-34. [3] 郝晓地, 金铭, 胡沅胜. 荷兰未来污水处理新框架——NEWs及其实践[J]. 中国给水排水, 2014, 30(20): 7-15. doi: 10.19853/j.zgjsps.1000-4602.2014.20.002 [4] 郝晓地, 任冰倩, 曹亚莉. 德国可持续污水处理工程典范——Steinhof厂[J]. 中国给水排水, 2014, 30(22): 6-11. [5] 郝晓地, 程慧芹, 胡沅胜. 碳中和运行的国际先驱——奥地利Strass 污水厂案例剖析[J]. 中国给水排水, 2014, 30(22): 1-5. [6] 郝晓地, 魏静, 曹亚莉. 美国碳中和运行成功案例——Sheboygan污水处理厂[J]. 中国给水排水, 2014, 30(24): 1-6. [7] VOURDOUBAS J. Irrigation of tree plantations with treated sewage effluents and use of the produced biomass for pellets production—A case study in Crete-Greece[J]. Journal of Chemical Engineering and Chemistry Research, 2015, 2: 824-831. [8] ALI S M H, LENZEN M, SACK F, et al. Electricity generation and demand flexibility in wastewater treatment plants: benefits for 100% renewable electricity grids[J]. Applied Energy, 2020, 268: 114960. doi: 10.1016/j.apenergy.2020.114960 [9] MARNER S T, SCHRÖTER D, JARDIN N. Towards energy neutrality by optimising the activated sludge process of the WWTP Bochum-Ölbachtal[J]. Water Science and Technology, 2016, 73(12): 3057-3063. doi: 10.2166/wst.2016.142 [10] BEHÖRDE F U , Klima, energie und agrarwirtschaft. Abwasserreinigung des klärwerkverbundes köhlbrandhöft/dradenau in hamburg - welcome to the geoss information exchange datahub [EB/OL] (2019–06–20) [2021–07–12]. https://cloud.csiss.gmu.edu/uddi/en/dataset/abwasserreinigung-des-klarwerkverbundes-kohlbrandhoft-dradenau-in-hamburg. [11] VOURDOUBAS J. Creation of zero carbon emissions wastewater treatment plants-a case study in Crete, Greece[J]. Energy and Environment Research, 2018, 8(1): 64-72. doi: 10.5539/eer.v8n1p64 [12] Turun seudun puhdistamo Oy, Kakolanmäen jätevedenpuhdistamon Tarkkailututkimus Vuosiraportti 2020[EB/OL][2021-2-25]. https://www.turunseudunpuhdistamo.fi/. [13] 郝晓地, 赵梓丞, 李季等. 污水处理厂的能源与资源回收方式及其碳排放核算: 以芬兰Kakolanmäen污水处理厂为例[J]. 环境工程学报, 2021, 15(9): 2849-2857. doi: 10.12030/j.cjee.202106073 [14] 王向阳. 污水处理碳足迹核算及环境综合影响评价研究[D]. . 北京: 北京建筑大学, 2019. [15] IPCC. 2006 IPCC Guidelines for National Greenhouse Gas Inventories[M]. Japan: IGES, 2006. [16] KIM S W, MIYAHARA M, FUSHINOBU S, et al. Nitrous oxide emission from nitrifying activated sludge dependent on denitrification by ammonia-oxidizing bacteria[J]. Bioresource Technology, 2010, 101: 3958-3963. doi: 10.1016/j.biortech.2010.01.030 [17] TALLEC G, GARNIER J, BILLEN G, et al. Nitrous oxide emissions from secondary activated sludge in nitrifying conditions of urban wastewater treatment plants: Effect of oxygenation level[J]. Water Research, 2006, 40: 2972-2980. doi: 10.1016/j.watres.2006.05.037 [18] YU R, KAMPSCHREUR M J, VAN LOOSDRECHT M C M, et al. Mechanisms and specific directionality of autotrophic nitrous oxide and nitric oxide generation during transient anoxia[J]. Environmental Science & Technology, 2010, 44: 1313-1319. [19] 王淑莹, 委燕, 马斌, 等. 控制污水生物处理过程中N2O的释放[J]. 环境科学与技术, 2014, 37(7): 78-84. [20] 付昆明, 张晓航, 刘凡奇, 等. 葡萄糖碳源条件下C/N对反硝化和N2O释放性能的影响[J]. 环境工程学报, 2021, 15(4): 1279-1288. doi: 10.12030/j.cjee.202010137 [21] WANG H, YANG Y, KELLER A A, et al. Comparative analysis of energy intensity and carbon emissions in wastewater treatment in USA, Germany, China and South Africa[J]. Applied Energy, 2016, 184: 873-881. doi: 10.1016/j.apenergy.2016.07.061 [22] NAKKASUNCHI S, HEWITT N J, ZOPPI C, et al. A review of energy optimization modelling tools for the decarbonisation of wastewater treatment plants[J]. Journal of Cleaner Production, 2021, 279: 123811. doi: 10.1016/j.jclepro.2020.123811 [23] HAO X, LI J, VAN LOOSDRECHT M C M, et al. Energy recovery from wastewater: Heat over organics[J]. Water Research, 2019, 161: 74-77. doi: 10.1016/j.watres.2019.05.106 [24] 郝晓地, 李季, 曹达啟. 污水处理碳中和运行需要污泥增量[J]. 中国给水排水, 2016, 32(12): 1-6. doi: 10.19853/j.zgjsps.1000-4602.2016.12.001 [25] 郝晓地, 张璇蕾, 刘然彬, 等. 剩余污泥转化能源的瓶颈与突破技术[J]. 中国给水排水, 2014, 30(18): 1-7. doi: 10.19853/j.zgjsps.1000-4602.2014.18.001 [26] HAO X D, LIU R B, HUANG X. Evaluation of the potential for operating carbon neutral WWTPs in China[J]. Water Research, 2015, 87: 424-431. doi: 10.1016/j.watres.2015.05.050 [27] FERNÁNDEZ-ARÉVALO T, LIZARRALDE I, FDZ-POLANCO F, et al. Quantitative assessment of energy and resource recovery in wastewater treatment plants based on plant-wide simulations[J]. Water Research, 2017, 118: 272-288. doi: 10.1016/j.watres.2017.04.001 [28] SCHAUM C, LENSCH D, BOLLE P Y, et al. Sewage sludge treatment: evaluation of the energy potential and methane emissions with COD balancing[J]. Journal Water Reuse Desalination, 2015, 5: 437-445. doi: 10.2166/wrd.2015.129 [29] FRIJNS J, HOFMAN J, NEDERLOF M. The potential of (waste)water as energy carrier[J]. Energy Conversion Management, 2013, 65: 357-363. doi: 10.1016/j.enconman.2012.08.023 [30] POWER C, MCNABOLA A, COUGHLAN P. Development of an evaluation method for hydropower energy recovery in wastewater treatment plants: case studies in Ireland and the UK[J]. Sustain Energy and Technology, 2014, 7: 166-177. [31] CIPOLLA S S, MAGLIONICO M. Heat recovery from urban wastewater: Analysis of the variability of flow rate and temperature in the sewer of Bologna, Italy[J]. Energy Procedia 2014, 45, 288–297. https://doi.org/10.1016/j.egypro.2014.01.031 [32] ARIF H, EMRAH B, ORHAN E, et al. A key review of wastewater source heat pump (WWSHP) systems[J]. Energy Conversion and Management 2014, 88, 700–722. https://doi.org/10.1016/j.enconman.2014.08.065. [33] MCCARTY P L, JAEHO B, JEONGHWAN K. Domestic wastewater treatment as a net energy producer-can this be achieved?[J]. Environmental Science & Technology, 2011, 45(17): 7100-7106. [34] HAO X D, CHEN Q, VAN LOOSDRECHT M C M, et al. Sustainable disposal of excess sludge: Incineration without anaerobic digestion[J]. Water Research, 2020, 170: 115298. doi: 10.1016/j.watres.2019.115298 [35] AVERFALK H, INGVARSSON P, PERSSON U. Large heat pumps in Swedish district heating systems[J]. Renewable and Sustainable Energy Reviews, 2017, 79: 1275-1284. doi: 10.1016/j.rser.2017.05.135 [36] Heat pump at Utrecht sewage treatment plant. https://www.eneco.com/what-we-do/sustainable-sources/heat-pump-at-utrecht-sewage-treatment-plant/[EB/OL], 2020. [37] NEUGEBAUER G, STGLEHNER G. Realising energy potentials from wastewater by integrating spatial and energy planning[J]. Sustainable Sanitation Practice, 2015, 22: 15-21. [38] GROSS T S C. Thermal drying of sewage sludge[J]. Water Environment Journal, 2010, 7: 255-261. doi: 10.1111/j.1747-6593.1993.tb00843.x [39] MURAKAMI T, SUZUKI Y, NAGASAWA H, et al. Combustion characteristics of sewage sludge in an incineration plant for energy recovery[J]. Fuel Processing Technology, 2009, 90: 778-783. doi: 10.1016/j.fuproc.2009.03.003 [40] 郝晓地, 张益宁, 李季, 等. 污水处理能源中和与碳中和案例分析[J]. 中国给水排水, 2021, 37(20): 1-8. doi: 10.19853/j.zgjsps.1000-4602.2021.20.001 -





 下载:
下载: