-
石墨相氮化碳(g-C3N4)是一种类石墨烯层状二维结构的聚合物半导体,其内部七嗪环结构单元使其具有较高的化学和热稳定性,较低的带隙能量使其可有效吸收可见光[1-2],这些特性使g-C3N4成为具有较好应用前景的光催化材料。但在实际研究中发现,g-C3N4存在光生电子与空穴易于复合、比表面积小等不足[3],这在一定程度上限制了其光催化活性。研究人员通过将其与其他半导体材料复合[4]、助催化剂修饰[5]、染料敏化[6]、形貌结构优化[7]等方法,提高g-C3N4的可见光吸收能力和载流子迁移与分离效率,从而加强其催化效果。
利用碳量子点(CQDs)负载修饰半导体光催化剂,可以提高光的利用率和催化效率[8-9]。CQDs本身具有良好的导电性,既可以作为电子供体也可以作为电子受体[10],有利于光生电子的快速迁移。此外,由于CQDs光化学稳定性高,具有上转换性等特有光学性质[11]。HU等[12]制备了CQDs/BiOCOOH/uCN光催化剂,构建Z型电荷转移机制,引入CQDs作为电子穿梭桥,从而提高了磺胺噻唑降解率。因此,将CQDs引入g-C3N4,二者之间以π-π键相连[13],形成异质结结构,可有效抑制载流子空穴复合效率,从而增强材料的光催化活性。
本研究基于g-C3N4与CQDs的结构和性能特点,采用水热法制备了CQDs与g-C3N4质量比为10%的CQDs/g-C3N4复合光催化材料,且将其用于盐酸四环素的光催化降解,通过FESEM、FETEM、XRD、XPS以及UV-vis等方法表征了催化剂形貌和结构变化,并考察了该催化剂在可见光下对盐酸四环素的降解效果,进一步探究了CQDs/g-C3N4复合材料的光催化机制。
-
所用试剂:三聚氰胺(C3H6N6)、柠檬酸(C6H8O7)、尿素(CH4N2O)、N,N-二甲基甲酰胺(DMF,C3H7NO)、盐酸四环素(C22H25ClN2O8)、无水乙醇(C2H5OH)、氨水(NH3·H2O)和盐酸(HCl)均为分析纯;所有实验用水均为超纯水。
所用仪器包括:XL-30 ESEM FEG型场发射扫描电子显微镜(美国FEI有限公司);Tecnai G2 20型场发射透射电子显微镜(美国FEI有限公司);BRUCKR D8 ADVANCE型X射线粉末衍射仪(德国布鲁克公司);ESC ALAB 250型X射线光电子能谱仪(美国Thermo公司);UV3600型紫外-可见近红外分光光度计(日本岛津公司);CHI1660C型电化学工作站(上海辰华仪器有限公司)。
-
在槽型坩埚中放入适量三聚氰胺粉末,并将其置于管式炉内,以350 mL·min−1的速率向管内通5 min氮气排净空气。随后,设置管式炉升温速率为5 ℃·min−1,升温至600 ℃,煅烧6 h后得到g-C3N4样品,随炉自然冷却至室温,取出后研磨成粉末。将制备的g-C3N4样品与适量的无水乙醇混合均匀,放入超声波仪器中,将剥离后的样品放在60 ℃条件下烘干备用。
-
称取1 g制备的g-C3N4样品,溶于10 mL DMF中,同时称取适量柠檬酸和尿素调整CQDs与g-C3N4的质量百分比为10%,将其加入上述溶液,搅拌至其完全溶解。将混合溶液转移至50 mL聚四氟乙烯反应釜中,在160 ℃下恒温反应4 h后自然冷却至室温。冷却后取出样品离心15 min,用无水乙醇反复洗涤3次,60 ℃条件下烘干得到10%CQDs/g-C3N4样品。
-
选用300 W氙灯(400~800 nm)作为可见光光源。配制10 mg·L−1盐酸四环素水溶液,溶液pH用HCl和NaOH水溶液进行调节。称取g-C3N4和CQDs/g-C3N4催化剂分散于250 mL盐酸四环素水溶液中,在避光状态下以700 r·min−1搅拌10 min进行吸附。随后打开氙灯光源,每隔10 min取样2.5 mL,将所取样品用0.45 μm针式过滤器过滤,最后用紫外-可见分光光度计测定所得滤液吸光度值,计算盐酸四环素的降解率。
-
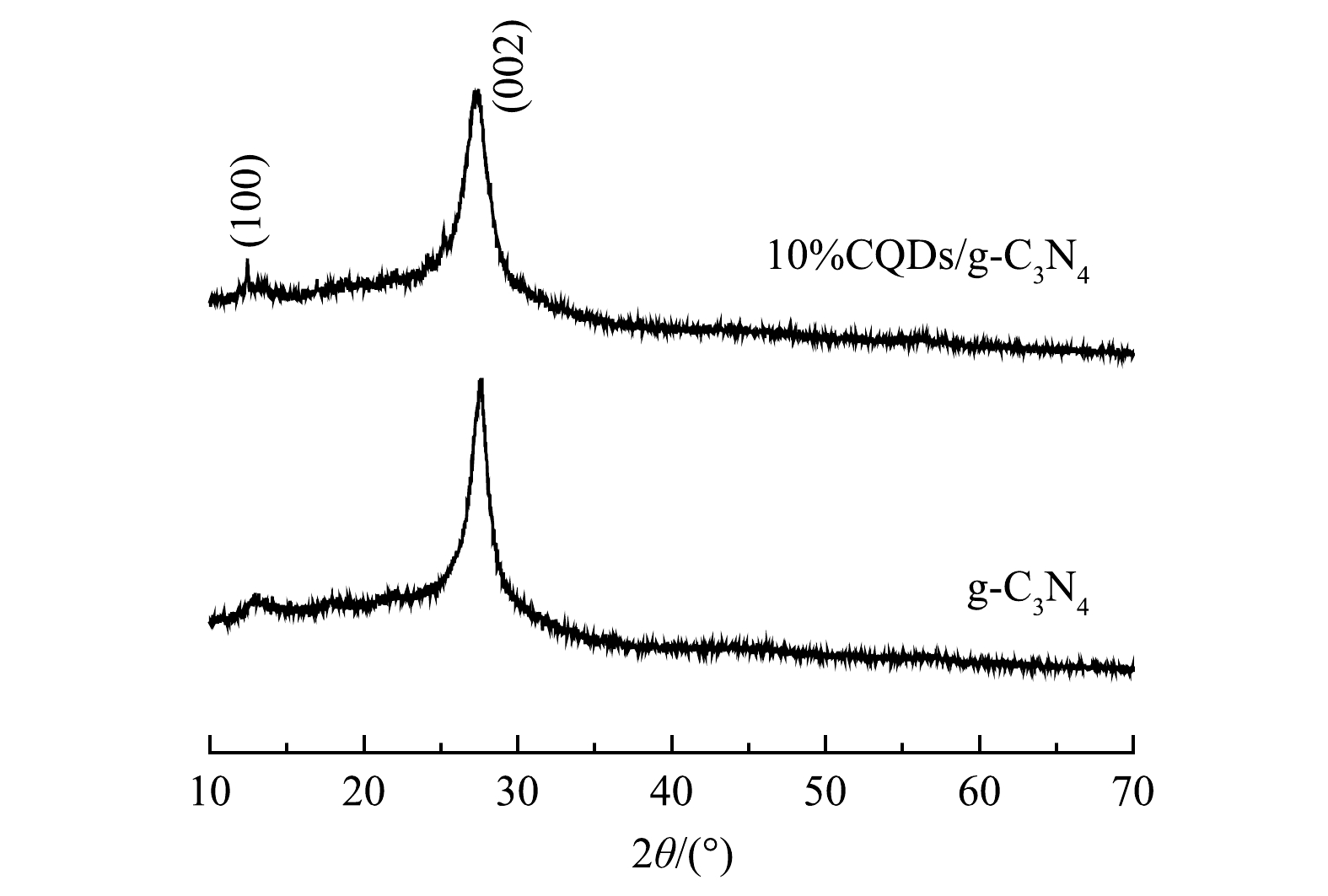
由图1可以看出,g-C3N4样品在2θ为12.94°和27.59°处出现的特征衍射峰,分别对应g-C3N4的(100)和(002)晶面[14]。这说明样品为纯相g-C3N4。其中(100)晶面与g-C3N4面内三嗪基基团相对应,(002)晶面与芳香环层间堆积相对应[15]。负载CQDs的复合材料中同样出现了对应的特征衍射峰,无其他明显杂峰。复合材料中由于CQDs的引入,衍射峰半峰宽增加且发生红移,晶粒尺寸减小,衍射峰强度减弱。这说明样品结晶度降低,但变化幅度并不明显。由此可以看出,碳量子点的负载对氮化碳本身的结构影响不大。
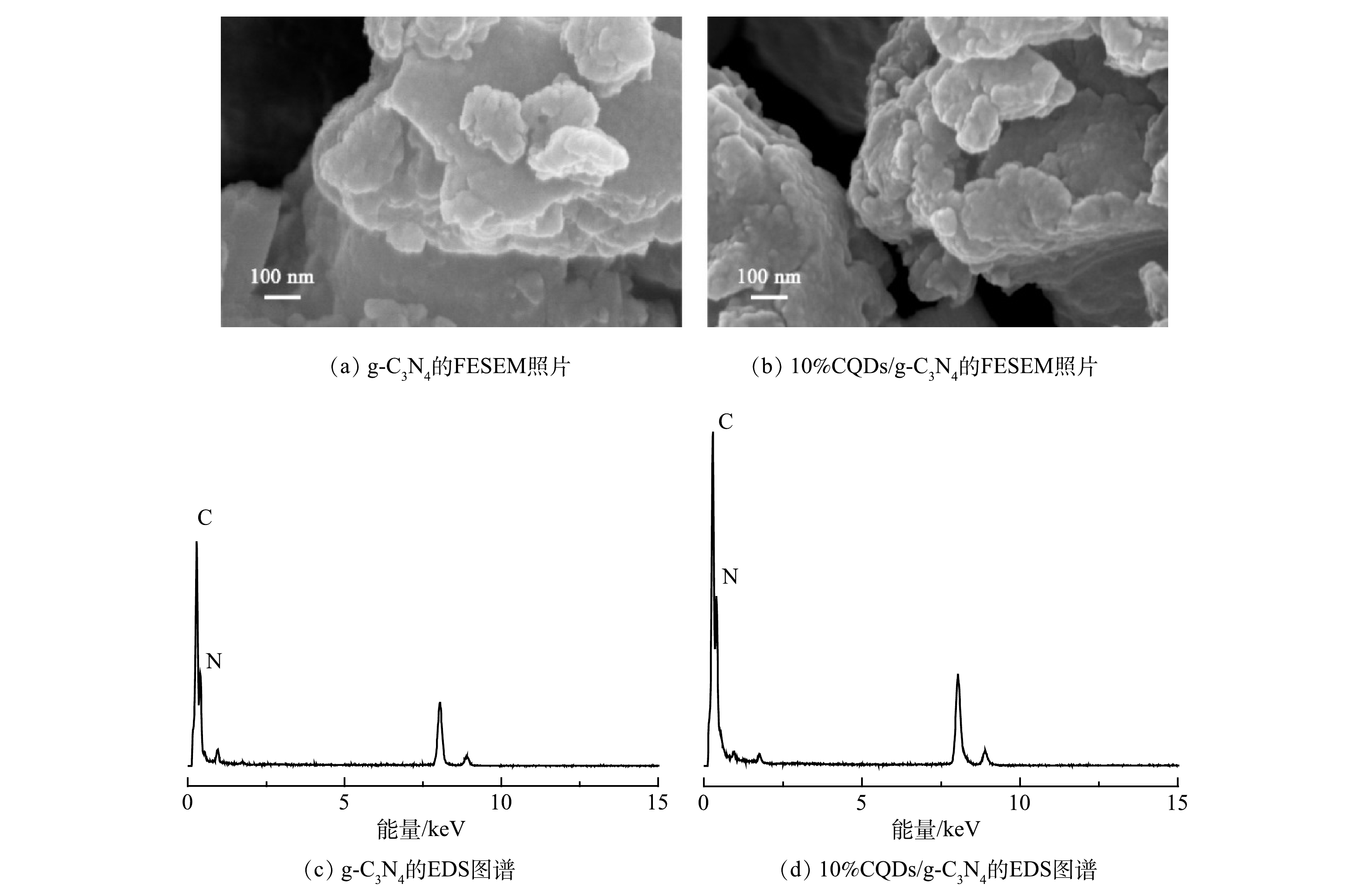
由图2可以看出,g-C3N4基材料呈现出类石墨层状堆叠,具有不规则分布无定型团聚特征。与纯g-C3N4相比,负载CQDs的样品形貌未发生明显改变,CQDs的引入使得材料表面更加粗糙,团聚颗粒粒径变小。图2(c)和图2(d)分别为g-C3N4和10%CQDs/g-C3N4的EDS的表征结果。纯g-C3N4和10%CQDs/g-C3N4材料中都只含有C、N 2种元素,说明制备的样品具有较高的纯度。
为进一步探究材料形貌变化,对纯g-C3N4和10%CQDs/g-C3N4样品进行了FETEM表征。在图3(a)中可以清晰地观察到g-C3N4样品的层状结构。这进一步证明g-C3N4为二维薄纳米片,表面相对光滑。由图3(b)可以看到,10%CQDs/g-C3N4表面可以明显观察到量子点分布。这说明量子点的成功负载。与纯g-C3N4相比,CQDs的负载并未明显改变材料形貌。由图3(c)可以看到,10%CQDs/g-C3N4样品表面量子点粒径为4~5 nm。
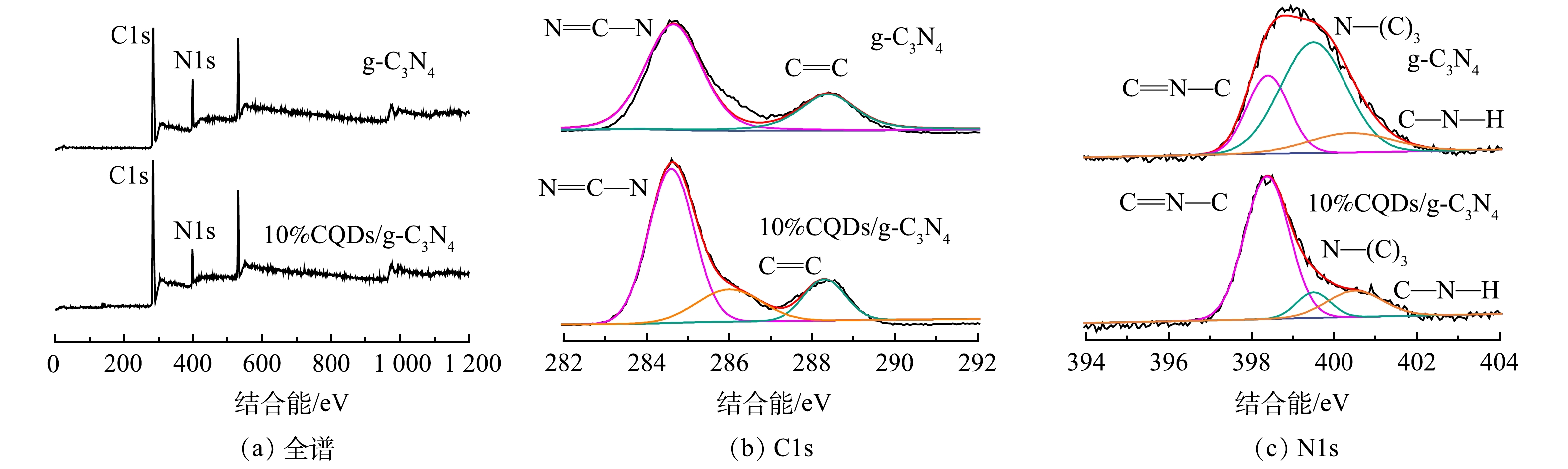
为确定样品表面各元素化学状态变化情况,对纯g-C3N4与10%CQDs/g-C3N4样品进行了XPS分析。由图4(a)可见,纯g-C3N4与10%CQDs/g-C3N4样品图谱中含有明显的C1s和N1s的信号峰。这说明样品由C、N元素组成。由图4(b)可以看出,10%CQDs/g-C3N4在284.61 eV和288.42 eV处的信号峰分别对应N—C=N和C=C键作用。与纯g-C3N4相比,在286.22 eV处出现的信号峰对应CQDs中的sp2杂化碳,说明CQDs已成功被负载[16-17]。由图4(c)可见,在398.40、399.5和400.55 eV处的信号峰分别对应C=N—C、N—(C)3和C—N—H键[18]。负载CQDs后,C=N—C键峰面积增加,说明CQDs与g-C3N4二者之间存在化学相互作用[19],导致碳氮共轭π键强度增加。
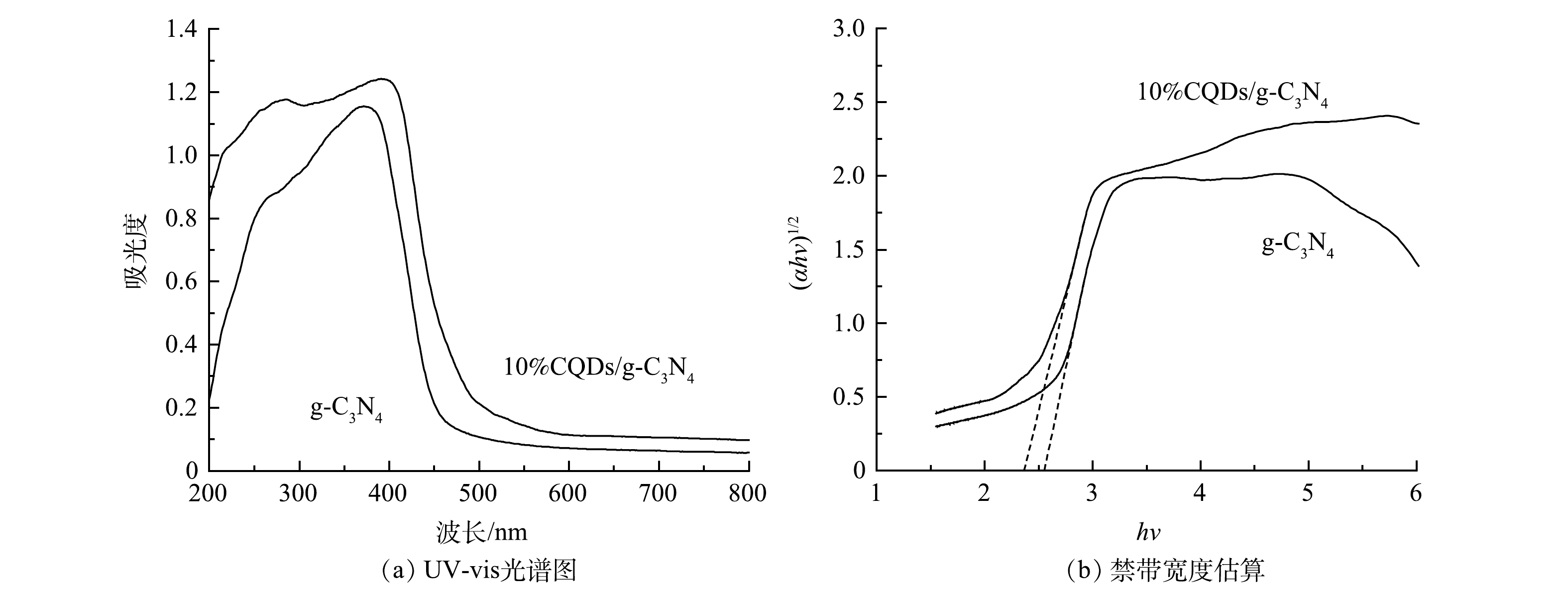
采用紫外-可见漫反射光谱图进一步探究了CQDs的引入对催化材料的光学性质的影响。由图5(a)中可以看出,与纯g-C3N4材料相比,10%CQDs/g-C3N4在可见光波长范围内表现出了较强的光吸收特性,复合材料的吸收带边向可见光区发生了红移。这说明碳量子点的引入增强了材料的可见光吸收响应[20]。根据Kubelka-Munk公式,作如图5(b)所示切线图,得到g-C3N4和10%CQDs/g-C3N4的禁带宽度分别为2.55 eV和2.36 eV。由此可见,CQDs的掺杂使材料的禁带宽度变低,有利于光催化反应中电子的迁移和分离,提高了材料光催化活性。
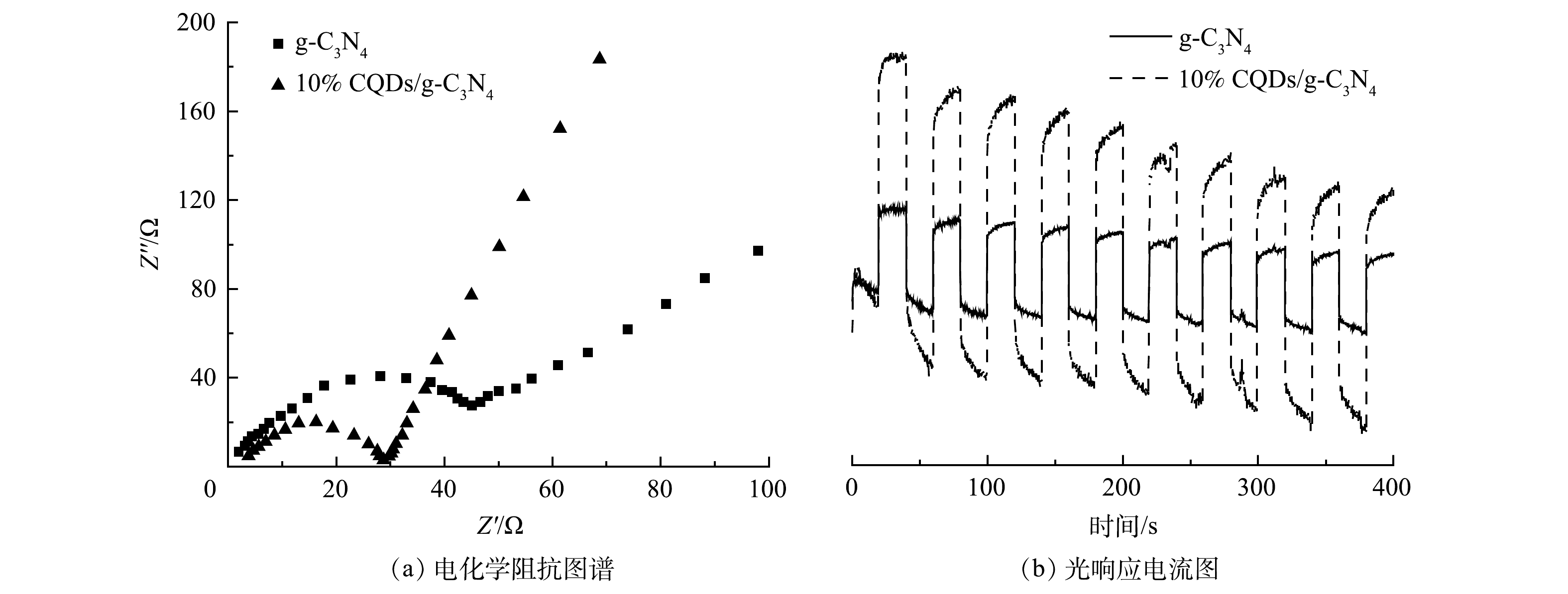
电化学阻抗谱中高频区半圆直径的大小可表征电子迁移和分离效率,直径越小,催化材料中电荷转移阻抗越小[21]。由图6(a)可见,与纯g-C3N4相比,10%CQDs/g-C3N4具有较小的半圆直径。这说明CQDs的负载增强了材料迁移和分离载流子的效率,光生电子更容易发生跃迁,进而可提高材料催化活性;同时也进一步说明CQDs与g-C3N4之间存在化学键使电子可以在两相间实现转移。图6(b)反映了纯g-C3N4和10%CQDs/g-C3N4的光响应电流。二者均具有快速的光电流响应,10%CQDs/g-C3N4的响应值明显高于纯g-C3N4,这说明10%CQDs/g-C3N4对载流子的分离效率更高[22],更有利于光催化反应中载流子的参与。
-
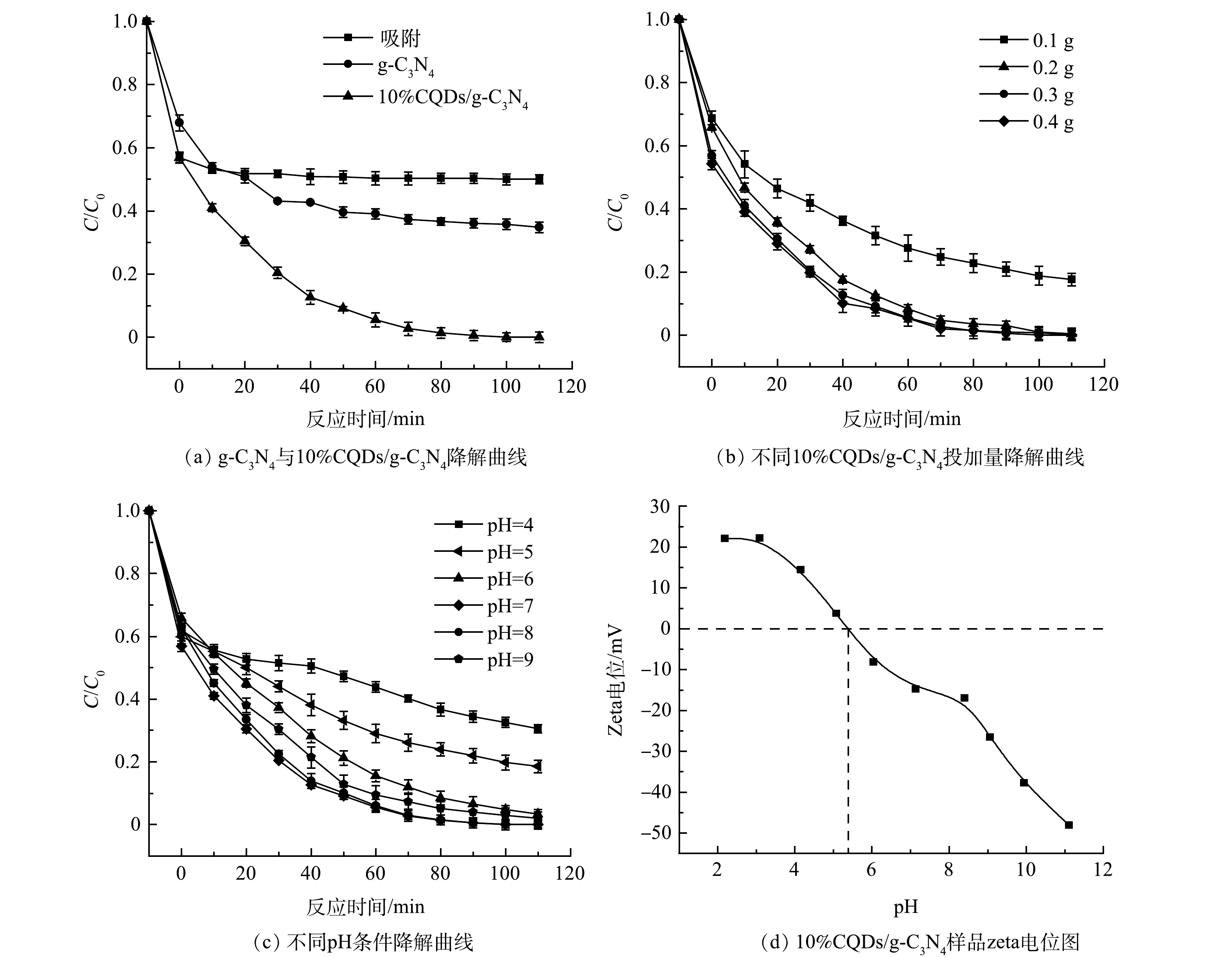
图7(a)为300W氙灯照射下0.3 g纯g-C3N4和10%CQDs/g-C3N4对10 mg·L−1盐酸四环素的降解效率。在可见光照射下,纯g-C3N4对盐酸四环素具有一定的降解效果,光照110 min时降解率达到45.46%;而CQDs/g-C3N4复合材料对盐酸四环素的降解效果明显高于纯g-C3N4,光照110 min时对盐酸四环素的降解率为99%。以上结果说明CQDs的引入提高了复合材料的光催化活性。
在室温条件下,探究了10%CQDs/g-C3N4的投加量对降解10 mg·L−1盐酸四环素的影响。如图7(b)所示,投加0.1、0.2、0.3和0.4 g的催化剂在避光状态下对盐酸四环素的去除率分别为31.2%、34.2%、43.2%和45.8%。当催化剂投加量为0.1 g时,10%CQDs/g-C3N4在光照110 min后对盐酸四环素的去除率为82%;当增加10%CQDs/g-C3N4投加量时,去除率也明显提升,这是因为催化剂的增加为光催化反应提供了更多的活性点位。催化剂投加量为0.3 g时,去除率提升到99%;当投加量继续增加至0.4 g时,去除率降解率接近100%。考虑到经济因素,选取0.3 g 作为10%CQDs/g-C3N4光催化剂的最佳投放量。
反应体系的pH可在一定程度上影响目标污染物和催化剂表面的带电情况、二者之间的相互作用关系以及活性物质的形成。本研究在pH为4~9时,考察了pH对0.3 g 10%CQDs/g-C3N4光催化降解盐酸四环素的影响。随着pH的升高,10%CQDs/g-C3N4对盐酸四环素的去除率逐渐增大,在pH为7时达到最大,随后随着pH的升高而降低。因此,本研究中最佳pH为7。
如图7(d)所示,测得10%CQDs/g-C3N4复合材料在不同pH条件下的Zeta电位,得到材料等电点为5.4。当溶液中pH低于催化材料的等电点时,催化剂材料表面带正电荷,反之则带负电荷。四环素的pKa1=3.3、pKa2=7.7、pKa3=9.7,当3.3<pH<7.7时,溶液中的四环素以两性离子形态存在[23]。因此,当催化剂与四环素带异种电荷时,二者之间相互吸引,可提高对污染物的去除效率[24],在pH=7时四环素去除率达到最大;另一方面,在酸性条件下,H+浓度的增大,会抑制·OH的形成,从而不利于光催化反应的进行。
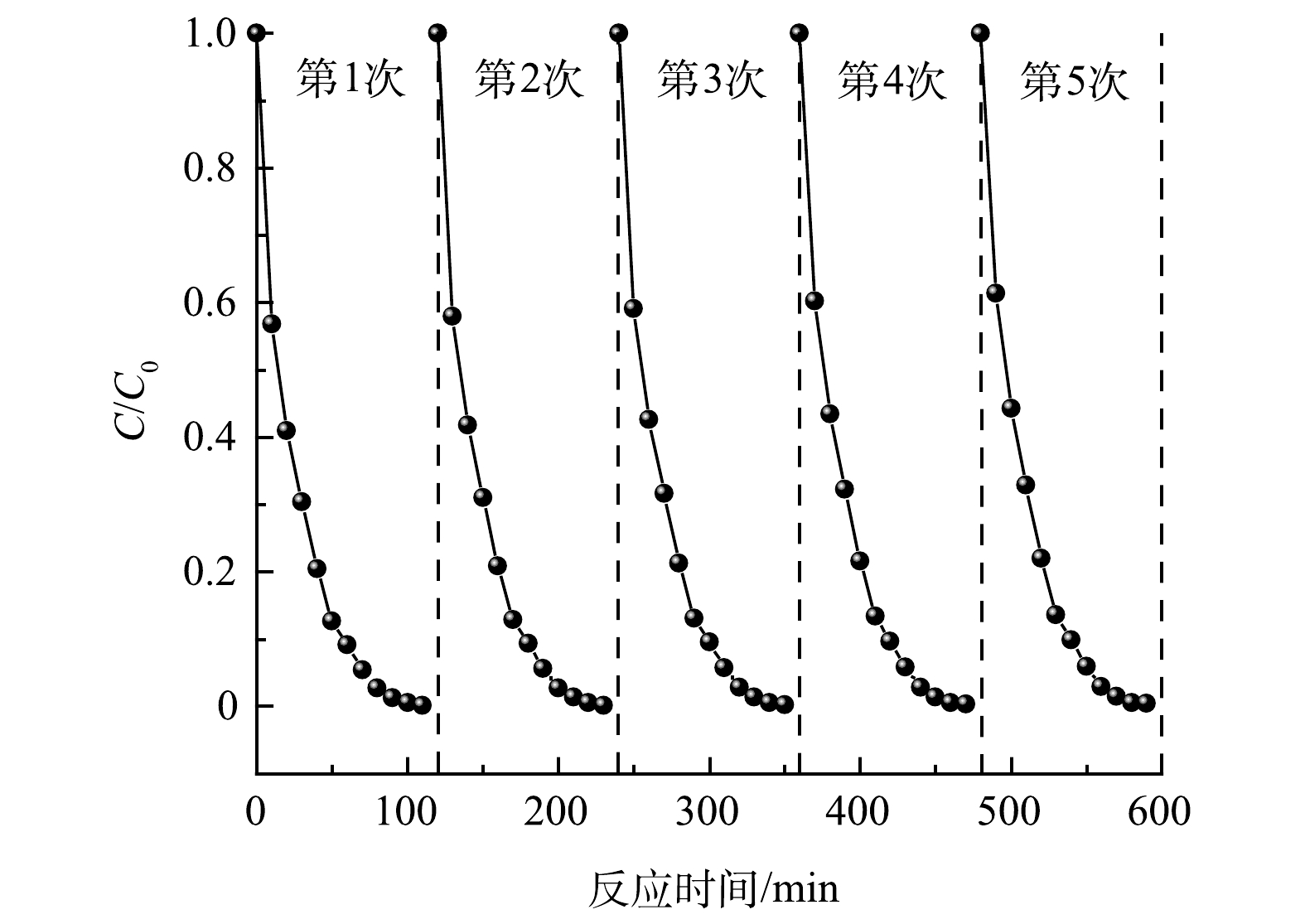
催化剂材料的稳定性和可重复利用性是影响其实际应用的一项重要因素,因此,对10%CQDs/g-C3N4材料进行了循环实验,共重复光催化降解盐酸四环素实验5次。每次实验后回收催化剂用超纯水反复冲洗,并在60 ℃条件下烘干供下一次循环实验使用。由图8可以看出,10%CQDs/g-C3N4在5次循环光催化实验中对盐酸四环素均表现出良好的降解性能,降解率由99%下降至97%,且这一过程中催化剂基本无损耗。因此,10%CQDs/g-C3N4具备良好的稳定性和可重复利用性。
-
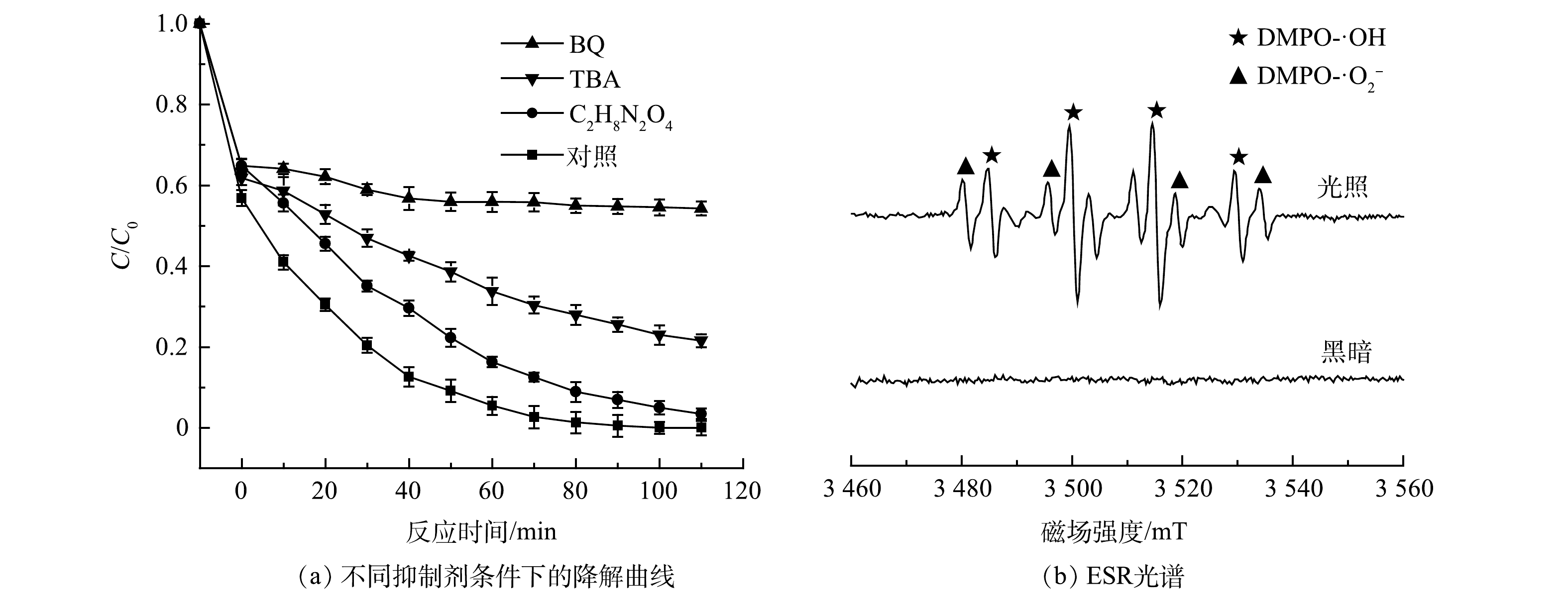
在光催化降解有机物的反应过程中,催化剂表面产生具有氧化性的自由基活性物质,如空穴(h+)、羟基自由基(·OH)以及超氧自由基(·O2−),与污染物发生反应将其氧化[25]。为探究10%CQDs/g-C3N4复合材料光催化降解盐酸四环素反应中起主要作用的活性物质,在实验过程中分别加入250 mmol·L−1草酸铵、叔丁醇和对苯醌作为抑制剂,观察对降解盐酸四环素的影响。如图9(a)所示,对苯醌的加入对盐酸四环素的降解并未产生明显影响,光照110 min后最终去除率为91%,草酸铵的加入使得去除率下降到70%,而叔丁醇对于光催化降解的抑制作用十分显著,最终去除率仅为50%。由此可以推断,·OH在10%CQDs/g-C3N4光催化降解盐酸四环素反应中为主要活性物质。
为了进一步探究10%CQDs/g-C3N4复合材料光催化反应机理,进行了电子自旋共振(ESR)测试。如图9(b)所示,黑暗状态下没有检测到ESR信号;光照条件下可看到明显的DMPO-·OH和DMPO-·O2−信号。其中DMPO-·OH特征信号峰相对强度为1∶2∶2∶1,DMPO-·O2−特征信号峰相对强度为1∶1∶1∶1。这说明在光照条件下反应体系中同时产生了·OH和·O2−。根据上述活性物种捕获实验和ESR分析的结果,推断·OH在10%CQDs/g-C3N4的光催化反应中起主要作用[26]。此外,·OH的产生与h+密切相关。因此,可以认为CQDs/g-C3N4材料光催化反应由·OH与h+主导。
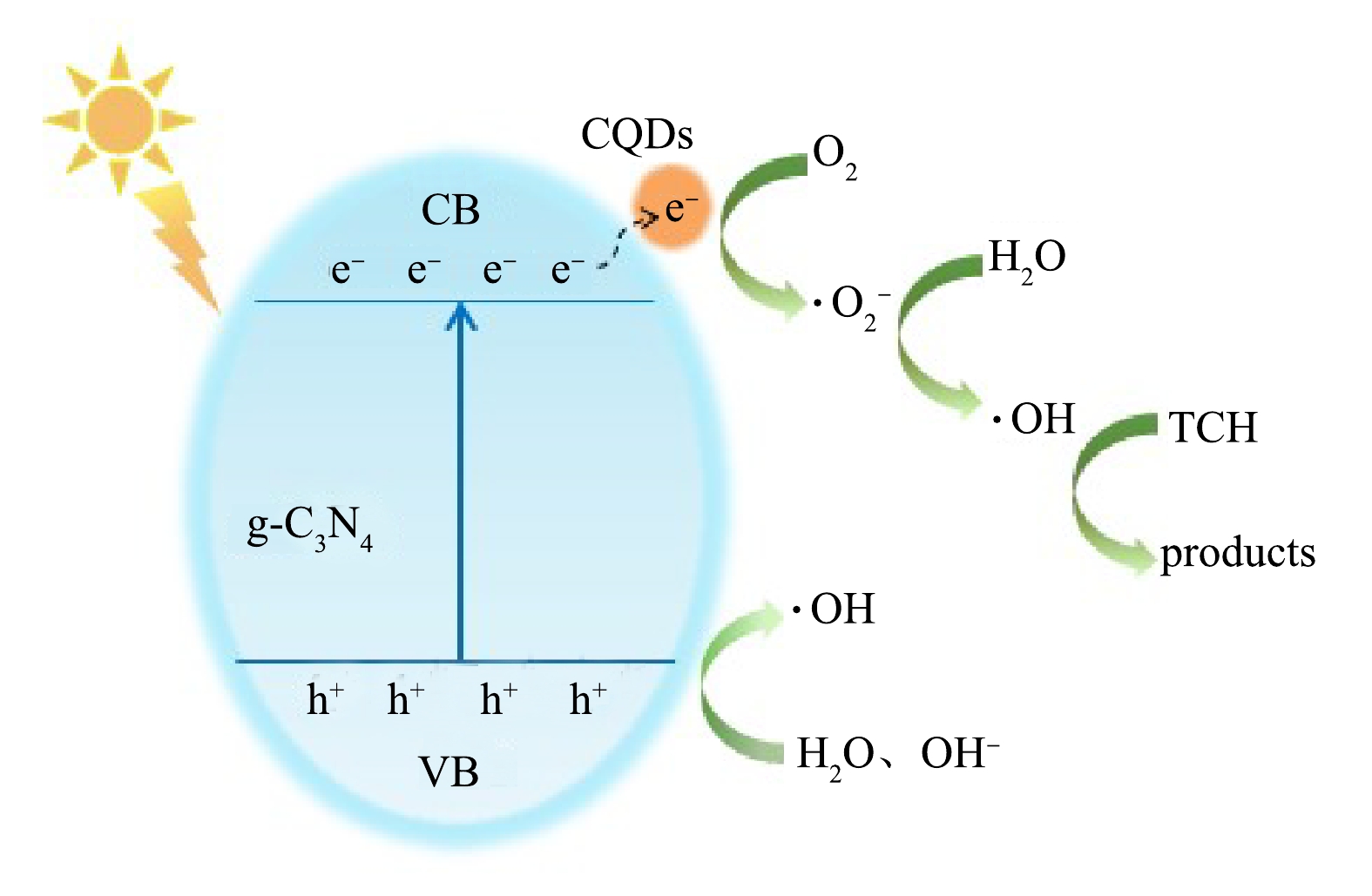
图10为CQDs/g-C3N4复合材料光催化降解机理示意图。可见,在可见光照射下,当入射光能量大于催化剂材料的禁带宽度时,光生电子(e−)被激发,从价带(VB)跃迁至导带(CB),同时价带上产生具有强氧化性的光生空穴(h+)。碳量子点能够捕获电子,有效抑制光生载流子与空穴的复合[27],此外,碳量子点的引入可以在两相间形成共轭π键,增强电子迁移能力。CQDs上的e−与材料表面的吸附氧发生还原反应生成·O2−,·O2−将H2O氧化生成·OH[28];另一方面,光生空穴与H2O、OH−发生氧化反应生成·OH,·OH具有强氧化性,能够将盐酸四环素氧化降解。
-
1)与纯g-C3N4相比,CQDs/g-C3N4可见光吸收范围更宽,光催化效率明显提高,光照110 min后10%CQDs/g-C3N4对盐酸四环素的去除率达到99%。
2) 10%CQDs/g-C3N4光催化剂最佳投放量为0.3 g,最适pH为7。在此条件下其稳定性和可重复利用性均较好。
3) CQDs/g-C3N4参与的光催化反应是由·OH和h+主导的,CQDs的引入提高了载流子迁移和分离效率,从而提高了材料的光催化活性。
CQDs/g-C3N4的制备及其光催化降解四环素性能
Synthesis of CQDs/g-C3N4 for visible light photocatalytic degradation of tetracycline
-
摘要: 以三聚氰胺为原料,通过煅烧制得石墨相氮化碳(g-C3N4),以柠檬酸和尿素作为碳量子点(CQDs)的碳源,采用水热法制备出CQDs/g-C3N4复合光催化材料。通过FESEM、FETEM、XRD、XPS、UV-vis对材料的形貌结构进行了表征,研究了其在可见光下降解盐酸四环素性能和机制。结果表明,CQDs的负载增强了材料的可见光吸收,提高了材料的光催化活性。在催化剂的投放量为0.3 g,pH=7的最适光催化反应条件下,光照110 min后,CQDs/g-C3N4复合材料对盐酸四环素的降解率达到99%。此外,CQDs/g-C3N4复合材料具有较高的稳定性和可重复利用性。CQDs/g-C3N4复合材料光催化反应是由·OH与h+主导的,CQDs的引入提高了载流子迁移和分离效率,从而提高了材料光催化降解盐酸四环素效率。Abstract: Graphite phase carbon nitride (g-C3N4) was synthesized by calcination of melamine, carbon quantum dots (CQDs) were prepared from citric acid and carbamide. Then the CQDs/g-C3N4 composite photocatalytic materials were prepared by hydrothermal method. The morphology and structure of these materials were characterized by FESEM, FETEM, XRD, XPS and UV-VIS. Then, the performance and mechanism of tetracycline hydrochloride degradation by CQDs/g-C3N4 in visible light were studied. The results showed that CQDs loading enhanced the visible light absorption and photocatalytic activity of the materials. Furthermore, the degradation rate of the tetracycline hydrochloride in aqueous solution by CQDs/g-C3N4 reached 99% after 110 min visible light irradiation at CQDs/g-C3N4 dosage of 0.3 g and pH=7. In addition, CQDs/g-C3N4 composite material had good stability and recycling ability. The photocatalytic reaction of CQDs/g-C3N4 composite material was dominated by ·OH and H+, and the introduction of CQDs helped the migration and separation of the carriers, thereby improving the efficiency of the photocatalytic degradation of tetracycline hydrochloride.
-
Key words:
- CQDs /
- g-C3N4 /
- photocatalytic materials /
- photocatalytic mechanism
-
水质生物毒性检测作为传统理化检测方法的补充,不仅能快速检测出水中是否含有毒性污染物,同时还可反映多种有毒物和污染物的综合毒性[1-2]。目前,用于水质生物毒性检测的生物传感器主要利用有毒物或污染物对不同营养级的指示生物(发光细菌、藻类、溞类、大型无脊椎动物和鱼类等)的呼吸作用、生长发育或运动能力的抑制效应来进行检测[2]。其中较高营养级的指示生物更能反映有毒物或污染物对环境质量的影响程度,但其检测成本较高、耗时也较长且需要专业的生物培养技能与装置,这导致该类群指示生物在实际应用时限制性较大;低营养级的指示生物特别是发光细菌因灵敏度高、响应快且生长周期短已被广泛用于水质生物毒性检测,但发光细菌中应用最多的费氏弧菌(Vibrio fischeri)和明亮发光杆菌(Photobacterium phosphoreum)实为海洋细菌,其生长需在含盐的溶液中,且溶液的浊度和色度会影响检测精度,这也同样限制了其在淡水生境中的广泛应用[3]。因此,寻找一种快速、灵敏、抗干扰能力强且低成本的新型生物毒性传感器成为了现实所需。
近年兴起的微生物燃料电池(microbial fuel cell, MFC)型生物毒性传感器以阳极电活性细菌(Geobacter spp.、Shewanella spp.和Pseudomonas spp.等)为指示生物,当阳极无毒性污染物存在时,电活性细菌通过催化分解有机底物产生电子,电子由胞外电子传递过程转移至阳极,再经电池外电路到达阴极形成稳定电流;当阳极有毒性污染物存在时,电活性细菌的活性或胞外电子传递受到抑制,导致MFC型生物毒性传感器产生的电流降低,通过检测有毒污染物存在时电池产电量的变化则可定量反映水质生物毒性[4-7]。该传感器具有灵敏、抗干扰能力强、无需外加能源、稳定和可自我修复等特点,已被用于检测BOD、COD、挥发性脂肪酸、重金属、氰化物、甲醛和抗生素等[4-7]。然而,目前关于MFC型生物毒性传感器用于检测农药的研究报道较少。KIM等[8]于2007年最早发现,当MFC型生物毒性传感器以1.0 mg·L−1有机磷农药(二嗪磷)为检测物时,所产生的电量降幅高达61%。2012年,王博等[9]利用MFC型生物毒性传感器构建出一套水质生物毒性预警系统,并成功预警了由强降雨导致自来水厂取水区域内农药倒灌引发的饮用水污染事件。2019年,CHOULER等[10]发现,0.3 mg·L−1三嗪类除草剂(莠去津)可使MFC型生物毒性传感器的回路电流下降12%。这些研究结果均表明,MFC型生物毒性传感器可对含农药污水产生毒性响应,但因农药种类多,来源复杂,再加上MFC型生物毒性传感器对不同农药检测的研究匮乏,进而导致MFC型生物毒性传感器检测农药的相关应用极为有限。
为探究MFC型生物毒性传感器对农药污染物的检测性能,本文研究了MFC型生物毒性传感器对溴氰菊酯(菊酯类杀虫剂)、敌百虫(有机磷杀虫剂)、百菌清(有机氯类杀菌剂)、莠去津(三嗪类除草剂)和烟嘧磺隆(磺酰脲类除草剂)5种典型农药检测的剂量-效应关系,评估了MFC型生物毒性传感器中毒后的自我修复能力,并对不同混合农药的生物毒性进行了检测与对比研究。
1. 材料与方法
1.1 实验装置
实验装置为双室圆柱立方体MFC型生物毒性传感器,材料为有机玻璃,双室中间以阳离子交换膜(CMI-7000 Membranes International,Glen Rock,NJ,USA)隔开,单室内径为3.0 cm,长为4.0 cm,阳极室和阴极室均填充满0.5 cm
⊆ ⊆ 1.2 装置启动和实验试剂
MFC型生物毒性传感器启动时,以南昌市朝阳污水处理厂氧化沟末端污泥作为阳极菌源,将阳极培养基与污泥等体积混合加入阳极室。阳极培养基参照检测有机磷杀虫剂(二嗪磷)的MFC型生物毒性传感器,以0.2 g·L−1葡萄糖为碳源,其他营养物质以及磷酸缓冲液的组成和浓度参考文献[8]。阴极室为氧饱和的50 mmol·L−1磷酸缓冲液(pH=6.8)。阳极液和阴极液均由蠕动泵周期泵入,流速为6.0 mL·min−1,周期为10 min(包括进样3 min和反应7 min)。待输出电压稳定后,将阴、阳电极与100 Ω电阻串联,待输出电压再次稳定后开始实验,输出电压稳定的判定依据为当前周期的平均输出电压与前5个周期的平均输出电压的差异小于5%。
实验所用的5种典型农药分别为25 g·L−1溴氰菊酯(拜耳作物科学有限公司,浙江)、90%敌百虫(沙隆达股份有限公司,湖北)、75%百菌清(利民化工股份有限公司,浙江)、38%莠去津(长青生物科技有限公司,江苏)和40 g·L−1烟嘧磺隆(长青生物科技有限公司,江苏),所有试剂均以去离子水配制。
1.3 农药生物毒性检测
为了得到MFC型生物毒性传感器检测不同农药的剂量-效应曲线,设置溴氰菊酯的质量浓度分别为0.005、0.05、0.10、0.20、0.30 mg·L−1,敌百虫的质量浓度分别为0.05、0.10、0.20、0.30、0.40 mg·L−1,百菌清的质量浓度分别为0.01、0.05、0.10、0.20、0.30 mg·L−1,莠去津的质量浓度分别为0.003、0.005、0.01、0.03、0.05 mg·L−1,烟嘧磺隆的质量浓度分别为0.01、0.05、0.10、0.20、0.30 mg·L−1。在检测毒性时,将阳极培养基和农药混合作为阳极液,每个浓度连续测试5个周期(50 min),以5个周期内最大产电抑制率(coulombic yield inhibition ratio, Ic)作为传感器对农药生物毒性的响应值,每个样品测试3次,最后拟合Ic与农药浓度,并计算引起10% Ic所对应的农药浓度[11]。毒性检测结束后,将阳极液改为单纯的阳极培养基,以使阳极微生物恢复活性,并记录MFC型生物毒性传感器的输出电压恢复至稳定所需的时间。2次测样之间应保证传感器有24 h的恢复时间[6]。
3种混合农药的设置方法如下:混合农药A为2种杀虫剂和1种杀菌剂混合,即0.005 mg·L−1溴氰菊酯+0.05 mg·L−1敌百虫+0.01 mg·L−1百菌清;混合农药B为2种除草剂混合,即0.003 mg·L−1莠去津+0.05 mg·L−1烟嘧磺隆;混合农药C为混合农药A+混合农药B。
1.4 测量与计算
极化曲线和功率密度利用电阻为10~99 999.9 Ω的电阻箱测试,由高到低依次调整MFC型生物毒性传感器外电阻,每次调整后稳定120 min,外电阻两端的电压(输出电压)使用数据采集卡(PISO-813, 研华科技有限公司,中国台湾)连续采集,以连续稳定的3个周期的平均电压作为相应外阻条件下的输出电压,回路电流利用欧姆定律计算,电流密度利用式(1)计算,功率密度利用式(2)计算,电流密度和功率密度均相对于阳离子交换膜几何面积。
stringUtils.convertMath(!{formula.content}) (1) stringUtils.convertMath(!{formula.content}) (2) 式中:I为电流,A;U为外电阻两端的电压,V;R为外电阻,Ω;S为阳离子交换膜几何面积,m2;P为功率密度,W·m−2。
产电抑制率为待测水样(含农药的阳极液)进入MFC型生物毒性传感器前后产电量的差值与待测水样进入MFC型生物毒性传感器前的产电量之比,用以表示待测水样的生物毒性,计算公式如式(3)所示[6,8]。
stringUtils.convertMath(!{formula.content}) (3) 式中:Ic为产电抑制率;Q0为待测水样进入MFC型生物毒性传感器前5个周期的平均产电量,C;Q为待测水样进入MFC型生物毒性传感器后1个周期的产电量,C。
2. 结果与讨论
2.1 微生物燃料电池型生物毒性传感器的启动和性能
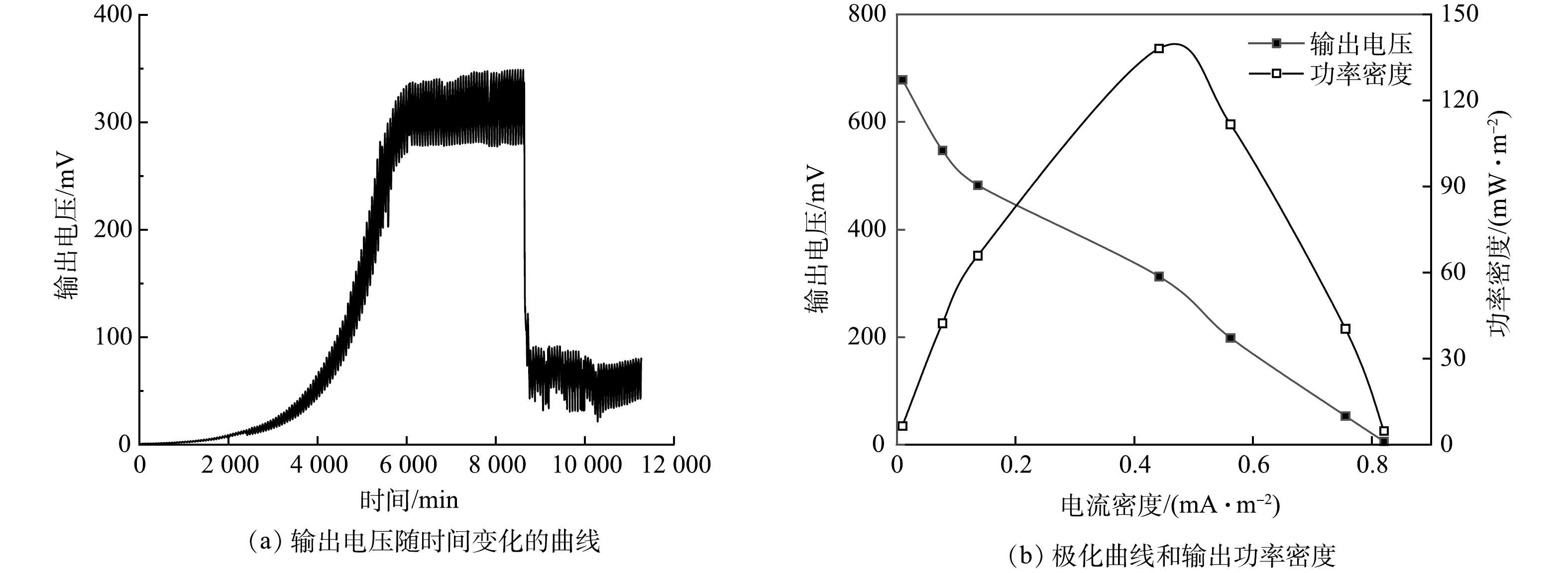
MFC型生物毒性传感器在启动时,外接电阻为1 000 Ω,在接种7 d后,输出电压稳定在(312±36) mV,回路电流为(0.31±0.04) mA(图2(a))。前期研究[12-13]已表明,外接电阻的大小可显著影响MFC型生物毒性传感器的检测性能。在外电阻为50~3 000 Ω时,MFC型生物毒性传感器对Cu(II)的毒性响应值随外电阻的降低先增后减,在外电阻约100 Ω时最大[12]。同样,在MFC型生物毒性传感器检测十二烷基硫酸钠时,在100 Ω外电阻下的毒性响应值远高于1 000 Ω外电阻[13]。因此,本研究为了获得更好的农药检测性能,以100 Ω作为实验时的电阻值。当外接电阻由1 000 Ω改变为100 Ω后,经过2 d的运行,输出电压稳定至(57±22) mV,回路电流为(0.57±0.22) mA(图2(a)),这表明MFC型生物毒性传感器已成功启动。
成功启动后,测试MFC型生物毒性传感器的极化曲线和输出功率(图2(b)),发现回路电流密度为0.44 A·m−2时,输出功率密度最大,为138 mW·m−2,远小于检测BOD的MFC型生物传感器的最大输出功率密度897 mW·m−2[5]。导致该现象的可能原因是,本研究中碳源的质量浓度(0.2 g·L−1)远低于检测BOD传感器的1.282 g·L−1,而使用MFC型生物毒性传感器在检测污染物生物毒性时,低浓度的碳源对应更高的毒性响应值[14]。
2.2 5种典型农药生物毒性的检测
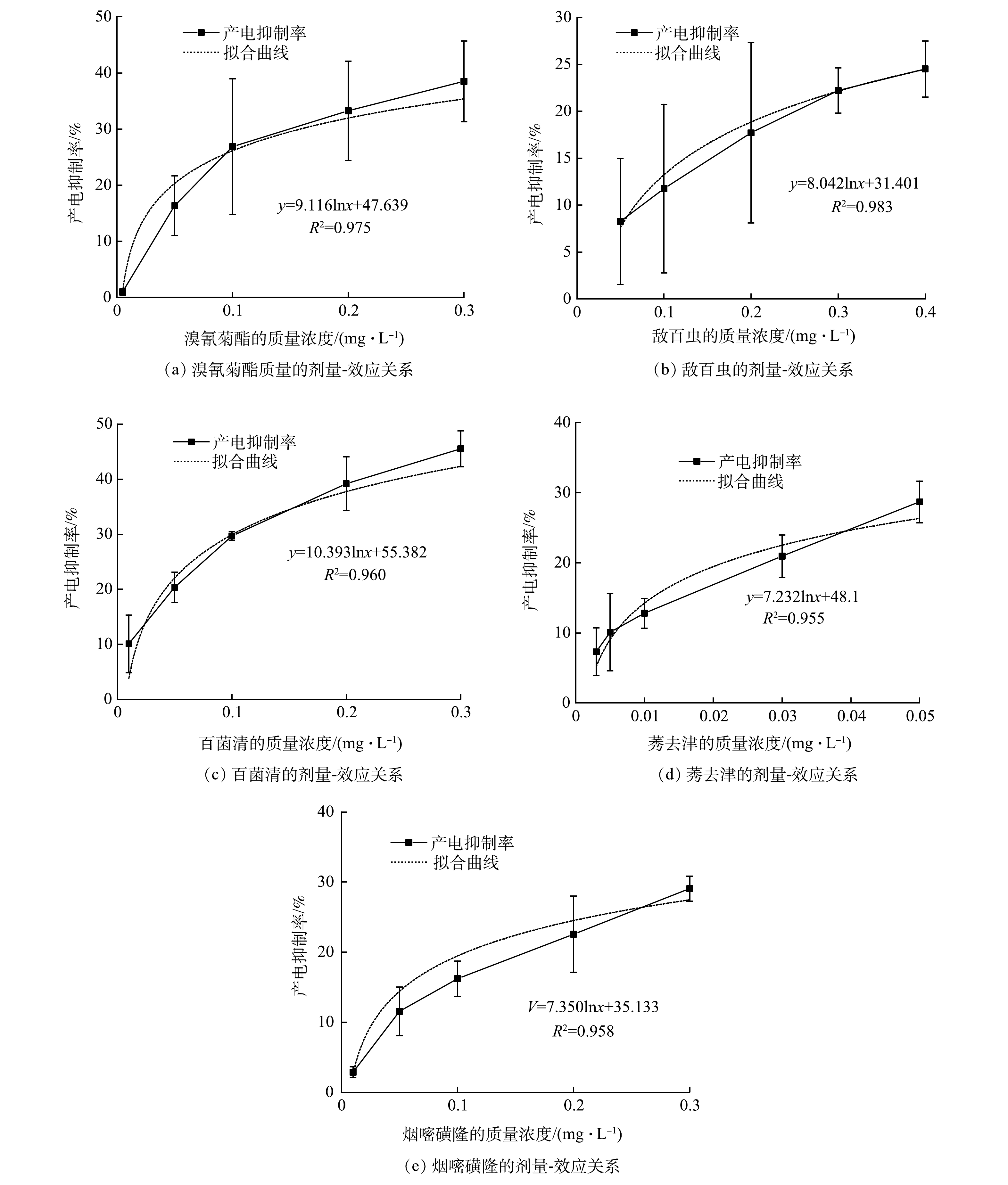
MFC型生物毒性传感器对溴氰菊酯(图3(a))、敌百虫(图3(b))、百菌清(图3(c))、莠去津(图3(d))和烟嘧磺隆(图3(e)) 5种典型农药均有明显的毒性响应(产电抑制率表示为Ic),且Ic随农药浓度增加而增加。当溴氰菊酯的质量浓度为0.005~0.3 mg·L−1时,Ic为(1.0±0.6)%~(38.5±7.2)%;当敌百虫的质量浓度为0.05~0.4 mg·L−1时,Ic为(8.3±6.7)%~(24.5±3.0)%;当百菌清的质量浓度为0.01~0.3 mg·L−1时,Ic为(10.1±5.2)%~(45.5±3.3)%;当莠去津的质量浓度为0.003~0.05 mg·L−1时,Ic为(7.3±3.4)%~(28.7±3.0)%;当烟嘧磺隆的质量浓度为0.01~0.3 mg·L−1时,Ic为(2.9±0.8)%~(29.1±1.8)%。
剂量-效应关系是毒理学的重要概念,通过剂量与效应的线性非阈值模型或阈值模型可对有毒污染物的毒性进行预测和外推。在MFC型生物毒性传感器中,Ic与污染物浓度的线性非阈值模型和阈值模型分别对应线性关系和对数关系[12]。由图3(a)~3(e)可以看出,Ic与农药浓度更符合阈值模型。为了获得10% Ic对应的农药浓度,拟合Ic与农药浓度的对数(图3(a)~3(e))。从5个拟合方程可看出,Ic与溴氰菊酯、敌百虫、百菌清、莠去津和烟嘧磺隆浓度的对数均呈良好的线性关系,可决系数(R2)分别为0.975、0.983、0.960、0.955和0.958。依据如上5个不同拟合方程,溴氰菊酯、敌百虫、百菌清、莠去津和烟嘧磺隆诱导10% Ic时的质量浓度分别为0.016、0.070、0.013、0.005、0.033 mg·L−1,这些质量浓度与GB 3838-2002地表水环境质量标准集中式生活饮用水源地中溴氰菊酯(0.02 mg·L−1)、敌百虫(0.05 mg·L−1)、百菌清(0.01 mg·L−1)、莠去津(0.003 mg·L−1)的质量浓度限值非常接近[15]。以上结果表明MFC型生物毒性传感器可用于预警水环境的低浓度农药污染。
此外,与其他不同营养级指示生物的水质生物毒性检测方法对比,发现莠去津的质量浓度达到15.2 mg·L−1才能使斑马鱼的死亡率达到10%[16],烟嘧磺隆的质量浓度超过1.17 mg·L−1才可使大型溞的急性活动抑制率达10%[17],百菌清的质量浓度达到4.3 mg·L−1时才使微藻(Skeletonema costatum)的96 h荧光抑制率达10%[18],而敌百虫的质量浓度需高达1 452 mg·L−1时才能对明亮发光杆菌(P. phosphoreum)产生10%的发光抑制率[19-20]。另外,HERNANDO等[21]以费氏弧菌(V. fischeri)为指示生物检测莠去津和溴氰菊酯时,发现莠去津的质量浓度升高至6 mg·L−1仍未观察到抑制作用,溴氰菊酯的质量浓度高达5 mg·L−1才可产生30%的发光抑制率。这些产生10%抑制效应的农药质量浓度均远高于本研究所得的结果,表明MFC型生物毒性传感器相比传统的生物毒性传感器对这5种典型农药的检出限更低。
2.3 微生物燃料电池型生物毒性传感器自我恢复能力的评价
为了使MFC型生物毒性传感器在实际预警水质污染时能长期稳定运行,要求阳极微生物在中毒后能快速并完全恢复活性[6,13,22]。本研究在检测每种农药后,通过向阳极连续注入新鲜无农药营养液的方式使阳极微生物快速恢复活性。在这个过程中,残留在阳极的农药被稀释和排出,部分未被排出的农药通过阳极微生物的代谢作用降解消除[10],同时,受损的微生物利用营养液修复繁殖并再生阳极微生物膜[23]。
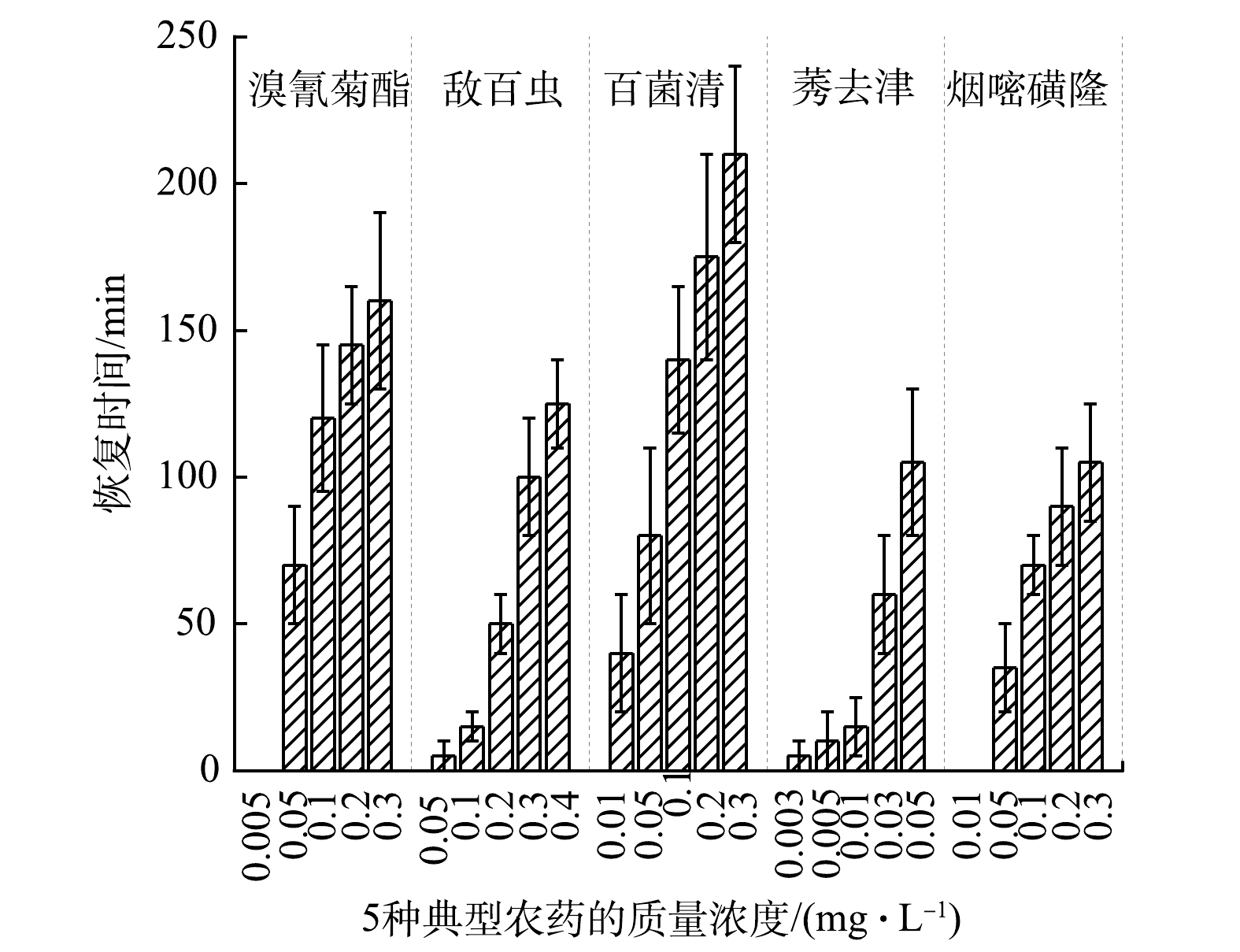
MFC型生物毒性传感器在检测这5种典型的农药后,输出电压恢复稳定的时间均随农药浓度的增加而延长(图4)。其中检测百菌清后的恢复时间明显高于其他农药。导致该现象的可能原因是:在检测百菌清时MFC型生物毒性传感器的Ic更大(图3),即电活性细菌的活性受抑制最严重,恢复所需的时间更长。这与KIM等[8]用MFC型生物毒性传感器检测高浓度有机磷杀虫剂(1 mg·L−1二嗪磷, Ic: 61%)时,恢复时间(10 h)更长的结果一致。另外,由图4可看出,MFC型生物毒性传感器检测这5种典型农药后的恢复时间均在240 min内。这表明MFC型生物毒性传感器的阳极微生物被这5种农药抑制后可快速恢复活性。
实验中还观察到,这5种典型农药在较低浓度条件下,MFC型生物毒性传感器的输出电压可恢复至未染毒前的水平,而随着农药浓度的升高,输出电压的恢复时间逐渐加长,甚至不能恢复至未染毒前的水平。这表明,当5种典型农药在较低浓度时,对MFC型生物毒性传感器阳极微生物活性的抑制是可逆的,而在高浓度时是不可逆的。这与MFC型生物毒性传感器检测十二烷基硫酸钠[13]和甲醛[24]时,输出电压在低浓度下可恢复至染毒前水平,在高浓度下不能恢复至染毒前水平的结果一致。在高浓度条件下,农药会对阳极微生物代谢过程中酯酶的磷酸化产生不可逆的影响[8],从而导致微生物活性受到不可逆的抑制。
在预警高浓度农药污染时,为了使MFC型生物毒性传感器能长期稳定在线监测,当部分阳极微生物发生不可逆失活时,可通过延长恢复时间使生物活性恢复至初始水平。如LI等[23]在利用MFC型生物毒性传感器检测0.1%甲醛时,发现阳极微生物部分失活,输出电压只能恢复到初始60%的水平,通过更换阳极液并延长恢复时间至33 h,可使阳极微生物再生,输出电压恢复至初始水平,且再次检测时获得了可重复的毒性响应;当全部阳极微生物发生不可逆失活时,可利用多个MFC型生物毒性组成的平行传感器组,及时更换失活的传感器[6]。
2.4 不同混合农药生物毒性的检测
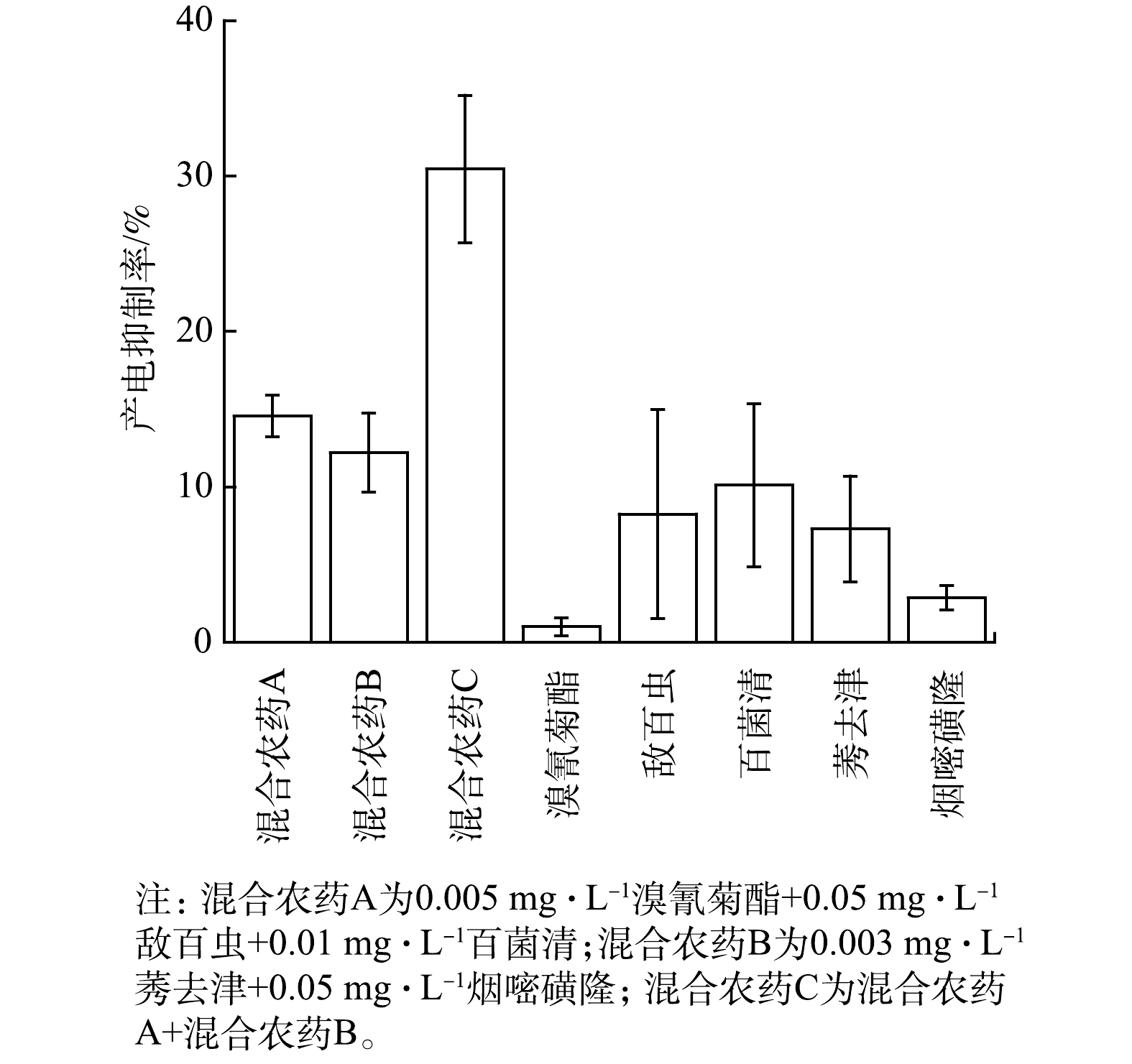
MFC型生物毒性传感器检测混合农药A和混合农药B的Ic分别为(14.6±1.3)%和(12.2±2.5)%,均高于各单一农药的毒性响应(图5),表明混合农药比单一农药具有更强的生物毒性。这与文献中报道的使用混合农药增强药效的现象类似。例如,敌百虫或溴氰菊酯与有机磷杀虫剂混合可增强杀虫作用[25-26],莠去津和烟嘧磺隆混合可提高灭藻效果[27]。进一步将混合农药A和B混合,得到含这5种典型农药的混合农药C,检测得Ic为(30.5±4.7)%(图5),该响应值高于这5种典型农药单一条件时的Ic之和,表明这5种典型农药通过协同作用强化了混合农药的联合毒性。这可能与莠去津可强化有机磷杀虫剂杀虫效果的现象类似[28]。混合农药C中的莠去津可通过增加阳极微生物细胞膜的通透性,促使更多农药进入细胞,从而导致更强的生物毒性。以上这些结果表明,在这5种典型农药浓度满足GB 3838-2002中集中式生活饮用水源地水质要求时,MFC型生物毒性传感器对以这5种典型农药所配制的不同混合农药均有明显的毒性响应。这说明该型生物毒性传感器具有检测低于集中式生活饮用水源地水质标准的混合农药生物毒性的能力,可弥补传统理化检测方法只能检测单一农药浓度不能反应混合农药综合毒性的不足,适用于预警水源地多种农药的混合污染。
MFC型生物毒性传感器在检测毒性污染物时,短期高浓度或长期低浓度染毒基本不改变阳极微生物菌群的组成,但电活性菌的相对丰度通常会降低[29-32]。XING等[29]发现,MFC型生物毒性传感器在检测高质量浓度Cu(II)(10 mg·L−1)、2,4-二氯苯酚(1 000 mg·L−1)或吡啶(1 000 mg·L−1)1次后,阳极微生物菌群组成基本无变化,电活性菌Geobacter、Azoarcus、Arcobacter和Desulfovibrio的相对丰度明显降低。长期低浓度染毒也有类似现象。例如,ZHOU等[32]用1.5 mmol·L−1呼吸链抑制剂叠氮化物使MFC阳极染毒13个月后,发现阳极微生物菌群结构未明显改变,优势菌仍为Geobacter和Ignavibacterium。长期高浓度染毒可改变阳极微生物菌群的结构。MFCs阳极经高质量浓度农药硝磺草酮(50 mg·L−1)、吡唑醚菌酯(30 mg·L−1)、乙氧氟草醚(50 mg·L−1)和异丙甲草胺(8 mg·L−1)染毒20~180 d后,阳极优势菌由电活性菌变为能够降解这些农药的微生物[33-36]。本研究中,MFC型生物毒性传感器阳极检测的农药质量浓度较低(<0.5 mg·L−1),染毒时间短(约50 min·d−1)且染毒后均在240 min内恢复。因此,可推测MFC型生物毒性传感器在检测这5种典型农药后,阳极微生物菌群的组成可能未发生变化,仅电活性菌相对丰度有所降低,经新鲜阳极液冲洗后可再生恢复。
传统生物传感器检测农药的原理归为2点:一是利用微生物的代谢作用,将农药作为底物检测;二是利用微生物的呼吸作用,将农药作为呼吸抑制剂检测[22,37]。利用MFC型生物毒性传感器检测农药时,阳极微生物的响应机制目前尚不清楚。在MFCs中,多种农药如六氯苯、涕滴伊、硝磺草酮、异丙甲草胺、吡唑醚菌酯、乙氧氟草醚和莠去津等已被证实可作为底物通过阳极微生物的共代谢作用降解[33-36,38-39]。这表明MFC型生物毒性传感器的阳极微生物可能通过代谢作用对农药产生响应。此外,农药种类多且不同农药产生生物毒性的机制不同,因此,MFC型生物毒性传感器的阳极微生物对不同农药的响应机制可能有所不同。KIM等[8]利用MFC型生物毒性传感器检测有机磷农药(二嗪磷)时,推测二嗪磷是通过抑制阳极微生物代谢过程中酯酶的磷酸化,直接引起响应。而CHOULER等[10]利用MFC型生物毒性传感器检测三嗪类除草剂(莠去津)时,推测莠去津被吸附在阳极表面,通过阻碍有机底物向阳极电活性菌的传质,间接引起响应。因此,MFC型生物毒性传感器的阳极微生物对这5种典型农药的具体响应机制有待后续进一步研究。
3. 结论
1) MFC型生物毒性传感器对5种典型农药具有明显的毒性响应且检测限较低,溴氰菊酯、百菌清、敌百虫、莠去津和烟嘧磺隆的质量浓度分别低至0.016、0.070、0.013、0.005和0.033 mg·L−1时即可使传感器的Ic达到10%。
2) MFC型生物毒性传感器检测这5种典型农药后,阳极微生物可快速恢复活性,输出电压恢复稳定的时间随农药浓度增加而延长,基本可在240 min内恢复。
3)以5种典型农药所配制的不同混合农药的生物毒性明显高于单一农药,包含这5种典型农药且浓度满足集中式生活饮用水源地水质标准的混合农药的Ic,可达(30.5±4.7)%。
-
-
[1] RAJENDRAN R, VIGNESH S, SUGANTHI S, et al. g-C3N4/TiO2/CuO S-scheme heterostructure photocatalysts for enhancing organic pollutant degradation[J]. Journal of Physics and Chemistry of Solids, 2022, 161: 110391. doi: 10.1016/j.jpcs.2021.110391 [2] WU T F, HUANG J F, CHENG G, et al. Enhanced photocatalytic hydrogen evolution based on ternary noble-metal-free Co3O4/CdS/g-C3N4 composite[J]. Materials Letters, 2020, 292: 129274. [3] 杨婷婷, 陈星, 陈长斌, 等. CeO2/g-C3N4光催化-芬顿高效降解盐酸强力霉素[J]. 环境工程学报, 2021, 15(8): 2576-2587. doi: 10.12030/j.cjee.202103134 [4] WANG J, WANG G H, WANG X, et al. 3D/2D direct Z-scheme heterojunctions of hierarchical TiO2 microflowers/g-C3N4 nanosheets with enhanced charge carrier separation for photocatalytic H2 evolution[J]. Carbon, 2019, 149: 618-626. doi: 10.1016/j.carbon.2019.04.088 [5] 李钱. 助催化剂修饰g-C3N4光催化还原CO2的性能优化与机理研究[D]. 杭州: 浙江大学, 2020. [6] QIAN X B, PENG W, HUANG J H. Fluorescein-sensitized Au/g-C3N4 nanocomposite for enhanced photocatalytic hydrogen evolution under visible light[J]. Materials Research Bulletin, 2018, 102: 362-368. doi: 10.1016/j.materresbull.2018.02.056 [7] WANG H Q, SUN Z X, LI Q, et al. Surprisingly advanced CO2 photocatalytic conversion over thiourea derived g-C3N4 with water vapor while introducing 200–420 nm UV light[J]. Journal of CO2 Utilization. 2016, 14: 143-151. [8] 梁磊. 二氧化钛基光催化剂的制备及其降解性能研究[D]. 兰州: 兰州理工大学, 2021. [9] ZHANG J J, KUANG M, WANG J, et al. Fabrication of carbon quantum dots/TiO2/Fe2O3 composites and enhancement of photocatalytic activity under visible light[J]. Chemical Physics Letters, 2019, 730: 391-398. doi: 10.1016/j.cplett.2019.06.011 [10] 于子洋. 氧化锌和碳量子点基复合材料的制备及其气敏性能研究[D]. 长春: 吉林大学, 2020. [11] WANG W, NI Y R, XU Z Z. One-step uniformly hybrid carbon quantum dots with high-reactive TiO2 for photocatalytic application[J]. Journal of Alloys and Compounds, 2015, 622: 303-308. doi: 10.1016/j.jallcom.2014.10.076 [12] HU Z Z, XIE X Y, LI S, et al. Rational construct CQDs/BiOCOOH/uCN photocatalyst with excellent photocatalytic performance for degradation of sulfathiazole[J]. Chemical Engineering Journal, 2021, 404: 126541. doi: 10.1016/j.cej.2020.126541 [13] JIAN X, LIU X, YANG H M, et al. Construction of carbon quantum dots/proton-functionalized graphitic carbon nitride nanocomposite via electrostatic self-assembly strategy and its application[J]. Applied Surface Science, 2016, 370: 514-521. doi: 10.1016/j.apsusc.2016.02.119 [14] 吴茂. 多级氮化碳基催化剂的可控构筑及其光催化产氢性能研究[D]. 武汉: 中国地质大学, 2019. [15] MI G K, WAN-KUEN J. Visible-light-activated N-doped CQDs/g-C3N4/Bi2WO6 nanocomposites with different component arrangements for the promoted degradation of hazardous vapors[J]. Journal of Materials Science & amp; Technology, 2020, 40(5): 168-175. [16] HONG Y Z, MENG Y D, ZHANG G Y, et al. Facile fabrication of stable metal-free CQDs/g-C3N4 heterojunctions with efficiently enhanced visible-light photocatalytic activity[J]. Separation and Purification Technology, 2016, 171: 29-237. [17] ZHOU J R, TIAN Y F, WU X, et al. Visible light photochemical vapor generation using metal-free g-C3N4/CQDs composites as catalyst: Selective and ultrasensitive detection of mercury by ICP-MS[J]. Microchemical Journal, 2017, 132: 319-326. doi: 10.1016/j.microc.2017.02.016 [18] TANG C Y, LIU C, HAN Y, et al. Nontoxic carbon quantum dots/g-C3N4 for efficient photocatalytic inactivation of staphylococcus aureus under visible light[J]. Advanced Healthcare Materials, 2019, 8(10): 1801534. doi: 10.1002/adhm.201801534 [19] 周进, 丁玲, 张婷, 等. g-C3N4/CQDs光催化材料的制备及性能[J]. 精细化工, 2020, 37(4): 702-709. [20] KADI M W, MOHAMED R M, BAHNEMANN D W. MgFe2O4 decoration of g-C3N4 nanosheets to enhance CIP oxidation in visible-light photocatalysis[J]. Optical Materials, 2021, 121: 111598. doi: 10.1016/j.optmat.2021.111598 [21] INGRAM D B, LINICC S. Water splitting on composite plasmonic-metal/semiconductor photoelectrodes: evidence for selective plasmon-induced formation of charge carriers near the semiconductor surface[J]. Journal of the American Chemical Society, 2011, 133(14): 5202-5205. doi: 10.1021/ja200086g [22] CUI E T, LU G X. New evidence for the regulation of photogenerated electron transfer on surface potential energy controlled co-catalyst on TiO2–The investigation of hydrogen production over selectively exposed Au facet on Au/TiO2[J]. International Journal of Hydrogen Energy, 2014, 39(15): 7672-7685. doi: 10.1016/j.ijhydene.2014.03.010 [23] 郑凯. 改性氮化碳光催化材料的制备及其光催化性能研究[D]. 济南: 山东大学, 2021. [24] WANG H, WU Y, FENG M, et al. Visible-light-driven removal of tetracycline antibiotics and reclamation of hydrogen energy from natural water matrices and wastewater by polymeric carbon nitride foam.[J]. Water Research, 2018, 144: 215-225. doi: 10.1016/j.watres.2018.07.025 [25] 黄浩. Ultrathin g-C3N4/AgI异质结的原位构建及其光催化性能研究[D]. 大连: 大连理工大学, 2021. [26] ZHANG J, YUAN X Z, JIANG L B, et al. Highly efficient photocatalysis toward tetracycline of nitrogen doped carbon quantum dots sensitized bismuth tungstate based on interfacial charge transfer[J]. Journal of Colloid & Interface Science, 2018, 511: 296-306. [27] FENG S T, CHEN T, LIU Z C, et al. Z-scheme CdS/CQDs/g-C3N4 composites with visible-near-infrared light response for efficient photocatalytic organic pollutant degradation[J]. Science of the Total Environment, 2020, 704: 135404. doi: 10.1016/j.scitotenv.2019.135404 [28] 陈鸿毅, 华涛, 李冬梅, 等. IL/GO/88A的制备及其对四环素的光催化降解性能[J]. 环境工程学报, 2021, 15(6): 1862-1872. doi: 10.12030/j.cjee.202101127 -






 下载:
下载: