-
新疆维吾尔自治区南疆地区地处西北极端干旱沙漠区,近年来,随着该区农业生产水平不断提高,生产规模随之扩大,对水资源和氮磷资源的需求量呈逐年上升趋势。氮磷资源的大量使用,一方面致使氮磷资源短缺的问题不断加剧,另一方面诱发了各种各样的环境问题[1]。在农业生产过程中,畜牧业作为新疆南疆最具特色的传统基础产业之一,在蓬勃发展的同时,各种各样的问题也接踵而至。其中,养殖废水中污染物的不合理排放导致了该区资源的严重浪费和塔里木河流域的局部地区污染。养殖废水中含有大量氮、磷,若处置不恰当,将导致氮、磷资源的流失,加剧水体富营养化[2]。此外,土壤盐渍化也是南疆地区典型的环境问题之一,盐渍化土壤水相中富集大量盐分离子,主要包括K+、Ca2+、Na+、Mg2+、
CO2−3 、HCO−3 、SO2−4 、Cl− 8种离子[3],离子含量随地区变化呈现不同的分布特征,其中主要以氯化物或硫酸盐-氯化物为主[4]。由于南疆农田土壤盐分含量较高,需定期进行灌溉排盐才能满足植物的生长需要,这进一步导致了塔里木河中盐分离子的持续升高。因此,养殖废水的氮磷污染问题和高浓度的农田盐碱排水问题的双重叠加效应对南疆生态环境造成了极大的压力,亟需寻找一种既能够减少水体污染又能回收氮磷资源的有效方法。国内外对磷回收方式包括化学沉淀法和结晶法等传统方法,还有源分离技术[5]、吸附/解吸法[6]和滤池过滤回收法[7]等物化回收技术及生物质磷回收技术、膜生物反应器(membrane bio-reactor, MBR)工艺和强化生物除磷(enhanced biological phosphorus removal, EBPR)工艺等生物回收技术[8]以及最近研究聚焦的污泥回收磷技术[9-10]和纳米技术[11]等。每种方法均有各自的优缺点。吸附/解吸附法中常用的吸附剂有水化硅酸钙、明矾污泥等,但由于吸附剂吸附容量较小,存在毒理性危害,限制了吸附/解吸附法在回收磷方面的应用。另外,目前一些新兴吸附剂如改性生物炭等也逐渐引起了研究者的注意[12]。上述这些新兴技术大多处在研究阶段,回收成本较高,还未大规模使用[14]。相比之下,化学沉淀法具备迅速将高浓度磷酸盐去除回收的特点,当与其他工艺结合起来时,不仅有化学沉淀量大、沉淀效果好的特点,还具备其他工艺的优势[13-14]。鸟粪石沉淀法(MAP)又称磷酸铵镁沉淀法[15],是化学沉淀法的典型代表,作为一种成熟、可靠、高效的磷回收技术,近年来受到越来越多的关注。原理是将Mg、N、P按照一定摩尔比,在碱性环境下生成鸟粪石(MgNH4PO4·6H2O),以此来实现氨氮和磷的同步回收。该方法生成的目标产物是一种良好的氮磷缓释肥,被广泛应用于农业生产,可获得经济效益[16-19]。鸟粪石沉淀法的主要反应如式(1)~式(3)所示。
镁源是制约MAP沉淀法大规模使用的重要因素。常用的镁源主要是MgCl2、MgSO4、MgO等溶解性化合物[20-21],这些镁化合物造价较为昂贵,将其作为镁源会大大提高MAP沉淀法的成本。因此,寻求低成本镁源是提高MAP沉淀法经济效益的有效途径[22]。很多学者之前已经采用海水、苦卤水[23-25]作为廉价镁源回收磷,并取得了较好的回收效果。由于新疆南疆农田土壤盐渍化极其严重,排水中的盐分含量较高,总盐质量浓度高达3~4 g·L−1[26],这为养殖废水中氮磷回收提供了潜在的镁源。如果能够将其加以利用,不仅能够回收养殖废水中氮磷污染物并加以资源化,还能够有效降低排入水体中的盐分离子及引发次生盐渍化。海水中Mg2+质量浓度约为1.2 g·L−1,相比之下,渍化土壤排水中Mg2+占总盐含量的6%~20%,为0.2~0.6 g·L−1[3-4],Mg2+含量略低于海水中的含量。由于渍化土壤排水中离子种类比海水少,开发难度相对较低,新疆地区每年需进行的春灌和冬灌为获得大量的渍化土壤排水提供了可行条件,因此,将盐渍化土壤水体作为镁源在技术和经济上具有可行性[27]。
本研究结合新疆养殖业的氮磷污染和盐渍化问题,利用农田高盐排水作为镁源对氮磷废水中的磷进行回收,通过对比实验、正交实验和干扰离子影响实验,综合分析了高盐排水回收磷的回收效果和经济可行性;将治理盐渍化问题与磷回收结合起来,开发了氮、磷回收利用与污染控制相结合的集成技术模式,所得结果对提升现行养殖废水处理技术水平,实现社会效益、经济效益和环境效益三者的统一具有重要意义。
-
供试试剂:氯化铵、磷酸氢二钠、六水氯化镁、酒石酸钾钠、酒石酸锑氧钾、过硫酸钾、纳什试剂、氨基磺酸、抗坏血酸、磷酸二氢钾、硝酸钾、钼酸铵、氢氧化钠、盐酸、硫酸、氯化钙、氯化钠、氯化钾、硫酸钠、碳酸氢钠,供试试剂均为分析纯,购自国药集团化学试剂有限公司。
实验仪器:循环水式多用真空泵(SHB-III,郑州预科仪器有限公司)、集热式磁力搅拌器(DF-101B,金坛友联仪器研究所)、紫外可见分光光度计(UV-5500,上海元析仪器有限公司)、pH计(FiveEasy PlusTM FE28,上海全脉科学仪器有限公司)、自热恒温培养箱(HPX-9162MBE,上海赫田仪器有限公司)、电热鼓风干燥箱(GZX-9146MBE,上海百典仪器设备有限公司)、手提式压力蒸汽灭菌器(YXQ-SG46-280S,上海博讯仪器有限公司)、全温振荡器(BS-2F,上海荣计达实验仪器有限公司)。
-
养殖废水中氮主要以氨态氮、硝态氮等形式存在,总氮质量浓度为200~2 000 mg·L−1;总磷质量浓度为50~800 mg·L−1[28-29]。对样品进行离心、过滤[30]等前处理后,进一步对其进行各项指标的测定。实验所需的养殖废水取自阿拉尔市十四团宏盛牧歌养殖有限公司,废水为一级厌氧消化后的处理物,主要物理化学指标如下:总磷为(205.00±2.50) mg·L−1、氨氮为(408.46±6.34) mg·L−1、含盐量为0.66%、电导率为12.18±3.44、pH为7.18±0.80。依据上述养殖废水中的氨氮、总磷含量配制相应的模拟废水。具体配置方法如下:取1.187 7 g NH4Cl溶于去离子水中,配制氨氮质量浓度为400 mg·L−1的标液,并按照n(N)∶n(P)=1∶1,准确称取7.950 7 g Na2HPO4溶于去离子水中配置磷质量浓度为668 mg·L−1的磷标液,以便后续易控制实验中氮磷摩尔比。
-
本研究通过土壤振荡淋洗法获得高盐水样,实验土样取自阿拉尔十团棉田,并收集了棉田周边沟渠的农田排水。南疆地区农田排水中的镁离子质量浓度为0.2~0.6 g·L−1[31]。本研究为了考察不同质量浓度的高盐排水对磷回收的影响和满足后续研究需要,对农田排水进行了离子富集处理。具体步骤为:称取100 g盐渍土,放入500 mL三角瓶中,按1∶5的土水比加入500 mL去离子水,标记此时液面位置。为了防止在振荡过程中溶液损失,提前用保鲜膜和锡箔纸封口。将三角瓶放入BS-2F全温振荡器中,温度调至25 ℃,以180 r·min−1振荡30 min。之后,将获得的水土混合液用真空抽滤泵进行抽滤,实现上清液和固体颗粒物分离。继续称取100 g盐渍土样,将过滤后的上清液与100 g盐渍土混合,为了保证土水比始终为1∶5,加水至标记位置,此为1个循环,共计5个循环。用密封性好的试剂瓶将滤液储存。测定滤样中的离子成分,并与农田水样离子成分进行对比。
-
设计2组对比实验。第1组考察MgCl2和高盐排水的回收磷的效果:首先,配制Mg2+质量浓度为0.2、0.4、0.6、0.8、1.0 g·L−1梯度的MgCl2溶液;再用去离子水将制备的高盐排水进行稀释,稀释至与上述MgCl2溶液对应的5个Mg2+浓度,并将15 mL氨氮标液和15 mL磷标液进行混合。将上述5份Mg2+高盐排水和5份不同浓度的MgCl2溶液分别投加到上述氮磷混合液中,反应pH、N∶P摩尔比、温度、转速和反应时间分别设置为9、1∶1、25 ℃、100 r·min−1和20 min,并设置3个平行组。反应过程中实时检测pH变化,反应20 min后测定反应前后磷的变化量,计算磷回收率。
第2组实验主要考察pH对高盐排水回收磷效果的影响。选择Mg2+浓度梯度为上述实验中磷回收率最高的1组,探究在其余条件不变的情况下,当pH为7、8、9、10和11时磷的回收率。
-
在南疆的农田排水中,Mg2+、K+、Ca2+、Na+、
CO2−3 、HCO−3 、SO2−4 和Cl−等离子的占比较高[32],可能会对磷回收产生一定的影响。因此,本研究进一步探讨了干扰离子对高盐排水回收磷的影响。高盐排水中除Mg2+外还有K+、Ca2+和Na+等金属阳离子,他们之间存在一定的化学相似性。因此,与阴离子相比,金属阳离子对氮磷回收反应的干扰性较大,应优先考虑金属阳离子对高盐排水回收磷的影响。分别配制浓度为0.001 mol·L−1和0.01 mol·L−1的KCl、CaCl2、和NaCl溶液,氮磷标液的配制同上,Mg2+浓度的选择1.4中磷回收率较高的一组。具体实验操作如下:以K+为例,取15 mL氨氮标液和15 mL磷标液配制成2份氮磷混合标液,分别加入15 mL 0.001 mol·L−1、0.01 mol·L−1的KCl溶液,再加入15 mL MgCl2溶液,反应pH、N∶P摩尔比、温度、转速和反应时间分别设置为9、1∶1、25 ℃、100 r·min−1和20 min,并设置3个平行组;Ca2+和Na+实验设置同上。由于农田排水中的CO2−3 含量较低[33],本研究未考虑CO2−3 对磷回收的影响,阴离子仅探讨HCO−3 、SO2−4 和Cl−对磷回收的影响。分别配制0.001 mol·L−1和0.01 mol·L−1 2个质量浓度梯度的 Na2SO4、NaHCO3和NaCl溶液,其余反应条件同上,反应20 min后测定反应前后磷的变化量,计算磷回收率。 -
由于影响氮磷回收的因素较多,本实验设置了三因素四水平正交实验(L34)[34]探讨pH(8、9、10、11)、Mg∶P(1.0、1.5、2.0、2.5)和N∶P(1.0、1.5、2.0、2.5)摩尔比对磷回收的影响(表1),以获得最优的反应条件。其中,反应温度设置25 ℃、转速100 r·min−1,反应时间20 min。实验过程中,通过改变pH、Mg∶P摩尔比和N∶P摩尔比的不同组合探究对磷回收率的影响。
-
土壤和水体中的盐分离子测定方法如下:采用EDTA络合滴定法测定Ca2+和Mg2+[35];采用火焰光度法测定K+和Na+[36];采用双电极法测定
CO2−3 和HCO−3 [37];采用硝酸银滴定法测定Cl− [38];采用EDTA间接滴定法测定SO2−4 [39]。MgCl2和高盐排水对磷的回收效果用TP回收率表示,TP根据式(4)进行计算。
式中:Re为TP回收率;C1为溶液中初始磷质量浓度,mg·L−1;C2为反应溶液中磷剩余质量浓度,mg·L−1;
溶液中的TP浓度采用钼锑抗分光光度法进行测定[40];溶液pH采用FiveEasy PlusTM FE28 pH计测量;反应沉淀物置于50 ℃烘箱中干燥3 h,采用扫描电镜(SEM-EDS)、X射线衍射(diffraction of x-rays, XRD)分析沉淀物形态特征及元素组成。
利用IBM SPSS Statistics(23,IBM,美国)进行数据分析,分析过程中出现的Ki为表中各列因素水平i(1,2,3,4)的磷回收率之和后的均值,Kij为在j(A,B,C)因素下i的磷回收率之和后的均值,极差R为每列因素Ki中最大值和最小值之差;采用Origin(2019b,OriginLab,美国)、Excel(2020,微软,美国)进行数据绘图;采用Jade(6.5,MDI,美国)进行XRD衍射图谱分析。
-
农田排水中
SO2−4 含量最高,Na+和Cl−居于其次,金属阳离子含量适中,CO2−3 和HCO−3 占比较低(表2),这主要与新疆地区特殊的土壤条件有关[41]。为了满足实验需求,本实验对土壤淋洗液采用离子富集方法进行了处理。由表2可知,经过5次浓缩处理后,金属阳离子、SO2−4 和Cl−浓度显著提高,其中Mg2+质量浓度更是达到了2.14 g·L−1。本实验制备的高盐排水中Mg2+质量浓度达到了2.14 g·L−1,Mg2+质量浓度低于吕媛等[24]实验所使用的海水水样(7.00 g·L−1),但高于张萍等[23]使用的海水水样(1.22 g·L−1)。HCO3−稳定性较差,经过振荡操作后,样品中HCO3−以CO2形式逸出,致使其含量降低。高盐排水中Mg2+质量浓度约为0.2~0.6 g·L−1,为了提高Mg2+质量浓度,可以对高盐排水进行浓缩(膜蒸馏、浸渍)处理。为满足实验需求,采用了多次浸渍制得Mg2+质量浓度为2.14 g·L−1高盐排水。多次浸渍可以有效提高高盐排水中Mg2+含量,以此来降低高盐排水的投加量,可避免二次污染现象的发生。
-
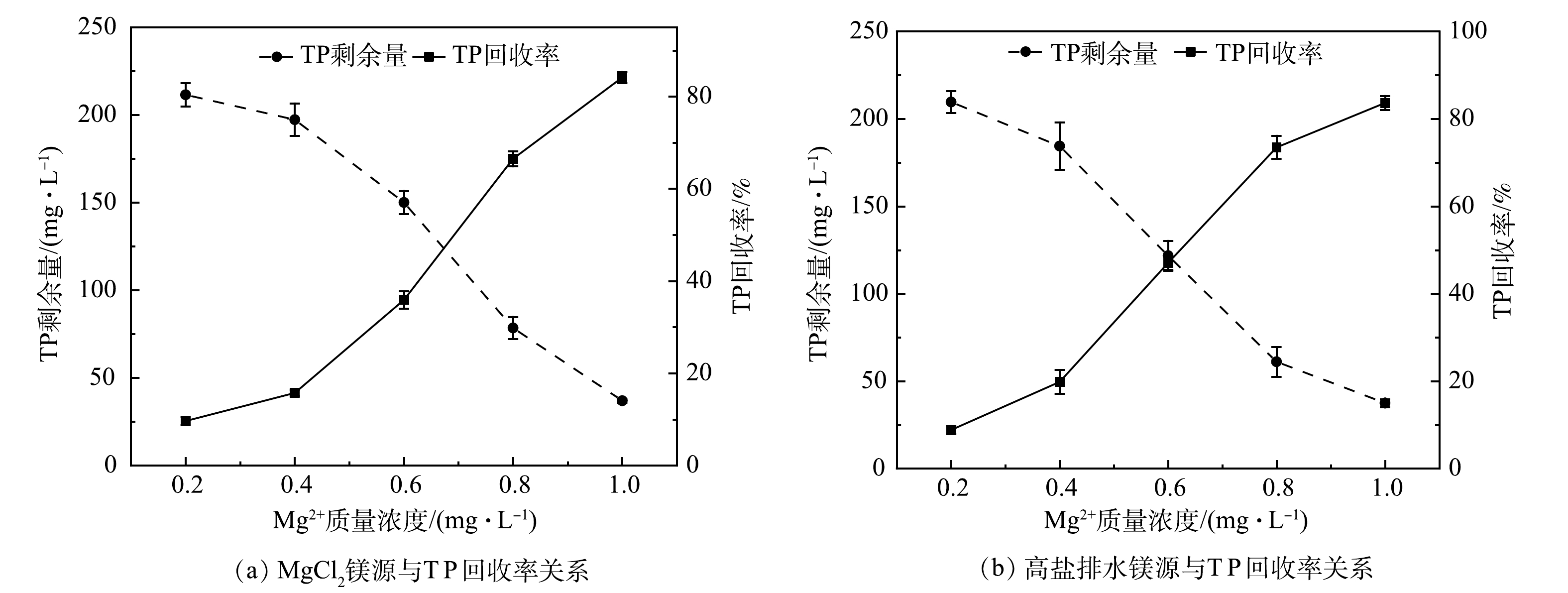
在投加MgCl2溶液和投加高盐排水的2个实验组中,TP平均回收率均随Mg2+质量浓度升高呈现递增的趋势(图1和图2)。当Mg2+质量浓度为1.0 g·L−1时,在投加MgCl2溶液的实验组中,TP平均回收率达到84.15%;在投加高盐排水的实验组中,TP的回收率为83.65%,比前者略低。对于同一Mg2+质量浓度下的MgCl2溶液和高盐排水,当n(Mg)∶n(P)<1.9时,高盐排水的TP平均回收率近似或略高于MgCl2溶液。其原因可能是,高盐排水成分较为复杂,除Mg2+外还含有大量的K+、Ca2+、Na+、
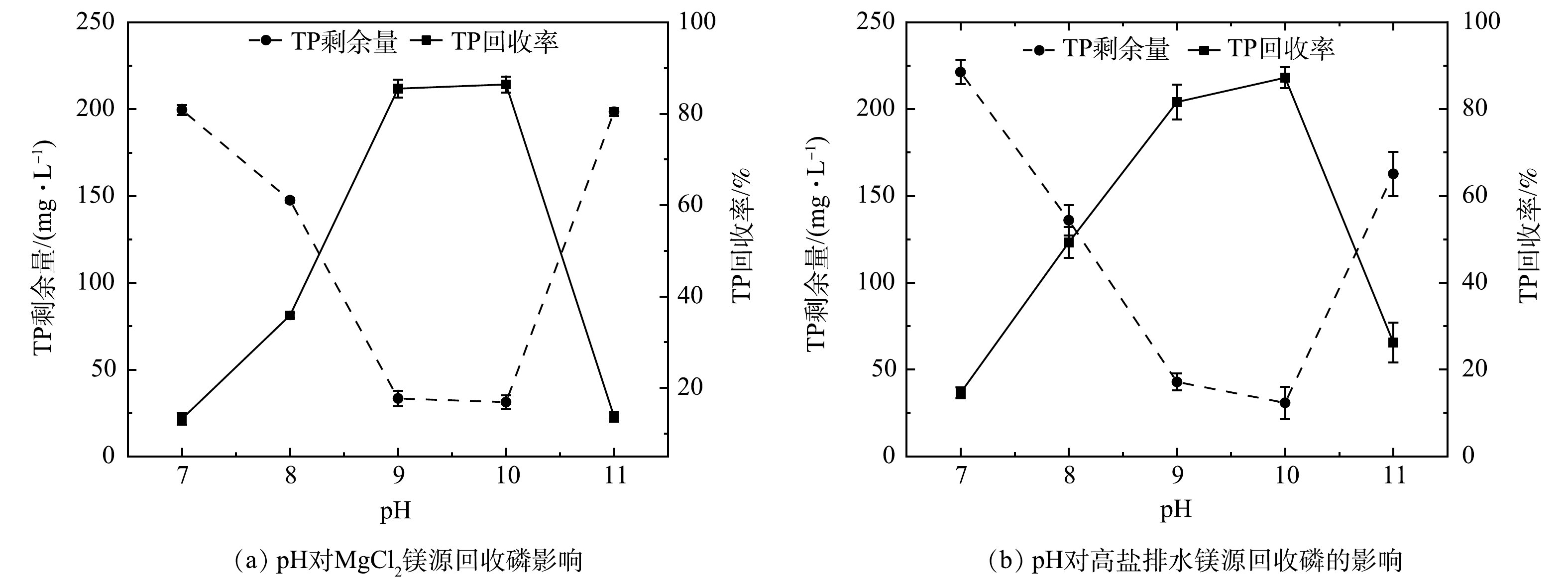
CO2−3 、HCO−3 、SO2−4 和Cl−等离子,正是由于这些离子的存在,与反应溶液中的Mg2+进行竞争[42],其争夺磷的能力要强于单纯的MgCl2溶液,促进了磷的回收。以最典型Ca2+为例,钙镁离子在元素周期表中位列同一族,化学性质极其相似,Ca2+易与溶液中的磷酸根离子反应,生成难溶于水的羧基磷灰石(Ca5OH(PO4)3)和磷酸钙等物质。当钙镁摩尔比不同时,对反应的影响也不同,具体分析在干扰离子实验中说明。另外,当Mg2+质量浓度低于0.6 g·L−1时,溶液中n(Mg)∶n(P)<1,两者的磷回收率较低;随着Mg2+质量浓度的提高,溶液中n(Mg)∶n(P)接近1,TP回收速率有了较为显著的提升。当Mg2+质量浓度达到1.0 g·L−1,溶液中n(Mg)∶n(N)∶n(P)=1.9:1∶1,此时,磷的平均回收率能够达到83.85%。图2反映出常规MgCl2和高盐排水的TP回收率均随pH升高整体呈现先升高后降低的趋势。当pH为7时,MgCl2和高盐排水对TP的回收率最低,分别为13.21%和14.61%,表明中性环境不利于反应的进行;当溶液环境逐渐转变为碱性时,TP回收率逐渐升高,并在pH为10时TP的回收率分别达到临界值86.42%和87.19%;临界值过后,两者的TP回收率随pH升高急剧降低,当pH为11时,两者的TP回收率仅为13.69%和26.21%。MgCl2溶液在pH为9时的TP回收率为85.49%,接近临界值86.42%;相比之下,此时高盐排水对TP回收率仅为81.61%;当pH为11时,高盐排水对TP回收率比MgCl2溶液高。反应结束后,溶液中高盐排水中TP剩余质量浓度要高于MgCl2,且在Mg2+质量浓度为0.2 g·L−1时最为显著。造成这些现象的原因可以归结于高盐排水复杂的离子环境。由于共存离子的存在,一方面使反应所需的pH提高;另一方面,当Mg2+浓度较低时,会使NH4+、PO42-与Mg2+的碰撞概率降低,降低反应速率[43]。吴健等[19]、鲍小丹等[44]发现,生成鸟粪石的最适pH为9.0;李洪刚等[17]、畅萧等[45]发现,当pH为9.5时,有利于鸟粪石的回收;李爱秀等[46]在优化猪场沼液氮磷工艺参数时得出最适pH为10。这些研究结果与本研究获得的结果一致。
-
图3表明,干扰离子对磷回收产生了不同程度的影响。TP初始质量浓度为172 mg·L−1,当溶液中只有Mg2+存在时,反应后溶液中TP剩余量53.83 mg·L−1。当金属阳离子浓度为0.001 mol·L−1时, K+、Ca2+、Na+实验组中TP剩余量依次为59.40、55.69、58.16 mg·L−1;当离子浓度上升至0.01 mol·L−1时,K+、Ca2+、Na+实验组中TP剩余量分别为50.74、28.46、55.07 mg·L−1(图3(a))。这表明Ca2+含量对磷的回收产生了较大影响。当Ca2+离子浓度较低时,反应溶液中磷剩余量与不存在干扰离子的对照组相比略高,此时Ca2+造成的影响较弱;随离子浓度的升高,Ca2+对反应的影响逐渐增强。Ca2+浓度提升10倍,溶液中TP剩余量由55.69 mg·L−1下降至28.46 mg·L−1。TP含量的降低表明,Ca2+浓度的升高对磷的回收起到了显著的促进作用。当溶液中n(Ca)∶n(Mg)<0.5时,反应以Mg2+消耗为主,反应主产物为MgNH4PO4·6H2O;当n(Ca)∶n(Mg)>0.5时,反应朝Ca2+与磷酸根离子结合的方向进行,此时的反应产物主要是磷灰石和磷酸钙等钙形式的化合物[47-48]。如果单从回收磷的角度考虑,新产物的生成进一步促进了磷的回收,但这会对氮磷回收产物中鸟粪石的纯度产生不利影响。生成的磷酸钙沉淀附着在鸟粪石表面,会抑制鸟粪石的生长,降低鸟粪石的纯度[49]。与Ca2+相比,K+、Na+质量浓度对磷的回收影响较小。
磷初始质量浓度为172 mg·L−1,加入MgCl2反应20 min,反应后溶液中磷剩余量54.45 mg·L−1;而分别投加0.001 mol·L−1
SO2−4 、HCO−3 和Cl−的实验组磷剩余量依次为63.96、60.60和58.34 mg·L−1(图3(b));当干扰离子浓度上升至0.01 mol·L−1时,SO2−4 、HCO−3 和Cl−的实验组磷剩余量分别为64.50、64.93和55.11 mg·L−1。在投加0.001 mol·L−1和0.01 mol·L−1的SO2−4 和HCO−3 实验组中,磷剩余量均高于对照组,投加Cl−的实验组磷剩余量变化不大。以上结果表明,阴离子的存在对磷的回收产生了抑制作用。导致TP剩余量略高的主要原因如下:SO2−4 带负电,易与金属离子或铵根结合,使溶液中Mg∶P和N∶P摩尔比降低,抑制反应进行[50];HCO−3 属于弱酸根离子,无法与大量OH−共存,当溶解pH较高时,为了维持溶液中的离子平衡,反应向生成CO2和H2O方向进行,溶液中大量OH−被消耗使得溶液pH降低,同样会抑制反应进行[51],而Cl−影响甚微。因此,阴离子的存在对磷回收也存在一定干扰,这种干扰表现为抑制作用,并且这种抑制作用不会随离子浓度的升高对磷回收产生较大的影响。因此,按照磷剩余量由高到低将各离子对氮磷回收的影响大小排序如下:当离子强度较低时,SO2−4 >HCO−3 >K+>Na+>Cl−>Ca2+;离子强度较高时,HCO−3 >SO2−4 >Na+>Cl−>K+>Ca2+。 -
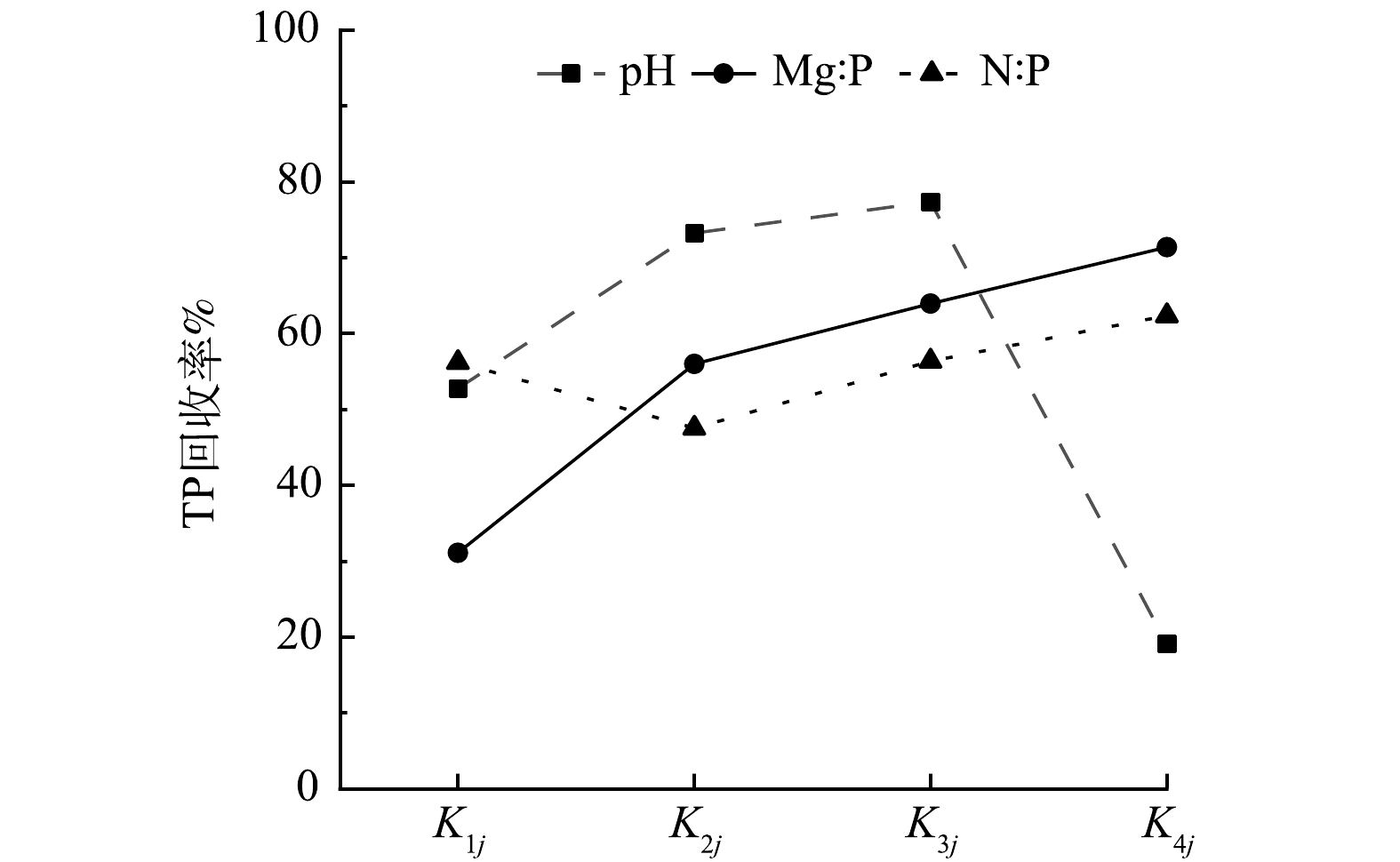
对三因素四水平正交实验的极差分析。由表3中K1、K2、K3、K4值可以看出,随着Mg∶P和N∶P摩尔比的增大,磷回收率有所提高,并在n(Mg)∶n(P)=2.5∶1、n(N)∶n(P)=4∶1时磷回收率达到最高。KiB由31.08增加至71.37,与Kic相比,KiB各K值间增幅较大,这表明Mg∶P对磷回收影响要大于N∶P。当pH在8~10,磷回收率随pH升高而升高,当pH超过11时,K值由K3A的77.33骤降到K4A的19.04,表明磷回收率急剧降低。因此,pH为10是高盐排水回收磷的最适值,稍高于其他文献利用纯MgCl2回收氮磷获得的最适pH(9.5)[52]。当超过最适值时,pH会对高盐排水回收磷的效率产生较大影响,不利于磷的回收。R值的排序为RA>RB>RC,表明pH是决定高盐排水回收磷效率的首要因素,Mg∶P、N∶P摩尔比位居其次,这与前面对于K值的分析结果一致。由图4可见,3条数据线的峰值分别对应pH=10、n(Mg)∶n(P)=2.5∶1、n(N):n(P)=4∶1,该组合即为极差分析得出的最佳反应组合。
采用SPSS软件对实验数据进行了进一步分析,处理因素pH、Mg∶P摩尔比、N∶P摩尔比分别用A、B、C表示,并按顺序输入数值,建立对应数据库[53]。分析结果如表4所示。
由表4中的方差分析结果可以看出,A和B 2个因素对实验结果有显著影响(P<0.001),即pH和Mg∶P摩尔比对磷回收的影响显著。N∶P(P>0.05)对磷回收无显著影响。处理因素影响顺序为A>B>C,这与前面极差分析得出的结论一致。SPSS单变量方差分析结果表明,当pH=10、n(Mg):n(P)=2.5∶1、n(N):n(P)=4∶1时,对应的磷回收率分别为77.33%、71.37%和62.33%,该组合即为最佳组合,该分析结果与极差分析结果一致。
-
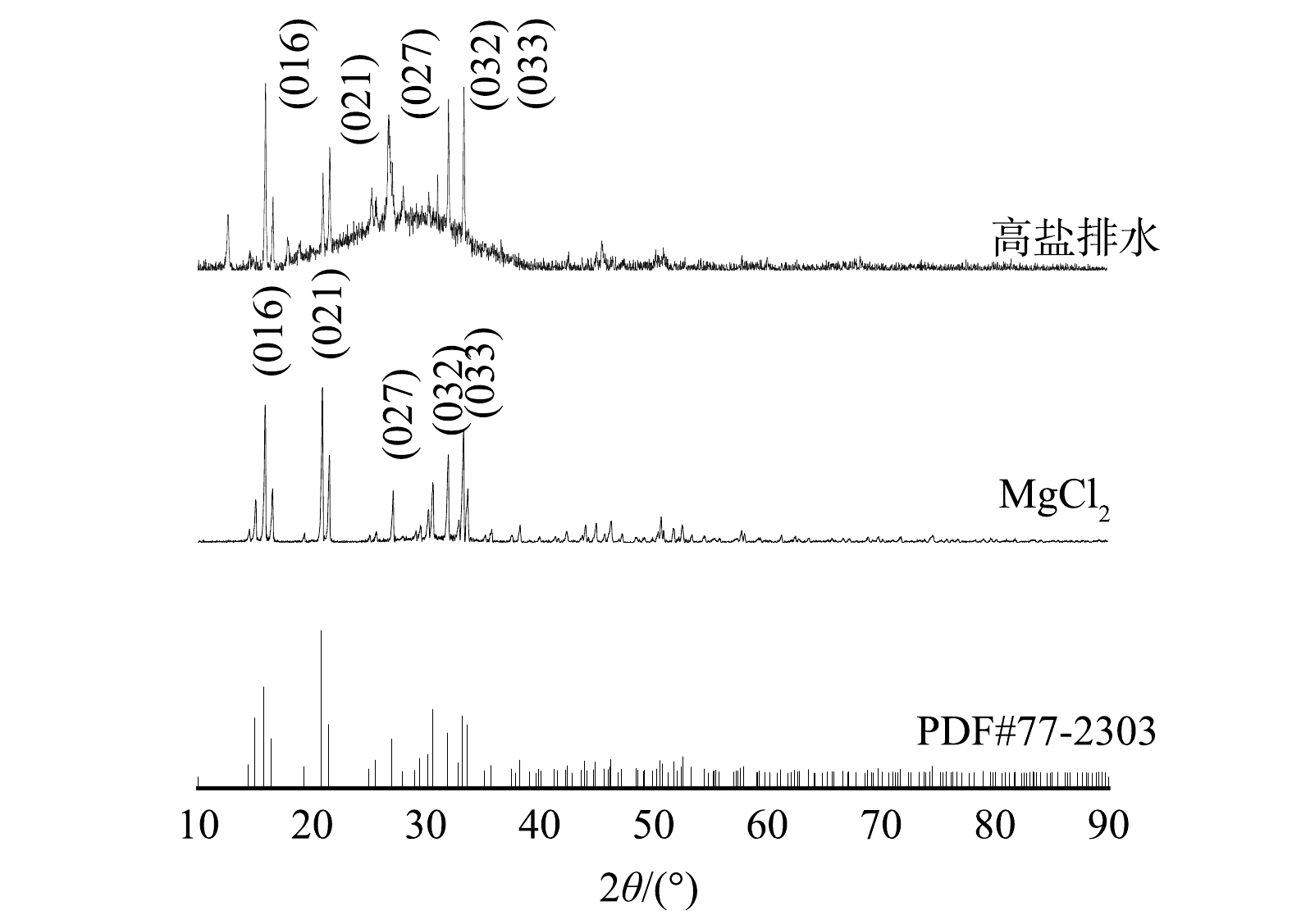
采用XRD和扫描电镜对反应产物进行了表征分析[54-55],图5(a)为pH=9、n(Mg)∶n(N)∶n(P)=1∶1∶1、转速100 r·min−1、反应时间20 min和温度25 ℃时,以MgCl2(图5(a))和高盐盐水(图5(b))分别作为镁源的沉淀产物扫描电镜图。由图5(a)可以发现,MgCl2作为镁源的沉淀产物晶体呈轴状,长度为100~200 μm,沉淀整体直观呈白色,有玻璃光泽,质地较脆,与卜凡等[56]和ZHANG等[57]对鸟粪石的表征结果相符。后续经XRD分析后,证明该沉淀物为鸟粪石[58-59]。图5(b)为n(Mg)∶n(N)∶n(P)=1∶1∶1时高盐盐水的沉淀产物电镜图。由图5(b)中可以看到许多长条状结构,结构较紧密,与MgCl2镁源沉淀产物相比,该结构更为细长,放大观察发现表面附着许多细小的颗粒,具备鸟粪石基本结构。这些长条状结构周围有较多板快结构,初步断定为反应副产物[60]。除此之外,由图5(b)中还观测到“晶体粘连”现象,可推断是有机物的粘附作用所致[44]。图5(c)为n(Mg)∶n(N)∶n(P)=1.9∶1∶1时高盐排水沉淀产物电镜图。由图5(c)中已经看不到“粘连”现象,生成的鸟粪石晶体形态优于镁磷摩尔比为1:1时的沉淀产物,更加与鸟粪石的形态吻合,印证了Mg2+含量对鸟粪石形态的影响。在图5(c)中还能观测到较多的不定形的磷酸钙晶体。其产生原因是,由于实验采用的高盐排水中Ca2+、Mg2+摩尔比为0.46,随反应进行会产生不定形的磷酸钙晶体,后续XRD衍射图谱中出现的宽峰同样证明了磷酸钙的存在。K+在高盐排水中占比较高,与Mg2+、
PO2−4 PO42-结合生成MgKPO4·6H2O(MKP)[57]。图6为n(Mg)∶n(N)∶n(P)=1.9∶1∶1时的沉淀产物XRD图。在MgCl2作为镁源的沉淀产物XRD衍射图谱中,(016)、(021)、(027)、(032)和(033)几个尖峰位置与标准衍射图谱(图6(c))中尖峰位置基本一致(图6(b)),整体走势相似,可确定反应产物为鸟粪石。高盐排水镁源沉淀产物的XRD图谱整体走势与标准比对卡大致相似(图6(a)),但也存在着局部差异。尖峰出现的位置表明,沉淀产物中有鸟粪石的存在;但尖峰最高点比标准衍射图谱略高,一方面说明晶体状态较好,另一方面表明反应沉淀物中存在其他物质,尖峰(027)比标准衍射图谱中高许多,经分析为SiO2。其原因是,由于农田排水中粒径细小的粘土颗粒以硅酸盐矿物的形式附着在鸟粪石表面,致使其在沉淀物中被检测到。(021)~(033)处宽峰出现的位置也证明了该反应存在其他产物。通过Jade 6.5软件分析,20°~40°处出现的宽峰主要为钙的化合物,大量钙化合物的生成,致使20°~40°处宽峰的峰高急剧升高[54]。此现象产生的原因是:由于钙镁离子是同族元素,化学性质极其相似,与磷酸根结合生成磷酸钙、磷灰石等不溶于水的物质[47,59]。前述结果再一次验证了钙离子对磷的回收产生了较大的影响。从XRD和扫描电镜联合检测结果可推测,高盐盐水镁源沉淀产物主要为鸟粪石,并伴有磷酸钙、磷灰石和硅酸盐矿物等物质生成。
-
以上研究结果表明,采用高盐排水为镁源可以实现与传统化学镁源相似的氮磷回收效率,磷回收率均在80%以上,所需高盐排水与模拟养殖废水体积之比约为1∶8,因此,不会产生严重的二次污染。目前,国内外对于MAP沉淀法相关研究多数集中在探究反应条件方面[8,13-15],对改善镁源方面的研究较少。本研究以寻求廉价镁源为出发点,与新疆高盐排水问题相结合,既充分利用了盐渍水中的镁源,又回收了养殖废水中的氮磷,所得鸟粪石可以制成肥料返入棉田,是一种可行的废物资源化利用模式。本研究得出的最佳组合为pH=10、n(Mg)∶n(P)=2.5、n(N):n(P)=4∶1。养殖废水中氨氮含量往往比磷含量高出2倍以上,可满足n(N)∶n(P)生成鸟粪石的基本要求,同时可以通过改变高盐排水投加量和投加浓度控制适宜的Mg与P的摩尔比。另外,根据中国化工网查询到工业级六水合氯化镁市价为300~900元·t−1不等。按照均价600元·t−1,n(Mg)∶n(P)=1.9,处理1 m3磷含量为200 mg·L−1养殖废水,需投加2.46 kg MgCl2·6H2O,可生产1.59 kg鸟粪石,氯化镁成本为1 500元·t−1。相比之下,高盐排水成本低廉,回收鸟粪石价格在5 000~38 000元·t−1不等,TP回收率在85%以上时可产生较大的经济效益。综上所述,在新疆南疆地区以农田高盐排水为替代镁源回收养殖废水中氮磷具有广阔的应用前景。
-
1) 当pH=9、温度25 ℃、n(N)∶n(P)=1∶1、转速100 r·min−1、n(Mg)∶n(N)∶n(P)=1.9∶1∶1时,高盐排水对TP回收率可达83.85%;在相同质量浓度的Mg2+下,随pH升高,两者对TP回收率逐渐升高,并在pH为10时回收率均达到最大值,分别为86.42%和87.19%;高盐排水和MgCl2对TP的回收效果相似,但高盐排水回收磷所需的体系pH比MgCl2溶液略高。
2)
HCO−3 、SO2−4 对磷回收表现为抑制作用,Ca2+对磷回收表现为促进作用,K+、Na+、Cl−对磷回收的影响较小。3) pH、Mg∶P摩尔比、N:P摩尔比是高盐排水回收磷的重要因素,影响的主次因素为RPH>RMg∶P>RN∶P。本研究中高盐排水回收磷的最佳组合条件为pH=10、n(Mg)∶n(P)=2.5、n(N)∶n(P)=4。
4) 不同Mg2+含量的农田排水镁源对氮磷的回收产物中均观测到了鸟粪石晶体的存在。与MgCl2镁源的沉淀产物相比,含低浓度Mg2+的农田排水回收产物中晶体呈细长轴状,存在有机物的粘连现象;而含高浓度Mg2+的农田排水回收产物中鸟粪石晶体形态与MgCl2镁源相似。因此,采用农田高盐排水回收养殖废水中的氮磷,可为替代MAP沉淀法中大规模使用的商业镁源产品提供一种新思路,也可在一定程度上缓解水体盐渍化的环境问题。
以农田高盐排水为替代镁源回收养殖废水中的磷素
Recovery of phosphorus from livestock wastewater using high salt drainage of farmland as an alternative magnesium source
-
摘要: 为解决新疆南疆地区养殖废水高浓度氮磷和农田排水中的高浓度盐分的协同污染问题,以农田高盐排水为镁源对模拟养殖废水中的磷进行了回收实验,对比了高盐排水和常规镁源的磷回收效率,探讨了影响其回收的主要因素,并通过正交试验获得了高盐排水回收磷的最优反应条件。与常规MgCl2镁源的磷回收对比分析结果表明,pH=10时高盐排水回收磷的效率最高,比MgCl2镁源达最大回收率所需的反应pH略高;利用
L43 正交试验探究了pH(8、9、10、11)、Mg∶P摩尔比(1.0、1.5、2.0、2.5)、N∶P摩尔比(1.0、1.5、2.0、4.0)对高盐排水镁源回收磷的影响,并结合SPSS统计分析得到高盐排水回收磷的最优反应条件为pH=10、n(Mg)∶n(P)=2.5,n(N)∶n(P)=4;高盐排水中的HCO−3 和SO2−4 离子对磷回收有抑制作用,而Ca2+离子对磷回收有促进作用;XRD和SEM-EDS分析表明,高盐排水回收磷的产物以鸟粪石为主,并夹杂着磷灰石和粘土矿物等杂质。整体上,以高盐排水作为替代镁源回收磷的效果较好,本研究为解决鸟粪石沉淀法的镁源问题提供了一种新思路。Abstract: In order to solve the synergistic pollution problem of high concentration nitrogen and phosphorus in livestock wastewater and high salt concentration in farmland drainage in southern Xinjiang. In this paper, the recovery experiment of phosphorus from simulated livestock wastewater was conducted with high salt drainage from agricultural soil as magnesium source. The phosphorus recovery efficiency between high salt drainage and conventional magnesium source was compared, and the main factors affecting the phosphorus recovery efficiency were also discussed. The optimal reaction conditions for phosphorus recovery by high salt drainage were determined through orthogonal test. In comparison with MgCl2 magnesium source, the maximum phosphorus recovery rate occurred at pH=10 by the high salt drainage, which was slightly higher than the reaction pH required by MgCl2 magnesium source. L34 orthogonal test combined with SPSS statistical analysis were conducted to study the effects of pH(8, 9, 10, 11), Mg∶P molar ratio(1.0, 1.5, 2.0, 2.5), and N∶P molar ratio(1.0, 1.5, 2.0, 4.0) on phosphorus recovery by high salt drainage magnesium source. The optimum reaction conditions for phosphorus recovery were pH=10, n(Mg)∶n(P)=2.5, n(N)∶n(P)=4.HCO−3 , andSO2−4 in high salt drainage inhibited the phosphorus recovery, while Ca2+ promoted P recovery. XRD and SEM-EDS revealed that the precipitation products were mainly guanite and mixed with impurity minerals of apatite and clay. Overall, high salt drainage as a substitute for magnesium source has a good effect on phosphorus recovery, which provided a new strategy to solve the magnesium source problem of struvite precipitation method.-
Key words:
- high salt drainage /
- struvite /
- magnesium source /
- phosphorus recovery /
- salt ions
-
短程硝化-厌氧氨氧化是一种高效的生物脱氮技术,具有无需外源添加碳源、污泥产量小、曝气能耗低、脱氮效率高的特点[1-2],而如何快速达到稳定的短程硝化效果是限制该技术推广的主要问题之一[3]。实现短程硝化的关键是抑制亚硝酸盐氧化细菌(nitrite-oxidizing bacteria,NOB)。为实现NOB的长期抑制,达到亚硝酸盐的稳定积累,往往需要多种控制手段的结合,包括低溶解氧(<2 mg·L−1)、高温(30~40 ℃)、高游离氨(free ammonia,FA) (1~10 mg·L−1)、高游离亚硝酸(free nitrous acid,FNA) (0.02~0.4 mg·L−1)等[4]。此外,优化反应器结构、外加磁场/超声波、添加化学试剂等方法均可强化短程硝化工艺[5]。目前高氨氮(
NH+4 自诱导物-2(autoinducer-2,AI-2)是群体感应(quorum sensing,QS)信号分子的一种,负责细菌间的种间通讯,并通过调整相关基因的表达来促进胞外聚合物(extracellular polymeric substances,EPS)的产生,调节群落结构和菌群活性,进而影响细菌的生理功能。利用AI-2介导的QS系统被认为是废水处理中一种很有前途的调控方法。AI-2参与了生物膜的形成[6],降低AI-2的浓度可以有效控制膜生物污染[7-8]。作为AI-2的重要组成成分,硼的加入能够触发AI-2介导的QS,提高系统的处理效果。在颗粒污泥中加入硼,加速了颗粒污泥的生长,改善了SBR的沉降性能,增加了生物量,且颗粒污泥中AI-2的活性明显提高[9]。添加硼也能够实现厌氧氨氧化反应器的快速启动,并可显著促进厌氧氨氧化菌(anammox bacteria,An AOB)的富集,促进EPS分泌进而形成粒径更大、结构更紧密的An AOB颗粒污泥[10-11]。以上的研究结果表明,利用硼促进细菌AI-2介导的QS系统具有成为一种高效的调控策略的潜力。
为了快速获得稳定的短程硝化效果,实现稳定的亚硝酸盐积累,确保产生足够的底物用于厌氧氨氧化,本研究探究了硼对硝化细菌AI-2类QS系统的影响,考察了不同质量浓度的硼酸对亚硝酸盐富集的影响,并结合硝化细菌丰度的变化分析了影响机制,以期为短程硝化工艺的快速启动提供参考。
1. 实验材料和方法
1.1 自养硝化污泥培养
本研究污泥取自武汉沙湖污水处理厂的回流污泥,接种到序批式反应器(sequencing batch reactor, SBR)中,并逐步提高氮负荷来驯化富集自养硝化污泥。SBR的有效体积为18 L,水力停留时间16 h,每周期8 h(进水30 min,曝气6 h,沉淀30 min,出水30 min,静置30 min)。反应器在25 ℃下运行,运行期间保持溶解氧(dissolved oxygen,DO)>2 mg·L−1,pH在7~8。进水采用人工配水,氮源为(NH4)2SO4,用NaHCO3和Na2CO3做pH调节剂,还包括营养元素54 mg·L−1 KH2PO4、75 mg·L−1 KCl、147 mg·L−1 CaCl2·2H2O、49 mg·L−1 MgSO4·7H2O、和微量元素溶液 (采用SMOLDERS等[12]的配方)。
污泥培养40 d后,进水
NH+4 NH+4 NH+4 NO−2 NO−3 1.2 短程硝化反应器启动实验
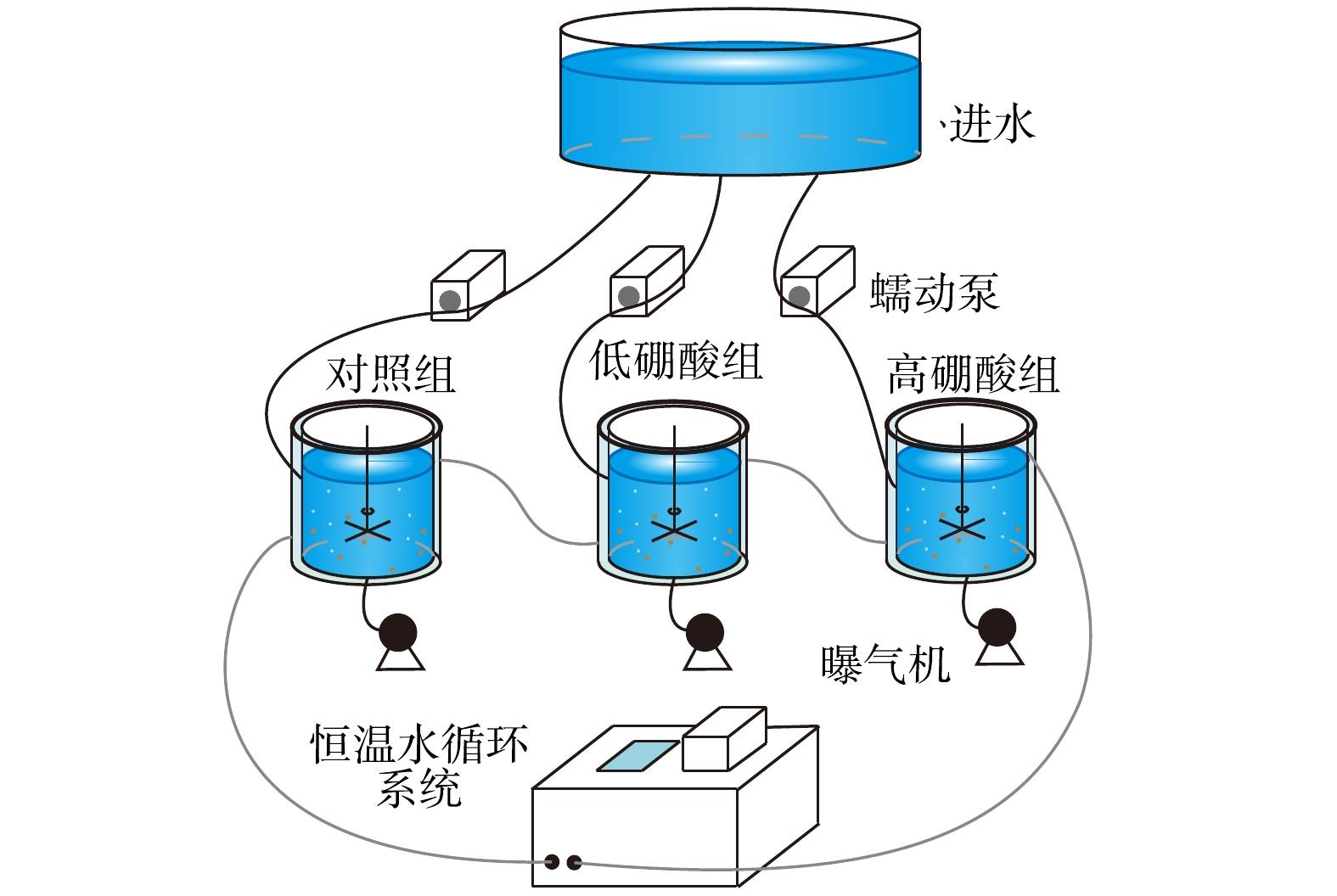
将SBR培养的硝化污泥接种至3个有效容积为1 L的小型反应器中(图1)。每天随进水向反应器中添加0.1 mmol·L−1硼酸(低硼酸组)和1 mmol·L−1硼酸(高硼酸组),并设置1组不添加硼(对照组)。反应器采用序批式运行,每循环为12 h (进水15 min、好氧10 h、沉淀30 min、出水15 min、静置1 h),采用人工进出水的方式,换水率50%,水力停留时间24 h。反应器初始MLSS为(2.13±0.05) g·L−1。运行期间保持DO>2 mg·L−1,pH在7~8,温度为25 ℃。
试验过程主要分为4个阶段:阶段Ⅰ(0~9 d),进水
NH+4 NH+4 NH+4 NH+4 定期监测反应器中DO、pH、
NH+4 NO−2 NO−3 1.3 EPS的提取及测定
EPS的提取参照任杰辉等[13]的方法,并测定EPS中的总有机碳(total organic carbon,TOC)、蛋白质和多糖的含量。TOC的测定采用总有机碳分析仪(multi N/C 2 100,德国耶拿分析仪器股份公司)。多糖采用苯酚-浓硫酸法以葡萄糖为标准测定[14],并对此方法进行改进,在测定溶解性微生物产物(soluble microbial products,SMP)中的多糖含量前,先加入0.2 mL的氨基磺酸氨对样品中的
NO−2 1.4 三维荧光(EEM)光谱的测定
三维荧光(fluorescence excitation-emission matrix,EEM)光谱的测定采用荧光分光光度计(F-7000 FL Spectrophotometer,HITACHI)[16]。以5 nm为增量激发波长从200 nm扫描到450 nm,发射波长从280 nm扫描至550 nm,扫描速度为2 000 nm·min−1,响应时间为0.002 s。为了消除拉曼散射和瑞利散射的影响,样品的荧光值均减去以纯水为空白的荧光值。
1.5 AI-2检测方法
采用黄晓遇等[17]的柱前衍生-固相萃取-高效液相色谱荧光法测定反应器中的AI-2。
1.6 实时荧光定量PCR检测
使用DNeasy PowerSoil Pro Kit (QIAGEN,德国)提取污泥DNA,用超微量分光光度计(KAIAO K5 800,北京)测定DNA质量浓度。针对细菌 16S rRNA、氨氧化细菌 16S rRNA 基因、硝酸盐氧化菌 16S rRNA进行实时荧光定量 PCR(real-time PCR)检测,所用引物与HU等[18]相同。
定量RCR反应采用PerfectStart Green qPCR SuperMix试剂盒(全式金,北京)。使用ABI QuantStudioTM 1 System (Thermo Fisher,美国)进行PCR扩增和检测。qPCR采用两步法:94 °C 30 s,然后94 °C 5 s,60 °C 30 s,40个循环。使用插入正确目的基因的质粒(pLB载体,天根,北京)作为标准,具体流程参考胡惠秩[15]的方法。所有qPCR运行结束时均进行熔融曲线分析,以确定扩增产物的特异性。
1.7 常规水质指标检测
用标准方法测定污泥的MLSS、MLVSS和ESS[19]。
NH+4 NO−3 NO−2 1.8 参数计算
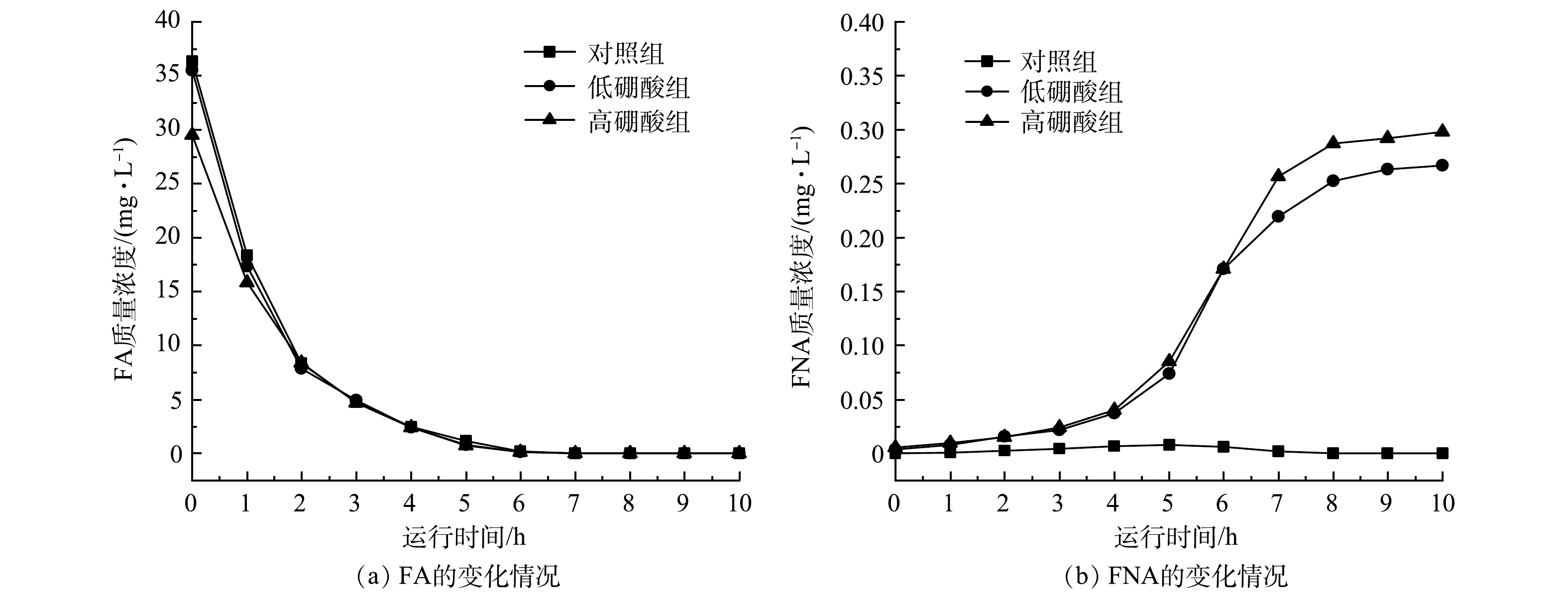
亚硝酸盐积累率根据式(1)进行计算,游离氨(FA)和游离亚硝酸(FNA)根据式(2)和式(3)[20]进行计算。
η=CNO−2−N/(CNO−2−N+CNO−3−N)×100% (1) 式中:η为亚硝酸盐积累率;
CNO−2-N NO−2 CNO−3-N NO−3 CFA=1714SNH+4-N×10pHe6 344/(273+T)+10pH (2) CFNA=4714SNO−2-Ne−2300/(273+T)×10pH (3) 式中:
CFA CFNA SNH+4-N NH+4 SNO−2-N NO−2 1.9 显著性检验
每个实验重复3次进行统计学检验。采用SPSS软件(25.0版)进行方差分析(ANOVA),检验不同样本间的差异,P<0.05时认为差异显著。
2. 结果与讨论
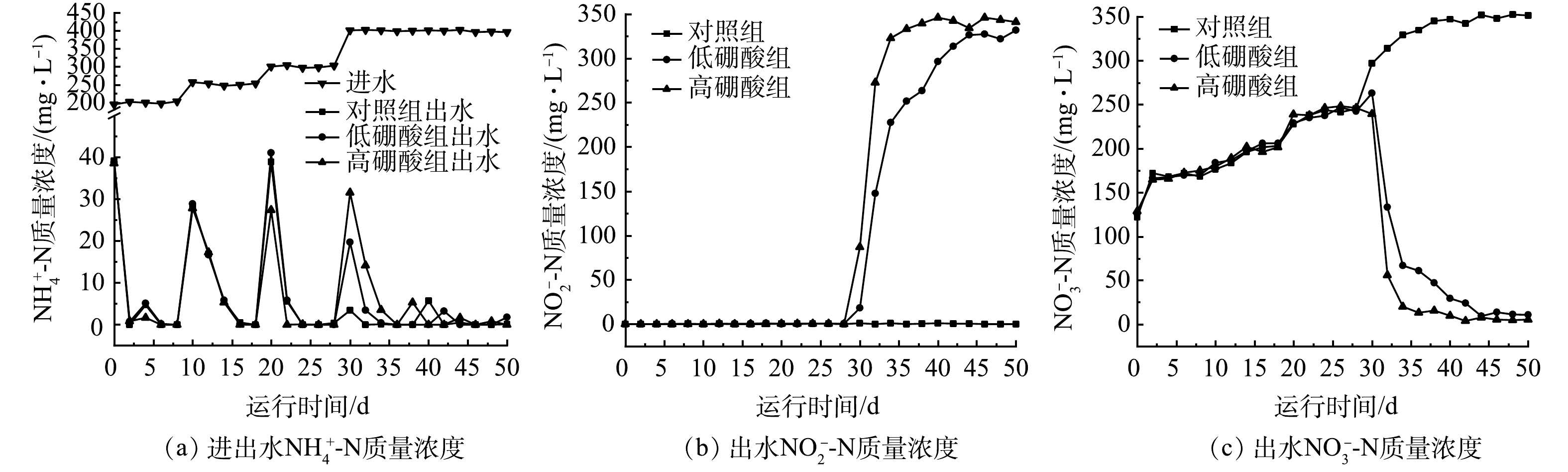
2.1 硼酸对短程硝化反应器启动的影响
由图2可知,反应器运行50 d后,在添加硼酸的条件下可以逐步实现短程硝化。当进水
NH+4 NO−2 NO−3 NO−2 NO−3 NO−2 FA和FNA质量浓度与
NH+4 NO−2 NH+4 NO−2 2.2 硼酸对硝化污泥生长特性的影响
硼酸的投加显著促进了污泥生物量的积累(表1)。低硼酸组和高硼酸组的平均生长速率较对照组分别增加了0.018 g·(L·d)−1和0.030 g·(L·d)−1(以MLSS计)。在之前的研究中,ZHANG等[9]发现,添加硼酸使得SBR中的好氧颗粒污泥具有更大的生物量。类似地,吴桂荣[10]发现,加硼反应器的颗粒污泥体积平均粒径(430.469 μm)略大于不加硼反应器颗粒污泥的体积平均粒径(357.122 μm)。本实验结果也验证了硼酸加速污泥平均生长速率的结论。
表 1 50 d后3组反应器中自养硝化污泥的特性Table 1. Characteristics of autotrophic nitrification sludge in three groups of reactors after 50 d组别 初始MLSS/(g·L−1) 实验末期MLSS/(g·L−1) 实验末期MLVSS/(g·L−1) 实验末期VSS/SS 平均ESS/(g·(L·d)−1) 平均生长速率/(g·(L·d)−1) 对照组 2.13 ± 0.05 3.11 ± 0.03 1.86 ± 0.08 0.597 0.15 0.130 低硼酸组 2.13 ± 0.05 3.57 ± 0.07 2.33 ± 0.01 0.652 0.12 0.148 高硼酸组 2.13 ± 0.05 3.62 ± 0.06 2.39 ± 0.04 0.661 0.13 0.160 2.3 硼酸对反应器中EPS组成的影响
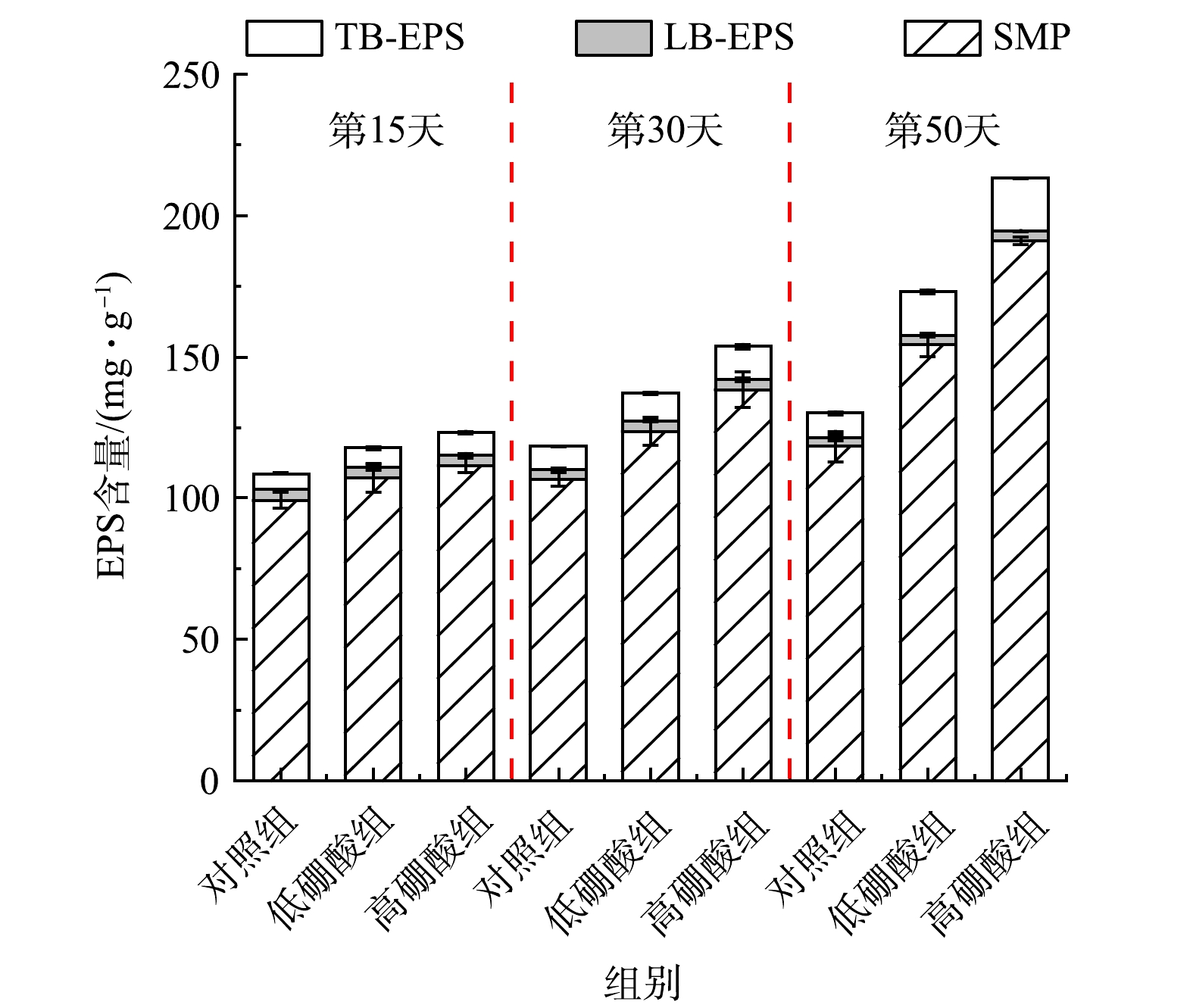
EPS是一种细菌代谢产物,在细菌的粘附聚集、信息交流方面发挥重要作用[23]。根据结合的紧密程度,EPS又可以划分为SMP、松散结合EPS(loosely bound EPS,LB-EPS)和紧密结合EPS (tightly bound EPS,TB-EPS)[24]。EPS中有机组分主要包括蛋白质、多糖、腐殖质样物质、醛酸、核酸和脂类[25],约占其总量的80%~90%。EPS的总含量通常可以用TOC来表征[26]。如图4所示,总EPS随着时间的推移逐渐增加,且实验组EPS含量显著高于对照组。硼的加入促进了硝化细菌中EPS的分泌,并对EPS的组分产生影响。反应器运行50 d后,低硼酸组和高硼酸组的总EPS含量较对照组分别提高了30.46%和61.61%。微生物分泌的EPS通常被认为能影响污水处理系统中微生物的聚集特性和结构功能,特别是生物膜的形成、颗粒污泥造粒等[25]。此外,硝化污泥中TB-EPS的含量显著高于SMP和LB-EPS的含量,这表明TB 是EPS的主要成分。其中硼酸对TB-EPS的促进最为明显(对照组106.49 mg·g −1,低硼酸组135.66 mg·g −1,高硼酸组169.11 mg·g−1)。在吴桂荣[10]的研究中,加硼反应器总EPS的含量也显著高于不加硼反应器,其中TB-EPS由102.67 mg·g−1增加至147.69 mg·g−1。这表明外源添加硼酸有助于胞外聚合物的分泌。
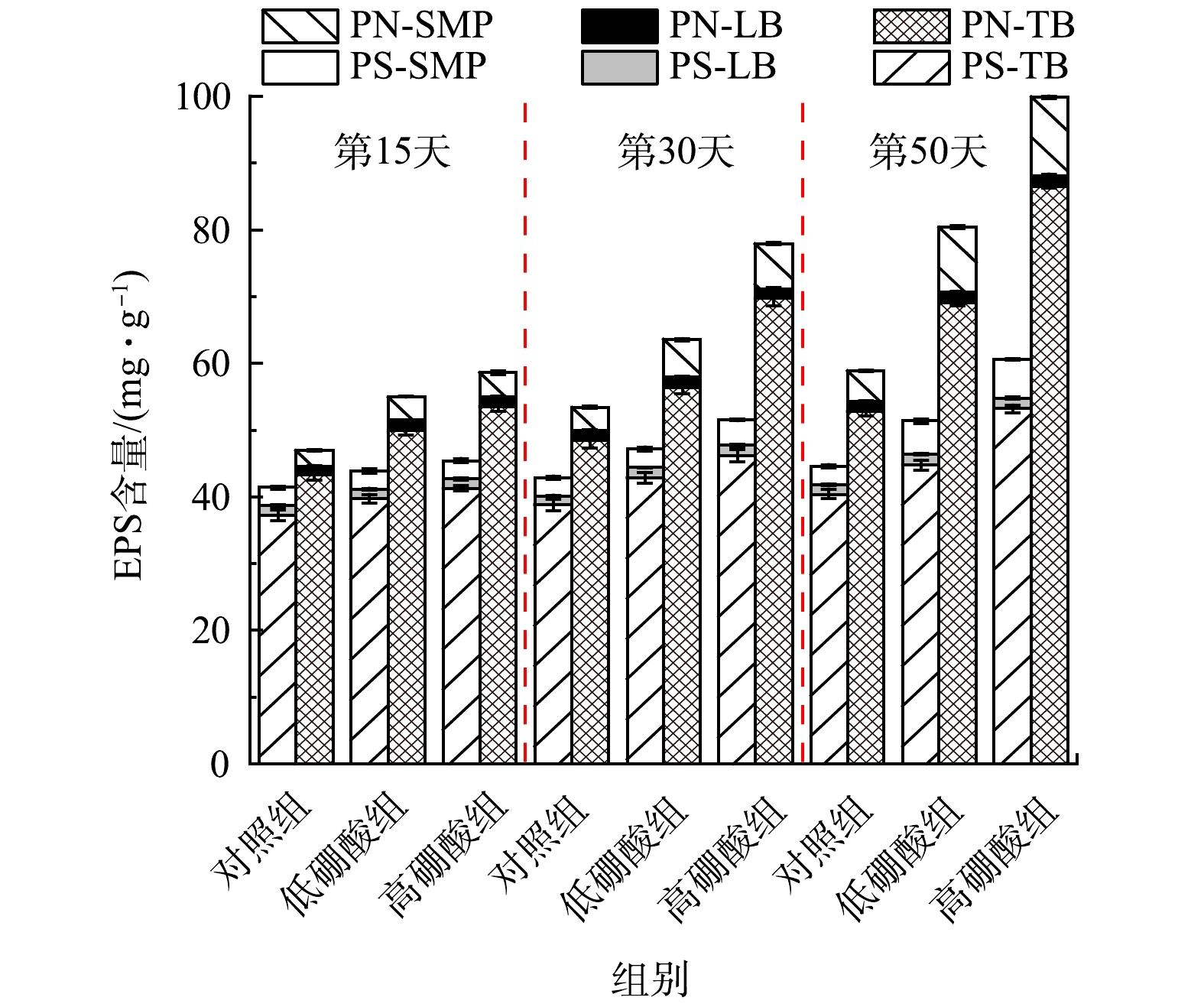
蛋白质(protein,PN)和多糖(polysaccharide,PS)是EPS的重要组成部分。PN的氨基酸组成和二级结构有助于疏水相互作用,进而提高微生物聚集体的活性[27]。PS具有很大的分子量和具有活性侧链的长碳主链结构,这是EPS有高絮凝特点的原因[28]。低硼酸组和高硼酸组PS的含量较对照组分别增加了15%和36%,PN的含量增加了37%和70%(图5)。这表明添加硼酸对PN和PS都有促进作用,但对PN的促进更明显,这与吴桂荣[10]的研究结果相似。PN是EPS的疏水部分,高含量的PN有利于微生物的附着和活性污泥的稳定[29]。本研究中,添加硼酸后TB-EPS中PN/PS值也显著增加,对照组为1.31,低硼酸组为1.54,高硼酸组为1.63。EPS的改变与活性污泥EES的变化一致,说明添加硼酸的活性污泥的稳定性和沉降性增强。
多糖可以增加EPS的持水量,而蛋白质具有疏水的结构,所以蛋白质/多糖的比例会影响污泥的沉降性能[30]。反应器运行过程中蛋白质含量始终高于多糖,PN/PS的值的变化如表2所示。随着时间的推移,LB的PS/PN值变化不显著,SMP和TB的PN/PS值逐渐上升,其中TB的PS/PN值变化尤为显著。在反应器运行第15、30、50天时,低硼酸组中TB的PN/PS值分别为1.26、1.32、1.54;高硼酸组中TB的PN/PS值分别为为1.30、1.49、1.63;而对照组中TB的PN/PS值分别为仅为1.16、1.25、1.31。添加硼酸后,活性污泥的沉降性能变好和生物量增加也可能与硝化污泥的EPS组成成分的变化有关。
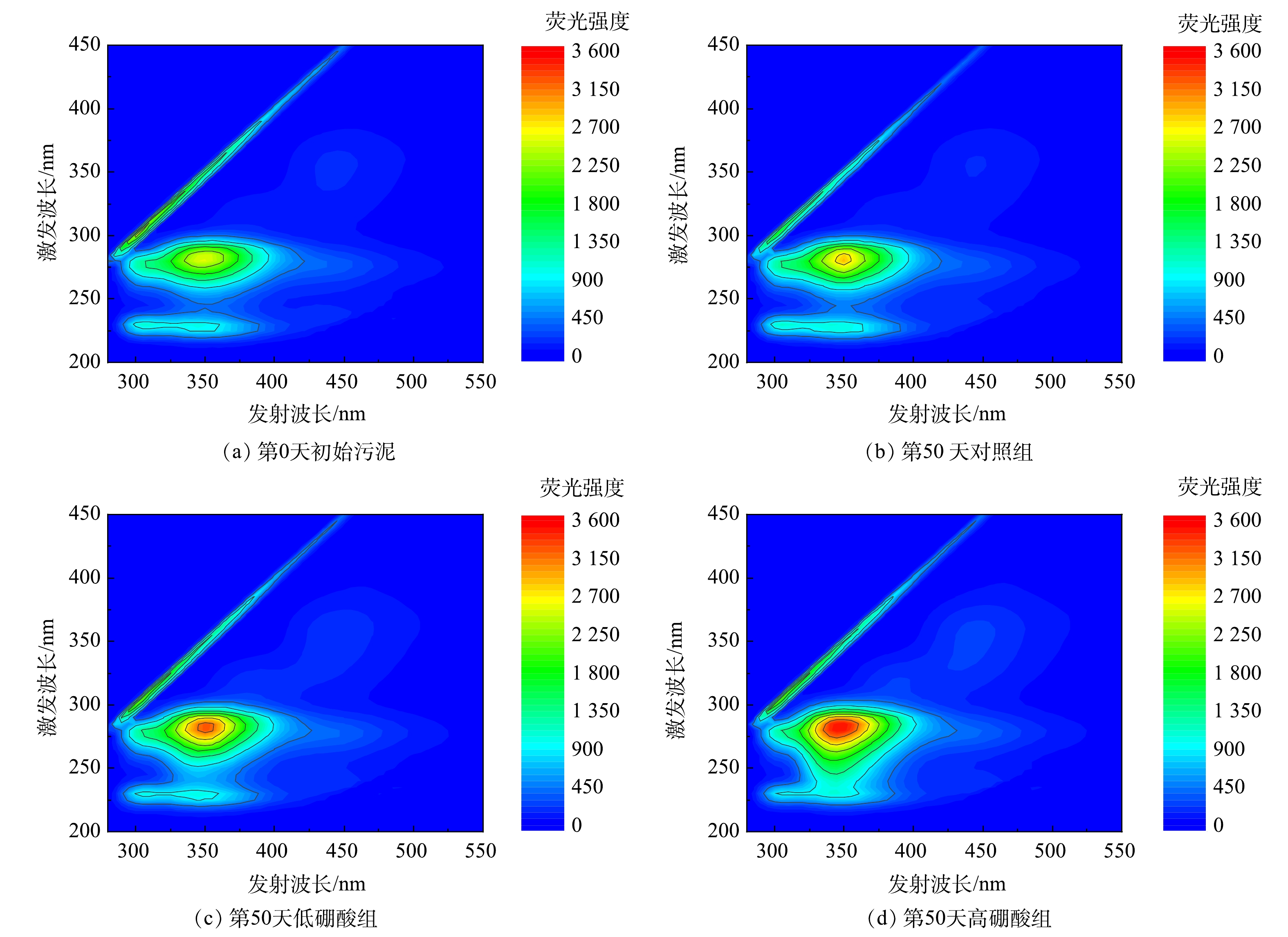
表 2 3个A/O反应器PN/PS值Table 2. PN/PS values of EPS in the three groups of reactors组别 SMP LB TB 15 d 30 d 50 d 15 d 30 d 50 d 15 d 30 d 50 d 对照组 0.91 1.27 1.64 0.92 1.00 1.04 1.16 1.25 1.31 低硼酸组 1.31 2.04 1.97 1.02 0.99 0.94 1.26 1.32 1.54 高硼酸组 1.35 1.77 2.03 1.02 0.95 0.93 1.30 1.49 1.63 EEM图谱可表征EPS组分的变化,结果如图6所示,EEM图谱中主要有4个荧光峰A、B、C和D,分别位于355 nm/445 nm、280 nm/345 nm、230 nm/310 nm、230 nm/345 nm。根据COBLE等[31]的方法,确定A峰为类腐殖质峰,A峰荧光强度较弱;B峰和D峰为类蛋白质峰,其中荧光与芳香族氨基酸色氨酸相关;C峰为类蛋白质峰,其中荧光与芳香族氨基酸酪氨酸相关。光谱的所有荧光参数,包括峰位置、荧光强度列于表3中。由EEM图谱可知,A、B、C和D峰的荧光强度均随着时间的推移逐渐升高,添加硼酸的反应器荧光强度增加尤为显著。其中B峰增加的幅度最大,低硼酸组和高硼酸组的色氨酸峰B强度分别较对照组增加了16%和23%。可见,硼酸对EPS中的荧光物质影响显著,尤其是以色氨酸为代表的疏水性氨基酸。色氨酸是一种疏水氨基酸,疏水性有助于微生物的聚集和活性污泥的稳定,这也解释了活性污泥稳定性增强的原因[32]。类似的结果是,在ZHANG等[9]的研究中,添加硼酸的反应器好氧颗粒污泥EPS的色氨酸峰强度增加了60%。因此,外源添加硼酸能改变EPS的组成成分,促进微生物分泌更多的胞外蛋白,增加色氨酸类氨基酸的形成,从而增强污泥的稳定性。
表 3 不同时期3组反应器EPS的EEM图谱峰位置和峰强度Table 3. Peak positions and intensities of EEM spectra of EPS in three groups of reactor during different periods组别 A峰 B峰 C峰 D峰 (Ex/Em)/nm 峰强度 (Ex/Em)/nm 峰强度 (Ex/Em)/nm 峰强度 (Ex/Em)/nm 峰强度 初始污泥 355/445 163.495 280/345 2 564.341 230/310 787.594 230/345 698.425 50 d后对照组 355/445 199.238 280/345 2 857.216 230/310 819.167 230/345 897.456 50 d后低硼酸组 355/445 216.951 280/345 3 312.845 230/310 871.534 230/345 917.816 50 d后高硼酸组 355/445 221.338 280/345 3525.259 230/310 983.037 230/345 1065.931 2.4 硼酸对功能细菌的影响
由于添加硼酸显著提高了
NO−2 表 4 3组反应器AOB和NOB的相对丰度Table 4. Relative abundance of AOB and NOB in the three groups of reactors处理组 AOB的相对丰度/% Nitrobacter的相对丰度/% Nitrospira的相对丰度/% 对照组 18.92 0.23 11.26 低硼酸组 18.68 0.24 16.59* 高硼酸组 19.22 0.29 20.37* 注:*表示差异显著,P<0.05。 2.5 硼酸对反应器中信号分子AI-2质量浓度的影响
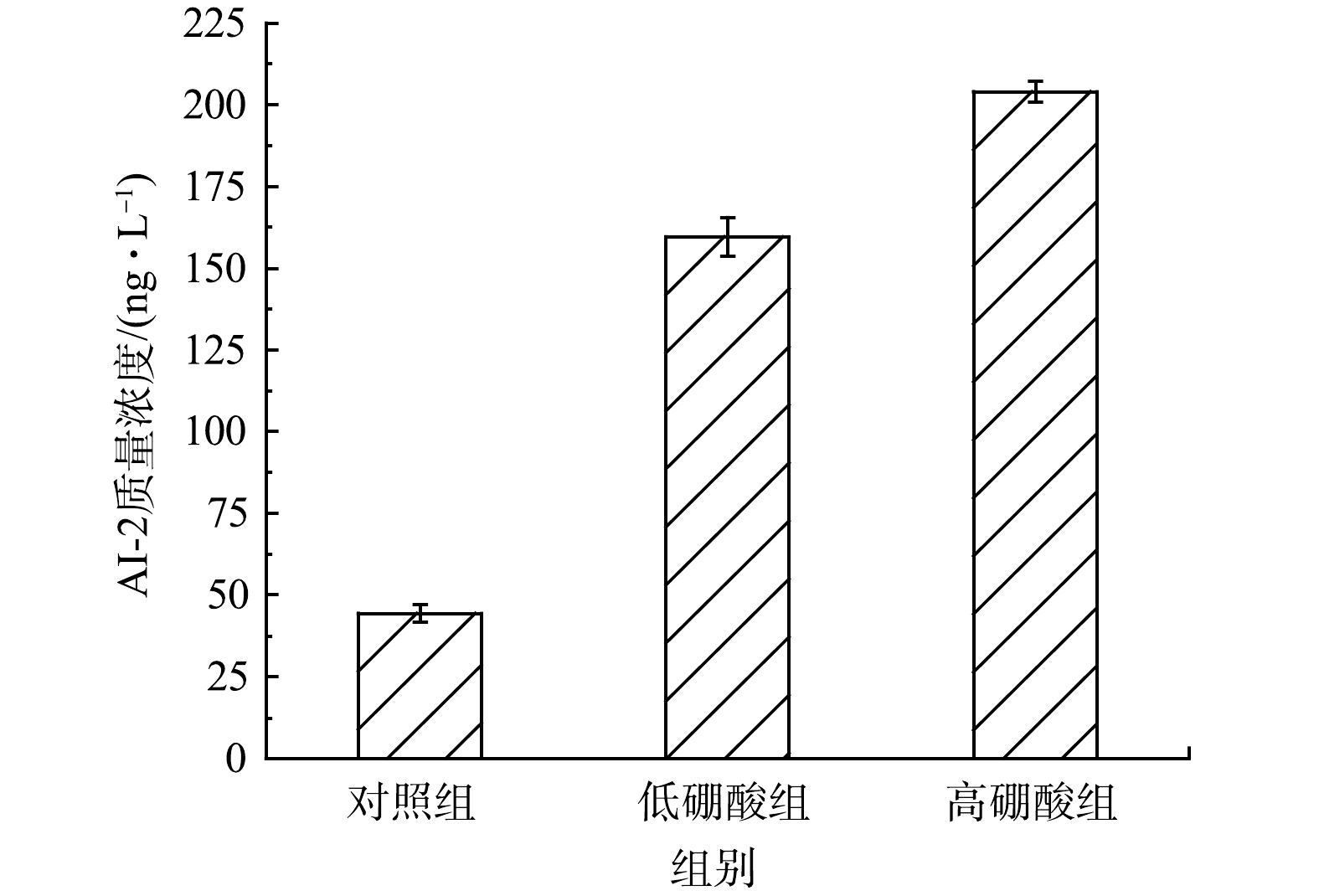
AI-2介导的QS与水处理过程中细菌的结构和功能有着密切的联系[34-35]。运行50 d后出水中实验组AI-2的质量浓度显著高于对照组(图7)。添加硼酸会触发AI-2介导的群体感应,低硼酸组和高硼酸组的AI-2质量浓度分别是对照组的3倍和4倍,这可能是由于硼与DPD以及LuxP-AI-2共复合物的形成受到刺激[9]。AI-2有利于EPS总量和细胞粘附性的增加[35]。对AI-2质量浓度和污泥的平均生长速率、总EPS、TB-EPS的PN/PS值、Nitrospira菌群相对丰度之间进行皮尔逊相关性分析发现,AI-2质量浓度与TB-EPS的PN/PS值之间显著相关(P=0.02),与其他变量之间总体趋势一致但相关性不显著(P>0.09),说明AI-2主要通过调控TB-EPS进而影响总EPS、污泥的平均生长速率和功能细菌相对丰度的变化。综上所述,硼酸对硝化污泥影响的可能机制如下:添加硼酸促进细菌分泌AI-2;AI-2的调控虽然增加了NOB数量,但降低了NOB活性,刺激EPS产生,改变微生物群落结构,进而促进短程硝化反应器的启动。
短程硝化系统的性能在很大程度上取决于硝化细菌的活性和生长速度,而另一种信号分子N-酰基高丝氨酸内酯(N-acyl homoserine lactones,AHLs)在介导QS过程中也发挥了重要作用[36]。不同类型的AHL对硝化系统的作用不同,C4-HSL与AOB活性有关,有利于亚硝酸盐的积累;而C6-HSL和C8-HSL能够抑制AOB活性,促进NOB活性[37-38]。添加适当类型的AHL可以选择性地促进AOB的活性和生长,从而为AOB提供优于NOB的竞争优势,有助于实现稳定的亚硝酸盐积累[37]。在本研究中,虽然反应器维持了良好的短程硝化效果,但AOB的丰度没有显著增加,可能是由于经硼酸处理后AOB活性增加,而AI-2虽然能提高NOB中Nitrospira菌群相对丰度,但可能种间通讯强化了FA和FNA对亚硝酸盐还原酶的抑制作用,NOB活性仍然保持在较低水平,进而导致NO2−-N的积累。
3. 结论
1)硼酸的加入能够促进反应器内NO2−-N的积累,从而快速实现短程硝化。
2)硼酸的加入能够显著增加信号分子AI-2的含量,进而增加了EPS的产量,尤其对EPS中PN的促进更为明显;以色氨酸为代表的疏水性氨基酸的含量增加显著。
3)从QS调控的角度分析,高浓度的AI-2强化了微生物的种间通讯,抑制了NOB的活性、加速了EPS的形成,改变了微生物群落结构,从而成功启动了短程硝化反应器。
-
表 1 高盐排水回收氮磷影响因素正交实验表
Table 1. Orthogonal experiment table of influencing factors of nitrogen and phosphorus recovery by high salt drainage
实验号 pH Mg∶P N∶P A B C 1 8 1.0 1.0 2 9 1.5 1.5 3 10 2.0 2.0 4 11 2.5 4.0 表 2 高盐排水主要离子成分及含量
Table 2. Main ion composition and content of high salt drainage
mg·L−1 排水 Ca2+ Mg2+ Na+ K+ 高盐排水 1 532.00±287.00 2 136.00±565.34 55 461.58±1024.22 1 006.56±105.25 农田排水 512.10±101.68 366.10±93.76 1 071.28±206.39 176.98±20.13 排水 CO2−3 HCO−3 Cl− SO2−4 高盐排水 未检出 164.57±20.35 71 680.80±787.45 27 058.75±458.54 农田排水 23.43±4.72 316.66±75.44 1 422.70±351.88 2 331.84±301.03 表 3 高盐排水磷平均回收率主体间效应检验
Table 3. Inter subject effect test of average phosphorus recovery rate by high salt drainage
实验号 pH Mg∶P N∶P 磷回收率/% A B C 1 8 1.00 1.00 28.51 2 8 1.50 1.50 39.25 3 8 2.00 2.00 63.76 4 8 2.50 4.00 79.50 5 9 1.00 1.50 42.04 6 9 1.50 1.00 78.92 7 9 2.00 4.00 80.14 8 9 2.50 2.00 91.83 9 10 1.00 2.00 49.33 10 10 1.50 4.00 85.27 11 10 2.00 1.00 88.88 12 10 2.50 1.50 85.83 13 11 1.00 4.00 4.42 14 11 1.50 2.00 20.44 15 11 2.00 1.50 22.95 16 11 2.50 1.00 28.33 K1 52.76 31.08 56.16 K2 73.23 55.97 47.52 K3 77.33 63.93 56.34 K4 19.04 71.37 62.33 R 58.29 40.29 14.81 SS 8 512.33 3 679.26 446.06 表 4 高盐排水磷平均回收率主体间效应检验
Table 4. Inter subject effect test of average phosphorus recovery rate by high salt drainage
来源 平方和 自由度 均方 F 显著性 修正模型 12 637.64 9 1 404.18 33.68 0.000 截距 49 439.52 1 49 439.52 1 185.65 0.000 A 8 512.33 3 2 837.44 68.05 0.000 B 3 679.25 3 1 226.42 29.41 0.001 C 446.06 3 148.68 3.57 0.087 误差 250.19 6 41.70 总计 62 327.35 16 修正后总计 12 887.83 15 -
[1] 马鸿文, 刘昶江, 苏双青, 等. 中国磷资源与磷化工可持续发展[J]. 地学前缘, 2017, 24(6): 133-141. [2] 贺周初. 我国磷资源开发利用现状与发展方向探讨[J]. 矿冶工程, 2012, 32(6): 128-131. [3] 李小东, 张凤华, 朱煜. 新疆南疆典型地区农业灌溉水质与土壤盐渍化关系的研究[J]. 新疆农业科学, 2016, 53(7): 1260-1267. [4] 田立文, 祁永春, 戴路, 等. 新疆南疆耕地土壤养分含量及其分布特征评价: 以阿克苏地区为例[J]. 核农学报, 2020, 34(1): 214-223. doi: 10.11869/j.issn.100-8551.2020.01.0214 [5] 张奇誉, 刘来胜. 农村分散式生活污水源分离技术现状与发展趋势分析[J]. 中国农村水利水电, 2020, 4(8): 20-24. doi: 10.3969/j.issn.1007-2284.2020.08.004 [6] TANG X, MIN W, RUI L, et al. Prospect of recovering phosphorus in magnesium slag-packed wetland filter[J]. Environmental Science & Pollution Research International, 2017, 24(29): 1-8. [7] 唐朝春, 吴庆庆, 段先月, 等. 利用吸附法处理废水中磷酸盐的研究进展[J]. 长江科学院院报, 2018, 35(4): 18-23. doi: 10.11988/ckyyb.20161181 [8] 员建, 苑宏英, 陈轶, 等. 化学沉淀法回收污泥中氮磷的影响因素研究[J]. 环境科学与技术, 2011, 34(6): 148-151. doi: 10.3969/j.issn.1003-6504.2011.06.033 [9] 郝晓地, 于晶伦, 刘然彬, 等. 剩余污泥焚烧灰分磷回收及其技术进展[J]. 环境科学学报, 2020, 40(4): 1149-1159. [10] LEE M, KIM D. Trends of phosphorus recovery technology from sewage sludge ash by wet chemical method[J]. Journal of Korean Society of Water and Wastewater, 2018, 32(2): 131-141. doi: 10.11001/jksww.2018.32.2.131 [11] DESROSIERS D, VANEECKHAUTE C. Author correction: Phosphorus removal and recovery from wastewater via hybrid ion exchange nanotechnology: A study on sustainable regeneration chemistries[J]. NPJ Clean Water, 2021, 4(1): 14. doi: 10.1038/s41545-021-00104-7 [12] LI B, JING F, HU Z, et al. Simultaneous recovery of nitrogen and phosphorus from biogas slurry by Fe-modified biochar[J]. Journal of Saudi Chemical Society, 2021, 25(2018): 101213. [13] CHEN Y, ZHENG X, FENG L, et al. Efficient recovery of carbon, nitrogen, and phosphorus from waste activated sludge.[J]. Water Science & Technology, 2013, 68(4): 916-922. [14] 郝晓地, 衣兰凯, 王崇臣, 等. 磷回收技术的研发现状及发展趋势[J]. 环境科学学报, 2010, 30(5): 897-907. [15] 霍守亮, 席北斗, 刘鸿亮, 等. 磷酸铵镁沉淀法去除与回收废水中氮磷的应用研究进展[J]. 化工进展, 2007, 26(3): 371-376. doi: 10.3321/j.issn:1000-6613.2007.03.014 [16] 张冬梅. 猪场废水氮磷MAP回收工艺及其对传统厌氧-好氧处理系统的影响研究[D]. 杭州: 浙江大学, 2013. [17] 李洪刚, 陈玉成, 肖广全, 等. 鸟粪石结晶法处理牛场沼液过程中磷形态转化[J]. 农业工程学报, 2016, 32(3): 228-233. doi: 10.11975/j.issn.1002-6819.2016.03.033 [18] 雍飞, 阳剑, 王家硕, 等. 基于纳滤多膜与太阳光热技术的南疆盐碱水分析研究[J]. 农业与技术, 2020, 40(21): 7-8. [19] 吴健, 平倩, 李咏梅. 鸟粪石结晶成粒技术回收污泥液中磷的中试研究[J]. 中国环境科学, 2017, 37(3): 941-947. [20] WANG J, YE X, ZHANG Z, et al. Selection of cost-effective magnesium sources for fluidized struvite crystallization[J]. Journal of Environmental Sciences, 2018, 70(8): 144-153. [21] 王浩, 王学江, 袁维芳, 等. MgO-PAL回收模拟养猪废水中的氮磷研究[J]. 水处理技术, 2019, 45(6): 28-32. [22] MELGAO L, ROBLES-AGUILAR A, MEERS E, et al. Phosphorus recovery from liquid digestate by chemical precipitation using low cost ion sources[J]. Journal of Chemical Technology & Biotechnology, 2021, 96(10): 2891-2900. [23] 张萍, 许强, 钱清华. 海水为镁源的鸟粪石结晶法回收氮磷的研究[J]. 连云港职业技术学院学报, 2020, 33(1): 13-16. doi: 10.3969/j.issn.1009-4318.2020.01.005 [24] 吕媛, 项显超, 李继云, 等. 海水和苦卤水作为廉价镁源对尿液废水中磷去除的影响[J]. 环境工程, 2019, 37(10): 105-109. [25] SHIRAZINEZHAD M, FAGHIHINEZHAD M, BAGHDADI M, et al. Phosphate removal from municipal effluent by a porous MgO-expanded graphite composite as a novel adsorbent: Evaluation of seawater as a natural source of magnesium ions[J]. Journal of Water Process Engineering, 2021, 43: 102232. doi: 10.1016/j.jwpe.2021.102232 [26] 丁邦新, 白云岗, 柴仲平, 等. 塔里木河下游绿洲灌区土壤盐渍化特征及季节性变化规律[J]. 水土保持通报, 2020, 40(2): 77-84. [27] HUANG H, GUO G, ZHANG P, et al. Feasibility of physicochemical recovery of nutrients from swine wastewater: Evaluation of three kinds of magnesium sources[J]. Journal of the Taiwan Institute of Chemical Engineers, 2017, 70: 209-218. doi: 10.1016/j.jtice.2016.10.051 [28] 沈颖, 叶志隆, 叶欣, 等. 鸟粪石法回收养猪废水中氮磷时产物的组分与性质研究[J]. 环境科学学报, 2013, 33(1): 92-97. [29] MONTALVO S, C HUILIÑIR, CASTILLO A, et al. Carbon, nitrogen and phosphorus recovery from liquid swine wastes: A review[J]. Journal of Chemical Technology & Biotechnology, 2020, 95(9): 2335-2347. [30] 李晓银, 张斯程, 张冬梅, 等. 前处理对猪场废水厌氧段氮磷降解影响研究[J]. 环境科学与技术, 2017, 40(2): 130-134. [31] 衡通, 王振华, 张金珠, 等. 新疆农田排水技术治理盐碱地的发展概况[J]. 中国农业科技导报, 2019, 21(3): 161-169. [32] 杨玉辉, 王兴鹏, 李朝阳, 等. 反渗透技术对南疆咸水淡化处理的适应性[J]. 水处理技术, 2019, 45(10): 121-124. [33] 张军, 李宗阳, 李朝阳, 等. 干旱区农田排水灌溉对枣树根区土壤水盐运移特性的影响[J]. 水土保持学报, 2014, 28(4): 278-282. [34] 周新宇, 吴志健, 王明文. 基于正交实验设计的人工蜂群算法[J]. 软件学报, 2015, 26(9): 2167-2190. [35] 刘建华, 戴文杰, 常欢. EDTA络合滴定法联合测定硅钙钡镁合金中钙钡镁[J]. 冶金分析, 2015, 35(2): 70-73. [36] 惠玉枝. 循环水中钾离子含量的测定方法[J]. 齐鲁石油化工, 2017, 45(3): 249-252. [37] 战楠, 黄毅, 饶竹, 等. 双电极法现场快速检测地下水和湖水中碳酸氢根和碳酸根[J]. 分析化学, 2016, 44(3): 355-360. doi: 10.11895/j.issn.0253-3820.150866 [38] 安泰莹, 文庆珍, 朱金华. 氯离子测定方法研究进展[J]. 河南化工, 2013, 30(Z2): 8-11. [39] 王瑞斌. NaOH间接滴定法快速测定工业废水中硫酸根[J]. 非金属矿, 2008, 31(2): 54-56. doi: 10.3969/j.issn.1000-8098.2008.02.019 [40] 雷立改, 马晓珍, 魏福祥, 等. 水中总氮、总磷测定方法的研究进展[J]. 河北工业科技, 2011, 28(1): 72-76. [41] 刘蕾. 新疆土壤盐分的组成和分布特征[J]. 干旱环境监测, 2009, 23(4): 227-229. doi: 10.3969/j.issn.1007-1504.2009.04.009 [42] 葛军, 申星梅, 吴成志, 等. K+、Na+、Ca2+共存离子对活性炭吸附Cr(Ⅵ)的影响[J]. 环境污染与防治, 2019, 41(1): 6-9. [43] 王纪红, 文闻, 李非, 氯化铵水溶液的分子动力学模拟[J]. 原子与分子物理学报, 2020, 37(1): 113-120. [44] 鲍小丹, 叶志隆, 马建华, 等. 鸟粪石法回收养猪废水中磷时pH对沉淀物组分的影响[J]. 环境科学, 2011, 32(9): 2598-2603. [45] 畅萧, 曾薇, 王保贵, 等. 从剩余污泥厌氧发酵上清液中以鸟粪石形式回收磷[J]. 环境科学, 2019, 40(9): 4169-4176. [46] 李爱秀, 翟中葳, 丁飞飞, 等. 鸟粪石沉淀法回收猪场沼液氮磷工艺参数优化模拟研究[J]. 农业环境科学学报, 2018, 37(6): 1270-1276. doi: 10.11654/jaes.2018-0157 [47] 李晋雅, 张顺, 戴荣海, 等. 鸟粪石结晶法回收磷中Ca2+对产物沉淀特性的影响[J]. 环境工程, 2014, 32(2): 54-58. [48] 尚丽梅, 蒋俊, 俞书宏. 钙离子镁离子共存的纯无机环境中镁方解石介观晶体的形成及其生物学意义[J]. 中国材料科学, 2021, 64(4): 999-1006. [49] 秦玮, 于岩岩, 王峰. 模拟猪场沼液MAP法氮磷回收结晶产物分析[J]. 辽宁化工, 2018, 47(7): 597-600. doi: 10.3969/j.issn.1004-0935.2018.07.002 [50] 倪誉晏, 栾绍玉. 通过某样品中硫酸根的多种测定方法探讨硫、硫酸以及硫酸根测定[J]. 山东化工, 2021, 50(17): 145-146. doi: 10.3969/j.issn.1008-021X.2021.17.055 [51] 俞凌云, 卢艳青, 安胜波. 碳酸氢根和碳酸根检测方法的研究进展[J]. 西部皮革, 2010, 32(19): 48-52. doi: 10.3969/j.issn.1671-1602.2010.19.017 [52] 陈瑶. 以鸟粪石形式从污水处理厂同时回收氨氮和磷的研究[D]. 长沙: 湖南大学, 2006. [53] 李建鹏, 陶进转, 陈冰. 蔗糖酶水解蔗糖的正交试验与SPSS分析[J]. 化学研究与应用, 2019, 31(10): 1807-1811. doi: 10.3969/j.issn.1004-1656.2019.10.015 [54] NGATIMAN M, JAMI M S, BAKAR M, et al. Investigation of struvite crystals formed in palm oil mill effluent anaerobic digester[J]. Heliyon, 2021, 7(1): e05931. doi: 10.1016/j.heliyon.2021.e05931 [55] YAN H, SHIH K. Effects of calcium and ferric ions on struvite precipitation: A new assessment based on quantitative X-ray diffraction analysis[J]. Water Research, 2016, 95(15): 310-318. [56] 卜凡, 谢丽, 陆斌, 等. 鸟粪石结晶法回收猪粪废水厌氧膜出水中磷的研究[J]. 环境工程, 2015, 33(8): 1-4. [57] ZHANG Z, LI B, BRIECHLE M, et al. Effect of acetic acid on struvite precipitation: An exploration of product purity, morphology and reaction kinetics using central composite design[J]. Chemosphere, 2021, 285: 131486. doi: 10.1016/j.chemosphere.2021.131486 [58] LU X, SHIH K, LI X Y, et al. Accuracy and application of quantitative X-ray diffraction on the precipitation of struvite product[J]. Water Research, 2016, 90: 9-14. doi: 10.1016/j.watres.2015.12.014 [59] MEIRA R, PAZ S, JAM C. XRD-Rietveld analysis as a tool for monitoring struvite analog precipitation from wastewater: P, Mg, N and K recovery for fertilizer production[J]. Journal of Materials Research and Technology, 2020, 9(6): 15202-15213. doi: 10.1016/j.jmrt.2020.10.082 [60] 李超群, 林木兰, 林金清. 工艺条件对磷回收过程中鸟粪石沉淀颗粒粒径的影响[J]. 环境工程学报, 2012, 6(3): 936-940. -

















 下载:
下载: