-
氨氮去除是污水处理系统中的重点。应用传统脱氮工艺(硝化-反硝化)处理老龄垃圾渗滤液、工业废水等低碳氮比废水时,不仅能耗高,且需外加有机碳源[1]。短程硝化是将废水中
NH+4 -N转化为NO−2 -N而阻止其进一步生成NO−3 -N的过程[2-5]。将该过程连接厌氧氨氧化工艺(anaerobic ammonium oxidation,Anammox)或反硝化工艺处理废水时,具有能耗低、有机碳源利用量少、污泥产量少等优点,在处理低碳氮比废水方面可达到经济、高效的目的[6]。因利用短程硝化耦合Anammox工艺处理低C/N废水时具有较大优势,所以其工艺已成为研究热点。实现短程硝化的关键在于促进氨氧化菌(ammonia oxidizing bacteria,AOB)生长的同时抑制亚硝酸盐氧化菌(nitrite oxidizing bacteria,NOB)活性,从而保持稳定的亚硝酸盐积累。有研究[7]表明,溶解氧(dissolved oxygen,DO)、pH、温度、游离氨(free ammonia,FA)和游离亚硝酸(free nitrous acid,FNA)等因素能够抑制NOB活性,从而稳定短程硝化过程。吴雪等的[8]研究表明,在pH=8.5、DO=0.8 mg·L−1、温度为30 ℃时可有效抑制NOB活性,从而使亚硝酸盐的积累量达到最大。张宇坤等[9]认为,当FA质量浓度在10 mg·L−1附近时,NOB的活性下降接近50%,而当FNA质量浓度大于0.2 mg·L−1时,NOB的活性被完全抑制,故通过控制FA和FNA有利于实现短程硝化。短程硝化过程不仅会受到NOB活性的影响,而且废水中存在的有机碳源会对短程硝化和厌氧氨氧化过程产生影响,进而可能造成整个工艺无法稳定运行。梁瑜海等[10]认为,化学需氧量(chemical oxygen demand,COD)会抑制AOB和Anammox的活性,从而使反硝化活性上升。李冬等的[11]研究表明,在氨氮质量浓度为100 mg·L−1、COD为300~400 mg·L−1的运行条件下,由于大量COD的存在会使异养好氧菌增殖,从而抑制AOB的活性,影响自养脱氮系统性能的稳定性。CAPODICI等[12]认为,通过高氨氮负荷和高COD值的综合作用也会抑制AOB活性。上述研究均表明,一定的COD值会抑制AOB活性,但未涉及有机碳源对短程硝化系统影响的机理解释,且未通过探究得到明确的调控手段以应对其性能的下降。因此,研究有机碳源对短程硝化工艺启动及稳定性的影响及恢复系统性能的调控手段具有重要意义。
针对上述问题,本研究设置了不同质量浓度的
NH4+ -N和有机碳源,通过调控曝气量、FA和无机碳源量等运行参数,以达到启动并稳定运行短程硝化过程的目的。在此过程中考察了脱氮性能、细胞胞外聚合物(extracellular polymeric substances,EPS)、酶活性以及微生物群落的变化,进而探究有机碳源对该过程的影响及相应的应对策略,以期为短程硝化过程的启动及稳定运行提供依据,同时为后续连接厌氧氨氧化工艺处理老龄垃圾渗滤液提供参考。 -
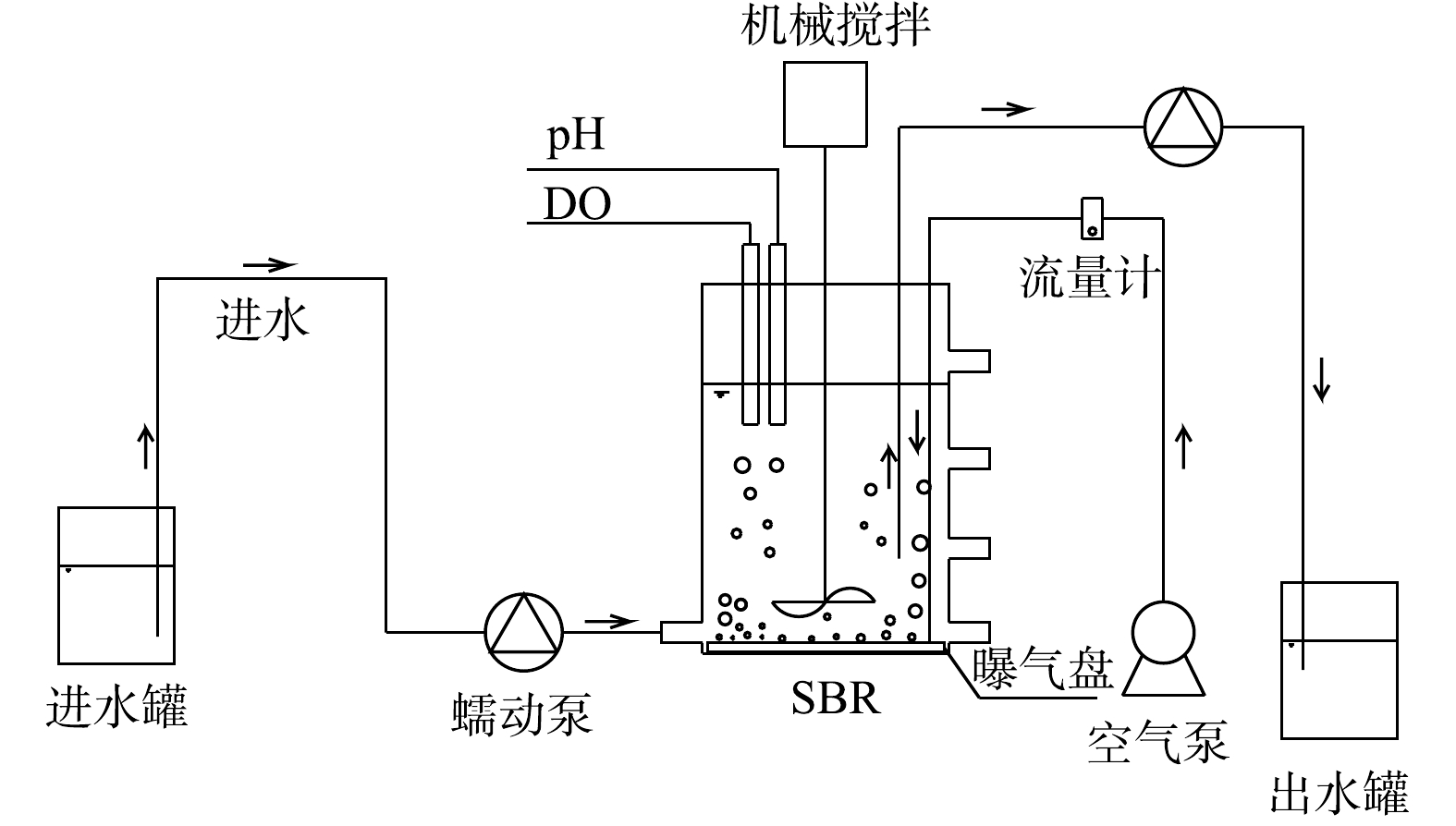
实验装置如图1所示。实验所用的序批式反应器(sequencing batch reactor,SBR)由圆柱形有机玻璃制成,内径为12 cm,高为18 cm,工作体积为1.6 L。反应器由底部进水,设有4个取样口,内部配有搅拌、曝气和控温装置,使DO为0.3~0.5 mg·L−1、温度为(26±1) ℃。反应器运行模式为每天4个周期,每个周期中包括进水15 min,曝气搅拌300 min,沉淀30 min,出水15 min。SBR体积交换比为50%,水力停留时间(hydraulic retention time,HRT)为12 h,污泥停留时间(sludge retention time,SRT)在阶段Ⅳ控制为10~15 d。实验阶段的运行参数见表1。
-
实验中采用人工配制的模拟废水,组成[13-14]如下:1 200 mg·L−1 NaHCO3、10 mg·L−1 KH2PO4、15 mg·L−1 CaCl2·2H2O、300 mg·L−1 MgSO4·7H2O、0.05 mol·L−1 EDTA-Fe2+;1.25 mL·L−1微量元素,其组成为15 g·L−1 EDTA、0.014 g·L−1 H3BO4、0.99 g·L−1 MnCl2·4H2O、0.25 g·L−1 CuSO4·5H2O、0.43 g·L−1 ZnSO4·7H2O、0.19 g·L−1 NiCl2·6H2O、0.21 g·L−1 NaSeO4·10H2O、0.22 g·L−1 NaMoO4·2H2O、0.05 g·L−1 NaWO4·2H2O。进水
NH4+ -N和有机碳源由(NH4)2SO4和CH3COONa(无水)提供。实验接种污泥取自实验室短程硝化反应器种泥。初始混合液悬浮固体浓度(mixed liquor suspended solids,MLSS)为1 050 mg·L−1。 -
通过热提取法提取EPS[15]。采用蒽酮比色法测定多糖含量,用BCA法测定蛋白质(碧云天BCA浓度测定试剂盒)[16]。利用荧光光谱仪(F-7000,Hatchi公司)测定提取的EPS样品,激发波长(Ex)为200~400 nm,发射波长(Em)为290~550 nm,其中激发和发射波长间隔分别为5 nm和1 nm。平行因子(PARAFAC)使用MATLAB进行分析[17],具体方法是:将测得的三维荧光数据转化为三维数据集,对其进行内滤校正和空白扣减,基于PARAFAC法识别三维荧光数据中通过数据校验的模型组分,通过开展平方和误比较、核心一致性和分半检验优选和验证PARAFAC模型,再通过与已知模型库中的模型进行比对,拟合文献中的模型得到各组分得分,计算各组分荧光值,从而对EPS综合分析。
-
NH+4 -N、NO−2 -N、NO−3 -N、MLSS和挥发性悬浮固体浓度(mixed liquid volatile suspended solids,MLVSS)用国家标准法测定[18],COD用哈希快速消解法测定[19],并利用公式对其数据进行校正[20]。使用MP516型台式溶解氧仪(上海三信)和pH计(雷磁)测定DO和pH,使用酶联生物科技公司(江苏晶美生物科技)试剂盒测定氨单加氧酶(ammonia monooxygenase,AMO)、羟胺氧化酶(hydroxylamine oxidase,HAO)、亚硝酸盐氧化酶(nitrite oxidoreductase,NOR)和亚硝酸盐还原酶(nitrite reductase,NIR)的相关活性,酶活性间的单因素方差分析通过Excel完成。系统中的FA、FNA值分别按照式(1)和式(2)进行计算[21]。式中:CFA为游离氨质量浓度,mg·L−1;CFNA为游离亚硝酸质量浓度,mg·L−1;
C[NH+4−N] 为氨氮质量浓度,mg·L−1;C[NO−2−N] 为亚硝酸盐质量浓度,mg·L−1;T为温度,℃。 -
取不同阶段泥水混合液各20 mL,10 000 r·min−1离心去上清液,用于微生物分析。根据E.Z.N.A.® soil DNA kit进行微生物群落总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA浓度和纯度;使用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)对16S rRNA基因V3~V4可变区进行PCR扩增,扩增程序如下:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),后72 ℃稳定延伸10 min,最后在4 ℃进行保存。PCR反应体系为:5×TransStart FastPfu缓冲液4 μL,2.5 mM dNTPs 2 μL,上游引物0.8 μL,下游引物0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,补足至20 μL。每个样本3个重复。将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物利用AxyPrep DNA Gel Extraction Kit进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus™ Fluorometer对回收产物进行检测定量。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
-
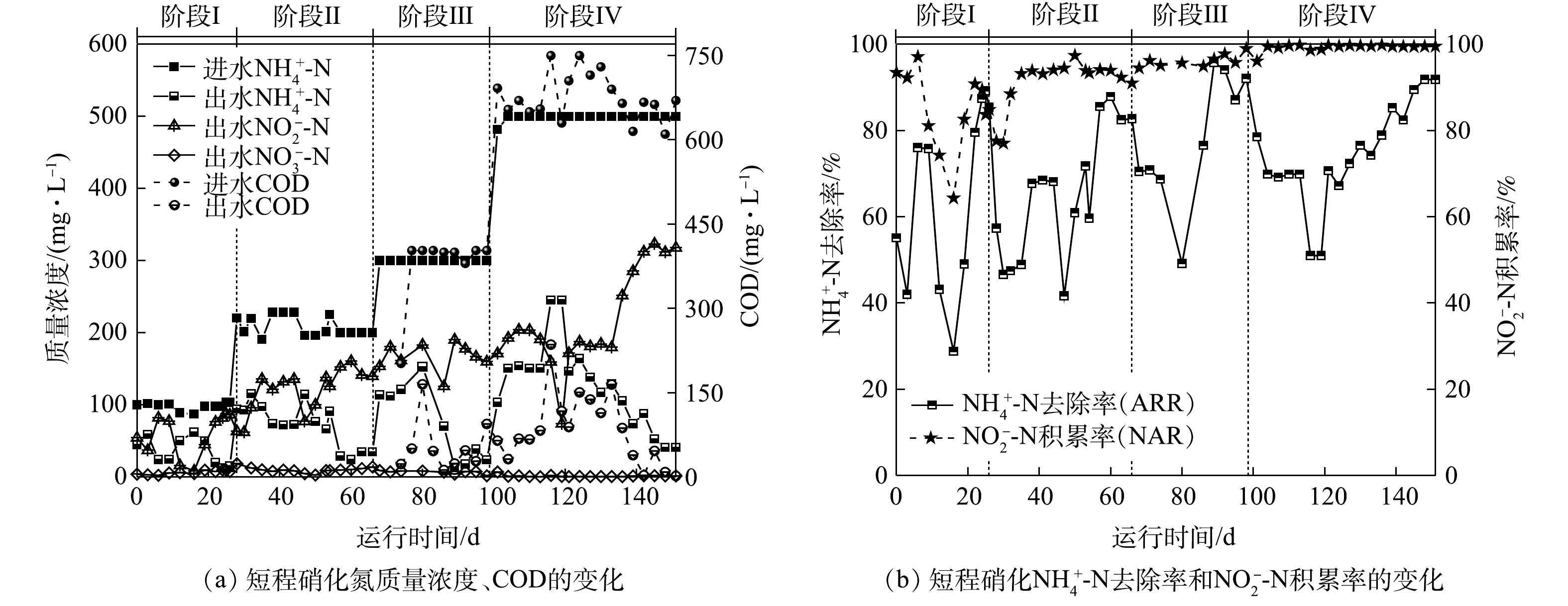
图2反映了反应器运行过程中氮质量浓度、氨氮去除率(ammonia removal rate,ARR)与亚硝酸盐积累率(nitrite accumulation rate,NAR)的变化。由于AOB和NOB的氧饱和常数分别为0.2~0.4 mg·L−1和1.2~1.5 mg·L−1,AOB对氧的亲和力大于NOB[22],因此,在阶段Ⅰ通过控制低DO(0.3~0.5 mg·L−1)可促进AOB生长活性的同时抑制NOB的生长。第3天出水
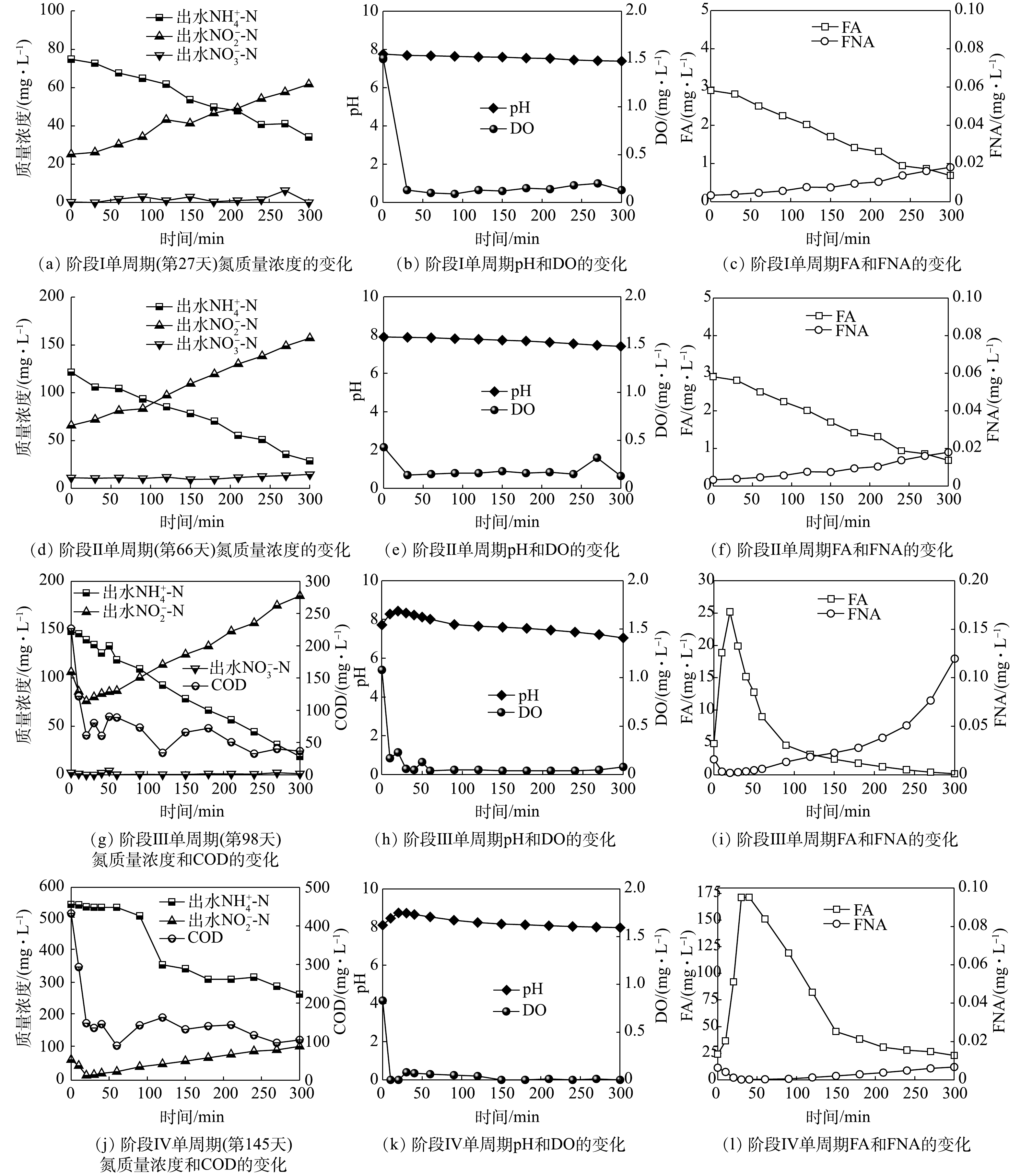
NH+4 -N质量浓度为59 mg·L−1,NO−2 -N质量浓度为37 mg·L−1,NO−3 -N质量浓度为4 mg·L−1,ARR为42%,NAR为92%。这表明在反应初期接种污泥就具有一定的短程硝化能力。但在第12天,由于搅拌速率过大,污泥被打散,沉降性能变差,导致大量污泥随水排出。所以,通过降低搅拌速率和加入少量有机碳源(COD=50 mg·L−1)可促进丝状菌生长恢复絮体结构,增强污泥沉降性能。但加入有机碳源后,ARR明显下降,这是由于异养菌与AOB竞争O2导致其活性下降[23]。据此,在第16天沉降性能恢复后停止加入有机碳源,ARR在第19天回升。第24天后,ARR和NAR分别稳定至(87±2)%和(89±3)%,这表明,通过控制反应器中的曝气量能够维持AOB的生长活性并抑制NOB的生长,进而可以进行稳定的短程硝化过程。
在阶段Ⅱ(28~66 d),将进水
NH+4 -N质量浓度提升至200 mg·L−1。反应初期ARR与NAR持续下降且于第30天分别下降至46%和77%。第32天将曝气速率增加至100 mL·min−1后,第41天ARR与NAR分别上升至68%和93%。但反应器内沉降性能明显下降并存在污泥流失。这是由于在无有机碳源的环境中异养菌生长速率较低,依然无法形成以丝状菌为骨架的污泥絮体,导致污泥沉降性能下降[24]。因此,第44天重新补充有机碳源且将COD值提升至70 mg·L−1后,沉降性能明显恢复,但第47天ARR下降至42%。这是由于提高有机碳源质量浓度导致反应器内异养菌对O2的需求量增加。随后将曝气速率继续增加至150 mL·min−1,ARR与NAR迅速提升至72%和94%并持续稳定。这表明NOB活性继续被抑制,但AOB活性不足无法转化更多的NH+4 -N。此阶段出水pH为6.2,这说明pH过低没有足够的碱度支持短程硝化过程,表明无机碳源量也是影响AOB生长活性的关键因素之一[25]。第54天提升NaHCO3质量浓度至2 000 mg·L−1,ARR迅速上升至88%并于第60~66天稳定在(85±3)%,且NAR一直维持在(92±1.5)%。单周期实验结果(图3(b))表明,进水pH为8.0时,FA初始质量浓度为6.5 mg·L−1,且在反应过程中FA质量浓度始终维持在1 mg·L−1以上。而FA抑制AOB和NOB的质量浓度分别为10~150 mg·L−1和0.1~1 mg·L−1,因此,在整个反应过程中FA对NOB都存在持续抑制作用[26]。这说明,在阶段Ⅱ通过曝气量、FA与无机碳源量结合的控制策略可稳定短程硝化过程。在阶段Ⅲ(67~98 d),将
NH+4 -N质量浓度和COD值提升至300 mg·L−1和400 mg·L−1,并将曝气速率提升至200 mL·min−1。负荷提升后ARR在第80天降低至49%,NAR无明显变化。这是由于提升负荷后异养菌消耗COD利用了更多O2,导致反应器内缺乏O2供AOB利用。随后将曝气速率增加至300 mL·min−1,DO仍维持在0.3~0.5 mg·L−1。ARR迅速升高并稳定至(92±2)%,NAR在此过程中维持在(97±2)%。通过单周期实验数据可得(图3(c)),在周期前50 min内FA持续处于高质量浓度(13~25 mg·L−1),抑制了AOB的活性进而影响NH+4 -N的转化,之后FA随pH的降低而降低,NH+4 -N转化速率加快,AOB活性恢复。而FA和FNA质量浓度直到周期结束时都高于抑制NOB的质量浓度(FA=0.16 mg·L−1,FNA=0.013 mg·L−1),因此,在整个过程中可通过低DO、高FA和高FNA综合抑制NOB。同时,单周期实验结果表明,在该阶段的前25 min,反应器内NO−2 -N质量浓度由106 mg·L−1降低至76 mg·L−1,COD值由226 mg·L−1迅速降低至60 mg·L−1,pH由7.72迅速上升至8.43。这表明在前25 min,反应器内以NO−2 -N为底物消耗有机碳源进行反硝化。当COD降低至60 mg·L−1后,由于缺乏有机碳源,反硝化无法继续进行[27],之后反应器内NO−2 -N质量浓度开始积累,并在反应结束时上升至184 mg·L−1,这说明短程硝化占主导作用。在阶段Ⅳ(99~151 d),分别提升
NH+4 -N质量浓度和COD值至500 mg·L−1和670 mg·L−1,提高曝气速率至600 mL·min−1。第113天出水NH+4 -N和NO−2 -N质量浓度分别达到150 mg·L−1和190 mg·L−1,ARR与NAR分别稳定在(68±0.5)%和(99±0.5)%。其中ARR仍小于85%,说明仅提升曝气速率后不能提高ARR。第113天将进水NaHCO3调整为3 000 mg·L−1后,第116天ARR继续下降至51%,表明提升碱度也不能提高ARR。由单周期实验数据(图3(d))可知,前30 min内反硝化导致pH升高,进而FA在该段持续增强抑制AOB活性,并在60 min超过抑制AOB的阈值(150 mg·L−1)达到171 mg·L−1,完全抑制其活性,出水NH+4 -N质量浓度无下降趋势。随后于第121天将进水pH调整至7.3(FA=8 mg·L−1)后,出水NH+4 -N和NO−2 -N的质量浓度立即下降至146 mg·L−1和171 mg·L−1。这是由于此阶段调整FA质量浓度后AOB活性恢复,即使每周期反应前50 min反硝化产碱依然导致FA升高从而抑制AOB活性,但随着短程硝化过程的进行会消耗碱度使FA质量浓度降低无法完全抑制AOB活性。但由于ARR仍小于85%,且出水NO−2 -N和TN质量浓度继续下降,说明反硝化作用持续增强。据此,增大曝气速率至1.5 L·min−1。第145天ARR迅速提升,并于第145~151天稳定在(91±1.36)%,NAR继续维持在(99±0.04)%,出水NH+4 -N和NO−2 -N质量浓度分别为41 mg·L−1和318 mg·L−1,这说明在高质量浓度NH+4 -N和有机碳源下已稳定运行短程硝化过程。 -
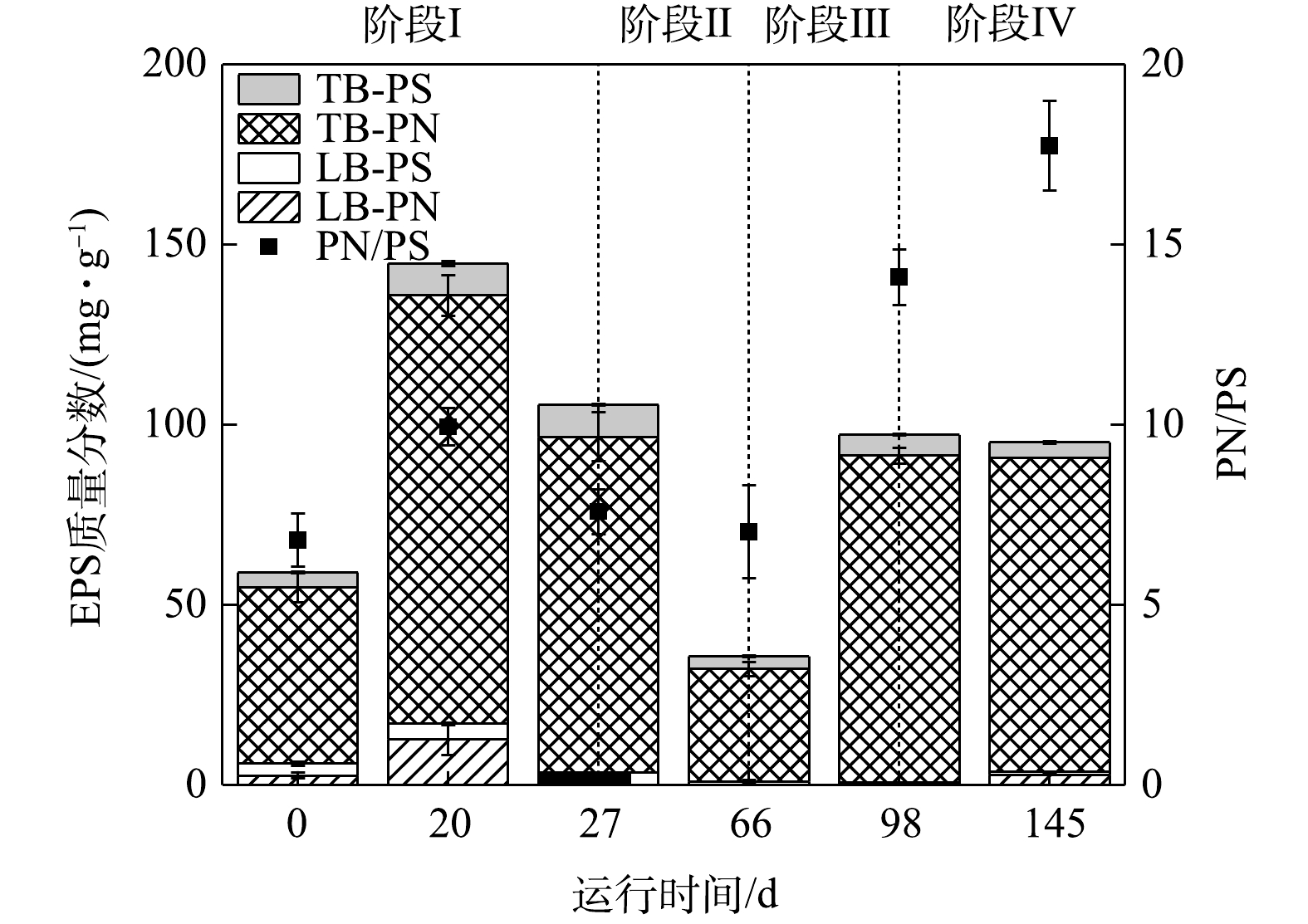
1) EPS质量分数的变化。各实验阶段EPS质量分数的变化情况如图4所示。接种污泥中EPS质量分数的平均值为(56.38±3.65) mg·g−1。第20天,由于反应环境中污泥沉降性能变差,导致MLSS和MLVSS急剧下降。在反应器中添加200 mL污水处理厂活性污泥后,其显著增加至(144.70±10.15) mg·g−1。这是由于,在添加污泥后MLSS和MLVSS上升,污泥中微生物量增加,EPS质量分数增加[28]。第27天,短程硝化过程稳定后,EPS质量分数的平均值为(105.56±6.66) mg·g−1。由于在添加活性污泥后,一定量的异养菌进入反应器内,而进水中不存在有机碳源,因此,异养菌利用了一部分EPS作为有机碳源,这导致EPS质量分数下降[29]。
阶段Ⅱ提升氮负荷后,加入少量有机碳源(COD=70 mg·L−1),第66天EPS质量分数下降至(35.70±1.40) mg·g−1。这是因为,引入少量有机碳源后,激活了异养菌的内源反硝化作用,在利用反应器中有机碳源的基础上进一步利用EPS作为碳源,导致EPS明显下降[30]。阶段Ⅲ、Ⅳ增加有机碳源至400 mg·L−1和670 mg·L−1,第98天测得EPS质量分数上升并稳定至(97.16±1.93) mg·g−1和(92.16±0.32) mg·g−1。这表明反应器内有机碳源充足的情况下,异养菌不再将大量EPS作为有机碳源进行内源反硝化,EPS质量分数已趋于稳定,从而反应器内污泥的沉降性能良好。
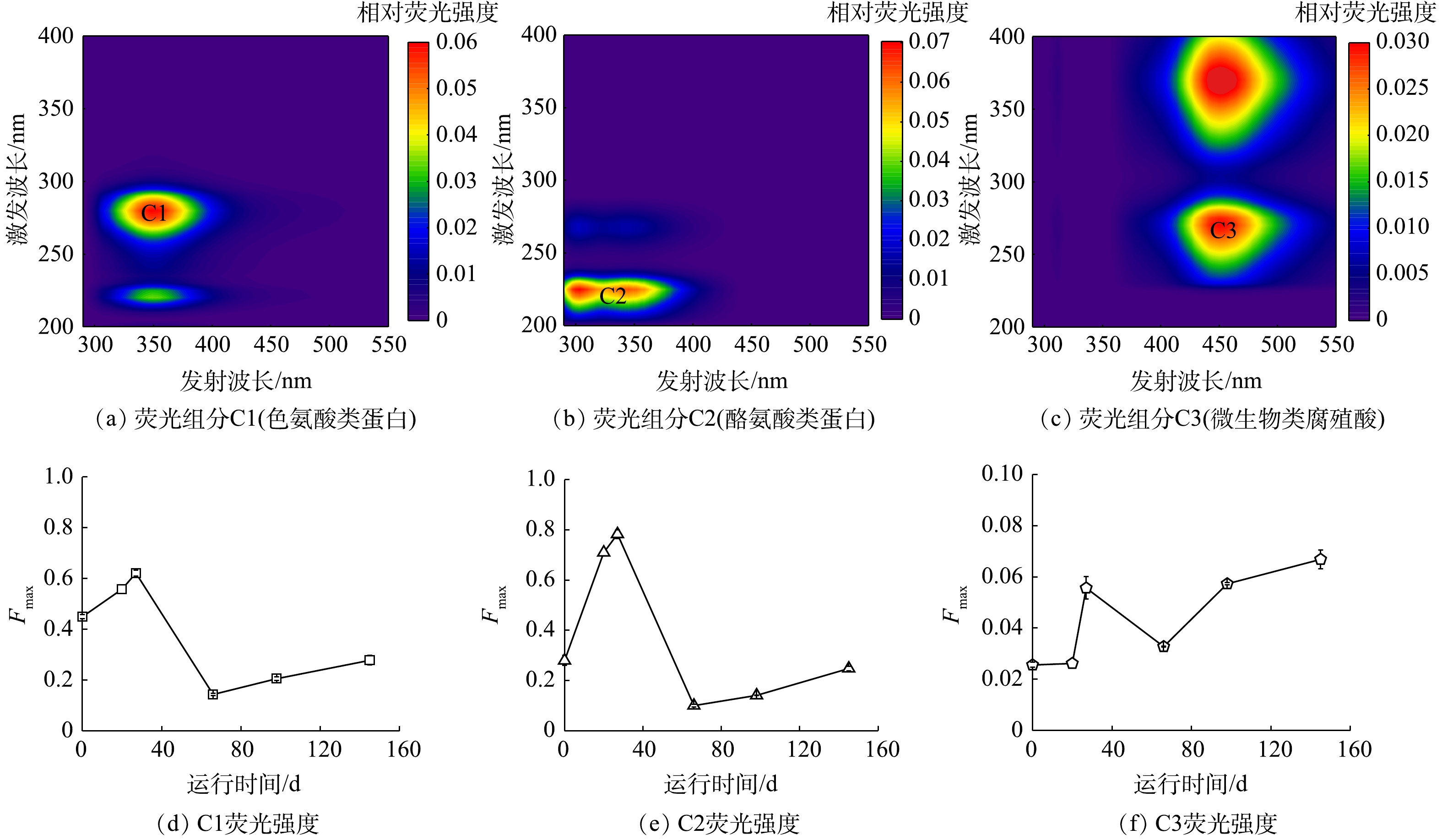
2) EPS的三维荧光光谱的平行因子分析。利用三维荧光的平行因子PARAFAC模型对EPS进行分析,有3种组分存在于EPS中(图5)。其中C1激发峰在220 nm和280 nm处,并在349 nm处有1个发射峰,为色酪氨酸蛋白质[31];组分C2激发波长在225 nm和270 nm,并在303 nm和345 nm处有2个发射峰,为类酪氨酸蛋白质[32];组分C3激发波长在270 nm和370 nm,且发射峰在451 nm,为微生物类腐殖酸[33]。
通过平行因子分析,确定了各组分的荧光强度(Fmax)。有研究[17]表明,Fmax值与各组分的浓度之间呈正相关性。由图5(d)和图5(e)中可知,组分C1和C2类色氨酸和类酪氨酸蛋白质在阶段Ⅰ的Fmax值由0.45和0.28上升至0.62和0.78,在阶段Ⅱ迅速下降至0.14和0.10,且在阶段Ⅲ、Ⅳ中继续上升,最终达到0.28和0.25。C1和C2的 Fmax值的变化趋势(图5(d)和图5(e))与EPS中蛋白质质量分数的变化趋势(图4)一致,这进一步验证了有机碳源对系统中污泥EPS质量分数的影响。对于组分C3微生物类腐殖酸的Fmax值的变化如图5(f)所示。阶段ⅠFmax由0.03上升至0.06,在阶段Ⅱ迅速下降至0.03,并于阶段Ⅲ、Ⅳ中有明显上升趋势,且最终达到0.07。这是由于,阶段Ⅰ混合了部分活性污泥,泥量增多,并且其混合的部分微生物可能无法快速适应反应环境,使得反应体系内细菌凋亡的数量增多,从而分泌更多的类腐殖酸。虽然阶段Ⅱ提升了氮负荷,但同时投加的有机碳源使体系内异养菌大量增殖,因而减少一定的内源呼吸作用,且微生物能够逐渐适应其生长环境,细菌凋亡数量减少,从而产生的类腐殖酸减少。而阶段Ⅲ、Ⅳ中继续提升氮质量浓度和COD值后,其产生的类腐殖酸有上升趋势,说明污染物浓度过高会对系统产生一定冲击,造成细菌凋亡数量增多。
-
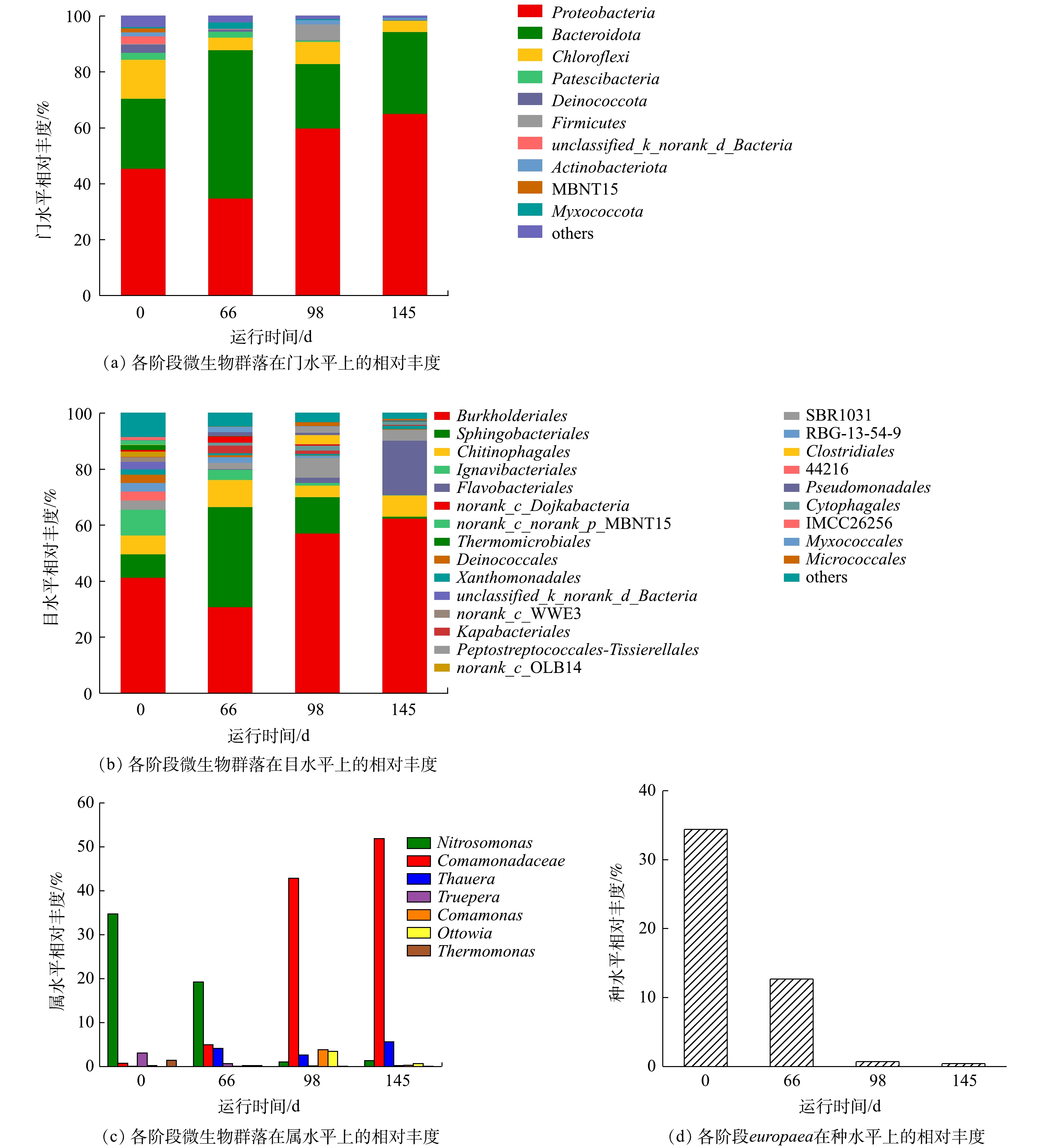
实验各阶段的微生物群落的结构分布如图6所示。图6(a)是污泥样品在门水平上的微生物组成结构,其中的优势菌门主要包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和绿弯菌门(Chloroflexi)。其中Proteobacteria的相对丰度逐渐由45.6%上升至65.1%,Bacteroidetes的相对丰度波动较大,但仍然在总数中占据优势。根据文献报道,Proteobacteria和Bacteroidetes是生物脱氮过程中的优势菌门,在污水处理过程中起到重要作用[34]。
如图6(b)所示,在目水平上,β-变形菌目(Burkholderiales)和鞘脂杆菌目(Sphingobacteriales)分别是Proteobacteria和Bacteroidetes的优势种群。其中Burkholderiales的相对丰度由41.4%上升至62.5%,这是由于反应器内有机碳源的增加导致异养菌的迅速增殖。Sphingobacteriales的相对丰度由8.5%先上升至35.8%再降低至7.1%。这是因为Sphingobacteriales可利用蛋白质和多糖作为有机碳源[30]。因此,当阶段Ⅱ有机碳源不足的情况下EPS消耗严重,阶段Ⅲ、Ⅳ当有机碳源充足时,Sphingobacteriales转而利用有机碳源而对EPS的消耗减少。因此,Sphingobacteriales在阶段Ⅱ相对丰度迅速上升,在阶段Ⅲ、Ⅳ迅速下降。
微生物群落分布的属水平结构分布如图6(c)所示。其优势菌属为反硝化菌属(Comamonadaceae)和亚硝化单胞菌属(Nitrosomonas)。其中Comamonadaceae的相对丰度由0.70%上升至51.89%,这是因为COD值的升高可为反硝化菌属(Thauera、Comamonas、Ottowia、Thermomonas)提供有利环境,进而反硝化菌迅速生长[35-37]。Nitrosomonas属可大致分为europaea和eutropha,通过微生物群落的种水平可分析得出(图6(d)),europaea是Nitrosomonas属的优势种,相对丰度由34.40%降低至0.41%,从而导致Nitrosomonas属的相对丰度由34.7%下降至1.35%。快速增殖的异养菌成为优势菌群,而这种下降并不意味着AOB数目的减少,而是由于作为自养菌的AOB增殖速度远远小于异养微生物,所以在反应器中引入有机碳源后,europaea在这种环境下逐渐失去优势[23]。但通过各阶段的氮质量浓度变化数据可得出其相对丰度的下降并没有严重影响短程硝化过程。
-
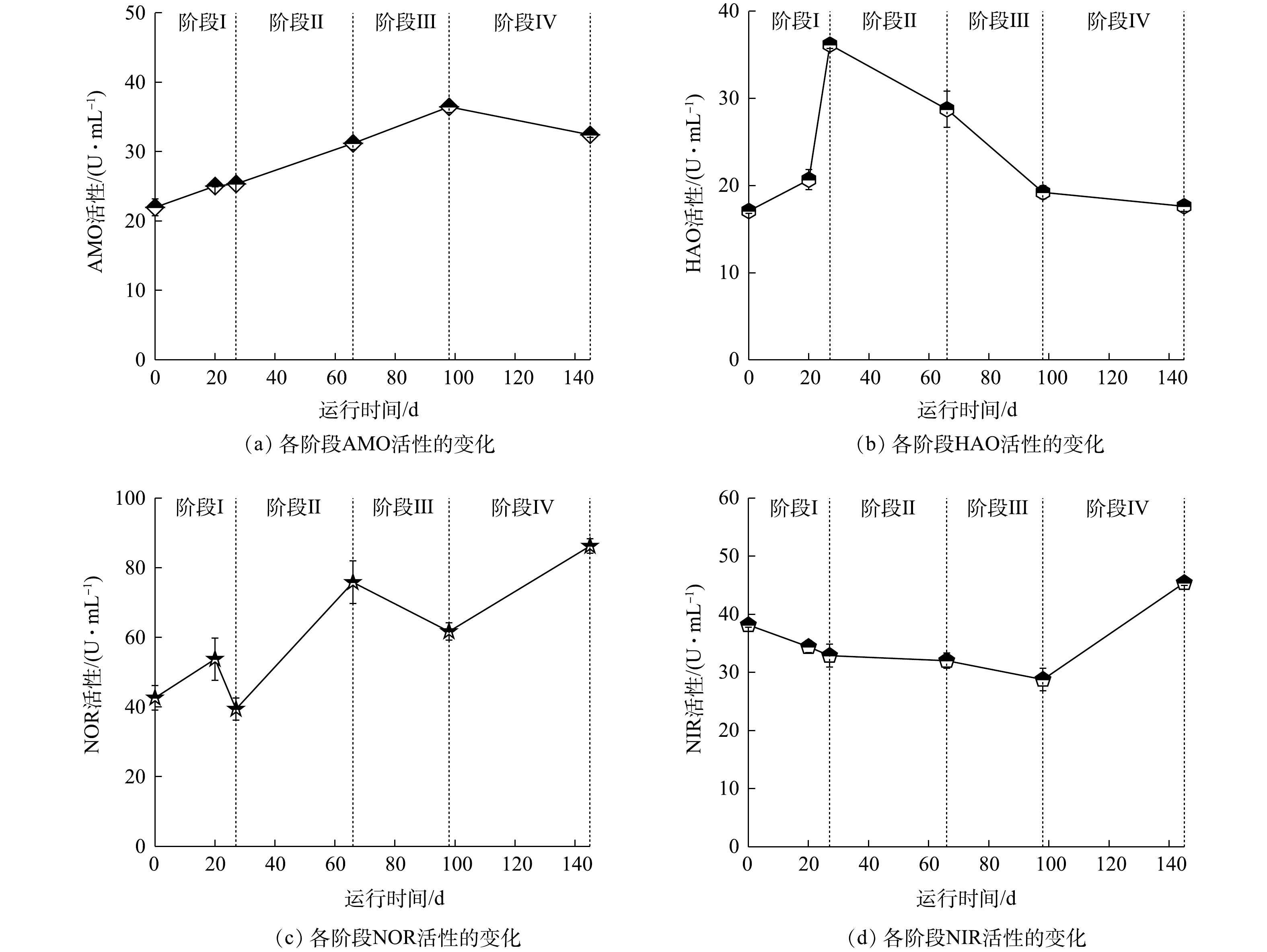
本实验研究了各阶段的AMO、HAO、NOR和NIR的活性,结果如图7所示。AMO为硝化过程中氨氮转化为羟胺过程中所参与的酶。其中AMO在第0天活性为21.97 U·L−1,在每阶段提升氮负荷后,活性均呈上升趋势,并在第145天稳定在32.42 U·L−1。根据单因素方差分析结果可知,第66天AMO活性出现显著性变化(P<0.05),并于阶段Ⅲ、Ⅳ呈极显著变化(P<0.01),说明随着进水
NH+4 -N质量浓度的增加,调整运行参数后,反应体系内AMO活性上升,从而使氨氧化能力提升。HAO是硝化过程中羟胺转化为NO−2 -N的过程中所参与的酶,HAO在第0天活性为17.08 U·mL−1,在阶段Ⅰ加入活性污泥后活性达到36.16 U·mL−1,变化显著。这是因为活性污泥中也存在短程硝化过程,在加入活性污泥后,经过低DO的条件运行,使其酶活性上升,提升了反应器内羟胺氧化能力。第66天其活性开始下降,并在第145天下降至17.61 U·mL−1。这是因为反应体系内随着进水NH+4 -N质量浓度的增加,中间产物NH2OH质量浓度也随之上升,而体系内超过一定质量浓度的NH2OH会对HAO产生抑制[39];同时,由于进水COD值的上升导致AOB对O2的竞争能力减弱,导致其活性下降。NOR是硝化过程中NO−2 -N到NO−3 -N过程中所参与的酶,通过对各阶段NOR活性的测定,阶段Ⅱ的NOR活性显著上升,并在阶段Ⅳ上升至86.22 U·L−1。结合微生物群落分析,在目水平上,Burkholderiales和Sphingobacteriales的相对丰度具有很大优势,有研究[38]表明,该部分菌目可将部分NO−2 -N转化为NO−3 -N。随着NH+4 -N质量浓度的提升,每阶段曝气速率逐渐提升,在促进短程硝化过程的同时,也提升了反应体系内NOR的活性。由于加入有机碳源,反应器出现反硝化现象,而NIR是反硝化过程中
NO−2 -N转化所参与的酶,因此,对NIR进行了测定。第0天NIR的活性为38.17 U·L−1,这说明接种污泥中就有Comamonadaceae,具有NIR活性;随后其活性缓慢降低,直至阶段Ⅲ其活性降低至28.77 U·L−1;在阶段Ⅳ其活性上升至45.42 U·L−1,变化显著(P<0.05)。这是由于体系内存在DO时,几乎所有的反硝化酶均会受到抑制[40]。因此,前3个阶段DO的存在抑制了NIR活性,使其活性持续下降,而第Ⅳ阶段DO基本为0,使NIR活性上升。 -
1)经151 d递增负荷的培养,ARR和NAR可分别稳定在(91±1.36)%和(99±0.04)%。
2)在无有机碳源的环境中仅通过调节曝气量即可成功启动短程硝化过程。在存在有机碳源的环境中,反硝化作用会随有机碳源质量浓度的提升而加剧,并会加强抑制短程硝化,通过综合控制曝气量、FA和无机碳源量可恢复稳定的短程硝化过程。
3)引入有机碳源后,反硝化菌属Comamonadaceae的相对丰度由0.70%上升至51.89%,说明在高质量浓度有机碳源的环境中更有利于反硝化菌的生长。而主要功能菌属Nitrosomonas的相对丰度由34.7%下降至1.35%,在运行过程中短程硝化性能出现下降趋势。但通过对运行参数的综合调控,最终可稳定运行短程硝化系统。
有机碳源对短程硝化系统的影响及综合调控
Effect of organic carbon source on the performance of partial nitrification system and its comprehensive regulation
-
摘要: 为探究废水中有机碳源对短程硝化系统的影响和维持短程硝化稳定过程的运行条件,利用序批式反应器(SBR)启动短程硝化过程,同时分析有机碳源质量浓度对短程硝化过程的影响。结果表明:在运行至151 d时,反应器中
NH+4 -N去除率(ARR)与NO−2 -N积累率(NAR)分别稳定为(91±1.36)%和(99±0.04)%;在无有机碳源的环境中,仅通过调节曝气量即可成功启动短程硝化;在有机碳源存在的环境中,反硝化作用会随着有机碳源质量浓度的提高而加剧,并会加强抑制短程硝化,通过综合调控曝气量、游离氨(FA)和无机碳源量,可恢复稳定的短程硝化过程。微生物群落分析结果表明:反硝化菌属Comamonadaceae的相对丰度由0.70%上升至51.89%,说明在高质量浓度有机碳源中更有利于反硝化菌的生长;而主要功能菌亚硝化单胞菌属Nitrosomonas的相对丰度由34.70%下降至1.35%,在运行过程中短程硝化性能出现下降趋势。通过对运行参数的综合调控,最终可稳定运行短程硝化系统。Abstract: A sequencing batch reactor (SBR) was used to start the partial nitrification process. The impact of organic carbon sources in wastewater on the partial nitrification system and the operating conditions of the stable process, as well as the influence of the mass concentration of organic carbon sources on the partial nitrification process were studied. The results showed that after 151 days of operation, theNH+4 -N removal rate (ARR) andNO−2 -N accumulation rate (NAR) in the reactor were stable at (91±1.36)% and (99±0.04)%, respectively. In the environment without organic carbon source, partial nitrification could be successfully initiated only by adjusting the aeration rate. In the presence of organic carbon sources, denitrification increased with the increase of organic carbon source concentration, and the inhibition of partial nitrification was strengthened. Stable partial nitrification process could be restored through the comprehensive regulation of aeration rate, free ammonia (FA) and inorganic carbon source. Through the analysis of microbial community, the relative abundance of Comamonadaceae of denitrifying bacteria increased from 0.70% to 51.89%, indicating that high concentrations of organic carbon sources were conducive to the growth of denitrifying bacteria. The relative abundance of the main functional bacteria Nitrosomonas decreased from 34.70% to 1.35%, and the partial nitrification performance showed a downward trend during operation. However, through the comprehensive control of operating parameters, the partial nitrification system could maintain stable finally. -
表 1 短程硝化过程不同阶段下的运行参数
Table 1. Operational parameters of partial nitrification process at different phases
阶段 运行时间/d 质量浓度/(mg·L−1) 曝气速率/(mL·min−1) 进水pH NH+4 COD DO NaHCO3 Ⅰ 0~12 100 0 0.3~0.5 1 200 20~40 8.0±0.2 13~16 100 50 0.3~0.5 1 200 20~40 8.0±0.2 17~27 100 0 0.3~0.5 1 200 20~40 8.0±0.2 Ⅱ 28~44 200 0 0.3~0.5 1 200~2 000 100~150 8.0±0.2 45~66 200 70 0.3~0.5 1 200~2 000 100~150 8.0±0.2 Ⅲ 67~98 300 400 0.3~0.5 2 000 200~300 8.0±0.2 Ⅳ 99~145 500 670 0.3~0.5 3 000 300~1 000 7.3±0.2 -
[1] MIAO L, YANG G Q, TAO T, et al. Recent advances in nitrogen removal from landfill leachate using biological treatments: A review[J]. Journal of Environmental Management, 2019, 235: 178-185. [2] CAPODICI M, CORSINO S F, DI TRAPANI D, et al. Achievement of partial nitrification under different carbon-to-nitrogen ratio and ammonia loading rate for the co-treatment of landfill leachate with municipal wastewater[J]. Biochemical Engineering Journal, 2019, 149: 107229. doi: 10.1016/j.bej.2019.05.006 [3] CUI H H, ZHANG L, ZHANG Q, et al. Stable partial nitrification of domestic sewage achieved through activated sludge on exposure to nitrite[J]. Bioresource Technology, 2019, 278: 435-439. doi: 10.1016/j.biortech.2019.02.004 [4] SHE Z, ZHAO L, ZHANG X, et al. Partial nitrification and denitrification in a sequencing batch reactor treating high-salinity wastewater[J]. Chemical Engineering Journal, 2016, 288: 207-215. doi: 10.1016/j.cej.2015.11.102 [5] 孙洪伟, 尤永军, 赵华南, 等. 游离氨对硝化菌活性的抑制及可逆性影响[J]. 中国环境科学, 2015, 35(1): 95-100. [6] LI J L, ZHANG L, PENG Y Z, et al. NOB suppression in partial nitritation-anammox (PNA) process by discharging aged flocs: performance and microbial community dynamics[J]. Chemosphere, 2019, 227: 26-33. doi: 10.1016/j.chemosphere.2019.04.023 [7] 付昆明, 廖敏辉, 任奕, 等. 污水短程硝化影响因素的对比分析[J]. 中国给水排水, 2019, 35(4): 24-29. [8] 吴雪, 赵鑫, 刘一威, 等. 高氨氮废水短程硝化系统影响因素研究[J]. 环境科学与技术, 2013, 36(S1): 5-9. [9] 张宇坤, 王淑莹, 董怡君, 等. 游离氨和游离亚硝酸对亚硝态氮氧化菌活性的影响[J]. 中国环境科学, 2014, 34(5): 1242-1247. [10] LIANG Y H, LI D, ZHANG X J, et al. Microbial characteristics and nitrogen removal of simultaneous partial nitrification, anammox and denitrification (SNAD) process treating low C/N ratio sewage[J]. Bioresource Technology, 2014, 169(5): 103-109. [11] 李冬, 何永平, 张肖静, 等. 有机碳源对SNAD工艺脱氮性能及微生物种群结构的影响[J]. 哈尔滨工业大学学报, 2016, 48(2): 68-75. doi: 10.11918/j.issn.0367-6234.2016.02.012 [12] CAPODICI M, CORSINO S F, TRAPANI D, et al. Achievement of partial nitrification under different carbon-to-nitrogen ratio and ammonia loading rate for the co-treatment of landfill leachate with municipal wastewater[J]. Biochemical Engineering Journal, 2019, 149: 107229. doi: 10.1016/j.bej.2019.05.006 [13] YE L H, LI D, ZHANG J, et al. Start-up and performance of partial nitritation process using short-term starvation[J]. Bioresource Technology, 2019, 276: 190-198. doi: 10.1016/j.biortech.2018.12.115 [14] TANG C J, ZHENG P, WANG C H, et al. Performance of high-loaded ANAMMOX UASB reactors containing granular sludge[J]. Water Research, 2011, 45(1): 135-144. doi: 10.1016/j.watres.2010.08.018 [15] LI X Y, YANG S F. Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation, sedimentation and dewaterability of activated sludge[J]. Water Research, 2007, 41(5): 1022-1030. doi: 10.1016/j.watres.2006.06.037 [16] ZURIAGA A E, BES P A, MENDOZA R A, et al. Influence of extraction methods on proteins and carbohydrates analysis from MBR activated sludge flocs in view of improving EPS determination[J]. Separation and Purification Technology, 2013, 112: 1-10. doi: 10.1016/j.seppur.2013.03.048 [17] LI J B, WEI J L, NGO H H, et al. Characterization of soluble microbial products in a partial nitrification sequencing batch biofilm reactor treating high ammonia nitrogen wastewater[J]. Bioresource Technology, 2018, 249: 241-246. doi: 10.1016/j.biortech.2017.10.013 [18] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. [19] 季民, 刘灵婕, 翟洪艳, 等. 高浓度游离氨冲击负荷对生物硝化的影响机制[J]. 环境科学, 2017, 38(1): 260-268. [20] CHEN Y, ZHAO Z, LIU H, et al. Achieving stable two-stage mainstream partial-nitrification/anammox (PN/A) operation via intermittent aeration[J]. Chemosphere, 2020, 245: 125650. doi: 10.1016/j.chemosphere.2019.125650 [21] 吕心涛, 周桐, 田夏迪, 等. 不同污泥浓度下缺氧FNA对硝化菌活性的影响[J]. 环境科学, 2019, 40(7): 3195-3200. [22] 王盟, 李军, 卞伟, 等. 两段式曝气对短程硝化启动的影响研究[J]. 中国给水排水, 2016, 32(1): 35-38. [23] 巩有奎, 赵强, 彭永臻. 不同C/N下SBBR脱氮过程N2O释放及胞外多聚物变化 [J]. 化工学报, 2019, 70(12): 4847-4855. [24] 闫玉涛, 周凌, 冯骞, 等. 紊动对活性污泥特性及微生物代谢产物的影响[J]. 环境科学与技术, 2016, 39(5): 1-7. [25] 祁菁, 任俊颖, 赵凡, 等. 碱度对低氨氮部分亚硝化的影响与机理分析[J]. 环境科学与技术, 2019, 42(6): 121-127. [26] SOLIMAN M, ELDYASTI A. Ammonia-oxidizing bacteria (AOB): opportunities and applications: A review[J]. Reviews in Environmental Science and Bio/Technology, 2018, 17(2): 285-321. doi: 10.1007/s11157-018-9463-4 [27] 张园, 罗固源, 许晓毅. UCT工艺的活性污泥特性及稳定性研究[J]. 中国给水排水, 2011, 27(1): 24-28. [28] 张驰, 刘永军, 刘喆, 等. 混凝强化造粒条件下好氧颗粒污泥中微生物的繁衍与聚集[J]. 水土保持学报, 2013, 27(5): 214-218. doi: 10.3969/j.issn.1009-2242.2013.05.042 [29] 徐旻旸, 胡湛波, 秦雅琪, 等. 智能化曝气控制A/O工艺处理低C/N生活污水有效性及其脱氮机制[J]. 环境工程学报, 2017, 11(10): 5359-5367. doi: 10.12030/j.cjee.201611046 [30] SUN H H, NARIHIRO T, MA X Y, et al. Diverse aromatic-degrading bacteria present in a highly enriched autotrophic nitrifying sludge[J]. Science of the Total Environment, 2019, 666: 245-251. doi: 10.1016/j.scitotenv.2019.02.172 [31] HONG H S, YANG L Y, GUO W D, et al. Characterization of dissolved organic matter under contrasting hydrologic regimes in a subtropical watershed using PARAFAC model[J]. Biogeochemistry, 2012, 109(1/2/3): 163-174. [32] CHEN M, PRICE R M, YAMASHITA Y, et al. Comparative study of dissolved organic matter from groundwater and surface water in the florida coastal everglades using multi-dimensional spectrofluorometry combined with multivariate statistics[J]. Applied Geochemistry, 2010, 25(6): 872-880. doi: 10.1016/j.apgeochem.2010.03.005 [33] OSBURN C L, STEDMON C A. Linking the chemical and optical properties of dissolved organic matter in the baltic–north sea transition zone to differentiate three allochthonous inputs[J]. Marine Chemistry, 2011, 126(1-4): 281-294. doi: 10.1016/j.marchem.2011.06.007 [34] WEI D, NGO H H, GUO W S, et al. Partial nitrification granular sludge reactor as a pretreatment for anaerobic ammonium oxidation (anammox): achievement, performance and microbial community[J]. Bioresource Technology, 2018, 269: 25-31. doi: 10.1016/j.biortech.2018.08.088 [35] ZOU X, ZHOU Y, GUO B, et al. Single reactor nitritation-denitritation for high strength digested biosolid thickening lagoon supernatant treatment[J]. Biochemical Engineering Journal, 2020, 160: 107630. doi: 10.1016/j.bej.2020.107630 [36] CAO Q, LI X C, JIANG H E, et al. Ammonia removal through combined methane oxidation and nitrification-denitrification and the interactions among functional microorganisms[J]. Water Research, 2021, 188: 116555. doi: 10.1016/j.watres.2020.116555 [37] LIU T, HE X, JIA G, et al. Simultaneous nitrifi cation and denitrifi cation process using novel surface-modified suspended carriers for the treatment of real domestic wastewater[J]. Chemosphere, 2020, 247: 125831. doi: 10.1016/j.chemosphere.2020.125831 [38] WEI Z S, WANG J B, HUANG Z S, et al. Removal of nitric oxide from biomass combustion by thermophilic nitrification-aerobic denitrification combined with catalysis in membrane biofilm reactor[J]. Biomass and Bioenergy, 2019, 126: 34-40. doi: 10.1016/j.biombioe.2019.05.004 [39] 陈佼, 张建强, 文海燕, 等. 羟胺抑制协同pH调控对人工快渗系统短程硝化的影响[J]. 环境科学学报, 2016, 36(10): 3728-3735. [40] LU H, CHANDRAN K, STENSEL D. Microbial ecology of denitrification in biological wastewater treatment[J]. Water Research, 2014, 64(1): 237-254. -










 下载:
下载: