-
中国是抗生素原料药的生产大国。近年来,抗生素原料药生产过程中产生的异味污染引发的民众投诉增多、环保问题日益突出[1-2],成为继废水处理之后制药企业必须解决的污染治理难点。制药产业中,大部分抗生素原料药采用发酵工艺生产,并存在工艺技术含量相对较低、环境污染重的普遍问题[1]。工信部等6部门在2016年联合发布了《医药工业发展规划指南》,将提高发酵类大宗原料药的清洁生产和污染治理水平作为医药行业实现绿色发展的重点内容之一。
异味污染也称恶臭污染,是由刺激嗅觉器官引起人们不愉快感觉及损害生活环境的异味气体引发的污染[3]。抗生素发酵制药产生的异味不同于垃圾填埋场等市政设施产生的典型恶臭,是一种特殊的异味。抗生素发酵制药工艺指的是利用微生物的特定功能合成目标抗生素活性成分,然后再进行提取合成的过程[4],工艺流程及各环节气态污染释放情况如图1所示。在发酵过程中需向发酵罐中不断注入大量空气进行好氧发酵,因而会产生连续排放的发酵废气。在后续提取和精制环节中,因使用大量有机溶剂,又会产生含有机溶剂的废气。国内学者研究表明:发酵制药工艺产生的特殊异味主要来自发酵废气;提取精制等环节是挥发性有机物(volatile organic compounds,VOCs)污染的主要释放源;而废水处理和菌渣处理环节则兼有恶臭和VOCs污染问题[3, 5-7]。
然而,造成发酵异味污染的关键物质成分仍不是很明确。业内普遍认为,发酵尾气的主要成分为空气和CO2,同时含有少量培养基物质,即发酵后期细菌开始产生抗生素时菌丝的气味[1, 8]。学者们对苯系物等VOCs污染物的研究大都聚焦于其参与大气光化学效应引发的污染和环境健康问题,而对于异味污染应重点关注这类气态污染物对人群嗅觉感知的影响。因此,异味污染研究在污染特征、评价方法和控制目标等方面应区别于传统意义上的VOCs污染[9]。由于异味污染以人的感官感受为主要评价依据,故科学合理地制定污染控制目标需以对关键污染物和污染特征进行清晰地辨识为前提。然而,目前对发酵废气中异味物质成分的认识仍较笼统。
发酵尾气普遍具有连续排放、气量大、湿度高、污染物浓度低且成分复杂的特点,并且尾气中异味物质组分和含量随工业菌种、原料配比和生产工艺参数的变化而发生改变。在异味污染控制方面,由于对关键异味组分和污染特征缺乏足够认识,导致废气除臭措施的处理效果常不理想,企业在选择发酵废气处理技术时仍处于“无的放矢”的局面。此外,工业发酵广泛用于食品、能源和医药及健康用品的生产,其产品种类繁多、生产菌种和工艺多样,发酵异味污染的问题也比较普遍。因此,亟需发展环境异味污染分析方法,建立发酵异味的识别解析和溯源分析方法,以更深刻认识发酵异味污染特征,指导制药行业和其他发酵企业的异味污染治理,从而提高企业污染治理和绿色生产水平。
尽管发酵制药废气排放造成的异味污染问题已在国内受到关注,然而由于抗生素原料药的产能主要集中在中国和印度等发展中国家,有关发酵异味污染特征和关键污染物的识别解析在国内外均鲜有深入报道。本研究以3个抗生素原料药发酵品种为例,通过采用感官评价-轮廓分析-物质识别的多手段分析方法,解析识别不同品种抗生素的发酵异味污染特征,以期为抗生素发酵异味污染治理和环境管理提供参考。
全文HTML
-
抗生素原料药的发酵尾气和发酵液样品分别采集自我国北方某市化工园区内的2家企业。原料药品种和通风量信息如表1所示。一般情况下,每种产品线同时运行的发酵罐数量均在10个以上。连续3 d在发酵罐尾气出口采集未经处理的发酵尾气样品,采用真空负压方式将废气采集到8 L聚酯样品袋中(迪兰奥特,天津),使用手持式多参数气体分析仪(Eranntex,深圳)测定尾气的温度、湿度及CO2、H2S、NH3的浓度等基本参数(表2)。在整个发酵周期的不同时间间隔采集发酵液样品,装于棕色玻璃瓶不留顶空并冷藏保存。
-
使用国标方法《空气质量 恶臭的测定 三点比较式臭袋法》(GB/T 14675-1993)测定发酵尾气的臭气浓度。使用电子鼻分析仪(AIRSENSE PEN3,Airsense Analytics,德国)在采集发酵尾气样品时进行现场分析,每次测量重复3次。电子鼻配置10个金属氧化物半导体传感器阵列,传感器分别对不同种类的物质有响应[10]。使用气相离子迁移谱分析仪(GC-IMS或FlavourSpec,G.A.S,德国)分别测定发酵尾气和发酵液中的挥发性物质[11-14]。尾气样品的进样量为1 mL,经过内置的Tenax组件热脱附浓缩后分析;液体样品使用静态顶空方法分析;离子迁移谱(IMS)分析参数的设定参照文献中的方法[11]。离子迁移谱采用正离子模式,定性分析使用癸醛、2-壬酮、2-辛酮、2-庚酮、2-己酮、2-戊酮和2-丁酮作为外标。对物质的离子迁移时间进行反应离子峰(RIP)归一化处理,以消除仪器背景对样品谱图比较分析的干扰。根据物质的保留时间和离子迁移时间绘制样品轮廓指纹图谱,利用内置NIST数据库和IMS数据库进行定性分析。
-
发酵尾气中的物质成分使用气袋采样-低温冷阱浓缩(Entech 7100)-气相色谱质谱法(GC 7890-5975C MS,Angilent)进行测定。色谱条件:DB-5MS色谱柱(60 m×0.32 mm×1.0 μm),高纯He流速1 mL·min−1,不分流进样,升温程序为保持35 ℃的温度5 min后,以5 ℃·min−1的升温速率将温度升至150 ℃,再以15 ℃·min−1的升温速率将温度升至220 ℃后保持7 min。质谱条件为:离子源温度230 ℃、EI离子源70 eV、扫描质量15~300 amu。使用含有102种非甲烷有机物的混合标准气体做标准曲线[15]。发酵液中的物质成分使用顶空固相微萃取-气相色谱质谱法(HS-SPME-GC/MS)(GC-MS-QP2010,Shimadzu)进行测定,色谱条件和质谱参数的设定参照文献中的方法[16]。在20 mL样品瓶中加入10 mL待测发酵液和2 g NaCl,使用DVB/CAR/PDMS (50/30 μm) SPME萃取头在65 ℃孵化条件下萃取30 min,解吸180 s。通过保留时间和标准质谱图检索进行样品定性,根据定性结果使用异味标准物质混标作为外标、采用最小偏二乘法绘制标准曲线进行定量。根据检出的挥发性物质的浓度和嗅阈值,用气味活度值法(odor activity value, OAV)计算该物质的气味活度值,从而表征气味物质对样品整体气味的贡献程度,并筛选关键异味物质[17]。通常,OAV值大于1则表示物质可以被嗅觉感知[18]。
1.1. 样品采集
1.2. 异味感官评价和轮廓分析
1.3. GC-MS分析
-
由于发酵尾气中物质成分组成复杂,发酵异味常较难以确切描述。本研究涉及的3种抗生素发酵尾气呈现出明显不同的气味特征。红霉素有明显的土霉味和樟脑样药味,也有报道称为“苦涩味”[8];与红霉素相比,四环素和泰乐菌素发酵尾气的气味特征明显不同,但均较难确切描述。未经处理的红霉素发酵尾气的臭气浓度值明显大于四环素和泰乐菌素(见表2),亦高于已有研究报道的青霉素等发酵尾气臭气浓度(5 000~8 000)[1, 7],超过国家现行恶臭污染物排放标准限值[19]。此外,现场使用手持式设备测定的结果表明,尾气中H2S和NH3的浓度很低,并非主要异味物质。这与尾气中没有H2S和NH3的气味特征相符。
-
本研究使用传感器阵列电子鼻和气相离子迁移谱2种方法对异味污染的组分进行轮廓分析。图2为电子鼻分析仪10个传感器的响应信号结果,传感器响应值的单位为G/G0(或倒数),其中G0为初始电阻,G为测定电阻。3种发酵尾气呈现出明显不同的响应组合。2#、6#、7#、8#、9#传感器均对红霉素发酵尾气给出强响应;泰乐菌素尾气在2#、7#和9#传感器有较强响应;四环素发酵尾气在2#、6#、7#、8#、9#传感器均有响应但信号较低。2#传感器为广谱性传感器,对3种尾气均具有响应;7#和9#传感器为硫化物型;6#传感器对短链烷烃类物质有响应;8#传感器对醇酮醛等含氧有机物有响应。采用重复测量的多元方差分析(MANOVA)对3种尾气样品的电子鼻数据进行统计分析。多变量检验结果表明,样品与传感器信号间的交互效应P<0.05,不同样品的电子鼻响应数据间存在显著差异、不具有轮廓相似性。此外,电子鼻给出的样品响应信号强弱差异与嗅辩感官评价得到的臭气浓度结果一致,即红霉素>>泰乐菌素>四环素。因此,使用电子鼻虽然不能给出异味物质化学组分的确切定性结果,但可以对样品中的物质种类进行大致的轮廓描述,是一种可以用于辅助快速判定样品间差异性或相似性的现场分析手段。
使用气相离子迁移谱对样品中挥发性物质的成分进行测定,尾气样品结果见图3,发酵液样品结果见图4。纵坐标为气相色谱保留时间;横坐标为相对反应离子峰(RIP)的离子漂移时间;谱图中的样品点强度是离子流的信号强度(见图3)。由于气相保留指数和离子迁移速率的差异,尾气样品中的挥发性组分分布在气相离子迁移谱二维成像图中的不同位置。小分子量或高蒸气压化合物的保留指数较小,如乙醇和丙酮,出现在谱图的左下方;随着化合物保留指数和离子迁移速率增大,如辛醛和苯甲醛,在谱图中出现的位置向右上角偏移。由图3可见,3种发酵尾气的谱图有较大差异,可分别定性检出16、17和13种有机物。样品的对比指纹图(见图3(d))指示每种尾气中均有特异物质存在,也含有相同的组分,如乙醇、丙酮、正丁醇、辛醛、壬醛、苯甲醛和乙酸丁酯。其中,丙酮、丁醇和乙酸丁酯是提取工序常用的有机溶剂,在发酵尾气中检出不能排除发酵进气中混入了提取车间排放的废气所致。由于气体样品中异味物质的化学浓度可能较低,在分析过程中易受空气背景和热脱附前处理的影响,故本研究采用静态顶空采样的方法对发酵液中的挥发性组分进行分析。与发酵尾气的结果一致,3种发酵液中的挥发性物质组成也表现出显著差异(见图4)。虽然不能定性识别出全部物质,但IMS定性筛查的结果表明:3种发酵液中均含有乙醇、丙酮、2-戊酮、辛醛和苯甲醛等物质;仅在红霉素发酵液中含有土臭素(geosmin)和二甲基异崁醇(2-MIB);仅泰乐菌素发酵液中检出甲基异丁酮和1-辛烯-3-醇;而在四环素发酵液中检出更多醛类物质。目前,将气相离子迁移谱应用于食品风味分析方面的研究较多,而在环境异味污染方面的应用还相对较少。受限于数据库规模,其物质定性能力有待于进一步扩展。然而,鉴于其在分析灵敏度和检测效率上的优势,气相离子迁移谱可以提供样品中挥发性物质组成的轮廓信息并可视化呈现样品间的差异,故与气相质谱技术一起使用可构成互为补充的分析手段。
-
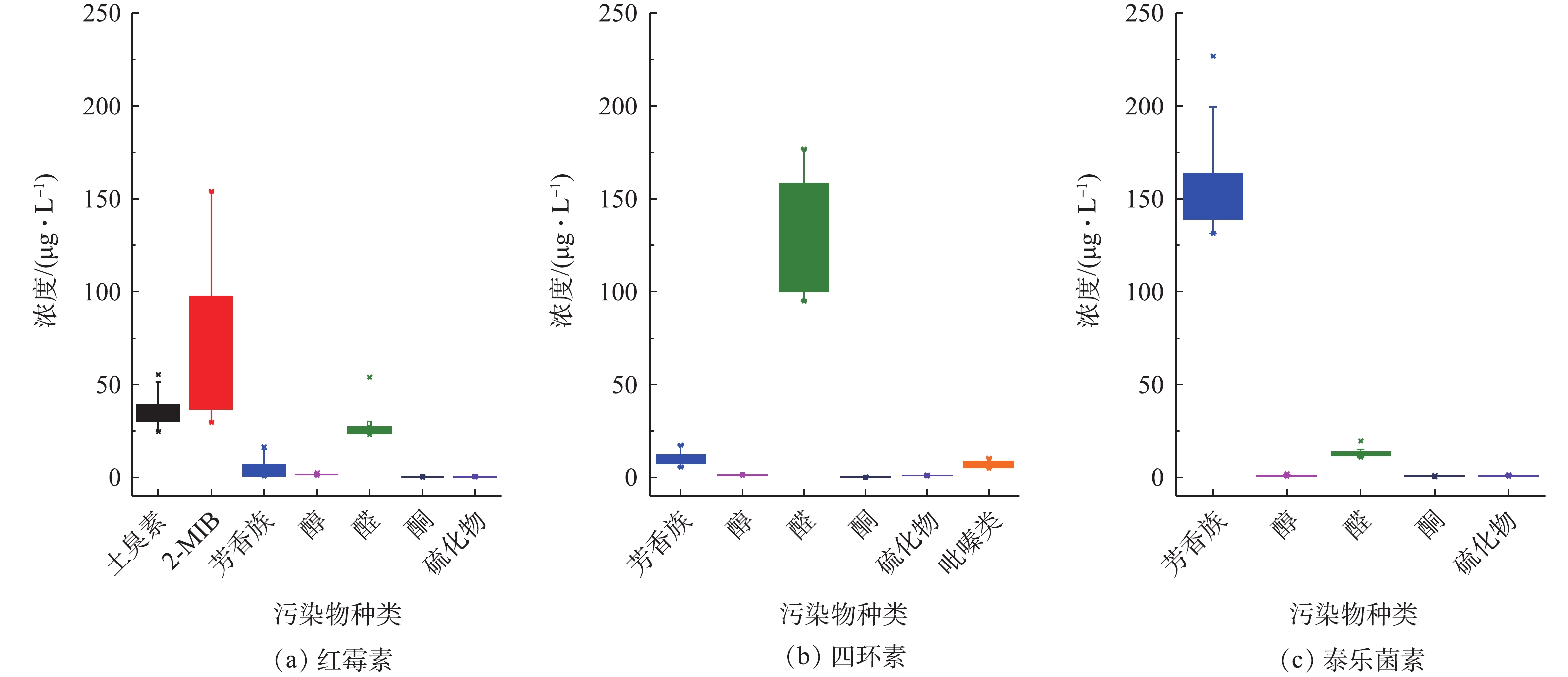
采用三级冷阱浓缩-GC/MS方法在3种发酵尾气中检出的异味物质种类组成和浓度差异较大(见图5),定量检出的VOCs总浓度为泰乐菌素(19.72 mg·m−3)>红霉素(14.92 mg·m−3)>四环素(1.03 mg·m−3)。从VOCs排放量来看,3种废气均不超过国家现行排放标准限值[20],故臭气浓度仍是主要的污染指标。使用三级冷阱浓缩-GC/MS分析,在红霉素发酵尾气中未检出土臭素和2-MIB。这可能是由于这2种物质在尾气中的浓度低于仪器方法的检测限,但由于这2种物质的嗅阈值非常低(约50 ng·m−3)[21-22],故仍可以被人鼻感知。采用顶空固相微萃取-GC/MS方法分析红霉素发酵液,成功检出了相当高含量的土臭素和2-MIB,并且在一个完整发酵周期不同阶段采集的样品中均检出这2种物质。发酵液中检出的2-MIB浓度为30~150 μg·L−1,土臭素的浓度为20~55 μg·L−1。此外,3种抗生素发酵液中均检出芳香族化合物、醇、醛、酮和硫化物5大类挥发性物质。其中,红霉素发酵液中独有土臭素和2-MIB,四环素发酵液中独有吡嗪类物质(见图6)。红霉素发酵液中2-MIB、土臭素和醛类物质的浓度较高,四环素发酵液中醛类物质的浓度最高,而泰乐菌素发酵液中则以芳香族烃类化合物为主。
表3列出了根据检出物质浓度及其嗅阈值计算得到的气味活度值(odor activity value, OAV),由此可确认2-MIB和土臭素是导致红霉素发酵异味最为关键的气味物质。2-MIB在低浓度时为霉味,在高浓度时则表现为类似樟脑的气味[23],与红霉素发酵异味特征高度吻合。由于没有突出的OAV物质主导,四环素和泰乐菌素的发酵异味是多种气味物质混合后共同作用于嗅觉感知细胞的结果。这是由于气味物质不仅具有气味变异性,还具有独特复杂的气味掩蔽、叠加和协同等效应。这些气味物质混合后使得整体气味发生变化,导致发酵尾气的气味非常特殊。泰乐菌素尾气和发酵液中虽然检出相对较高浓度的烃类和苯系物,但这类物质的嗅阈值通常较高[21],故对整体气味的贡献可能不大。此外,值得指出的是,四环素发酵尾气中略带有酸味,但受限于检测方法,本实验中未检出挥发性脂肪酸。是否存在挥发性脂肪酸以及其可能的异味贡献,值得进一步研究确认。
本研究涉及的3种发酵产品均以玉米、葡萄糖和豆油等作为主要原料,但仅红霉素发酵液中存在高浓度的2-MIB和土臭素,这应当与红霉素发酵使用的菌种有关。有研究发现,使用阿维链霉菌发酵合成阿维菌素时产生的严重异味也是由于产生土臭素导致[24]。本研究提及的3种抗生素的发酵菌株及阿维链霉菌均为放线菌属,而多种放线菌属,尤其是链霉菌属的微生物均可代谢产生2-MIB和土臭素这2种嗅阈值极低的萜烯类物质[25-26]。实际上,放线菌属微生物产生异味的现象非常普遍,例如湿润泥土散发的泥土气味,以及水体和水产品中带有的土霉味都与放线菌属微生物的代谢活动有关[22, 25, 27]。由于红霉素发酵过程产生2-MIB和土臭素这2种异味物质,因此,红霉素发酵尾气异味污染强度大,其异味控制技术难度也更大,需要从源头削减到末端处理全面考虑,才可能得到较理想的异味控制效果。四环素和泰乐菌素发酵尾气的臭气浓度值相对较小,但由于关键异味物质具有水溶性差、嗅阈值低的特点,使用常规的水洗喷淋或是氧化处理的氧化程度不足,均不能达到理想的除味效果。
2.1. 感官评价
2.2. 异味轮廓分析
2.3. 异味物质识别
-
1)研究涉及的3种抗生素发酵尾气呈现出明显不同的气味特征。红霉素发酵尾气具有明显的土霉味,且臭气浓度值明显大于四环素和泰乐菌素的臭气浓度值。采用传感器阵列电子鼻和气相离子迁移谱2种分析方法,均证实3种发酵尾气中挥发性物质组分存在显著差异。
2)采集到的3种发酵尾气中可检出挥发性物质的总浓度均低于20 mg·m−3,异味是主要的污染问题。红霉素发酵异味是由2-MIB和土臭素2种物质造成的土霉味;而四环素和泰乐菌素的发酵异味是由多种醛等含氧有机物和有机硫化物混合后形成的。其中,红霉素发酵尾气气量大、异味物质嗅阈值极低,具有异味污染影响范围广、治理难度大的特点。



 下载:
下载: