-
在2000—2016年,中国沿海地区共发生1194起有害藻华,平均每年约70起[1]。有害藻类水华的频发不仅恶化了水生生态环境[2-4],而且影响人类健康[5]。当水中藻类数量达到109细胞·L−1时,可在水体表面明显观察到绿色的蓝藻漂浮带,水华暴发[6]。针对于有害藻类水华的治理,混凝沉淀、吸附等传统物理化学技术可作为快速治理手段,但由于其药剂投加量大且处理时间长,不利于藻类的快速清洁处理[7],而生态修复法可以改变生态系统中优势藻类及其相关种群之间的生态关系,控制藻类生长,但由此导致的负面生态影响和长期生态风险很难评估[8]。
气浮法因其治理速度快、分离并收集藻类容易、施工简单且成本低等优点被应用于水华治理[9-10]。传统的混凝-气浮法是先混凝再通入气泡分离污染物,该过程高度依赖混凝作用,耗药量大且异位处理[11]。传统气浮过程使用的气泡气含率小(0.56%)、气泡密度小、去除效果不稳定,因而对藻的捕获能力有限[12-13]。有研究人员[14]利用表面活性剂对气泡表面进行功能化修饰,通过改变气泡的表面电荷,加强气泡与细胞或颗粒间的静电作用。单独使用表面活性剂时,去除效果不佳,但气泡附着良好;单独使用聚合物时,由于聚合物的桥接,细胞得到有效去除,但聚合物不能很好地附着在气泡表面[15]。基于此,YAP等[15]以表面活性剂和聚合物的混合溶液为气泡发生液,在溶气法中产生气泡,用于分离铜绿微囊藻,结果表明,聚合物的桥接能力和表面活性剂的疏水性可以结合,从而提高了蓝藻的去除率。SHI等[16]在溶气法中使用壳聚糖作为表面修饰剂,将其与阳离子表面活性剂十六烷基三甲基溴化铵(CTAB)进行混合并制备气泡,用以去除天然有机物。对气泡表面进行功能化修饰是对混凝气浮工艺的改进,可以将其发展成为一类原位高效水华治理技术。然而,在常用的溶气法处理蓝藻水华的研究中,尚未见针对表面功能化气泡的性质及其治理中度水华并抑制藻再生的报道。
本研究以蓝藻水华中常见的铜绿微囊藻为目标污染物,以环境友好型且起泡性良好的十二烷基二甲基甜菜碱(BS-12)为起泡剂[17],其主要由1个末端带羧基的阴离子官能团、1个带季铵盐-N的阳离子官能团和1个有15个碳的烷烃链构成,并以普遍使用的高效混凝剂聚合氯化铝(PACl)为气泡表面的修饰剂。BS-12和PACl的混合溶液经过高压溶气后,产生PACl修饰的表面带正电的混凝型胶质气泡(coagulative colloidal gas aphrons, CCGAs)。本研究分析了气泡的粒径、半衰期、气含率等特征,且考察了其对铜绿微囊藻的去除率和再生长抑制情况,探讨了其去除铜绿微囊藻细胞的可能机理。
全文HTML
-
实验试剂包括十二烷基二甲基甜菜碱(BS-12),阿达玛斯试剂有限公司;氯化铝(AlCl3,99%,分析纯),上海阿拉丁生化科技股份有限公司;碳酸氢钠(NaHCO3,≥99.5%,分析纯),国药集团化学试剂有限公司;丙酮(C3H6O,≥99.5%,分析纯),杭州双林化工试剂有限公司,铜绿微囊藻Microcystis aeruginosa (FACHB-905)购自中国科学院水生生物研究所。实验仪器包括pH计(Innolab-20p,Prima),Zeta电位仪(Nano-ZS90,英国马尔文仪器有限公司),紫外分光光度计(UV-1800,岛津仪器(苏州)有限公司),酶标仪(AMR-100,杭州奥盛仪器有限公司),溶气装置(杭州桂冠环保科技有限公司),蠕动泵(BT300-2J,兰格恒流泵有限公司),显微镜(OLYMPUS 1X71,日本OLYMPUS)。
-
1)模拟蓝藻水华水的配制。藻液的培养:25 ℃下,由经过高温(120~125 ℃、30 min)灭菌后的BG-11培养基在光照比为12 h∶12 h的条件下培养铜绿微囊藻[10, 18]。据WHO报告,水环境中蓝藻细胞密度为105细胞·mL−1时便已达到预警水华期[19]。因此,在实验中选用此密度的6.8~99.0倍的细胞密度,模拟低中度水华。实验中,用已灭菌的BG-11培养基将培养好的铜绿微囊藻液稀释到固定OD值(OD680=0.05、0.26、0.76)作为模拟蓝藻水华水。测量给定OD680下铜绿微囊藻悬液的细胞密度、Chl-a、Zeta电位和pH(表1)。随着OD680的增加,细胞密度和Chl-a增大。铜绿微囊藻表面荷负电,混凝型胶质气泡可以通过静电吸引对其进行捕获。
2)气泡发生-除藻实验。气泡修饰组分(无机高分子混凝剂PACl)的制备:以0.2 mol·L−1的AlCl3溶液和0.5 mol·L−1的NaHCO3溶液为原液。在室温、剧烈的磁力搅拌下,用蠕动泵以不超过0.25 mL·min−1的流速逐滴将NaHCO3溶液加入AlCl3溶液中,去离子水定容后最终得到浓度为0.1 mol·L−1(以铝含量计)、碱度为2 mmol·L−1的PACl溶液。将其移入棕色瓶中,熟化4 h后,置于4 ℃冰箱保存[20] (PACl浓度以铝含量计)。
CCGAs的制备:精确称取定量的BS-12和PACl(BS-12和PACl的投量均为气泡通入到藻液处理罐后,试剂在气浮悬液中的浓度),加入气泡发生罐(图1)中,温和摇晃30 s,使其混合均匀、复配。打开溶气装置(图1),气泡发生液进入溶气装置,在0.4 MPa下溶气5 min。释放压力,得到CCGAs。
铜绿微囊藻的去除:实验在室温((25±1) ℃)下进行,溶气装置中溶气罐体积约为1.5 L,气泡发生罐的容积约为15 L,藻液处理罐的容积约为1.3 L。处理流程如图1所示。在藻液处理罐中添加600 mL模拟铜绿微囊藻水华水。气泡发生液经过5 min的溶气处理后,用蠕动泵1以320 mL·min−1的泵速将400 mL混凝型胶质气泡由阀1泵入藻液处理罐,待气泡完全泵入后开始计时,每隔一定时间从阀2处取10 mL溶液,并测定溶液的OD680、Chl-a、Zeta、pH。在处理完毕后,打开泵2从阀3将上部浮渣泵入藻渣收集罐中。
藻再生观测:在阀2处取500 mL处理后的悬液于已灭菌的烧杯中,培养条件相同,每间隔2 d从烧杯上部取10 mL溶液,测定溶液的OD680和Chl-a,为期10 d。每个实验组设置2组平行。
-
1)气泡性质测定。将由溶气后产生的气泡悬液通过蠕动泵以320 mL·min−1的速度快速泵入250 mL量筒中,记录排液体积随时间的变化。通过拟合排水曲线(式(1))计算得到气泡半衰期[21]。
式中:I为t时刻排出液体的体积,mL;J为排出液体后的最大体积,mL;n为曲线的S型曲线,L为气泡悬液的半衰期,s。
气含率[22]根据式(2)进行计算。
式中:
ε 为气含率;M为气泡悬液的初始体积,mL;N为排液结束后的体积,mL。将配制好的气泡发生液倒入气泡发生罐中,打开溶气装置,控制溶气时间与实验时溶气时间一致,通过泵1,快速将溶气后产生的气泡转移至载玻片,使用带有数码相机的显微镜(400×)观察并拍照[22]。选取15张照片,使用Image J软件对所拍气泡(300个以上)进行粒径分析,计算平均直径。
2)铜绿微囊藻相关参数测定。藻液经过处理后打开藻液处理罐下部阀2,取2 mL处理后藻液,由注射器缓慢将其注入Zeta样品池中,注入过程避免气泡产生。电位分析仪利用激光多普勒电泳测定Zeta电位。pH由pH计测定。OD680使用紫外分光光度计在680 nm处进行测量。有研究[23]表明,OD680与细胞密度呈现线性正相关。水体的富营养化可以通过跟踪监测水中叶绿素的含量来实现,其中叶绿素a (Chl-a)是所有叶绿素中含量最高的。取10 mL藻液用0.45 µm微孔滤膜抽滤,将滤后滤膜在3 mL 90%丙酮溶液中充分溶解,4 ℃中24 h暗提取后,以3 000 r·min−1离心5 min,取上清液用酶标仪检测吸光度[24],叶绿素a浓度可由式(3)计算得出。
式中:A为叶绿素a浓度,mg·L−1;B和C分别为在663 nm和645 nm处的吸光度。
考虑气泡发生液在藻液处理罐中的稀释作用,OD680及Chl-a的去除率根据式(4)进行计算。
式中:R为OD680或Chl-a的去除率;D、H分别为分离前后溶液中的细胞密度(OD680)或Chl-a浓度,mg·L−1;E和F是待处理的藻液(600 mL)和气泡破灭后的处理液,mL。
1.1. 实验试剂及仪器
1.2. 实验方法
1.3. 分析方法
-
混凝剂对胶质气泡表面修饰是否成功主要取决于发生液中混凝剂与表面活性剂分子是否发生有效结合[22]。在混凝剂和表面活性剂的复配体系中,两者应以适当浓度比例混合,否则可能形成不溶性复合物[25]。两性表面活性剂由于其内部盐的存在受聚合物的影响较小[26],因此选BS-12为起泡剂[22]。与经典的高速搅拌法相比,溶气法可以不受起泡剂(此处为表面活性剂BS-12)浓度限制,从而避免因药剂使用量大导致二次污染,因此,混凝型胶质气泡由溶气法制备。此外,溶气气浮装置在工程中更为常见,有利于混凝型胶质气泡技术的推广使用。
-
气泡的半衰期、气含率和粒径对气浮分离效果均有所影响,因此,研究了BS-12和PACl混合溶液产生的混凝型胶质气泡的性质变化。由图2(a)可知,当BS-12浓度为27.5 mg·L−1和73.4 mg·L−1时,气泡的平均粒径分别为9 µm和11 µm,低于传统溶气法中50~60 µm的气泡[13]。较大的气泡不仅会降低分离效率,而且会打散絮凝体,阻止气浮[13]。对于混凝型胶质气泡的荷电性,混凝剂包覆在气泡上,PACl在溶液中溶解出Al3+可能使混凝型胶质气泡荷正电。由图2(b)可见,混凝型胶质气泡平均5%的气含率与JAMESON在0.4 MPa时的溶气法中得到0.56%的气含率相比[12],气含率增加了7.9倍,可使更多的混凝型胶质气泡参与到气浮捕获细胞的过程中。在相同的PACl浓度下,表面活性剂(BS-12)浓度越大,混凝型胶质气泡的半衰期越长(图2(b))。强稳定性气泡在去除铜绿微囊藻的过程中,气泡与蓝藻细胞的接触时间延长,可降低气泡的上浮速度,使更多的气泡为气浮捕获细胞提供浮力[27]。
-
分别用混凝型胶质气泡(产生于PACl和BS-12的混合溶液)和普通胶质气泡(产生于BS-2溶液)处理铜绿微囊藻悬液(OD680为0.26),监测铜绿微囊藻的去除率随处理时间的变化(图3)。由图3可见,混凝型胶质气泡的处理效果明显优于单独的胶质气泡。在相同PACl投加量下,藻悬液中BS-12浓度为308.0 mg·L−1时的处理效果要优于30.8 mg·L−1下的效果。虽然表面活性剂的浓度增加了10倍,但其处理效果并未得到较大的提升。铜绿微囊藻的去除率随处理时间的延长而增加;混凝型胶质气泡在5 min时便可达到最佳效果,故为提高处理效率,后续实验中以5 min中为藻悬液气浮分离时间。
-
利用BS-12和PACl复配后所产生的混凝型胶质气泡去除铜绿微囊藻时,药剂的投加量是影响去除率的主要因素。因此,本研究首先探索了BS-12和PACl投加量对除藻效果的影响,优化投加量,并测定体系中Zeta电位和出水pH变化,以研究捕获藻细胞过程中混凝型胶质气泡与铜绿微囊藻的静电吸引作用。
1) BS-12投加量对除藻效果的影响。在溶气气浮法中使用混凝型胶质气泡对不同密度下(OD680为0.05、0.26、0.76)铜绿微囊藻进行处理(图4)。如图4(a)和图4(b)所示,藻悬液中PACl浓度为31.6 mg·L−1、BS-12投加量为91.7 mg·L−1时,OD680和叶绿素a的去除率达到最佳,分别为93.5%和42.9%(OD680为0.05)、98.5%和66.3%(OD680为0.26)、93.1%和82.3%(OD680为0.76)。叶绿素a的去除率随铜绿微囊藻密度的增加逐渐升高(图4(b))。这是因为,在适宜浓度的投加量下,混凝型胶质气泡对铜绿微囊藻的捕获能力一定,随着溶液中细胞的增加,单个混凝型胶质气泡所捕获的铜绿微囊藻也逐渐增加。由图4(c)可见,由于铜绿微囊藻细胞带负电,Zeta电位随细胞密度的增加而逐渐降低。通过投加BS-12,前期Zeta变化不明显。PACl浓度为31.6 mg·L−1、BS-12浓度为73.4 mg·L−1时,Zeta电位从−44.4 mV升至−9.9 mV(OD680为0.05)。随着两性表面活性剂BS-12的投加,溶气法所能产生的混凝型胶质气泡增多,与细胞之间的碰撞概率增大,提高了去除率。当OD680为0.26,PACl浓度为31.6 mg·L−1,不断投加BS-12,Zeta电位从−45.3 mV增加至−16.4 mV后降低到−19.7 mV。蓝藻细胞从稳定分散态变为初步脱稳状态,表面活性剂作为起泡剂加大了溶液的起泡性和PACl的分散效果,使得PACl与团聚体之间产生静电斥力[28]。在初始藻密度OD680为0.05、0.26、0.76时,水体pH分别为8.4、9.2、10.4,而最佳处理后的出水pH分别为6.9、7.4、9.5。
2) PACl投加量(以铝计)对除藻效果的影响。PACl作为混凝剂通过絮凝、卷扫、桥连等作用去除蓝藻细胞。在固定的BS-12投量(BS-12为27.5 mg·L−1(OD680为0.05)、BS-12为73.4 mg·L−1(OD680为0.26、0.76))下,考察了不同PACl浓度对除藻效果的影响,以确定最佳的PACl投加量(图5)。由图5(a)可知,当PACl的投加量为31.6 mg·L−1和40.5 mg·L−1时,OD680和叶绿素a的去除率达到最佳,分别为85.0%和24.3%(OD680为0.05)、93.8%和77.5%(OD680为0.26),当OD680为0.76时,OD680的去除率在PACl为16.2 mg·L−1时最高(88.9%),叶绿素a去除率在PACl为40.5 mg·L−1时最高(75.7%)。
在PACl与BS-12混合溶液中,PACl溶解所形成的单体铝或低聚物包覆在胶质气泡表面,使气泡的表面荷正电,由此可增强气泡与表面荷负电的铜绿微囊藻细胞之间的静电吸引作用[10],从而强化气泡对细胞的捕获能力[29]。随着PACl投加量由16.2 mg·L−1增加到40.5 mg·L−1,3种不同密度下的藻液中均观察到Zeta电位的上升(图5(c))。之后再投加PACl,低密度藻液(OD680为0.05)中Zeta电位逐渐趋于0 mV,此时细胞处于高度不稳定状态。中密度藻液(OD680为0.26)中,PACl投加量超过40.5 mg·L−1时,Zeta电位下降,这表明在PACl过量时团聚体由于荷正电而产生静电排斥,进而导致体系反稳[28]。在高密度藻液(OD680为0.76)中,Zeta电位持续上升,PACl修饰后表面荷正电的混凝型胶质气泡吸附铜绿微囊藻。PACl在高pH溶液中会产生氢氧根沉淀,且利用其进行混凝和络合吸附[30]。此外,铝盐的水解导致处理后水体的pH随PACl用量的增加而降低(图5(d))[20],在本实验的最佳PACl投量下,处理后藻悬液的pH为6~9,在天然水体的pH范围之内。
综上所述,在溶气法制备混凝型胶质气泡的过程中,BS-12影响溶液的起泡能力、气含率及PACl在溶液中的分散效果。而过量的PACl可能使BS-12分子与PACl相互作用,形成复合体,体系的起泡性可能会因为BS-12分子的减少而减弱,导致胶质气泡的稳定性降低[24]。因此,PACl的投加量不仅影响气泡表面的荷电能力、对细胞捕获、静电吸引作用,而且影响着气泡发生液的起泡能力。
-
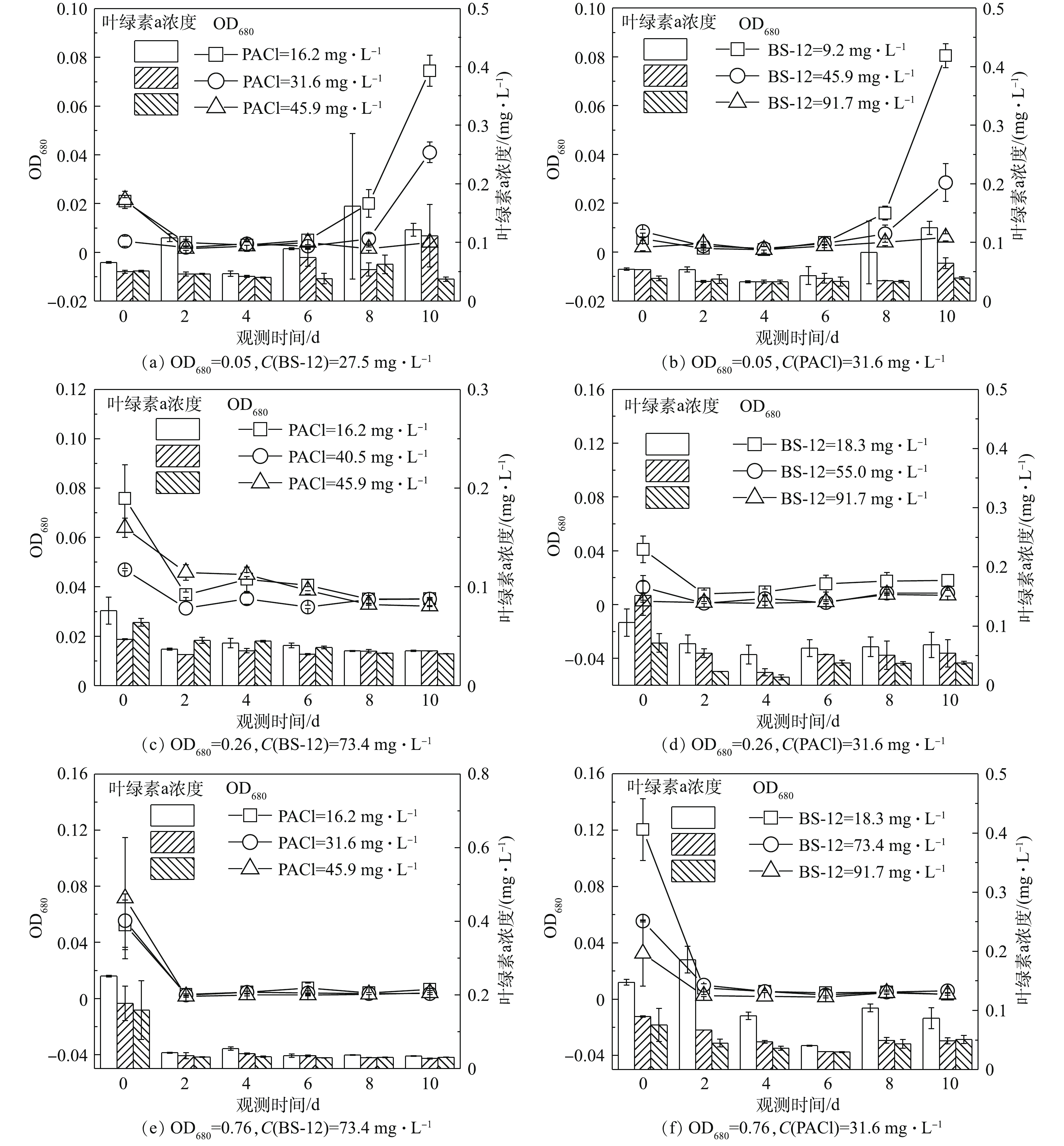
在蓝藻生长的抑制研究中,研究人员发现水稻秸秆浸泡液同样对铜绿微囊藻有抑制作用[31]。但水体中的藻类细胞仍增加了后续处理的负担。铜绿微囊藻水华水处理的目的不仅在于去除水中的铜绿微囊藻而且要达到抑制铜绿微囊藻再生的效果。因此,需要监测处理后的藻液再生长情况。图6(a)是在BS-12浓度27.5 mg·L−1时投加PACl对低密度细胞悬液处理后细胞再生长曲线。图6(c)、图6(e)分别是在BS-12浓度73.4 mg·L−1时投加PACl对中、高密度细胞悬液处理后细胞再生长曲线。图6(b)、图6(d)、图6(f)分别是在PACl浓度为31.6 mg·L−1时投加BS-12对不同初始细胞密度(OD680为0.05、0.26、0.76)的悬液处理后细胞再生长曲线。由低密度细胞再生长曲线可以看出,当BS-12浓度为27.5 mg·L−1、PACl浓度为16.2、31.6 mg·L−1时,细胞在第6天后再生长趋势明显;BS-12浓度为27.5 mg·L−1,PACl浓度为45.9 mg·L−1时则不会出现藻再生的现象(图6(a))。高投加量一方面可得到较好的细胞去除效果,使溶液中残余的细胞数量降低;另一方面可能导致溶液中有较高的药剂残余,其中Al的存在对细胞有毒害作用,降低细胞的再生长潜力。有研究报道指出,当铝浓度为0.5~16.2 mg·L−1时,可以抑制蓝藻细胞的细胞活力和生长速度[32]。由于磷与铝的间接化学作用,水体溶解磷的供应可能会减少,从而使藻细胞的生长受到限制。NALEWAJKO等[33]的研究发现,铝添加量大于50 μg·L−1时,磷的吸收率就显著下降,其原因是与铝的络合使磷无法进行酶的运输,导致营养元素缺失,抑制生长。低投加量对蓝藻细胞再生抑制效果弱,未被完全去除的铜绿微囊藻在监测后期再度生长,继而形成水华[10]。中、高密度的细胞再生长曲线在第0~2天内OD680骤降,这是由于处理后的藻悬液中存在大量的絮体,絮体通过吸附、网捕等作用吸附残余的铜绿微囊藻后静置沉降到水体底部[34]。之后的监测中未监测到藻再生现象,故可认为达到了对藻再生的抑制效果。因此,溶气法制备混凝型胶质气泡技术在去除蓝藻细胞及抑制再生后未导致水华再暴发。
-
通过将混凝型胶质气泡与其他传统的混凝沉淀-气浮的工艺进行比较(表2),分析了混凝型胶质气泡气浮的性能和优点。首先,相对于先向溶液中投加混凝剂再进行气浮的传统方法,混凝剂在混凝型胶质气泡产生的过程中已经包覆在气泡表面,然后通过气浮去除蓝藻细胞,结果表明,混凝型胶质气泡在5 min内可以去除85.0%~93.8%的铜绿微囊藻。YAP等[15]和SUN等[35]在传统的混凝沉淀-气浮中使用PACl和硫酸铝去除铜绿微囊藻,发现达到94.3%~95.0%的细胞去除率需23~52 min,与此相比,混凝型胶质气泡减少了78.3%~90.4%的处理时间[15, 20, 35],处理效率得到大幅提升。其次,表2中基于传统的混凝沉淀-气浮处理后的藻液未对藻再生情况进行跟踪监测,对处理后的溶液是否会再次暴发水华亦缺乏研究,本实验结果已表明,混凝型胶质气泡可以抑制铜绿微囊藻再生。因此,混凝型胶质气泡具有去除率高、再生抑制效果好、分离速度快、结构简单(不需要单独设立混凝单元)、明显降低成本等特点,极大地改善了混凝-气浮技术对藻类的处理过程。此外,值得注意的是,不同水华蓝藻物种之间的差异(形态、大小、有机质)可能会影响此方法的应用效果。这需要在我们今后的研究中系统地加以探讨,而且对于其在实际水体环境中的应用也要加以探讨。
2.1. 气泡性质
2.2. 铜绿微囊藻去除率随时间的变化情况
2.3. BS-12和PACl投加量对铜绿微囊藻的去除影响
2.4. 混凝型胶质气泡对藻再生的抑制效果
2.5. 与传统混凝沉淀-气浮法的比较
-
1)将无机高分子表面活性剂PACl与两性表面活性剂BS-12复配并在溶气条件下制备的CCGAs,相较于普通溶气所得气泡,气泡粒径减小82%、含气量提高7.9倍。
2)在BS-12和PACl的最佳投量下,5 min内85.0%~93.8%的细胞被去除。处理后的溶液经过10 d的监测藻再生抑制效果明显,消除了水华再暴发的隐患。
3)混凝型胶质气泡具有去除率高、分离速度快、藻再生抑制效果好的特点,不仅省去前端混凝单元,更强化了气泡特异性捕获藻细胞的能力,为蓝藻水华的高效原位治理提供了新的思路。



 下载:
下载: