-
NOx是我国工业炉窑排放的主要大气污染之一[1],与酸雨[2]和化学烟雾[3]的形成有关。根据国家对节能减排的具体规划,NOx的排放限值越来越严格。自2012年1月1日起,新建火力发电锅炉及燃气轮机组的NOx排放浓度限值为100 mg·m−3。常见脱硝方法有湿法脱硝和干法脱硝2类[4-5]。酸碱吸收法适用于以NO2为主要组成的NOx脱除;而干法脱硝中,材料与NO发生气-固反应进而去除NOx,操作简便。
电石渣是电石水解获取乙炔气体后的废渣,主要成分为Ca(OH)2,含有少量金属氧化物(Al2O3、SiO2、MgO、Fe2O3)、无机物及有机物[6-10]。电石渣主要应用在化工领域和建筑领域。因其与石灰石性质相似,且主要成分都是碱性氧化物,故其对酸性气体有较好的脱除效果,所以也被广泛用于环境治理。王亚丽等[11]发现,当稻壳灰和电石渣按6∶5的配比混合,掺入水泥生料中,在900 ℃下反应可脱除NO和SO2。汪鑫[12]在电石渣中掺杂甘蔗渣制备电石渣球粒,当反应温度为825~875 ℃时,可同时脱除SO2和NO。因此,利用改性电石渣干法脱除NO达到以废治废的目的。
本研究中,采用KOH对电石渣进行改性,通过脱硝性能测试及材料表征、正交实验探究改性条件的影响,考察其对NO脱除的可行性,并对反应过程中的影响因素进行了研究,探讨其最佳反应条件。
全文HTML
-
以KOH溶液作改性剂,采用浸渍法将一定浓度的KOH溶液与电石渣按2∶1(mL∶g)混合均匀后浸渍12 h,之后于100 ℃的干燥箱中烘干,并置于马弗炉中焙烧得到改性电石渣。
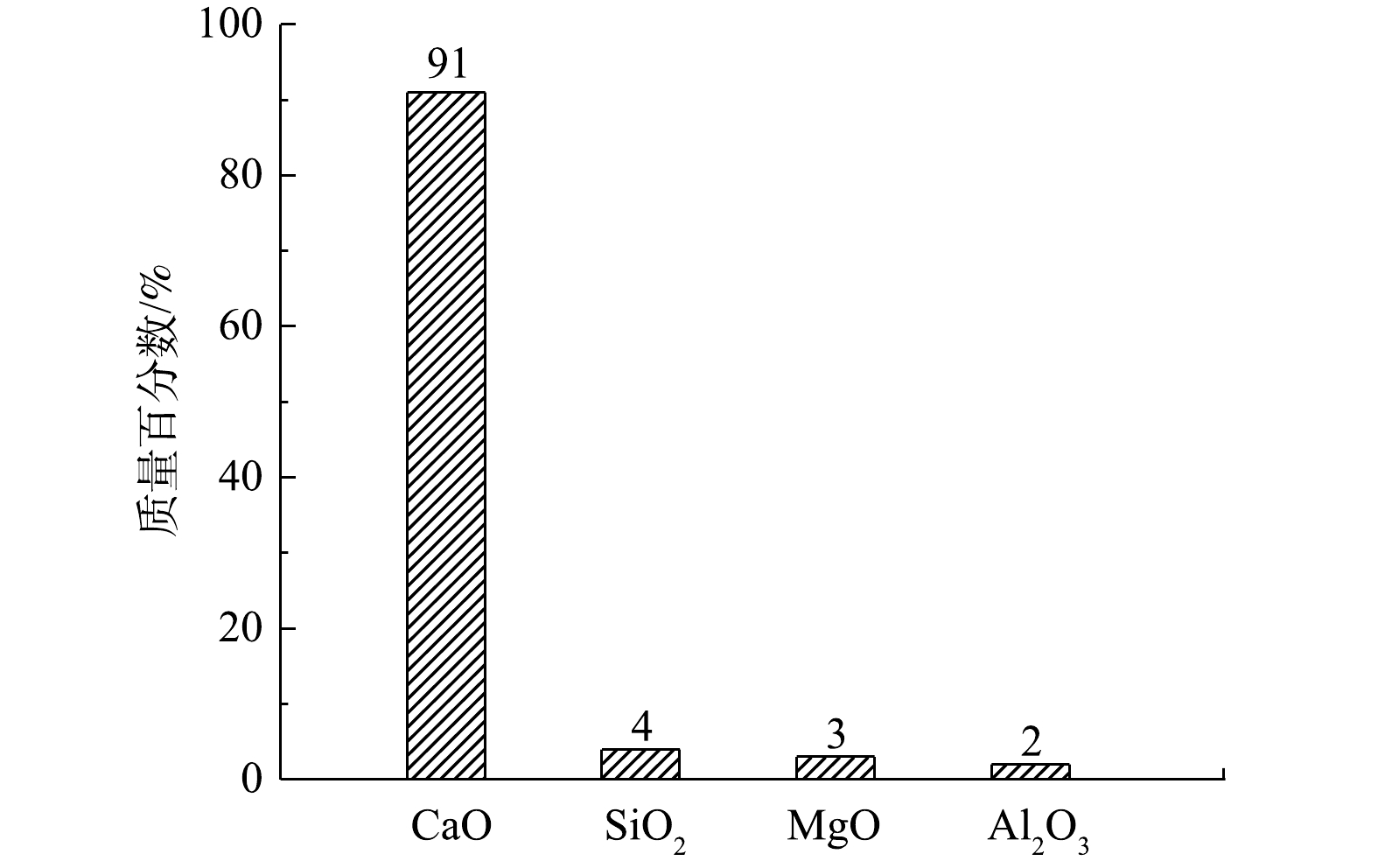
X射线荧光衍射分析(XRF)检测的结果如图1所示。电石渣的化学成分主要是CaO,还有少量SiO2、MgO、Al2O3、Fe2O3等。
-
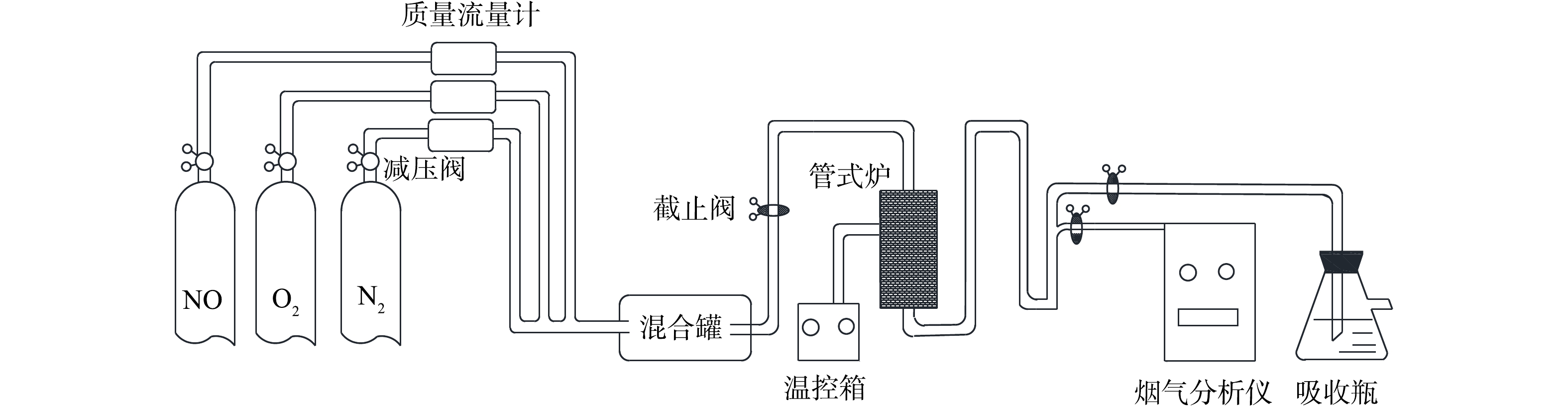
材料的活性评价在自制反应器中进行。实验装置及流程如图2所示。本实验采用动态配气配制模拟烟气,总流量200 mL·min−1,NO的质量浓度为700 mg·m−3,O2含量5%,N2作为平衡气。管式炉中直径为6 mm的石英管内装入0.1 g的电石渣。
-
1)正交实验设计。改性条件对电石渣脱除NO效率会有影响。本研究选择KOH溶液浓度、焙烧温度、焙烧时间作为影响因素进行考察,采用 L16 (34)正交表设计实验,选取的因素水平如表1所示。
2)材料性能分析。反应器进出口气体由MRU红外烟气分析仪在线检测。反应中所有测试条件均不变(气体流量200 mL·min−1,NO的质量为700 mg·m−3,O2含量5%)。材料性能以NO脱除率来衡量,计算采用式(1)。
式中:
ηNO 为NO脱除率,%;CNOin 为NO进口质量浓度,mg·m−3;CNOout 为NO出口质量浓度,mg·m−3。
1.1. 改性电石渣的制备
1.2. 实验装置
1.3. 实验方法和分析方法
-
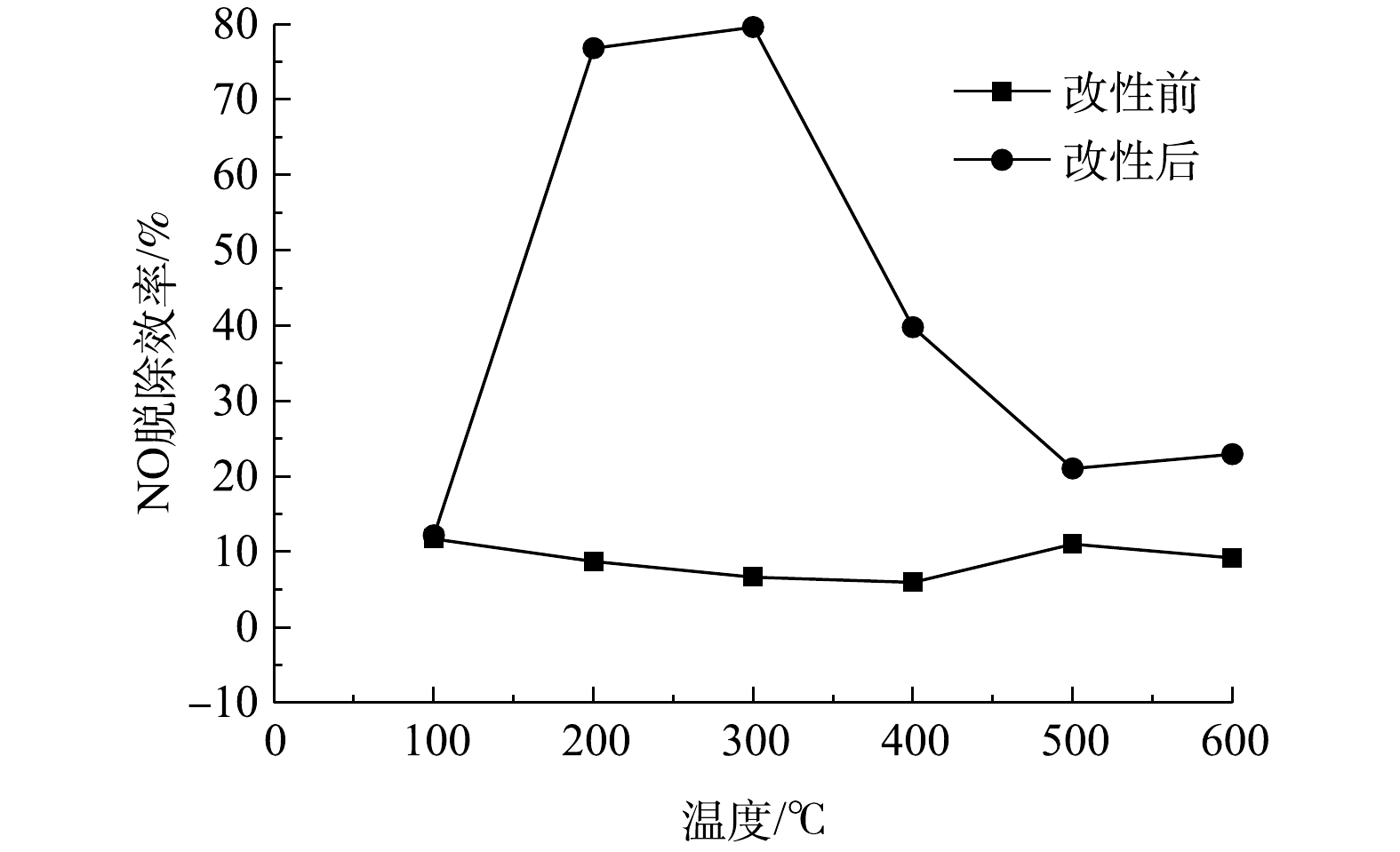
电石渣在改性条件为KOH浸渍浓度5 mol·L−1,焙烧温度300 ℃,焙烧时间3 h。电石渣改性前后对NO的脱除率对比结果见图3。由图3可知,电石渣改性前对NO的脱除率基本保持在10%左右,其本身对NO的脱除率相对较低;改性后的电石渣对NO脱除率均高于改性前的原材料,NO脱除率从6.66%增加到79.63%,提高了72.92%。因此,利用改性电石渣干法脱除NO是可行的、有效的。经KOH处理后,催化剂的比表面积、孔结构及表面官能团发生变化,可提高催化氧化NO的效率[13-15]。
-
1)改性前后电石渣的SEM分析。图4(a)显示电石渣原材料为块状,紧密相连,没有明显孔结构,这与王亚丽等[11]研究结果一致。而改性后电石渣微观结构发生了变化(见图4(b)),有大量的细小气孔出现,结构形状明显改变。微小的气孔利于吸附NO,使NO得以吸附在电石渣表面[16],为脱除NO提供了催化反应场所。
2)改性前后电石渣的BET分析。对改性前后电石渣进行BET测试。测试结果表明,电石渣改性前后的孔径均为中孔,其比表面积分别为19.779 m2·g−1、19.848 m2·g−1。电石渣改性前后比表面积变化不明显,说明了改性电石渣物理吸附脱除NO的能力有限。
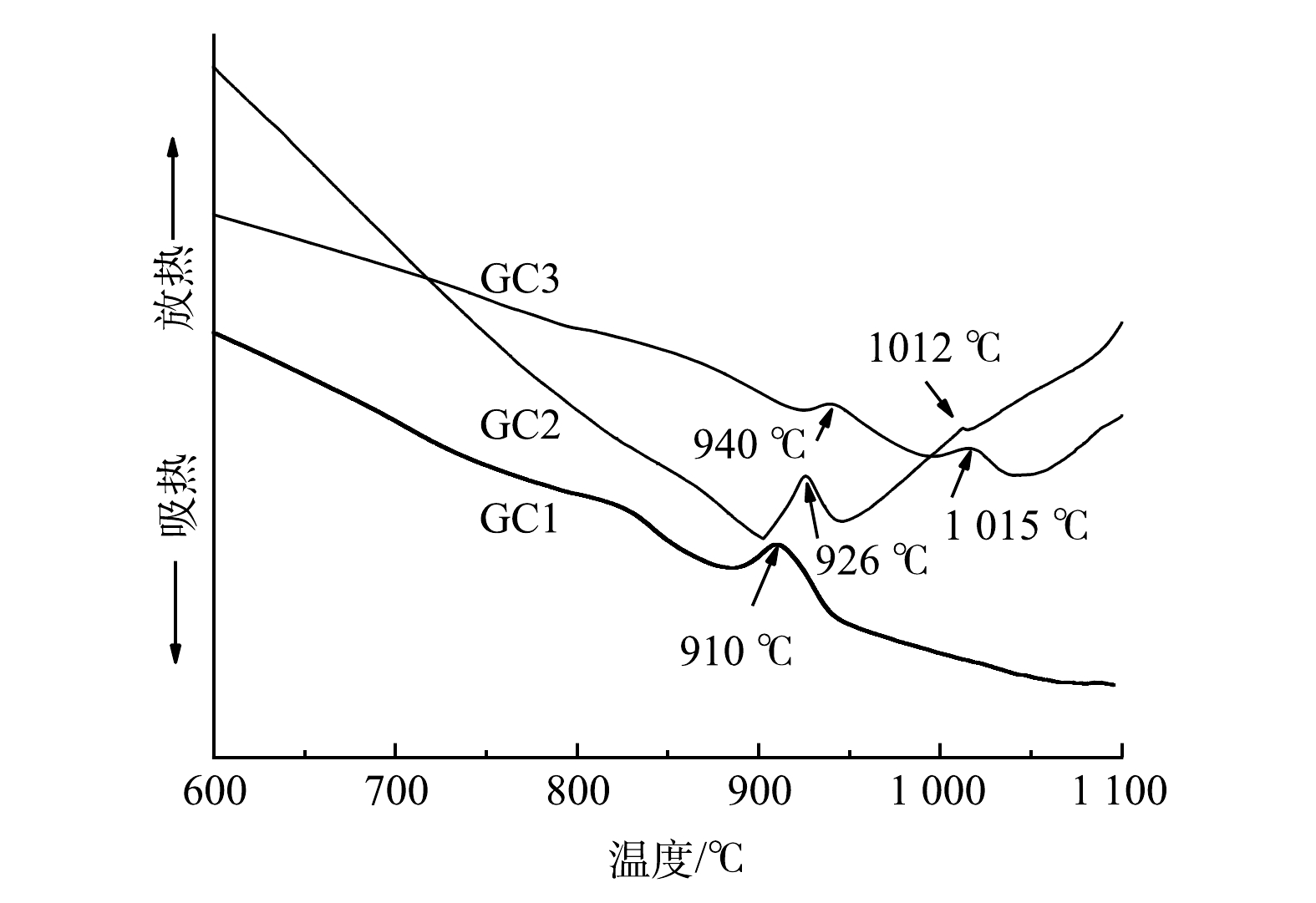
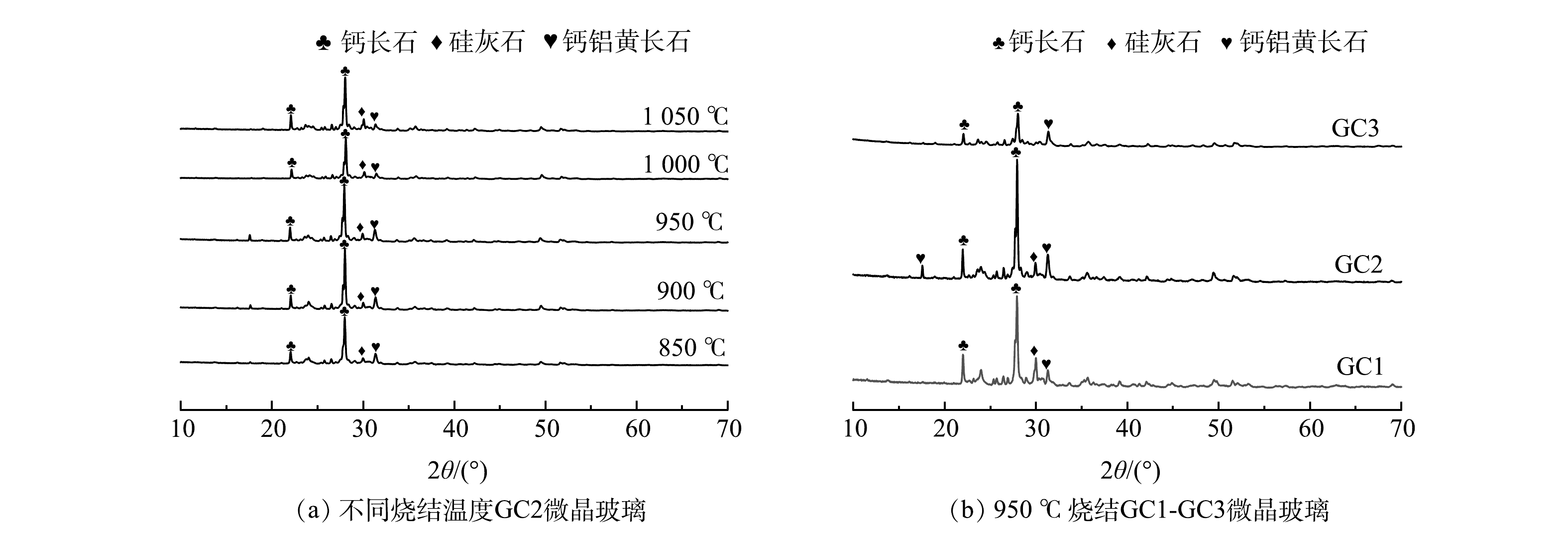
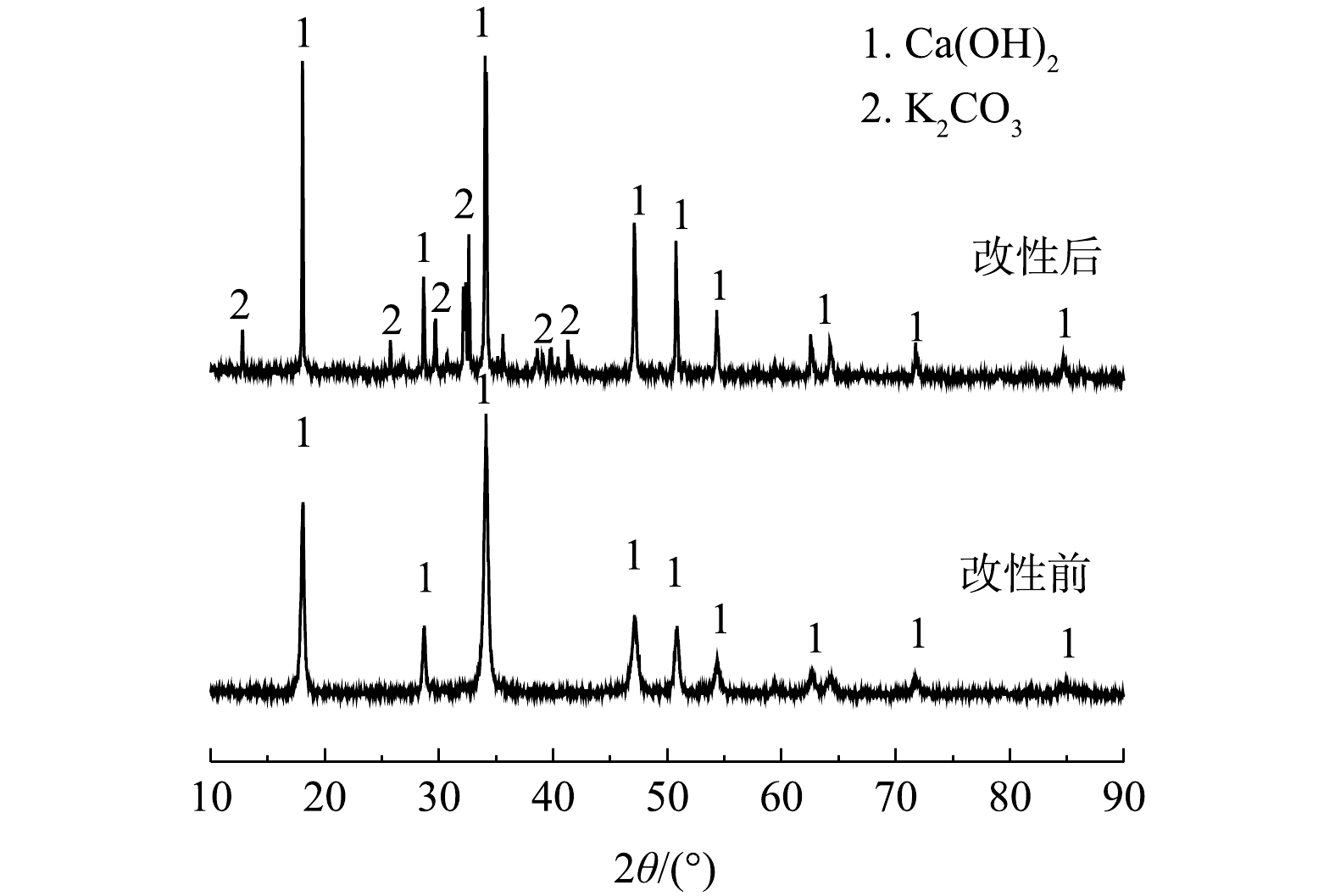
3)改性前后电石渣的XRD分析。由图5可知,改性前电石渣的主要成分是CaO,但以Ca(OH)2形式存在,这与XRF的分析结果(91%)一致[11]。改性后电石渣衍射峰仍以Ca(OH)2为主,但2θ在25°~45°出现了K的衍射峰,主要以K2CO3形式存在。改性前后XRD图谱均有彼此独立且尖锐的峰,峰形明显,表明材料存在结晶或者近晶,且改性后并没完全改变电石渣的基本框架,均为晶型结构。K2CO3峰相比于Ca(OH)2的衍射峰相对较平缓,强度不大,说明K2CO3分散性更好。KOH作活化剂时会生成K2O、K2CO3等活性组分。有文献报道,活性组分进入碳晶格中,会产生大量的无序结构,从而创造更多的活性点位[17-18],即可为脱除NO提供更多的活性点位。从SEM和BET的结果可知,改性电石渣微观结构明显发生改变,大量微小气孔利于吸附NO,使NO附着在其表面。有文献报道,在活性组分K2CO3的作用下,将NO氧化为NO2,气相NO被O2催化氧化为NO2的反应机理有2种[19-20]。当NO与O2反应时,主要发生反应的机理为:1) NO + O2 →NO3,NO3+ NO →2NO2;2) 2NO → (NO) 2,(NO)2 + O2 → 2NO2,同时存在且相互竞争。低温时,主要发生机理2的反应。反应温度大于327 ℃时,机理1占优势。该实验中NO在改性电石渣表面发生化学反应聚合生成(NO)2,(NO)2与O2生成NO2,最终实现NO的催化氧化以达到对NO的脱除净化目的。
-
以改性电石渣在反应温度300 ℃下的NO脱除率为参考指标,结果见表2。表2中K1、K2、K3、K4表示各因素在其水平K1、K2、K3、K4下的4次实验中所得的NO脱除率之和;k1、k2、k3、k4则是4次实验的平均值;极差R为k1、k2、k3、k4中最大值与最小值之差,反映各因素对考察指标的影响大小,极差越大,影响越大。
对实验结果的极差分析表明,各因素对NO脱除率的影响顺序是浸渍浓度>焙烧温度>焙烧时间。其中,KOH浸渍浓度对脱硝效率影响最明显。由表1和表2可知,理论最优条件为A3B1C2,即KOH浸渍浓度为5 mol·L−1,焙烧温度为300 ℃,焙烧时间3 h。
-
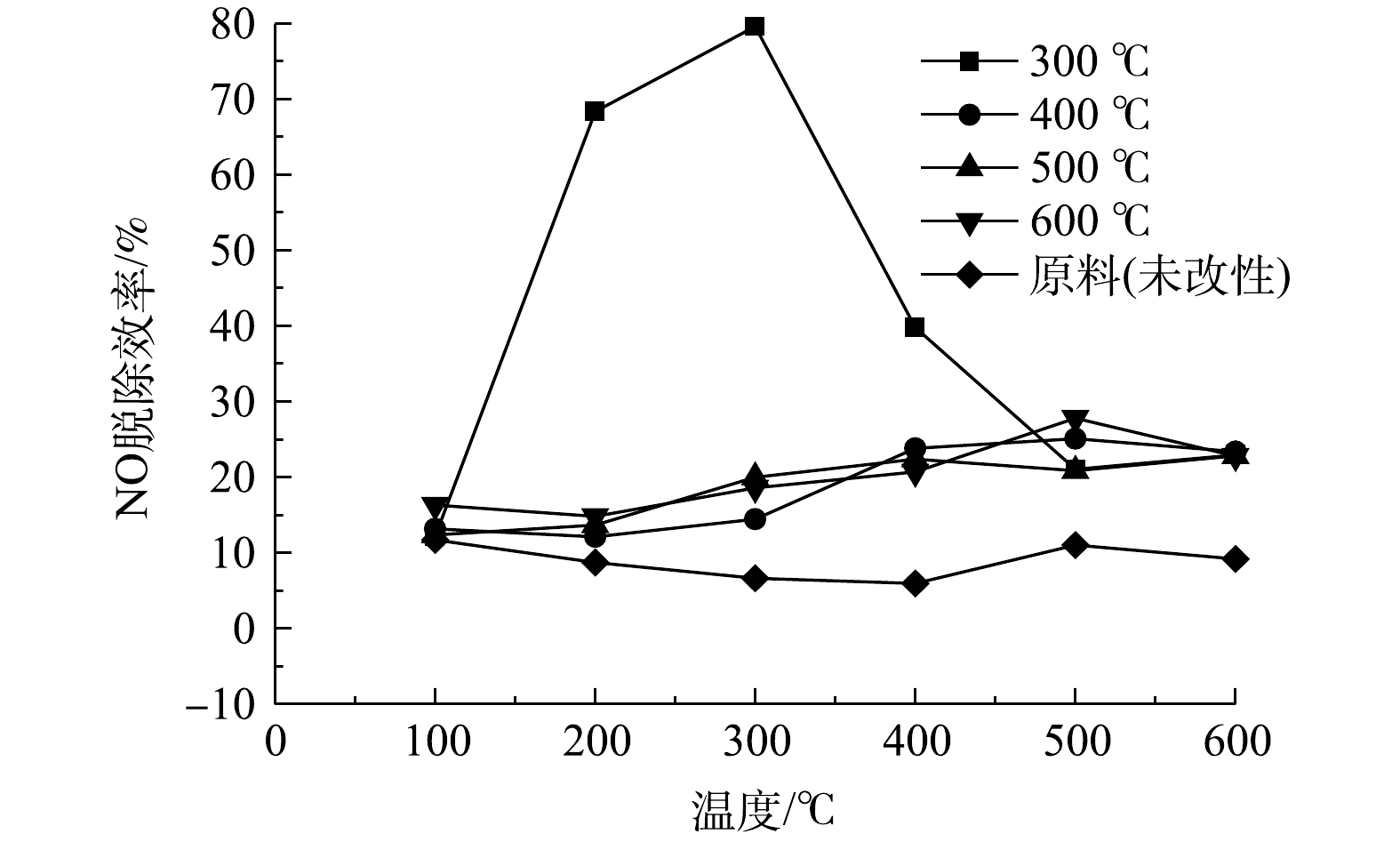
由图6可知,随着KOH浓度不断增加,NO的脱除率呈现先升高后下降的趋势。当KOH溶液浓度为5 mol·L−1时,NO脱除率最高,可达到80%左右。此外,当KOH溶液浓度为2、5和 10 mol·L−1时制备得到的改性电石渣对NO的脱除率会先随着温度升高而升高;当温度为300 ℃时,改性电石渣对NO的脱除率达到最大;当反应温度超过300 ℃时,反应温度继续升高,改性电石渣对NO脱除率下降。当KOH浓度为12 mol·L−1时制备改性电石渣,其NO脱除率相较未改性电石渣有一定提高,但对NO的脱除率较差,基本稳定在10%~20%。这是由于KOH浸渍焙烧后,电石渣会负载K2CO3,并在浓度为5 mol·L−1时达到饱和状态,脱硝活性效果最好。随着浓度的增加,反而不利于K2CO3的负载,导致脱硝活性下降[13]。因此,浸渍适当浓度的KOH有利于催化氧化NO,但过量K也会导致催化剂活性降低。
-
由图7可知,焙烧温度为300 ℃时制备的电石渣对NO脱除率最好,性能明显优于培烧温度为400、500、600 ℃时制备的改性电石渣。在温度升高过程中,NO脱除率会随之升高,在焙烧温度为300 ℃时达到最大。当反应温度超过300 ℃时,随着焙烧温度的进一步升高,制得改性电石渣对NO脱除率反而下降。当焙烧温度为400、500、600 ℃时,改性电石渣对NO脱除率相较未改性电石渣有一定提高,但NO脱除率总体仍然较差,基本稳定在10%~25%,随焙烧温度变化也不大。这是由于焙烧温度过高会引起电石渣的烧结、融合,活性组分分散度变差,引起脱硝活性降低[21-22]。因此,合适的焙烧温度有利于NO的催化氧化,焙烧温度过高也会导致催化剂活性降低。
-
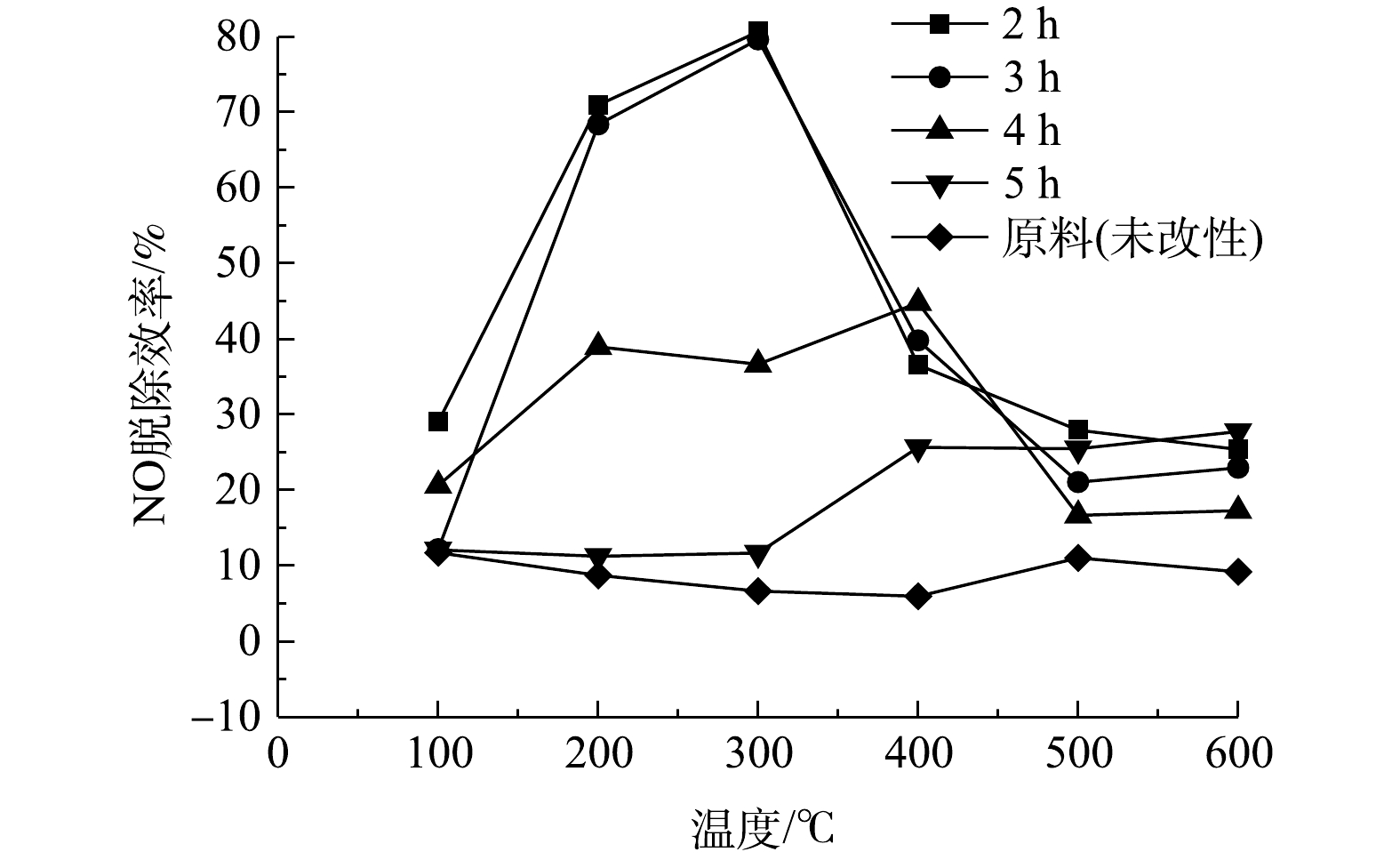
由图8可知,随着焙烧时间的增加,制得改性电石渣对NO脱除率呈下降趋势。其中,当焙烧时间为2 h时,NO脱除率最佳,焙烧时间为5 h时,NO脱除率较低。焙烧时间低于3 h时,NO脱除率都先随着温度升高而升高,并在反应温度为300 ℃时达到最大。当反应温度超过300 ℃时,随着反应温度进一步升高,NO脱除率反而下降。焙烧时间高于4 h时,其脱硝效率相较未改性电石渣有一定提高,但其NO脱除率较差。焙烧时间越长,对催化剂表面的作用时间就越长,过长的处理时间会破坏催化剂结构,使气孔堵塞,导致活性下降,不利于对NO的吸附。因此,适当的焙烧时间有利于催化氧化NO,但焙烧时间过长又会导致催化剂活性降低。
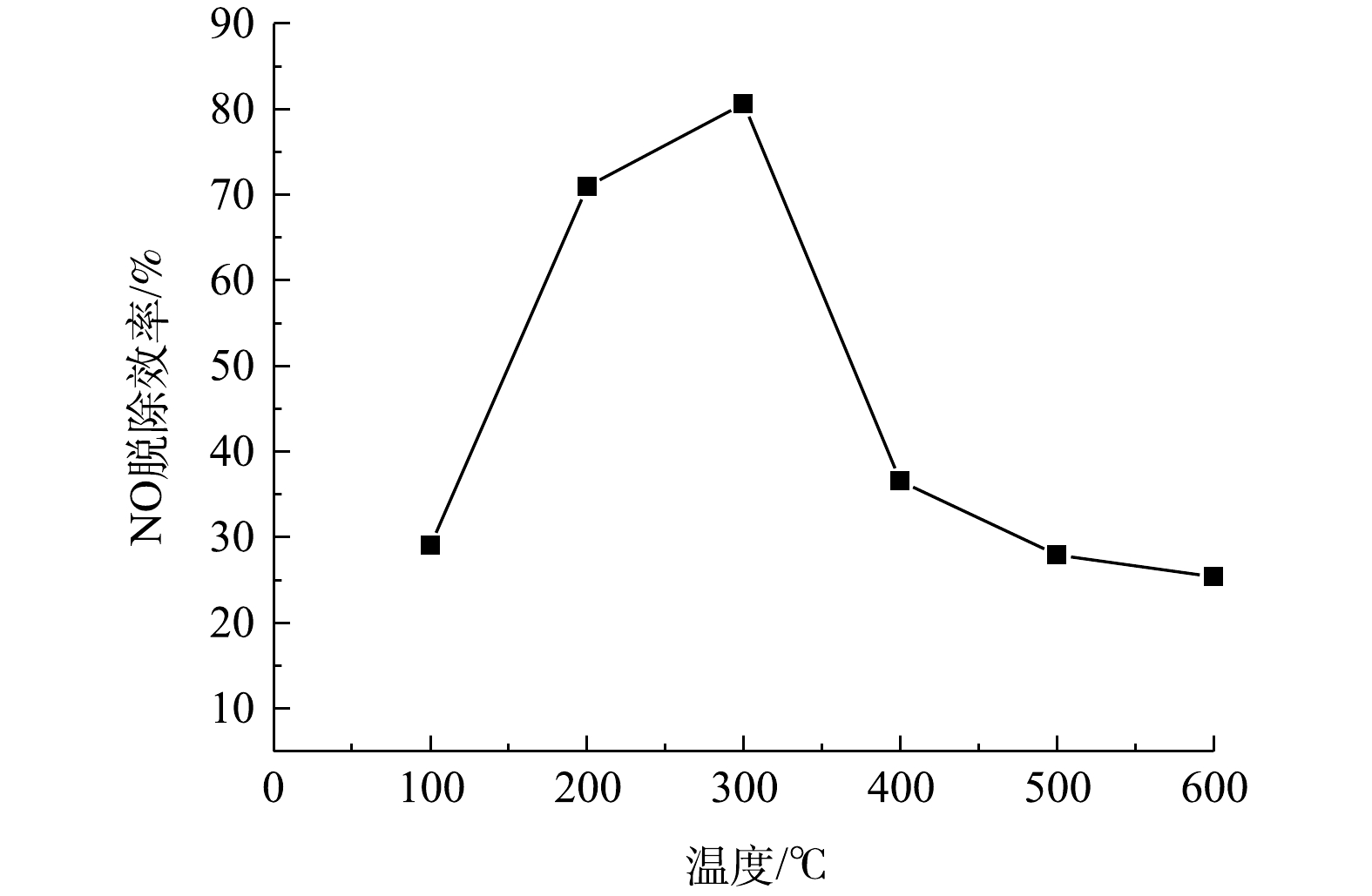
综合单因素实验结果,制备改性电石渣的最优条件是浸渍浓度为5 mol·L−1,焙烧温度为300 ℃,焙烧时间为2 h。改性电石渣的NO脱除率最高可达80.66%。其对NO脱除效果如图9所示。
2.1. 改性电石渣干法催化净化NO性能评价
2.2. 电石渣的表征分析
2.3. 正交实验结果
2.4. 改性条件对NO脱除的影响单因素实验
2.4.1. KOH浓度对NO脱除的影响
2.4.2. 焙烧温度对NO的脱除影响
2.4.3. 焙烧时间对NO的脱除影响
-
1)采用改性电石渣干法脱除NO是可行且有效的。在气体流量200 mL·min−1,NO质量浓度为700 mg·m−3,O2含量5%的反应条件下,改性电石渣的NO脱除率随反应温度的升高呈先增大后减小的趋势。在反应温度为300 ℃时,NO脱除率最大。
2)通过KOH改性之后,电石渣的脱硝效率明显提高。表征改性电石渣微观结构发现其结构明显发生改变,为NO氧化为NO2提供了反应场所,而生成的K2CO3为NO的去除提供了更多活性点位,可提高催化氧化NO为NO2的速率。
3)各因素对NO脱除率的影响顺序:浸渍浓度>焙烧温度>焙烧时间。随着KOH浓度不断增加,改性电石渣NO脱除率呈现先增加后下降的趋势;当KOH溶液浓度为5 mol·L−1时,改性电石渣对NO脱除率最高,可达到80%。随着焙烧温度和焙烧时间的增加,改性电石渣对NO脱除率下降。当KOH浓度为5 mol·L−1,焙烧温度为300 ℃,焙烧时间为2 h时,改性电石渣的NO脱除率可达80.66%。



 DownLoad:
DownLoad: