-
化学镀镍是一种前沿的表面处理技术,具有镀层均匀、耐腐蚀、操作方便等优点,在汽车、电子、石油等领域得到了广泛的应用[1]。在化学镀镍的过程中,镍离子通过次磷酸盐、氨基硼烷、硼氢化合物的还原作用沉积在金属的表面[2]。随着反应的进行,溶液中的镍离子和次磷酸盐不断减少,通常需要补充硫酸镍和次磷酸钠,但是积存的亚磷酸盐、硫酸盐、钠等物质降低了金属薄膜的质量,因此,须更换镀液,更换镀液的过程中产生了大量的废槽液,再加上镀件表面的清洗流程,化学镀镍活动会消耗大量的清洗水。
化学镀镍废水含有较高浓度的次亚磷酸钠、重金属镍,为提高镀层的质量、镀液的稳定性及金属镍的沉积速度,在化学镀镍液中均须添加各种有机酸络合剂[3],故在化学镍废水中也含有较高的COD。目前,化学镀镍废水的处理方法主要有化学沉淀法、离子交换法、膜分离及吸附法[4]。施银燕等[5]发现H2O2、NaOH和聚丙烯酰胺能够沉淀、回收化学镀镍废水中大部分的镍离子。白滢等[6]以电镀废水为处理对象,研究了高分子重金属絮凝剂PEX对废水中重金属离子、浊度及有机污染物的处理效果。虽然化学沉淀法能够有效去除废水中的重金属离子,但因其产生的污泥量大,故处理污泥危废的成本较高,并且化学沉淀法难以协同去除废水中的次亚磷酸盐。LI等[7]对化学镀镍废液在电渗析回收过程中的2种阳离子交换膜的不同性能进行了测试,发现其能有效去除废液中的有害金属离子(亚磷酸、硫酸盐和钠)。但是离子交换法、膜分离及吸附法存在操作难度高、膜易受污染、离子交换剂饱和及再生等问题[8]。
电化学方法是一种有效的环境友好的净水技术,其在水中发生电化学反应,经过絮凝、沉淀、氧化和还原等组合作用,可在短时间内完成对多种污染物的去除[9]。电絮凝技术已经广泛应用于电镀废水处理中,可有效去除废水中的多种重金属污染物;电芬顿法处理电镀废水也已有报道[10-13]。研究针对化学镀镍废水中的镍离子、有机污染物和次亚磷酸盐,开展了电化学处理研究,详细考察了电絮凝、双氧水强化电絮凝等对化学镀镍废水中的总磷、镍离子与COD的去除效果,并分析了影响去除效果的主要因素与影响机制,可为电镀废水中的次亚磷酸盐、有机物和镍离子的有效去除提供技术参考。
全文HTML
-
实验用水取自某电镀园区化学镀镍废水,呈浅绿色,废水中主要成分有硫酸镍、次磷酸氢钠、柠檬酸钠、氨水。该废水的pH=5.6,镍离子浓度为95 mg·L−1,COD为2 250 mg·L−1,总磷浓度为1 200 mg·L−1,次亚磷酸盐的浓度为1 194 mg·L−1。
-
实验试剂为30% H2O2、NaOH、H2SO4,均为分析纯,购于上海阿拉丁生化科技股份有限公司。实验装置如图1所示,由DH1765-1型直流稳压电源、反应容器、磁力搅拌器、极板与阴阳极接线组成。阳极为铁板2块,尺寸均为100 mm×60 mm×2 mm;阴极为不锈钢板2块,尺寸均为100 mm×60 mm×2 mm;调节极板间距为10 mm,浸入水中高度60 mm;在反应过程中,阳极和阴极分别通过电极线与DH1765-1型程控直流稳压稳流电源的相关输出端连接,使电化学体系在恒定电流下发生反应。采用Ms-(H)-Pro数显型磁力搅拌器,以确保反应容器内溶液混合均匀,转速为600 r·min−1。电化学系统有效工作容积为500 mL。
-
用硫酸和氢氧化钠将水样初始pH调节为3,投加6 mL·L−1的30% H2O2,调节不同电流密度分别为2、5、10、15 mA·cm−2,总反应时间为40 min,取样时间分别为0、5、10、20、30、40 min,并记录下每次取样时的pH,考察电流密度对实验结果的影响。
用硫酸和氢氧化钠将水样初始pH分别调节为2、3、4、5,投加6 mL·L−1的30% H2O2,固定电流密度为10 mA·cm−2,反应时间以及取样时间不变,并记录下取样时的pH,考察初始pH对实验结果的影响。
用硫酸和氢氧化钠将水样的初始pH调节为3,固定电流密度为10 mA·cm−2,H2O2投加量分别设为0、2、4、6、8 mL·L−1,反应时间和取样时间不变,并记录下每次取样时的pH,考察H2O2投加量对实验结果的影响。
-
水样均用0.45 μm滤膜过滤,分析测定水中镍离子浓度、总磷、正磷和COD。水样的pH用奥立龙720APLUS Benchtop型pH计(Thermo Orion Co. USA)进行测定;COD采用加热消解比色法(HACH DRB200消解仪及DR2800型COD比色仪)[14]测定;镍离子浓度采用电感耦合等离子体ICP-OES(710)光谱仪(AgilentTechnologies.USA)[14]测定;总磷以及正磷采用钼酸铵分光光度法(GB 11893-1989)[14]测定。
1.1. 实验用水水质
1.2. 实验试剂与仪器
1.3. 实验方法
1.4. 分析方法
-
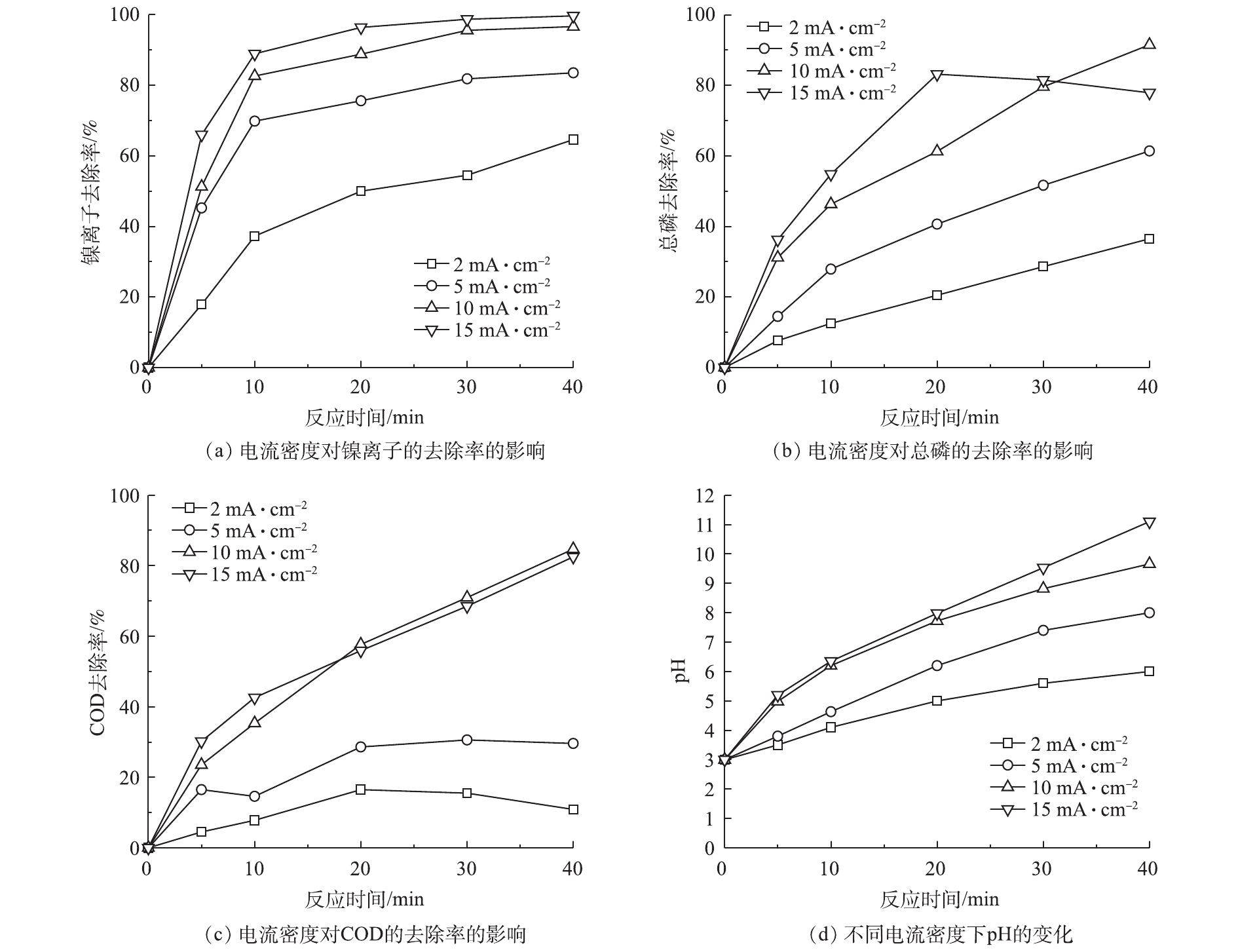
电流密度对镍离子、总磷和COD去除率的影响及反应过程中pH的变化情况见图2。电流密度的大小决定了亚铁离子的溶出量和氢氧根的生成量,是较为重要的影响因素。由图2(a)可知,随着电流密度的增大,镍离子的去除率有所升高。当电流密度为15 mA·cm−2,在反应40 min时,镍离子的浓度从初始的95 mg·L−1降至0.4 mg·L−1,去除率达到了99.6%。镍离子的去除原因可能归为2个方面:一方面,随着电流密度的增大,阳极铁板溶出大量的亚铁离子,Fe2+经双氧水催化生成Fe3+,阴极析氢产生大量的OH−,Fe2+和Fe3+分别与OH−反应,产生大量絮凝剂Fe(OH)2和Fe(OH)3,镍离子与这些絮凝剂相互作用从而共沉淀[15];另一方面,外加的H2O2与阳极溶出的Fe2+发生芬顿反应,产生的羟基自由基氧化电位高达2.8 eV[16],可以破坏镍离子与废水中有机酸的络合形态,使镍离子游离出来,进一步与OH−相互作用,生成沉淀。由图2(b)可见,随着电流密度的增大,总磷的去除率有所提高,这是由于亚铁离子溶出量增大,促进了电芬顿反应的效率,电芬顿反应生成的羟基自由基可以将化学镀镍废水中次亚磷酸盐氧化为正磷酸盐,正磷酸盐再与Fe3+相互作用生成磷酸铁沉淀,具体反应如式(1)~式(5)所示。
当电流密度为10 mA·cm−2,反应40 min后,总磷去除率达到91.5%;然而在电流密度为15 mA·cm−2,反应20 min时去除率为83.2%,在40 min时总磷去除率仅有77.9%,总磷去除率出现了先升后降的趋势。由图2(c)可见,随着电流密度的增大,COD的去除率也有所升高。这可能是由于随着电流密度的增大,产生的羟基自由基数量增多,能够有效破坏有机物的络合形态,从而快速氧化污染物。由图2(d)可知,随着反应的进行,pH持续升高,并且随着电流密度的增大,pH的升高幅度越大,这是因为阴极极板上产生大量OH−,使溶液pH随着反应时间的延长不断升高。
由图2可知,增大电流密度能够在短时间内提高镍离子和COD的去除率,在反应30 min后,继续升高的电流密度对去除率的影响并不明显。并且过高的电流密度会引起pH的持续升高,这不利于正磷的沉淀。从经济的角度考虑,电流密度过大,也会增加用电成本和铁泥量。故确认10 mA·cm−2是一个比较合理的电流密度,在此条件下,反应40 min后,镍离子、总磷和COD的去除率分别达到96.6%、91.5%和84.7%。
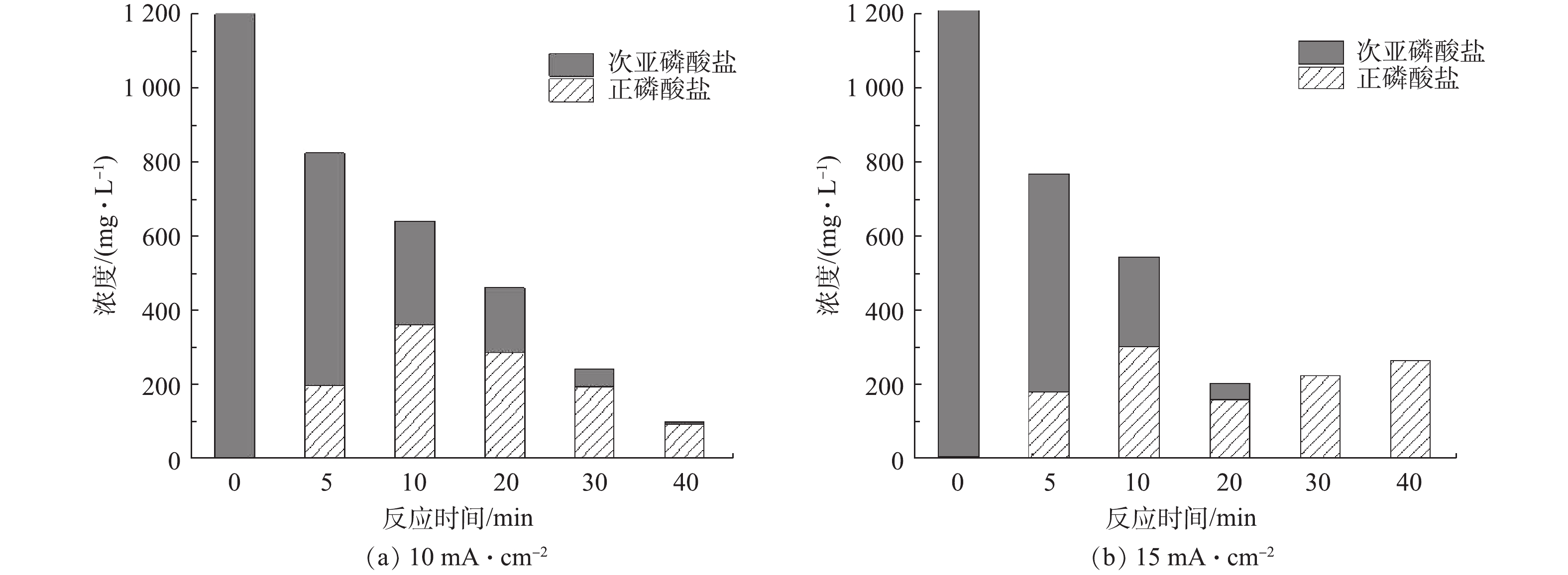
图3为电流密度分别为10 mA·cm−2和15 mA·cm−2时,水样中次亚磷酸盐与正磷酸盐的浓度随处理时间的变化特征。由图3(a)可知,随着反应的进行,芬顿反应产生的羟基自由基将次亚磷酸盐氧化成正磷酸盐,同时正磷酸根与Fe3+离子反应,生成FePO4沉淀,总磷含量不断减少。同时,由图3(b)可知,在反应30 min后,次亚磷酸盐已经完全被氧化成正磷酸盐,并且在随后的反应过程中,正磷酸盐含量有所升高。正磷酸根能否与Fe3+离子反应生成FePO4沉淀与反应溶液的pH有关[17],结合图2(d)可知,在电流密度为15 mA·cm−2、反应时间为30 min、溶液pH=9.53时,产生的大量OH−会与水解产生Fe3+最先生成较难溶的Fe(OH)3沉淀,会抑制正磷酸盐与Fe3+离子形成沉淀[18],导致正磷酸盐溶出,总磷浓度升高。这就解释了随着电流密度的增大,总磷去除率先增大后减小的原因。
-
芬顿反应一般要求溶液的pH较低(pH≈3),这是因为高pH会导致Fe2+和Fe3+的沉淀,从而影响芬顿反应的效率[19]。在电芬顿反应过程中,随着反应的进行,溶液pH会不断地上升,所以反应溶液的初始pH对电化学处理化学镀镍废水的效率会有影响。图4反映了初始pH对镍离子、总磷和COD的去除率的影响以及反应过程中pH的变化。由图4(a)可知,在前10 min内,初始pH越小,对镍离子的去除效果越差,这可能是由于在酸性条件下,H+会与OH−发生中和反应,抑制OH-与镍离子生成沉淀。随着反应的进行,OH−不断生成,导致pH上升,当初始pH分别为3、4和5时,镍离子去除率在40 min时趋于相同。由图4(b)可以看出,总磷去除率在初始pH=3时最好。当初始pH为4或5时,芬顿反应的效率较低,在反应30 min时,pH上升至9以上,过高的pH不利于正磷的沉淀,总磷浓度反而上升,去除率下降。由图4(c)可知,当初始pH为2或3时,COD的去除效果最好,在反应40 min时,COD的去除率分别为86.1%和84.7%。由此可见,在偏酸性条件下,芬顿反应对污染物的氧化效率更高。
-
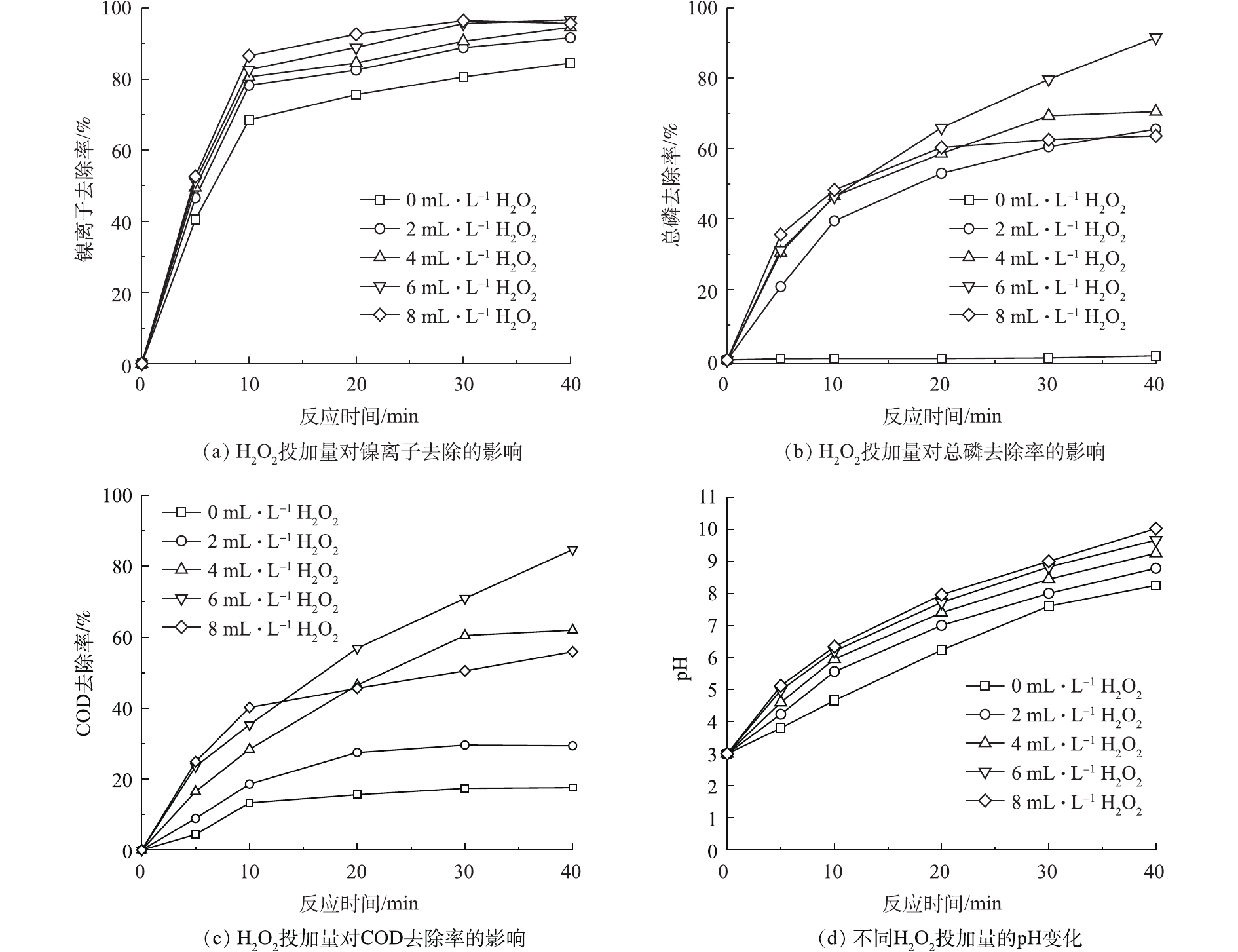
图5反映了H2O2投加量对镍离子、总磷、COD的去除率的影响以及pH的变化。由图5(a)可知,当不投加H2O2时,为单独的电絮凝反应,在反应40 min时,镍离子去除率为84.5%。当双氧水投加量为6 mL·L−1时,去除效果最好,反应40 min时,去除率为96.6%。由此可见,镍离子主要是通过电絮凝反应去除。由图5(b)可知,当不投加H2O2时,总磷含量几乎不发生变化,化学镀镍废水中大量的次亚磷酸盐难以通过电絮凝方式去除,只有通过芬顿反应产生的羟基自由基将次亚磷酸盐氧化成正磷酸盐,正磷酸根与铁离子反应生成FePO4沉淀方式去除。随着H2O2投加量的增加,总磷去除率先增大后减小。当H2O2投加量为6 mL·L−1时,总磷的去除效果最好,反应40 min后,总磷浓度为102 mg·L−1,去除率达到91.5%。由图5(c)也可知,COD的去除率也随着双氧水投加量的增加表现为先增大后减小,当H2O2投加量为6 mL·L−1时,COD去除效果最好,反应40 min后,COD含量为344 mg·L−1,去除率达到84.7%。由图5(d)可知,在单独的电絮凝过程中,pH上升比较缓慢,当增加H2O2的投加量后,pH上升较快,当H2O2投加量为8 mL·L−1时,反应40 min后,pH上升至10.02。
2.1. 电流密度对镍离子、总磷和COD去除率的影响
2.2. 初始pH对镍离子、总磷和COD去除率的影响
2.3. H2O2投加量对镍离子、总磷和COD去除率的影响
-
1)电流密度的大小决定了亚铁离子的溶出量和氢氧根的生成量,镍离子和COD的去除率随着电流密度的增大而增大。随着电流密度的持续增大,反应溶液pH不断上升,会导致原本沉淀的正磷酸盐溶出,致使总磷的去除率降低。
2)较高的pH会降低芬顿反应的效率。当调节初始pH为2~3时,能够快速高效地去除镍离子、总磷和COD。
3)在不投加H2O2的条件下,反应40 min时,镍离子去除率为84.5%,所以镍离子主要通过电絮凝作用去除。投加H2O2后,H2O2与阳极溶出的Fe2+发生芬顿反应, 产生的羟基自由基能够迅速氧化废水中的次亚磷酸盐和COD,再通过一系列的吸附絮凝作用沉淀。
4)采用电化学方法处理化学镀镍废水,芬顿氧化+电絮凝的处理过程能够高效同步去除水中镍离子、总磷和COD。最佳工艺参数为:电流密度为10 mA·cm−2、初始pH为3、30% H2O2投加量为6 mL·L−1、反应时间40 min,镍离子、总磷和COD的去除率分别达到96.6%、91.5%和84.7%。




 下载:
下载: