-
氨气是一种无色、易反应、具有腐蚀性的气体,通常来自化肥生产行业、畜禽养殖业、化石燃料燃烧和污水处理厂[1]。氨气能够刺激人的皮肤、眼睛、呼吸系统,甚至是胃肠道。在浓度达到0.003~0.013 mg·L−1时,即可产生可识别的刺激性气味。氨气是大气中PM2.5的重要前体,其沉降后又会引发水体富营养化和土壤酸化[2],因此,其排放对人类健康及生态环境会产生潜在的危害。因此,世界各国政府都对不同的行业建立了严格的氨气排放标准。
含氨废气可以通过热氧化、催化燃烧、化学吸收和生物过滤的方法进行处理,其中生物过滤法由于其成本低、效率高被广泛应用于各行业[3]。生物滤池和生物滴滤池(biotrickling filter,BTF)是2种典型的生物过滤技术。传统的生物滤池以堆肥、泥炭和土壤为固体填料,这些填料为细菌附着提供载体,同时为细菌生长提供营养物质和pH缓冲体系。在BTF中,氨溶解进入液相,并输送到微生物表面,然后转移到细胞内,再通过生物转化,形成亚硝酸盐、硝酸盐和氮气。与生物滤池不同,BTF以惰性材料(聚氨酯泡沫、Kaldes环和多孔陶瓷)为细菌生长提供载体,以营养盐溶液的滴滤和再循环为细菌提供营养物质和pH缓冲体系。与化学洗涤法相比,BTF可将溶解在液相中的氨氧化成亚硝酸盐和硝酸盐,这有助于氨的进一步溶解,同时达到淋洗液循环使用的目的[4-5]。但是,由于游离亚硝酸(free nitric acid,FNA)对氨氧化细菌(AOB)和亚硝酸盐氧化细菌(NOB)的抑制作用,淋洗液中的亚硝酸盐和硝酸盐积累会降低BTF的硝化性能[6-7]。而含有亚硝酸盐和硝酸盐的淋洗液排放后,仍能引发水体富营养化。因此,仅通过BTF的硝化作用并不能达到总氮控制的要求。为此,SAKUMA等[1]和RABONI等[8]利用反硝化处理BTF中的硝化淋洗液,取得了良好的效果。以葡萄糖和甘油作为碳源后,亚硝酸盐和硝酸盐显著降低,近70%的氨氮通过反硝化作用转化为氮气。若将反硝化过程的出水回流至BTF中,反硝化产生的碱度可以为硝化细菌创造合适的pH,从而强化硝化过程。利用反硝化处理BTF出水的唯一问题在于,须严格控制C/N,以防止有机物重新进入BTF中,影响硝化反应。
厌氧氨氧化是以亚硝酸盐为电子受体,在厌氧条件下将氨转化为氮气和少量硝酸盐的自养生物过程[9]。这一新型氮素转化途径经常与短程硝化过程联用,目前已被广泛应用于各类含氨废水的处理中[10-11]。本研究探讨了利用BTF对氨气淋洗液进行短程硝化并通过厌氧氨氧化上流式厌氧污泥床(UASB)对BTF的淋洗液出液进行净化的可行性,考察了回流比和氨气负荷对BTF中短程硝化过程的影响,以期为采用短程硝化-厌氧氨氧化组合工艺处理氨淋洗液提供参考。
全文HTML
-
短程硝化BTF的高度为1.5 m、内径为10 cm,以聚氨酯泡沫块为填料,填料层高度1.2 m。反应器在25 ℃下运行,实验流程如图1所示。将增湿后的压缩空气与氨气混合,制成浓度为0.03~0.31 mg·L−1的模拟含氨废气,气体与淋洗液同向从BTF顶部连续进入,并从底部流出反应器。
首先,采用分批培养的方式对填料进行生物膜的培养。将3.5 L养猪废水添加到BTF中,并以0.64 m·h−1的速率持续循环,直到废水中90%以上的
NH+4 -N被转化。第1个批次培养7 d后,向BTF中通入空气,进而提高氨的转化和生物膜生长速率。生物膜培养好后,氨淋洗及处理实验正式开始。然后开始BTF反应器的正式运行。按照进气中氨气浓度和反应器的运行方式,将BTF反应器运行分为3个阶段。阶段Ⅰ(1~28 d)为启动阶段,氨气浓度为0.03~0.10 mg·L−1,淋洗速率(淋洗液单位时间内通过生物滴滤池的距离)为0.05 m·h−1,其中营养盐溶液提供速率为0.03 m·h−1,淋洗液出液回流提供速率为0.02 m·h−1。阶段Ⅱ(29~78 d),为考察淋洗液出液回流速率和营养盐溶液速率的比例(回流比)对亚硝酸积累的影响,因此,在此阶段,维持氨气浓度为0.10 mg·L−1,淋洗速率为0.07 m·h−1,调整回流比为1∶4、1∶3、1∶2、1∶1、2∶1。阶段Ⅲ(79~172 d),在此阶段,氨气的浓度继续提高至0.14~0.31 mg·L−1,考察较高氨气负荷时,BTF中短程硝化的性能。此时,由于淋洗液出液中NH+4 和NO−2 浓度较高,为避免淋洗液出液回流带入的NO−2 促进亚硝酸氧化细菌生长,破坏短程硝化过程,因此,关闭回流泵(图1),停止淋洗液出液回流,仅使用营养盐溶液进行淋洗,淋洗速率保持与阶段Ⅱ相同,仍为0.07 m·h−1。在BTF整个运行期间,气体空床时间(气体通过生物滴滤池的时间)为30 s。营养盐溶液组成见表1。BTF的运行性能可通过3个指标来表征:1)氨气去除率;2)亚硝酸的积累率,以液相中亚硝氮增量与液相中硝化产物增量的比值进行计算;3)氨的转化率,以液相中硝化产物增量和液相中总氮增量的比值进行计算。三者的计算方法见式(1)~式(3)。
式中:Eg为氨气去除率;Eni为亚硝酸的积累率;Eam为氨的转化率;
CNH3,in 为氨气进气浓度,mg·L−1;CNH3,out 为氨气出气浓度,mg·L−1;CNO2,in 为营养盐与回流液混合后进液中NO−3 -N的浓度,mg·L−1;CNO3,out 为淋洗液出液中NO−2 -N的浓度,mg·L−1;CNO3,in 为营养盐与回流液混合后进液中NO−3 -N的浓度,mg·L−1;CNO3,out 为淋洗液出液中NO−3 -N的浓度,mg·L−1;CTN, in为营养盐与回流液混合后进液中NH+4 -N、NO−2 -N和NO−3 -N的浓度和,mg·L−1;CTN, out为淋洗液出液中NH+4 -N、NO−2 -N和NO−3 -N的浓度和,mg·L−1。 -
厌氧氨氧化UASB的有效容积为3.6 L,接种污泥为3 L预培养的厌氧氨氧化颗粒污泥。污泥的MLSS和MLVSS分别为49.36 g·L−1和33.32 g·L−1。该厌氧氨氧化UASB反应器首先在25 ℃下单独运行41 d(图1),保证细菌活性的恢复和稳定,单独运行时的基质为营养盐溶液(组成见表1)。在厌氧氨氧化UASB反应器运行的第42天,将其与BTF连接(图1)。此时,BTF运行至第99天,无回流。为保证BTF淋洗液出液中氨氮和亚硝氮的负荷不超过厌氧氨氧化UASB的处理能力,在该阶段后期,将BTF淋洗液出液经自来水适当稀释,用磷酸盐和碳酸氢盐调节碱度后,部分出液泵入UASB反应器中。此时,为防止厌氧氨氧化过程产生的
NO−3 对BTF处理性能的影响,厌氧氨氧化UASB反应器的出水直接排放,不再返回到BTF中。连接后,2个反应器同时运行74 d,在BTF运行至172 d,厌氧氨氧化UASB运行至115 d时,实验结束。 -
NH+4 -N、NO−2 -N、NO−3 -N的测定采用文献中的方法[13]。气相中氨气浓度的测定采用酸吸收法。气体样品以200 mL·min−1的流速通过装有50 mL硫酸(0.02 mol·L−1)的气体洗瓶进行吸收,然后根据吸收液中NH+4 -N浓度来计算BTF进出气中氨气浓度。 -
实验结束后,分析了距BTF顶部0.4 m和0.8 m处的微生物群落组成。将收集的聚氨酯泡沫置于超声波振荡器中振荡,使生物膜脱落并破碎。然后使用环境样品3S DNA分离试剂盒V 2.2(申能博彩生物科技有限公司,中国),提取生物膜样品的DNA。用凝胶电泳检测2种样品的完整性和浓度。随后用细菌通用引物对341f(5′-CCTACACGACGCTCTTCCGATCTNCCTACGGGNGGCWGCAG-3′)和805r(5′-GACTGGAGTTCCTTGGCACCCGAGAATTCCA-GACTACHVGGGTATCTAATCC)扩增16S rRNA的V3~V4区建库并做相应的检测(上海生工生物股份有限公司,中国)。针对检测合格的文库,采用Illumina Miseq高通量测序平台对样品进行测序。
1.1. 短程硝化BTF的建立和运行
1.2. 厌氧氨氧化UASB的建立及其与BTF的连接
1.3. 化学分析
1.4. 微生物群落分析
-
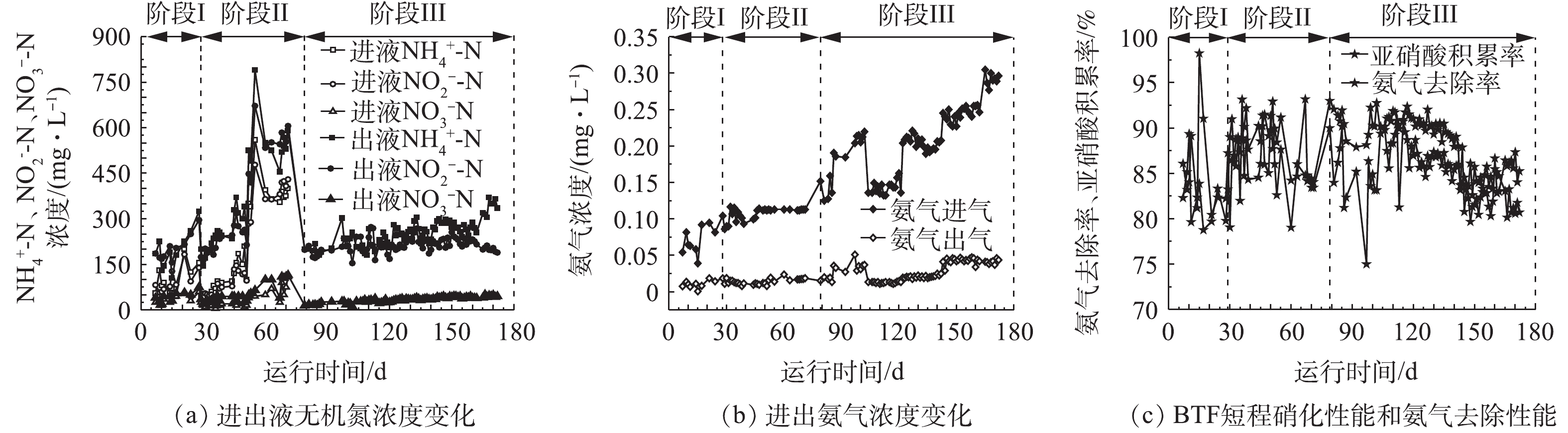
在整个BTF运行期间,进气中氨气浓度为0.03~0.31 mg·L−1,空床时间为30 s,其总体性能见图2。BTF运行可以分为3个阶段。阶段Ⅰ(1~28 d)为启动阶段,氨气浓度为0.03~0.10 mg·L−1,淋洗速率为0.05 m·h−1,其中0.02 m·h−1由回流提供。在阶段Ⅰ结束时,氨气去除率稳定保持在82%,淋洗液出液中
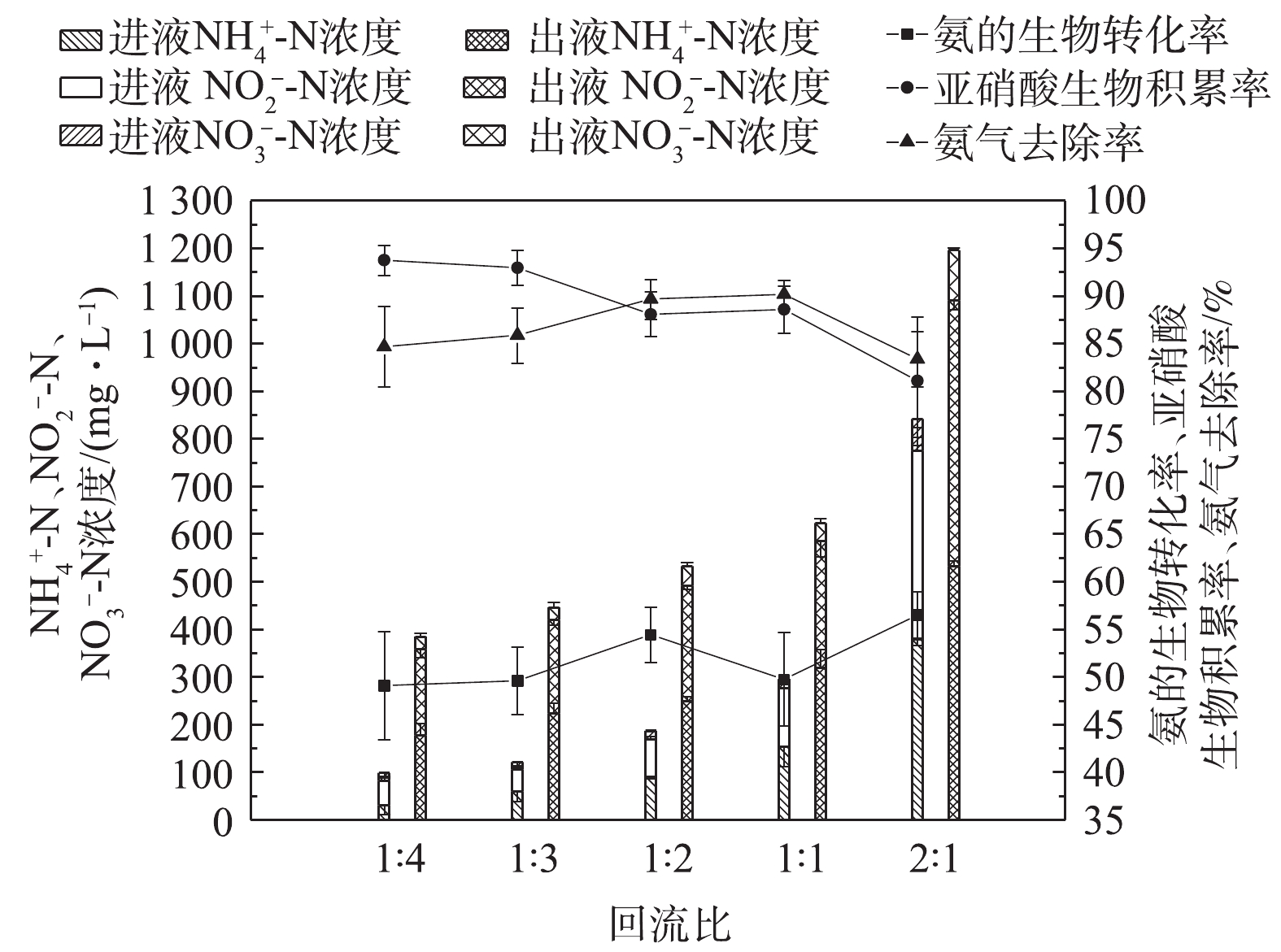
NH+4 -N、NO−2 -N和NO−3 -N的浓度分别为152、156和17.5 mg·L−1(图2);在第28天时,亚硝酸生物积累率为80%,淋洗液出液中NO−2 -N/NH+4 -N为0.9,可以满足厌氧氨氧化反应的要求。在阶段Ⅱ(29~78 d)中,氨气浓度维持在0.10 mg·L−1,淋洗速率增加至0.07 m·h−1,淋洗液回流比为1∶4~2∶1,此时氨气平均去除率和亚硝酸生物积累率均为87%,氨气的去除速率为0.17~0.25 kg·(m3·d)−1。在阶段Ⅲ(79~172 d)中,氨气的浓度升高至0.14~0.31 mg·L−1,停止淋洗液回流,仅使用营养盐溶液进行淋洗,淋洗速率仍保持与阶段Ⅱ相同。在阶段Ⅲ,氨气去除率平均值为86.9%,氨气的去除速率为0.25~0.63 kg·(m3·d)−1。淋洗液出液中亚硝酸生物积累率平均值为86%,NO−2 -N与NH+4 -N比值为0.5~1.2。在实验过程中,BTF中短程硝化现象稳定。淋洗液回流可以保证BTF具有足够的液气比来吸收氨气,同时延长基质与生物膜的接触时间,提高基质的生物转化效率。众所周知,在硝化过程中,游离氨(free ammonia,FA)和FNA既是AOB和NOB的基质,也是这2种细菌的抑制剂。淋洗液回流重新带入的氨和亚硝酸对BTF中的生物转化过程是一把“双刃剑”,因此,实验考察了回流比对氨的生物转化和亚硝酸生物积累过程的影响。在阶段Ⅱ,维持淋洗速率为0.07 m·h−1,比较回流比为1∶4、1∶3、1∶2、1∶1和2∶1时BTF中的亚硝酸生物积累率和氨的生物转化率的变化。在阶段Ⅱ,BTF表现出了较好的亚硝酸积累率,NOB的活性得到较好的抑制,亚硝酸生物积累率维持在80%以上(图3)。这与BTF淋洗液中较高浓度的游离氨FA和FNA密切相关。由表2可知,在阶段Ⅱ,保持氨气进气浓度为0.12 g·L−1,淋洗液中FA浓度为0.2~23.1 mg·L−1,均明显高于FA对NOB的抑制浓度临界值(0.1~1.0 mg·L−1);而淋洗液中FNA浓度为0.024~0.159 mg·L−1,亦明显高于FNA对NOB的临界抑制浓度(0.011~0.07 mg·L−1)[14]。因此,在二者的共同作用下,BTF中NOB的活性被抑制,硝化过程停止在亚硝化阶段。回流比的增加可使氨的生物积累率由49%增加至56%,亚硝酸生物转化率由94%降至81%(图3)。回流将更多的铵和亚硝酸重新带入BTF中,回流比越高,带入量越大。一方面,回流增加了AOB和NOB与基质氨和亚硝酸的接触时间,促进了氨和亚硝酸的生物转化,促进了硝酸盐的生成;另一方面,回流使2种细菌更容易逐渐适应高浓度的FA和FNA,从而产生耐受性,进而减弱了FA和FNA对两者的抑制作用。特别是当回流比大于1时,进液中
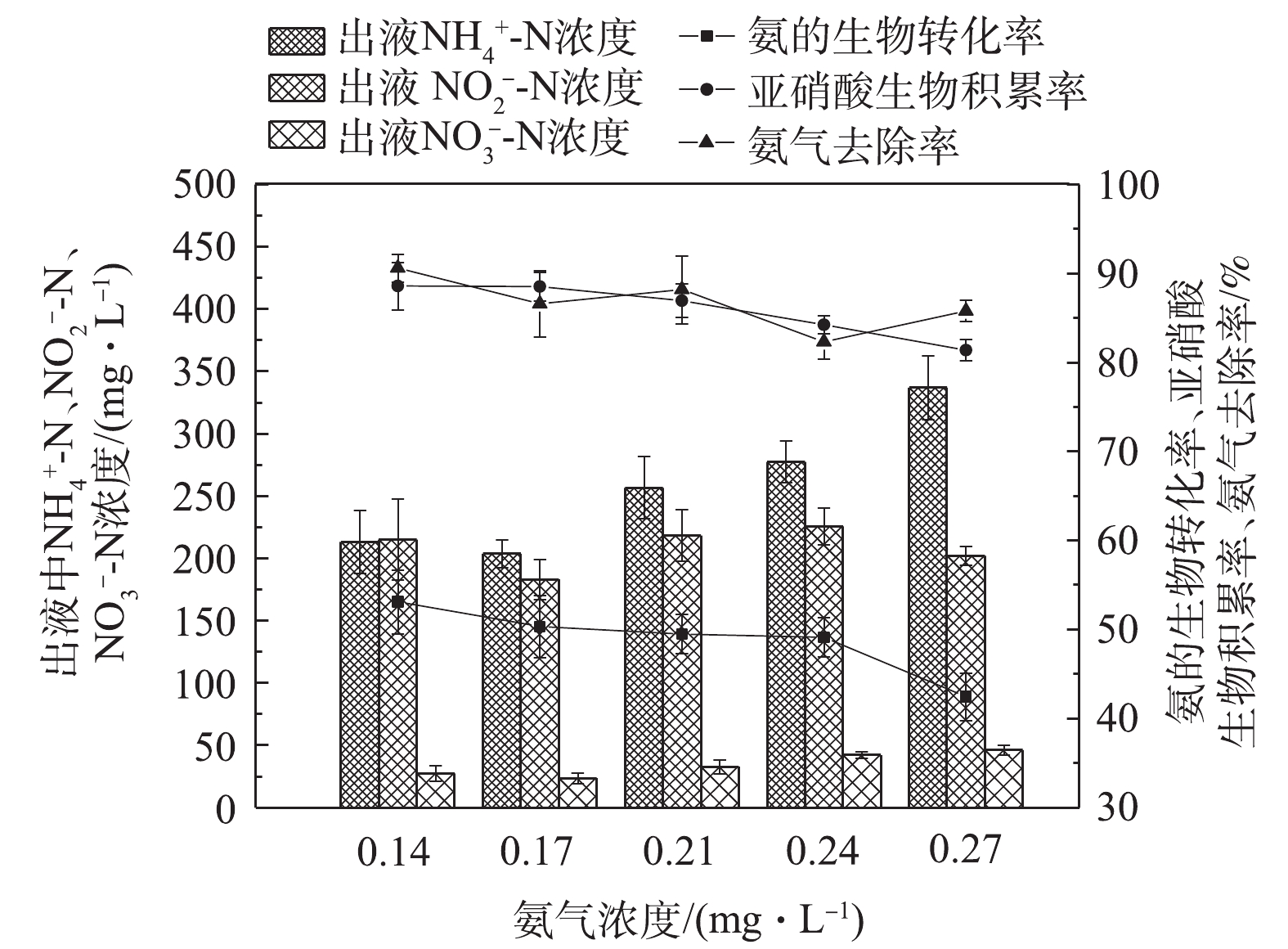
NH+4 -N和NO−2 -N陡然升高,分别达到379 mg·L−1和396 mg·L−1,亚硝酸生物积累率迅速由89%下降至81%。同样地,回流比过高(达到2)会带入的大量NH+4 -N,导致氨气气液传质变缓,这也是BTF对氨气吸收效果下降的主要原因。综上所述,回流比为1∶2可作为BTF中短程硝化的最佳回流比。实验考察了氨气负荷对BTF生物转化过程的影响。为避免淋洗液回流带入的铵和亚硝酸对氨气吸收和生物转化过程的影响,阶段Ⅲ中停止淋洗液回流,但保持淋洗速率(0.07 m·h−1)和空床时间(30 s)均与阶段Ⅱ相同,考察了不同氨气负荷对BTF性能的影响。当氨气浓度从0.14 mg·L−1提高至0.27 mg·L−1时,虽然BTF也表现出较好的氨气处理效果,氨气去除率维持在80%以上,硝化产物中
NO−2 -N亦可占据80%以上,但整体氨气吸收性能和生物转化性能均随氨气浓度的升高而降低(图4)。显然,当氨气浓度提高后,现有的液气比已不能满足氨气吸收的要求,这就直接导致对氨气的吸收能力不足。当氨气浓度为0.27 mg·L−1时,淋洗液中FA浓度可达94 mg·L−1,已达到对AOB的抑制浓度范围(10~150 mg·L−1),故会影响氨氧化过程[14](表2)。此外,在BTF运行过程中,填料表面出现盐的积累、淋洗液短流等现象,这也会导致铵和亚硝酸等基质的生物有效性降低,进而影响铵的转化。氨氧化过程被抑制后,淋洗液出液中NO−2 -N与NH+4 -N的比值降低至0.5~0.7,这对后续厌氧氨氧化过程的顺利实施十分不利。在阶段Ⅲ,亚硝酸的积累并没有因氨气浓度的升高而被强化,亚硝酸生物积累率由89%降低至81%,这同样也与FA和FNA对细菌的抑制作用有关(表2)。虽然在此阶段中的FA浓度一直高于对NOB的抑制值,但其抑制功能的减退很可能是由于经过超过150 d的运行,NOB对高FA环境的耐受性不断提高的原因[15]。另外,在此阶段,FNA值已经低于其对NOB的抑制浓度,因此,FNA对NOB的抑制作用减轻,甚至消失。
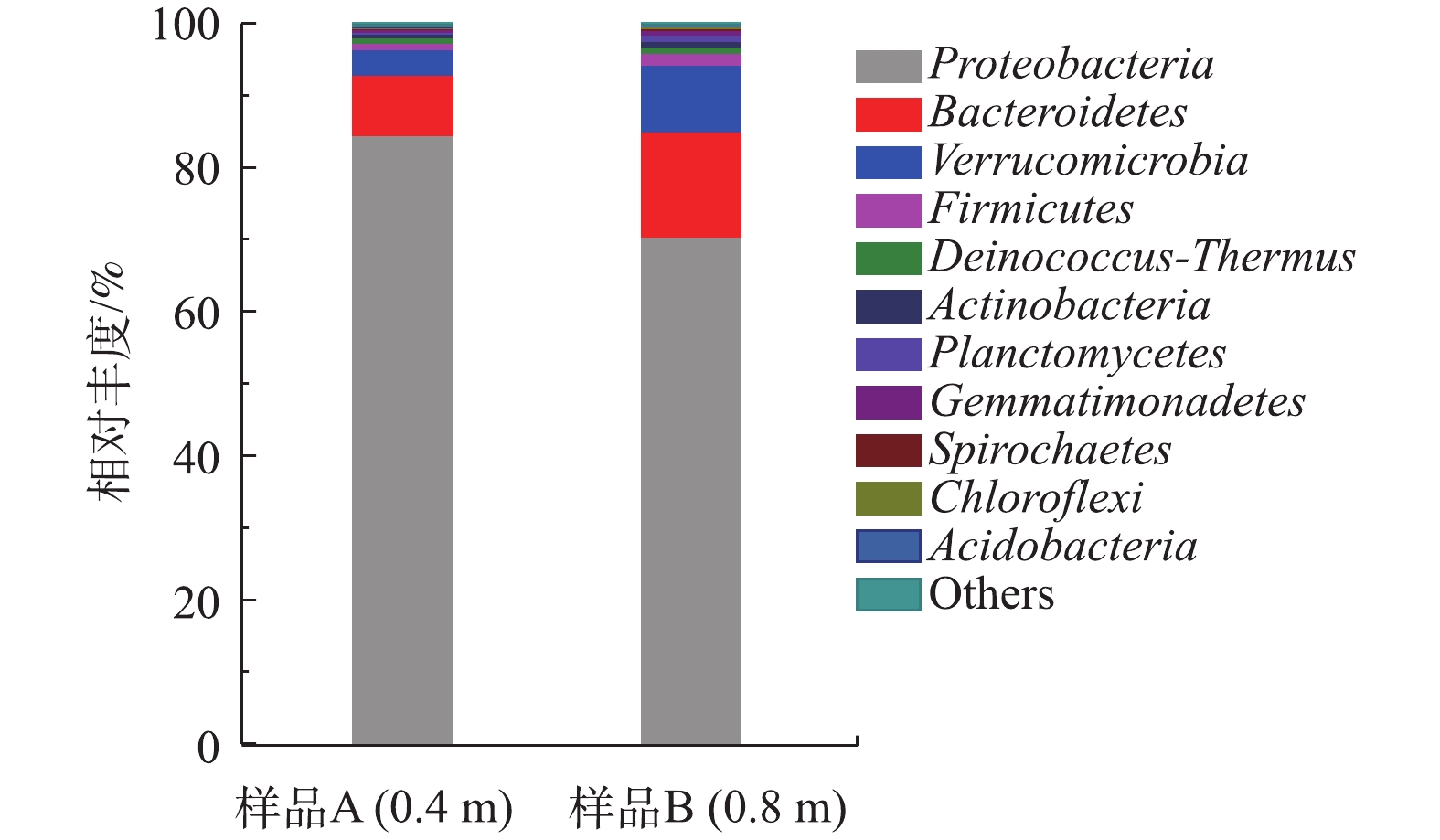
通过对BTF反应器内生物膜菌群结构进行分析,证明该反应器中确实存在短程硝化过程。实验结束后,对BTF反应器距顶部0.4 m(样品A)和0.8 m(样品B)高度处生物膜中的微生物菌群建立PCR扩增文库,对BTF中的菌群多样性进行分析。将样品A中的68 755条序列和样品B中的69 828条序列归类至22个门、38个纲、64个目、135个科和382个种。2个样品中占优势的前5个门均是Proteobacteria、Bacteroidetes、Verrucomicrobia、Firmicutes和Deinococcus-Thermus,在样品A中的相对丰度分别为84.5%、8.4%、3.5%、0.9%和0.8%,在样品B中的相对丰度分别为70.4%、14.6%、9.3%、1.6%和0.9%(图5)。样品A的Proteobacteria门细菌主要为Gammaproteobacteria纲,相对丰度为50.3%。而随着高度的降低,Proteobacteria门细菌由Gammaproteobacteria纲转变为Betaproteobacteria纲,为优势菌群(相对丰度为36.5%)。这种变化主要是由于Gammaproteobacteria纲中具有反硝化活性的Rhodanobacter sp.减少,而Betaproteobacteria纲中典型的AOB Nitrosomonas sp.的含量增加了10%。在2个样品中,典型的NOB Nitrobacter的含量仅为0.03%~0.05%,这就是BTF中亚硝酸积累的微生物学原因,主要氨转化细菌的相对丰度见表3。
Rhodanobacter sp.是一种革兰氏阴性菌,广泛存在于天然和人工环境中。有研究[16-17]表明,该菌种能够以有机物为电子受体还原硝酸盐。BTF中还存在Comamonas和Thermomonas等反硝化细菌,其丰度随反应器深度的增加而降低[18-19]。这些反硝化细菌能够在反应器中长期存在的原因是,它们可以在缺氧条件下,利用溶解性细胞产物为电子供体,进行硝酸盐的还原。另有一些细菌(如Pseudoxanthomonas和Chiayiivirga)的存在可以维持生物膜的稳定结构[20-21]。值得注意的是,Terrimicrobium这类发酵细菌也存在于BTF之中[22]。AOB、NOB、反硝化细菌、发酵细菌共生于BTF生物膜上,证明生物膜存在好氧区、缺氧区和厌氧区。O2限制区域的出现刚好有利于AOB的生长,抑制NOB的繁殖,这也是BTF反应器内亚硝酸积累的重要原因。
通常,污水处理过程中短程硝化实现的策略主要有以下几点:根据AOB和NOB对氧气的半饱和常数的不同,通过控制水中溶解氧在较低的范围内,从而抑制NOB的生长;控制水中pH和铵离子的浓度,利用NOB比AOB对FA和FNA敏感的特性,抑制NOB的生长;利用AOB和NOB在不同温度下生长速率的差异,在15 ℃以上调整污泥龄,即可将NOB洗出反应器,进而保留AOB,从而达到积累亚硝酸的目的[23]。本研究认为淋洗液中FA和FNA的浓度对亚硝酸的积累至关重要。在整个实验中,FA的浓度均高于其对NOB的抑制浓度,故短程硝化过程得以稳定维持(表2)。而在特定的条件下,如增加回流比和提高氨气负荷时,可能由于长期运行导致NOB对FA产生抗性,或者由于在阶段Ⅲ不回流的情况下,FNA浓度低于其对NOB的抑制浓度,2种作用共同引发了亚硝酸积累减弱的现象(表2)。此外,生物膜上O2限制也是短程硝化得以实现的原因之一。在BTF中,氨气随空气进入反应器,反应器内含有大量的O2。然而由于O2的气液传质过程主要受液膜控制,当淋洗速率较低时,O2气液传质较慢,生物膜上O2含量较低,则会在内部产生缺氧和厌氧区,反应器内出现反硝化细菌和发酵细菌便证明了这些区域的存在。故这种局部O2限制的现象成就了亚硝酸的积累。而O2传质过程如何控制BTF中的短程硝化,有待通过氧气总体积传质系数测定、生物膜上溶解氧分布测定等实验进行深入研究。
-
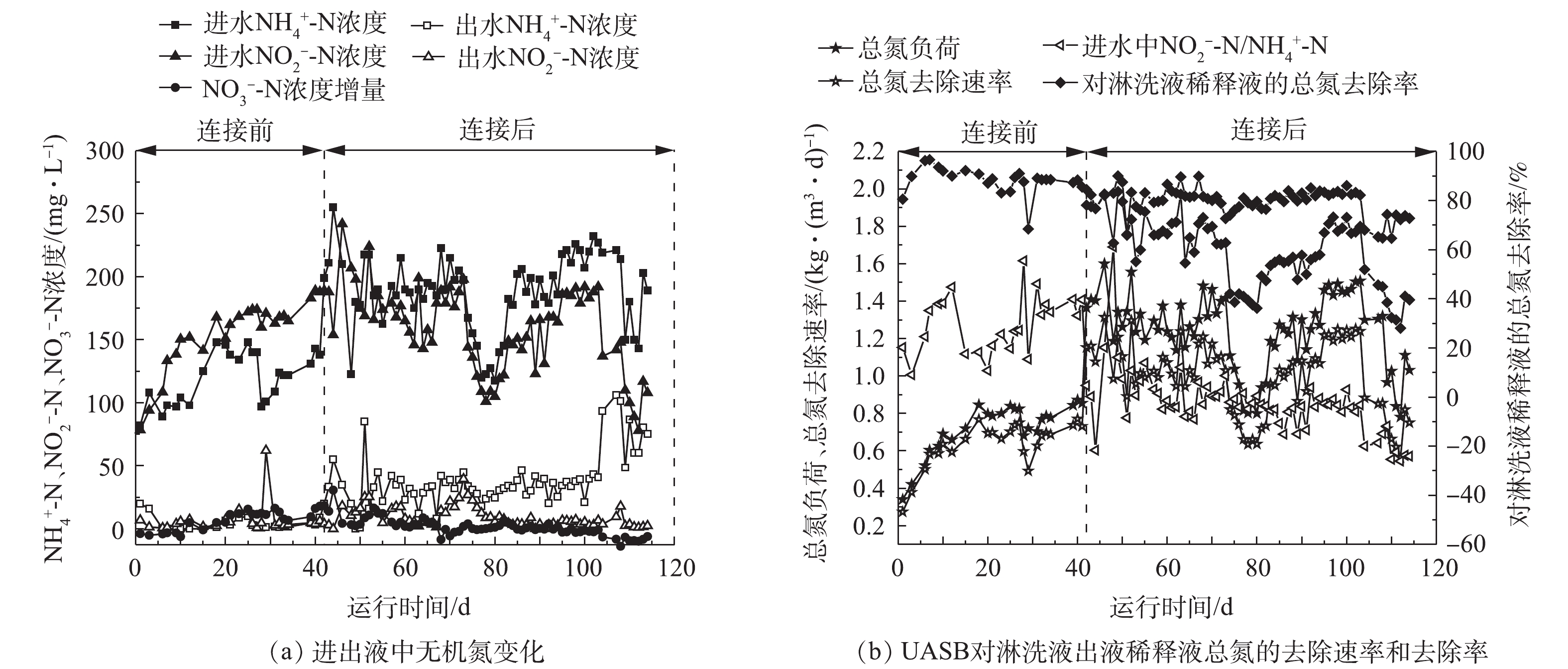
在厌氧氨氧化UASB反应器与BTF连接之前,首先独自运行41 d,以恢复细菌活性。在连接之前,厌氧氨氧化UASB反应器的总氮去除速率为1.25 kg·(m3·d)−1。在连接2个反应器时,BTF反应器处于阶段Ⅲ(99 d),处理的氨气浓度为0.14 mg·L−1,淋洗液无回流,出液中
NO−2 -N和NH+4 -N浓度均为210 mg·L−1,二者比例接近1。经适当稀释后,该淋洗液中NO−2 -N和NH+4 -N浓度为180~190 mg·L−1,其总氮负荷为1.26 kg·(m3·d)−1,满足连接条件。连接后,厌氧氨氧化UASB反应器表现出较好的氮素处理性能,对淋洗液稀释液的氨氮去除率为51%~100%,对淋洗液稀释液的亚硝氮去除率为80%~100%(图6(a))。厌氧氨氧化UASB反应器总氮负荷为0.78~1.60 kg·(m3·d)−1,总氮去除速率为0.56~1.31 kg·(m3·d)−1(图6(b))。由于对淋洗液出液稀释后,只有部分淋洗液出液通过后续厌氧氨氧化UASB进行了处理,因此,厌氧氨氧化UASB对BTF淋洗液出液中所有氮素的去除率为28%~84%。厌氧氨氧化UASB对淋洗液氮素去除率波动较大的原因在于:1)在实验后期,BTF淋洗液出液中NH+4 -N和NO−2 -N浓度远超过厌氧氨氧化反应器的处理能力(图2(a)),因此,须对淋洗液出液进行稀释,再进入厌氧氨氧化UASB反应器中,这样就导致处理的淋洗液出液量较少;2)稀释后,BTF淋洗液出液中NO−2 -N/NH+4 -N远小于1(0.5~0.7),导致NH+4 -N因电子受体不足在UASB出液中积累,最终使得氮素处理效果下降。淋洗液出液中
NO−2 -N/NH+4 -N的比值接近1是后续厌氧氨氧化工艺顺利进行的重要前提。显然,在保证短程硝化的前提下,只有提高氨的生物转化效率,才能提高NO−2 -N与NH+4 -N比值。在本研究中,通过增大BTF淋洗液的回流比,即可增加氨与生物膜的反应时间,故可提高氨的生物转化效率。在实验过程中,可明显观察到,在BTF的中下段,由于布水不均产生了淋洗液的短流和边壁现象,这也是氨生物转化较慢的另一原因。在实验室中,可在反应器内不同高度处分段布水,加强氨气的传质过程,以克服这些问题。最后,碱度与氨的比值也是保证淋洗液出液NO−2 -N与NH+4 -N比值维持在1的重要前提条件。短程硝化过程是一个耗碱过程。当碱度不足时,短程硝化进程则会停止。在采用短程硝化-厌氧氨氧化工艺处理废水时,一般需保证二者的比例接近1[23]。本研究并未对BTF淋洗液的碱度进行定量控制,而氨气不断向液相转移,很可能造成淋洗液中碱度缺乏,使得氨的生物转化过程受阻。短程硝化作为一种新型的生物脱氮途径,近年来在含氨废水处理中得到了大量的应用。本研究将BTF用于氨气吸收,并首次成功在低、高氨气负荷下均实现淋洗液的短程硝化。BAQUERIZO等[24]用BTF处理氨气时发现,当氨气负荷为0.16 kg·(m3·d)−1时,亚硝酸生物积累率仅为16%;当氨气负荷提高至0.64 kg·(m3·d)−1时,亚硝酸生物积累率为到56%。据此认为BTF淋洗液中亚硝酸积累与氨气负荷密切相关。而本研究在阶段Ⅱ中平均氨气负荷仅为0.26 kg·(m3·d)−1时,亚硝酸生物积累率仍高达87%,因此,认为亚硝酸积累与氨气负荷高低无直接关联,可通过控制回流比等操作条件予以实现。林兴等[25]采用短程硝化-厌氧氨氧化一体化上流式反应器处理含氨废气,其反应器运行方式为高浓度负荷(氨气浓度17.8~28.8 mg·L−1)、低空气流量负荷(气体停留时间1 h)。在氨气浓度达到17.8 mg·L−1时,通过通入额外空气的方式保证短程硝化的顺利进行,最高总氮去除速率为0.51 kg·(m3·d)−1。根据大部分含氨废气浓度为0.14~0.48 mg·L−1的特点,本研究采用低浓度负荷(氨气浓度为0.03~0.31 mg·L−1)、高流量负荷(空床时间为30 s)的方式运行反应器。在氨气浓度较低,淋洗液FA对AOB和NOB的抑制作用较难控制的情况下,实现了短程硝化过程,并利用后续厌氧氨氧化过程对淋洗液进行净化,达到淋洗液回流、总氮排放控制的目的。因此,本研究具有较强的工程应用意义。
2.1. BTF对氨淋洗液的短程硝化效果
2.2. UASB对BTF淋洗液的脱氮效果
-
1)当氨浓度为0.03~0.31 mg·L−1时,BTF中80%以上的氨被淋洗至液相,淋洗液中28%~84%的氮素通过后续厌氧氨氧化过程被去除。
2)在较低和较高的氨负荷(0.072~0.72 kg·(m3·d)−1)下,BTF中均可以实现短程硝化,淋洗液中FA和FNA对AOB和NOB的抑制以及O2限制是实现短程硝化的直接原因。
3)回流比1∶2是保证短程硝化BTF亚硝酸积累、氨吸收效果、氨生物转化效率的最佳回流比。






 下载:
下载: