-
海产品作为水生物资源,在解决人口激增、资源短缺与环境恶化等全球性问题中扮演着越来越重要的角色[1]。为保证海产品的品质,国内外对海产品暂养环境的处理手段大多通过物理方法进行调控[2]。但在高密度的暂养条件下,海产品代谢的加快与暂养池设计的不合理,大量泡沫与污染物堆积于水体,并积累大量硝酸盐与悬浮颗粒物,致使海产品暂养环境恶化[3-5]。当总悬浮颗粒物浓度在44 mg·L−1时,会降低暂养水的洁净度[6];水体中氮磷等营养盐的动态失衡则会危及水生态系统的平衡,破坏其物质循环与能量流动,加之暂养池过滤效果差、脱氮除磷效果不佳等问题[7-8],最终造成暂养水体水质恶化。与此同时,暂养水体携带大量污染物,一旦进入受纳水体则严重破坏水域生境[9-10],危害水域生态的健康及物种的多样性。
养殖水体氮、磷含量过高易引发水环境污染,诱发海产品疾病的蔓延[11-12]。目前,传统暂养水处理工艺逐渐被新型工艺取代,包括物理方法[13-14]、化学方法[15]和生物方法[16-17]。基于对海产品暂养水处理的更高的要求,驯化富集耐低温、嗜盐微生物菌种,并用于处理受纳水体,已逐渐成为当下水域生态和环境工程等领域的研究重点[18-20]。本研究通过构建低温条件下高盐微生物驯化系统,富集培养了低温耐盐菌种,分析了群落结构及物种多样性,并以玉米芯和玉米衣为碳源,探究了低温条件下暂养水处理与微生物驯化富集的耦合效应,可为低温菌种的筛选和水处理技术的拓展提供参考。
全文HTML
-
本研究选用的试剂为KNO3、(NH4)2SO4、KH2PO4、NaNO2、C6H12O6、NaHPO4、MgSO4·7H2O、K2HPO4、CaCO3、Na3C6H5O7·2H2O5,以上试剂均为分析纯,来自于国药化学试剂有限公司;硝化菌实验样品采自上海海洋大学海参循环水养殖系统;反硝化菌实验样品采自上海海洋大学滨海基地池塘养殖底泥;玉米芯、玉米衣取自上海市宝山区罗南镇罗南新村农田。
-
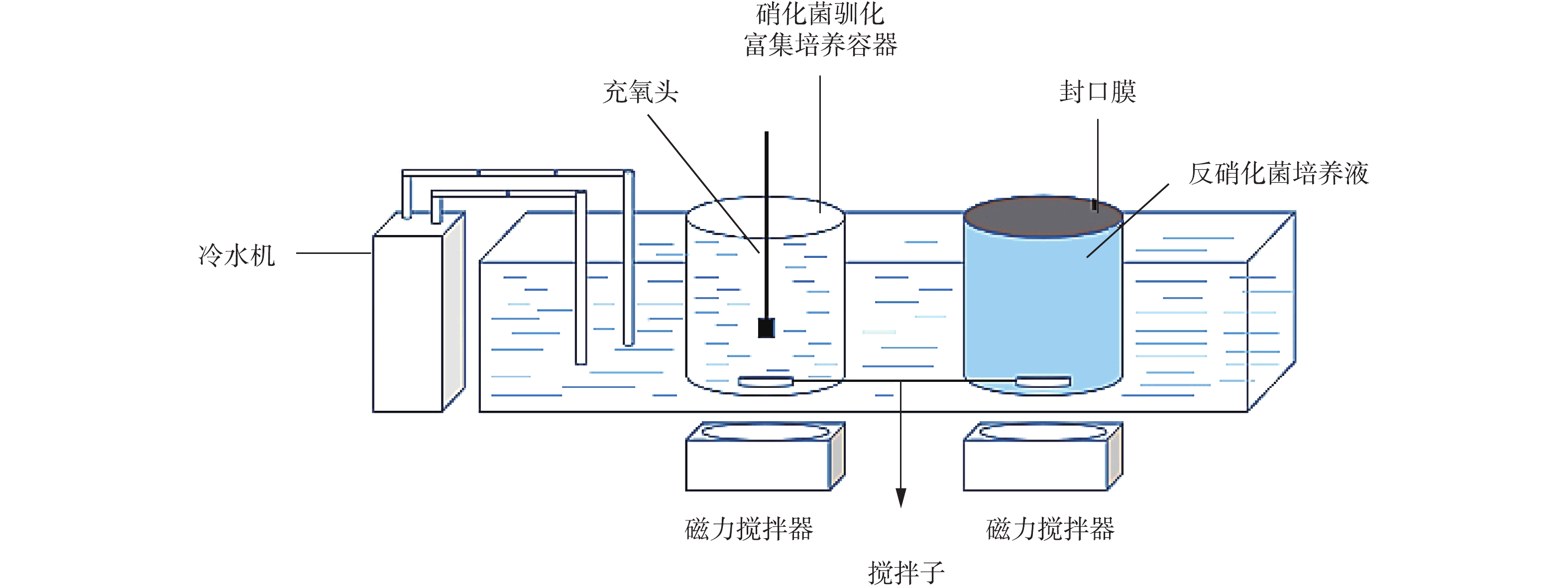
如图1所示,实验构建硝化反硝化菌培养容器,由冷水机、硝化菌驯化富集培养器、反硝化菌驯化富集培养器3部分组成,分别用以营造低温环境、驯化、富集培养耐低温、嗜盐菌种。玻璃容器有效容积为10 L,底部置有磁力搅拌器。
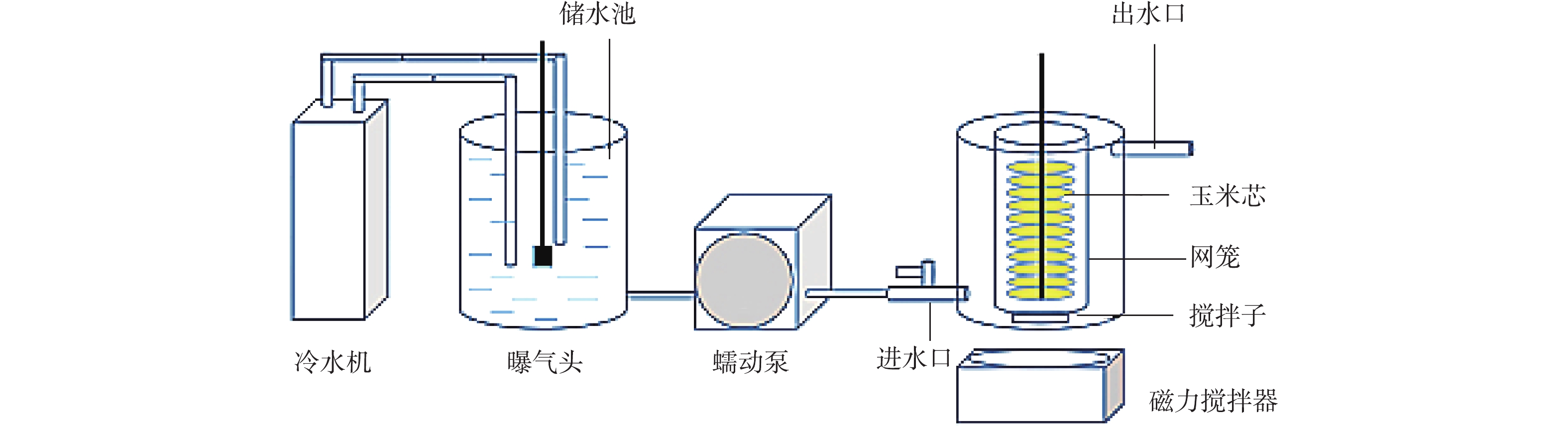
在微生物驯化富集后,设计构建脱氮除磷装置(如图2所示)。该装置由冷水机、储水池、蠕动泵与脱氮除磷反应器4部分组成。冷水机用以营造低温环境,储水池进水,将待处理水体经蠕动泵通入脱氮除磷反应器,反应器内置有经挂膜的玉米芯、玉米衣,对处理水体进行脱氮除磷。
-
将取自上海海洋大学海参循环水养殖系统的硝化菌实验样品与采自上海海洋大学滨海基地池塘养殖底泥的反硝化菌实验样品放置于4 ℃冰箱,保存备用。玉米芯、玉米衣加入去离子水,浸泡4 h,过滤清洗后,置于鼓风干燥箱中,于50 ℃下干燥12 h,取出置于干燥器中备用。
参考常规海产品循环暂养水水质指标,添加适量KNO3、(NH4)2SO4、KH2PO4配置实验用水,盐度2.7%~3%,水质指标保持pH为7.27±0.01,DO为(6.65±0.01) mg·L−1,TN为(41.62±0.11) mg·L−1,
NH+4 -N为(8.97±0.05) mg·L−1,NO−3 -N为(32.04±0.10) mg·L−1。实验采用10 L玻璃容器,加入培养液,硝化菌驯化培养基成分包含(NH4)2SO4、NaNO2;反硝化菌培养基成分包含KNO3、C6H12O6,NaHCO3调节pH至7~7.5,用NaCl调节盐度至(2.7±0.05)%,曝气并用磁力搅拌器进行搅拌,DO保持4 mg·L−1以上,15 ℃恒温培养60 d[21]。
将装置洗净灭菌后,取适量经驯化培养的反硝化菌液(KNO3 4.00 g·L−1、Na3C6H5O7·2H2O 6.00 g·L−1、NaHPO4 1.00 g·L−1、MnSO4·7H2O 0.04 g·L−1、K2HPO4 1.00 g·L−1)于10 L玻璃容器中,使用邵留等[22]的人工强化挂膜方式,将经洗涤和干燥的玉米芯、玉米衣、玉米芯+玉米衣3种载体形式分别置入反硝化菌液中,设置3组实验,充分浸泡3 d,保持容器的内部恒温15 ℃。将已经充分浸泡过反硝化菌的载体浸入富集培养好的硝化菌液((NH4)2SO4 2.00 g·L−1、MnSO4·4H2O 0.01 g·L−1、NaHPO4 0.25 g·L−1、MgSO4·7H2O 0.03 g·L−1、CaCO3 0.3 g·L−1、K2HPO4 0.75 g·L−1)中,经磁力搅拌器搅拌直至挂膜完成。使用NaHCO3溶液调节pH至7~7.5,富集培养60 d,保持15 ℃恒温进行富集培养,保证其增殖。
-
高通量测序分析方法:取载体表层切片,经EYELA东京理化冷冻干燥机(FDU-1200型 东京理化器械株式会社)低温处理,硝化菌液采用细菌通用引物,上游引物为5'-CARTGYCAYGTBGARTA-3',下游引物HQd5'-TWNGGCATRTGRCARTC-3';反硝化菌液采用nrfA引物,上游引物为5'-CARTGYCAYGTBGARTA-3',下游引物为5'-TWNGGCATRTGRCARTC-3';最后经16S rRNA基因文库测序分析微生物群落结构、丰度及其多样性[23]。高通量测序服务由上海派森诺生物科技股份有限公司提供(上海,中国)。
常规水质指标测定:采用国家水质标准[24],对TN、
NH+4 -N、NO−2 -N、NO−3 -N、DO、pH进行测定。
1.1. 实验试剂
1.2. 实验装置
1.3. 实验方法
1.4. 分析方法
-
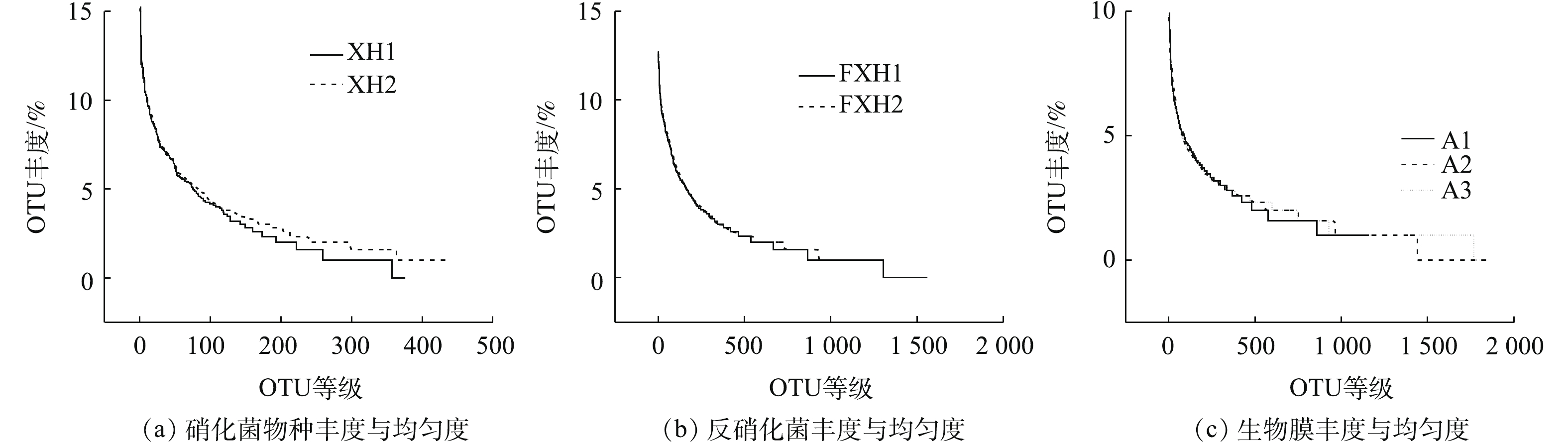
1)群落结构(丰度)。使用Rank-Abundance曲线检测载体表层微生物物种丰富和均匀度[25],如图3所示,A1、A2、A3分别代表实验初期(15 d)、中期(30 d)、末期(45 d)载体表层生物膜,XH1和XH2表示硝化菌物种丰度和均匀度;FXH1和FXH2表示反硝化菌物种丰度和均匀度。由图3可知,载体表层微生物的丰度大小序列为FXH1、FXH2>A2>A3>A1>XH1、XH2,载体所附着的反硝化菌的丰度高于硝化菌。但从均匀度方面来看,富集培养的硝化菌均匀度优于反硝化菌,这说明硝化菌种群的个体数目的分配状况对于反硝化菌来说相对合理;在载体均匀度方面,由A3>A2>A1的趋势可知,在低温、高盐条件下,反硝化菌富集培养效果比硝化菌富集培养效果更佳。
装置运行期间,A2阶段(中期30 d)相较于A1阶段(初期15 d)和A3阶段(末期45 d),载体所附着的微生物膜的丰度状态处在较高的水平,表明装置在A2阶段(中期30 d)运行良好,且生物对于环境的适应性也在增强;A1阶段(初期15 d)处于装置运行的初始阶段,丰度处在较低的水平,其主要原因是:载体上的微生物菌群处于一个适应阶段,增长速度相对较慢,且对于低温高盐水体的实际适用性也需要一定周期来提升[26],同时,该结果与JESSICA等[27]所得的丰度趋势相近;A3阶段(末期45 d)处在装置运行后期,其生物膜的丰度、均匀度从整体上略低于A2阶段(中期30 d),这是由于在一个运行周期内,载体上的微生物随时间的延长,丰度开始降低,于较低的水平处于平衡态,这与崔丙健等[28]对微生物菌落的解析结果相吻合。以上结果说明:本装置在微生物的驯化富集培养过程中具有较好的效果,并能够为其提供较好的好氧厌氧环境,从而达到成功驯化并富集的目的。
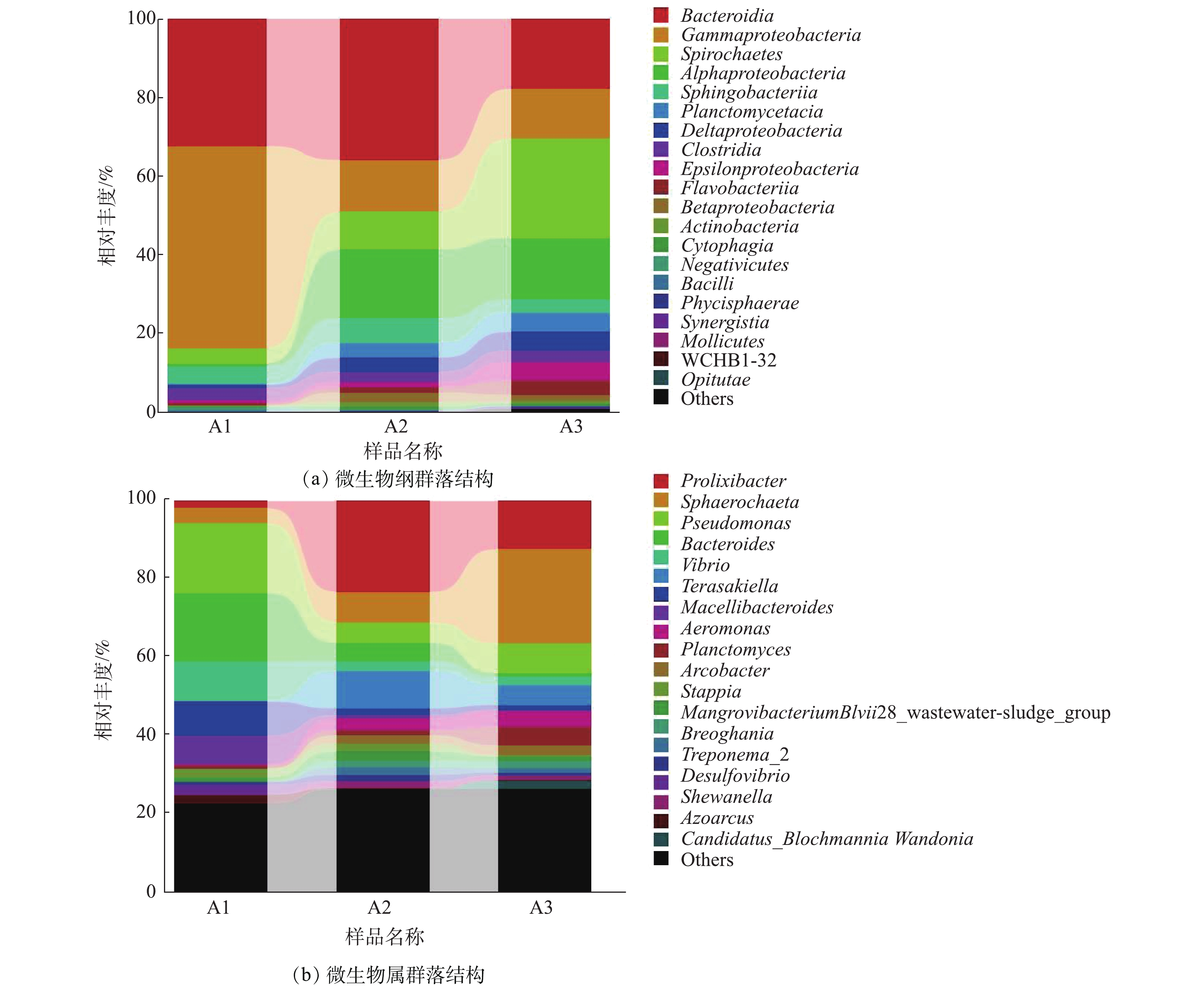
2)微生物多样性。图4为微生物纲水平和属水平群落结构,其优势菌种主要以α-变形杆菌纲(Alphaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、拟杆菌纲(Bacteroidia)、螺旋体纲(Spirochaete)、鞘脂杆菌纲(Sphingobacteriia)为主。A1表示实验初期载体表层生物膜的微生物数量占比,研究发现,微生物主要以拟杆菌纲(Bacteroidia)、γ-变形菌纲(Gammaproteobacteria)为主,该阶段是微生物的自身因子对低温高盐环境的调控期间,周海红等[29]的研究也证实了拟杆菌纲(Bacteroidia)与γ-变形菌纲(Gammaproteobacteria)生长的适应性与稳定性。装置运行进入中后期,载体的相对丰度产生了明显的变化:从前期的拟杆菌纲(Bacteroidia)、γ-变形菌纲(Gammaproteobacteria)2大优势菌种更替为以拟杆菌纲(Bacteroidia)、γ-变形菌纲(Gammaproteobacteria)、螺旋体纲(Spirochaetes)、α-变形杆菌纲(Alphaproteobacteria)为主的5大优势菌种;整个实验期间,检测出主要的属有7种,实验中期(A2)和后期(A3)的样品主要属的种类数量占比同实验前期有显著差异,载体表层所附着的菌群结构随着低温高盐水体的输入,优势菌门转变为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、螺旋菌门(Spirochaetae)、浮霉菌门(Planctomycetes)。这些菌可从多种生境中分离获得,如海洋、超盐环境、碱性或酸性环境等,且具有很强的污水脱氮能力[30]。装置运行期间,3个样品中变形菌门的比例有所下降,从初始运行阶段的53.61%下降至10.55%,研究到后期仅有8.69%;假单胞菌属(Pseudomonas)作为反硝化菌的主要部分,其占比略高于其他菌属,与本实验前中期
NO−3 -N去除率略高于NH+4 -N与TN的去除率变化趋势相一致。 -
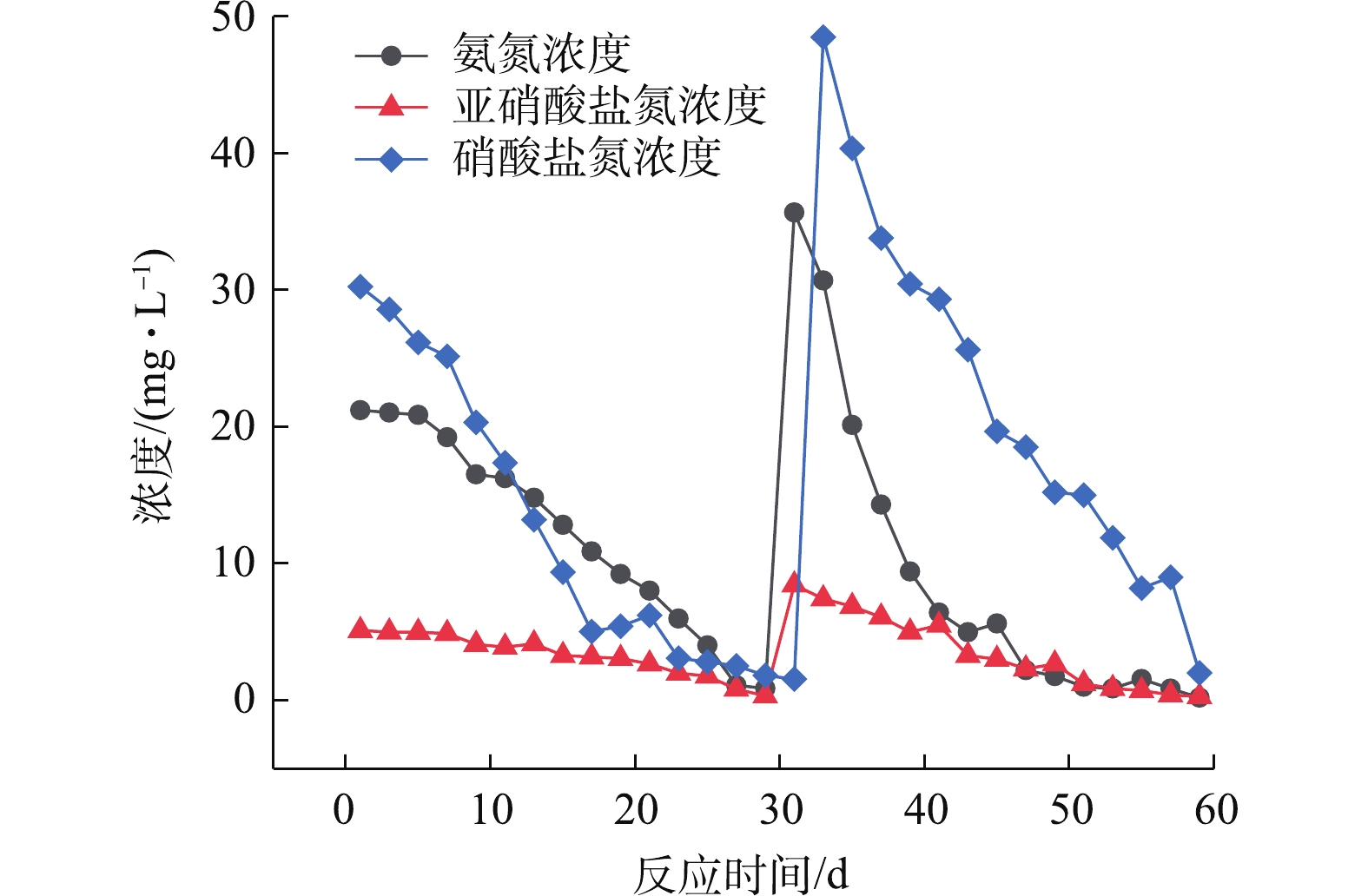
微生物经驯化培养,其数量级达到可投入使用的程度,再对其进行富集培养处理。图5反映了硝化菌在60 d内的培养中
NH+4 -N、NO−2 -N、NO−3 -N的变化情况。在硝化菌驯化培养的1~5 d,NH+4 -N与NO−2 -N浓度变化不大,波动较小,表明硝化菌对新环境适应不足,这与周海红等[29]的研究以及上文的纲水平、属水平变化情况相符。而NO−3 -N从第1天开始,呈现缓慢下降的趋势,第4天开始,曲线开始迅速下降,而后趋于动态的稳定趋势,表明反硝化菌在富集的同时消耗了大量的C6H12O6,并对NO−3 -N进行处理,致使NO−3 -N含量降低;在6~29 d,NH+4 -N的浓度开始降低,且下降加快,从初始的19.23 mg·L−1下降到0.8 mg·L−1,平均每天下降0.67 mg·L−1。NO−2 -N在实验前期也存在较长的缓冲时间,NO−3 -N在这个周期内的浓度降至1.01 mg·L−1,平均每天下降1.79 mg·L−1,在初始的30 d内,NO−2 -N的浓度从5.12 mg·L−1降至0.34 mg·L−1,平均每日降低0.31 mg·L−1。在第2个运行周期(31~60 d)内,硝化菌的活性随着环境的适应得到提升。第30天,加入适量(NH4)2SO4、NaNO2,使
NH+4 -N浓度提升至35.65 mg·L−1,NO−2 -N浓度达到8.45 mg·L−1。第31天,在反硝化菌培养液之中加入适量的KNO3、C6H12O6,提高培养液的NO−3 -N浓度至48.46 mg·L−1;在16~30 d,NO−3 -N浓度下降的速率加快,约为第1周期的2倍;在31~60 d,硝化菌驯化培养液,NH+4 -N的浓度总体呈现下降而速率增加的趋势,后趋于平稳。同第1运行周期(1~30 d)相比,第2运行周期NH+4 -N浓度下降的速率比第1运行周期增加近1倍,平均每天下降1.22 mg·L−1;NO−2 -N的浓度下降速率较第1个运行周期更快,平均每日下降浓度0.54 mg·L−1。在第1个运行周期内,由于对运行环境的适应性与对硝化菌生态因子调控的不足,使前期的
NH+4 -N与NO−2 -N去除效果不明显;在第2运行周期内,硝化菌的生态因子以及其耐受范围对于环境发生了适应性的变化,摄取了丰富的营养物质,加速了生长代谢,培养液中的NH+4 -N与NO−2 -N的消除速率也随之变快;反硝化菌在繁殖的同时,对环境适应速度要优于硝化菌,且在第2周期的期末,NO−3 -N的浓度降低至2.01 mg·L−1,平均每天下降3.32 mg·L−1。结果表明,微生物驯化富集培养情况较为良好,与孟璇等[31]对微生物驯化富集的结果趋近,且要优于其近1个百分点。 -
微生物驯化富集培养后,按照图2的实验步骤,将硝化反硝化菌、玉米芯异构载体投入使用,并运行装置。玉米芯和玉米衣作为缓释碳源与载体,易于微生物的附着,应用于水处理领域可间接增大与水体接触面积,为微生物提供碳源,促进微生物的增殖,提高净化效率[32]。
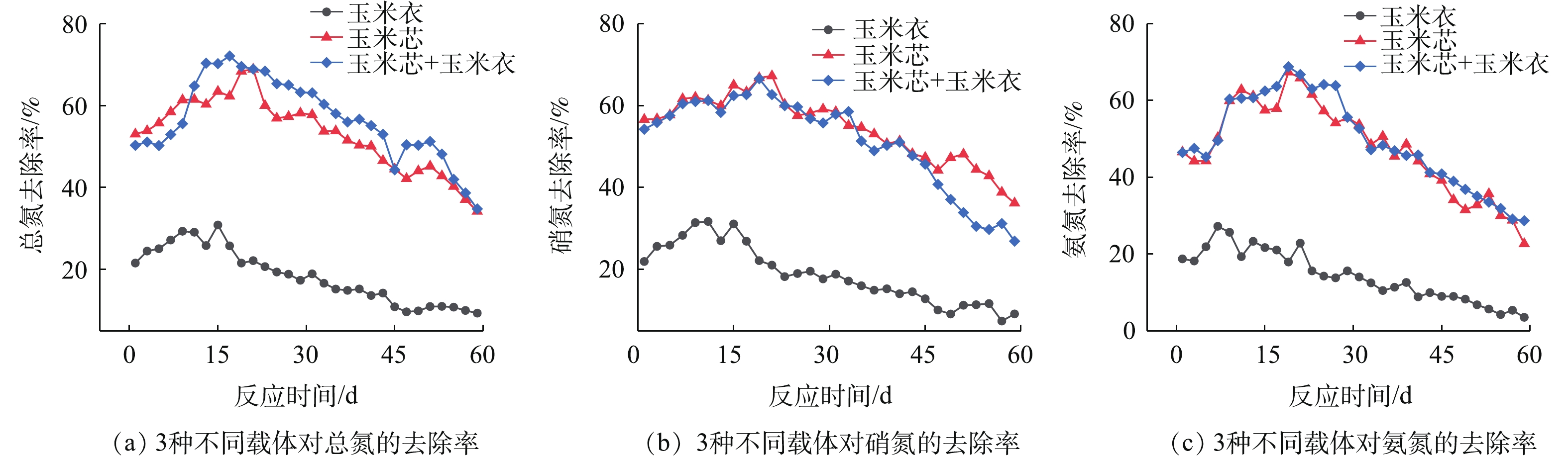
在装置中置入玉米芯柱、玉米衣柱、玉米芯+玉米衣的组合(以下简称芯衣)3种不同组合的碳源载体来改变其来源与脱氮效果。在微生物脱氮运行时,玉米芯、玉米衣的碳源含量直接影响脱氮效率[33-34]。装置通过改变载体的方式来对低温海水暂养水进行处理。纵观3种碳源组合的处理效果可以发现,玉米芯对脱氮具有促进的效果。由图6(a)可以看出,从初始阶段,玉米芯与芯衣对TN的去除具有良好效果,在17 d和21 d均达到最大值,分别为72.09%和68.88%。而玉米衣对TN的处理则处于一个较低的水平,维持在20%~30%,最高值为30.84%;由图6(b)可以看出,前期与TN的处理效果较为接近,玉米芯和芯衣的
NO−3 -N去除率最高可达66.56%和67.24%,而玉米衣对NO−3 -N的去除率也存在一个较低的水平,并在该低水平范围内波动,其最高值出现在17 d,为31.71%;由图6(c)可以看出,与TN、NO−3 -N的去除率相似,其最高值分别为68.76%(玉米芯)、67.38%(芯衣)和27.23%(玉米衣)。玉米芯自身构造特殊,其内外层分别形成厌氧/缺氧与好氧层,微生物附着后能够促进脱氮。本实验中,玉米芯表层附着的硝化菌消耗大量DO,致使玉米芯内部呈缺/厌氧环境,有利于反硝化菌的生长与繁殖;作为固相碳源,在水体中碳源含量较低时,玉米芯亦可作为固相碳源,释放一定量有机碳,促进脱氮的进一步运行。装置运行期间,总氮、硝氮与氨氮去除率分别达到(63.46±0.55)%、(65±0.63)%、(62.79±0.52)%。陈佼等[35]在利用玉米芯构造脱氮系统中,将TN与
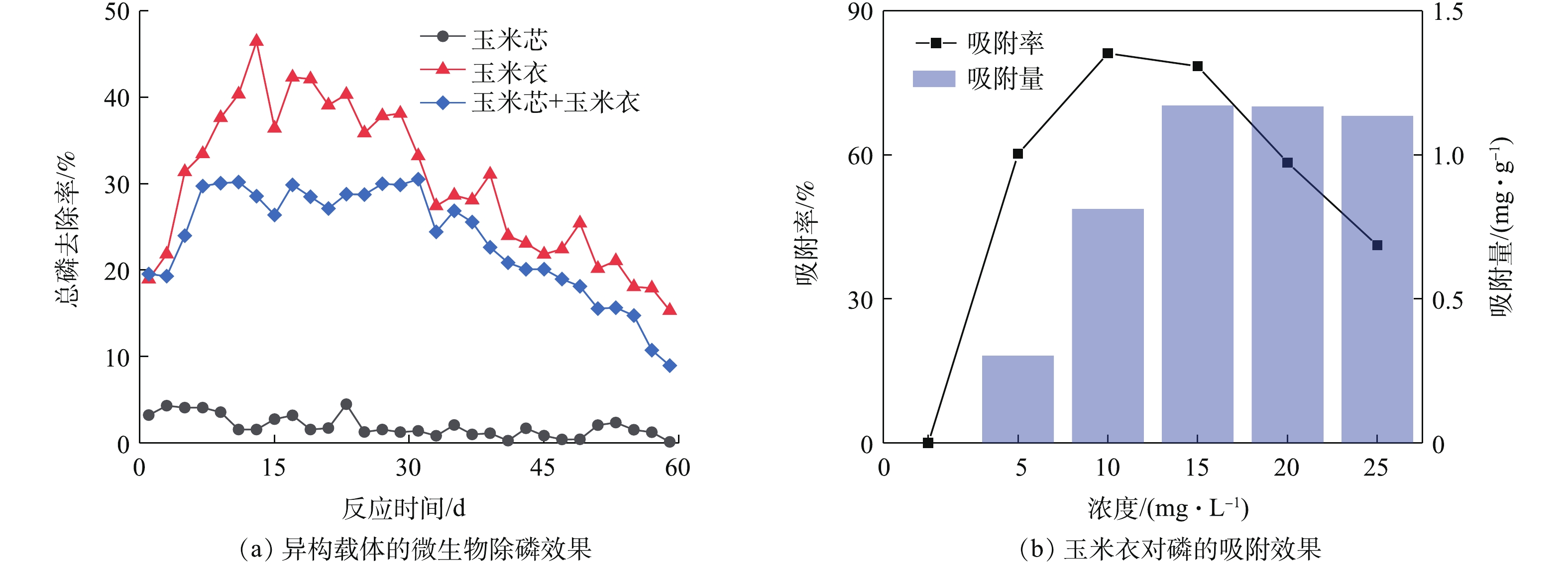
NO−3 -N的去除率提升较高,表明玉米芯作为碳源与载体的优越性,但其缺乏对NH+4 -N的去除率。在脱氮基础上,研究了不同碳源条件下微生物对磷元素去除效果。经60 d的周期实验,除磷效果如图7所示。对比玉米芯、玉米衣、芯衣的除磷效果,玉米芯的除磷效果较差,最高仅达到4.49%,但玉米衣对除磷具有显著效果,高于芯衣,两者去除率分别为46.45%和30.51%,说明玉米衣虽然脱氮效果不佳,但对磷元素的吸附和去除具有明显效果。针对玉米衣能够较好地去除磷元素这个特点,采用不同浓度的TP对其进行数据测定,磷元素吸附效果如图7所示。
随TP浓度的增加,玉米衣对磷的吸附量呈先上升后缓降的趋势。当TP浓度达到10 mg·L−1时,玉米衣的吸附率达到最高值,为81.14%,但此时的吸附量仅为0.813 mg·g−1;当TP浓度达到15 mg·L−1时,玉米衣的吸附量达到最高,为1.172 mg·g−1,吸附率为78.45 %,吸附率开始呈下降的态势,此时的吸附量趋于稳定。有研究[36]表明,在有限的玉米衣的量的情况下,其吸附量也有一个阈值,由实验结果看出,TP初始浓度为10 mg·L−1和15 mg·L−1时,玉米衣所呈现的效果较好,与唐婧等[37]所研究的磷吸附性能相吻合, 达到80%以上。
在对磷的去除方面,玉米芯作为载体的实验组则表现出乏力的态势,玉米衣的除磷效果显著高于芯衣,去除率分别为46.45%和30.51%。实验表明,玉米芯对脱氮存在较好的效果,玉米衣则对磷元素具有很好的去除效果,但囿于规模限制,结合实际微生物水处理性能,兼顾脱氮除磷除沫、载体材料回收利用及用量优化配比还有待研究。目前,用农业废弃物制备吸附剂是较热门的方向[36,38-39]。
在进行水处理的同时,水体中也会产生较多颗粒物,包括残饵、粪便、鱼体黏液和老化的生物絮体等,通常粒径分布在3~300 μm,而其中95%以上的颗粒物粒径小于20 μm,占颗粒物总质量的47%以上。养殖水中细微颗粒物在过滤时,气泡的细化和水力停留时间的增加对颗粒物去除率有显著影响,特别是对粒径>50 μm的颗粒物。由表1可知,在水力停留时间为1.7 min时,生物膜过滤对粒径为50~90 μm的颗粒物去除率相对较高,整个装置循环除沫率最高可达(82.14±0.23)%。
2.1. 微生物群落结构与多样性分析
2.2. 微生物驯化富集培养与无机氮浓度变化关系
2.3. 同属异构碳源条件下作用效果研究
-
1)微生物经富集培养后,利用高通量测序,发现其丰度、均匀度都有所提高。其中反硝化菌的多样性提升要优于硝化菌,且变形菌门(Proteobacteria)在适应、驯化、富集之中分别占硝化菌96.40%、反硝化菌91.30%的丰度水平。
2)变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、螺旋菌门(Spirochaetae)、浮霉菌门(Planctomycetes)等此类污水脱氮菌,在低温高盐条件下,具有较好的繁育与增殖能力,且微生物繁育程度越好,对有机物的降解速率越高。
3)微生物以玉米芯、玉米衣为载体和碳源,对TN去除率可达72.09%,并在此基础上,对除磷手段进行了拓展:玉米芯和玉米衣协同除磷,其去除率可达46.45%,为低温高盐暂养水处理提供了数据支撑。
4)本实验运用新型吸附剂材料玉米芯和玉米衣进行系统地脱氮除磷,为农用废弃物合理回收与再利用提供新的途径。



 下载:
下载: