-
活性污泥法因其除污效果好、投资低、操作方便等优点而被广泛应用于废水处理中[1],但其存在污泥结构布局松散、沉降能力差及易产生污泥膨胀等问题,给工程的维护与管理带来诸多困难[2],导致处理后废水TN和TP等指标达不到国家规定的最新排放标准。随着对污水处理工艺的不断探索和改进,污水处理中磁生物效应的应用越来越广泛[3-5],通常途径就是往活性污泥中投加一定量的微米级或纳米级的Fe3O4磁粉。磁粉与活性污泥混合接触后, 会对系统产生2个方面的影响:一方面,污泥絮体结构得到了有效的改善,系统能达到较好的泥水分离效果;另一方面,污泥中微生物受到磁粉的磁生物效应,其除污效率和抗高负荷的能力均得到了提升,污泥膨胀得到改善,污泥浓度也有一定的升高, 从而增大了单元容积的处理效能[6-9]。尽管Fe3O4在活性污泥系统方面的应用已取得较大的成功,但若将未加修饰的Fe3O4投加到活性污泥系统中,其在液相中的不稳定性和较差的分散性[10]会影响磁粉与污泥的充分混合。而SiO2化学性质比较稳定,具有良好的生物相容性和亲水性;同时,SiO2可以屏蔽粒子之间的偶极相互作用,阻止粒子团聚,具有较好的分散性[11-14]。在磁性颗粒表面包裹一层SiO2是磁性颗粒功能化修饰比较常见的方法,其包覆作用可以有效减少Fe3O4磁粉的裸露,防止其在水溶液中的团聚,并保持良好的磁性,以便回收再利用。因此,本研究从磁性材料强化活性污泥角度入手,在活性污泥系统中分别投加Fe3O4和Fe3O4@SiO2,考察其对活性污泥系统的影响效果,并进行典型周期内的脱氮除磷动力学探究,以验证Fe3O4@SiO2是否对污泥系统有强化作用;探讨Fe3O4@SiO2对污泥颗粒化进程的影响及其脱氮除磷机制,研究结果可对该技术的实际工程应用提供参考。
-
首先,采用化学共沉淀法制备Fe3O4纳米球[15],然后将制备的Fe3O4粉末稀释于蒸馏水、加入无水乙醇和浓氨水的混合液,在恒温水槽中经超声振动溶解后,向其中缓慢滴加一定量TEOS(正硅酸乙酯)并继续磁力搅拌12 h,磁铁分离,用无水乙醇洗涤3次,干燥并烘干,得出样品Fe3O4@SiO2。
-
本实验设置3个相同的序批式活性污泥反应器(SBR)(图1),分别接种相同量的活性污泥。其中,未投加任何磁性材料的为1号反应器,作为对照组,分别投加0.5 g·L−1 Fe3O4和Fe3O4@SiO2的为2号和3号反应器。接种污泥取自双流县西航港污水处理厂曝气池,接种量约为反应器有效容积的50%,启动时,污泥混合液悬浮固体浓度(MLSS)为4 279 mg·L−1,污泥体积指数(SVI)为202.15 mL·g−1。反应器每天运行2个周期,每个周期运行12 h,包括进水0.5 h,曝气10 h,沉淀(根据运行时间逐步缩短),排水0.5 h,静置(剩余时间)。反应器均置于(30±1) ℃恒温水浴锅中,曝气量为300 mL·min−1(溶解氧DO约为4.0 mg·L−1),污泥龄SRT约为15 d。
-
实验进水为人工配制的模拟生活污水,葡萄糖,柠檬酸三钠作为碳源,硫酸铵作为氮源,KH2PO4为磷源,NaHCO3提供碱度,FeCl3、CuCl2等提供微量元素,主要实验进水指标如下:化学需氧量(COD)值为483.73~510.23 mg·L−1,氨氮(
NH+4 -N)浓度为37.57~46.70 mg·L−1,总氮(TN)浓度为43.39~50.28 mg·L−1,总磷(TP)浓度为3.42~3.91 mg·L−1,pH保持在6.9~7.2。 -
水质指标COD、TN、TP、
NH+4 -N、NO−3 -N、NO−2 -N以及主要的污泥指标MLSS、SVI等的测定均采用国家标准方法[16],EPS的提取采用甲醛-氢氧化钠法[17],多糖(PS)含量的测定采用蒽酮-硫酸法[18],蛋白质(PN)含量的测定采用Folin-酚法[19]。用数码相机记录污泥外观,用光学显微镜观察并拍照保存污泥微观形态。 -
在反应器运行进程中,用数码显微镜对各个反应系统中污泥的形态进行观察,其结果如图2所示。反应器进行第20天时,在1号反应器内,虽可观察到较紧实的污泥絮状结构,但无明显颗粒化污泥形成;在2号反应器内,可以看到有少部分的颗粒污泥的形成,但空间分布不均匀,这是因为Fe3O4磁粉对污泥虽有一定的吸附作用,但粒子间的磁性作用使得粒子间极易发生团聚,减少了Fe3O4和污泥之间的接触,降低了污泥颗粒化程度;而在3号反应器内,污泥颗粒化现象开始明显,其污泥结构完整,饱满密实,肉眼可明显观察到颗粒污泥,粒径集中分布在0.3~1.0 mm。由此可见,经SiO2包覆后的Fe3O4磁性硅球(Fe3O4@SiO2)拥有良好的分散性和稳定性,便于与污泥的充分接触,同时,Fe3O4@SiO2较高的表面能和较大的比表面积对污泥有强大的吸附作用,改变了活性污泥原来的松散结构,从而提高了污泥颗粒化进程。
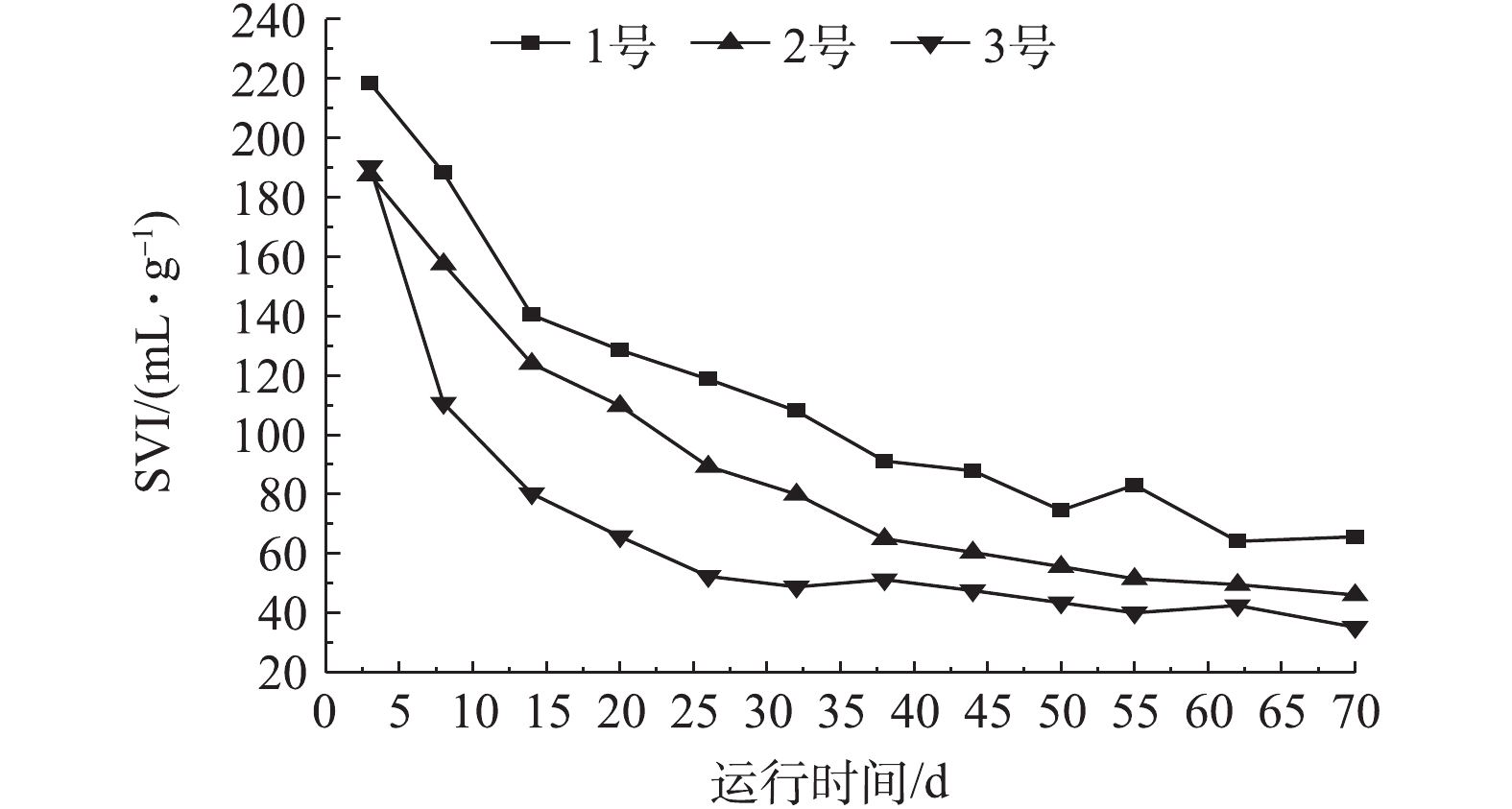
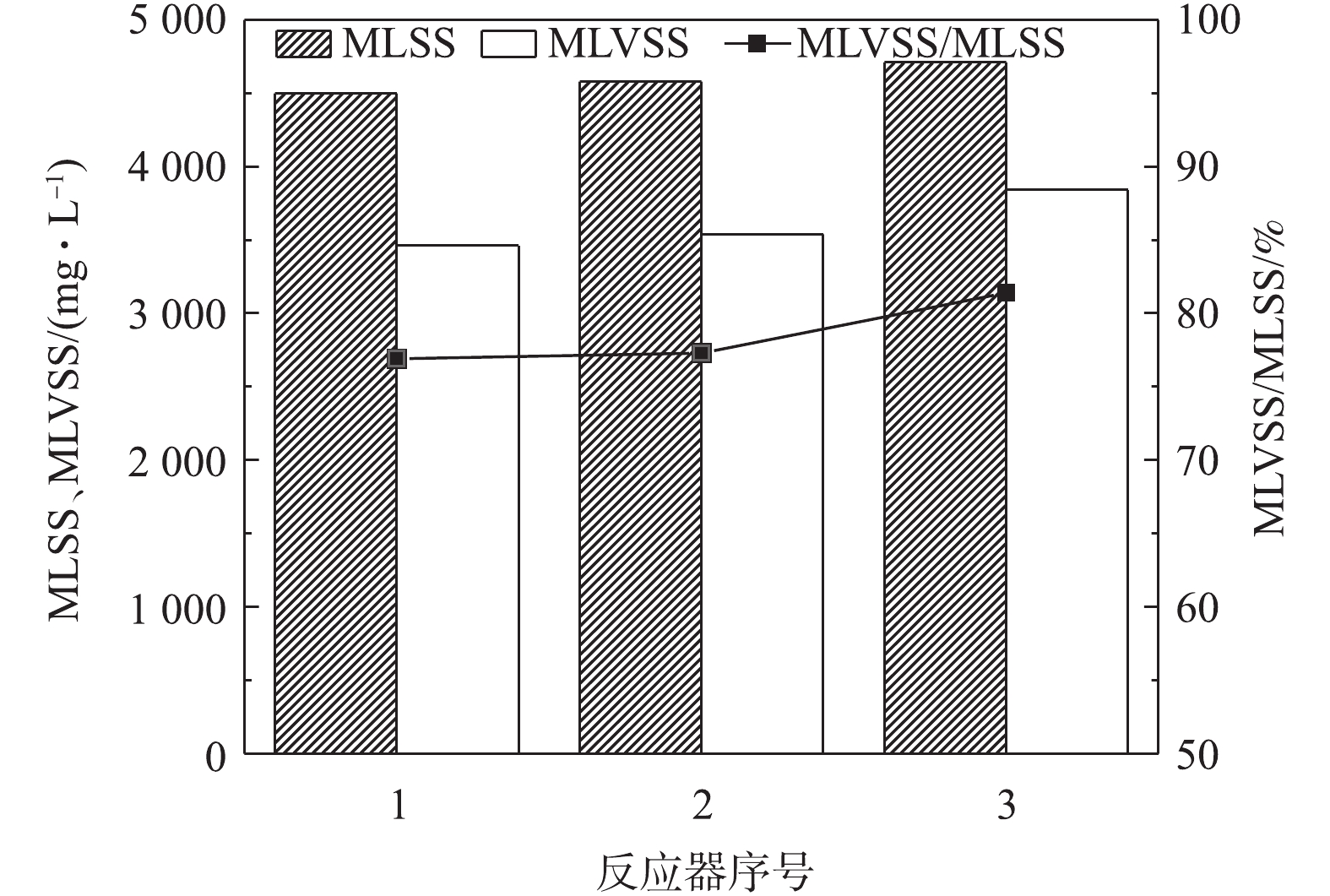
污泥体积指数(SVI)是判断污泥沉降性能的重要指标,其数值越低,说明反应系统污泥沉降性能越好,泥水分离效果越好。由图3可知,3个反应器内的污泥SVI在反应初期均在200 mL·g−1左右,随着反应器的运行,接种污泥不断适应环境,其沉降性能均有所改善。当各反应器运行到第40天后,1号反应器的SVI平均值较其他2个反应器较大,这说明在2号和3号反应器中所投加的磁性材料可以降低污泥SVI,改善其沉降性能。其原因在于投加的磁性材料粒径较小,比表面积较大,极易与菌胶团相结合,增大了污泥絮体的比重,使污泥絮体结构紧密,提高了污泥的沉降性能,缩短了泥水分离时间[7]。在反应器稳定运行末期(70 d),2号和3号反应器的SVI分别为46.10 mL·g−1和35.22 mL·g−1,均明显低于1号反应器(65.68 mL·g−1)。同时,2号反应器污泥SVI略高于3号,其原因在于单独Fe3O4磁粉粒子之间存在磁性吸引力和范德华力,粒子间易于团聚,减少了与污泥的接触,对污泥吸附不完全,致使其沉降性能略低于3号反应器。由此可见,SiO2的包覆提高了Fe3O4磁粉的分散性,改善了污泥的沉降性能。图4为各反应器在第70天时系统中污泥浓度的变化结果。1号反应器中的MLVSS和MLSS分别为3 460 mg·L−1和4 500 mg·L−1,MLVSS/MLSS为76.91%;2号反应器中的MLVSS、MLSS分别可达3 540 mg·L−1和4 580 mg·L−1,MLVSS/MLSS为77.29%;3号反应器MLVSS升至3 840 mg·L−1,MLSS升至4 710 mg·L−1,MLVSS/MLSS变为81.41%。由图3可以明显看出,在投加Fe3O4@SiO2后,对MLVSS、MLSS有不同程度的促进作用,相比之下,Fe3O4的影响较小,Fe3O4@SiO2的影响比较明显,3号反应器系统中有机成分含量比例提高最大,分别比1号和2号提高了4.12%,提高了系统中生物量,这在一定程度上反映了系统生物活性的提高。
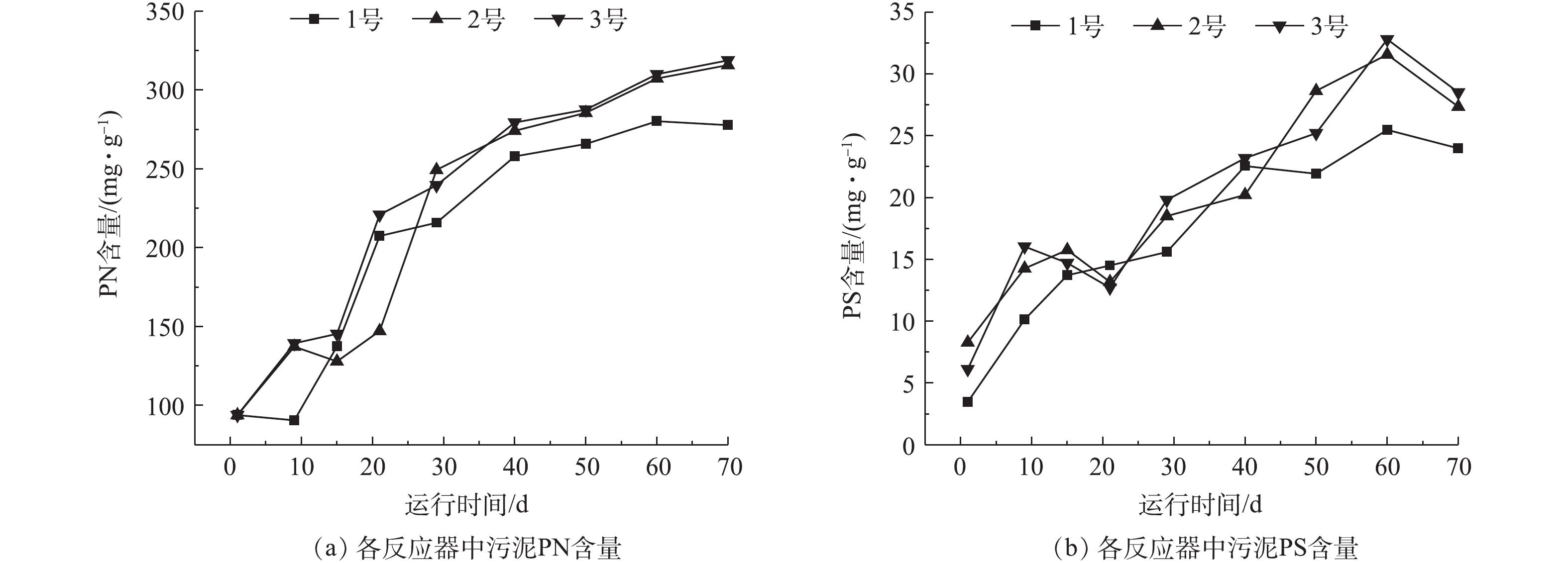
胞外聚合物(EPS)是微生物在新陈代谢过程中分泌的高分子有机物,主要包括胞外蛋白质(PN)和胞外多糖(PS),二者的比例对颗粒污泥的形态构成及稳定运行起重要作用。在本研究中,各反应器内污泥EPS中PN、PS含量的变化情况如图5所示。接种污泥的PN含量为93.87 mg·g−1,随着反应时间的进行,各反应器内的PN均呈逐渐升高的趋势。反应器运行的第55天,1号、2号、3号反应器的污泥PN含量分别为277.82、315.87、318.89 mg·g−1 (图5(a))。同时,各反应器内污泥的PS也呈逐步升高的趋势,但相对于PN,其相对含量较低,第70天时,各反应器内PS分别为23.98、27.35、28.51 mg·g−1 (图5(b))。一般来讲,污泥PN含量越多,其微生物细胞疏水性就越明显,从而有利于污泥的凝聚,PN的疏水特性和PS的卷扫作用均为颗粒污泥的稳定性起的促进作用,从而确保了良好的除污性能。本实验中投加的Fe3O4和Fe3O4@SiO2对活性污泥的PN和PS含量均有不同程度的促进作用,这与董青等[20]的研究结果一致。
-
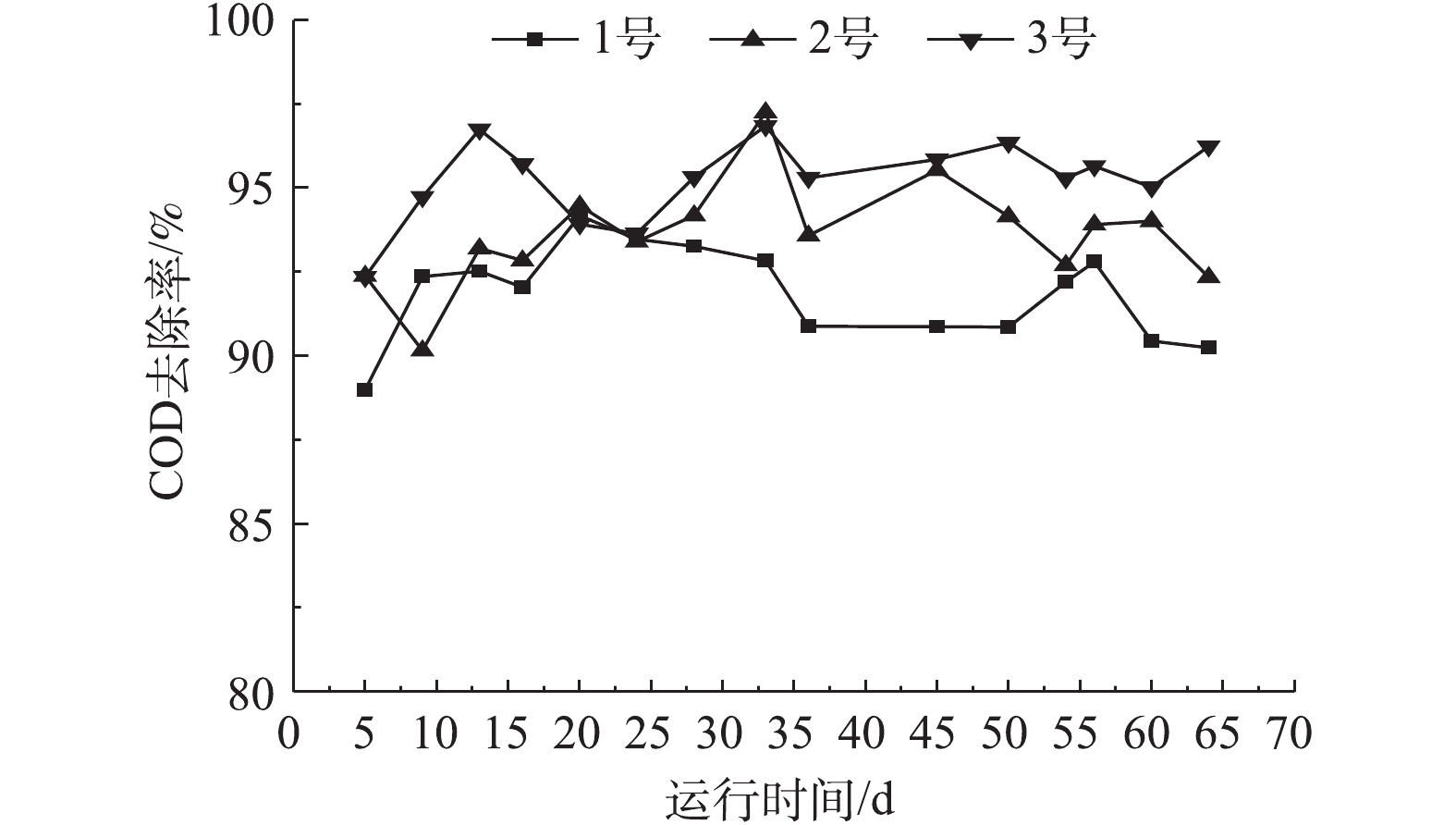
运行期间,各反应器污水中COD去除率变化情况如图6所示。在反应器整个启动运行期间,1、2和3号反应器对COD平均去除率分别为91.86%,93.61%和95.26%。对于3号反应器,在反应初期,Fe3O4@SiO2和微生物共同作用,迅速吸附水中大量有机物,反应系统COD去除率迅速提高,随之吸附达到饱和,12 d后,维持平衡,最终对COD的去除率维系在95%左右。投加磁性材料可提高系统中COD去除率的原因可归为2个方面:一方面,由于菌胶团的物理吸附作用,逐渐形成紧密的磁粉团粒结构,减少了游离细菌的损失,生物量迅速增加,提高系统内生物活性;另一方面,投加的磁性材料比表面积大,对水体中污染物的吸附作用强,使絮体颗粒均匀,利于有机物与微生物充分接触和向絮体内的扩散[8];并且磁场的存在对微生物酶活性有一定的促进作用,提高了微生物的新陈代谢能力和对有机物的氧化分解能力,从而促进对有机物的降解[20]。
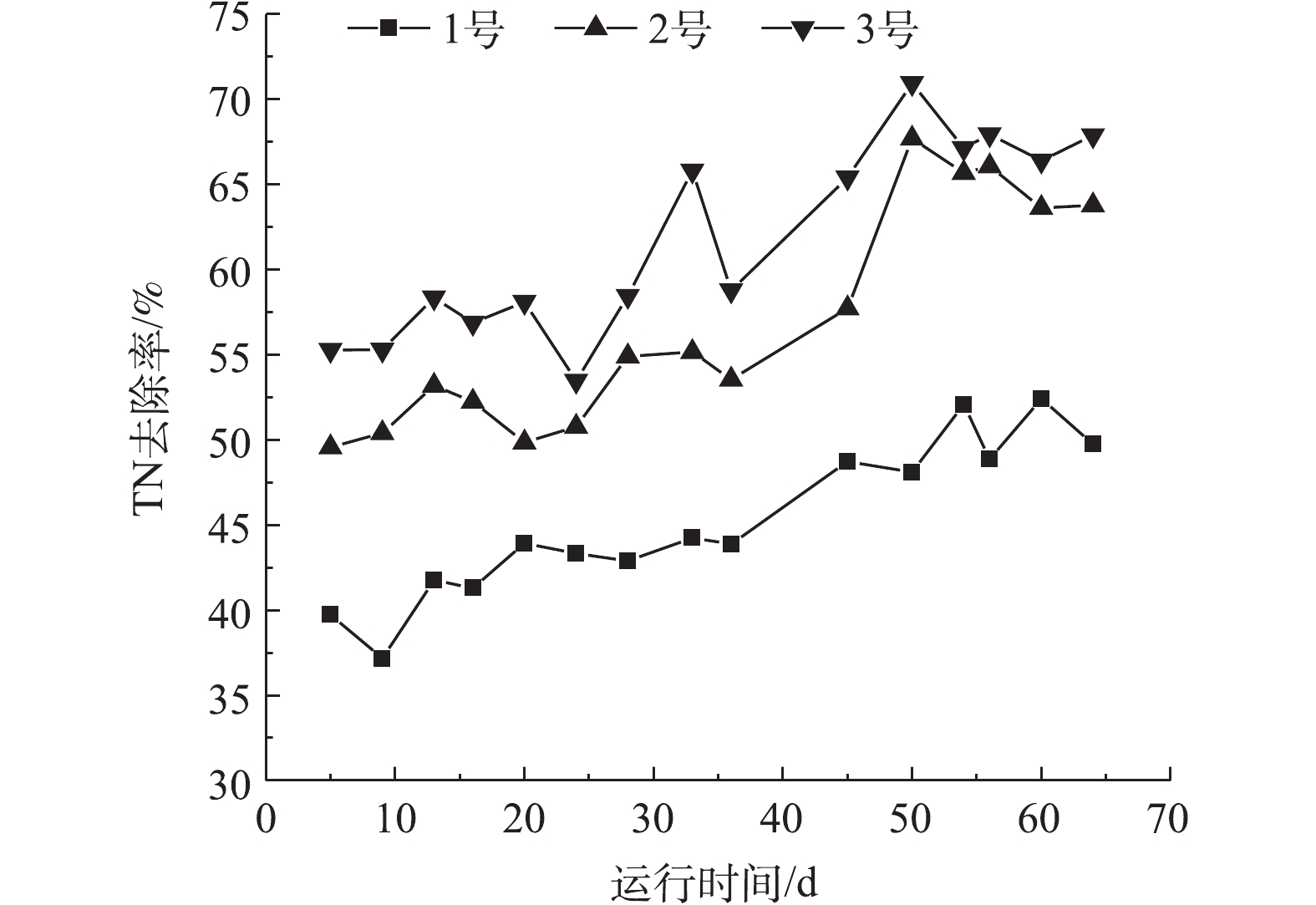
各反应器对TN的去除率如图7所示。2号和3号反应器对TN去除率较1号反应器都有明显提高。其中,2号反应器对污水TN的平均去除率为56.95%,而3号反应器对污水TN的平均去除率为61.74%,分别比1号反应器提高了11.73%、16.52%。实验结果表明,活性污泥系统中磁性材料的投加对污水TN的去除有明显的促进作用,特别是投加Fe3O4@SiO2的3号反应器对污水TN平均去除率最高。这是因为Fe3O4包裹SiO2后,其分散性提高,磁粉更利于与污泥充分接触,附着在活性污泥上,使得污泥结构紧密,可为繁殖速度慢、世代时间长的硝化和亚硝化细菌提供合适栖息载体,使之不易流失并逐渐富集,生长量相对较多, 增强了反应器内的生物同化和硝化反硝化作用,进而提高了对氮素的去除[8]。
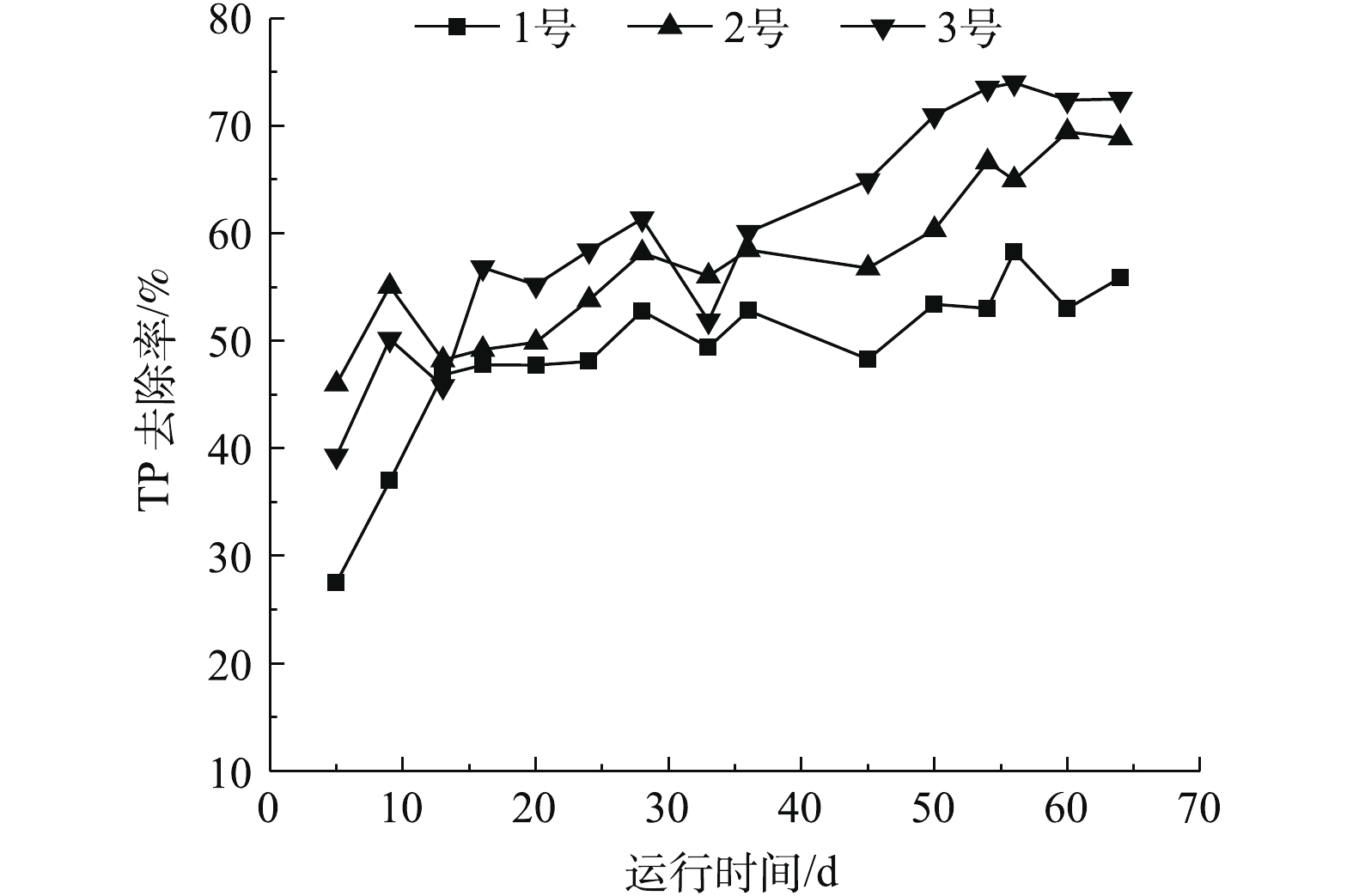
各反应器中TP去除率的变化结果如图8所示。可以看出,在各反应器中TP的去除率随反应运行时间均呈逐渐上升的趋势,相对于1号反应器,在2号和3号反应器中的TP去除率更加明显。其中,2号反应器对TP的平均去除率达到57.50%,较1号反应器提升8.67%;而3号反应器对TP的平均去除率为60.5%,比1号反应器提升11.69%。由此可见,磁性材料的投加有利于TP的去除。这是由于磁性纳米材料特有的磁生物效应,其暴露表面的配位不饱和活性位点多,使其具备优异的催化活性。一方面,在磁性纳米颗粒的催化作用下,有利于含磷酸物质的催化转化;另一方面,磁性纳米颗粒利用其较大的比表面积,可有效吸附磷酸盐,从而降低了其含量,同时,投加的磁粉使其表面的醛基利用共价键和废水中的胶体、悬浮物、蛋白质、脂肪、磷酸盐等结合在一起,进而达到去除污染物的目的[21]。此外,3号反应器对TP的平均去除率比2号反应器提升了3.02%,这说明经SiO2包裹后Fe3O4的分散性和稳定性均有所提升,故使其催化活性得到了一定程度的提升。
-
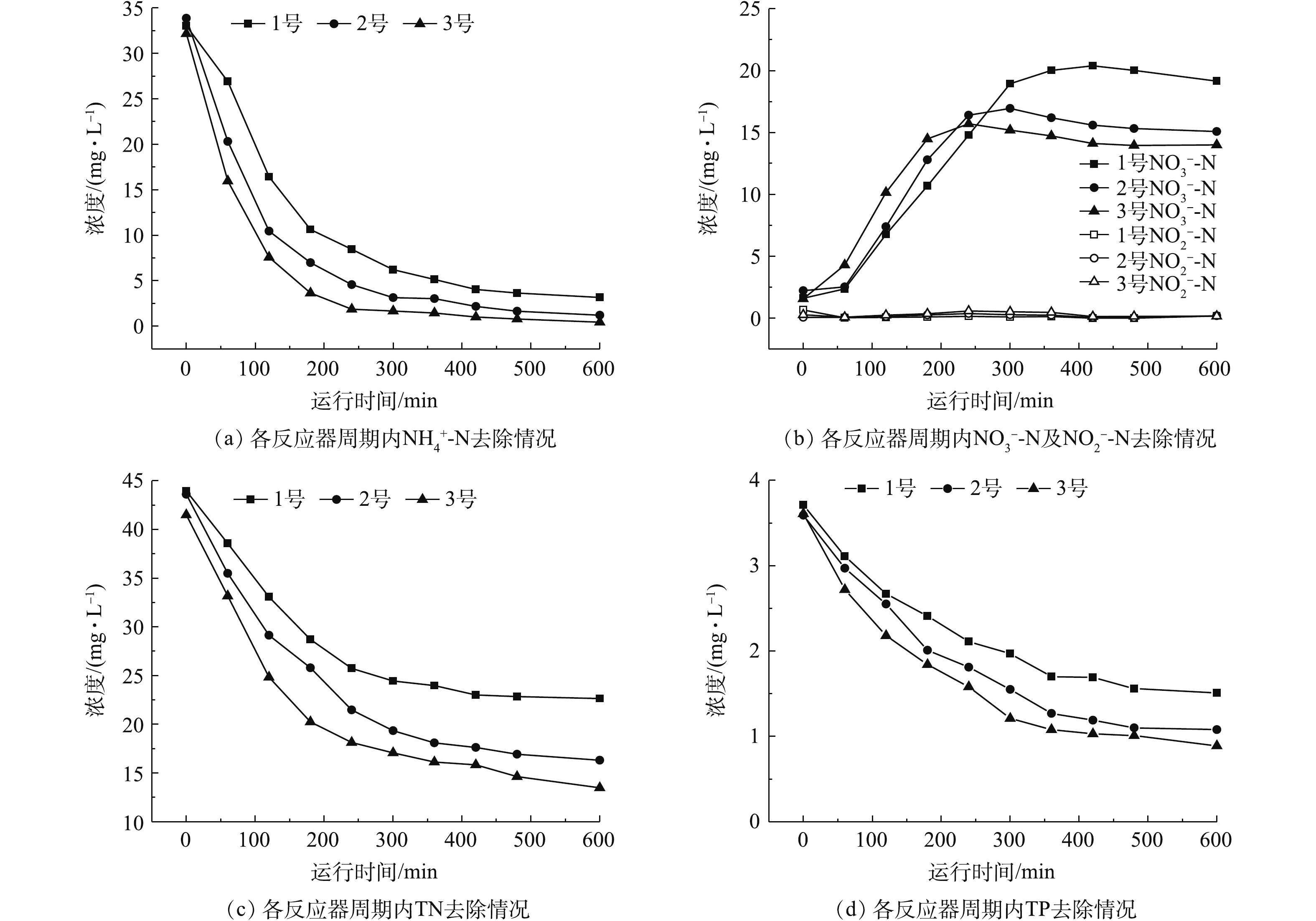
在反应器稳定运行典型周期(30 d)内,各反应器氮素及总磷变化情况如图9所示。各反应器对氨氮去除率最终均可达到90%以上(图9(a))。1号反应器中的氨氮浓度由33.03 mg·L−1下降至4.04 mg·L−1,在420 min内已基本去除,反应结束时,其最终浓度为3.17 mg·L−1,此时其去除率为90.40%;2号较1号反应速率较快,在300 min内,已基本完成氨氮的转化,硝化速率为6.14 mg·(L·h)−1,最终氨氮去除率达96.43%,明显高于1号反应器;3号反应器反应速率最快,在240 min内,氨氮就已降低至1.87 mg·L−1,最终出水浓度为0.45 mg·L−1,氨氮去除率可达98.60%,比2号提高2.17%,表现出了良好的脱氮性能。在氨氮浓度下降的同时,也伴有
NO−3 -N及NO−2 -N的积累(图9(b)),但各系统中NO−2 -N的积累量都很少,维持在1 mg·L−1以下,NO−3 -N的生成速率和积累量各不相同,1号NO−3 -N初始浓度为1.6 mg·L−1,在420 min时,其可达到最高,为20.39 mg·L−1,此后浓度基本保持不变,最终出水浓度为19.15 mg·L−1;2号和3号中的NO−3 -N浓度变化趋势与1号反应器一致,出水浓度分别为15.09 mg·L−1和14.01 mg·L−1,3号保持了较低的NO−3 -N出水浓度。对比图9(a)和图9(b),在氨氮浓度下降的同时,对应NO−3 -N和NO−2 -N浓度有所提高,且硝化速率趋势保持一致,在反应前180 min内,1、2、3号反应器内NO−3 -N积累速率分别可达3.03、3.53、4.31 mg·(L·h)−1;结合TN变化情况(图9(c))可知,NO−3 -N的运行浓度随时间的延长不断升高,此时TN却一直在下降,这说明氨氮转化生成的NO−3 -N被转化了一部分,系统中发生了反硝化,转化成其他氮素形式,从而达到脱氮的目的。这主要是好氧颗粒污泥表面进行反硝化作用消耗了部分NO−3 -N,在颗粒内部的缺氧环境下,厌氧反硝化菌也进行反硝化作用,共同降低了系统的NO−3 -N出水浓度,此结果与前文所提到的3号颗粒化程度优于2号的结论是一致的(图9(c))。在此期间,TN也不断变化,1号反应器中的TN进水浓度43.95 mg·L−1,在240 min内,降低到25.73 mg·L−1,反应结束时,其浓度为22.64 mg·L−1,TN去除率可达48.49%;2号反应器反应迅速,在180 min内,TN浓度降低至25.79 mg·L−1,最终出水浓度为16.31 mg·L−1,TN去除率为62.60%;3号速率最快,在180 min内的TN去除速率比2号提高了1.14 mg·(L·h)−1,出水浓度为13.48 mg·L−1,表现出良好的脱氮性能。3个反应器TN平均去除率分别为48.49%、62.60%、67.51%。综合各氮素去除率变化结果可知,3号>2号>1号,改性后的Fe3O4@SiO2纳米材料可以提高反应系统的除污性能。TP在周期内的去除率变化如图9(d)所示。在600 min内,各系统中的磷浓度均经历急剧下降到去除平缓的变化趋势。1号反应器中的TP在360 min内基本完全被去除,2号反应器中的TP被完全去除也需360 min,3号反应器的去除时间明显缩短,较1号和2号提前了60 min。在300 min内,各反应器去除速率分别为0.35、0.41、0.48 mg·(L·h)−1,至反应结束时,1号TP出水浓度为1.51 mg·L−1,去除率为59.3%;2号TP出水为1.08 mg·L−1,去除率为69.92%;3号TP出水可达0.89 mg·L−1,其去除率明显高于1号和2号,高达75.35%。 -
目前,关于加载Fe3O4@SiO2可促进活性污泥处理系统性能的影响机理研究鲜有报道。本研究的结果表明,包覆SiO2的磁粉既提高了其在水体中的分散性,增强了污泥的自凝聚过程和沉降性能,又保持了磁粉良好的磁性效应,促进了污泥胞外聚合物分泌和提高了脱氮除磷效果。其影响机制可能是,Fe3O4经过SiO2包覆后,其表面电势、空间位阻和静电势力均有所降低,从而提高了磁性颗粒的分散性,使其可作为污泥颗粒化的“成核”载体。由于投加的Fe3O4@SiO2材料有一定的比表面积和孔隙率,当将其投加到活性污泥系统中,在材料表面和内部的孔隙中会富集大量的微生物,并有利于富集生长速率较慢的硝化细菌等脱氮菌群;随着微生物的不断增殖,相互黏结,开始形成颗粒污泥雏形,加上反应器运行过程中曝气气流和水力剪切力等外力作用,Fe3O4@SiO2材料的加入使得污泥与材料之间在反应器内发生更加频繁的碰撞和摩擦,使形成的颗粒污泥雏形不断长大,导致反应器内颗粒化程度明显。此外,Fe3O4@SiO2的投加使得其在污泥颗粒化进程中充当稳定的“内核”,从而避免因传质阻力引起的污泥颗粒内部分裂。投加的Fe3O4@SiO2,由于其表面的羟基[11]等基团利用共价键和废水中的胶体、悬浮物、蛋白质、脂肪、磷酸盐等结合,增加了污泥的密实度。一旦反应器内出现明显的颗粒污泥,由于颗粒污泥独特的球状立体结构,在其边缘及内部存在溶解氧梯度,会形成外部好氧、内部缺氧的微环境,这种独特的空间结构为硝化菌、反硝化菌以及除磷菌提供了有利的生活环境,从而使反应器宏观上表现出良好的脱氮除磷的效果。另外,磁性材料的投加也会影响活性污泥系统中微生物的种群结构组成和代谢活性。Fe3O4@SiO2通过磁力键、磁力、洛伦兹力和磁致胶体效应等作用,极大地促进了污泥经磁聚、吸附作用富集到其表面,形成颗粒污泥,有利于脱氮除磷等微生物截留和附着,提高反应系统的脱氮除磷效果,其具体的微生物学影响机制仍须进一步的深入研究。
-
1) Fe3O4@SiO2对SBR污泥性能有明显影响,通过促进污泥PN、PS的含量进而改善了活性污泥的沉降性能。在反应器运行20 d时,3号反应器内的活性污泥结构完整,饱满密实,粒径集中分布在0.3~1.0 mm,污泥颗粒化现象明显;Fe3O4@SiO2对污泥中的PN、PS均有促进作用,第70天时,3号反应器内的PN和PS含量分别为318.89 mg·g−1和28.51 mg·g−1;Fe3O4@SiO2能明显改善活性污泥沉降性能,第70天时,3号反应器内污泥SVI为35.22 mL·g−1。
2) Fe3O4@SiO2对SBR脱氮除磷性能有明显促进作用。相对于1号反应器,3号反应器污水TN和TP去除率分别提升了15.2%和12.4%。在典型周期内,3号反应器对氮素及磷的去除速率明显高于1号反应器,在240 min内,1号和3号反应器内的TN去除速率分别为4.56 mg·(L·h)−1和5.84 mg·(L·h)−1,TP去除速率分别为0.44 mg·(L·h)−1和0.51 mg·(L·h)−1。
3) Fe3O4@SiO2对活性污泥系统除污及污泥性能的规律和影响机制为:经SiO2包覆后的Fe3O4@SiO2,提高了其在水体中的分散性,增大了与污泥的接触程度,并通过磁力键、磁力、洛伦兹力和磁致胶体效应等作用,极大地促进了污泥经磁聚、吸附作用富集到其表面,形成颗粒污泥,有利于脱氮除磷等微生物截留和附着,提高反应系统的脱氮除磷效果。
磁性硅球对SBR活性污泥脱氮除磷性能的影响
Impact of Fe3O4@SiO2 on the performances of nitrogen and phosphorus removal in a SBR
-
摘要: 为研究磁性硅球(Fe3O4@SiO2)对序批式活性污泥反应器(SBR)污水处理系统中脱氮除磷性能的影响,建立了3个相同的SBR (编号依次为1号、2号和3号),在2号和3号反应器中分别投加0.5 g·L−1的纳米Fe3O4和Fe3O4@SiO2,1号反应器为不投加任何磁性材料的对照组。结果表明:Fe3O4@SiO2对SBR中的污泥性能有显著的影响,3号反应器在运行20 d时,反应器内活性污泥结构完整,饱满密实,污泥粒径多集中分布在0.3~1.0 mm,颗粒化现象明显,而1号反应器无明显颗粒污泥,2号反应器虽能看到有少部分的颗粒污泥,但分布不均匀;Fe3O4@SiO2对污泥胞外蛋白(PN)、胞外多糖(PS)的含量有促进作用,并能改善污泥的沉降性能,第70 天时,3号反应器内PN和PS含量分别为318.89 mg·g−1和28.51 mg·g−1,污泥沉降指数(SVI)为35.22 mL·g−1,性能优于1号和2号反应器;在除污方面,2号和3号反应器对污水总氮(TN)和总磷(TP)去除率比1号反应器分别提升了10.80%、15.20%和9.40%、12.40%,3号反应器表现出最高的脱氮除磷性能;此外,在典型周期内,3号反应器对氮素及磷的去除速率明显高于1号反应器,在240 min内,1号和3号反应器对TN去除速率分别为4.56 mg·(L·h)−1和5.84 mg·(L·h)−1,对TP去除速率分别为0.44 mg·(L·h)−1和0.51 mg·(L·h)−1。由此可见,经SiO2包覆后所制备的Fe3O4@SiO2,提高了其在水体的分散性,增大了与污泥的接触程度,极大促进了污泥经磁聚、吸附作用富集到其表面形成颗粒污泥,并利于脱氮除磷等微生物截留和附着,提高活性污泥反应系统的脱氮除磷效果和去除速率。以上结果可为进一步探索磁性纳米材料对SBR 活性污泥脱氮除磷性能影响提供参考。Abstract: The identical three sequencing batch reactors (SBRs) were set up in order to illuminate the effects of Fe3O4@SiO2 on the performances and kinetics of nitrogen and phosphorus removal in the sequencing batch reactor (SBR). 0.5 g·L−1 nano-Fe3O4 and 0.5 g·L−1 nano-Fe3O4@SiO2 were added to SBR 2 and SBR 3, respectively, and compared with the control group of SBR 1 without addition of magnetic material. The results showed that nano-Fe3O4@SiO2 had significant influence on the sludge property in SBR. After 20 d running, the sludge in SBR 3 presented complete structure, fullness and compactness, and its particle size was mainly distributed in 0.3~1.0 mm, obvious granulation phenomenon occurred. However, no obvious granular sludge appeared in SBR 1, a few sludge granules with non-uniform distribution formed in SBR 2. Moreover, Fe3O4@SiO2 could promote the secretion of exopolysaccharides(EPS) and improve sludge sedimentation performance. On the 70th day, the contents of PN and PS in SBR 3 were 318.89 mg·g−1 and 28.51 mg·g−1, respectively, and sludge volume index(SVI) was 35.22 mL·g−1, and the sludge performance was better than that of SBR 1 and SBR 2. In the aspect of pollutants removal, compared with reactor 1, the removal efficiencies of total nitrogen(TN) and total phosphorus(TP) in SBR 2 and SBR 3 increased by 10.80% and 15.20%, 9.40% and 12.40%, respectively, and SBR 3 showed the highest performance on nitrogen and phosphorus removal. In addition, the removal rates of nitrogen and phosphorus in SBR 3 were significantly higher than those in SBR during the typical circle; during 240 min, the TN removal rates in SBR 1 and SBR 3 were 4.56 mg·(L·h)−1 and 5.84 mg·(L·h)−1, respectively, the TP removal rates in SBR 1 and SBR 3 were 0.44 mg·(L·h)−1,0.51 mg·(L·h)−1, respectively. Therefore, the silica-based magnetic particles (nano-Fe3O4@SiO2) could improve its dispersion in water and contact with sludge, then significantly promoted the formation of granular sludge through enrichment on the sludge surface by magnetic aggregation, adsorption functions, and was conducive to the interception and adsorption of the microbes of nitrogen and phosphorus removal. The removal efficiency and rate of nitrogen and phosphorus were improved. This study provides a theoretical basis for further exploring the effect of magnetic nanomaterials on the denitrification and phosphorus removal performance of SBR activated sludge.
-
有机磷酸酯(Organophosphate esters OPEs)是一类用来改变材料性能、防止风化或延缓燃烧的化学物质,常被添加到电子设备、电器零件、家具等产品的塑料、树脂或聚氨酯泡沫中[1 − 5],容易通过挥发、磨损等方式进入环境[6 − 7]. 随着这些产品生产和使用量的增加,OPEs已普遍存在于我们的生活中,目前不仅在空气、水体、灰尘等环境介质中广泛检出[8 − 12],而且在尿液、血液、指甲和头发等人体样品中也有不同浓度的报道[13 − 17]. OPEs已经被证明具有神经毒性、行为和内分泌干扰等多种毒性效应[18 − 20]. 因此OPEs暴露已经成为危害人体健康不可忽视的影响因素[21 − 25].
头发作为生物监测材料已经被广泛应用于法医学、毒理学、环境科学等研究领域中[26 − 29],相比于血液或尿液而言,它具有无创性、采集简单、性质稳定等优点,既可以反映短期暴露又可以反映长期暴露[30 − 32]. 然而目前环境有机污染物进入毛发的机制还缺乏深入的研究. 亚洲人以黑发为主,随着年龄的衰老,常常会出现白发,因此在头发样品采集的过程中,存在黑、白或棕色混杂的现象,而颜色是否会对污染物在毛发中的富集产生影响还未有定论. 唐斌等采集了电子垃圾拆解工人的黑、白头发并分别检测了头发中9种OPEs的含量,发现大部分OPEs在黑发中的浓度高于白发[33]. 但人群头发可能同时包含内部摄入和外部自由扩散两种途径的污染物[34 − 35],而动物暴露实验可以有效的控制体内暴露的剂量和外部环境的污染,能够成为研究毛发中污染物富集机制的有力手段. 多项研究表明喹硫平等药物在不同颜色毛发中的富集水平存在显著差异[36 − 38],但也有文献报道毛发颜色对某些合成大麻素等药物几乎不存在影响[39]. 目前关于毛发颜色对其中有机污染物(包括OPEs)富集的影响,还缺乏动物暴露实验的相关研究.
豚鼠(学名:Cavia porcellus)是一种常见的模式动物,其毛发与人类头发生物结构高度相似,同样具有表皮衍生物如髓质、皮质、角质分层结构;毛囊具有丰富的毛细血管,体内污染物可以通过血管进入毛发中. 豚鼠汗腺不发达,可以减少体内暴露污染物通过汗腺对毛发的污染. 一些品种具有多种毛色,可以开展毛发颜色对污染物富集影响的研究[40].
本研究以三色豚鼠为实验对象,通过控制三种典型OPEs的剂量进行暴露实验,研究不同颜色毛发的OPEs暴露特征. 应用基于超声提取-分散固相萃取的前处理技术和液相色谱质谱联用定量分析技术,检测同一只豚鼠不同颜色毛发中的OPEs含量,探究毛发颜色对豚鼠毛发中不同OPEs富集的影响,为人群调查中头发样品的采集提供参考,推动头发作为人体新污染物暴露监测的非侵入材料的广泛应用.
1. 材料与方法(Materials and methods)
1.1 化学品、试剂与仪器
主要化学品:目标化合物标准品磷酸三(1,3-二氯-2-丙基)酯(Tris(1,3-dichloro-2-propyl) phosphate,TDCIPP)、磷酸三苯酯(Triphenyl phosphate,TPHP)、磷酸三丁酯(Tri-n-butyl phosphate,TNBP)(AccuStandard,美国),氘代同位素标准品 d15-TDCIPP、d15-TPHP(Cambridge Isotope Laboratories,美国). 三种OPEs的基本信息见表1.
表 1 三种OPEs的基本理化性质和毒理参数Table 1. Basic physicochemical properties and toxic parameters of three OPEs化合物Compounds CAS 结构式Structural formula 分子量Molecular weight 辛醇-水分配系数alg Kow 酸电离常数bpKa 半数致死剂量c /(mg·kg−1)LD50 无可见有害作用水平/最小可见损害作用水平/(mg·kg−1·d−1)NOAEL/ LOAEL TDCIPP 13674 -87-8
430.91 3.65 6.19 大鼠口服:1850;小鼠口服: 2250 13.2d TPHP 115-86-6 
326.29 4.59 4.66 大鼠口服: 3800 25e TNBP 126-73-8 
266.30 4.00 6.08 大鼠口服: 3000 100f alg Kow bpKa cLD50、来源于ChemIDplus数据库;alg Kow bpKa cLD50 were obtained from the ChemIDplus database; d NOAEL,基于小鼠肝重增加[41];d NOAEL,based on the increased liver weight in mice[41]; e LOAEL,基于对大鼠行为表达的影响[42];e LOAEL,based on the effects on the behavioral expression in rats[42]; f NOAEL,基于大鼠体重降低[43]. f NOAEL,based on the reduced body weight in rats[43]. 主要材料与试剂:无水硫酸钠(Na2SO4),碳18(C18),2 mL、15 mL离心管,2.5 mm、5 mm氧化锆研磨珠(上海安谱实验科技股份有限公司,中国);色谱纯甲醇(MeOH) (默克,德国),色谱纯正己烷(HEX)、丙酮(ACE)、乙酸乙酯(EtAC)、乙腈(ACN)、乙酸铵(上海安谱实验科技股份有限公司,中国).
主要仪器:Agilent
1260 液相色谱仪(Agilent,美国),AB SCIEX API4000 三重四极杆质谱仪(AB SCIEX,美国),Poroshell 120 EC-C18 色谱柱( 4.6 mm×50 mm,2.7 μm) (Agilent,美国),混合型研磨仪MM400(Restch,德国),离心机(Thermo Fisher Scientific,美国),氮吹仪(Organomation,美国),涡旋振荡器(Troemner,美国).1.2 动物暴露实验
健康雄性三色豚鼠饲养于广东省医学实验动物中心普通级动物房,品种为短毛顺毛,毛发颜色同时包含黑色、棕色或白色,质量为200—300 g,使用普通级饲料喂养,饮用水为无菌水,自由摄食和饮水,保持12 h/12 h的日/夜光照循环,室内温度为20—24 ℃,湿度为40%—60%. 本研究已经通过广东省医学实验动物中心伦理委员会批准(批准号:B202302-7). 为避免含排泄物的垫料对毛发可能产生的污染,本次暴露实验采用不锈钢笼饲养. 大/小鼠经口暴露TDCIPP、TPHP、TNBP这3种化合物的无可见有害作用水平/最小可见损害作用水平(no observed adverse effect level/ lowest observed adverse effect level,NOAEL/ LOAEL)分别为13.2 mg·kg−1·d−1、25 mg·kg−1·d−1、100 mg·kg−1·d−1,本次暴露剂量设置为10 mg·kg−1,尽量避免化合物毒性对豚鼠健康的影响. 所有豚鼠在实验室适应性饲养7 d后开始暴露实验,按照随机分配的原则分为对照组(n = 5)和暴露组(n = 7). 开始暴露前,将豚鼠背部的毛剃除干净. 每天上午10:00,对照组豚鼠使用纯玉米油灌胃,暴露组豚鼠使用混有3种化合物的玉米油灌胃,连续暴露20d,期间每3d记录一次体重.
1.3 样品采集与准备
暴露结束后,使用电动剃毛刀按照不同颜色将背部毛发剃下,称重后用洁净的锡箔纸包裹并于−20 ℃保存. 样品分析前,使用丙酮清洗过的尖头镊子将黑色、棕色和白色的毛发完全区分开. 毛发的清洗参考之前的研究[44],具体步骤为:准确称量50 mg毛发置于2 mL 离心管中,加入1.5 mL丙酮,以
1500 r·min−1速度涡旋1 min、100 Hz超声1 min后小心吸出溶液,重复两次,清洗结束后将毛发自然晾干. 干燥后的毛发置于干净的2 mL离心管中,加入氧化锆研磨珠,使用研磨仪充分研磨成粉末. 毛发中目标化合物的提取参考罗镇南等的方法[45],准确称量10 mg毛发粉末于15 mL离心管,加入100 μL的 EtAC及20 μL同位素内标(d15-TPHP、d15-TDCIPP质量分数均为100 ng·mL−1),通风橱静置过夜使溶剂挥发. 加入HEX、ACE、ACN 及EtAC(1:1:1:1,V/V/V/V)的混合溶液4 mL,2000 r·min−1 涡旋4 min,20 ℃ 超声20 min,4000 r·min−1离心15 min后取提取上清液. 此提取过程重复3次后,将合并的上清液在温和氮气下浓缩至1 mL,加入20 mg无水 Na2SO4 和 100 mg C18 进行除水和净化,1200 r·min−1 涡旋 7 min、3500 r·min−1 离心 15 min后,再转移上清液至干净的离心管中. 氮吹近干后,使用200 μL MeOH复溶,放置−20 ℃冰箱中静置 4—6 h 冷冻沉淀除杂,取上清液待质谱分析.1.4 仪器分析
使用液相色谱-三重四极杆串联质谱仪(LC-MS/MS)分析样品中OPEs的含量. 色谱柱为Poroshell 120 EC-C18 (4.6 mm× 50 mm,2.7 μm);流动相为甲醇(A)和0.01 mol·L−1的乙酸铵溶液(B),梯度洗脱时间共计18 min: 0—2 min,50% A;2—4 min,50—95% A;4—6 min,95% A;6—6.1 min,95—50% A;6.1—9 min,50% A. 流速250 μL·min−1,进样量5 μL,色谱柱温45 ℃. 质谱条件:正离子扫描;毛细管电压
4000 V;气体(N2)温度550 ℃. 三种OPEs的质谱信息见表2.表 2 三种OPEs的质谱信息Table 2. Mass spectrometry parameters of three OPEs化合物Compounds 初级离子(m/z)Primary ion 次级离子(m/z)Secondary ion 保留时间/min Retention time 去簇电压/VDeclustering potential 碰撞能/eVCollision energy 对应内标Corresponding internal standard TDCIPP 431 99 11.3 82 42 d15-TDCIPP TPHP 327 152 11.4 102 49 d15-TPHP TNBP 267 155 11.9 65 15 d15-TPHP 1.5 质量保证与质量控制(QA/QC)
样品研磨过程使用的研磨珠及样品前处理过程使用的离心管均为一次性使用,避免交叉污染. 实验样品制备过程同步设置3个空白样品. 每6个实验样品同步做一个平行样品. 方法定量限(limit of quantification,LOQ)和方法检出限(limit of detection,LOD)分别为空白样品中目标化合物浓度的均值加10倍和3倍标准差;空白未检出时,LOQ或LOD定义为10倍或者3倍信噪比,本研究TDCIPP、TPHP、TNBP的LOD分别为0.35 ng·g−1 (dw,干重)、0.93 ng·g−1 (dw)、0.49 ng·g−1 (dw). 用混合毛发制备3个基质加标样品,按照“1.3”节的方法进行前处理,仪器分析后计算加标回收率. 实验得到TDCIPP、TPHP、TNBP的回收率分别为(59.4% ± 12.5%)、(79.8% ± 7.6%)、(74.2% ± 3.8%).
1.6 统计学方法
采用SPSS 25.0软件进行统计学分析. 描述分析中,样品检出浓度结果用均值±标准差(`x ± s)表示;检出浓度低于检出限时,浓度值计为零. 两组间比较采用独立样本T检验,3组及以上采用单因素方差分析,两两比较使用最小显著差异(least significant difference, LSD)t检验,P < 0.05和P < 0.01分别表示有显著性和非常显著性差异.
2. 结果与讨论(Results and discussion)
2.1 豚鼠毛发中三种OPEs的检出特征
本实验饲养的三色豚鼠3种颜色毛发在体表分布不均,个别豚鼠的背部毛发可能缺少其中一种颜色,例如对照组有1只缺失棕色,暴露组中3只豚鼠分别缺失黑色、棕色和白色. 因此最终获得对照组毛发14份,暴露组毛发18份.
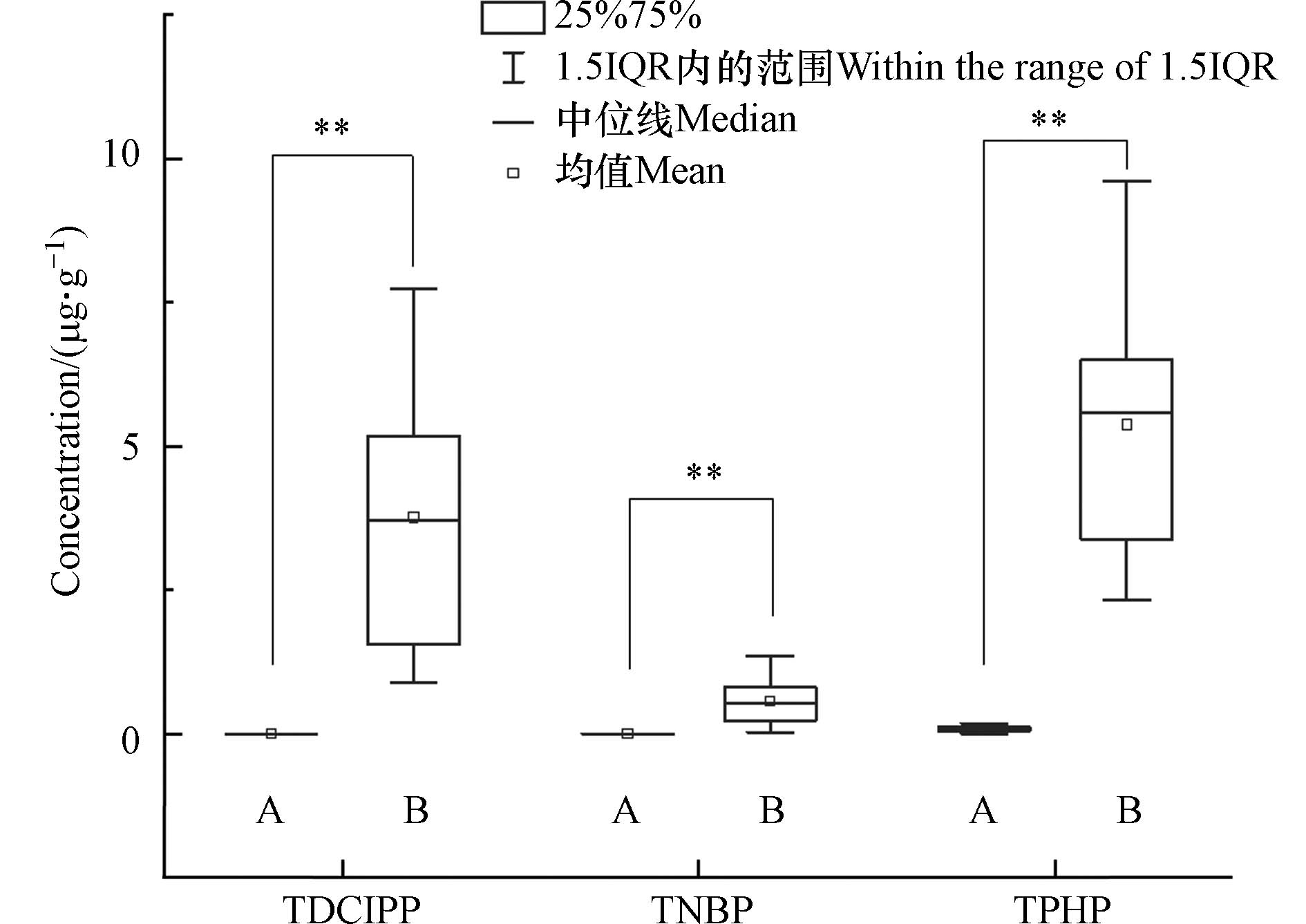
TDCIPP在对照组所有豚鼠毛发样品中均未检出,而在暴露组毛发中的浓度范围为0.96—13.9 μg·g−1,平均浓度为(4.11 ± 3.12) μg·g−1(图1). 该结果表明通过灌胃进入豚鼠体内的TDCIPP能够蓄积到毛发中. TDCIPP的暴露剂量为10 mg·kg−1(即10 μg·g−1),则TDCIPP从灌胃到进入毛发平均富集0.41倍,最高富集了1.39倍. 目前关于OPEs在动物毛发中富集的报道相对较少,一项关于C57BL/6雄性小鼠的暴露实验发现[46],300 mg·kg−1 TDCIPP连续暴露35d后,毛发中TDCIPP含量为(76.0 ± 10.2) μg·g−1,从灌胃到进入毛发平均富集0.25倍,略低于本实验中豚鼠毛发的平均富集倍数,这可能与不同物种的代谢差异有关.
与TDCIPP不同,对照组除了1个毛发样品未检出外,其它均检出TPHP,最高浓度为0.18 μg·g−1,平均浓度为(0.078 ± 0.043) μg·g−1,这可能是饲养环境中较高的本底值导致. 暴露组毛发样品均检出了较高浓度的TPHP,浓度范围为2.3—9.6 μg·g−1,平均浓度为(5.5 ± 2.3) μg·g−1(图1). 暴露组中TPHP检出浓度显著高于对照组(P < 0.01),表明毛发中的TPHP可以反映豚鼠的内负荷水平. 扣除本实验对照组的本底值后,TPHP在毛发中的平均富集倍数为0.47,与TDCIPP(0.41)较为接近. 目前还未发现关于TPHP在动物毛发中富集水平的相关报道.
TNBP在对照组毛发中均未检出,暴露组毛发中的浓度范围为0.028—1.08 μg·g−1,平均浓度为(0.46 ± 0.28) μg·g−1(图1). 尽管3种污染物的暴露剂量相同,然而毛发中TNBP的含量显著低于TPHP和TDCIPP(P < 0.05). 毛发中TNBP的平均富集倍数仅为0.046,较TPHP和TDCIPP低一个数量级,这可能与污染物在豚鼠体内的生物利用度和其理化性质有关. 目前关于TNBP在实验动物毛发中的报道也较为缺乏.
OPEs进入机体后会在代谢酶的作用下快速水解,分解为代谢物随尿液排出体外[47];尚未代谢的OPEs会随血液传输到各个组织,其中在毛囊周围毛细血管中的OPEs会扩散进入生长中的毛囊基质细胞,进而蓄积在毛发中[48]. 因此,毛发中污染物的含量与其在机体内的代谢速率和毛发血液分配系数密切相关. 已有文献报道了3种OPEs在大鼠体内的代谢速率呈现TNBP > TPHP > TDCIPP[49]的趋势;另有研究发现,小鼠在暴露3种OPEs后,TDCIPP在小鼠组织中的总含量明显高于TNBP和TPHP[50],这与本研究豚鼠毛发中TDCIPP浓度显著高于TNBP的结果一致,而TPHP在毛发中的富集程度与TDCIPP相接近,可能是由于豚鼠与小鼠间物种差异的原因.
另一方面,污染物在毛发中可能会与角蛋白、黑色素等成分相结合,因此理化性质也是影响在毛发中富集的重要因素. 如 Nakahara [51]发现在药物进入头发的过程中,含氯和苯环基团起到了积极的促进作用. 另有研究显示,极化率高的分子与毛发中角蛋白的亲和力更大,如苯、酚类与头发的结合量明显高于环己烷等烷烃类化合物[52]. 这与本研究豚鼠毛发中TDCIPP(氯代)和TPHP(芳基)含量显著高于TNBP(烷烃类)的结果相一致. Wang等[53]发现,咪达唑仑低剂量(5 mg·kg−1)给药28 d后豚鼠毛根中的检出浓度为0.01—0.04 ng·mg−1,而几乎检测不到其亲水的代谢物(羟基-咪达唑仑),认为化合物在头发中的结合与其亲脂性呈正相关关系. 此外,体外实验和理论模型也表明亲脂性能够促进化合物与毛发的结合[54]. 然而本研究并未发现该趋势,这可能与3种OPEs的辛醇-水分配系数比较接近有关(lgKow:3.65—4.59).
2.2 不同颜色毛发中OPEs的检出特征
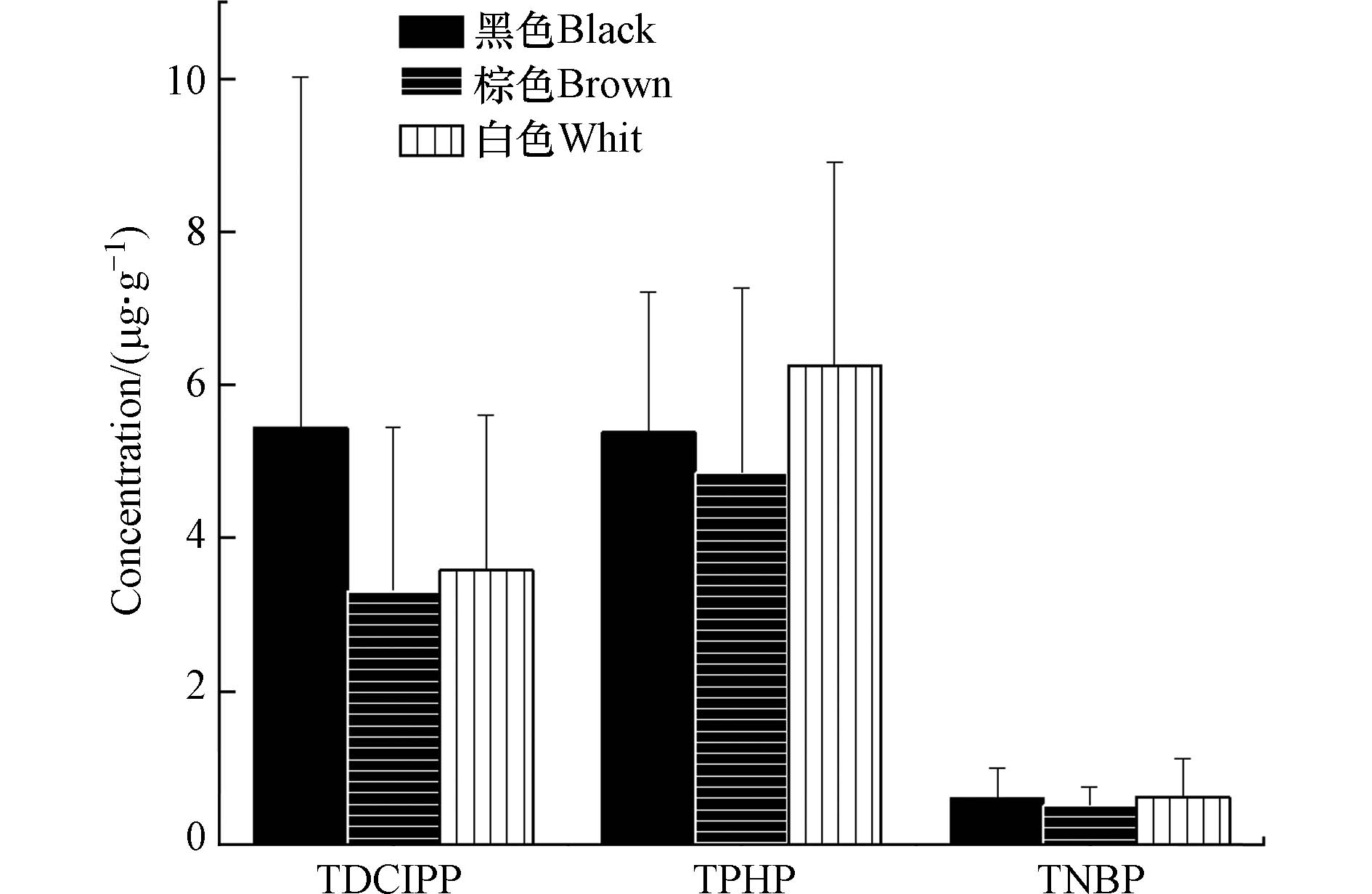
暴露组豚鼠黑色毛发中TDCIPP、TPHP和TNBP的浓度分别为(5.4 ± 4.6) μg·g−1、(5.4 ± 1.8) μg·g−1和(0.59 ± 0.40) μg·g−1;棕色毛发中TDCIPP、TPHP和TNBP的浓度分别为(3.3 ± 2.1) μg·g−1、(4.9 ± 2.4) μg·g−1和(0.51 ± 0.24) μg·g−1;白色毛发中TDCIPP、TPHP和TNBP的浓度分别为(3.6 ± 2.0) μg·g−1、(6.3 ± 2.7) μg·g−1和(0.61 ± 0.51) μg·g−1. 黑色、棕色和白色毛发中三种OPEs检出浓度均明显高于对照组(P < 0.01),表明不同颜色的毛发均可以表征污染物的内负荷. 刘俊芳等[37]对不同毛色的豚鼠开展了氯胺酮药物暴露实验,结果也表明不同颜色的毛发药物检出量均满足给药剂量相关性.
刘俊芳等[37]关于毛发颜色对氯胺酮在豚鼠毛发中分布影响的研究采用了不同毛色的豚鼠,可能存在个体差异的影响. 本研究选用三色豚鼠可以对同一只豚鼠的毛发进行成对比较,避免这一因素的影响. 如图2所示,TDCIPP在毛发中呈现黑色>白色>棕色的趋势,TPHP呈现白色>黑色>棕色的趋势,而TNBP在黑色和白色的含量相当,均略高于棕色毛发. 然而通过对豚鼠毛发每两种颜色的TDCIPP、TPHP和TNBP检出浓度分别做最小显著差异法LSD-t检验,发现黑色-白色、黑色-棕色、棕色-白色三组对比均没有显著性差异(P ˃ 0.05). 这项结果表明,同等暴露条件下,对同一只豚鼠个体,毛发颜色对于TDCIPP、TPHP和TNBP这3种OPEs在毛发中的富集没有明显的影响. 已有研究表明黑色素对于多种药物、毒品等具有较强的吸附能力,但缺乏对有机污染物的研究[38,55]. 本研究结果与之前药物的研究结果不同,可能是由于OPEs本身的理化性质与药物的差异较大,如喹硫平、氯胺酮等药物含有亚胺基等碱性基团,这些药物的lgKow也更低[36,37]. 这些性质可能更有利于与黑色素的带电基团发生结合[55],从而导致不同颜色的毛发中化合物浓度差异更加明显. 因此,本研究提示有机污染物在毛发中的富集机制可能与药物不同,不能直接套用药物研究的结论,而需要开展具体的实验研究.
3. 结论(Conclusion)
本研究通过三种典型OPEs的三色豚鼠灌胃暴露实验发现,TNBP(烷烃OPEs)在毛发中的蓄积显著低于TPHP(芳基OPEs)与TDCIPP(氯代OPEs),其中TNBP和TPHP在实验动物毛发中的检出是首次报道. 对照实验表明,毛发可以表征OPEs的体内负荷;三色豚鼠可以作为模式动物,评价毛发颜色对污染物富集的影响. 本实验结果的统计分析显示,不同颜色毛发中的OPEs浓度无显著差异,表明毛发颜色对富集结果没有明显影响. 本实验未分析毛发中OPEs的代谢物以及血液样品中相关化合物的浓度,因此对于三种OPEs在毛发中的富集规律有待进一步验证. 此外,本实验还存在样本量较少和暴露浓度单一的局限性,还需进一步开展相关实验研究,以便更好地阐明毛发对有机物污染的富集机制.
-
[1] WANG B Z, LI J, WANG L, et al. Mechanism of phosphorus removal by SBR submerged biofilm system[J]. Water Resource, 1998, 32: 2633-2638. [2] 任小玲, 周迟骏. 废水生物处理技术发展浅谈[J]. 化工时刊, 2004, 18(2): 32-34. doi: 10.3969/j.issn.1002-154X.2004.02.010 [3] SUANON F, SUN Q, MAMA D, et al. Effect of nanoscale zero-valent iron and magnetite (Fe3O4) on the fate of metals during anaerobic digestion of sludge[J]. Water Research, 2016, 88: 897-903. doi: 10.1016/j.watres.2015.11.014 [4] ABELSALAMA E, SAMERB M, ATTIA Y A. Comparison of nanoparticles effects on biogas and methane production from anaerobic digestion of cattle dung slurry[J]. Renewable Energy, 2016, 87: 592-598. doi: 10.1016/j.renene.2015.10.053 [5] BAGHERI M, MASTERI-FARAHANI M, GHORBANI M. Synthesis and characterization of heteropoly tungstate-ionic liquid supported on the surface of silica coated magnetite nanoparticles[J]. Journal of Magnetism and Magnetic Materials, 2013, 327: 58-63. doi: 10.1016/j.jmmm.2012.09.038 [6] 陆光立, 赵庆祥. 磁粉活性污泥法工艺技术研究[J]. 城市环境与城市生态, 1998, 11(2): 10-12. [7] 孙水裕, 刘鸿, 谢光炎, 等. 磁粉强化活性污泥法处理餐饮废水的研究[J]. 环境污染与防治, 2003, 25(3): 170-172. doi: 10.3969/j.issn.1001-3865.2003.03.015 [8] 任月明, 魏希柱, 马军, 等. 纳米磁粉生物反应系统处理效能研究[J]. 哈尔滨工业大学学报, 2008, 40(8): 1247-1251. doi: 10.3321/j.issn:0367-6234.2008.08.015 [9] 麻海珍, 吴志庆, 牛志卿. 磁场对紫色非硫光合细菌脱氢酶活性影响[J]. 环境科学, 1995, 16(3): 3-5. [10] 鲍晓磊, 强志民, 贲伟伟, 等. 磁性纳米复合材料CoFeM48对水中磺胺类抗生素的吸附去除研究[J]. 环境科学学报, 2013, 33(2): 401-407. [11] BAKHTEEVA Y, MEDVEDEVA L, UIMIN M, et al. Magnetic sedimentation and aggregation of Fe3O4@SiO2 nanoparticles in water medium[J]. Separation and Purification Technology, 2016, 159: 35-42. doi: 10.1016/j.seppur.2015.12.043 [12] GAO J, HUANG Y, HUANG F, et al. Progress in Study on core/shell magnetic TiO2[J]. Photocatalyst, 2007, 21: 119-123. [13] BUMB A, BRECHBIEL M W, CHOYKE P L, et al. Synthesis and characterization of ultra-small superparamagnetic iron oxide nanoparticles thinly coated with silica[J]. Nanotechnology, 2008, 19(33): 335601. doi: 10.1088/0957-4484/19/33/335601 [14] SELVAN S T, PATRA P K, ANG C Y, et al. Synthesis of silica-coated semiconductor and magnetic quantum dots and their use in the imaging of live cells[J]. Angewandte Chemie, 2007, 46: 2448-2452. doi: 10.1002/anie.200604245 [15] 辛铁军, 张和鹏, 马明亮, 等. Fe3O4@TiO2核壳磁性纳米材料的制备及表征[J]. 功能材料, 2014, 45(1): 1072-1077. doi: 10.3969/j.issn.1001-9731.2014.01.016 [16] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. [17] 朱亮, 徐向阳, 罗伟国, 等. 废水生物处理好氧污泥颗粒化研究进展[J]. 环境科学, 2007, 28(11): 2657-2663. doi: 10.3321/j.issn:0250-3301.2007.11.044 [18] 林永波, 张丹. 磁性活性污泥在废水处理中作用机理的探讨[J]. 环境科学与管理, 2007, 32(7): 80-82. doi: 10.3969/j.issn.1673-1212.2007.07.025 [19] 潘涌璋, 张志永, 师波. 磁性载体生物膜反应器处理生活污水的试验研究[J]. 中国环境科学, 2011, 31(5): 734-739. [20] 董青, 欧阳立明, 刘建文, 等. 纳米磁粉固定化酶催化合成α-D葡萄糖-1-磷酸[J]. 催化学报, 2010, 31(10): 1227-1232. [21] TERASHIMA Y, OZAKI H, SEKINE M. Removal of dissolved heavy metals by chemical coagulation magnetic seeding and high gradient magnetic filtration[J]. Water Research, 1986, 20(5): 537-545. doi: 10.1016/0043-1354(86)90017-5 -




 DownLoad:
DownLoad: