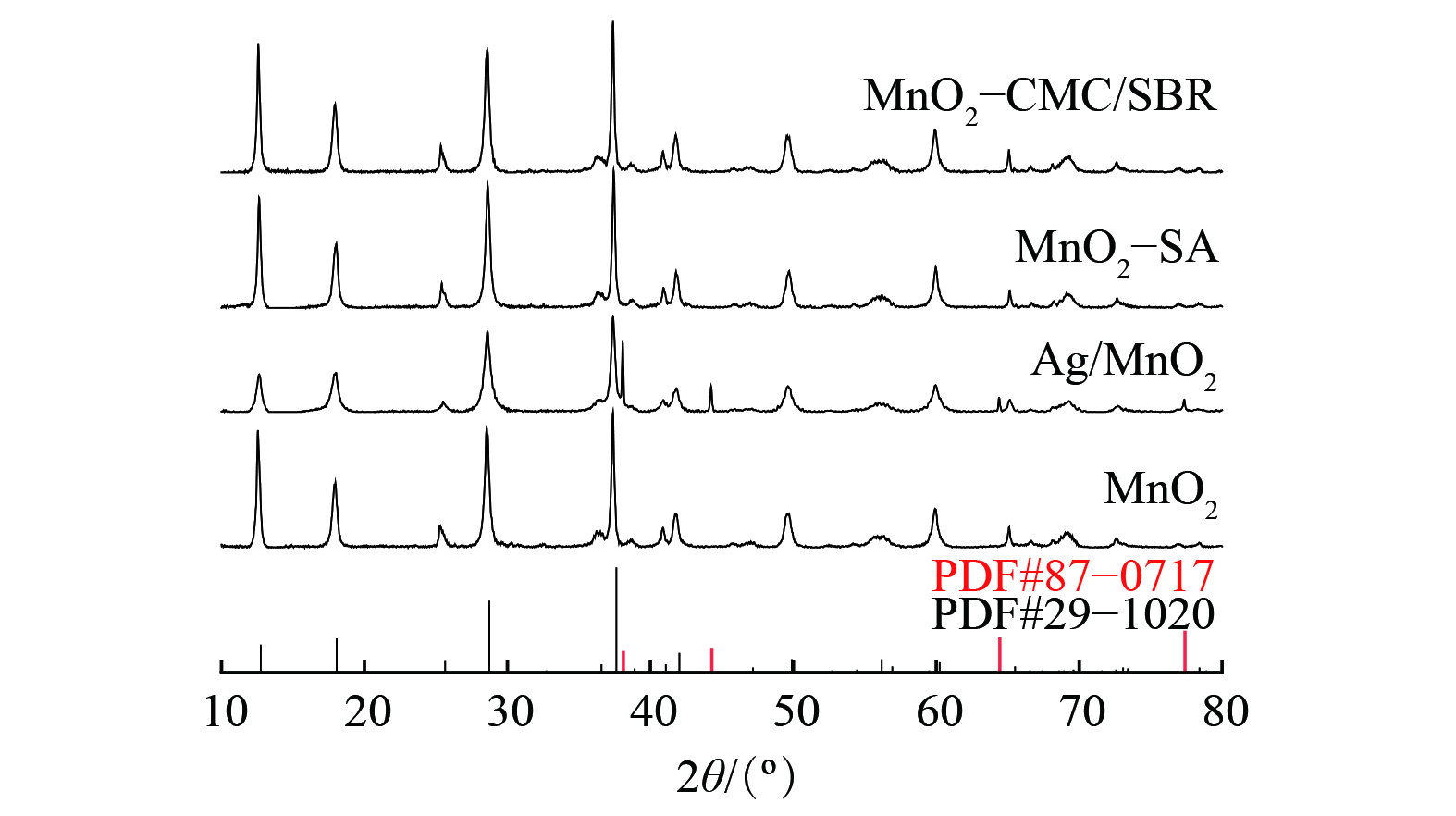
-
中国是世界上最大的抗生素生产国,是青霉素、四环素和林可霉素等发酵类抗生素的主要生产基地[1]。在抗生素发酵生产过程中产生的废母液通常含有高浓度抗生素[2-4],目前这些废母液主要是经生活污水稀释后,采用活性污泥法等常规生物工艺进行处理。抗生素作为一种抑菌或杀菌物质,可影响污水生物处理系统的功能[5],并可能导致耐药菌及耐药基因的产生和排放[6]。为了有效处理上述含抗生素废水,需要在生物处理之前去除废母液中抗生素残留效价。强化水解技术已经被证明具有削减链霉素、螺旋霉素和土霉素等抗生素效价的有效性[7-9]。前期研究[10]已表明林可霉素结构稳定,难以通过温度或pH调节加速其水解过程,强化水解技术无法经济、有效地应用于其实际生产废水的处理。为了保障林可霉素发酵废水的安全、高效处理,须开发相应有效的预处理技术。
大量研究表明,臭氧对水体中的硝基苯、酚类、氯化苯、多环芳香烃等有很好的去除效果[11],并且已成功应用于印染和石化等工业废水的处理[12-18]。LIU等[19]考察了臭氧预处理土霉素实际废水的效果,发现土霉素废母液抗生素降解50%时消耗的臭氧量为0.63 mg·mg−1土霉素,处理后污水不再诱导后续生物处理单元耐药性发展。上述研究表明,臭氧氧化可以作为一种制药废水的预处理技术,然而,目前有关臭氧氧化处理林可霉素发酵废水的研究较少。
本研究以林可霉素发酵废水的高效预处理为目标,利用配水实验评价了臭氧氧化削减林可霉素效价的有效性,考察了共存基质和反应pH对林可霉素去除的影响,将臭氧预处理与厌氧生物处理技术耦合,处理实际林可霉素发酵废水,讨论了臭氧预处理对废水生化处理的促进效果,以期为林可霉素废水的处理提供参考。
全文HTML
-
盐酸林可霉素(98.0%)购自上海TCI试剂公司。乙腈(99.8%,加拿大CALEDON试剂公司)、甲醇(99.9%,德国CNW试剂公司)和甲酸(99.9%,德国CNW试剂公司)均为色谱纯,超纯水电导率为18.2 Ω·cm−1。LB培养基由酵母提取物5 g、蛋白胨10 g、琼脂20 g和1 000 mL超纯水配制而成。
-
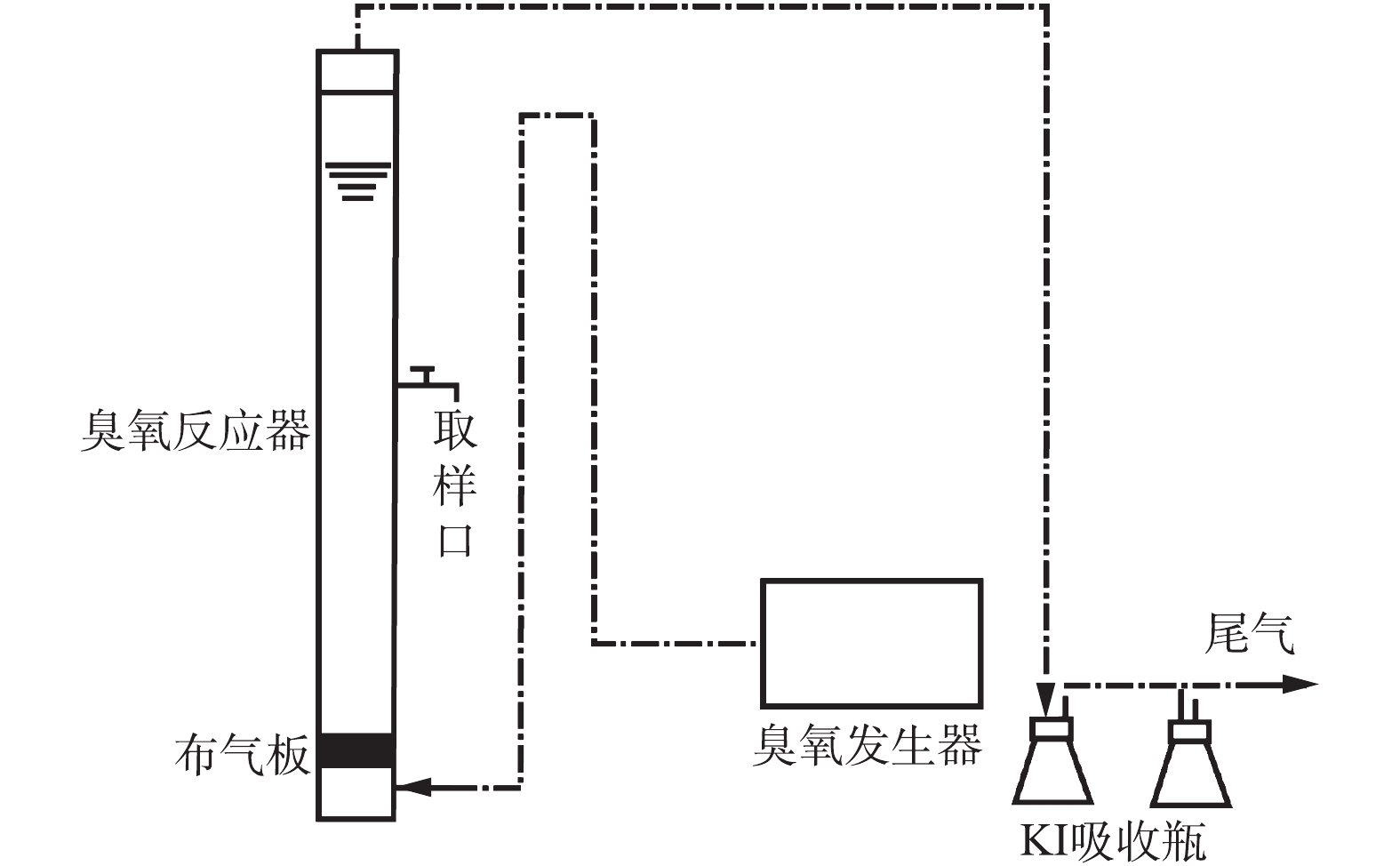
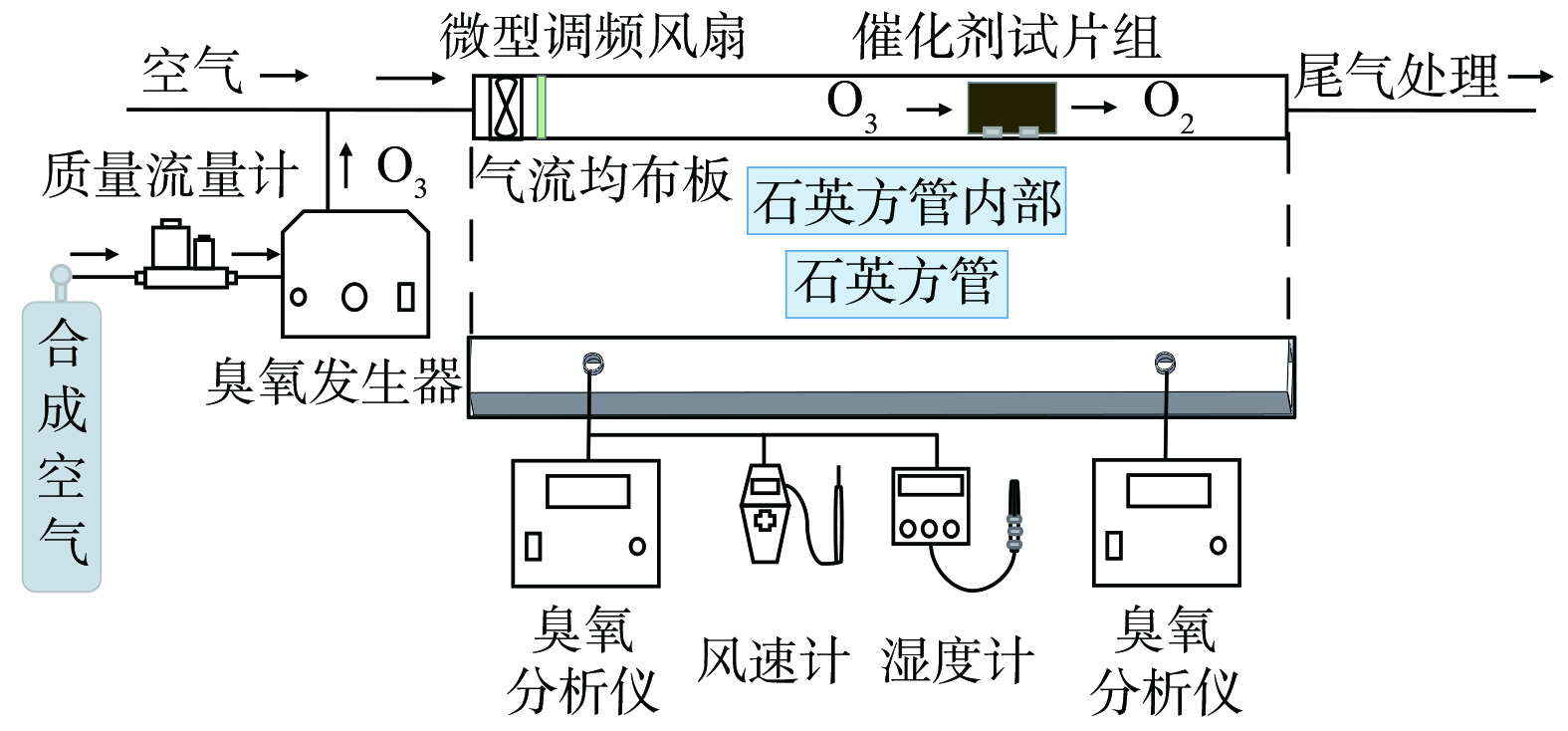
实验装置见图1。臭氧由臭氧发生器(OS-1N,三菱电气公司,日本)产生,臭氧氧化实验在一个直径40 mm、高度为600 mm、容量为700 mL的玻璃柱内进行,实验时将100 mg·L−1的500 mL抗生素溶液一次性转入反应器中,臭氧是由玻璃柱底部的砂板进入反应体系,所有实验在恒温(25 ℃)条件下进行。臭氧的浓度由臭氧监测器(Hare EG-600,Ebara Jitsugyo,日本)进行监控,并用碘量法对臭氧浓度进行校正,反应后的残余臭氧由5%的KI溶液吸收。臭氧浓度稳定后开始计时,在不同反应时间从取样口取4 mL样品进行指标测试。
-
林可霉素浓度测定采用超高效液相色谱-串联质谱法(UPLC-MS/MS)方法,色谱柱为ACQUITY UPLC BEH Shield RP18(1.7 μm × 2.1 mm × 100 mm,沃特世,美国);柱温为35 ℃;流速为0.3 mL·min−1;进样量5 μL;流动相A为乙腈,流动相B为0.1%甲酸水。梯度洗脱程序参考文献中的方法[20]。电离方式为电喷雾电离(ESI,正离子模式),扫描方式为多反应监测(MRM),毛细管电压为1.0 kV,离子源温度为150 ℃,脱溶剂温度为500 ℃,碰撞气流量为50 L·h−1,脱溶剂气流量为600 L·h−1。林可霉素母离子的m/z为406.9,子离子的m/z为125.9(定量离子)和359(定性离子),锥孔电压为30 V,碰撞电压为25 V和22 V。
抗生素效价是指某一物质或水样产生抑菌效果的功效单位。本实验采用实验室前期建立的方法[21]测定水样的抗生素效价,步骤如下:采用金黄色葡萄球菌(Staphylococcus aureus)作为标准菌株,分别采用废水中相应的抗生素和参照标准抗生素作标准曲线,测得相应的抗生素效价当量。1 mL的抗生素标准溶液或者待测样品与9 mL菌液混合,分别为标准曲线组和待测样品组,同时设置了1 mL磷酸盐缓冲液(PBS)和9 mL菌液混合作为阳性对照,1 mL PBS和9 mL不加菌液的抗生素Ⅲ号培养基混合作为空白对照。在WBS-100微生物浊度法测定仪中37 ℃条件下培养4 h,间歇振荡,从45 min后每10 min测定580 nm下的光密度,光密度强弱反映细菌的生长情况。实验结束后,得到20组监测数据,根据标准曲线的线性相关系数选择标准曲线相关性高的一组数据,并根据此标准曲线计算样品的效价当量。所有样品的效价测定均为3个平行,计算平均值。
使用便携式pH计(WTW-pH-Meter Multiline P4,德国)测定pH。使用Phoenix 8000总有机碳分析仪(Teledyne Tekmar,美国)测定溶解性有机碳(DOC)。化学需氧量(COD)采用快速消解分光光度法[22]测定。
-
臭氧氧化反应包括直接反应和间接反应,反应过程复杂。本研究中臭氧连续通入,可认为在整个反应过程中臭氧是持续过量的,因此,反应过程可按照一级反应动力学[23-24]模拟。
一级反应动力学速率方程如式(1)所示。
式中:r为反应动力学速率;C为抗生素浓度,mg·L−1;t为反应时间,min;k为反应速率常数,min−1;基于初始变量t=0,C=C0,分离变量、积分,则得一级反应动力学方程(如式(2)和式(3)所示)。
式中:C0为抗生素初始浓度,mg·L−1;Ct为抗生素在t时刻的浓度,mg·L−1;k为一级反应动力学常数,min−1。
-
厌氧可生化性实验在Bioprocess Control(瑞典)的甲烷自动测试系统(AMPTS-Ⅱ)中进行。实验所用厌氧污泥取自北京市高碑店城市污水处理厂剩余污泥处理单元的中温厌氧消化池。实验在一个500 mL的样品瓶中进行,每个样品瓶盛入200 mL消化污泥(VSS=2 000 mg·L−1),分别加入200 mL空白(不加抗生素的溶液)、未处理过的林可霉素废水(林可霉素浓度为1 000 mg·L−1)、臭氧处理后的林可霉素废水(林可霉素浓度为4 mg·L−1),其中对照组中的化学需氧量(COD)与实际废水的COD(7 800 mg·L−1)相同,由醋酸钠溶液配制,所有实验组均设置2个平行。实验前溶液初始pH用盐酸和氢氧化钠溶液调至7.00±0.05,氮吹3 min,将处理好的样品瓶置于恒温((35 ± 1) ℃)水浴锅中。
1.1. 实验材料
1.2. 实验方法
1.3. 测试及计算方法
1.4. 抗生素臭氧氧化动力学
1.5. 厌氧可生化性评价方法
-
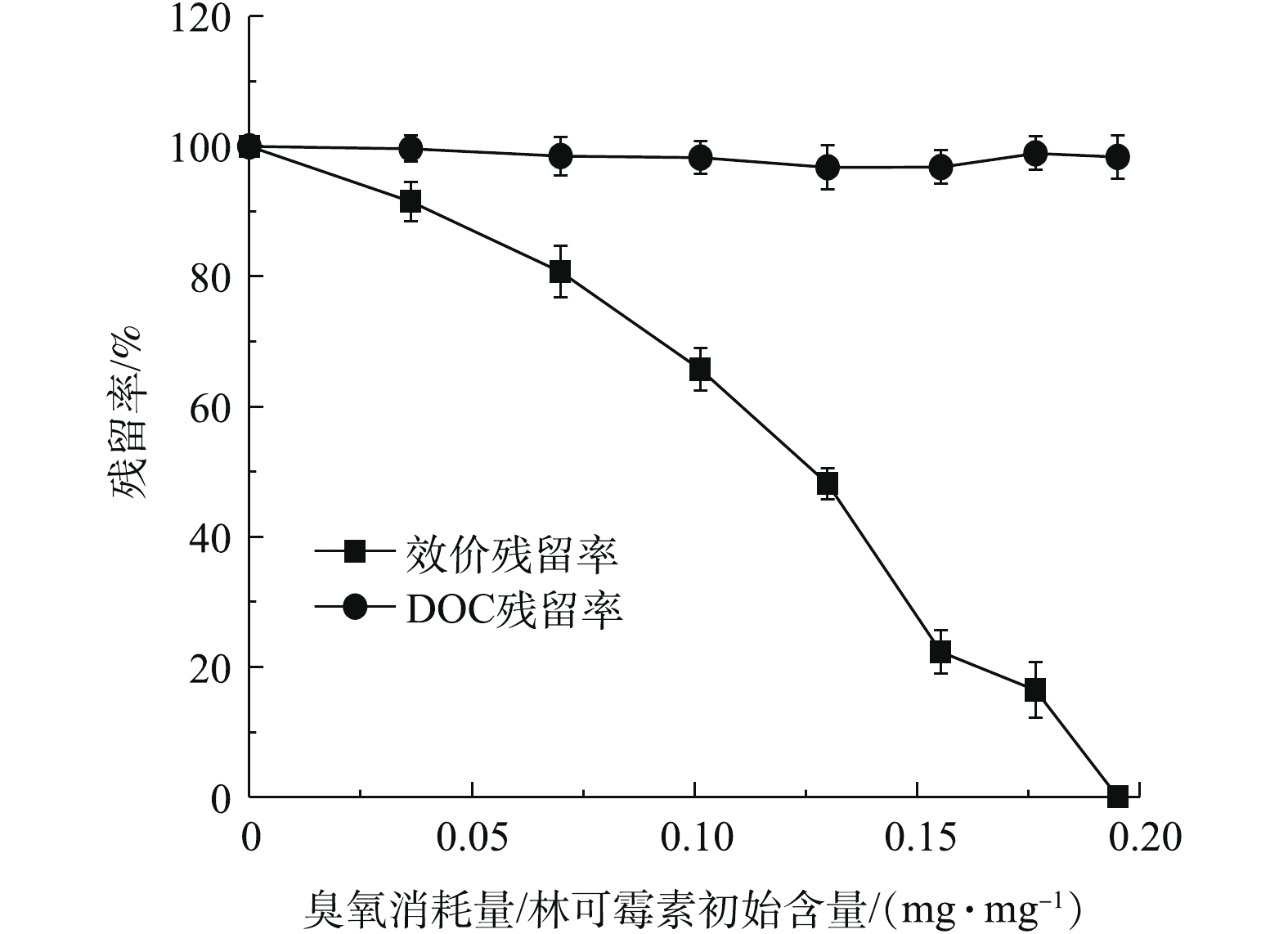
选择林可霉素初始浓度为100 mg·L−1,研究在臭氧氧化过程中其效价和DOC的变化。如图2所示,臭氧对林可霉素具有降解效果,在最终实验结束时(2 h),林可霉素可完全降解(效价去除率100%),对应的臭氧消耗量为0.195 mg·mg−1。QIANG等[25]曾报道,臭氧氧化可以在10 ms内完全降解林可霉素(1 mg·L−1),进一步证明了臭氧对林可霉素降解的可行性。DOC代表水中有机碳的含量,林可霉素初始DOC含量为57.14 mg·L−1,由图2可以看出,臭氧处理过程中林可霉素溶液的DOC基本没有变化,表明本研究条件下臭氧只是对抗生素进行了改性,导致其效价降低,并未将其彻底矿化。LIU等[19]在考察臭氧处理土霉素实际废水的研究中,同样发现0.63 mg·mg−1土霉素的臭氧投量只是降低了废水效价,并未导致废水DOC下降。进一步采用一级降解动力学模型对抗生素浓度进行拟合,结果如表1所示。林可霉素降解过程中ln(C0/Ct)与反应时间成线性关系,其相关系数均超过0.97(P<0.001),表明了林可霉素的臭氧氧化过程确实符合一级降解动力学。同时,根据降解动力学曲线计算得出林可霉素降解50%时,臭氧的消耗量为0.118 2 mg·mg−1。
-
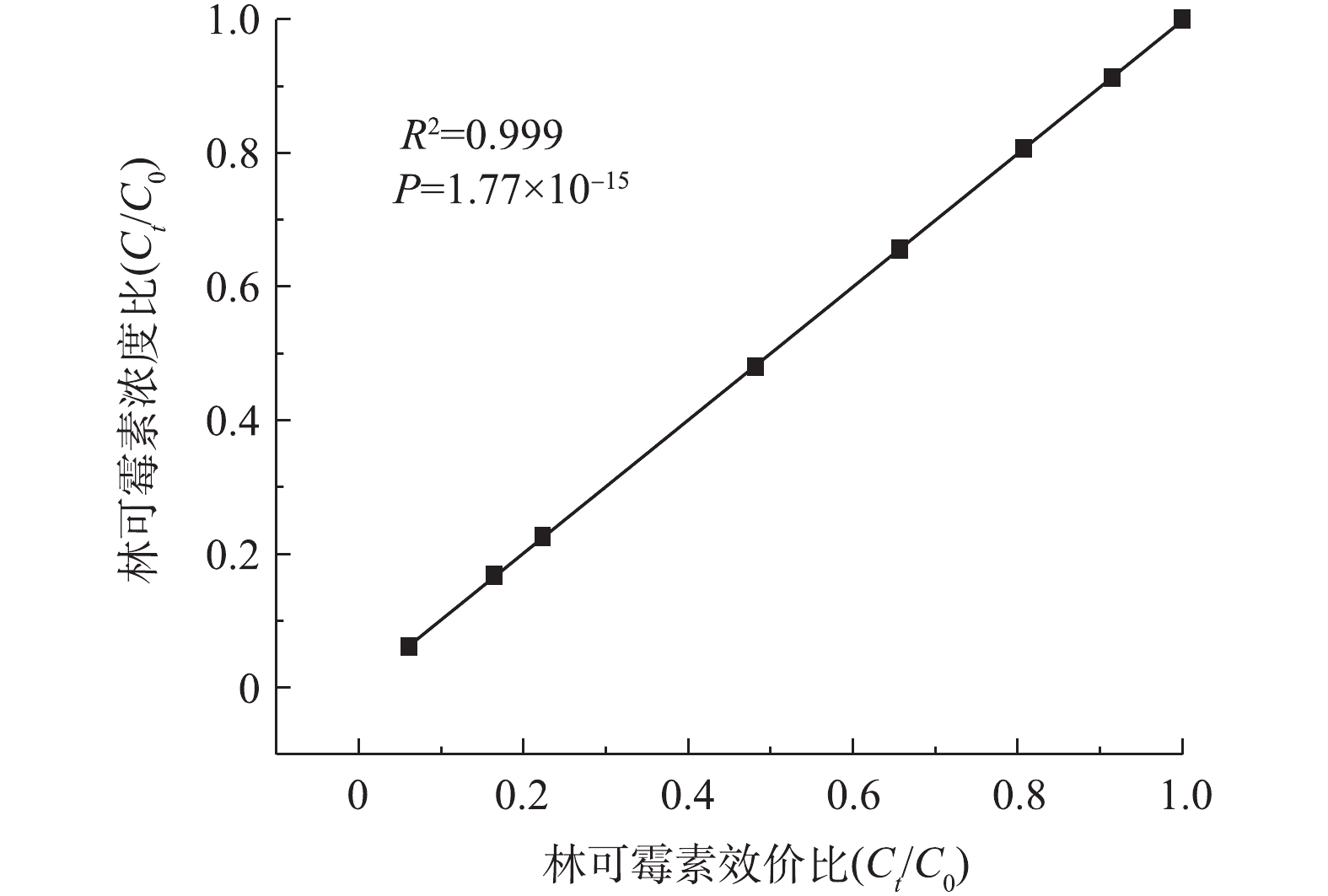
上述结果表明臭氧氧化可以有效去除林可霉素的效价,为了进一步验证臭氧氧化在实际抗生素发酵废水预处理中的有效性,评价了臭氧氧化过程中林可霉素浓度变化和效价削减的相关性。如图3所示,林可霉素的降解过程中效价和浓度的变化高度一致(R²为0.999),表明林可霉素臭氧氧化产物不具有抑菌活性,臭氧氧化过程中效价的降低主要源于母体物质的降解。YI等[7]同样发现,土霉素和四环素废水的效价主要源于其母体物质,水解产物抑菌活性较低。本研究结果同样表明,可以用简单、低成本的效价方法替代操作复杂、测试成本高的色谱方法测定林可霉素的残留水平。
-
pH是影响臭氧氧化过程的一个重要因素。一方面,pH影响水中臭氧的分解;另一方面,pH影响水中有机物的解离,而有机物的存在状态也与臭氧氧化过程有关[26]。由表2可知,在初始浓度为100 mg·L−1,pH为3.63、6.7和11.27的条件下,在30 min内,林可霉素臭氧氧化降解率分别为30.7%、47.5%和66.1%,由此可知,随着pH的增加,臭氧对林可霉素的降解效率逐渐提高。QIANG等[25]同样发现林可霉素在分子状态比质子化状态具有更强的降解活性。pH对水中臭氧的分解及羟基自由基的生成有重要影响:酸性条件下,臭氧分解缓慢,以分子形态直接氧化有机物;而在碱性条件下,臭氧经OH−离子催化分解生成羟基自由基(·OH)等活性基团[27],·OH与臭氧相比,具有更高的反应速率常数(107~109 L·(mol·s)−1)[28]。此外,还须指出臭氧氧化90 min后,不同pH条件下的林可霉素降解率依次为90.0%、90.9%和93.7%,降解率相差不大。其原因主要为:一方面,足够的反应时间后,臭氧分子也可以充分降解林可霉素;另一方面,溶液pH过高时,·OH之间容易发生淬灭反应,导致有机物的降解速率下降[29]。同时,由表2可知,在同样的降解时间内,碱性条件下消耗的臭氧量最多,酸性其次,中性条件下消耗最少。上述结果表明,碱性条件可促进林可霉素的臭氧氧化降解,但中性条件下,可兼顾抗生素的削减效果和臭氧消耗量。考虑到实际的林可霉素发酵废水pH通常为酸性(约4.4)[30],因此,后续模拟或实际废水实验均将pH调至中性。
-
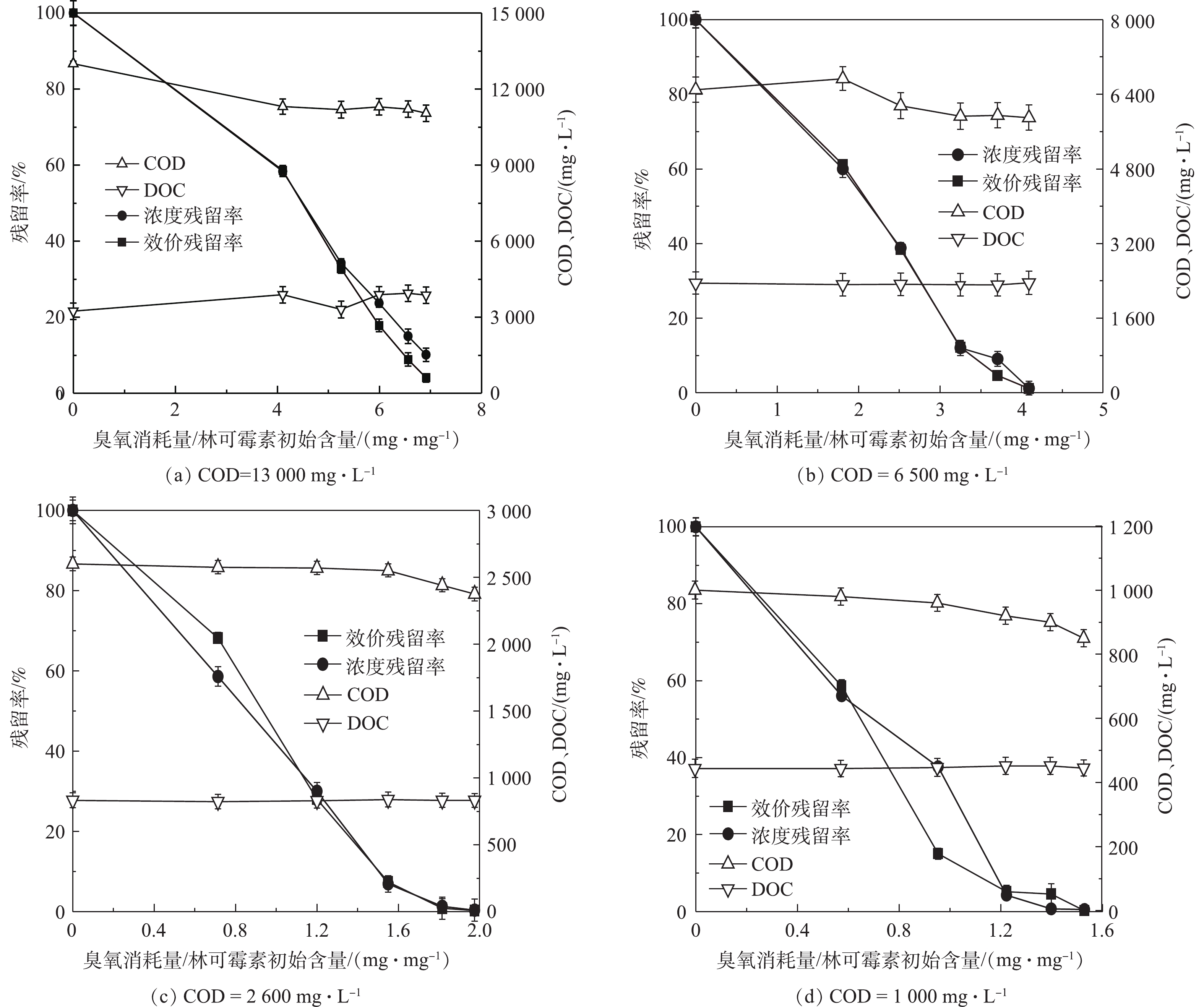
臭氧主要与化学污染物的双键和杂环结构等反应[31],而实际抗生素废水中除抗生素残留外通常还含有大量耗氧有机物(以COD计),并且不同的抗生素提取工艺导致废水中有机物含量也有所差异。这些实际废水中残留的有机物同样可能具有易于臭氧反应的官能团,因此,废水中背景COD可能会严重影响臭氧对抗生素的降解效果。我们用LB培养基溶液模拟抗生素发酵废水,通过控制初始林可霉素浓度(100 mg·L−1)不变的情况下改变LB培养基加入量以改变背景COD浓度的方法开展臭氧氧化实验,来考察废水背景COD对林可霉素臭氧氧化的影响。如图4和表1所示,不同COD背景下林可霉素臭氧氧化过程同样符合一级降解动力学。不同COD下实现林可霉素50%效价削减所需消耗的臭氧绝对量分别为230.66 (COD=13 000 mg·L−1)、112.64(COD=6 500 mg·L−1)、49.43(COD=2 600 mg·L−1)和38.94 (COD=1 000 mg·L−1),表明共存的高浓度耗氧有机物(以COD计)会延缓林可霉素的臭氧氧化过程。由上述结果计算得知,废水COD每增加100 mg·L−1,单位抗生素实现50%削减需要增加的臭氧消耗量约1.64 mg,结果可为林可霉素实际废水的臭氧氧化处理臭氧投量的计算提供参考。
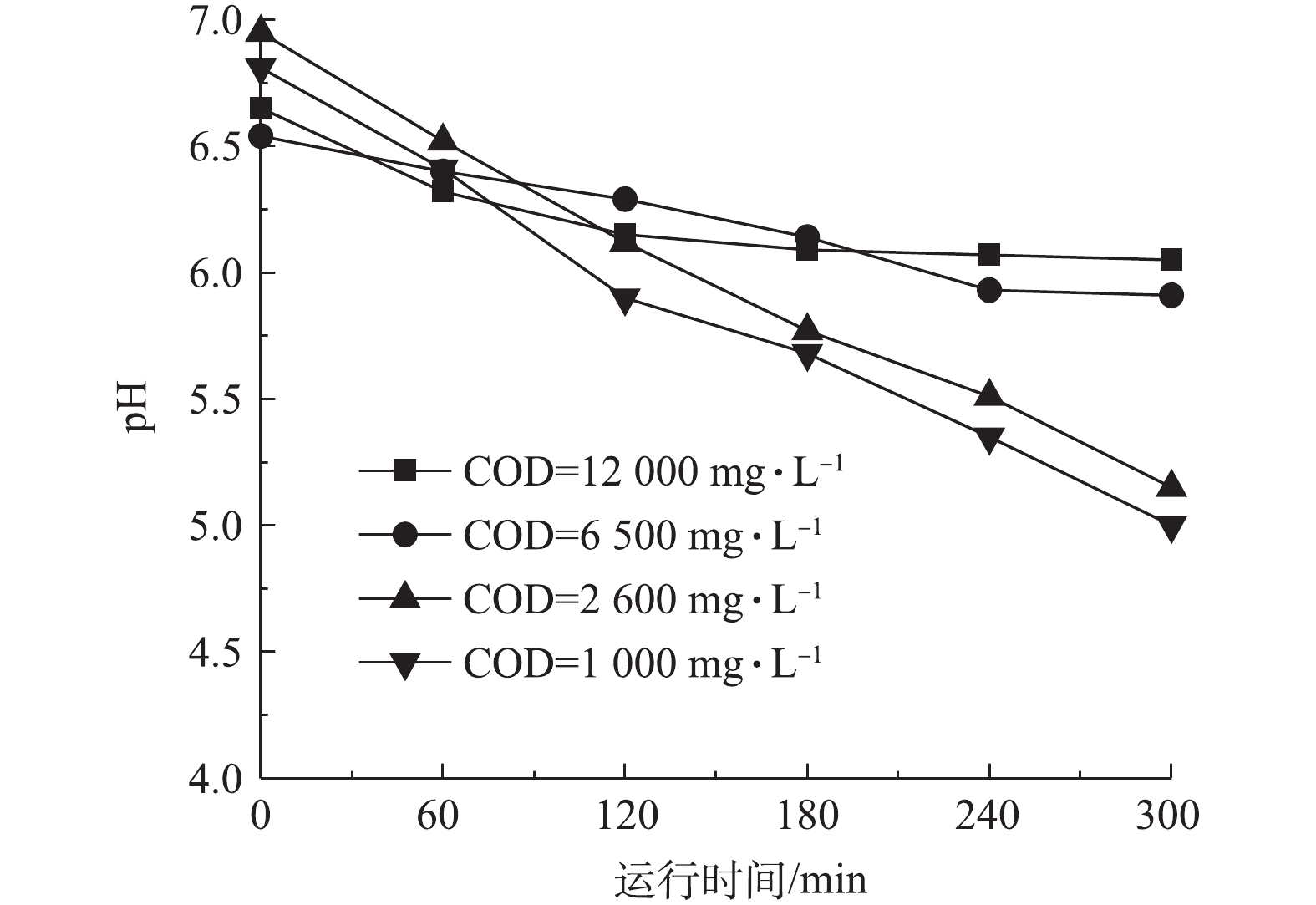
尽管COD添加实验中林可霉素的降解整体符合一级动力学曲线,但与纯水结果不同,COD添加实验在反应末期抗生素降解速率略有减缓,这可能与反应过程中溶液酸化有关。如图5所示,臭氧氧化后COD添加水样pH呈下降趋势,并且溶液COD越低,pH下降幅度越大。这可能是由于反应过程中水中COD被氧化,生成了小分子有机酸[31],降低了水样pH,而酸性环境下臭氧更容易保持稳定,不易分解产生强氧化性·OH,氧化过程的转变造成抗生素去除率的降低。上述结果表明实际抗生素废水臭氧处理过程中pH控制的重要性。
-
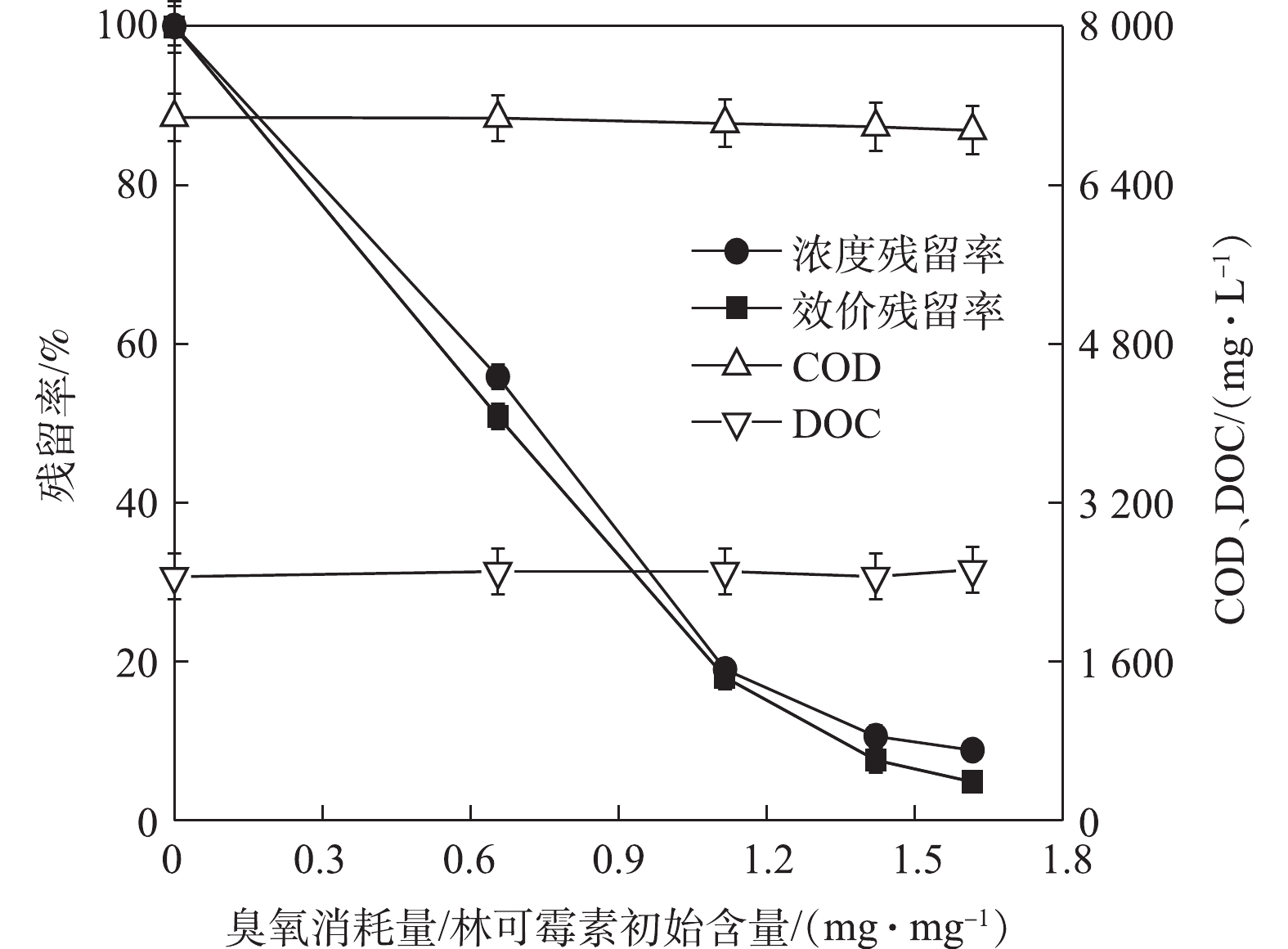
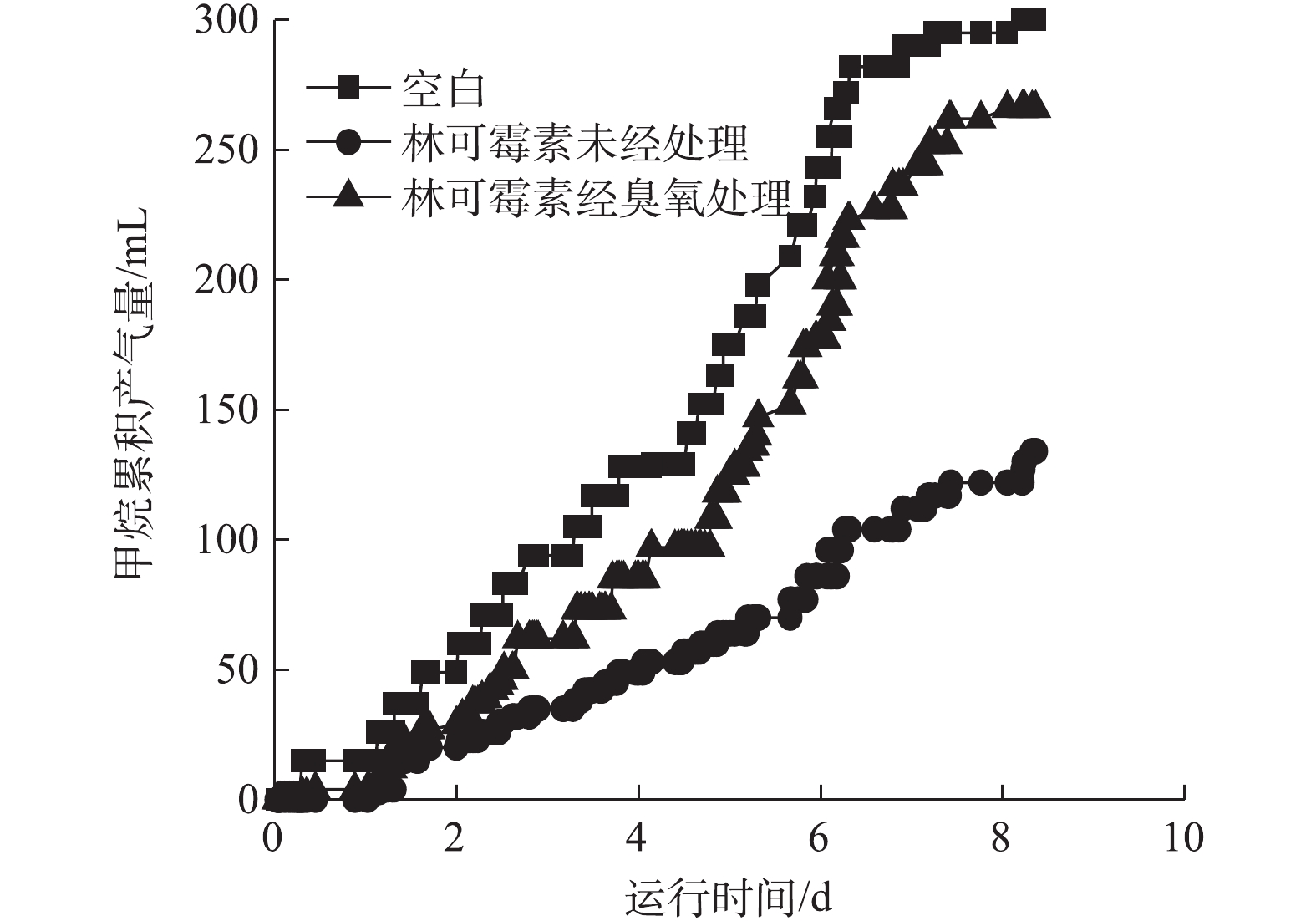
为了进一步验证臭氧氧化预处理的有效性,我们采用实际含有林可霉素废水(COD=7 800 mg·L−1,林可霉素浓度为1 000 mg·L−1)进行实验。如图6所示,臭氧氧化能够有效降解实际废水中林可霉素,当臭氧消耗量/林可霉素含量为1.62 mg·mg−1时,林可霉素效价降低了96%,同时降解过程中COD和DOC基本不变。抗生素发酵废水属于高浓度有机废水,而厌氧生化技术可以承受高有机负荷并可回收甲烷气,是上述废水的优选处理技术。实际的抗生素生产废水处理系统通常也是使用厌氧与好氧生物处理技术的串联实现废水达标排放[32-34],因此,进一步对处理前后的林可霉素废水进行厌氧可生化性评价,甲烷产量结果如图7所示。实际废水具有一定的产甲烷抑制性,导致甲烷产率较低,在200 h的实验周期内,累计甲烷产量仅为134 mL。而臭氧氧化后废水抑制性减弱,200 h的甲烷产量为266 mL,相对于未处理废水增加了98.51%,为空白对照组的88.67%。前面的结果已经表明,林可霉素臭氧化产物没有抑菌活性,因此,臭氧处理后实际废水的甲烷产量相对对照系统略低,可能与实际废水中有机物组成有关。对照系统使用醋酸钠做基质,产甲烷古菌可直接以其为基质进行甲烷代谢,而林可霉素发酵废水含有大量大分子有机物,厌氧甲烷代谢需要经历水解、酸化、产氢产乙酸和产甲烷等过程[35],导致产甲烷速率较慢。
2.1. 臭氧氧化对林可霉素效价的削减效果
2.2. 林可霉素效价与浓度的相关性
2.3. 初始pH对臭氧氧化林可霉素效果的影响
2.4. COD对臭氧氧化林可霉素效果的影响
2.5. 臭氧氧化处理实际林可霉素生产废水
-
1)臭氧氧化可有效降解林可霉素,降解过程符合一级降解动力学。
2) pH升高可促进林可霉素的臭氧氧化,但同时加快了臭氧的消耗,故综合考虑,建议在中性条件下处理林可霉素废水。
3)废水中COD可延缓林可霉素的降解,每增加COD 100 mg·L−1,单位抗生素实现50%的削减需要增加的臭氧量约为1.64 mg,此外,随着反应的进行,反应环境向酸性发展会降低反应速率。
4)臭氧预处理和厌氧生物处理的耦合工艺可以在有效降解林可霉素的同时,提高甲烷产率,具有实际应用潜力。







 下载:
下载: