-
我国在过去的几十年里,由于金属的大量开采和冶炼[1]、污水灌溉[2]、化肥的不合理施用[3],镉砷在农田土壤中不断地积累。镉砷是毒性较大的重金属,农田土壤中重金属总量超标现象会通过食物链对生态系统和人类的健康构成威胁。根据原环境保护部和国土资源部2014年4月公布的《全国土壤污染状况调查公报》[4],全国镉污染物点位超标率为7.0%,位居重金属污染物榜首;砷污染物点位超标率为2.7%,砷超标的问题也不容忽视。因此,土壤镉、砷超标的环境问题亟待解决。
修复重金属污染农田有多种修复技术,其中使用修复材料将农田土壤的重金属钝化的技术因其具有成本低廉、修复时间短、效果显著的优点[5],具有广泛的应用前景。然而,GONG等[6]认为,这些钝化技术的研究大多停留在条件容易控制的实验室研究阶段,实际应用条件的复杂性可能会影响修复效果及可行性。近年来,针对镉污染土壤现场修复有效的钝化材料包括生物炭材料[7]、磷酸盐材料[8]、黏土矿物[9]等,黏土矿物因其来源丰富、成本低廉、效果显著等特点已被广泛研究[6]。TAHERVAND等[10]发现,黏土矿物具有很强的吸附重金属的能力,但黏土矿物对重金属的吸附存在选择性。目前,研究用黏土矿物进行砷的固定修复的研究比较少,砷污染土壤的修复材料以铁基材料为主[11]。
镉砷是2种性质极不相同的元素,农田重金属污染大多是复合污染,适合镉单一污染修复的材料和适合砷单一污染修复的材料能否用于农田镉、砷复合污染修复尚有待研究。国内外的学者们普遍研究单一修复材料对农田重金属的钝化效果,而不同修复材料之间的修复效果缺乏比较。因此,本研究比较分析了不同修复材料(硅藻土、膨润土、海泡石、人造沸石)和农田调理剂对农田土壤镉、砷的钝化效果,探究了修复材料处理后土壤中的镉、砷的形态以及土壤理化性质的变化,通过种植水稻并检测水稻内的镉、砷含量来检验修复效果,从而为镉砷污染农田土壤现场修复提供参考。
-
供试土壤场地位于中国广东省佛山市三水区,农田大小约为6 660 m2,黄棕色黏质土,选取其中的42个点对农田的基本情况进行分析,土壤的基本理化性质如下:总镉0.95~1.50 mg·kg−1,总砷11.41~17.06 mg·kg−1,总铅30.92~42.82 mg·kg−1,总锌39.35~69.70 mg·kg−1,速效磷16.9~86.1 mg·kg−1,碱解氮73.2~117 mg·kg−1,有机质25.7~95.4 g·kg−1,阳离子交换量4.33~7.12 cmol·kg−1,pH为5.22~5.70。供试的修复材料有硅藻土、膨润土、海泡石、人造沸石和农田调理剂,均为化学纯,粒径均在微米级;农田调理剂是由硅、镁、磷等元素构成的复合材料。供试的水稻品种为油牙占。
-
修复材料处理方法如图1所示。育苗工作完成后,投加修复材料7 d后插秧,修复材料处理10 d后(插秧3 d后)施加尿素,修复材料处理17 d和24 d后施加氮磷复合肥。从插秧前到水稻分蘖期期间都是淹水处理,保证田间持水量达到60%~80%,到水稻分蘖数足够的时候开始晒田。
在修复材料处理30 d(水稻秧苗期)、60 d(分蘖期)、100 d(成熟期)时按蛇形取样法随机采集每块实验田的土壤样品,然后进行风干处理,在水稻成熟后按蛇形取样法随机采集水稻样品,每块实验田采集20株水稻。
-
土壤重金属总量的测定参考电感耦合等离子体质谱法[12];土壤重金属有效形态含量的测定参考电感耦合等离子体质谱法[13];Cd和As形态分布的测定参考Tessier提出的顺序提取程序(SEP)[14];参考钼锑抗分光光度法[15]检测土壤速效磷含量;参考《森林土壤氮的测定》[16]检测土壤碱解氮含量;参考分光光度法[17]检测土壤有机质含量;参考分光光度法[18]检测土壤阳离子交换量;参考《土壤pH的测定》[19]检测土壤的pH;参考《食品中镉的测定》[20]和《食品中总砷及无机砷的测定》[21]测定水稻中Cd和As的含量。
-
表1为实验田各时期Cd和As总量的平均值,总Cd含量高于风险筛选值,低于风险管控值,可能存在食用农产品不符合质量安全标准等土壤污染风险[22]。理论上,钝化材料的投加不会影响重金属在土壤中的总量,经检验,各组别的总Cd和总As的含量之间无显著差异(P<0.05)。土壤重金属总量在秧苗期、分蘖期、成熟期之间也无显著差异(P<0.05)。
-
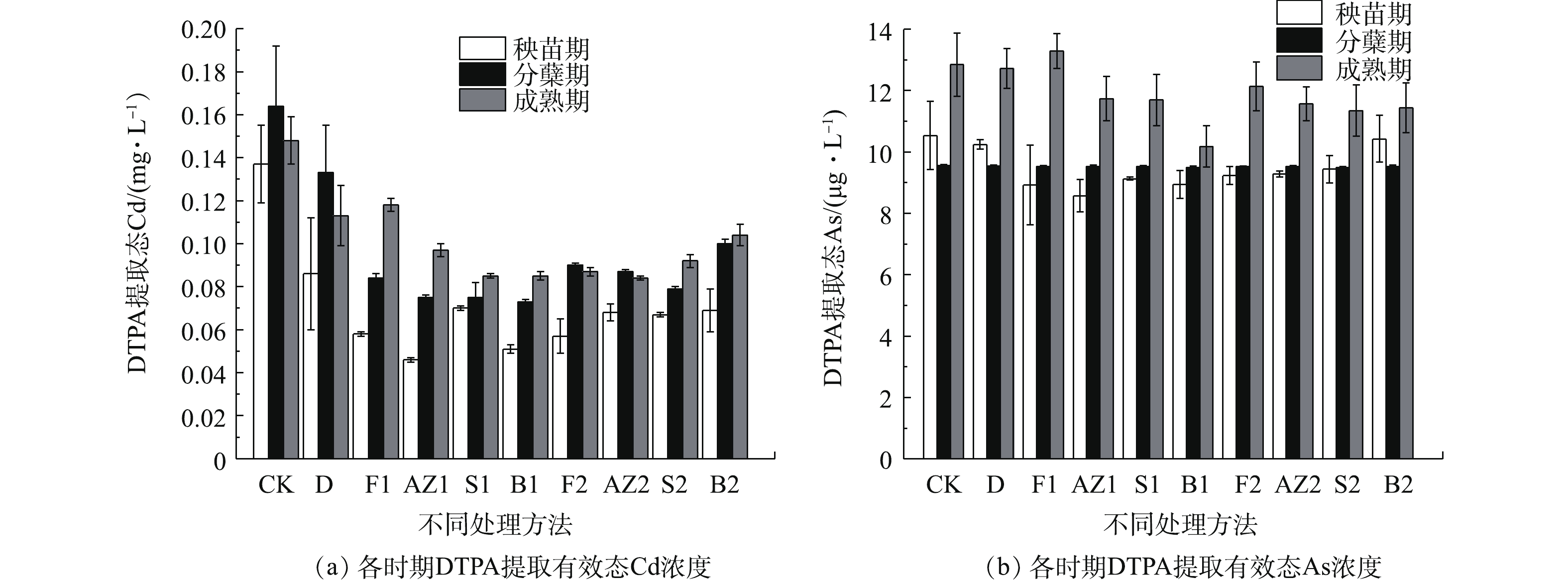
1)钝化材料对DTPA提取Cd有效性的影响。水稻的秧苗期、分蘖期、成熟期的DTPA浸出的平均Cd浓度如图2(a)所示,从秧苗期到分蘖期浸出液的平均Cd浓度有所提升,其原因可能是秧苗期水稻淹水程度较高,分蘖期水稻淹水程度较低,淹水程度高可以降低水稻吸收重金属Cd的效率[23-24]。跟CK对比,各种材料的浸出Cd浓度下降了20.3%~43.2%,S1、S2在处理初期就有较好的钝化效果,而F1和F2在成熟期的钝化效果最好,其原因可能是海泡石处理后迅速提高了土壤的pH和土壤中酶的活性[24],从而提高土壤中Cd的稳定性,而调理剂可能是通过与Cd形成磷酸盐沉淀,所以反应时间更长。
-
2)钝化材料对DTPA提取As有效性的影响。水稻的秧苗期、分蘖期、成熟期的DTPA浸出的平均As浓度如图2(b)所示,空白对照组浸出液的平均As浓度没有随时间发生显著变化,其他修复材料处理后浸出液的平均As浓度变化趋势与CK保持一致。跟CK相比,各组修复材料对砷都没有明显的修复效果,但维持着土壤中有效形态的As含量,没有造成有效态As显著提升的副作用。修复材料的种类和投加量对As的有效形态含量的改变无显著影响,因此,可以认为本研究中的硅藻土、调理剂、海泡石、人造沸石、膨润土等修复材料能显著降低土壤中DTPA提取Cd有效性的效果。
-
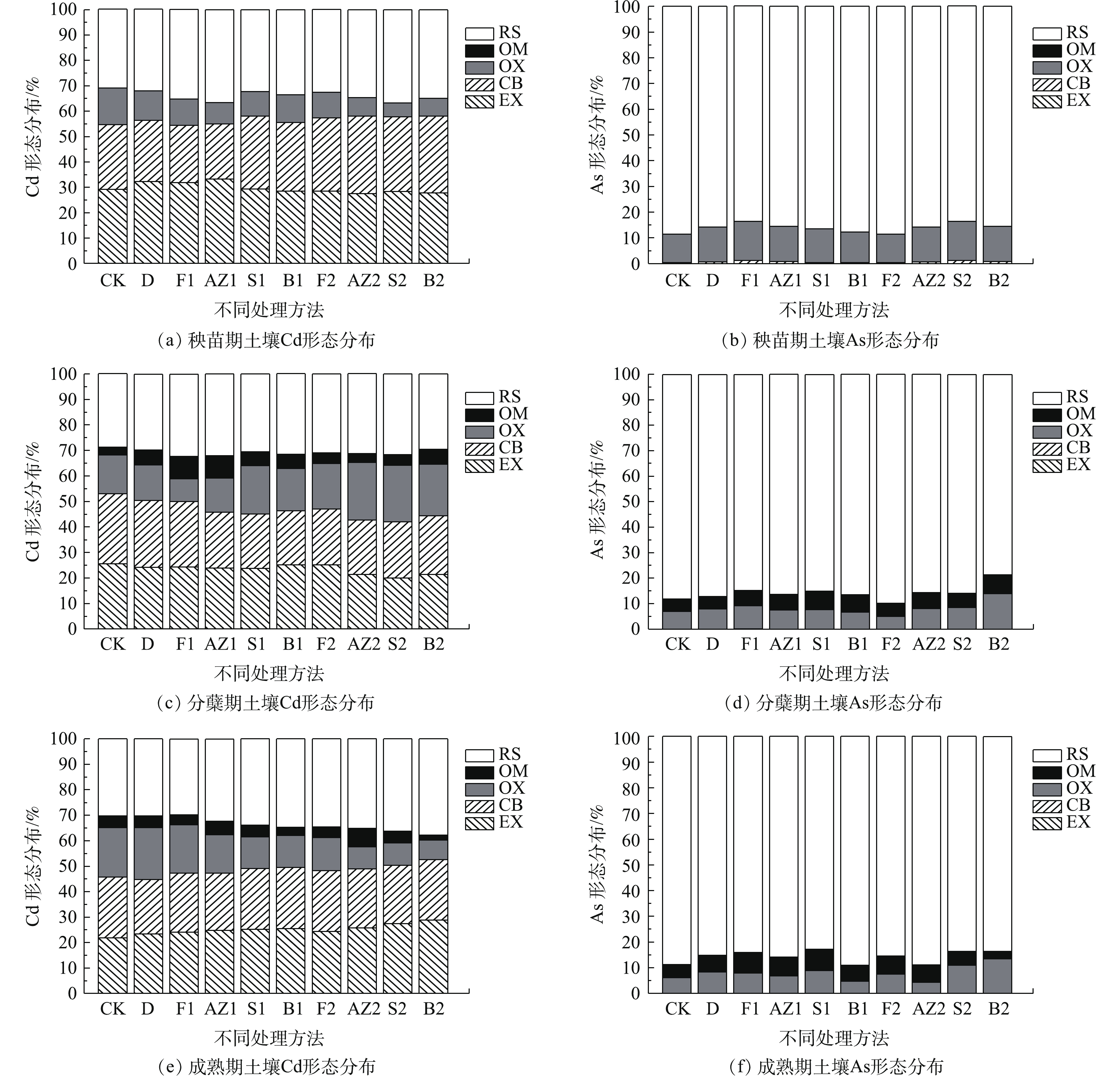
通过SEP连续提取法估算土壤中真实的重金属形态分布和机理[25-26]。在SEP连续提取法中,土壤中的重金属可以根据其在土壤中的稳定性划分为可交换态(EX)、碳酸盐结合态(CB)、铁锰氧化态(OX)、有机结合态(OM)和残余态(RS),各种形态的稳定性顺序为EX<CB<OX<OM<RS。结合图3(a)、图3(c)、图3(e)来看,CK从秧苗期到成熟期的OM形态上升可能是秧苗期后给农田中的水稻追肥所致,修复材料处理后RS形态与CK相比有所提高,其中AZ2、S2、B2的提高幅度比较明显,这说明人造沸石、海泡石、膨润土可能主要以沉淀的方式固定Cd。结合图3(b)、图3(d)、图3(f)来看,空白对照组的OM形态的As含量有所上升,这说明可能是秧苗期前后投加的肥料使OX形态的砷转化为OM形态,或者是由其他农艺因素引起的。其余修复材料处理后,As的各种形态变化趋势与CK相似,这说明修复材料对土壤中As的形态变化无显著影响。
-
不同修复材料处理后土壤的pH如表2所示。在秧苗期,pH提高的幅度依次为人造沸石粉>海泡石粉>调理剂>膨润土,投加硅藻土后农田土壤的pH反而略有下降。在分蘖期和成熟期,经修复材料处理后农田土壤的pH的变化趋势基本与秧苗期的一致,硅藻土的pH与CK基本一致,其余修复材料处理后的土壤pH均有不同程度地提高,提高的幅度依次为人造沸石粉>海泡石粉>膨润土>调理剂。
土壤溶液中的氮、磷元素是植物的主要氮源和磷源,也是衡量土壤肥力的重要指标[24];同时,还有研究表明,速效磷有利于土壤中的Cd形成沉淀[27]。不同修复材料处理后土壤的速效磷含量如表2所示,在秧苗期,经F2处理后,速效磷含量有所提高,与CK存在显著差异,其余修复材料处理后与CK没有较大差异;在成熟期,F1和F2处理后土壤的速效磷含量与CK相比,提升幅度最大,这说明使用调理剂能在较短时间内大幅度提高土壤速效磷含量,其余修复材料处理后,速效磷与CK一致。
不同修复材料处理后,土壤的碱解氮含量如表2所示,在秧苗期,土壤碱解氮的含量高于分蘖期和成熟期,其原因可能是秧苗期前后施加了尿素和复合肥。在秧苗期,经修复材料S1、AZ2、S2、B2处理后,农田土壤的碱解氮含量与CK相比明显提高。在分蘖期和成熟期,各种修复材料处理后,农田土壤的碱解氮含量与空白对照组相比没有显著性差异,这说明修复材料投加后的短时间内,土壤的碱解氮含量会有所提升,经过一段时间后,会恢复到空白对照组的水平。
土壤有机质是土壤肥力的物质基础,其对土壤肥力有多方面的作用[28]。不同修复材料处理后土壤的有机质含量如表2所示,在秧苗期,经修复材料S1和S2处理后,农田的有机质含量与CK相比有所下降,这说明海泡石粉使用初期容易使土壤的有机质减少。在分蘖期,各组实验田的有机质含量与CK相比基本上没有显著差异;在成熟期,除B2处理后农田的有机质含量与CK相比有所下降,其余修复材料处理后农田的有机质含量与CK相比没有显著差异。
阳离子交换量可以用来估算土壤吸收、保留和交换阳离子的能力。不同修复材料处理后土壤的阳离子交换量如表2所示。在秧苗期和分蘖期,部分修复材料处理后的阳离子交换量有所提高,与CK存在显著差异;在成熟期,只有B2处理后的阳离子交换量与CK相比存在较大差异,其原因可能是膨润土富含大量的阳离子,阳离子与土壤中的重金属离子发生交换[29]。这说明修复材料投加后的短时间内土壤的阳离子交换量会有所提升,经过一段时间后,阳离子交换量基本上会恢复到没有修复材料处理过的空白对照组的水平。
-
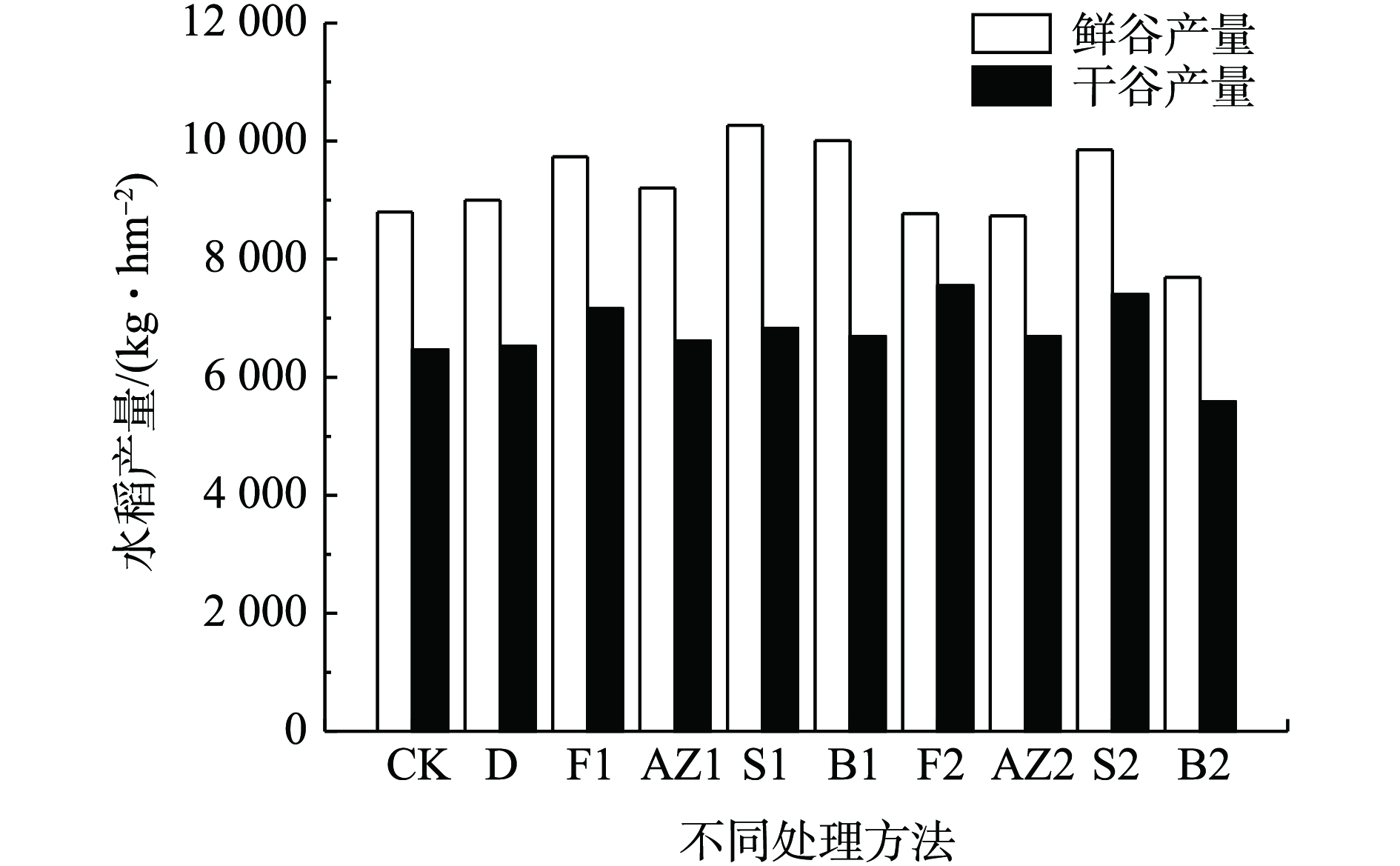
水稻的产量是评价修复材料是否适合农田修复的重要指标,水稻的产量因品种不同、气候不同等因素存在差异。不同修复材料处理后水稻的收成情况如图4所示,各组的水稻产量存在差异,空白对照组的鲜谷产量为8 800 kg·hm−2。经修复材料处理后,水稻的鲜谷产量均有不同程度地增加,其中S1、B1、S2和F1处理后的鲜谷产量最高。空白对照组的干谷产量为6 466 kg·hm−2,除B2外,经修复材料处理后,水稻的干谷产量均有不同程度地增加,其中F2、S2和F1处理后的干谷产量最高,分别为7 549、7 400、7 160 kg·hm−2,分别增产16.74%、14.43%、10.72%。水稻增产的原因可能是因为修复材料缓解了Cd抑制水稻生长的不良影响[30],提高土壤pH从而提高植物的酶活性;同时,磷是作物生长的必需元素,结合土壤速效磷含量的数据可知,调理剂提高了土壤速效磷浓度,有利于水稻的光合作用、碳水化合物运输、氮元素的代谢和脂肪生成,从而提高水稻的产量[31]。
-
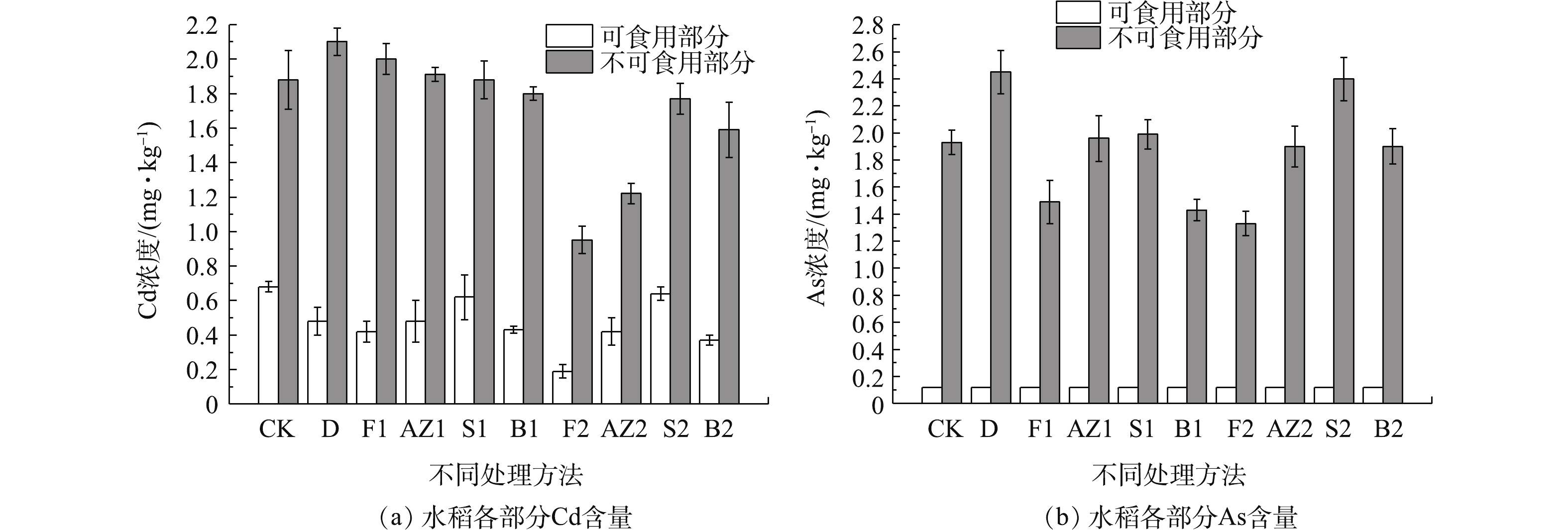
农田修复最关键的是让水稻可食用部分的重金属含量可以满足人体健康食用。水稻可食用部分的Cd含量如图5(a)所示,空白对照组水稻可食用部分的平均Cd含量为《食品中污染物限量》[32]中标准值(0.20 mg·kg−1)的3.4倍。F2处理后水稻可食用部分的Cd含量最低,平均含量为0.19 mg·kg−1,符合《食品中污染物限量》[32]的食用标准值,其他修复材料处理后的平均Cd含量均超出相关标准[32],F2处理后水稻可食用部分的Cd含量与CK相比下降了72%,与MENG等[33]使用的碱性修复材料的修复效果相似,F2处理后速效磷含量和Cd残余态含量均有所提高,因此,调理剂的修复机理可能是调理剂以磷酸盐沉淀固定Cd[27]。B2和AZ2处理后水稻可食用部分与CK相比分别下降了46%和38%,效果没有调理剂明显,膨润土可能是通过离子交换抑制水稻吸收Cd,人造沸石可能是通过表面吸附和沉淀来钝化重金属[34]。F1处理后,水稻可食用部分的Cd含量为0.42 mg·kg−1,与F2存在显著差异,其余修复材料也有相似的规律。这说明在一定范围内,投加量越高,修复材料的修复效果越好,修复材料的投加量和修复材料的种类相比,修复材料的投加量对修复材料修复效果的影响更大。
水稻可食用部分的As含量如图5(b)所示,空白对照组水稻可食用部分的As含量为0.12 mg·kg−1,未超过《食品中污染物限量》的标准值(0.20 mg·kg−1)[32]。修复材料处理后,水稻可食用部分的As含量均是0.12 mg·kg−1,As含量也未超过标准值。
水稻不可食用部分的Cd含量如图5(a)所示,空白对照组的不可食用部分Cd的平均浓度为1.88 mg·kg−1,F2、AZ2和B2处理后水稻的不可食用部分Cd的平均浓度与CK存在显著差异,其中F2与CK相比下降了49.5%,下降幅度最大。其余的修复材料处理后,水稻的不可食用部分Cd与CK没有太大的差异。
水稻不可食用部分的As含量如图5(b)所示,F2与CK相比下降了31.1%,B1和F1与CK相比下降了25.9%和22.8%。其余的修复材料处理后,与CK没有显著差异。海泡石粉、膨润土的投加量对阻止As进入水稻不可食用部分有显著的影响,海泡石粉、膨润土的投加量越高,则会促进As进入水稻的不可食用部分,原因可能是海泡石粉、膨润土的投加量越高,土壤的pH提升越显著,导致含砷沉淀物中的As得到释放,As的迁移能力得到提高[35]。
-
1)跟其他修复材料相比,调理剂的修复效果最好,既能有效地阻止Cd进入水稻的可食用部分和不可食用部分,也能提升水稻干谷产量,且提升幅度比其他修复材料更高。因此,调理剂具有修复Cd和As污染农田的应用前景。1 kg·m−2投加量的调理剂修复效果比0.5 kg·m−2的调理剂更好。
2)膨润土具备修复Cd污染农田的能力。0.5 kg·m−2投加量的膨润土能有效地阻止Cd进入水稻的可食用部分和不可食用部分,提升水稻干谷产量。但1 kg·m−2投加量的膨润土会减少水稻干谷产量,故膨润土的投加量要根据实际情况考虑。
3)人造沸石具备修复Cd污染农田的能力,能有效地阻止Cd进入水稻的可食用部分。投加人造沸石粉对水稻产量没有较大的影响。1 kg·m−2投加量的人造沸石修复效果比0.5 kg·m−2的人造沸石更好。
4)海泡石粉可以降低农田土壤中Cd的迁移能力,但无法有效地阻止Cd和As进入水稻的可食用部分和不可食用部分。海泡石粉处理后能提高水稻干谷产量。
5)硅藻土能抑制Cd进入水稻的可食用部分,促进Cd和As进入水稻的不可食用部分。因此,这种情况下建议不要将水稻的不可食用部分还田,以减少农田中重金属的总量。投加硅藻土对水稻产量没有较大的影响。
5种钝化剂对镉砷污染稻田的田间修复效果对比
Comparative of the field remediation effect of cadmium and arsenic contaminated paddy by five passivators
-
摘要: 为选取费效比高的镉砷复合污染稻田土壤修复材料,比较了黏土矿物和调理剂不同投加组合对稻田土壤中镉砷的田间修复效果,并且针对种植水稻进行了修复效果的验证;研究了修复前后稻田土壤镉砷的有效形态变化、镉砷的形态分布变化、土壤理化性质变化、成熟期水稻产量和水稻各部分镉砷的含量。结果表明,修复100 d后,不同修复材料的二乙烯三胺五乙酸提取态Cd浓度与空白对照组相比均有明显下降;各修复材料均能提高土壤中Cd的残余态(RS)和As的有机结合态(OM)。修复材料处理后,土壤pH均有所提升,其他理化性质初期虽有所变化,但最终会恢复到空白对照组的水平附近;除1 kg·m−2的膨润土处理外,其他材料处理后水稻干谷产量均有所提升;农田调理剂处理后水稻的可食用部分Cd含量最低,修复率达到72.0%。水稻的可食用部分As含量无显著差异,籽粒中Cd和As平均含量符合食用标准。调理剂在田间修复镉砷复合污染稻田土壤中有明显优势,黏土矿物仅适用于镉污染农稻田土壤的修复。Abstract: In order to select high cost-effectiveness remediation materials for Cd-As combined contaminated paddy soil, the field remediation effects of Cd-As in paddy soil by the different combinations of clay minerals and conditioner(F) were compared, and their remediation effects were verified by rice planting. For the paddy soils before and after remediation, the available contents and the species distribution of Cd and As in them, their physical and chemical properties, the yield of rice at maturity and the content of cadmium and arsenic in various parts of rice were studied. The results showed that the extractable Cd concentration of diethylenetriamine pentaacetic acid from 100 d remediated paddy soils with different repair materials decreased significantly, which were compared with the blank control group. The actions of each remediation material could improve the residual state (RS) of Cd and the organic binding state (OM) of As in soil. The soil pH increased after the treatment of the remediation materials, and some changes occurred at first for other physical and chemical properties, while these properties could restored to the level of the blank control group at last. Except for bentonite treatment with 1 kg·m−2, the dry grain yield per mu of rice increased when paddy was treated by other materials. After conditioner (F2) remediation, Cd content in edible part of rice was the lowest, and the recovery rate reached 72.0%. There was no significant difference in As content in edible parts of rice, and the average contents of Cd and As in grains met the food standard. Conditioner has obvious advantages in field remediation of Cd-As contaminated paddy soil, while clay minerals are only suitable for remediation of Cd contaminated paddy soil.
-
Key words:
- cadmium contamination /
- arsenic contamination /
- paddy soil /
- clay minerals /
- farm conditioner /
- field remediation
-
表 1 实验田各时期Cd和As总量
Table 1. Total cadmium and arsenic content in paddy field during different periods
mg·kg−1 样品 总Cd浓度 总As浓度 秧苗期 分蘖期 成熟期 秧苗期 分蘖期 成熟期 CK 1.22 1.13 1.16 14.10 14.05 14.28 D 1.16 1.13 1.13 13.20 13.62 14.01 F1 1.06 1.08 1.15 17.06 14.06 14.15 AZ1 1.06 1.09 1.07 16.84 13.49 13.83 S1 1.12 1.11 1.01 15.66 13.25 13.37 B1 1.10 1.09 0.99 15.19 13.24 13.32 F2 1.09 1.12 1.02 15.76 13.07 13.94 AZ2 1.07 1.12 1.00 13.96 12.81 12.85 S2 1.05 1.11 0.97 14.02 12.77 11.44 B2 0.99 1.10 0.95 16.76 11.41 11.17 表 2 土壤理化性质的变化
Table 2. Changes of basic physical and chemical properties of soil
阶段 样品 pH 速效磷/(mg·kg−1) 碱解氮/(mg·kg−1) 有机质/(g·kg−1) 阳离子交换量/(cmol·kg−1) 秧苗期 CK 6.02±0.01 33.9±10.2 148±6 32.1±0.8 7.53±0.01 D 5.91±0.07 29.3±2.2 165±0 30.5±0.3 7.74±0.07 F1 6.93±0.04 42.0±4.2 142±25 28.3±5.6 9.16±0.03 AZ1 7.61±0.01 25.1±9.1 137±10 27.6±4.5 7.66±0.30 S1 6.99±0.05 27.4±6.0 204±4 22.8±2.7 8.41±0.64 B1 6.19±0.13 28.7±6.0 164±15 24.0±0.1 8.75±0.01 F2 6.95±0.01 119±27.5 170±5 27.1±4.2 9.38±0.13 AZ2 7.30±0.25 31.1±4.7 292±4 23.7±1.1 8.42±0.55 S2 7.36±0.13 38.3±0.5 320±4 20.0±1.1 9.71±0.02 B2 6.23±0.08 28.4±6.4 330±3 26.1±0.1 8.92±0.13 分蘖期 CK 5.60±0.03 15.9±1.0 88.6±0.2 36.9±0.2 6.10±0.30 D 5.40±0.12 17.3±3.3 81.8±4.8 27.6±5.2 7.70±1.30 F1 5.93±0.04 26.9±1.8 84.7±3.9 30.1±5.3 7.04±1.16 AZ1 6.86±0.02 14.8±0.3 85.5±1.1 38.2±2.3 7.60±0.20 S1 6.49±0.11 14.7±1.8 86.6±9.6 29.3±0.5 9.80±0.20 B1 6.55±0.00 17.2±0.1 77.1±0.1 34.3±0.6 7.14±0.74 F2 6.35±0.01 35.0±4.7 85.6±8.4 22.8±6.9 5.00±0.40 AZ2 6.47±0.03 33.0±2.3 74.0±0.2 14.8±7.4 5.30±0.10 S2 6.38±0.02 22.1±0.1 96.5±7.4 33.9±1.0 5.50±0.30 B2 5.92±0.01 34.1±0.4 73.7±3.0 34.1±8.9 6.64±0.04 成熟期 CK 5.89±0.01 21.3±5.9 95.8±14.9 21.9±3.8 5.88±0.04 D 5.62±0.02 20.7±0.3 106±4.2 33.1±1.8 6.24±0.04 F1 6.18±0.02 45.5±3.4 86.0±3.5 34.4±2.0 7.74±1.30 AZ1 6.64±0.01 21.5±0.9 89.0±0.1 35.7±4.8 6.14±0.30 S1 6.33±0.21 19.5±0.4 95.4±3.3 35.8±0.9 6.27±0.19 B1 6.29±0.02 9.90±0.6 94.4±11.8 30.2±4.5 6.27±0.19 F2 6.27±0.04 41.5±2.7 87.8±1.7 31.3±0.2 5.11±0.19 AZ2 7.07±0.02 26.1±0.7 98.2±8.7 23.4±6.4 5.11±0.19 S2 6.93±0.08 23.6±1.0 101±5.4 22.2±1.5 6.76±0.10 B2 6.59±0.06 29.6±0.8 76.9±0.2 15.0±3.6 8.32±0.49 -
[1] ETTLER V, KRIBEK B, MAJER V, et al. Differences in the bioaccessibility of metals/metalloids in soils from mining and smelting areas (Copperbelt, Zambia)[J]. Journal of Geochemical Exploration, 2012, 113(1): 68-75. [2] CHARY N, KAMALA C D. Assessing risk of heavy metals from consuming food grown on sewage irrigated soils and food chain transfer[J]. Ecotoxicology and Environmental Safety, 2008, 69(3): 513-524. doi: 10.1016/j.ecoenv.2007.04.013 [3] HUANG S S, LIAO Q L, HUA M, et al. Survey of heavy metal pollution and assessment of agricultural soil in Yangzhong district, Jiangsu Province, China[J]. Chemosphere, 2007, 67(11): 2148-2155. doi: 10.1016/j.chemosphere.2006.12.043 [4] 环境保护部, 国土资源部. 全国土壤污染状况调查公报[J]. 中国环保产业, 2014, 36(5): 10-11. [5] MICHALKOVA Z, KOMAREK M, SILLEROVA H, et al. Evaluating the potential of three Fe- and Mn-(nano)oxides for the stabilization of Cd, Cu and Pb in contaminated soils[J]. Journal of Environmental Management, 2014, 146(8): 226-234. [6] GONG Y, ZHAO D, WANG Q. An overview of field-scale studies on remediation of soil contaminated with heavy metals and metalloids: Technical progress over the last decade[J]. Water Research, 2018, 147: 440-460. doi: 10.1016/j.watres.2018.10.024 [7] BIAN R, LI L, BAO D, et al. Cd immobilization in a contaminated rice paddy by inorganic stabilizers of calcium hydroxide and silicon slag and by organic stabilizer of biochar[J]. Environmental Science and Pollution Research, 2016, 23(10): 10028-10036. doi: 10.1007/s11356-016-6214-3 [8] WANG B, XIE Z, CHEN J, et al. Effects of field application of phosphate fertilizers on the availability and uptake of lead, zinc and cadmium by cabbage (Brassica chinensis L.) in a mining tailing contaminated soil[J]. Journal of Environmental Sciences, 2008, 20(9): 1109-1117. doi: 10.1016/S1001-0742(08)62157-9 [9] SUN Y B, LI Y, XU Y M, et al. In situ stabilization remediation of cadmium (Cd) and lead (Pb) co-contaminated paddy soil using bentonite[J]. Applied Clay Science, 2015, 105: 200-206. [10] TAHERVAND S, JALALI M. Sorption and desorption of potentially toxic metals (Cd, Cu, Ni and Zn) by soil amended with bentonite, calcite and zeolite as a function of pH[J]. Journal of Geochemical Exploration, 2017, 181: 148-159. doi: 10.1016/j.gexplo.2017.07.005 [11] ZHAO F J, MCGRATH S P, MEHARG A A. Arsenic as a food chain contaminant: Mechanisms of plant uptake and metabolism and mitigation strategies[J]. Annual Review of Plant Biology, 2010, 61(1): 535-559. doi: 10.1146/annurev-arplant-042809-112152 [12] 中华人民共和国生态环保部. 土壤和沉积物12种金属元素的测定王水提取-电感耦合等离子体质谱法: HJ 803-2016[S]. 北京: 中国环境科学出版社, 2016. [13] 中华人民共和国生态环保部. 土壤8种有效态元素的测定二乙烯三胺五乙酸浸提-电感耦合等离子体质谱法: HJ 804-2016[S]. 北京: 中国环境科学出版社, 2016. [14] TESSIER A, CAMPBELL P G, BISSON M. Sequential extraction procedure for the speciation of particulate trace metals[J]. Analytical Chemistry, 1979, 51(7): 844-851. doi: 10.1021/ac50043a017 [15] 中华人民共和国生态环保部. 土壤有效磷的测定碳酸氢钠浸提-钼锑抗分光光度法: HJ 704-2014[S]. 北京: 中国环境科学出版社, 2014. [16] 中华人民共和国国家林业局. 森林土壤氮的测定: LY/T 1228-2015[S]. 北京: 中国环境科学出版社, 2015. [17] 中华人民共和国生态环保部. 土壤有机碳的测定重铬酸钾氧化-分光光度法: HJ 615-2011[S]. 北京: 中国环境科学出版社, 2011. [18] 中华人民共和国生态环保部. 土壤阳离子交换量的测定三氯化六氨合钴浸提-分光光度法: HJ 889-2017[S]. 北京: 中国环境科学出版社, 2017. [19] 中华人民共和国农业部. 土壤pH的测定: NY/T 1377-2007[S]. 北京: 中国环境科学出版社, 2007. [20] 中华人民共和国国家卫生和计划生育委员会. 食品中镉的测定: GB 5009.15-2014[S]. 北京: 中国环境科学出版社, 2014. [21] 中华人民共和国国家卫生和计划生育委员会. 食品中总砷及无机砷的测定: GB 5009.11-2014[S]. 北京: 中国环境科学出版社, 2014. [22] 中华人民共和国生态环保部. 土壤环境质量农用地土壤污染风险管控标准(试行): HJ/T 15618-2018[S]. 北京: 中国环境科学出版社, 2017. [23] YE X, LI H, ZHANG L, et al. Amendment damages the function of continuous flooding in decreasing Cd and Pb uptake by rice in acid paddy soil[J]. Ecotoxicology and Environmental Safety, 2018, 147: 708-714. doi: 10.1016/j.ecoenv.2017.09.034 [24] LI J, XU Y. Effects of clay combined with moisture management on Cd immobilization and fertility index of polluted rice field[J]. Ecotoxicology and Environmental Safety, 2018, 158: 182-186. doi: 10.1016/j.ecoenv.2018.04.031 [25] FILIP M G T, MARC G V. Single extractions versus sequential extraction for the estimation of heavy metal fractions in reduced and oxidized dredged sediments[J]. Chemical Speciation and Bioavailability, 1999, 11(2): 43-50. doi: 10.3184/095422999782775708 [26] ZHU Y G, CHEN S B, YANG J C. Effects of soil amendments on lead uptake by two vegetable crops from a lead-contaminated soil from Anhui, China[J]. Environment International, 2004, 30(3): 351-356. doi: 10.1016/j.envint.2003.07.001 [27] CAO X, DERMATAS D, XU X, et al. Immobilization of lead in shooting range soils by means of cement, quicklime, and phosphate amendments[J]. Environmental Science and Pollution Research, 2008, 15(2): 120-127. doi: 10.1065/espr2007.05.416 [28] LIU Y, WANG Y, LU H, et al. Biochar application as a soil amendment for decreasing cadmium availability in soil and accumulation in Brassica chinensis[J]. Journal of Soils and Sediments, 2018, 18(7): 2511-2519. doi: 10.1007/s11368-018-1927-1 [29] KAYA A, OREN A H. Adsorption of zinc from aqueous solutions to bentonite[J]. Journal of Hazardous Materials, 2005, 125(1): 183-189. [30] 何俊瑜, 任艳芳, 朱诚期, 等. 镉胁迫对镉敏感水稻突变体活性氧代谢及抗氧化酶活性的影响[J]. 生态环境, 2008(3): 1004-1008. doi: 10.3969/j.issn.1674-5906.2008.03.025 [31] 黄晶, 张杨珠, 徐明岗, 等. 长期施肥下红壤性水稻土有效磷的演变特征及对磷平衡的响应[J]. 中国农业科学, 2016, 49(6): 1132-1141. [32] 中华人民共和国国家卫生和计划生育委员会. 食品中污染物限量: GB 2762-2017[S]. 北京: 中国环境科学出版社, 2017. [33] MENG J, ZHONG L, WANG L, et al. Contrasting effects of alkaline amendments on the bioavailability and uptake of Cd in rice plants in a Cd-contaminated acid paddy soil[J]. Environmental Science and Pollution Research, 2018, 25(9): 8827-8835. doi: 10.1007/s11356-017-1148-y [34] PENG Z, WEN J, LIU Y, et al. Heavy metal leachability in soil amended with zeolite- or biochar-modified contaminated sediment[J]. Environmental Monitoring and Assessment, 2018, 190(12): 751. doi: 10.1007/s10661-018-7124-2 [35] CUI Y, DU X, WENG L, et al. Assessment of in situ immobilization of lead (Pb) and arsenic (As) in contaminated soils with phosphate and iron: Solubility and bioaccessibility[J]. Water, Air, & Soil Pollution, 2010, 213(1/2/3/4): 95-104. -




 下载:
下载: