-
随着各地餐厨垃圾的产生量日益增加,餐厨垃圾的处理压力亦越来越大。由于餐厨垃圾具有含水率高、易腐败等特性,如不及时处理会给城市环境带来巨大的压力,因此,对餐厨垃圾进行有效处置越来越受到重视[1]。厌氧发酵技术是目前餐厨垃圾处理的主要方法之一,该技术利用厌氧微生物的代谢作用将餐厨垃圾进行高效降解,在处理垃圾的同时产生能源气体——沼气[2]。
通常情况下,厌氧发酵产生的沼气中含有40%~60%的CH4,25%~50%的CO2以及N2,H2S等其他微量气体。目前,沼气主要用来发电和供热[3-4]等,但大量CO2的存在降低了沼气的热值(2.1×104~2.8×104 kJ·m−3),如能去除沼气中的CO2,则CH4浓度可达到95%以上,成为生物甲烷,这可大大提高沼气的热值(3.3×104~3.8×104 kJ·m−3),同时能扩大沼气的利用方式[5-6]。生物甲烷不仅能作为天然气的替代品,还能用作汽车燃料等[7-8]。在沼气的生物提纯过程中,CO2能被嗜氢产甲烷菌直接代谢为CH4和H2O(见式(1)),这不仅提高了CH4含量,还避免了其他副产物的产生[9]。沼气生物提纯可分为原位和异位2种方式,原位通入H2不需要额外的装置,经济性较好,但可能会破坏原有的反应体系[10]。基于相分离的异位甲烷提纯具有较好的可操作性,通过厌氧微生物和嗜氢产甲烷菌的分离富集,可使提纯效率更加高效[11]。
近年来,对沼气异位生物提纯的研究越来越受到重视,包括对提纯过程中的温度[10],pH[12],气液传质[13]以及厌氧颗粒污泥特性[14]等的研究。在各种反应条件中,通气比例被认为是沼气异位生物提纯的重要参数之一,合适的通气比例可使提纯更加经济高效。如果通气比例过低,则不能为嗜氢产甲烷菌提供足够的底物;而通气比例过高,则会破坏体系稳定。MARTIN等[15]研究了通H2和CO2混合气比例为4∶1情况下的产甲烷速率,在顶空加压的情况下,增大了H2气液传质,获得了较高的产甲烷速率;但由于成本问题,加压在规模化利用中并不适用,如能获得最佳的混合气通入比例,则可实现气体的充分利用,在不需加压的情况下同样可实现较高的甲烷产量。在沼气生物提纯研究中,厌氧消化产沼气的底物有葡萄糖[16]、秸秆[17]以及乳清和牛粪[18]等,但目前以餐厨垃圾为底物进行沼气发酵,同时进行异位提纯的研究较少。
本研究对餐厨垃圾厌氧发酵和沼气生物提纯进行了耦联探讨,在此基础上,对提纯相的通气比例进行了优化分析。实验中首先将餐厨垃圾进行厌氧发酵,对产生的沼气进行异位提纯,提纯相中通入的H2和CO2比例为4∶1;然后对提纯阶段的通气比例进行研究,设置不同的H2∶CO2比,旨在获得最佳通气比;最后,将餐厨垃圾厌氧发酵与最佳通气比的沼气生物提纯进行联合实验。
全文HTML
-
实验所用的餐厨垃圾取自江南大学第2食堂,收集的餐厨垃圾经人工分拣去除其中的骨头、纸、塑料袋等后进行破碎,干化处理后备用。接种污泥取自无锡市甜丰食品加工厂的厌氧发酵罐,为厌氧颗粒污泥,实验前,在(37±1) ℃下活化1周后作为接种污泥。餐厨垃圾与接种污泥的基本性质见表1。
-
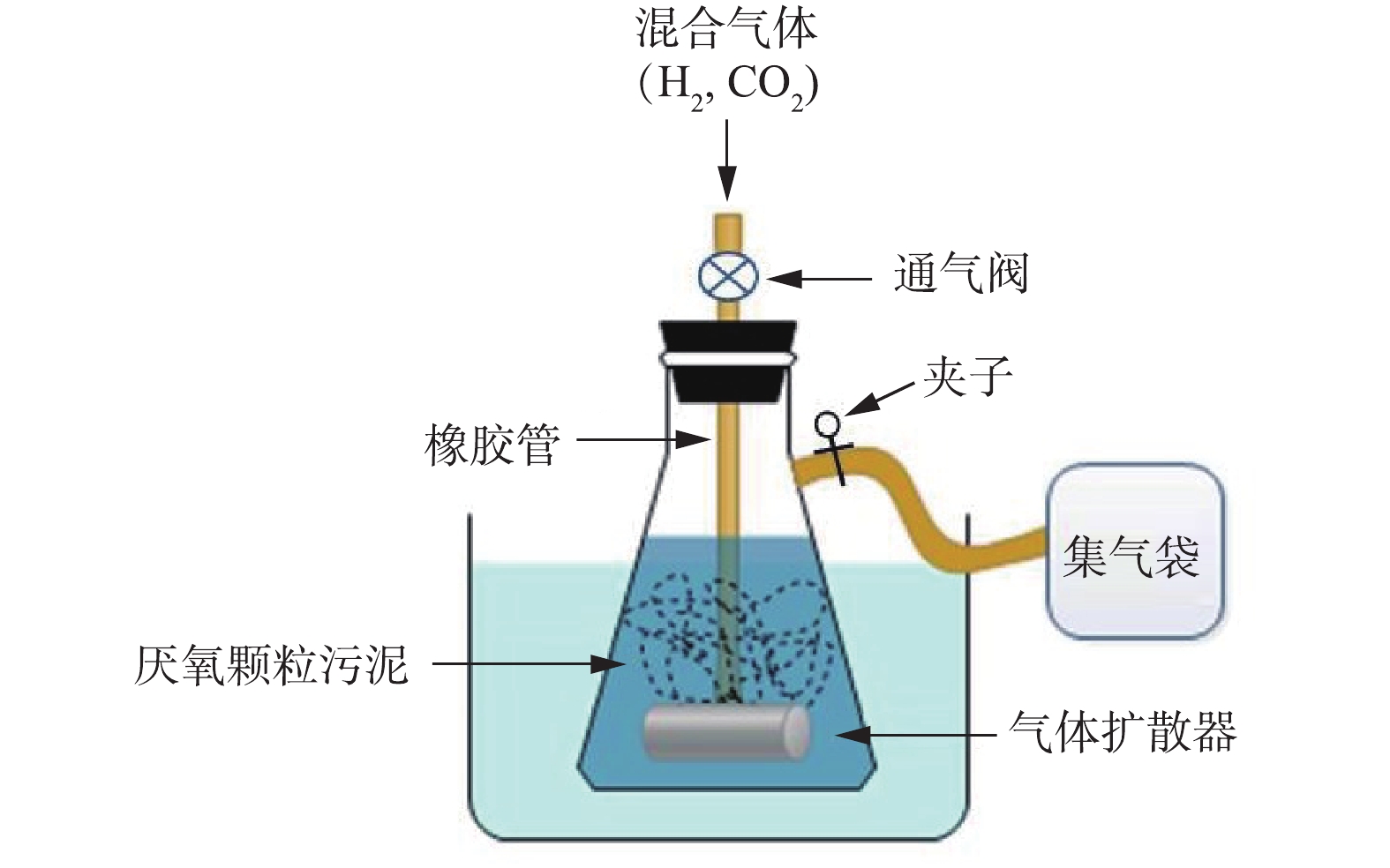
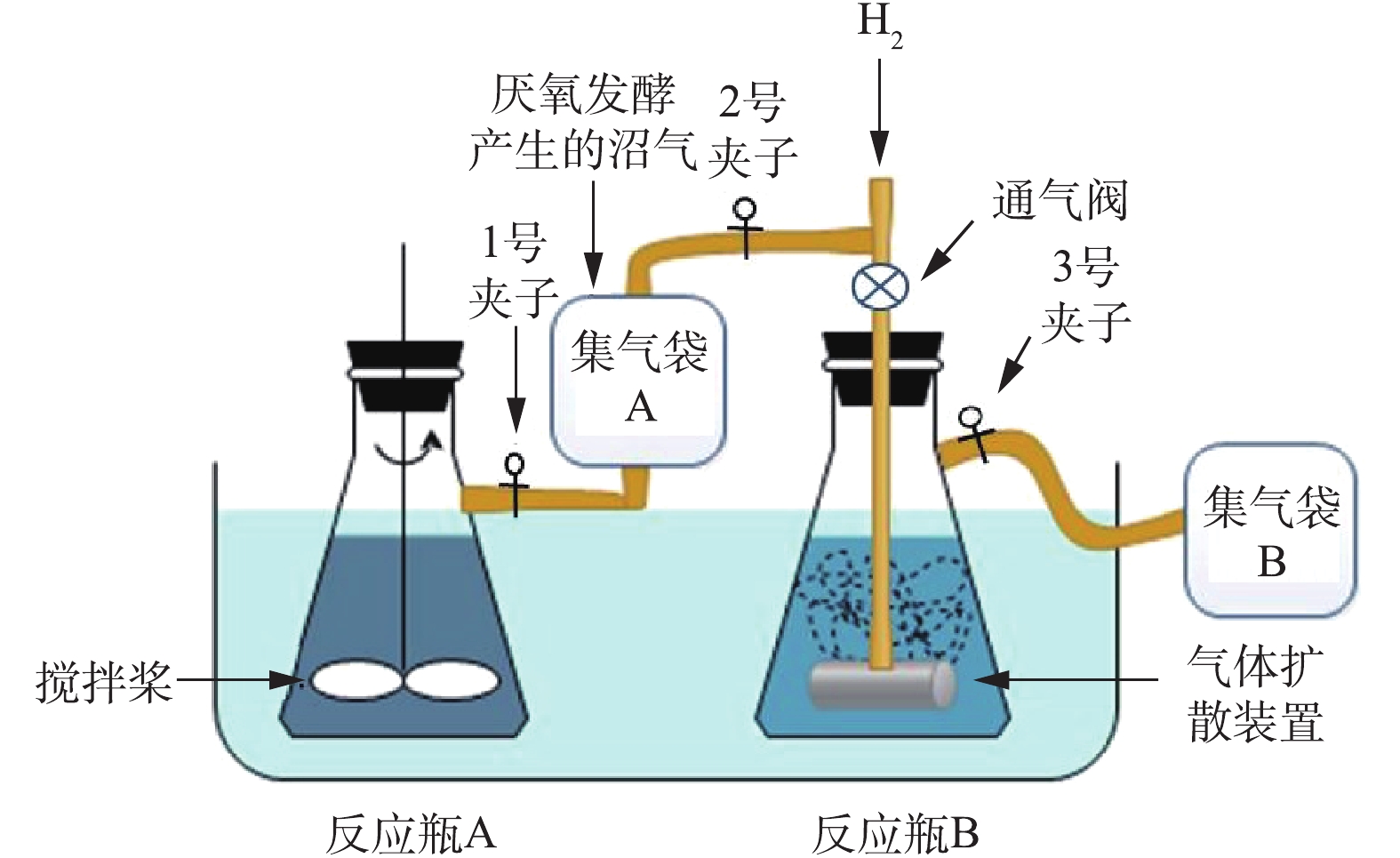
餐厨垃圾厌氧发酵与沼气提纯的耦联装置见图1。耦联装置由反应瓶A和B组成,反应瓶体积均为1 L,置于(37±1) ℃的恒温水浴锅中。反应瓶A中进行餐厨垃圾的批式厌氧发酵,反应过程中采用悬臂式电动搅拌机(GZ-120 型,江阴保利科研器械有限公司)进行间歇式搅拌。反应瓶B中进行沼气的异位生物提纯,顶部连接1个可以调节压力和流量的通气阀,石英材质的气体扩散器置于反应瓶底部。集气袋A和B均通过橡胶管与反应瓶A和B相连,收集反应过程中产生的气体,且由夹子控制气体的流向。
-
不同通气比例的沼气异位生物提纯装置见图2。反应瓶体积为1 L,置于(37±1) ℃的恒温水浴锅中。反应瓶顶部连接1个可以调节压力和流量的通气阀,石英材质的气体扩散器置于反应瓶底部,集气袋通过橡胶管与反应瓶相连,由夹子控制反应瓶气体的流向。
-
1) 餐厨垃圾厌氧发酵与沼气生物提纯分析。反应瓶A中餐厨垃圾与厌氧污泥的TS比为1∶1,体系的总固体含量为15%,初始pH为7.6[19],搅拌速度为60 r·min−1。在厌氧反应过程中,1号夹子打开,2号夹子呈关闭状态,厌氧发酵产生的沼气进入集气袋A中。反应瓶A每隔48 h进行取样并对集气袋A中的气体进行检测。
反应瓶B中厌氧污泥与去离子水占反应瓶体积的80%,体系初始pH为8,反应瓶B每隔48 h进行通气,通气压力为100 kPa。通入的H2总量根据集气袋A中的CO2含量计算,使H2和CO2 通入比为4∶1[9]。当需要通气时,关闭1号夹子和通气阀,打开2号夹子,将计算好的H2加入到集气袋A中,然后打开通气阀和3号夹子,集气袋A中的气体通过气体扩散器扩散到液体中,通气时间为5 min(前期实验获得的最佳通气时间)。通气结束后,关闭2、3号夹子和通气阀,然后打开1号夹子,继续收集反应瓶A中产生的沼气。48 h后,打开3号夹子,反应瓶B内的气体进入集气袋B中,检测气体成分并对反应物进行取样分析。耦联实验进行3次平行分析。
-
2) 不同通气比例的沼气生物提纯相研究。在餐厨垃圾厌氧发酵与沼气生物提纯的耦联实验中发现:在提纯反应结束时,H2被全部消耗,但仍有CO2残留,这表明H2∶CO2为4∶1并不是沼气提纯的最佳比例。因此,本实验研究了不同H2∶CO2比例对沼气提纯的影响,H2和CO2比例分别设为 4∶1、5∶1、6∶1和7∶1,各组通入的混合气(H2和CO2)总体积恒定。反应瓶内为厌氧污泥与去离子水,未添加营养物质,厌氧颗粒污泥同上述分析,体系初始pH为8。不同比例的气体每隔48 h进行通气,通气时打开通气阀与夹子,通气时间为5 min;通气结束后关闭通气阀和夹子;48 h后打开夹子,气体进入集气袋中,对集气袋中气体成分进行取样和检测。每组实验进行3次平行实验。
-
3) 最佳通气比下厌氧发酵与沼气提纯两相中气体组分变化分析。在上面的讨论中发现,H2与CO2比例为5∶1时产甲烷性能最好,采用此比例对餐厨垃圾厌氧发酵与沼气提纯进行耦联实验,实验装置同图1,实验方法同上面的实验。反应共进行31 d,每隔48 h进行取样分析。每个实验进行3次平行实验。
-
碳水化合物和蛋白质分别采用苯酚-硫酸法和Folin-酚法[20];TS、VS采用重量法[21];pH采用pH计测定;C、N采用元素分析仪进行测定。产气量采用排水法测定;气体(H2、CH4和CO2)组分和含量使用气相色谱仪(GC-2014,日本岛津公司)测定,采用热导检测器(TCD)及TDX-1色谱柱,柱温,进样口温度和检测器温度分别为100、180和180 ℃,载气为氩气[22]。挥发性脂肪酸(VFA)浓度使用气相色谱仪(GC-2010PLUS,日本岛津公司)测定,采用氢火焰离子化检测器(FID)及peg-20 m色谱柱,柱温,进样口温度和检测器温度分别为70、250和250 ℃,载气为氮气。
1.1. 接种物与底物
1.2. 实验装置
1.3. 实验方法
1.4. 测定方法
-
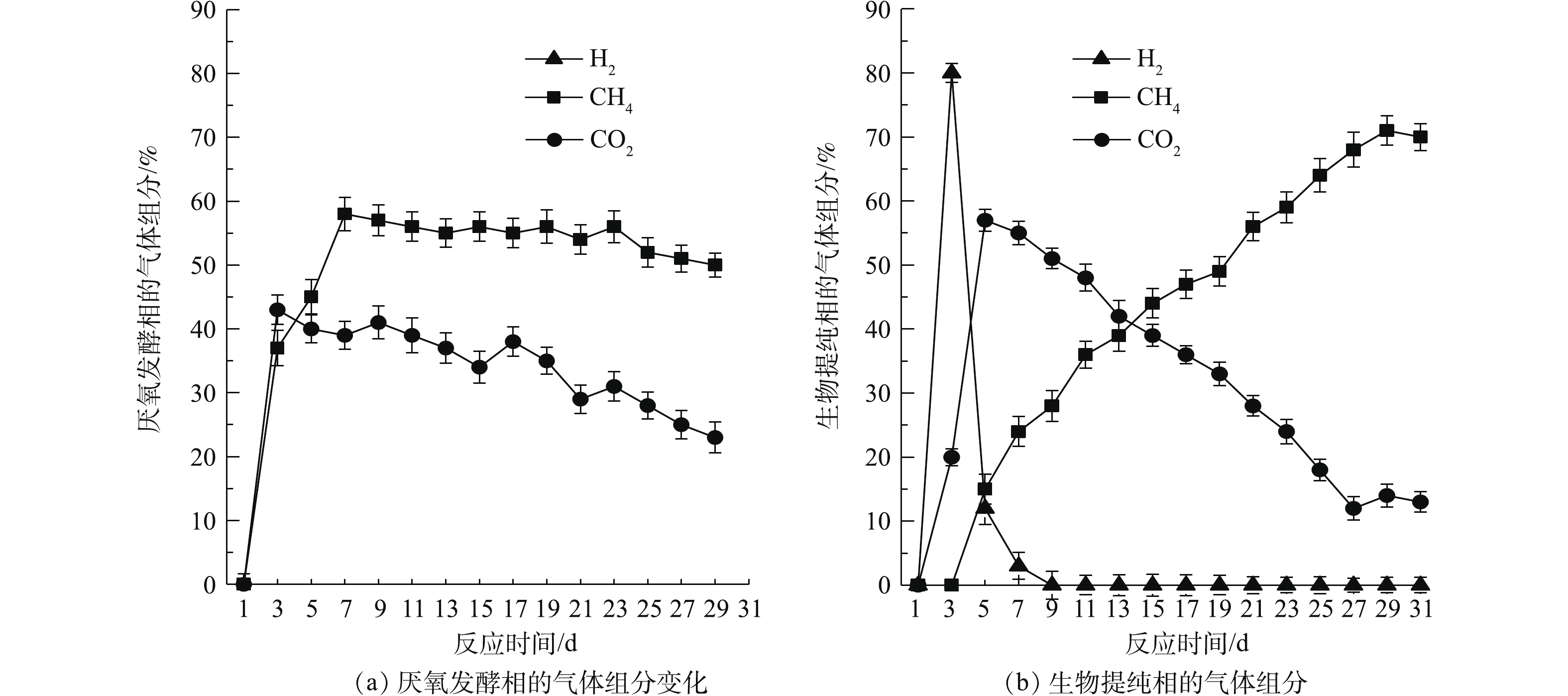
沼气组分及其变化能较直观地反映厌氧消化的效果,这也是评价反应效率的一个重要指标[23]。厌氧发酵阶段和提纯阶段的气体组分变化如图3所示。由图3(a)可知,在厌氧发酵阶段,CH4体积分数在反应的前7 d迅速提高至58.3%,此后保持稳定,最终CH4体积分数为52.4%。而CO2的体积分数在反应的第3天达到43.1%,但随着反应的进行呈现下降的趋势,最终CO2体积分数为22.8%。
在沼气提纯阶段,第1天没有通气,第3天开始通气。由图3(b)可知,H2体积分数在第5天下降到12.7%,在第7天又进一步减少到3.1%,随后均未检测到。CH4的体积分数随着反应的进行呈现出不断增加的趋势,最高为第29天的73.5%,最终为71.4%,比未提纯提高了36.3%。CO2的体积分数在第5天上升到57.6%,但此后不断下降,最终为13.2%,与厌氧相相比减少了42.1%。根据化学计量式(式(1)),在提纯反应中,理论上,H2和CO2可以被完全利用,然而在实际反应中,H2全部消耗而CO2还有剩余,这可能是因为在提纯反应过程中有其他微生物参与了反应,如同型产乙酸菌能将H2和CO2转化为乙酸和水[23]。SCHINK[24]在对外源H2和CO2异位生成CH4的研究过程中,也发现同型产乙酸菌对反应有影响。
-
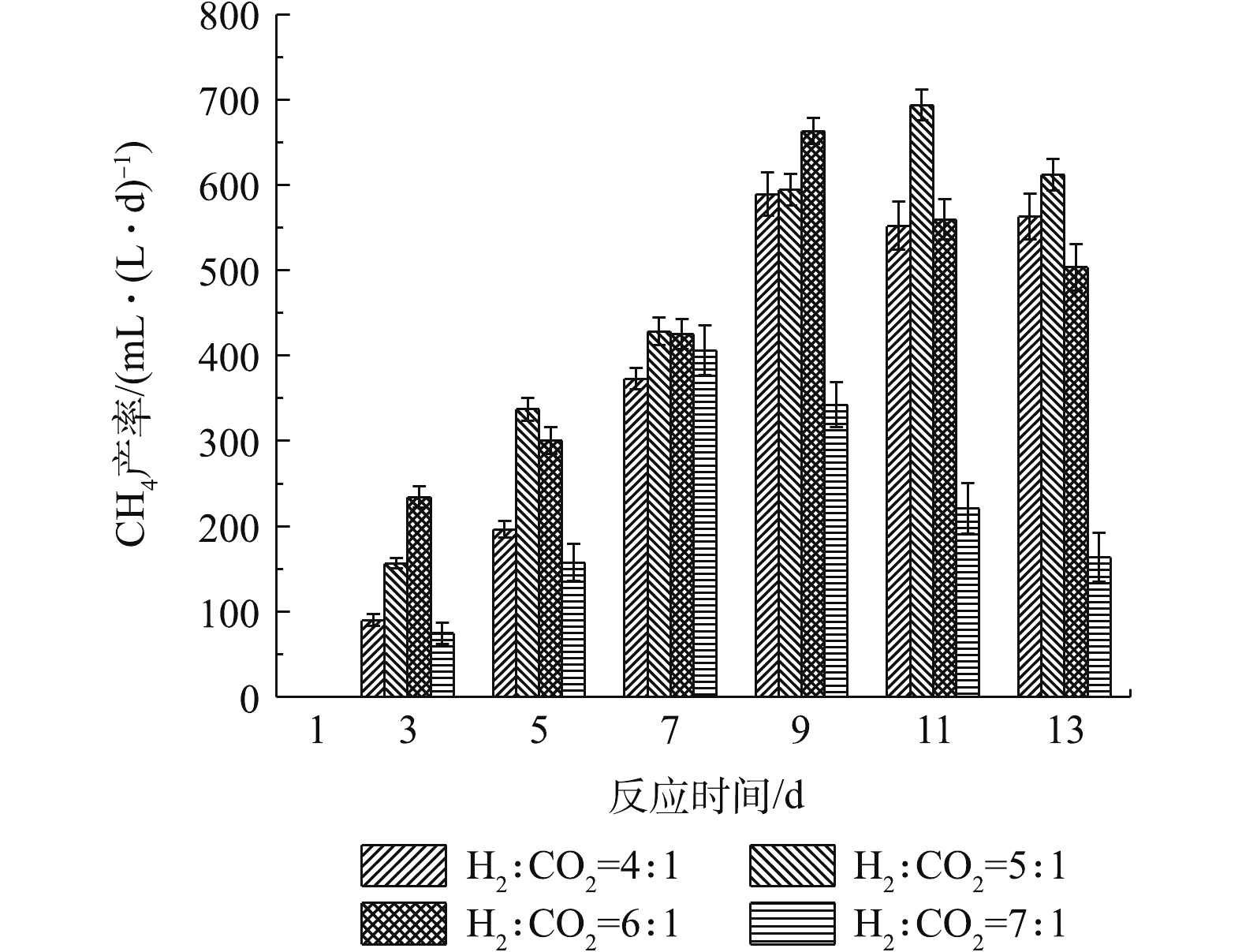
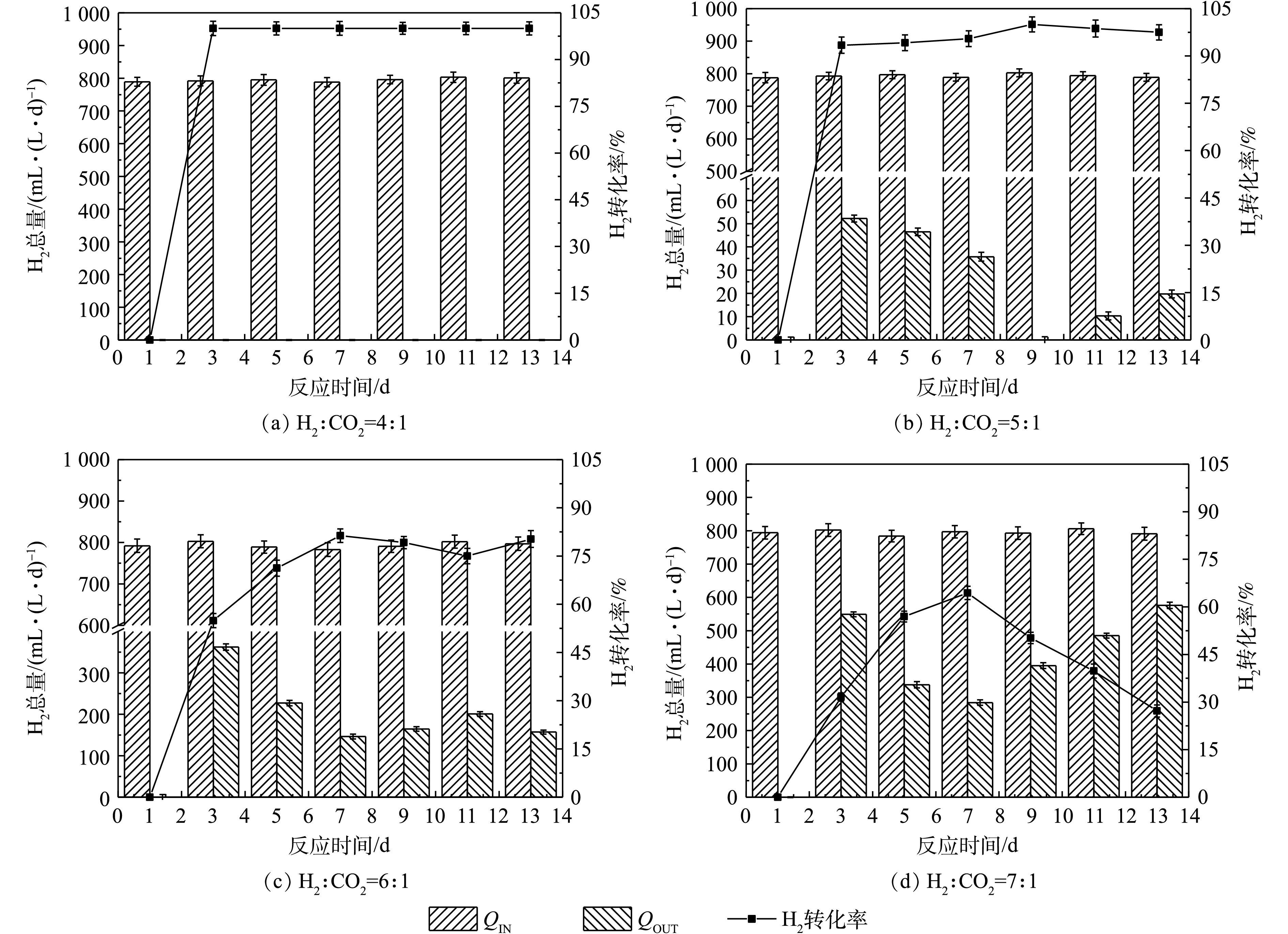
1) 不同通气比例对CH4产率的影响。不同通气比例对提纯过程中CH4产率的影响如图4所示。实验时,反应瓶中只有厌氧污泥和水,同时通入的气体只有H2和CO2,因此,反应测得的甲烷都为嗜氢产甲烷菌代谢产生的甲烷。不同通气比例的CH4产率随着反应的进行,均呈先上升后下降的趋势,当H2和CO2比例为5∶1时,获得最高产率。当气体比例为4∶1时,最高CH4产率为第9天的589.1 mL·(L·d)−1;而当气体比例为7∶1时,CH4产率在整个反应过程中都明显低于其他反应组。第9天,H2和CO2为6∶1时,CH4产率达到最高为663.2 mL·(L·d)−1;而5∶1比例时,CH4产率在第11天达到最高为693.7 mL·(L·d)−1。
在所有反应组中,反应一开始,H2和CO2被体系中的微生物利用生成CH4,但随着反应的进行,到达一定通气量后,反应呈现饱和状态,CH4产生量减小,CH4产率均呈先增加后下降的趋势。由图4可知,CH4产率未与H2的通入量成比例关系:CH4产率在通气比例为5∶1时获得最大值,但在6∶1和7∶1时不断下降,这说明H2通入量的增加未能同步提高CH4产率。KIM等[25]对不同通气比例的研究也表明,CH4产率在H2和CO2比例在5∶1时获得最大值,而当通气比例超过6∶1时,CH4产率反而急剧降低。
-
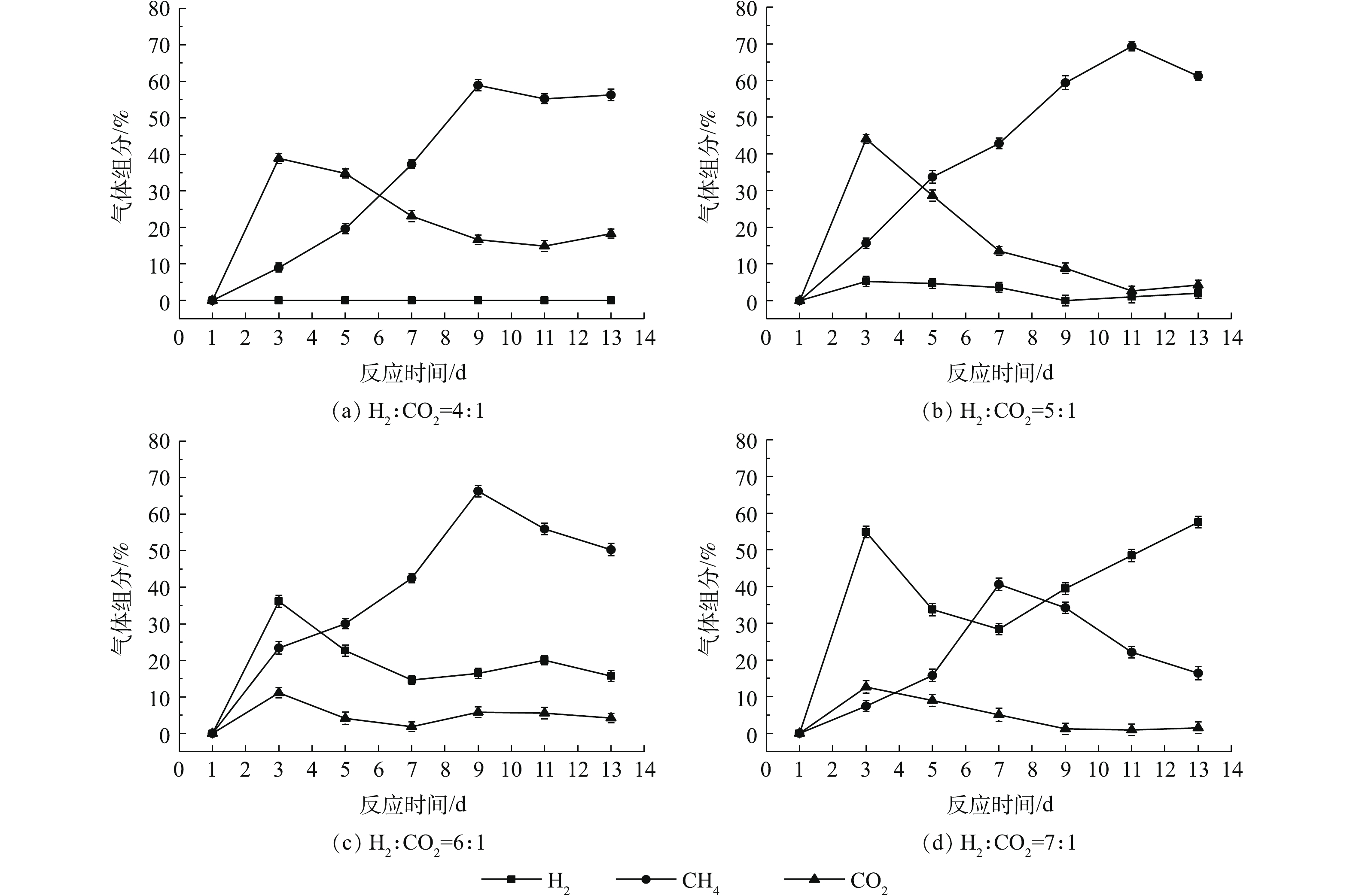
2) 不同通气比例对气体组分的影响。不同的通气比例对提纯反应中气体组分的影响如图5所示。当H2为CO2通入量的4倍时,反应结果与2.1节实验中的提纯相气体变化相似,H2被全部消耗,最高CH4体积分数为58.9%,但是CO2的残余量高达到14%以上。在通气比例为5∶1时,反应过程中有H2剩余但含量较少,都小于5.5%;在第11天时,获得最高CH4体积分数为69.4%,且此时的H2和CO2分别为1.1%和2.7%;反应过程中CO2含量不断下降,最终的CO2剩余量为4.3%。而H2量是CO2的6倍时,H2的残余量均高于14%,最高CH4体积分数为66.3%。随着气体比例进一步提高到7倍,H2在反应开始时被利用而降低,但之后含量不断增加,而CH4含量逐渐降低。
在进行不同气体比例的通气后,H2和CO2比例为4∶1时,虽然H2被全部消耗,但CO2的剩余量较高,这可能是因为反应中有其他微生物参与了耗氢过程[26],使得CO2不能与H2完全反应产生CH4,由此可见,4∶1不是最适宜的通气比例。当H2为5倍通入量时,CH4含量最高,且此时的H2和CO2均处于较低水平,这可能是因为H2含量的增加提高了H2的气液传质效率,适宜的H2量满足了不同耗氢微生物的生长需要[27];通气比例进一步提高时,虽然产生的CH4含量也较高,但是反应中有较多的H2剩余,这会造成气体资源的浪费。而通气比例为7∶1时,反应可能发生了底物抑制,这是因为过量的H2通入不利于耗氢微生物生长,反而为产酸微生物提供了足够的底物[28]。本实验表明,H2和CO2比例为5∶1是最佳通气比例,实验结果与林春绵等[29]研究结论一致。
-
3) 不同通气比例对H2转化率的影响。H2转化率能反映反应体系对氢气的利用情况。根据外源H2的通入量和剩余量,可以计算出外源氢气消耗量,消耗量与通入量的比值定义为外源氢气的转化率[27],计算方法如式(2)所示。
式中:R为H2的转化率;QIN为H2的通入量,mL·(L·d)−1;QOUT为H2的残留量,mL·(L·d)−1。
图6是不同通气比例下H2转化率的变化情况。H2和CO2的通气比例为4∶1时,通入的H2被全部利用,没有检测到残余气体,H2转化率为100%,但此时的CO2剩余量较高。当H2和CO2比例为5∶1时,H2的转化率均在90%以上,当CH4含量最高时,其转化率高达98.7%;当H2通入量为CO2的6倍时,H2转化率在70%~80%,CH4含量最高时的H2转化率为79.2%,与5∶1时相比降低了19.5%。7∶1的通气比例下,H2转化率最低,均低于65%。通过对H2转化率的对比分析发现,H2和CO2比例5∶1为最佳。
由图6可知,外源H2通入量与H2转化率不具有相关性。H2和CO2比例为5∶1时最佳,这可能是因为气体的通入不仅为嗜氢产甲烷菌提供了充足的底物,而且也满足了其他耗氢微生物的生长需要[27]。随着外源H2通入量的增加,微生物对H2和CO2的消耗速度逐渐减小,甚至在过量的情况下造成产甲烷微生物抑制[12]。有研究[26]表明,嗜氢产甲烷菌对H2的利用是有限度的,这与本实验结果相同。
-
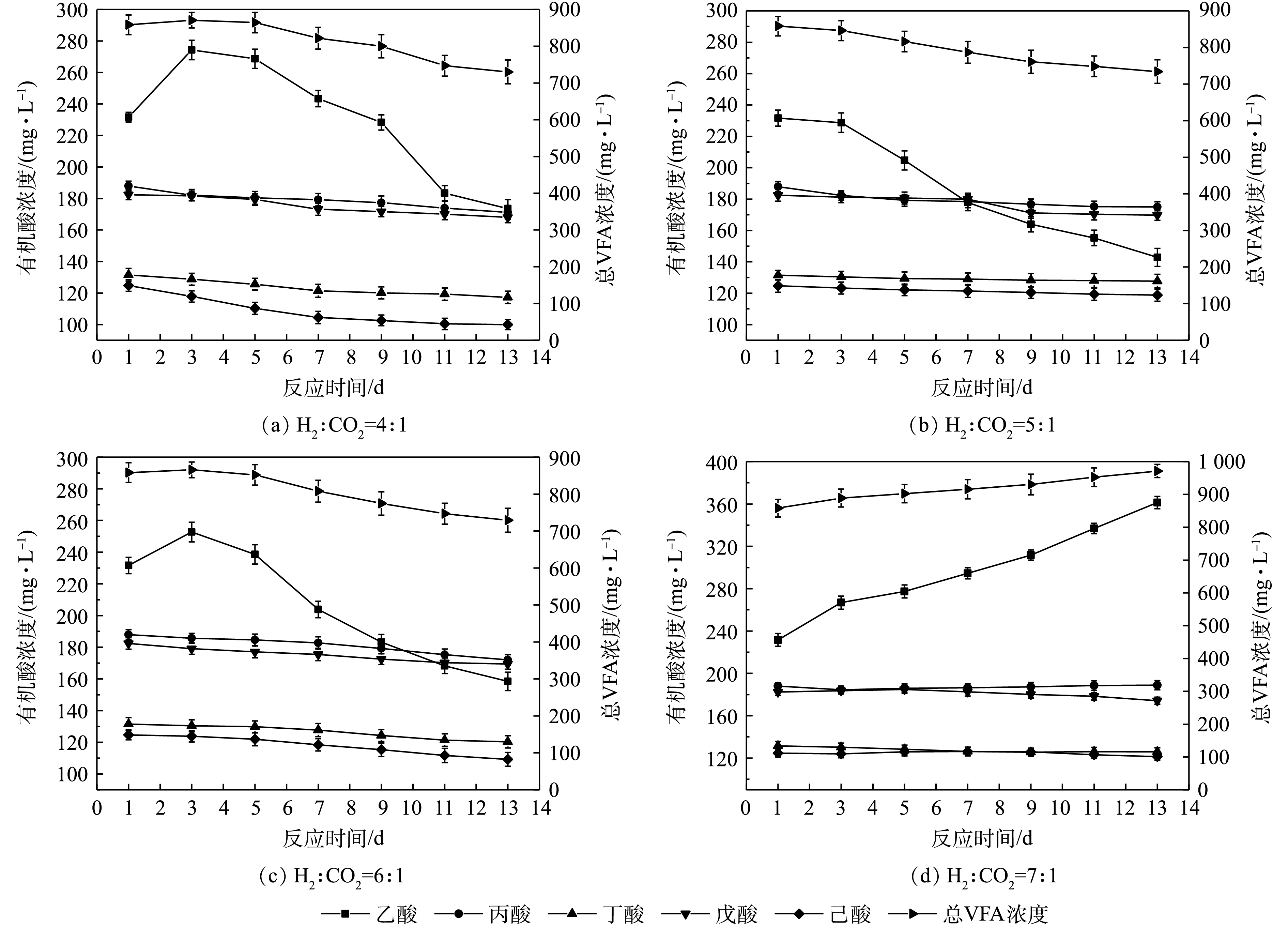
4) 不同通气比例对提纯过程中VFA的影响。VFA浓度的高低与微生物活性及反应过程的稳定性有密切的关系[30]。不同通气比例对生物提纯过程中VFA的影响如图7所示。在反应过程中,乙酸在H2和CO2比例为4∶1和6∶1时,呈现先增加后下降的趋势,这可能是因为,在反应一开始,同型产乙酸菌消耗H2产生乙酸,但随着反应的进行,嗜氢产甲烷菌逐渐富集,H2和CO2被消耗产生CH4,而体系中的乙酸被嗜酸型产甲烷菌生成CH4[14]。MULAT等[31]研究也表明,H2能刺激同型产乙酸菌消耗H2和CO2产生乙酸。当H2和CO2比例为5∶1时,乙酸没有出现积累,这可能是因为耗氢微生物的迅速富集,同时体系中的乙酸也被迅速消耗。而当H2和CO2比例为7∶1时,由于H2过量,体系中乙酸不断积累,体系酸化。有研究表明,过量的H2通入会导致VFA积累[32]。其他挥发性脂肪酸的降解程度不高,LUO等[32]的研究也表明在沼气生物提纯过程中,没有明显的丙酸和丁酸降解。
反应过程中的挥发性脂肪酸总量在H2和CO2比例为4∶1、5∶1和6∶1时,均呈现出下降趋势,这与乙酸的变化趋势一致,最终总VFA浓度均低于750 mg·L−1。而气体比例为7∶1时,由于乙酸的不断积累,有机酸总量也呈现增加的趋势,造成体系酸化,CH4含量较低,最终总VFA浓度为971.5 mg·L−1。
-
将餐厨垃圾厌氧发酵与最佳通气比例(5∶1)的生物提纯相进行耦联,不同阶段的气体组分变化如图8所示。在厌氧发酵相中,CH4的体积分数在前9 d迅速增加到58.4%,此后基本维持稳定,最终CH4体积分数为54.7%。CO2含量呈现先上升后下降的趋势,最终CO2体积分数为24.1%。厌氧发酵相的气体情况与2.1实验类似。在反应第3天通入H2和CO2比例为5∶1的混合气,H2含量不断下降,最终H2的体积分数为0.3%。CH4含量在反应过程中不断增加,最高CH4体积分数为第27天的97.4%,而最终的CH4体积分数为96.1%,达到了生物甲烷的品质(CH4 > 95%)[5]。CO2含量呈现不断降低的趋势,反应结束时的CO2体积分数为1.8%。本实验提纯后的甲烷含量高于BASSANI等[12]的研究结果(88.9%)。
与厌氧发酵相的沼气对比,经过提纯以后的气体中CH4体积分数增加了75.7%,而CO2降低了92.5%,H2的残余量仅为0.3%。与2.1节实验提纯相的气体进行对比,结果表明,经过优化通气比例的气体中CH4体积分数增加了35.4%,CO2减少了86.2%。BURKHARDT等[33]对连续反应器进行了沼气生物提纯,最终CH4体积分数达到97.9%。本实验在批式实验中也获得了较高的CH4体积分数,这表明,H2和CO2通气比为5∶1能够显著提高CH4的体积分数。
2.1. 餐厨垃圾厌氧发酵与沼气生物提纯过程中的气体组分变化分析
2.2. 不同通气比例的生物提纯相研究
2.3. 最佳通气比下厌氧发酵与沼气提纯两相中气体组分变化分析
-
1)对餐厨垃圾厌氧发酵产生的沼气进行生物提纯能有效提高CH4体积分数。经过提纯,CH4体积分数从52.4%上升到71.4%,提高了36.3%,而CO2下降了42.1%。
2)通气比例对CH4提纯效率具有显著影响。当H2和CO2比例为5∶1时,提纯效果最佳,在此比例下,CH4产率和H2转化率最高,且有机酸降解程度也最大。因此,H2和CO2比例为5∶1是沼气生物提纯的最佳比例。
3)将厌氧发酵与最佳通气比例的沼气生物提纯进行联合实验,反应结束时,CH4体积分数达到96.1%,H2和CO2含量较低,实现了生物甲烷的品质。本研究为沼气生物甲烷化利用提供了参考。



 下载:
下载: